修回日期: 2022-06-23
接受日期: 2022-08-18
在线出版日期: 2022-08-28
NF-κB信号通路对胃癌的发生起协同作用, 而NLRC5作为其上游因子, 与胃癌的发生密切相关. 但是NLRC5在不同胃癌患者中的表达不同, 可能与NLRC5基因多态性有关, 我们通过基因测序来研究NLRC5基因多态性与胃癌的关系.
探讨NLRC5基因多态性与胃癌易感性及胃癌患者预后的关系.
选用2014-09/2016-10浙江中医药大学附属第一医院胃癌患者75例和同期健康人群59例(年龄和性别匹配)作为研究对象, 采用PCR产物一代测序法检测NLRC5rs56315364和rs289726基因型, 测序产物采用MegAlign和Chromas 2.4.3软件进行分析, 比较胃癌患者和健康人群NLRC5基因多态性与胃癌患者预后的关系.
NLRC5rs56315364 CC基因型增加胃癌发病风险(OR = 7.06, 95%CI: 2.81-17.72), rs289726TC、CC基因型增加胃癌发病风险(OR = 11.04, 95%CI: 4.29-28.43; OR = 4.77, 95%CI = 1.57-14.48), 且幽门螺杆菌(Helicobacter pylori, H. pylori)阴性和阳性组间无显著差异. 生存分析结果显示NLRC5rs289726基因型与胃癌预后有关(P<0.05), 且CC基因型的胃癌患者预后最差. COX多因素回归分析发现年龄和TNM分期与胃癌患者预后显著相关(P<0.05).
NLRC5rs56315364CC基因型和NLRC5rs289726TC基因型增加胃癌的发病风险. 年龄越大、TNM分期越高, 胃癌患者预后越差, NLRC5 rs289726携带CC基因型的胃癌患者预后最差.
核心提要: NLRC5通过参与调控NF-κB信号通路, 与胃癌的发生密切相关, 其机制尚不明确. 不同胃癌患者中NLRC5表达不同, 其基因多态性与胃癌和幽门螺杆菌相关胃癌的易感性及患者预后密切相关.
引文著录: 倪栋琼, 谭惠城, 张欣怡, 邵欢, 黄宣. NLRC5基因多态性与胃癌易感性的关系. 世界华人消化杂志 2022; 30(16): 701-709
Revised: June 23, 2022
Accepted: August 18, 2022
Published online: August 28, 2022
The NF-κB signaling pathway exerts a synergistic effect on gastric carcinogenesis. NLRC5 is an upstream regulator of the NF-κB signaling pathway, which is closely related to gastric carcinogenesis. Since NLRC5 expression is different among gastric cancer patients, we speculated that it might be related to NLRC5 gene polymorphisms. We explored the associations between NLRC5 gene polymorphism and gastric carcinogenesis through gene sequencing.
To investigate the associations of the NLRC5 rs56315364 and rs289726 gene polymorphisms with gastric cancer susceptibility and prognosis.
A total of 75 gastric cancer patients and 59 healthy volunteers (age- and sex-matched) were enrolled in the study from September 2014 to October 2016. The NLRC5 rs56315364 and rs289726 genotypes were determined by first-generation sequencing of PCR products. Sequencing products were analyzed using MegAlign and Chromas 2.4.3 software. Differences in NLRC5 gene polymorphisms between patients with gastric cancer and healthy volunteers were identified to investigate the relationship between NLRC5 gene polymorphisms and the prognosis of gastric cancer.
The NLRC5 rs56315364 CC genotype increased the risk of gastric cancer [odds ratio (OR) = 7.06, 95% confidence interval (CI): 2.81-17.72], as did the rs289726 TC and CC genotypes (OR = 11.04, 95%CI: 4.29-28.43; OR = 4.77, 95%CI: 1.57-14.48, respectively). There was no significant difference in the genotype frequency of NLRC5 rs56315364 and rs289726 between the Helicobacter pylori (H. pylori)-negative group and the H. pylori-positive group (P > 0.05). Survival analysis showed that the NLRC5 rs289726 genotype was correlated with the prognosis of gastric cancer (P < 0.05), and the NLRC5 rs289726 CC genotype was associated with the worst prognosis. Multivariate Cox regression analysis showed that age and tumor-node-metastasis (TNM) stage were correlated with the prognosis of gastric cancer patients (P < 0.05)
The NLRC5 rs56315364 CC and rs289726 TC genotypes significantly increase the risk of gastric cancer. Older age and higher TNM stage are associated with the worse prognosis of patients with gastric cancer. The prognosis of gastric cancer patients with NLRC5 rs289726 CC genotype is the worst.
- Citation: Ni DQ, Tan HC, Zhang XY, Shao H, Huang X. Relationship between NLRC5 gene polymorphisms and gastric cancer susceptibility. Shijie Huaren Xiaohua Zazhi 2022; 30(16): 701-709
- URL: https://www.wjgnet.com/1009-3079/full/v30/i16/701.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i16.701
我国是胃癌的高发地区, 发病率位于全部恶性肿瘤的第二位, 死亡率也位居前列, 造成严重的经济负担[1,2]. 胃癌的病因还不完全清楚, 由多种环境因素和遗传因素共同导致的, 其中环境因素包括微生物如幽门螺杆菌(Helicobacter pylori, H. pylori)、EB病毒感染等, 从而改变了细胞增殖、凋亡, 最终可能导致肿瘤发生[3].
核转录因子-κB(nuclear factor kappa-light-chain-enhancer of activated B cells, NF-κB)信号通路是细胞内重要的核因子, 在机体的免疫应答, 细胞增殖, 肿瘤的发生等方面发挥重要作用[4], 在炎症和肿瘤的关系中的作用受到广泛关注. 核苷酸结合结构域受体家族含CARD结构域-5(NLRC family, CARD domin containing 5, NLRC5)可以在胃癌、恶性黑色素瘤、肾癌、肝癌、宫颈癌、结直肠癌、前列腺癌等多种恶性肿瘤中广泛表达[5,6]. 胃癌的发生与慢性炎症密切相关, 研究发现H. pylori感染胃黏膜细胞后, 产生的炎性细胞因子如[肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和白细胞间介素-1(interleukin-1, IL-1)]可以激活NF-κB信号通路, 导致多种细胞趋化因子的产生上调, 对胃癌发生发挥协同作用[7,8]. 其中NLRC5是NF-κB信号通路的上游因子, 参与调控NF-κB信号通路. 但是目前NLRC5在胃癌中的作用尚不明确. NLRC5在不同胃癌患者之间表达不同, 72.2%的胃癌患者NLRC5表达阳性, 而27.8%表达阴性, 并且与胃癌患者的TNM分期和淋巴结转移存在一定关系[5].
单核苷酸多态性(single nucleotide polymorphism, SNP)是一组基于基因组水平单核苷酸变异的多态性. 作为第三代遗传标记, SNP被应用于疾病的精细定位, 尤其是复杂的疾病易感基因. 研究表明XPG、ERCC1、LIG3基因多态性可能影响胃癌发病风险[9-11]. NLRC5在胃癌患者之间表达不同, 我们推测可能与NLRC5基因多态性有关. 因此本研究采用病例对照方法, 研究NLRC5rs56315364和rs289726基因多态性与胃癌易感性及预后的关系.
本研究纳入病例组共计75例及对照组59例. 具体一般资料见表1, 显示两组性别年龄匹配(P>0.05). 我们通过电话随访的方式获得胃癌患者的生存资料, 随访时间至2019-12-31, 生存时间是从手术之日起至随访结束的时间或两次不同的事件发生之间的时间, 平均生存时间(34.44±16.39) mo, 至随访日期结束为止胃癌患者死亡46人(61.3%), 存活29人(38.7%). 本研究经过浙江中医药大学附属第一医院伦理委员会的批准(2020-K-199-01).
| 胃癌患者n(%) | 健康对照人群n(%) | χ2 | P | ||
| 性别 | 男 | 39(52.0) | 30(50.8) | 0.18 | 0.90 |
| 女 | 36(48.0) | 29(49.2) | |||
| 年龄(mean±SD)(岁) | 64.76±9.99 | 62.05±9.02 | 0.11 | ||
| 幽门螺杆菌感染 | 阳性 | 37(49.3) | 30(50.8) | 0.03 | 0.86 |
| 阴性 | 38(50.7) | 29(49.2) | |||
| TNM分期 | Ⅰ期 | 8(10.7) | - | - | - |
| Ⅱ期 | 23(30.7) | - | - | - | |
| Ⅲ期 | 39(52.0) | - | - | - | |
| Ⅳ期 | 5(6.6) | - | - | - | |
| 分化程度 | 低分化 | 43(57.3) | - | - | - |
| 中分化 | 27(36.0) | - | - | - | |
| 高分化 | 5(6.7) | - | - | - | |
| 肿瘤部位 | 贲门 | 17(22.7) | - | - | - |
| 非贲门 | 58(77.3) | - | - | - | |
| 肿瘤大小(T) | TⅠ/Ⅱ期 | 10(13.3) | - | - | - |
| TⅢ/Ⅳ期 | 65(86.7) | - | - | - | |
| 出现淋巴结转移 | 48(64.0) | - | - | - | |
| 出现远处转移 | 5(6.7) | - | - | - | |
| 术后进行化疗 | 29(38.7) | - | - | - | |
| 随访患者情况 | 存活 | 29(38.7) | - | - | - |
| 死亡 | 46(61.3) | - | - | - | |
纳入标准和排除标准: 病例组为浙江中医药大学附属第一医院2014-09/2017-10期间经手术切除后病理确诊为胃癌且一般资料齐全的患者. 排除标准: (1)排除患有自身免疫性疾病及炎症性疾病, 如系统性红斑狼疮(systemic lupus erythematosus, SLE)、类风湿关节炎(rheumatoid arthritis, RA)、炎症性肠病(inflammatory bowel disease, IBD)等; (2)排除有胃癌家族史的患者; (3)排除于手术治疗前曾行放化疗的患者.
对照组为同期进行胃镜检查的健康体检人群, 除H. pylori感染外无其他消化道疾病史. 排除标准: 排除其他心脏、肺脏、肝脏、肾脏等重大脏器疾病、无高血压、糖尿病等慢性疾病史, 无各种恶性肿瘤、自身免疫性疾病、炎症性疾病及传染病等疾病史.
1.2.1 观察指标及评价标准: 胃癌的分化程度由经验丰富的的病理科医师来进行分类; 胃癌的组织大小、肿瘤对胃壁的浸润深度、是否出现淋巴结转移及远处转移等情况采用国际抗癌联合会(Union Internationale Contre le Cancer, UICC)的最新胃癌TNM分级标准进行评判.
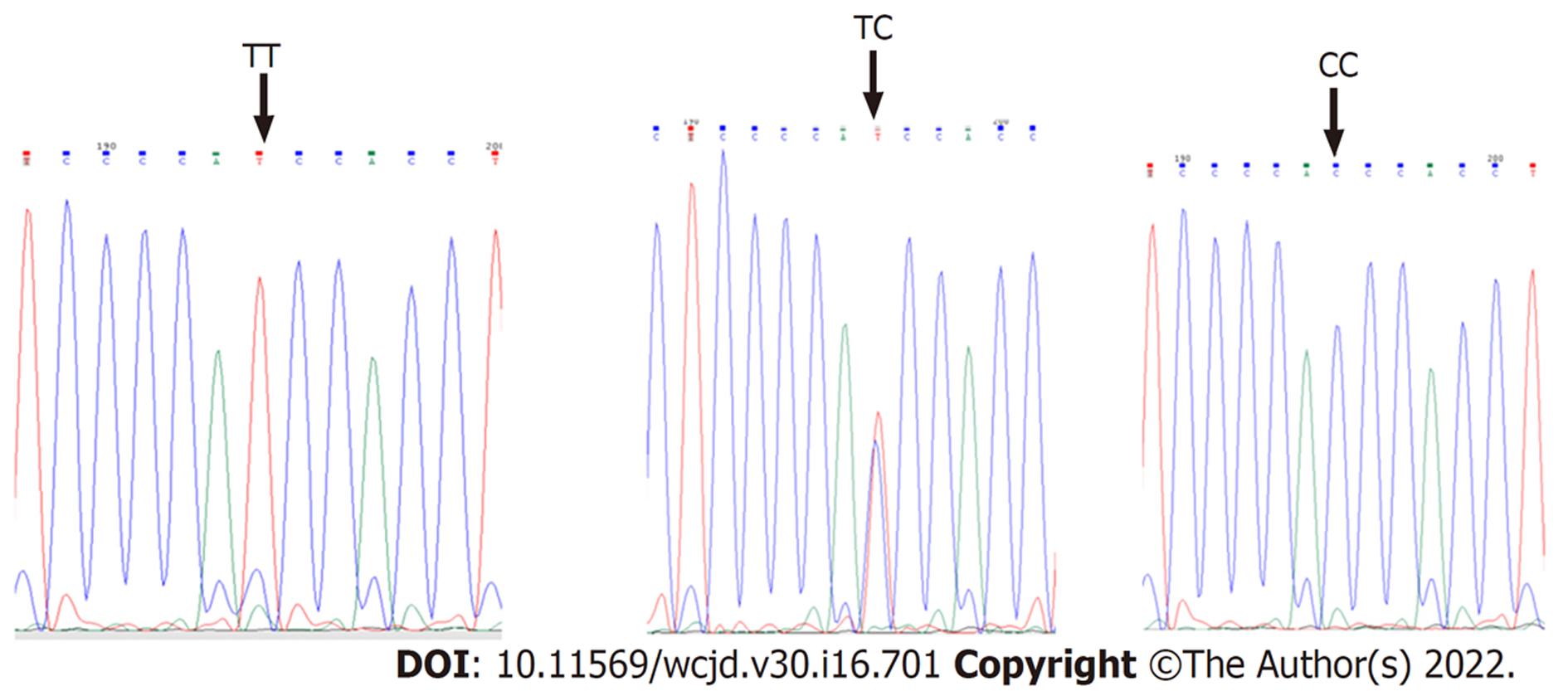
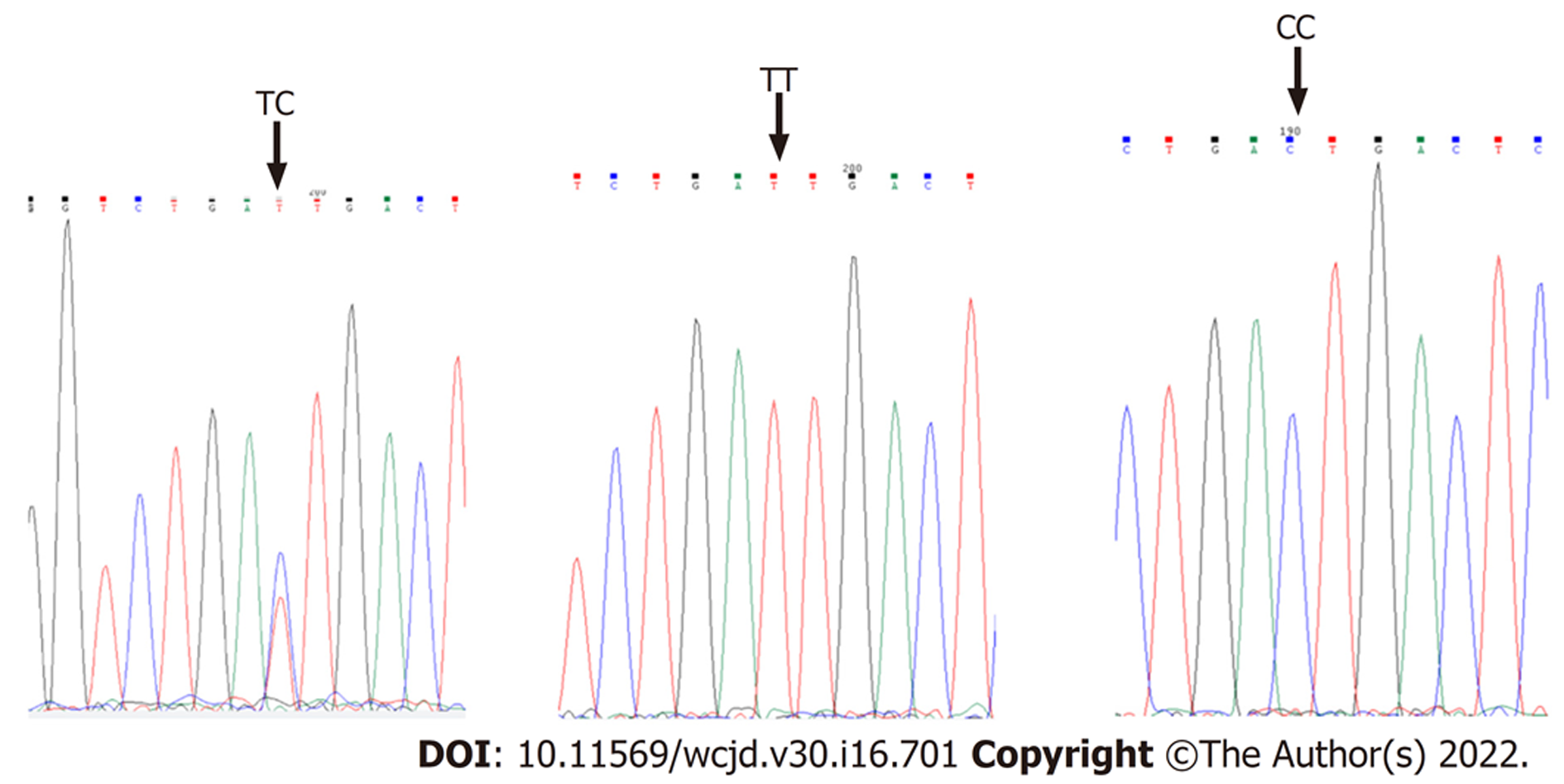
1.2.2 基因分型: 采用GeneJET FFPE DNA Purification Kit进行提取, 操作步骤严格按照说明书进行, PCR引物设计采用Primer Premier 6.0软件进行, 引物序列为然后由引物生工生物工程(上海)股份有限公司负责合成, 再进行PCR扩增, rs56315364引物序列为GGAGAGGTGGAGGTTGCACCGCTATCAGCACATCATACCTT, 扩增长度为447bp, rs289726引物序列为GGACTACTGAAGGCTCGATTCGAGGCCATCACTGTACCTCAT, 扩增长度为422 bbp. PCR结束后, 取5 ul进行电泳分析, 剩余PCR产物送往生工生物工程(上海)股份有限公司进行一代测序, 测序产物采用MegAlign和Chromas 2.4.3软件进行分析, 用人工比对的方法获得SNP位点的基因型.
统计学处理 统计分析在SPSS 19.0软件中完成, 以P<0.05为具有统计学意义. 采用χ2检验对NLRC5基因型的分布差异进行分析; 采用二元Logistic回归分析计算基因型与胃癌发病风险因素优势比(odds ratio, OR)及95%可信区间(confidence intervals, CI), 来表示NLRC5各基因型与胃癌发病风险的相关性; NLRC5基因多态性与胃癌患者预后的关系采用Log-Rank检验和Kaplan-Meier生存曲线进行单因素分析, 同时采用COX回归进行多因素分析.
NLRC5rs56315364位点中, 胃癌组TT基因型占10例(13.3%), TC基因型占15例(20%), CC基因型占50例(66.7%). 对照组TT、TC、CC基因型则分别为24例(40.7%)、18例(30.5%)和17例(28.8%). 与TT基因型相比, CC基因型增加胃癌发病风险(OR = 7.06, 95%CI = 2.81-17.72, P = 0.00), 而TC基因型无显著差异(OR = 2.00, 95%CI = 0.73-5.47, P = 0.18) . NLRC5rs289726位点中, 胃癌组TT基因型占8例(10.6%), TC基因型占53例(70.7%), CC基因型占14例(18.6%). 对照组TT、TC、TC基因型则分别30例(50.8%)、18例(30.5%)和11例(18.7%). 与TT型相比, TC、CC基因型可以增加胃癌发病风险(OR = 11.04, 95%CI = 4.29-28.43; OR = 4.77, 95%CI = 1.57-14.48)(表2).
在胃癌患者中H. pylori阳性组和H. pylori阴性组中NLRC5rs56315364和rs289726的基因型频率无显著差异(χ2 = 1.71, P = 0.43; χ2 = 0.79, P = 0.66). 在对照组中H. pylori阳性组和H. pylori阴性组中NLRC5rs56315364和rs289726的基因型频率无显著差异(χ2 = 0.43, P = 0.81; χ2 = 2.59, P = 0.27)(表3).
| 基因型 | H. pylori阳性(%) | H. pylori阴性(%) | χ2 | Pa | OR(95%CI) | |
| 胃癌组 | rs56315364 | |||||
| TT | 6(16.2) | 4(10.5) | 1.71 | 0.43 | 1.0 | |
| TC | 9(24.3) | 6(15.8) | 1.00(0.20-5.12) | |||
| CC | 22(59.5) | 28(73.7) | 0.52(0.13-2.09) | |||
| rs289726 | ||||||
| TT | 3(8.1) | 5(13.2) | 0.79 | 0.66 | 1.0 | |
| TC | 26(70.3) | 27(71.1) | 1.61(0.35-7.41) | |||
| CC | 8(21.6) | 6(15.7) | 2.22(0.38-13.18) | |||
| 对照组 | rs56315364 | |||||
| TT | 11(36.7) | 13(44.8) | 0.43 | 0.81 | 1.0 | |
| TC | 10(33.3) | 8(27.6) | 1.48(0.43-5.05) | |||
| CC | 9(30.0) | 8(27.6) | 1.33(0.38-4.62) | |||
| rs289726 | ||||||
| TT | 14(46.7) | 16(55.2) | 2.59 | 0.27 | 1.0 | |
| TC | 10(33.3) | 8(27.6) | 1.43(0.44-4.62) | |||
| CC | 6(20.0) | 5(17.2) | 1.37(0.34-5.49) |
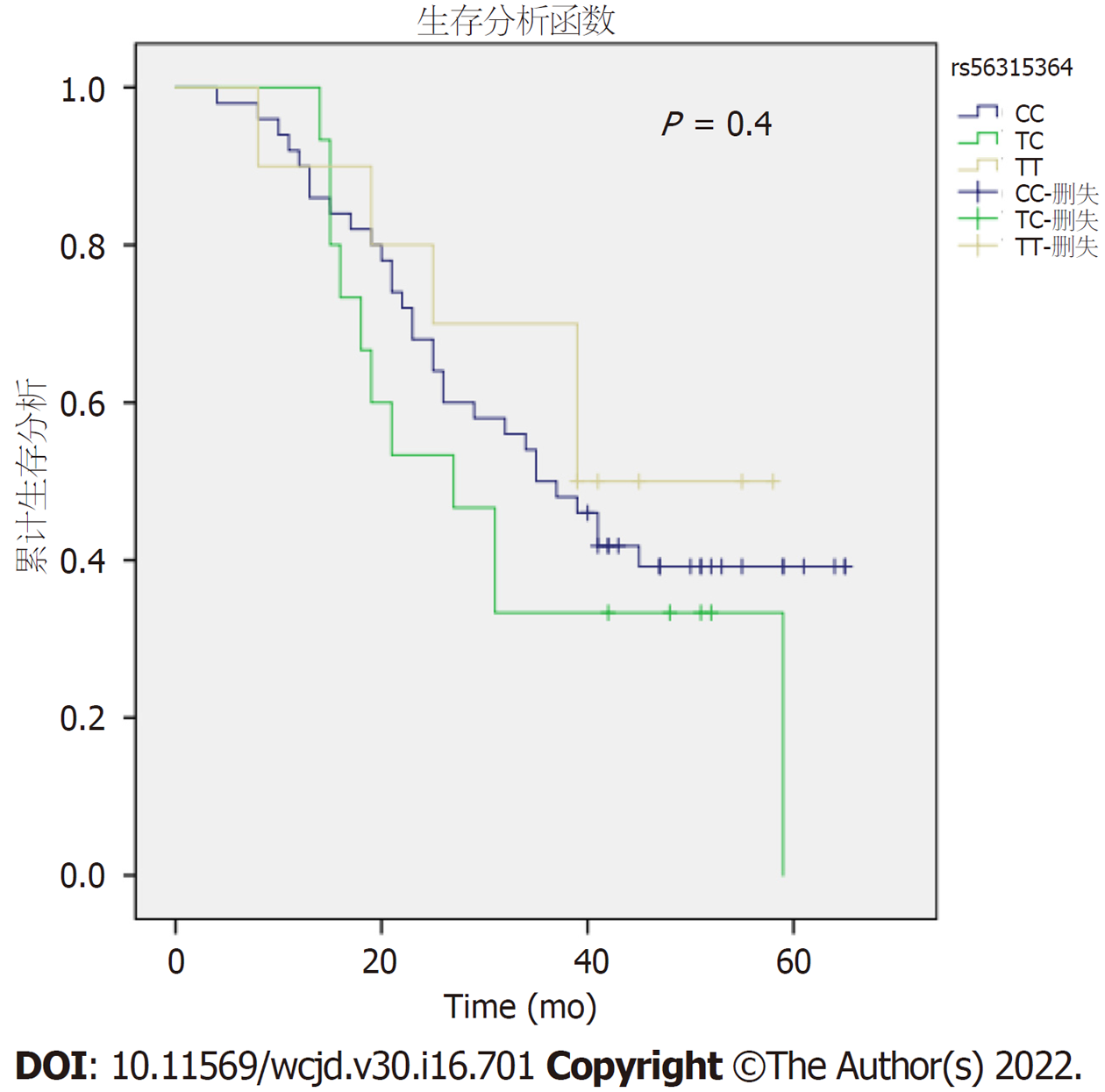
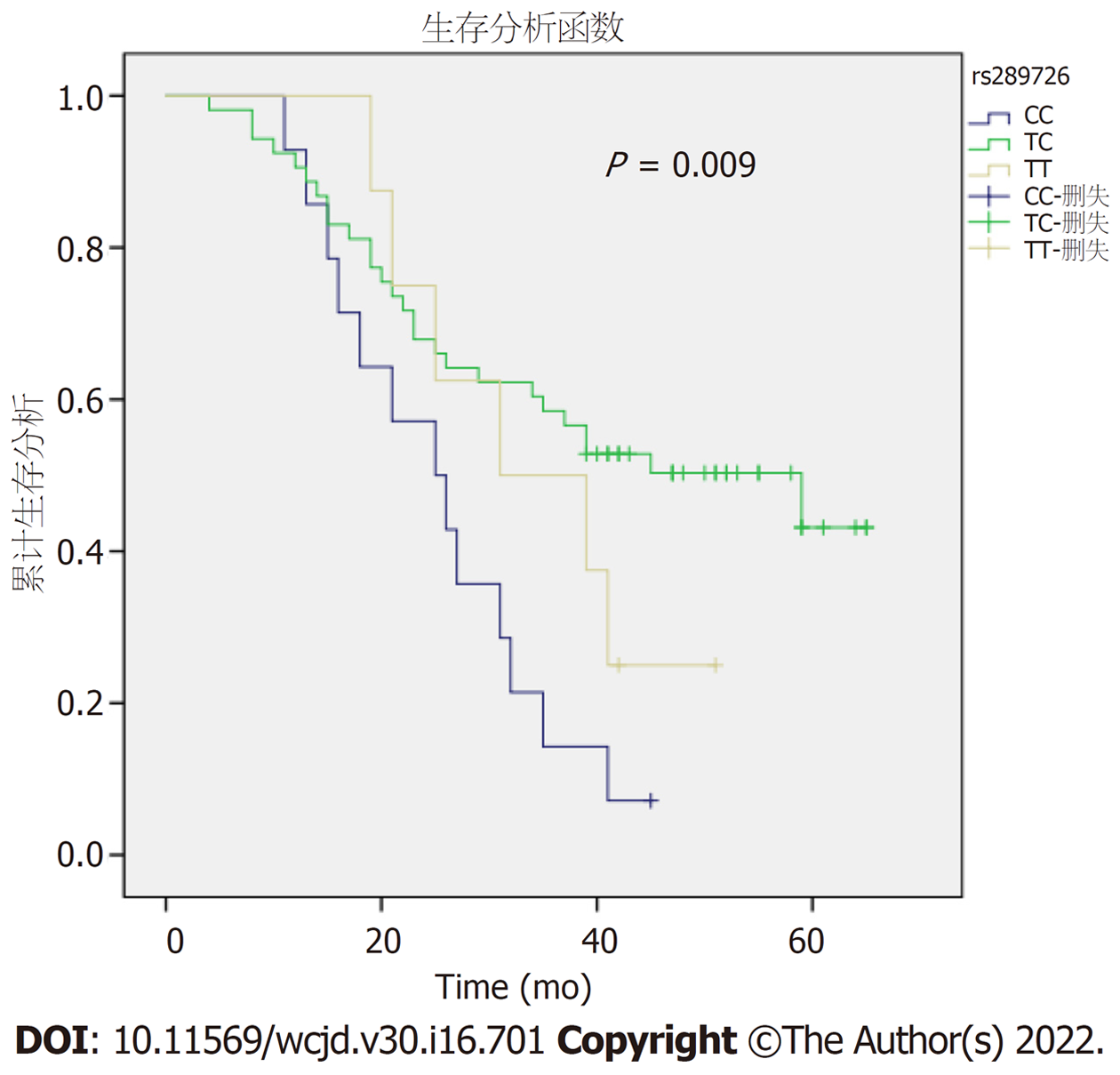
采用Kaplan-Meier生存曲线分别对NLRC5rs56315364、NLRC5rs289726的不同基因型胃癌患者进行生存分析. NLRC5rs56315364不同基因型的胃癌患者生存率无明显差别(Log Rank P = 0.40)(图3). NLRC5rs289726不同基因型的胃癌患者生存率存在显著差异(Log Rank P = 0.009), NLRC5 rs289726出现CC基因型胃癌患者的预后最差(图4). Cox回归多因素分析结果显示, 年龄和TNM分期与胃癌患者预后显著相关(P = 0.00, P = 0.026)(表4).
| 因素 | B | SE | Wald | HR(95%CI) | P |
| 年龄 | 0.077 | 0.021 | 13.047 | 1.08(1.04-1.13) | 0.00 |
| 性别 | |||||
| 女 | - | - | - | 1.00 | - |
| 男 | -0.256 | 0.32 | 0.63 | 0.77(0.41-1.46) | 0.43 |
| TNM分期 | |||||
| TNMⅠ/Ⅱ期 | - | - | - | 1.00 | - |
| TNMⅢ/Ⅳ期 | 0.74 | 0.33 | 5.16 | 2.12(1.11-4.07) | 0.023 |
| 肿瘤部位 | |||||
| 非贲门癌 | - | - | - | 1.00 | - |
| 贲门癌 | 0.34 | 0.37 | 0.85 | 1.41(0.68-2.92) | 0.36 |
| 分化程度 | |||||
| 低分化 | - | - | - | 1.00 | 0.67 |
| 中分化 | -0.32 | 0.35 | 0.81 | 0.73(0.36-1.46) | 0.37 |
| 高分化 | -0.081 | 0.64 | 0.016 | 0.92(0.26-3.24) | 0.90 |
| 幽门螺杆菌感染 | 0.015 | 0.33 | 0.002 | 1.02(0.54-1.92) | 0.96 |
| rs56315364 | |||||
| TT | - | - | - | 1.00 | - |
| TC | 0.39 | 0.40 | 0.12 | 1.15(0.53-2.49) | 0.73 |
| CC | 0.15 | 0.54 | 0.034 | 0.91(0.32-2.61) | 0.86 |
| rs289726 | |||||
| TT | - | - | - | 1.00 | 0.008 |
| TC | -0.15 | 0.49 | 0.093 | 0.86(0.33-2.25) | 0.76 |
| CC | 1.02 | 0.57 | 3.20 | 2.77(0.91-8.47) | 0.073 |
NLRC5在先天性和适应性免疫应答中发挥重要的作用, 参与调控Ⅰ类MHC基因表达和Ⅰ类MHC抗原提呈过程中相关基因表达, 参与调控NF-κB信号通路、IFN信号通路和抗病毒免疫反应等[12,13]. NLRC5可以阻断IKK复合物, 通过与IKKα/IKKβ反应并抑制其磷酸化负调控NF-κB信号通路[14]. 研究显示NLRC5特异性敲除能够促进NF-κB信号转导, 且诱导其下游炎症因TNF-α和IL-6表达[15].
研究表明[16-22], 炎症反应相关的基因遗传多态性与胃癌易感性及预后相关, 如IL、TLRs基因多态性等. 目前研究发现NLRC5rs289723与慢性轻度牙周炎和慢性局部牙周炎的风险增加密切相关, 特别是A/A基因型与慢性牙周炎发生相关[23], 另外NLRC5 rs27194和rs289747基因多态性与结直肠恶性肿瘤的发生及5-FU化疗预后相关[24]. 而NLRC5基因多态性与胃癌的关系尚未有过报道. H. pylori导致胃癌发生的具体机制不明, 但是并非所有人感染H. pylori后均会发生胃癌, 这可能与NLRC5基因多态性有关. 本研究通过病例对照研究, 探讨了NLRC5基因多态性与胃癌易感性及H. pylori感染相关胃癌之间的关系. 我们发现rs56315364和rs289726基因多态性与胃癌易感性之间存在显著相关性, rs56315364 CC基因型和rs289726 TC及CC基因型与胃癌的发病风险增加有关(P<0.05).
已经有不少研究发现NF-κB信号通路参与H. pylori相关胃癌的发生[25-28]. 一些研究结果显示在H. pylori感染后, 胃黏膜NLRC5水平升高, 并且与胃炎的严重程度有关[29]. 另外一项研究分别从胃癌患者和胃炎患者中分离的两种H. pylori菌株感染单核巨噬细胞(THP-1细胞)后, 结果发现NLRC5的表达是下调至少两倍[8]. 但是遗憾的是, 我们分别比较了H. pylori阳性和H. pylori阴性胃癌患者的rs56315364和rs289726的基因型频率, 结果显示这两个位点的基因多态性与H. pylori感染在胃癌发生中无协同作用(P>0.05). 这与我们先前的猜测不符, 可能是H. pylori感染导致NLRC5的其他位点发生突变. 因此, 我们可能需要进一步分析NLRC5的其他几个位点基因多态性与H. pylori感染之间的关系, 并增加研究的样本量, 来进一步探索NLRC5基因多态性与H. pylori感染及H. pylori相关胃癌的易感性的关系.
胃癌患者的预后与多种因素密切相关, 如年龄、肿瘤部位、TNM分期、肿瘤大小、病理类型、营养状况、HER2表达等[30-32]. 本研究进行生存分析后发现, rs289726基因多态性与胃癌患者的预后显著相关(P<0.05), TC基因型的胃癌患者术后生存时间较TT基因型和CC基因型的患者长. COX回归多因素分析结果显示, 年龄、TNM分期及rs289726TC基因型与胃癌患者预后相关(P<0.05).
本研究的创新性在于以往没有NLRC5基因多态性与胃癌相关性的研究, 我们纳入胃癌患者和健康对照人群对两者关系进行研究, 发现NLRC5rs56315364CC基因型和rs289726TC、CC基因型基因多态性与胃癌发病风险增加有关. 当然, 本研究也存在一些局限性: (1)本研究的样本量不够多, 选择的胃癌患者和健康人群都是来自同一个医院, 地区局限, 并不能代表整个人群, 需要扩大样本量, 对不同医院不同地区的胃癌患者和健康人群进行研究; (2)我们对于胃癌患者和对照组的标本选取人群只是在年龄、性别等情况没有显著差异, 并没有对研究对象的病史、家族史及生活饮食习惯、生活方式、种族、遗传背景等各方面因素进行调查. 因为导致胃癌的发生不仅仅是包括遗传因素, 也包括了各种环境因素, 所以有条件的情况下对这些因素也应该进行匹配.
综上所述, 本研究评估NLRC5基因多态性与胃癌易感性及预后的关系. 研究数据表明NLRC5rs56315364和rs289726基因多态性与胃癌易感性相关, 但与H. pylori感染对胃癌的发生无协同关系. 另外, 年龄、TNM分期和NLRC5 rs289726基因型与胃癌的预后有关. 年龄越大、TNM分期越高, 胃癌患者预后越差, NLRC5 rs289726携带CC基因型的胃癌患者预后最差.
胃癌在我国发病率和死亡率高, 其发病机制目前不明. 其中核转录因子-κB(nuclear factor kappa-light-chain-enhancer of activated B cells, NF-κB)信号通路是细胞内重要的核因子, 通过调节众多基因的转录参与细胞增殖、免疫反应、炎症等众多的生理、病理过程, 作用十分广泛, 在炎症和肿瘤中的作用日益受到广泛关注. 而核苷酸结合结构域受体家族含CARD结构域-5(NLRC family, CARD domin containing 5, NLRC5)作为其上游因子, 参与调控NF-κB信号通路. NLRC5在胃癌患者之间表达不同, 我们猜测可能与NLRC5基因多态性相关.
本研究探索研究NLRC5rs56315364和rs289726基因多态性与胃癌易感性及预后的关系, 进一步探索其影响NLRC5与胃癌易感性及及预后的关系的机制.
本研究通过病例对照研究, 研究NLRC5rs56315364和rs289726基因多态性与胃癌易感性及预后的关系, 以及分析幽门螺杆菌(Helicobacter pylori, H. pylori)感染是否能在胃癌发病中起到协同作用. 通过研究了NLRC5基因多态性与中国人群胃癌发病风险、胃癌临床病理特征及其预后的关系, 增加了炎症因子基因在胃癌发病中的认识, 丰富了我国胃癌分子流行病学资料.
本研究提取胃癌患者及健康人群的胃组织标本核酸, 进行引物设计并合成引物, 再进行PCR扩增, 对PCR产物进行测序, 对测序产物进行分析. 患者临床病理资料和生存资料通过查阅病历资料和电话随访方式获得. 本研究采用χ2检验对每组等位基因频率的分布差异进行分析, 采用二元Logistic回归分析计算基因型与胃癌发病风险因素OR值及95%可信区间来表示NLRC5各基因型与胃癌及H. pylori相关胃癌发病风险的相关性. 基因多态性与预后的关系分别采用Log-rank检验及Kaplan-Meier生存曲线分析.
NLRC5rs56315364 CC基因型、NLRC5rs289726TC基因型和NLRC5rs289726CC基因型增加胃癌发病风险, 但是是否存在H. pylori感染在NLRC5rs56315364和rs289726与胃癌的发病中无协同关系. NLRC5rs289726基因型与胃癌预后有关, 其中携带NLRC5rs289726CC基因型的胃癌患者预后最差. 年龄和TNM分期与胃癌患者预后相关, 年龄越大、TNM分期越高, 胃癌患者的预后越差.
NLRC5rs56315364CC携带基因型和NLRC5rs289726携带TC基因型胃癌发病风险更高. 年龄越大、TNM分期越高, 胃癌患者预后越差. 另外NLRC5 rs289726携带CC基因型的胃癌患者预后最差.
国内外研究尚未有过NLRC5基因多态性与胃癌易感性的研究, 本研究首次提出NLRC5基因多态性与胃癌的关系, 对进一步筛选并保护易感人群, 对胃癌的基因治疗具有重要的临床意义. 下一步我们将进一步分析混杂因素包括抽烟、饮酒、高盐饮食、进食速度等在NLRC5与胃癌易感性中的作用. 探索NLRC5rs56315364CC基因型和NLRC5rs289726TC基因型增加胃癌的发病风险的机制以及NLRC5 rs289726携带CC基因型的胃癌患者预后最差的机制.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 2. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 3. | Crew KD, Neugut AI. Epidemiology of gastric cancer. World J Gastroenterol. 2006;12:354-362. [PubMed] [DOI] |
| 4. | Manikandan P, Vinothini G, Vidya Priyadarsini R, Prathiba D, Nagini S. Eugenol inhibits cell proliferation via NF-κB suppression in a rat model of gastric carcinogenesis induced by MNNG. Invest New Drugs. 2011;29:110-117. [PubMed] [DOI] |
| 5. | Li Y, Zhang M, Zheng X. High Expression of NLRC5 Is Associated with Prognosis of Gastric Cancer. Open Med (Wars). 2018;13:443-449. [PubMed] [DOI] |
| 6. | Yoshihama S, Roszik J, Downs I, Meissner TB, Vijayan S, Chapuy B, Sidiq T, Shipp MA, Lizee GA, Kobayashi KS. NLRC5/MHC class I transactivator is a target for immune evasion in cancer. Proc Natl Acad Sci USA. 2016;113:5999-6004. [PubMed] [DOI] |
| 7. | Xu YH, Li ZL, Qiu SF. IFN-γ Induces Gastric Cancer Cell Proliferation and Metastasis Through Upregulation of Integrin β3-Mediated NF-κB Signaling. Transl Oncol. 2018;11:182-192. [PubMed] [DOI] |
| 8. | Castaño-Rodríguez N, Kaakoush NO, Goh KL, Fock KM, Mitchell HM. The NOD-like receptor signalling pathway in Helicobacter pylori infection and related gastric cancer: a case-control study and gene expression analyses. PLoS One. 2014;9:e98899. [PubMed] [DOI] |
| 9. | Hua RX, Zhuo ZJ, Zhu J, Jiang DH, Xue WQ, Zhang SD, Zhang JB, Li XZ, Zhang PF, Jia WH, Shen GP, He J. Association between genetic variants in the XPG gene and gastric cancer risk in a Southern Chinese population. Aging (Albany NY). 2016;8:3311-3320. [PubMed] [DOI] |
| 10. | He J, Zhuo ZJ, Zhang A, Zhu J, Hua RX, Xue WQ, Zhang SD, Zhang JB, Li XZ, Jia WH. Genetic variants in the nucleotide excision repair pathway genes and gastric cancer susceptibility in a southern Chinese population. Cancer Manag Res. 2018;10:765-774. [PubMed] [DOI] |
| 11. | Hua RX, Zhuo Z, Zhu J, Zhang SD, Xue WQ, Li XZ, He J, Jia WH. LIG3 gene polymorphisms and risk of gastric cancer in a Southern Chinese population. Gene. 2019;705:90-94. [PubMed] [DOI] |
| 12. | Yao Y, Wang Y, Chen F, Huang Y, Zhu S, Leng Q, Wang H, Shi Y, Qian Y. NLRC5 regulates MHC class I antigen presentation in host defense against intracellular pathogens. Cell Res. 2012;22:836-847. [PubMed] [DOI] |
| 13. | Meissner TB, Li A, Biswas A, Lee KH, Liu YJ, Bayir E, Iliopoulos D, van den Elsen PJ, Kobayashi KS. NLR family member NLRC5 is a transcriptional regulator of MHC class I genes. Proc Natl Acad Sci USA. 2010;107:13794-13799. [PubMed] [DOI] |
| 14. | Cui J, Zhu L, Xia X, Wang HY, Legras X, Hong J, Ji J, Shen P, Zheng S, Chen ZJ, Wang RF. NLRC5 negatively regulates the NF-kappaB and type I interferon signaling pathways. Cell. 2010;141:483-496. [PubMed] [DOI] |
| 15. | Benko S, Magalhaes JG, Philpott DJ, Girardin SE. NLRC5 limits the activation of inflammatory pathways. J Immunol. 2010;185:1681-1691. [PubMed] [DOI] |
| 16. | Tian J, Liu G, Zuo C, Liu C, He W, Chen H. Genetic polymorphisms and gastric cancer risk: a comprehensive review synopsis from meta-analysis and genome-wide association studies. Cancer Biol Med. 2019;16:361-389. [PubMed] [DOI] |
| 17. | Moghimi M, Dastgheib SA, Heiranizadeh N, Zare M, Sheikhpour E, Neamatzadeh H. Association of il-8 -251t>a (rs4073) polymorphism with susceptibility to gastric cancer: a systematic review and meta-analysis based on 33 case-control studies. Arq Gastroenterol. 2020;57:91-99. [PubMed] [DOI] |
| 18. | Heydari-Mehrabadi A, Kordi Tamandani DM, Baranzehi T, Hemati S. Analysis of Polymorphism and Expression Profile of ASIC1 and IL-6 Genes in Patients with Gastric Cancer. Asian Pac J Cancer Prev. 2018;19:3451-3455. [PubMed] [DOI] |
| 19. | Cárdenas DM, Sánchez AC, Rosas DA, Rivero E, Paparoni MD, Cruz MA, Suárez YP, Galvis NF. Preliminary analysis of single-nucleotide polymorphisms in IL-10, IL-4, and IL-4Rα genes and profile of circulating cytokines in patients with gastric Cancer. BMC Gastroenterol. 2018;18:184. [PubMed] [DOI] |
| 20. | Liu S, Wang X, Shi Y, Han L, Zhao Z, Zhao C, Luo B. Toll-like receptor gene polymorphisms and susceptibility to Epstein-Barr virus-associated and -negative gastric carcinoma in Northern China. Saudi J Gastroenterol. 2015;21:95-103. [PubMed] [DOI] |
| 21. | Tahara T, Arisawa T, Wang F, Shibata T, Nakamura M, Sakata M, Hirata I, Nakano H. Toll-like receptor 2 -196 to 174del polymorphism influences the susceptibility of Japanese people to gastric cancer. Cancer Sci. 2007;98:1790-1794. [PubMed] [DOI] |
| 22. | Zeng HM, Pan KF, Zhang Y, Zhang L, Ma JL, Zhou T, Su HJ, Li WQ, Li JY, Gerhard M, Classen M, You WC. Genetic variants of toll-like receptor 2 and 5, helicobacter pylori infection, and risk of gastric cancer and its precursors in a chinese population. Cancer Epidemiol Biomarkers Prev. 2011;20:2594-2602. [PubMed] [DOI] |
| 23. | Zupin L, Navarra CO, Robino A, Bevilacqua L, Di Lenarda R, Gasparini P, Crovella S. NLRC5 polymorphism is associated with susceptibility to chronic periodontitis. Immunobiology. 2017;222:704-708. [PubMed] [DOI] |
| 24. | Catalano C, da Silva Filho MI, Jiraskova K, Vymetalkova V, Levy M, Liska V, Vycital O, Naccarati A, Vodickova L, Hemminki K, Vodicka P, Weber ANR, Försti A. Short article: Influence of regulatory NLRC5 variants on colorectal cancer survival and 5-fluorouracil-based chemotherapy. Eur J Gastroenterol Hepatol. 2018;30:838-842. [PubMed] [DOI] |
| 25. | Bontems P, Aksoy E, Burette A, Segers V, Deprez C, Mascart F, Cadranel S. NF-κB activation and severity of gastritis in Helicobacter pylori-infected children and adults. Helicobacter. 2014;19:157-167. [PubMed] [DOI] |
| 26. | Peng C, Ouyang Y, Lu N, Li N. The NF-κB Signaling Pathway, the Microbiota, and Gastrointestinal Tumorigenesis: Recent Advances. Front Immunol. 2020;11:1387. [PubMed] [DOI] |
| 27. | Gall A, Gaudet RG, Gray-Owen SD, Salama NR. TIFA Signaling in Gastric Epithelial Cells Initiates the cag Type 4 Secretion System-Dependent Innate Immune Response to Helicobacter pylori Infection. mBio. 2017;8:e01168-17. [PubMed] [DOI] |
| 28. | Hartung ML, Gruber DC, Koch KN, Grüter L, Rehrauer H, Tegtmeyer N, Backert S, Müller A. H. pylori-Induced DNA Strand Breaks Are Introduced by Nucleotide Excision Repair Endonucleases and Promote NF-κB Target Gene Expression. Cell Rep. 2015;13:70-79. [PubMed] [DOI] |
| 29. | Chonwerawong M, Ferrand J, Chaudhry HM, Higgins C, Tran LS, Lim SS, Walker MM, Bhathal PS, Dev A, Moore GT, Sievert W, Jenkins BJ, D'Elios MM, Philpott DJ, Kufer TA, Ferrero RL. Innate Immune Molecule NLRC5 Protects Mice From Helicobacter-induced Formation of Gastric Lymphoid Tissue. Gastroenterology. 2020;159:169-182.e8. [PubMed] [DOI] |
| 30. | Machlowska J, Maciejewski R, Sitarz R. The Pattern of Signatures in Gastric Cancer Prognosis. Int J Mol Sci. 2018;19:1658. [PubMed] [DOI] |
| 31. | Sun Z, Chen H, Han Z, Huang W, Hu Y, Zhao M, Lin T, Yu J, Liu H, Jiang Y, Li G. Genomics Score Based on Genome-Wide Network Analysis for Prediction of Survival in Gastric Cancer: A Novel Prognostic Signature. Front Genet. 2020;11:835. [PubMed] [DOI] |
| 32. | Ma X, Zhang C, Wang C, Miao W, Zhou W, An J, Qiao W, Li M, Lai M, Yu P. Comparison of clinicopathologic profiles and prognosis of gastric cancer in the upper, middle and lower third of the stomach: A retrospective cohort study. Medicine (Baltimore). 2020;99:e21261. [PubMed] [DOI] |