修回日期: 2022-03-27
接受日期: 2022-05-03
在线出版日期: 2022-06-28
切口感染是开腹胃肠外科术常见并发症及临床亟待解决的问题. 红外线局部照射联合皮肤再生医疗技术能通过改善切口局部血液循环, 降低致痛化学介质作用, 抑制切口过度炎症反应, 并通过加快渗出物吸收, 缓解局部炎症.
探讨红外线局部照射联合皮肤再生医疗技术治疗开腹胃肠外科术后切口感染效果及对白介素-4(interleukin-4, IL-4)/白介素-13(interleukin-13, IL-13)/转录激活子6(signal transducer and activator of transcription 6, STAT6)信号通路影响.
按照1:1试验设计原则和电脑随机数字表法将2019-03/2021-06我院收治的66例开腹胃肠外科术后切口感染患者, 随机分为对照组、实验组进行前瞻性研究, 各33例. 两组均给予抗菌药物治疗, 在此基础上, 对照组给予皮肤再生医疗技术, 实验组给予红外线局部照射联合皮肤再生医疗技术. 比较两组疗效、炎症指标[C反应蛋白(C-reactive protein, CRP)、降钙素原(procalcitonin, PCT)、白细胞(WBC)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)]、IL-4 mRNA、IL-13 mRNA、STAT6 mRNA、换药次数、红肿痛缓解时间、病原菌培养转阴时间、住院时间、温哥华瘢痕量表(vancouver scar scale, VSS)评分.
两组疗效分布情况比较, 差异有统计学意义, 实验组显效率为75.76%, 高于对照组的42.42%(P<0.05); 实验组治疗3 d后、治疗5 d后CRP、PCT、WBC、TNF-α低于对照组(P<0.05); 实验组治疗3 d后、治疗5 d后IL-4 mRNA、IL-13 mRNA、STAT6 mRNA低于对照组(P<0.05); 实验组换药次数、红肿痛缓解时间、病原菌培养转阴时间、住院时间低于对照组(P<0.05); 实验组VSS量表色泽、血管、柔软性、厚度、疼痛评分低于对照组(P<0.05).
红外线局部照射联合皮肤再生医疗技术治疗开腹胃肠外科术后切口感染, 能增强疗效, 改善炎症反应与切口愈合质量, 加快患者临床症状体征缓解和恢复进程.
核心提要: 红外线局部照射联合皮肤再生医疗技术治疗开腹胃肠外科术后切口感染, 能增强疗效, 缓解局部炎症, 并能通过降低白介素-4(interleukin-4, IL-4)mRNA、白介素-13(interleukin-13, IL-13)mRNA、转录激活子6(signaltransducer and activator of transcription 6, STAT6)mRNA表达机制, 改善炎症反应与切口愈合质量, 加快患者临床症状体征缓解和恢复进程.
引文著录: 马柏英, 傅旭堂, 陈芃芃, 李肃. 红外线局部照射联合皮肤再生医疗技术治疗开腹胃肠外科术后切口感染效果及对IL-4/IL-13/STAT6信号通路影响. 世界华人消化杂志 2022; 30(12): 521-528
Revised: March 27, 2022
Accepted: May 3, 2022
Published online: June 28, 2022
Incision infection is a common complication of open gastrointestinal surgery and an urgent clinical problem to be solved. Infrared local irradiation combined with skin regeneration medical technology can improve the local blood circulation of the incision, reduce the effect of painful chemical mediators, inhibit excessive inflammation of the incision, and alleviate local inflammation by accelerating the absorption of exudate.
To investigate the efficacy of local infrared irradiation combined with skin regenerative medical technology in the treatment of wound infection after open gastrointestinal surgery and the influence on the interleukin-4 (IL-4)/interleukin-13 (IL-13)/activator of transcription 6 (STAT6) pathway.
According to the 1:1 trial design principle and the computerized random number table method, 66 patients with incisional infection after open gastrointestinal surgery admitted to our hospital from March 2019 to June 2021 were randomly divided into a control group and an experimental group for prospective research, with 33 cases in each group. Both groups were treated with antibacterial drugs. On this basis, the control group was given skin regenerative medical technology, and the experimental group was given infrared local irradiation combined with skin regenerative medical technology. Clinical efficacy, inflammation indicators [C-reactive protein (CRP), procalcitonin (PCT), white blood cells (WBC), and tumor necrosis factor-α (TNF-α)], IL-4 mRNA, IL-13 mRNA, STAT6 mRNA, number of dressing changes, time to relief of redness, swelling, and pain, time for pathogen culture to turn negative, length of hospital stay, and Vancouver scar scale (VSS) score were compared between the two groups.
The therapeutic effects differed significantly between the two groups. The effective rate of the experimental group was 75.76%, which was higher than that (42.42%) of the control group (P < 0.05). At 3 d and 5 d after treatment, CRP, PCT, WBC, and TNF-α, as well as the mRNA expression of IL-4, IL-13, and STAT6 were significantly lower in the experimental group than in the control group (P < 0.05). The number of dressing changes, time to relief of redness, swelling, and pain, time for pathogen culture to turn negative, and length of hospital stay in the experimental group were significantly lower than those of the control group (P < 0.05). The color, blood vessel, flexibility, thickness, and pain scores of the experimental group were better than those of the control group (P < 0.05).
Infrared local irradiation combined with skin regenerative medical technology to treat incision infections after open gastrointestinal surgery can enhance the efficacy, improve the inflammatory response and the quality of incision healing, and accelerate the relief of clinical symptoms and signs and the recovery process.
- Citation: Ma BY, Fu XT, Chen PP, Li S. Local infrared radiation combined with skin regenerative medical technology for treatment of incision infection after open gastrointestinal surgery: Efficacy and influence on IL-4/IL-13/STAT6 signaling pathway. Shijie Huaren Xiaohua Zazhi 2022; 30(12): 521-528
- URL: https://www.wjgnet.com/1009-3079/full/v30/i12/521.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i12.521
由于开腹胃肠外科手术创伤较大, 切口较长, 且术中进行分离切除操作时, 腹腔脏器中一些内容物可能污染手术部位, 加之术毕缝合在同一部位反复进针、出针, 可引起皮下脂肪液化、缝线沾染, 导致术后易发生切口感染, 增加切口不愈合、败血症等发生的风险, 因此及时有效治疗意义重大[1,2]. 目前多采用抗菌药物治疗开腹胃肠外科术后切口感染, 但单纯依赖抗菌药物治疗周期较长, 切口愈合较慢, 故联合感染切口局部治疗是必要的. 皮肤再生医疗技术一方面能以液化方式无损伤地清除感染组织, 另一方面利用人体再生潜能, 创造有利于切口愈合的环境, 实现皮肤再生式愈合[3]. 根据既往报道[4], 皮肤再生医疗技术能通过调控难愈合创面血管生成, 加快创面愈合速度. 红外线局部照射是一种物理疗法, 辅助治疗压疮创面感染可促进压疮愈合, 并能预防切口愈合不良[5,6]. 白介素-4(interleukin-4, IL-4)/白介素-13(interleukin-13, IL-13)/转录激活子6(signal transducer and activator of transcription 6, STAT6)信号通路与伤口愈合、皮肤纤维化、瘢痕形成有关[7]. 而红外线局部照射联合皮肤再生医疗技术现阶段尚缺乏临床研究的论证, 治疗开腹胃肠外科术后切口感染是否能增强疗效尚不明确. 基于此本研究尝试从疗效、瘢痕美观度、康复进程、IL-4/IL-13/STAT6信号通路等角度, 明确红外线局部照射联合皮肤再生医疗技术的应用价值, 详情如下.
按照1:1试验设计原则和电脑随机数字表法将2019-03/2021-06我院收治的66例开腹胃肠外科术后切口感染患者, 随机分为对照组、实验组进行前瞻性研究, 各33例. 其中对照组女16例, 男17例, 年龄(26-68)岁, 平均(43.58±8.69)岁, 体质量指数(21-26) kg/m², 平均(24.18±0.88) kg/m², 开腹胃癌手术5例, 开腹肠癌手术7例, 开腹肠套叠复位术9例, 开腹胃十二指肠穿孔修补术8例, 开腹肠梗阻手术4例, Ⅱ类手术切口12例, Ⅲ类手术切口21例, 感染发生时间术后(5-30) d, 平均(15.68±5.06) d, 手术时间(68-249) min, 平均(156.77±44.26) min, 切口长度(7-17) cm, 平均(11.94±2.35) cm, 术中出血量(94-203) mL, 平均(149.33±27.80) mL; 实验组女12例, 男21例, 年龄(24-69)岁, 平均(41.99±8.05)岁, 体质量指数(21-26) kg/m², 平均(24.35±0.80) kg/m², 开腹胃癌手术3例, 开腹肠癌手术9例, 开腹肠套叠复位术7例, 开腹胃十二指肠穿孔修补术9例, 开腹肠梗阻手术5例, Ⅱ类手术切口12例, Ⅲ类手术切口21例, 感染发生时间术后(4-30) d, 平均(14.97±5.39) d, 手术时间(73-256) min, 平均(162.58±40.91) min, 切口长度(7-18) cm, 平均(12.13±2.06) cm, 术中出血量(89-211) mL, 平均(152.75±30.36) mL. 两组性别、年龄、体质量指数、手术类型等具均衡可比性. 本研究获医院伦理委员会审核通过, 患者知情, 自愿加入.
纳入标准: 开腹胃肠外科手术后, 出现切口红、肿、痛及发热等症状体征, 采集切口分泌物进行病原菌培养, 证实为切口感染; 均为表浅切口感染; 自愿签署知情同意书.
排除标准: 免疫缺陷疾病者; 血液系统疾病者; 并发器官功能衰竭者; 存在相关药物过敏史者; 未遵医完成治疗者; 中途转院者.
1.2.1 治疗方法: 两组均采集创面分泌物进行病原菌培养与药敏试验, 根据药敏试验结果, 给予敏感型抗菌药物治疗. 在此基础上, 对照组给予皮肤再生医疗技术, 常规消毒后, 先对切口进行清创, 再均匀涂抹湿润烧伤膏, 并覆盖湿润烧伤膏药纱, 无菌敷料包扎, 每日换药1次至切口创面无感染、坏死组织. 实验组给予红外线局部照射联合皮肤再生医疗技术(方法同对照组), 并采用BMP红外光疗仪对感染切口局部进行红外线照射, 30 min/次, 2次/d, 至切口创面无感染、坏死组织.
1.2.2 检测方法: 于治疗前、治疗3 d后、治疗5 d后分别采集患者外周静脉血5 mL, 行血常规检测, 记录白细胞(white blood cell, WBC)水平, 将剩余血标本以12000×g离心10 min, 分离血清, 应用免疫比浊法检测血清C反应蛋白(C-reactive protein, CRP)水平, 采用胶体金法检测血清降钙素原(procalcitonin, PCT)水平, 应用酶联免疫吸附法检测血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)水平; 并采集感染创面组织标本, 采用实时荧光定量聚合酶链反应法检测白介素-4(interleukin-4, IL-4)mRNA、白介素-13(interleukin-13, IL-13)mRNA、STAT6 mRNA表达, 试剂盒均购于宝生物工程(大连)有限公司.
(1)比较两组疗效. 1周后评估疗效, 显效: 切口红肿痛消失, 无渗液, 连续3次病原菌培养转阴, 随访2周, 在随访期内切口愈合; 有效: 切口红肿痛明显缓解, 无渗液, 至少1次病原菌培养转阴; 无效: 切口红肿痛无明显缓解, 有渗液、分泌物[8]; (2)比较两组治疗前、治疗3 d后、治疗5 d后CRP、PCT、WBC、TNF-α水平; (3)比较两组治疗前、治疗3 d后、治疗5 d后IL-4 mRNA、IL-13 mRNA、STAT6 mRNA表达; (4)比较两组换药次数、红肿痛缓解时间、病原菌培养转阴时间、住院时间; (5)比较两组出院时温哥华瘢痕量表(vancouver scar scale, VSS)[9]评分, 包括色泽、血管、柔软性、厚度、疼痛, 分值越高, 对应的表现越严重.
统计学处理 数据采用SPSS 24.0分析, 计数资料用n(%)表示、χ2检验, 等级资料采用Ridit检验, 计量资料以mean±SD表示, 组间比较行独立样本t检验, 组内比较行配对t检验. α = 0.05.
两组疗效分布情况比较, 差异有统计学意义, 实验组显效率为75.76%, 高于对照组的42.42%(P<0.05). 见表1.
| 组别 | 例数 | 显效 | 有效 | 无效 |
| 实验组 | 33 | 25(75.76) | 7(21.21) | 1(3.03) |
| 对照组 | 33 | 14(42.42) | 16(48.48) | 3(9.09) |
| u | 2.378 | |||
| P | 0.017 |
两组治疗3 d后、治疗5 d后CRP、PCT、WBC、TNF-α均低于治疗前, 且实验组低于对照组(P<0.05). 见表2.
| 时间 | 组别 | 例数 | CRP(mg/L) | PCT(ng/mL) | WBC(×109/L) | TNF-α(ng/mL) |
| 治疗前 | 实验组 | 33 | 16.25±5.38 | 2.89±0.84 | 14.67±3.29 | 52.38±12.69 |
| 对照组 | 33 | 15.74±4.97 | 2.93±0.91 | 13.82±3.50 | 50.84±10.22 | |
| t | 0.400 | 0.186 | 1.017 | 0.543 | ||
| P | 0.691 | 0.853 | 0.313 | 0.589 | ||
| 治疗3 d后 | 实验组 | 33 | 11.06±3.81a | 1.53±0.47a | 10.09±1.05a | 32.26±9.50a |
| 对照组 | 33 | 13.22±3.26a | 1.86±0.51a | 11.54±1.28a | 41.39±10.07a | |
| t | 2.475 | 2.733 | 5.031 | 3.789 | ||
| P | 0.016 | 0.008 | <0.001 | <0.001 | ||
| 治疗5 d后 | 实验组 | 33 | 7.17±1.93ab | 0.40±0.13ab | 7.28±0.97ab | 24.39±5.88ab |
| 对照组 | 33 | 10.35±2.24ab | 0.86±0.24ab | 9.33±0.84ab | 30.95±7.27ab | |
| t | 6.178 | 9.681 | 9.178 | 4.030 | ||
| P | <0.001 | <0.001 | <0.001 | <0.001 |
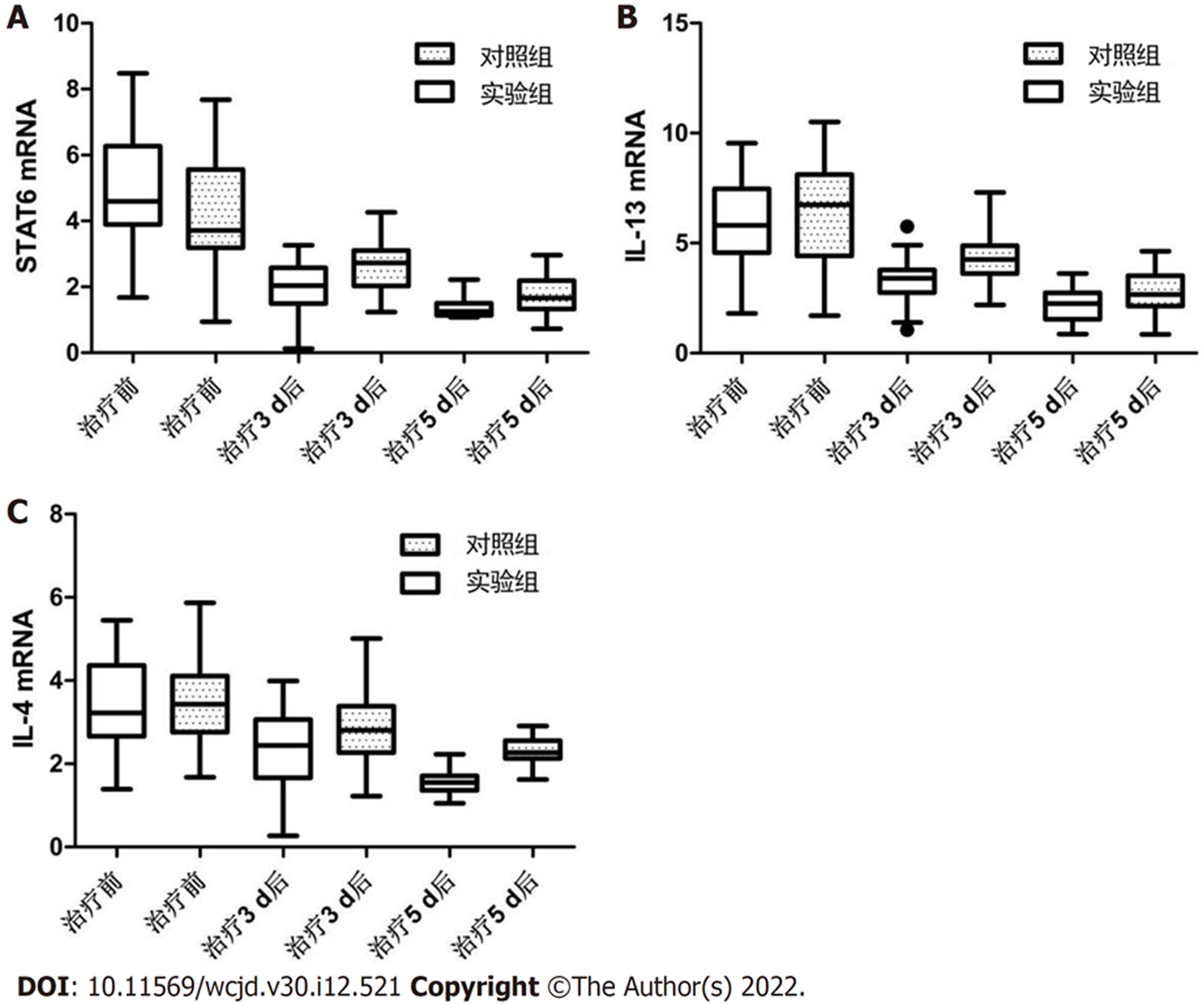
两组治疗3 d后、治疗5 d后IL-4 mRNA、IL-13 mRNA、STAT6 mRNA低于治疗前, 且实验组低于对照组(P<0.05). 见表3、图1.
| 时间 | 组别 | 例数 | IL-4 mRNA | IL-13 mRNA | STAT6 mRNA |
| 治疗前 | 实验组 | 33 | 3.58±1.12 | 5.75±1.82 | 4.88±1.50 |
| 对照组 | 33 | 3.29±1.00 | 6.03±1.94 | 4.65±1.48 | |
| t | 1.110 | 0.605 | 0.627 | ||
| P | 0.271 | 0.548 | 0.533 | ||
| 治疗3 d后 | 实验组 | 33 | 2.39±0.85a | 3.11±0.97a | 2.03±0.62a |
| 对照组 | 33 | 2.86±0.92a | 4.28±1.23a | 2.59±0.73a | |
| t | 2.156 | 4.291 | 3.359 | ||
| P | 0.035 | <0.001 | <0.001 | ||
| 治疗5 d后 | 实验组 | 33 | 1.53±0.26ab | 1.97±0.84ab | 1.26±0.33ab |
| 对照组 | 33 | 2.26±0.34ab | 2.79±0.90ab | 1.84±0.56ab | |
| t | 9.796 | 3.826 | 5.126 | ||
| P | <0.001 | <0.001 | <0.001 |
实验组换药次数、红肿痛缓解时间、病原菌培养转阴时间、住院时间低于对照组(P<0.05). 见表4.
| 组别 | 例数 | 换药次数(次) | 红肿痛缓解时间(d) | 病原菌培养转阴时间(d) | 住院时间(d) |
| 实验组 | 33 | 8.02±2.15 | 4.19±1.24 | 6.48±0.83 | 10.18±2.33 |
| 对照组 | 33 | 10.47±2.28 | 5.56±1.70 | 7.59±0.62 | 12.67±2.19 |
| t | 4.491 | 3.740 | 6.155 | 4.473 | |
| P | <0.001 | <0.001 | <0.001 | <0.001 |
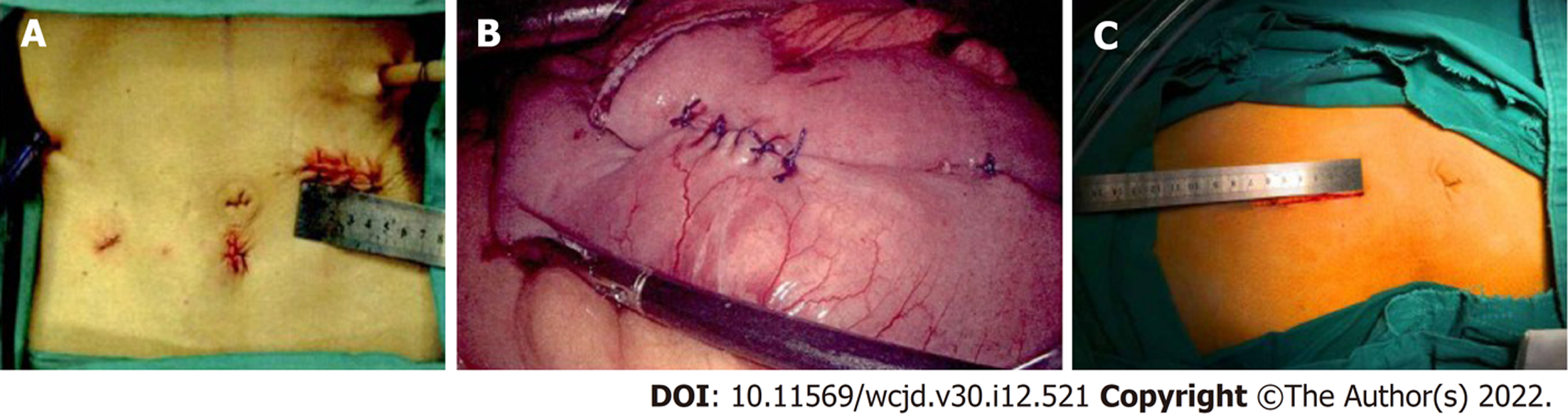
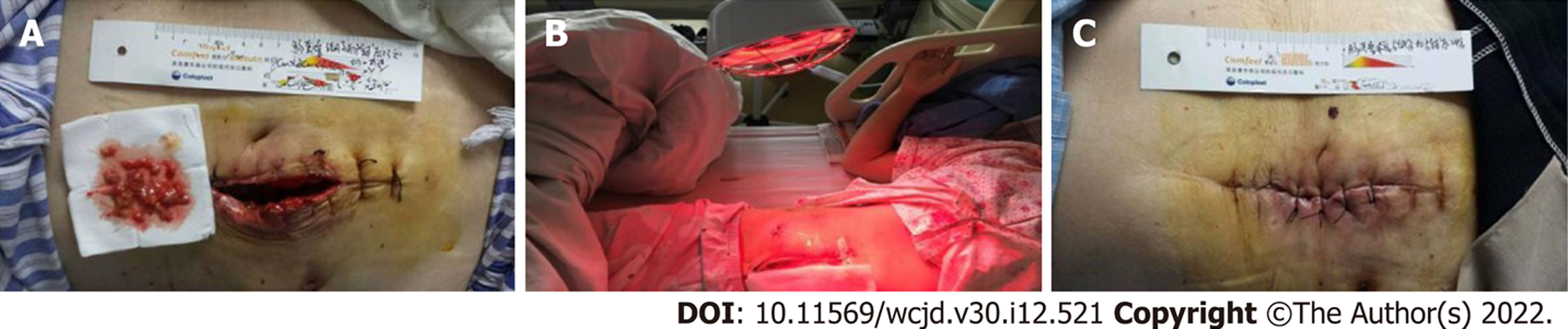
联合组VSS量表色泽、血管、柔软性、厚度、疼痛评分低于对照组(P<0.05). 见表5、图2、图3.
| 组别 | 例数 | 色泽 | 血管 | 柔软性 | 厚度 | 疼痛 |
| 实验组 | 33 | 0.64±0.20 | 0.31±0.10 | 0.84±0.23 | 0.40±0.12 | 0.24±0.06 |
| 对照组 | 33 | 0.95±0.26 | 0.53±0.11 | 1.09±0.21 | 0.62±0.15 | 0.39±0.13 |
| t | 5.429 | 8.501 | 4.611 | 6.579 | 6.018 | |
| P | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
两组均未见不良反应发生.
近年来, 腹腔镜胃肠手术不断增多, 但是胃肠的开腹手术在基层医院仍然是主流方式. 开腹胃肠外科术后切口感染不仅会增加住院时间, 影响患者康复进程, 还可能引起全身性感染、器官功能障碍等, 对患者生命安全造成潜在威胁, 需予以重视. 本研究在常规抗菌治疗基础上, 采用红外线局部照射联合皮肤再生医疗技术进行治疗, 结果显示实验组疗效优于对照组, 换药次数、红肿痛缓解时间、病原菌培养转阴时间、住院时间低于对照组, 提示红外线局部照射联合皮肤再生医疗技术治疗开腹胃肠外科术后切口感染, 能大大缩短感染切口的愈合时间, 加快患者临床症状体征缓解, 促进患者康复, 凸显快速外科康复的理念.
皮肤再生医疗技术由湿润暴露疗法和湿润烧伤膏组成, 针对切口愈合过程中局部潜能再生细胞不足的特点, 激活细胞的再生潜能, 为其增殖、分化提供充足的维生素、氨基酸、脂肪酸等成分, 促进血管再生, 为肉芽组织与上皮组织的生成创造有利微环境, 加快感染切口的生理再生进程[10]. 红外线局部照射促进切口感染控制与愈合的机制包括多方面: (1)能利用红外光的热效应, 透射至感染切口结缔组织、血管、神经系统等不同深度部位, 起到促进局部代谢、改善局部组织营养和血液循环作用, 并能加快局部渗出物的吸收, 控制炎症, 且其温热效应可解痉和缓解肌紧张, 消肿镇痛; (2)红外线基于人体生物大分子共振吸收效应理论, 发射光谱为(0.4-4) μm, 局部照射可激励感染部位生物大分子产生受激相干共振吸收效应, 向体液系统、神经系统传递信息, 引起生光化反应, 调节人体代谢功能、免疫功能, 增强对感染切口的修复能力[11]. 因此红外线局部照射联合皮肤再生医疗技术能协同增强疗效.
创面修复是一个复杂有序的过程, 其中炎症反应期是首先经历的阶段之一, 适度的炎症反应有利于切口修复, 但治疗过程中炎症反应的持续可引起感染部位疼痛、红肿、瘢痕形成等[12]. 切口感染后, 机体受损血管激活血小板, 释放多种止血物质, 并刺激CRP、PCT、WBC、TNF-α等炎症指标的合成与分泌, CRP、PCT、WBC、TNF-α水平越高, 提示炎症反应越明显[13,14]. 本研究显示, 与皮肤再生医疗技术比较, 红外线局部照射联合皮肤再生医疗技术能进一步降低CRP、PCT、WBC、TNF-α水平, 促进感染部位炎症反应的改善. 黄新灵等[15]报道, 红外线局部照射治疗烧伤创面, 可减少TNF-α、CRP合成分泌, 本研究观点与之相似, 证实红外线局部照射有利于控制局部炎症. 红外线局部照射的温热效应一方面通过改善切口局部血液循环, 降低致痛化学介质的作用, 抑制切口过度炎症反应, 另一方面通过加快渗出物的吸收, 缓解局部炎症.
组织增殖与重塑是切口创面修复的另两个必经阶段, 涉及多个生理过程, 细胞生长因子、生物学信号通路等在机体的调控下呈现高度的有序性、协调性、完整性, 凡影响细胞生长因子、生物学信号通路等的因素, 均可导致对应阶段被干扰[16]. IL-4/IL-13/STAT6信号通路是控制创面感染愈合的一个机制[17], 其中IL-4、IL-13可诱导STAT6磷酸化, 激活M2巨噬细胞极化, 导致转化生长因子-β等纤维化因子大量产生. Maeda等[18]报道, IL-4和IL-13在异常疤痕中表达上调, 介导切口愈合过程中瘢痕形成. 当IL-4 mRNA、IL-13 mRNA、STAT6 mRNA过表达时, 感染切口创面修复过程中, IL-4/IL-13/STAT6信号通路功能失调, 导致切口愈合不能以正常的生物学步骤有序进行, 从而影响切口愈合速度与质量. 本研究显示, 红外线局部照射联合皮肤再生医疗技术治疗开腹胃肠外科术后切口感染, 能降低IL-4 mRNA、IL-13 mRNA、STAT6 mRNA, 有利于抑制IL-4/IL-13/STAT6信号通路对切口愈合的消极作用, 改善切口愈合质量. 联合组VSS量表色泽、血管、柔软性、厚度、疼痛评分低于对照组, 且通过两组治疗前后切口部位图片对照发现, 红外线局部照射联合皮肤再生医疗技术在改善切口愈合质量中的价值, 而其机制可能有: (1)抑制切口部位过度炎症反应, 为切口早期修复创造有利局部微环境; (2)抑制IL-4/IL-13/STAT6信号通路异常激活, 使切口能按照正常的生物学步骤有序进行, 从而减少疤痕形成, 提高切口修复、愈合速度及质量. 但由于既往缺乏相似报道的论证和本研究结果的新颖性, 以上观点的可靠性仍有待进一步研究的验证.
综上所述, 红外线局部照射联合皮肤再生医疗技术治疗开腹胃肠外科术后切口感染, 能增强疗效, 改善炎症反应与切口愈合质量, 加快患者临床症状体征缓解和恢复进程.
切口感染是开腹胃肠外科术后常见并发症之一, 可延长住院时间, 增加经济负担, 并可能影响预后. 现阶段开腹胃肠外科术后切口感染处理方法较多, 但采用何种方法最优尚无定论, 故对此进行研究意义重大.
本研究拟探究红外线局部照射联合皮肤再生医疗技术治疗开腹胃肠外科术后切口感染效果及对白介素-4(interleukin-4, IL-4)/白介素-13(interleukin-13, IL-13)/转录激活子6(signal transducer and activator of transcription 6, STAT6)信号通路影响, 旨在为临床处理开腹胃肠外科术后切口感染提供一种行之有效且实用性强的方法, 并初探其机制, 期待为临床研究提供一个新思路和方向.
探寻一种治疗开腹胃肠外科术后切口感染的有效方法及可能的机制, 这不仅为临床处理开腹胃肠外科术后切口感染提供了参考, 还为该领域关于IL-4/IL-13/STAT6信号通路的研究奠定了学术基础.
本研究按照前瞻性试验和1:1随机试验原则, 将66例开腹胃肠外科术后切口感染患者随机分为两组, 两组均给予抗菌药物治疗, 在此基础上, 对照组给予皮肤再生医疗技术, 实验组给予红外线局部照射联合皮肤再生医疗技术, 可保证单一变量原则与组间的可比性. 采用SPSS软件统计比较两组疗效、炎症指标、IL-4/IL-13/STAT6信号通路改变、换药次数、红肿痛缓解时间、病原菌培养转阴时间、住院时间、瘢痕愈合质量, 可保证数据统计的客观性.
红外线局部照射联合皮肤再生医疗技术治疗开腹胃肠外科术后切口感染, 能增强疗效, 改善炎症反应与切口愈合质量, 加快患者临床症状体征缓解和恢复进程; 并能降低IL-4 mRNA、IL-13 mRNA、STAT6 mRNA表达, 为开腹胃肠外科术后切口感染治疗及切口愈合机制研究提供了一种新方法.
红外线局部照射联合皮肤再生医疗技术治疗开腹胃肠外科术后切口感染, 能增强疗效, 改善炎症反应与切口愈合质量, 加快患者临床症状体征缓解和恢复进程; 并能降低IL-4 mRNA、IL-13 mRNA、STAT6 mRNA表达, 提示其治疗机制可能是通过调控IL-4/IL-13/STAT6信号通路实现的.
红外线局部照射、皮肤再生医疗技术对医院硬件要求不高, 在减轻患者经济负担、树立医院口碑等多方面具有优势, 且推广使用范围广, 相信能使开腹胃肠外科术后切口感染患者受益. 未来建议增大样本或者设计自身对照对研究内容和结果进行进一步的完善.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Curran T, Alvarez D, Pastrana Del Valle J, Cataldo TE, Poylin V, Nagle D. Prophylactic closed-incision negative-pressure wound therapy is associated with decreased surgical site infection in high-risk colorectal surgery laparotomy wounds. Colorectal Dis. 2019;21:110-118. [PubMed] [DOI] |
| 2. | Maruyama H, Kusachi S, Makino H, Kanno H, Yoshida H, Niitsuma T. Postoperative Infection after Colorectal Surgery: Subanalysis of Data from the 2015 Japan Postoperative Infectious Complications Survey. J Nippon Med Sch. 2020;87:204-210. [PubMed] [DOI] |
| 3. | Khalili S, Khorasani SN, Razavi SM, Hashemibeni B, Tamayol A. Nanofibrous Scaffolds with Biomimetic Composition for Skin Regeneration. Appl Biochem Biotechnol. 2019;187:1193-1203. [PubMed] [DOI] |
| 7. | Nguyen JK, Austin E, Huang A, Mamalis A, Jagdeo J. The IL-4/IL-13 axis in skin fibrosis and scarring: mechanistic concepts and therapeutic targets. Arch Dermatol Res. 2020;312:81-92. [PubMed] [DOI] |
| 8. | Javed AA, Teinor J, Wright M, Ding D, Burkhart RA, Hundt J, Cameron JL, Makary MA, He J, Eckhauser FE, Wolfgang CL, Weiss MJ. Negative Pressure Wound Therapy for Surgical-site Infections: A Randomized Trial. Ann Surg. 2019;269:1034-1040. [PubMed] [DOI] |
| 9. | Mahar PD, Spinks AB, Cleland H, Bekhor P, Waibel JS, Lo C, Goodman G. Improvement of Burn Scars Treated With Fractional Ablative CO2 Lasers-A Systematic Review and Meta-analysis Using the Vancouver Scar Scale. J Burn Care Res. 2021;42:200-206. [PubMed] [DOI] |
| 11. | 都 丽丽. 高压氧联合红外线照射及磺胺嘧啶银乳膏治疗糖尿病肾病Ⅲ期压疮患者30例疗效分析. 中华航海医学与高气压医学杂志. 2019;26:53-55, 65. [DOI] |
| 12. | Wilgus TA, Ud-Din S, Bayat A. A Review of the Evidence for and against a Role for Mast Cells in Cutaneous Scarring and Fibrosis. Int J Mol Sci. 2020;21. [PubMed] [DOI] |
| 13. | 周 楠, 王 晓雯, 白 丹, 董 萱, 杨 燕帆, 张 鹏. PCT作为骨科术后切口感染指标的临床价值. 中国骨与关节损伤杂志. 2020;35:329-331. [DOI] |
| 15. | 黄 新灵, 周 忠志, 邹 梅林, 奉 水华. 远红外频谱照射联合水凝胶敷料治疗烧伤创面的效果及对血清EPO和TGF-α表达的影响. 中国美容医学. 2020;29:96-101. [DOI] |
| 16. | Lin X, Li Y, Luo W, Xiao L, Zhang Z, Zhao J, Liu C, Li Y. Leucine-activated nanohybrid biofilm for skin regeneration via improving cell affinity and neovascularization capacity. J Mater Chem B. 2020;8:7966-7976. [PubMed] [DOI] |
| 17. | Serezani APM, Bozdogan G, Sehra S, Walsh D, Krishnamurthy P, Sierra Potchanant EA, Nalepa G, Goenka S, Turner MJ, Spandau DF, Kaplan MH. IL-4 impairs wound healing potential in the skin by repressing fibronectin expression. J Allergy Clin Immunol. 2017;139:142-151.e5. [PubMed] [DOI] |
| 18. | Maeda D, Kubo T, Kiya K, Kawai K, Matsuzaki S, Kobayashi D, Fujiwara T, Katayama T, Hosokawa K. Periostin is induced by IL-4/IL-13 in dermal fibroblasts and promotes RhoA/ROCK pathway-mediated TGF-β1 secretion in abnormal scar formation. J Plast Surg Hand Surg. 2019;53:288-294. [PubMed] [DOI] |