修回日期: 2021-03-01
接受日期: 2021-03-27
在线出版日期: 2021-04-28
藤梨根提取物(rattan root extract, RRE)可抑制胃癌、肺癌等肿瘤细胞增殖, 具有一定抗肿瘤作用, 但其是否影响结直肠癌细胞的恶性表型还未知. miR-192-5p在结直肠癌组织中表达降低, 且其低表达与肿瘤大小等临床病理特征相关, 可作为结直肠癌诊治的潜在生物学标志物. StarBase生物信息学软件预测显示, 环腺苷酸调节的磷酸化蛋白19(cAMP-regulated phosphoprotein 19, ARPP19)可能是miR-192-5p的靶基因. 本研究假设RRE可通过调控miR-192-5p/ARPP19轴影响结直肠癌细胞增殖和凋亡.
探讨RRE对结直肠癌SW480细胞增殖和凋亡的影响及作用机制.
RRE干预SW480细胞后, MTT检测细胞增殖, 流式细胞术检测细胞凋亡, 蛋白质印迹法检测细胞中CyclinD1、C-caspase-3和ARPP19蛋白水平, RT-qPCR检测细胞中miR-192-5p和ARPP19 mRNA水平. 转染miR-192-5p模拟物或ARPP19小干扰RNA至SW480细胞, 上述相同方法观察过表达miR-192-5p或抑制ARPP19表达对SW480细胞增殖、凋亡及CyclinD1和C-caspase-3蛋白表达的影响. 双荧光素酶报告基因实验验证miR-192-5p和ARPP19调控关系.
RRE可降低SW480细胞存活率及ARPP19 mRNA和蛋白的表达(P<0.05), 增加SW480细胞凋亡率及C-caspase-3蛋白和miR-192-5p的表达(P<0.05). 过表达miR-192-5p或抑制ARPP19表达均可降低SW480细胞存活率及CyclinD1蛋白表达(P<0.05), 而提高SW480细胞凋亡率及C-caspase-3蛋白表达(P<0.05). miR-192-5p在SW480细胞中靶向负调控ARPP19表达. 抑制miR-192-5p表达可逆转RRE对SW480细胞增殖、凋亡及CyclinD1和C-caspase-3蛋白表达的影响. 抑制ARPP19表达可逆转抑制miR-192-5p表达对RRE处理的SW480细胞增殖、凋亡及CyclinD1和C-caspase-3蛋白表达的影响.
RRE可有效抑制结直肠癌SW480细胞增殖, 促进细胞凋亡, 其作用机制与调miR-192-5p/ARPP19轴有关.
核心提要: 藤梨根提取物可降低结直肠癌SW480细胞的增殖能力, 并诱导细胞凋亡, 其可能通过上调miR-192-5p进而抑制ARPP19的表达发挥作用.
引文著录: 徐万苏, 柯飞, 许怡, 郑艺. 藤梨根提取物通过调控miR-192-5p/ARPP19轴影响结直肠癌细胞的增殖和凋亡. 世界华人消化杂志 2021; 29(8): 398-406
Revised: March 1, 2021
Accepted: March 27, 2021
Published online: April 28, 2021
Radix Actinidiae extract (RAE) can inhibit the proliferation of gastric cancer, lung cancer, and other tumor cells, and has appreciated anti-tumor effects, but it is unknown whether it affects the malignant phenotype of colorectal cancer cells. The expression of miR-192-5p is reduced in colorectal cancer tissues, and its low expression is related to clinicopathological characteristics such as tumor size. Thus, it can be used as a potential biomarker for the diagnosis and treatment of colorectal cancer. StarBase bioinformatics software predicts that cAMP-regulated phosphoprotein 19 (ARPP19) may be a target gene of miR-192-5p. This study hypothesized that RAE can affect the proliferation and apoptosis of colorectal cancer cells by regulating the miR-192-5p/ARPP19 axis.
To investigate the effects and mechanism of RAE on proliferation and apoptosis of colorectal cancer SW480 cells.
After SW480 cells were treated with RAE, cell proliferation was detected by MTT assay, apoptosis was detected by flow cytometry, and the protein expression levels of Cyclin D1, cleaved Caspase-3, and ARPP19 were detected by Western blot. The expression of miR-192-5p and ARPP19 mRNA in cells was detected by RT-qPCR. miR-192-5p mimic or ARPP19 small interfering RNA was transfected into SW480 cells, and then the above methods were used to observe the effects of over-expressing miR-192-5p or inhibiting ARPP19 on cell proliferation, apoptosis, and the protein expression of CyclinD1 and cleaved Caspase-3 in SW480 cells. The regulatory relationship between miR-192-5p and ARPP19 was verified by the dual luciferase reporter gene assay.
RAE decreased the survival rate of SW480 cells and the expression of ARPP19 mRNA and protein (P < 0.05), but increased the apoptosis rate of SW480 cells and the expression of cleaved Caspase-3 protein and miR-192-5p (P < 0.05). Over-expressing miR-192-5p or inhibiting ARPP19 expression could decrease the survival rate of SW480 cells and the expression of CyclinD1 protein (P < 0.05), but increase the apoptosis rate of SW480 cells and the expression of cleaved Caspase-3 protein (P < 0.05). miR-192-5p negatively regulated the expression of ARPP19 in SW480 cells. Inhibiting miR-192-5p reversed the effects of RAE on proliferation, apoptosis, and the protein expression of CyclinD1 and cleaved Caspase-3 in SW480 cells. Inhibiting ARPP19 reversed the effects of inhibiting miR-192-5p on proliferation, apoptosis, and the protein expression of CyclinD1 and cleaved Caspase-3 of SW480 cells treated with RAE.
RAE inhibits the proliferation of colorectal cancer SW480 cells and promotes apoptosis, and its mechanism of action is related to the regulation of the miR-192-5p/ARPP19 axis.
- Citation: Xu WS, Ke F, Xu Y, Zheng Y. Radix Actinidiae extract affects proliferation and apoptosis of colorectal cancer cells by regulating miR-192-5p/ARPP19. Shijie Huaren Xiaohua Zazhi 2021; 29(8): 398-406
- URL: https://www.wjgnet.com/1009-3079/full/v29/i8/398.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i8.398
结直肠癌是常见的恶性肿瘤, 发病率在所有恶性肿瘤中排名第三位, 死亡率居第四位严重威胁人类生命健康[1,2]. 目前, 结直肠癌的发病机制尚未明确且缺乏有效的治疗药物, 探讨其发生发展的分子机制, 并寻找用于治疗该肿瘤的药物和分子靶点具有积极意义. 藤梨根是猕猴桃科猕猴桃属软枣猕猴桃的根, 具有清热利湿、祛风除痹、解毒消肿、止血的功效. 近年来研究显示, 藤梨根提取物(rattan root extract, RRE)具有抗肿瘤功效, 是肿瘤治疗的潜在药物. 党辉等[3]研究显示, RRE可通过干预胃癌SGC7901细胞周期和凋亡抑制SGC7901细胞的增殖, 发挥抗肿瘤作用. 孙雪飞等[4]研究显示, RRE可通过阻滞细胞周期和诱导细胞凋亡抑制人肺癌A549细胞生长. 目前, RRE是否发挥抗结肠癌的作用还未知. 微小RNA (microRNA, miRNA)可调控其靶基因的表达, 参与细胞的生长、分化、凋亡等生命过程, 可作为肿瘤治疗的分子靶点[5]. 研究显示, miR-192-5p在结直肠癌组织和细胞系中表达降低, 与肿瘤大小等临床病理特征相关, 是结直肠癌诊治的潜在生物学标志物[6,7]. StarBase生物信息学软件预测显示, 环腺苷酸调节的磷酸化蛋白19(cAMP-regulated phosphoprotein 19, ARPP19)可能是miR-192-5p的靶基因. ARPP19可通过抑制蛋白磷酸酶2A来调节有丝分裂, 其高表达可能与肿瘤细胞的恶性行为有关[8]. 因此, 本研究以结直肠癌SW480细胞为研究对象, miR-192-5p/ARPP19轴为切入点, 探讨了RRE对SW480细胞增殖和凋亡及可能的分子机制, 以期为结直肠癌的治疗提供新途径.
1.1.1 RRE制备: 藤梨根(河南中医药大学第一附属医院中药房)干燥后, 粉碎, 过200目筛. 准确称取500 g藤梨根粉, 加入2000 mL正丁醇, 60 ℃回流24 h, 过滤. 滤渣再次回流, 将两次滤液合并, 旋转蒸发回收正丁醇至膏状, 真空干燥后研磨至粉末. 经检测提取物(RRE)主要成分为三萜类化合物.
1.1.2 细胞和试剂: SW480细胞系, 中国科学院上海细胞库; 胎牛血清(FBS)、RPMI 1640培养基和四甲基噻唑蓝(MTT), 北京索莱宝; LipofectamineTM 2000试剂盒, 美国Invitrogen公司; 鼠抗人细胞周期蛋白D1(CyclinD1)和活化的半胱天冬酶-3(C-caspase-3)抗体, 美国Santa Cruz公司; 重组人cAMP调节磷蛋白(ARPP19)抗体, 南京莱富赛生物科技有限公司; PCR引物、miR-192-5p模拟物(mimics)和抑制剂(anti-miR-192-5p)及对照序列miR-NC和anti-miR-NC、ARPP19小干扰RNA(si-ARPP19)及乱序无意义阴性序列(si-NC), 上海吉凯基因公司; Trizol试剂和逆转录试剂盒和PCR试剂盒, 日本TAKARA公司; Annexin V-FITC/PI细胞凋亡试剂盒, 二喹啉甲酸(BCA)蛋白检测试剂盒和双荧光素酶活性检测试剂盒, 上海碧云天.
1.2.1 细胞培养和转染: SW480细胞复苏后, 用含10% FBS的RPMI 1640培养基培养. 调整对数生长期的SW480细胞浓度为2.5×104个/mL, 以2.5 mL/孔接种于6孔板中. 采用LipofectamineTM 2000脂质体法, 分别转染miR-192-5p mimics、miR-NC、anti-miR-192-5p、anti-miR-NC、si-ARPP19、si-NC、anti-miR-192-5p与si-ARPP19、anti-miR-192-5p与si-NC. 转染12 h, 更换培养基, 再培养24 h, 收集细胞备用.
1.2.2 细胞分组: 未转染的SW480细胞分为对照组(NC组)和不同剂量RRE组, 其中NC组细胞正常培养; RRE组细胞分别用含50、100、200、400 μg/mL[3] RRE的培养基培养24 h. 转染miR-192-5p、miR-NC、si-ARPP19、si-NC的SW480细胞用不含RRE的培养基培养24 h, 分别记为miR-192-5p组、miR-NC组、si-ARPP19、si-NC组. 转染anti-miR-192-5p、anti-miR-NC、共转染anti-miR-192-5p与si-ARPP19、anti-miR-192-5p与si-NC的SW480细胞均用含200 μg/mL RRE的培养基培养24 h, 分别记为, RRE+anti-miR-192-5p组、RRE+anti-miR-NC组、RRE+anti-miR-192-5p+si-ARPP19组、RRE+anti-miR-192-5p+si-NC组.
1.2.3 MTT检测细胞增殖: 调整细胞浓度为1.0×105个/mL, 以200 μL/孔接种于96孔板中. 按1.3.2分组处理, 培养后, 加20 μL MTT (5 mg/mL). 再孵育4 h, 弃培养基, 加150 μL二甲基亚砜, 酶标仪490 nm测吸光度值(A). 存活率(%) = A实验组/A对照组×100%
1.2.4 流式细胞仪检测细胞凋亡: 调整细胞浓度为1.0×105个/mL, 以1.0 mL/孔接种于24孔板中. 按1.3.2分组处理, 培养后, 收集细胞, 参照Annexin V-FITC/PI试剂盒说明书, 用流式细胞仪检测细胞凋亡.
1.2.5 RT-qPCR检测细胞中miR-192-5p和ARPP19 mRNA水平: 细胞接种和处理同1.3.4, 培养结束后, Trizol试剂提取总RNA, 逆转录为cDNA, 行PCR扩增. 引物序列: miR-192-5p上游5'-GCCGCGGTACGTCGAGCAA-3', 下游5'-CCGTAGCCGAAGTAAAGTA-3'; ARPP19上游5'-GCCTGGAGGTTCAGATTTCTTA-3', 下游5'-CACCAGTGACCTCCGTCTTAT-3'; GAPDH上游5'-GCTGGCGCTGAGTACGTCGTGGAGT-3', 下游5'-CACAGTCTTCTGGGTGGCA GTGA-3'; U6上游5'-TGTCCGTAGCTGAAACGACAC-3', 下游5'-CCGTAAAGCTGCCCG CTGACGC-3'. 2-△△Ct法计算miR-192-5p相对于内参U6、ARPP19 mRNA相对于内参GAPDH的表达水平.
1.2.6 Western Blot法检测ARPP19、CyclinD1和C-caspase-3蛋白表达水平: 细胞接种和处理同1.2.4, 培养结束后, RIPA试剂提取细胞中总蛋白, 经BCA法定量、10% SDS-PAGE电泳、转膜、5%脱脂奶粉封闭后, 分别加ARPP19(稀释度1:500)、CyclinD1(稀释度1:600)、C-caspase-3(稀释度1:400)一抗体, 4 ℃孵育过夜. 加山羊抗兔二抗(稀释度1:2000), 室温孵育1 h. 加化学发光试剂, 避光显影后曝光拍照.
1.2.7 双荧光素酶报告基因实验: 调整对数生长期的SW480细胞浓度为2.5×104个/mL, 以2.5 mL/孔接种于6孔板中. 采用LipofectamineTM 2000脂质体法, 分别共转染WT-ARPP19与miR-192-5p mimic或miR-NC、MUT-ARPP19与miR-192-5p mimic或miR-NC. 转染12 h, 更换培养基, 再培养24 h, 收集细胞. 参照双荧光素酶活性检测试剂盒操作说明, 检测荧光素酶活性.
统计学处理 SPSS 22.0软件分析实验数据. 符合正态分布的计量资料以mean±SD表示. 两组间比较用独立样本t检验; 多组间比较用单因素方差分析, 进一步两两比较采用SNK-q检验. 以P<0.05表示差异有统计学意义.
与NC组比较, 不同浓度(50、100、200、400 μg/mL)的RRE作用SW480细胞后, 细胞存活率降低(P<0.05). 由于200 μg/mL的RRE对SW480细胞抑制率接近50%, 因此选择RRE浓度为200 μg/mL进行后续实验. 见表1.
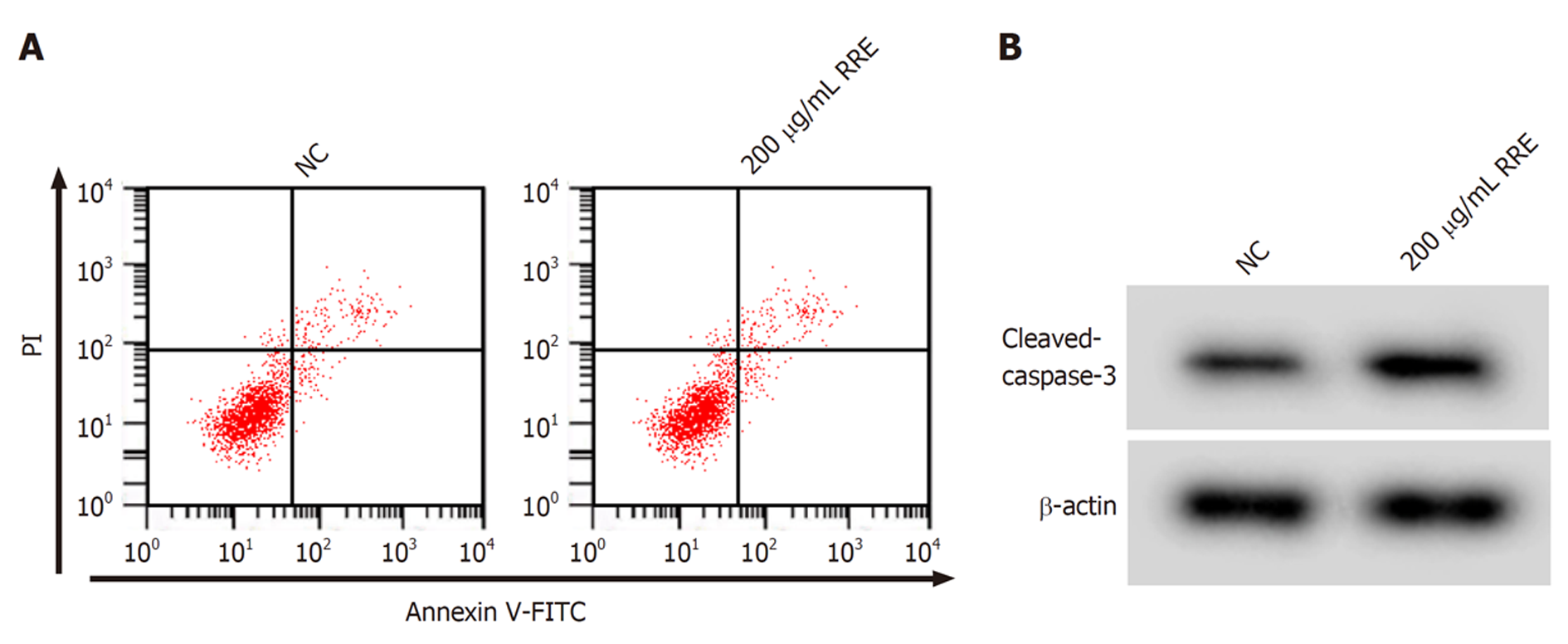
与NC组比较, 200 μg/mL RRE作用SW480细胞后, 细胞凋亡率、C-caspase-3蛋白表达升高(P<0.05). 见图1、表2.
与NC组比较, 200 μg/mL RRE作用SW480细胞后, 细胞中miR-192-5p表达升高(P<0.05), ARPP19 mRNA和蛋白的表达降低(P<0.05). 见图2、表3.
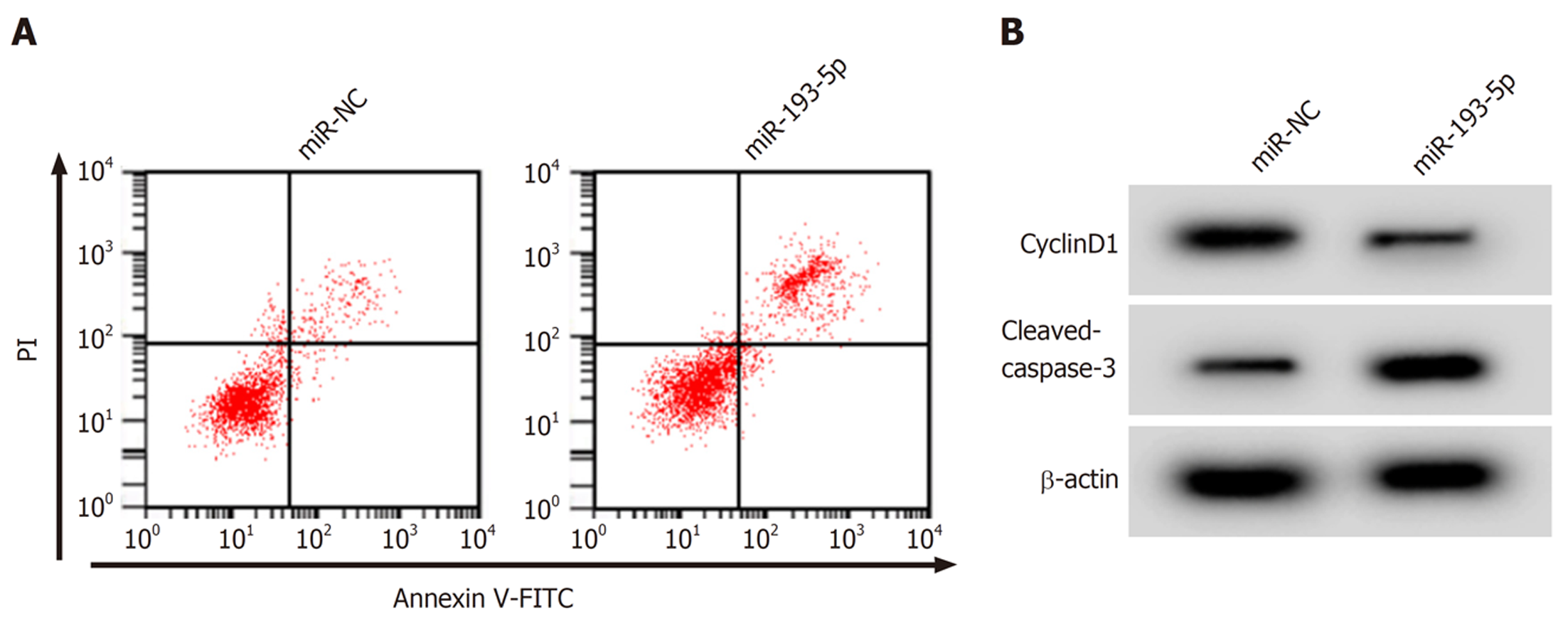
与miR-NC组比较, miR-192-5p组SW480细胞中miR-192-5p表达升高(P<0.05), 细胞存活率、CyclinD1蛋白表达降低(P<0.05), 凋亡率、C-caspase-3蛋白表达升高(P<0.05). 见图3和表4.
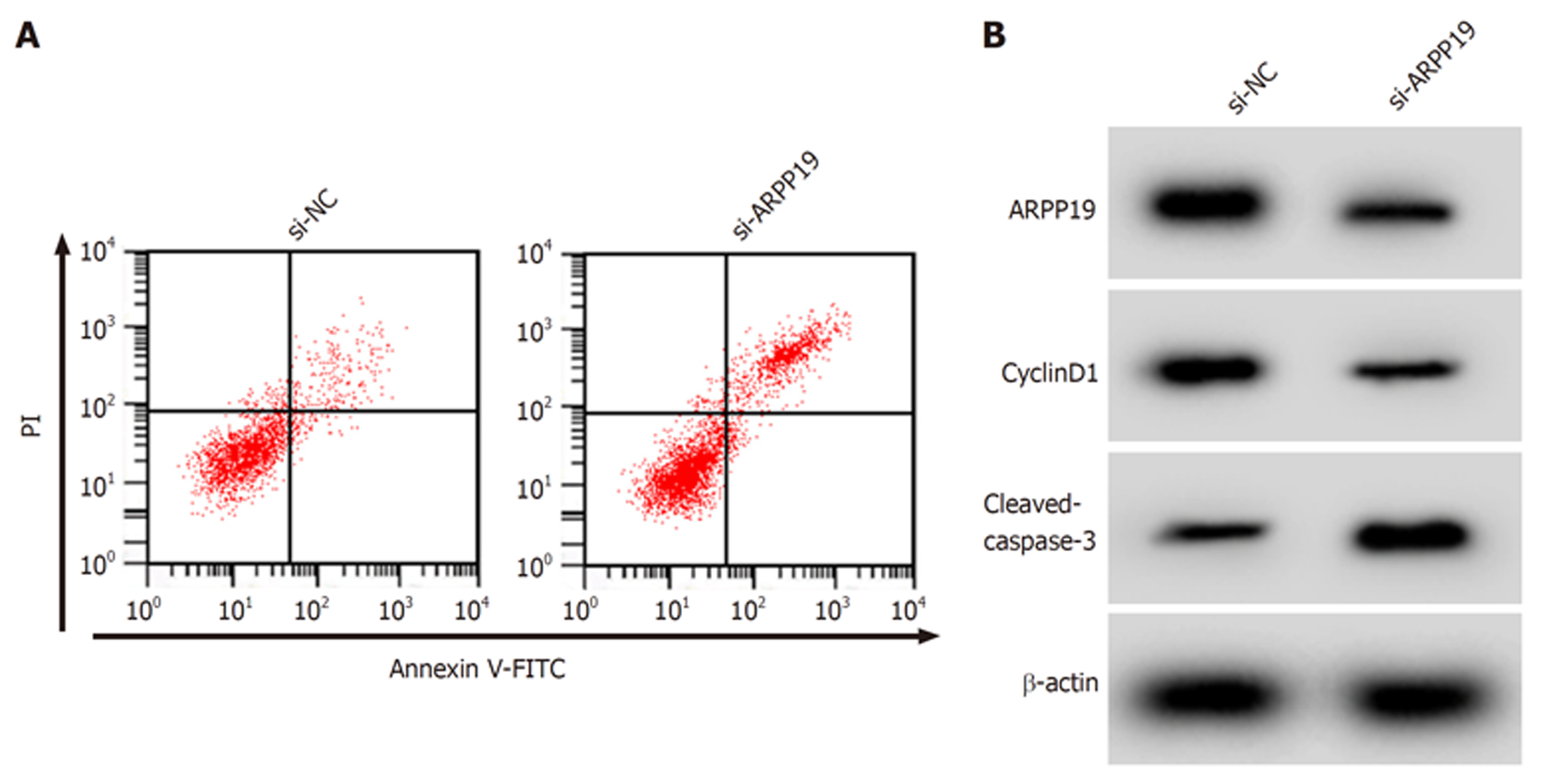
与si-NC组比较, si-ARPP19组SW480细胞中ARPP19蛋白表达降低(P<0.05), 细胞存活率、CyclinD1蛋白表达降低(P<0.05), 凋亡率、C-caspase-3蛋白表达升高(P<0.05). 见图4、表5.
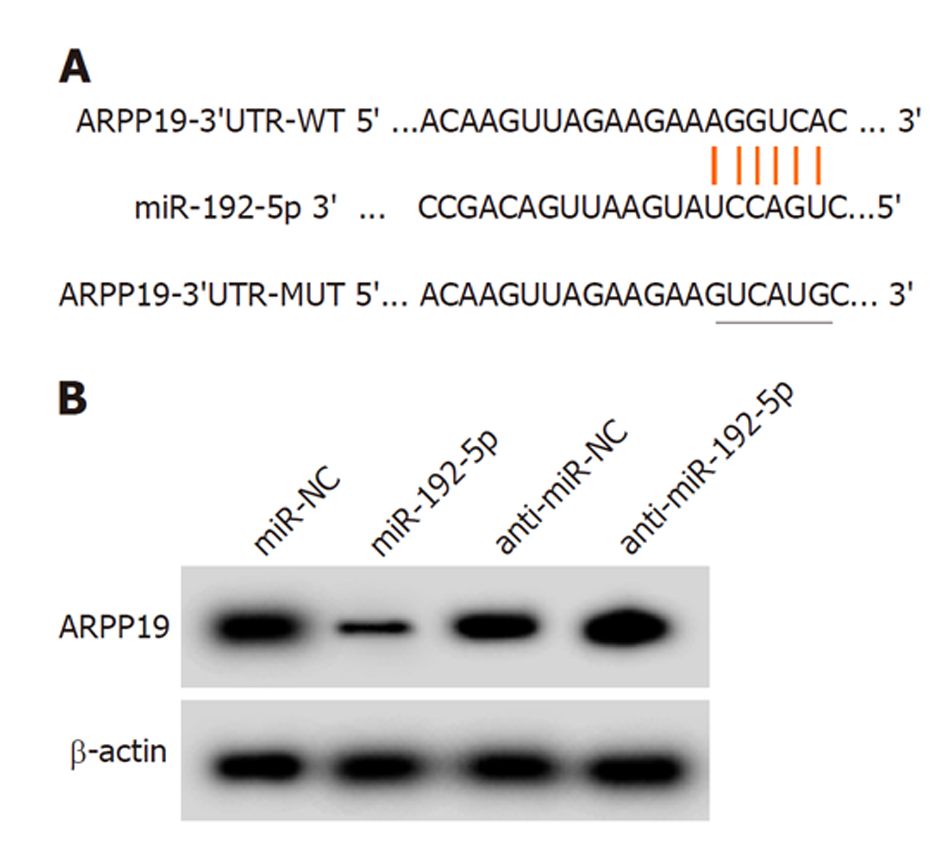
ARPP19的3'UTR与miR-192-5p的连续结合位点见图5A. SW480细胞中共转染miR-192-5p mimics与WT-ARPP19后荧光素酶活性降低(0.29±0.03比1.00±0.11, t = 18.681, P<0.05), 而共转染miR-192-5p mimics与MUT-ARPP19后荧光素酶活性无显著变化(1.07±0.12比1.06±0.10, t = 0.192, P = 0.850), 说明miR-192-5p可与ARPP19的3'UTR靶向结合. 与miR-NC组比较, miR-192-5p组SW480细胞中ARPP19蛋白水平降低(0.42±0.04比1.04±0.11, t = 15.891, P<0.05), 而与anti-miR-NC组比较, anti-miR-192-5p组SW480细胞中ARPP19蛋白水平升高(1.25±0.13比1.02±0.12, t = 3.900, P<0.05), 进一步说明miR-192-5p靶向负调空ARPP19表达. 见图5.
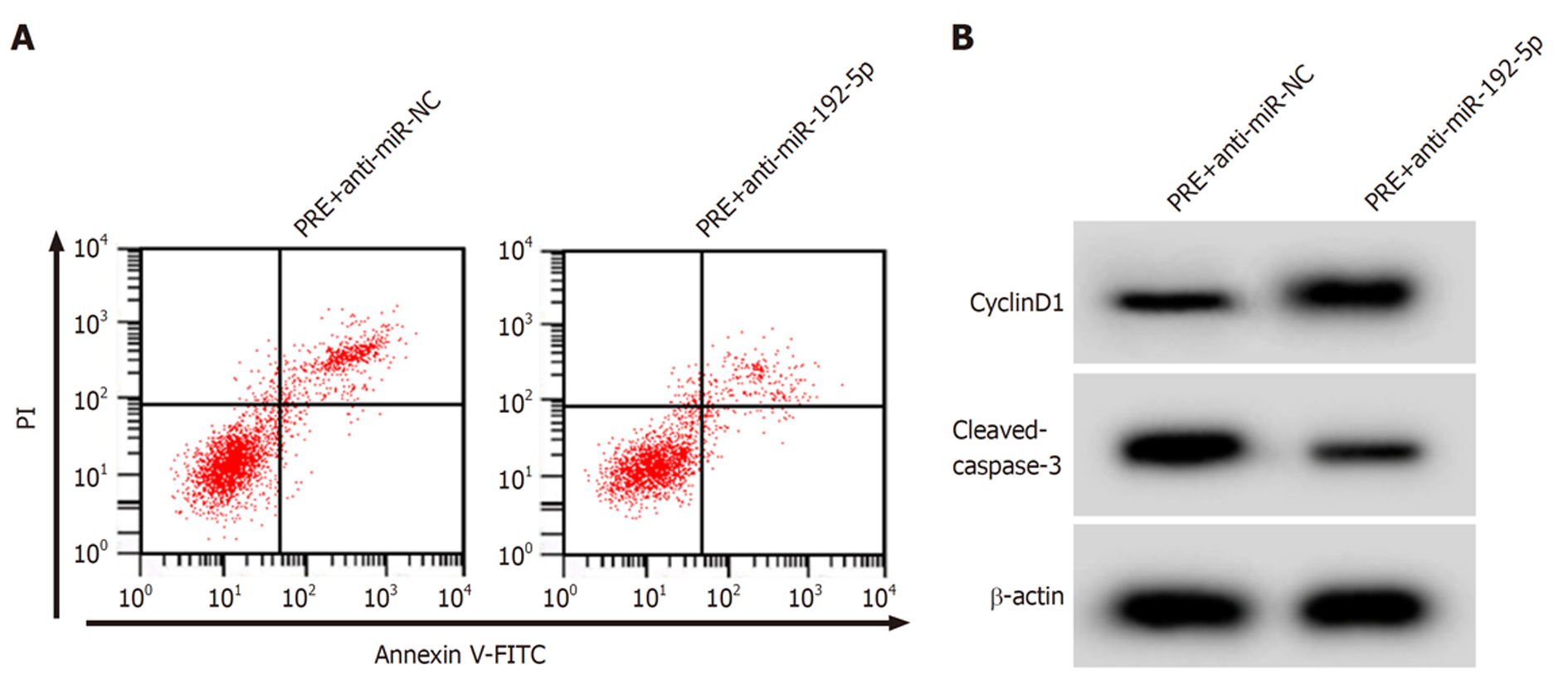
与RRE+anti-miR-NC组比较, RRE+anti-miR-192-5p组SW480细胞存活率、CyclinD1蛋白表达升高(P<0.05), 凋亡率、C-caspase-3蛋白表达降低(P<0.05). 见图6和表6.
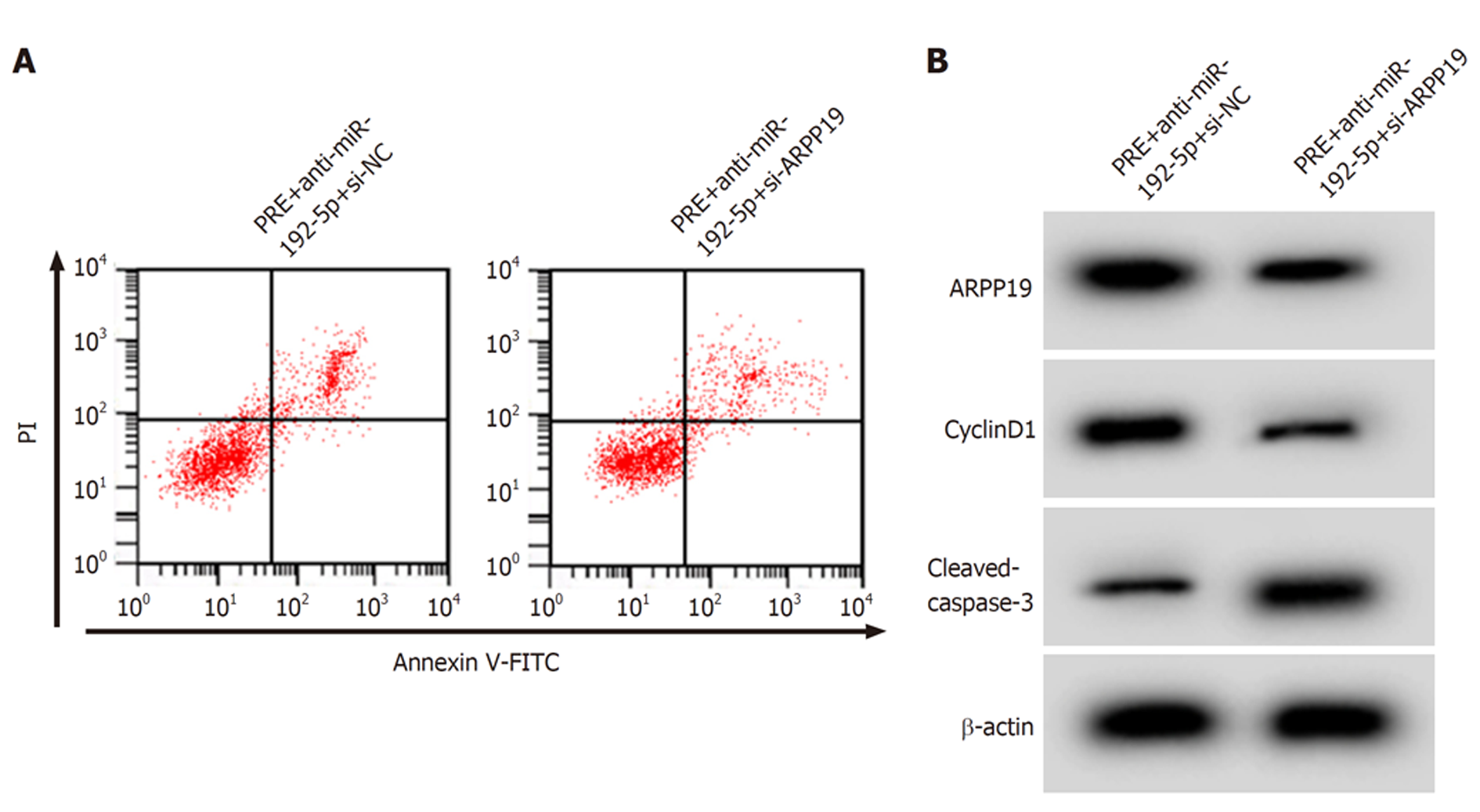
与RRE+anti-miR-192-5p+si-NC组比较, RRE+anti-miR-192-5p+si-ARPP19组SW480细胞存活率、CyclinD1蛋白表达降低(P<0.05), 凋亡率、C-caspase-3蛋白表达升高(P<0.05). 见图7和表7.
结直肠癌的治疗通常辅助化疗、放疗等治疗, 但化疗药物通常存在较大的副作用, 且疗效不佳[9]. 近年来, 中药及其活性成分因毒副作用小、药效强, 其在肿瘤治疗中的作用备受关注. RRE是从中药藤梨根提取而来, 研究显示, RRE可能通过胃癌SGC-7901细胞Bcl-2蛋白水平的表达促进SGC-7901细胞凋亡[10]; RRE可通过抑制PI3K/Akt通路的激活抑制人肺癌细胞A549增殖. 这说明RRE具有抗肿瘤的作用. Caspase级联反应参与调控细胞凋亡, 而caspase-3是caspase级联反应的关键调控蛋白, 其活化后剪切下游分子, 进而诱导细胞凋亡[11]. 本研究显示, RRE作用SW480细胞后, 细胞存活率降低, 而凋亡率及细胞中C-caspase-3蛋白表达升高, 表明RRE可能通过调控caspase级联反应来抑制SW480细胞增殖及促进细胞凋亡, 发挥抗结直肠癌作用.
miR-192-5p是一种miRNA, 参与多种肿瘤的发生发展. Zhu等[12]研究显示, miR-192-5p在肝癌组织中表达降低, 过表达miR-192-5p通过靶向甲状腺激素受体相互作用因子13对肝癌细胞增殖、迁移和侵袭发挥抑制作用, 而对其上皮-间质转化起促进作用, 为肝癌的治疗提供了新的作用靶点. Zou等[13]研究显示, miR-192-5p在胰腺癌组织和患者血清表达上调, 血清miR-192-5p可用于胰腺癌的早期诊断. 这说明miR-192-5p在不同肿瘤中发挥的作用不同, 即可作为抑癌基因抑制肿瘤发展进程, 又可作为促癌基因促进肿瘤发展进程. 吴巍芸等[14]研究显示, 过表达miR-192可抑制结直肠癌SW480细胞的迁移和侵袭. 本研究显示, 转染miR-192-5p mimics对阻碍SW480细胞增殖, 并加剧其凋亡, 提示miR-192-5p在结直肠癌中起抑癌基因作用, 其可能是结直肠癌治疗的分子靶点. Jin等[15]研究显示, 姜黄素可通过上调miR-192-5p表达减弱非小细胞肺癌细胞的增殖能力及促进细胞凋亡. 本研究显示显示, RRE可促进结直肠癌SW480细胞中miR-192-5p表达, 抑制miR-192-5p表达逆转了RRE对SW480细胞增殖、凋亡及CyclinD1和C-caspase-3蛋白表达的影响, 说明RRE通过上调细胞中miR-192-5p表达发挥抗结直肠癌作用.
为了进一步探讨RRE通过上调细胞中miR-192-5p表达发挥抗结直肠癌作用的机制, 本研究还证实了miR-192-5p在SW480细胞中靶向负调控ARPP19表达. 研究显示, 甲状腺乳头状癌细胞中ARPP19表达升高, 上调miR-26a通过靶向抑制ARPP19阻碍甲状腺乳头状癌细胞增殖[16]; ARPP19表达水平与肝细胞癌肿瘤大小成正比, 抑制ARPP19表达可降低肝细胞癌细胞HepG2和SMMC-7721的生长速率[17]; 抑制miR-320表达通过上调ARPP19促进乳腺癌MCF-7细胞的生长[18]. 目前, ARPP19在结直肠癌中发挥的作用还未知. 本研究显示, 抑制ARPP19表达可抑制结直肠癌细胞增殖, 并促进细胞凋亡, 说明ARPP19作为促癌基因参与结直肠癌的发生发展, 抑制其表达可有效缓解结直肠癌的发展进程, 对改善患者预后有积极帮助. 本研究还显示, RRE可抑制结直肠癌SW480细胞中ARPP19表达, 抑制ARPP19表达可逆转抑制miR-192-5p表达对RRE处理的SW480细胞增殖、凋亡及CyclinD1和C-caspase-3蛋白表达的影响, 进一步说明RRE通过上调细胞中miR-192-5p表达, 进而下调ARPP19表达发挥抗结直肠癌作用.
综上, RRE可阻碍结直肠癌SW480细胞增殖, 而诱导其凋亡, 作用机制可能与调控miR-192-5p/ARPP19轴有关, 具有治疗结直肠癌的潜在价值. 本研究接下来将通过动物实验进一步探讨RRE对体内结肠癌肿瘤生长和转移的影响及其他作用机制, 以期为其用于临床治疗提供实验依据.
结直肠癌的发病机制尚未明确, 且缺乏有效的治疗药物. 藤梨根提取物(rattan root extract, RRE)具有一定抗胃癌和肺癌作用, 但其是否影响结直肠癌发生发展还未知. 本研究探究RRE对结直肠癌细胞增殖和凋亡的影响及可能机制, 以期为结直肠癌的治疗提供新途径.
本研究的主题是RRE是否影响结直肠癌细胞增殖和凋亡及其能否调控miR-192-5p/ARPP19轴发挥作用, 目前是为了探究RRE是否发挥抗结直肠癌作用及其可能的作用机制.
本研究的主要目标是探讨RRE是否具有抗结直肠癌作用及其可能的作用机制, 通过体外细胞实验明确RRE可能通过调控miR-192-5p/ARPP19轴抑制结直肠癌细胞增殖, 并促进细胞凋亡, 以期为其用于结直肠癌的治疗提供一定的实验依据.
本研究采用MTT检测细胞增殖, 流式细胞术检测细胞凋亡, 蛋白质印迹法检测细胞中CyclinD1、C-caspase-3和ARPP19蛋白水平, RT-qPCR检测细胞中miR-192-5p和ARPP19 mRNA水平. 双荧光素酶报告基因实验验证miR-192-5p和ARPP19靶向调控关系.
本研究结果表明RRE可抑制结直肠癌细胞增殖, 并促进其凋亡, 在一定程度上发挥抗结直肠癌作用. 同时, RRE促进结直肠癌细胞中miR-192-5p表达而抑制ARPP19表达. 过表达miR-192-5p或抑制ARPP19均可降低结直肠癌细胞的增殖能力, 并促进细胞凋亡, 且miR-192-5p靶向负调控ARPP19.
本研究首次发现RRE可抑制结直肠癌细胞增殖, 并加剧细胞凋亡, 其作用机制可能与调控miR-192-5p/ARPP19轴有关, 具有治疗结直肠癌的潜在价值.
本研究存在不足之处, 仅在体外细胞层面进行了探究, 尚未通过动物实验在体内探究RRE的抗结直肠癌作用, 接下来将通过裸鼠移植瘤实验进一步在体内验证RRE对结直肠癌发生发展的影响及潜在机制, 以期为结直肠癌的治疗提供新途径.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 5. | Mao Y, Liu R, Zhou H, Yin S, Zhao Q, Ding X, Wang H. Transcriptome analysis of miRNA-lncRNA-mRNA interactions in the malignant transformation process of gastric cancer initiation. Cancer Gene Ther. 2017;24:267-275. [PubMed] [DOI] |
| 6. | Zhao H, Chen J, Chen J, Kong X, Zhu H, Zhang Y, Dong H, Wang J, Ren Q, Wang Q, Chen S, Deng Z, Chen Z, Cui Q, Zheng J, Lu J, Wang S, Tan J. miR-192/215-5p act as tumor suppressors and link Crohn's disease and colorectal cancer by targeting common metabolic pathways: An integrated informatics analysis and experimental study. J Cell Physiol. 2019;234:21060-21075. [PubMed] [DOI] |
| 7. | Chiang Y, Song Y, Wang Z, Liu Z, Gao P, Liang J, Zhu J, Xing C, Xu H. microRNA-192, -194 and -215 are frequently downregulated in colorectal cancer. Exp Ther Med. 2012;3:560-566. [PubMed] [DOI] |
| 8. | Gharbi-Ayachi A, Labbé JC, Burgess A, Vigneron S, Strub JM, Brioudes E, Van-Dorsselaer A, Castro A, Lorca T. The substrate of Greatwall kinase, Arpp19, controls mitosis by inhibiting protein phosphatase 2A. Science. 2010;330:1673-1677. [PubMed] [DOI] |
| 11. | 江 流芳, 劳 雅琴, 马 庆华, 赵 宗权. 维生素D受体对高糖环境下足细胞凋亡及Caspase-3活化水平的影响及机制. 中国老年学杂志. 2018;38:2482-2485. [DOI] |
| 12. | Zhu MX, Wei CY, Zhang PF, Gao DM, Chen J, Zhao Y, Dong SS, Liu BB. Elevated TRIP13 drives the AKT/mTOR pathway to induce the progression of hepatocellular carcinoma via interacting with ACTN4. J Exp Clin Cancer Res. 2019;38:409. [PubMed] [DOI] |
| 13. | Zou X, Wei J, Huang Z, Zhou X, Lu Z, Zhu W, Miao Y. Identification of a six-miRNA panel in serum benefiting pancreatic cancer diagnosis. Cancer Med. 2019;8:2810-2822. [PubMed] [DOI] |
| 15. | Jin H, Qiao F, Wang Y, Xu Y, Shang Y. Curcumin inhibits cell proliferation and induces apoptosis of human non-small cell lung cancer cells through the upregulation of miR-192-5p and suppression of PI3K/Akt signaling pathway. Oncol Rep. 2015;34:2782-2789. [PubMed] [DOI] |
| 16. | Gong Y, Wu W, Zou X, Liu F, Wei T, Zhu J. MiR-26a inhibits thyroid cancer cell proliferation by targeting ARPP19. Am J Cancer Res. 2018;8:1030-1039. [PubMed] |
| 17. | Song H, Pan J, Liu Y, Wen H, Wang L, Cui J, Liu Y, Hu B, Yao Z, Ji G. Increased ARPP-19 expression is associated with hepatocellular carcinoma. Int J Mol Sci. 2014;16:178-192. [PubMed] [DOI] |