修回日期: 2021-01-23
接受日期: 2021-03-02
在线出版日期: 2021-03-28
Krüppel样因子5(krüppel-like factor 5, KLF5)和Wnt/β-Catenin通路都是肿瘤发生的研究热点, 目前有研究发现KLF5与肠上皮细胞的分化和增殖有关, 推测其可能参与了肠化生的发生. 但目前有关KLF5对胃黏膜肠化生组织增殖、凋亡的影响及其分子机制的研究报道相对较少.
分析KLF5通过激活Wnt通路对幽门螺杆菌(Helicobacter pylori, H. pylori)诱导胃黏膜肠化生(gastric intestinal metaplasia, GIM)作用的影响.
收集肠化生组织和正常胃黏膜, 采用RT-PCR法、Western blot法分别检测KLF5、Wnt3a mRNA和蛋白表达. 体外培养胃黏膜上皮细胞GES1, 分为空白对照组、HpSlyD组(200 ng/mL的HpSlyD+阴性序列)、干扰KLF5组(200 ng/mL的HpSlyD +KLF5 siRNA)、Wnt激动剂组(200 ng/mL的HpSlyD +KLF5 siRNA+氯化锂)、Wnt激动剂+干扰KLF5组. 采用MTT法、流式细胞仪分别检测各组GES1细胞增殖、凋亡情况, 采用RT-PCR法检测KLF5、Wnt3a、β-catenin、Villin 1, VIL1)、三叶因子Ⅱ(trefoil factor 2, TFF2)、尾侧同源盒因子2(caudal homeobox factor 2CDX2)mRNA表达. Western blot法检测VIL1、TFF2、CDX2蛋白表达.
KLF5、Wnt3a mRNA和蛋白表达量在肠化生组织中明显高于在正常胃黏膜中的表达(P<0.01). HpSlyD组、干扰对照组细胞增殖率明显高于空白对照组、凋亡率明显低于空白对照组(P<0.05), 干扰KLF5组细胞增殖率明显低于HpSlyD组、凋亡率明显高于HpSlyD组(P<0.05). HpSlyD组、干扰对照组细胞VIL1、TFF2、CDX2 mRNA和蛋白表达明显高于空白对照组(P<0.05), 干扰KLF5组细胞VIL1、TFF2、CDX2 mRNA和蛋白表达明显低于HpSlyD组(P<0.05). 干扰KLF5组细胞Wnt3a、β-catenin、CDX2 mRNA表达明显低于HpSlyD组(P<0.05). 而Wnt激动剂+干扰KLF5组Wnt3a、β-catenin、CDX2 mRNA表达明显高于干扰KLF5组(P<0.05).
干扰KLF5表达可显著抑制HpSlyD诱导的胃黏膜化生的发生, KLF5可能通过激活Wnt/β-Catenin促进HpSlyD诱导的胃黏膜化生, 为胃癌的临床预防提供了新的靶点.
核心提要: Krüppel样因子5(krüppel-like factor 5, KLF5)在肠化生组织中高表达, 沉默KLF5表达后肠化生相关蛋白表达水平受到抑制, Wnt/β-Catenin通路相关基因Wnt3a、β-catenin、CDX2也受到抑制, 进而抑制细胞增殖和促进细胞凋亡, 沉默KLF5表达可能是通过Wnt/β-Catenin通路来抑制肠化生的发生.
引文著录: 季永欣, 王春子, 李雪, 李莉. KLF5通过激活Wnt通路对HpSlyD诱导胃黏膜肠化生作用的影响. 世界华人消化杂志 2021; 29(6): 274-281
Revised: January 23, 2021
Accepted: March 2, 2021
Published online: March 28, 2021
Krüppel like factor 5 (KLF5) and the Wnt/β-catenin pathway are hot topics in the research of tumorigenesis. Some studies have found that KLF5 is related to the differentiation and proliferation of intestinal epithelial cells, suggesting that KLF5 may be involved in the occurrence of intestinal metaplasia. However, there are few reports on the effect of KLF5 on intestinal metaplasia and the underlying molecular mechanism.
To explore the effect of KLF5 on gastric intestinal metaplasia (GIM) induced by Helicobacter pylori (H. pylori) and the underlying mechanism.
The mRNA and protein expression of KLF5 and Wnt3a was detected by RT-PCR and Western blot, respectively. Gastric epithelial cell line GES1 was cultured in vitro and divided into a blank control group, HpSlyD group (200 ng/mL HpSlyD + negative sequence), KLF5 interference group (200 ng/mL HpSlyD + KLF5 siRNA), Wnt agonist group (200 ng/mL HpSlyD + KLF5 siRNA + lithium chloride), and Wnt agonist + KLF5 interference group. GES1 cell proliferation and apoptosis were determined by MTT assay and flow cytometry, respectively. RT-PCR was used to detect KLF5, Wnt3a, beta-catenin, wool protein 1 (VIL1), trefoil factor 2 (TFF2), and caudal homeobox factor 2 (CDX2) mRNA expression. The expression of VIL1, TFF2, and CDX2 proteins was detected by Western blot.
The expression of KLF5 and Wnt3a mRNA and protein in intestinal metaplasia was significantly higher than that in the normal gastric mucosa (P < 0.01). The cell proliferation rates in the HpSlyD group and interference control group were significantly higher than that of the blank control group, and the apoptosis rates were significantly lower than that of the blank control group (P < 0.05). The cell proliferation rate of the KLF5 interference group was significantly lower than that of the HpSlyD group, and the apoptosis rate was significantly higher than that of the HpSlyD group (P < 0.05). The mRNA and protein expression of VIL1, TFF2, and CDX2 in the HpSlyD group and interference control group was significantly higher than that of the blank control group (P < 0.05), while the mRNA and protein expression of VIL1, TFF2, and CDX2 in the KLF5 interference group were significantly lower than those of the HpSlyD group (P < 0.05). The expression of Wnt3a, β-catenin, and CDX2 mRNA in the KLF5 interference group was significantly lower than that of the HpSlyD group (P < 0.05). The expression of Wnt3a, β-catenin, and CDX2 mRNA in the Wnt agonist + KLF5 interference group was significantly higher than that of the KLF5 interference group (P < 0.05).
Interference of KLF5 expression can significantly inhibit HpSlyD induced gastric metaplasia. KLF5 may promote HpSlyD induced gastric metaplasia by activating the Wnt/β-catenin pathway, which provides a new target for clinical prevention of gastric cancer.
- Citation: Ji YX, Wang CZ, Li X, Li L. KLF5 promotes HpSlyD induced gastric intestinal metaplasia by activating Wnt/β-catenin pathway. Shijie Huaren Xiaohua Zazhi 2021; 29(6): 274-281
- URL: https://www.wjgnet.com/1009-3079/full/v29/i6/274.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i6.274
胃癌是起源于胃黏膜上皮的常见消化道恶性肿瘤之一, 在我国各种恶性肿瘤中发病率居首位, 好发于50岁以上人群, 且近年来呈年轻化趋势. 目前胃癌的诊断和治疗方面存在诸多问题, 由于早期胃癌多数患者无明显症状, 难以引起足够重视, 且胃镜检查早期胃癌检出率低, 因此大多数患者就诊时都处于中晚期, 对放化疗治疗敏感性较差, 5年生存率明显低于早期胃癌患者[1]. 胃癌的发生发展是一个渐进过程, 胃黏膜肠化生(gastric intestinal metaplasia, GIM)在此过程中是胃黏膜从良性向恶性转变的重要环节, 是胃黏膜在修复过程中偏离正常轨道的表现[2]. 已有研究证实GIM为肠型胃癌密切相关的癌前病变[3], 因此探讨GIM发生、持续、发展过程, 对于逆转癌前病变、选择合适的干预治疗靶点具有重要意义. Krüppel样因子5(krüppel-like factor 5, KLF5)是一种可与DNA结合的锌指转录调节因子, 广泛参与胚胎发育、细胞增殖、分化、凋亡等多种生物学过程[4]. 目前已发现KLF5在诸多肿瘤组织中表达异常, 并通过调控下游众多靶蛋白及相关信号通路, 在肿瘤发生发展过程中扮演者重要角色[5]. Wnt信号通路在肿瘤的发生发展过程中起着重要的调节作用. Wnt通路激活后细胞周期和凋亡相关基因、生长因子和粘附分子开始转录, 参与肿瘤的发生发展. 研究表明, 在KLF5基因敲除小鼠中, Wnt通路被抑制, 肠上皮内稳态被破坏[6]. 既往研究发现一个新的、与胃癌变相关幽门螺杆菌(Helicobacter pylori, H. pylori)毒力因子-肽酰-脯氨酰顺反式异构酶, 编码蛋白为H. pylori SlyD(HpSlyD)具有促进细胞增殖, 抑制凋亡的能力. 本研究通过HpSlyD诱导GIM的发生, 旨在探究KLF5对GIM发生机制的影响.
正常胃粘膜和肠上皮化生组织的选取: 收集2015-05/2018-01在我院病理科存档的石蜡标本, 包括正常胃黏膜标本20例来自良性胃病患者, 均无癌症相关性疾病病史; 病理诊断证实为肠化生的胃黏膜标本20例, 所有患者均签署知情同意书.
HpSlyD H. pylori重组蛋白(中国医科大学附属肿瘤研究所肿瘤病因与筛查研究室制备); 胰蛋白酶(上海康朗生物科技有限公司); RNA提取试剂盒(哈尔滨新海基因检测有限公司); RIPA(上海吉至生化科技有限公司); 蛋白酶抑制剂(上海伟寰生物科技有限公司); MTT试剂盒(上海恒斐生物科技有限公司); Annexin V-FITC/PI凋亡试剂盒(广州威佳科技有限公司); SDS-PAGE蛋白缓冲液(北京百奥莱博科技有限公司); ECL显影液(上海士锋生物科技有限公司); 相关抗体(英国Abcam公司).
超净工作台(上海辅泽商贸有限公司); 紫外分光光度计(上海科敏生物科技有限公司); 恒温水浴锅(南京贝登医疗股份有限公司); 倒置显微镜(北京佳源兴业科技有限公司); 酶标仪(北京安麦格贸易有限公司); 低速离心机(上海翊圣生物科技有限公司); 电泳槽(广州威佳科技有限公司); 转膜仪(上海艾研生物科技有限公司); 水平摇床(武汉纯度生物科技有限公司); 化学发光成像系统(上海易孛特光电技术有限公司).
将细胞分为空白对照组、HpSlyD组(200 ng/mL的HpSlyD处理)、干扰对照组(200 ng/mL的HpSlyD+阴性序列)、干扰KLF5组(200 ng/mL的HpSlyD +KLF5 siRNA)、Wnt激动剂组(200 ng/mL的HpSlyD +KLF5 siRNA+氯化锂)、Wnt激动剂+干扰KLF5组. GES1细胞常规培养于含10%胎牛血清、青霉素、链霉素各100 μ/mL的RPMI-1640培养液中, 置于37 ℃、5%CO2培养箱中进行培养, 根据细胞生长情况2-3 d更换培养液, 细胞长至50%-60%密度时, 将50 nmol/L浓度KLF5 siRNA和阴性序列转染GES1细胞, 24 h更换培养液, 加入200 ng/mL的HpSlyD处理, 置于37 ℃、5%CO2培养箱中进行培养24 h, 观察细胞感染情况.
1.3.1 RT-PCR法检测相关基因表达: 取出GES1细胞(正常胃黏膜组织、肠化生组织), 加入Trizol试剂提取总RNA, 取5 μL提取的总RNA, 采用分光光度仪测定样品光密度值, 计算RNA纯度和浓度. 按照试剂说明配制反应体系和设定反应时间进行逆转录反应, 按照引物说明书进行参数设置, 冰上进行PCR反应体系的制备, 设阴性对照组. 采用2-△△CT公式分析KLF5、Wnt3a、绒毛蛋白1(Villin 1, VIL1)、三叶因子Ⅱ(trefoil factor 2, TFF2)、尾侧同源盒因子2(caudal homeobox factor 2CDX2)表达量.
1.3.2 MTT法检测各组GES1细胞增殖情况: 取对数生长期的GES1细胞, 接种于24孔板中, 在每个孔中加入浓度为5 mg/mL MTT溶液20 μL和l80 μL的改良性RPMI-1640培养基, 培养4 h后, 丢弃上清液并添加150 μL DMSO, 上清液在恒温震荡箱中摇10 min, 用酶标法测定各组492 m波长处的吸光度值. 细胞增殖抑制率 = (1-实验组OD值/对照组OD值).
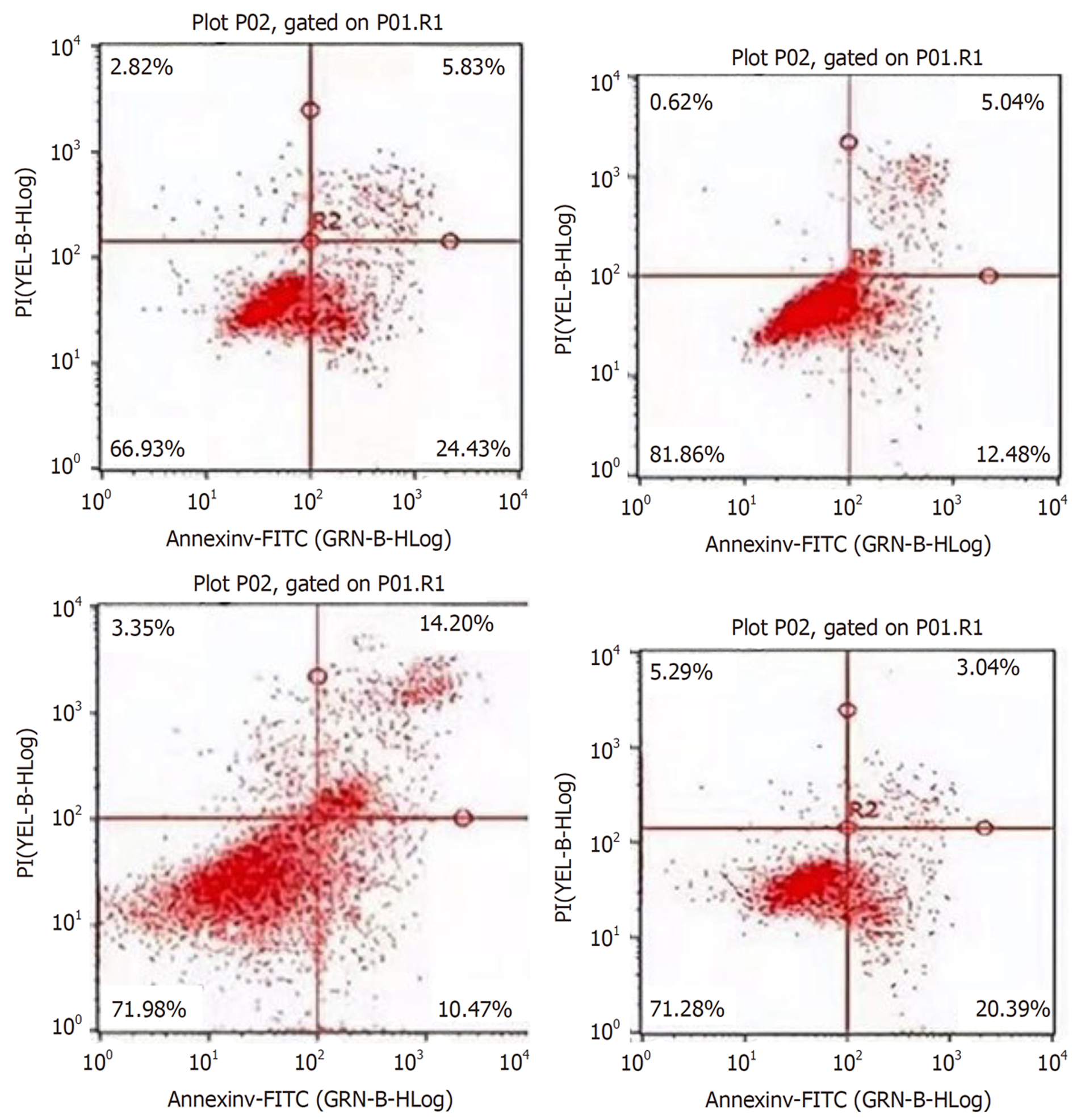
1.3.3 流式细胞仪检测各组细胞凋亡情况: GES1细胞接种于6孔板, 次日转染和换液, 48 h后进行消化细胞并用新鲜培养基重悬, PBS洗涤两次收集细胞1-5×105/mL, 加Binding Buffer 500 μL, 分别加入Annexin V-FITC和PI各50 μL混匀, 60 min内进行流式细胞仪观察和检测.
1.3.4 Western blot法检测蛋白的表达: 收集各组GES1细胞, 按照BCA法测定蛋白浓度, 蛋白液中滴加5×SDS上样缓冲液, 充分离心使蛋白质变性, -80 ℃保存; 制备浓缩胶和分离胶, 采用恒定电压进行电泳, 1 h后电转移至PVDF膜, 常温封闭2 h. 将一抗用TBST稀释至适当浓度加入, 4 ℃孵育过夜, 加入相应的二抗室温孵育2 h, 电化学发光试剂显色、曝光.
统计学处理 本研究数据均采用SPSS 21.0软件包进行分析, 计量数据均采用(mean±SD)表示, 多个样本数据间的比较先进行方差齐性检验, 方差相等时采用t检验或方差分析, P<0.05视为具有统计学意义.
RT-PCR法、Western blot法检测结果显示, KLF5、Wnt3a mRNA和蛋白表达量在肠化生组织中明显高于在正常胃黏膜中的表达, 差异具有统计学意义(P<0.01). 见表1、图1.
| 组织 | 样本数 | KLF5 | Wnt3a | ||
| mRNA | 蛋白 | mRNA | 蛋白 | ||
| 肠化生组织 | 20 | 2.13±0.05 | 2.26±0.05 | 2.23±0.08 | 2.21±0.06 |
| 正常胃黏膜 | 20 | 1.00±0.05 | 1.03±0.09 | 1.01±0.07 | 1.00±0.05 |
| t值 | 50.535 | 37.779 | 36.293 | 48.992 | |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | |
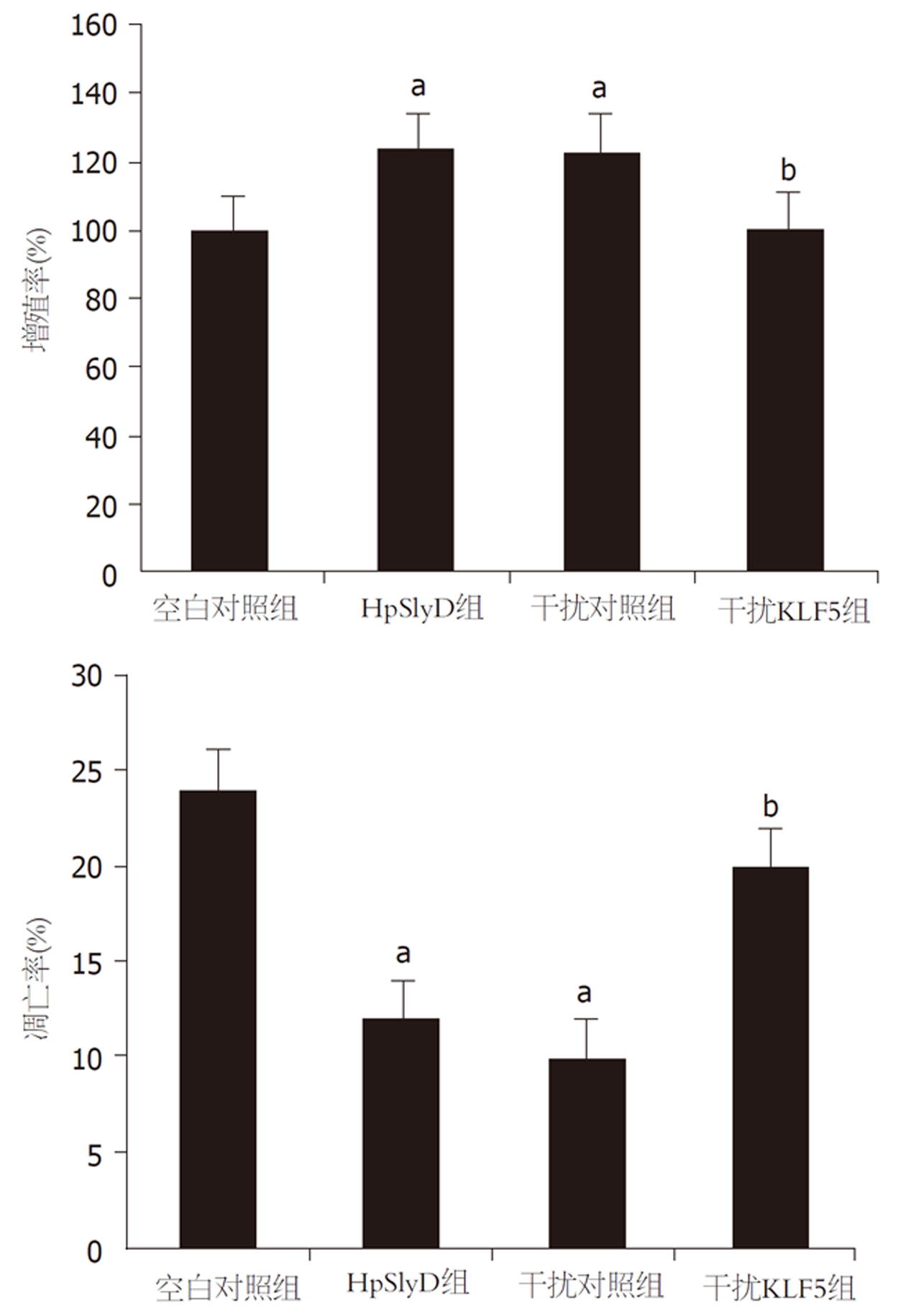
HpSlyD组、干扰对照组细胞增殖率明显高于空白对照组、凋亡率明显低于空白对照组(P<0.05), 干扰KLF5组细胞增殖率明显低于HpSlyD组、凋亡率明显高于HpSlyD组(P<0.05). 见表2、图2、图3.
| 分组 | 样本数 | 增殖率 | 凋亡率 |
| 空白对照组 | 10 | 100.12±5.78 | 24.43±0.61 |
| HpSlyD组 | 10 | 124.36±3.58a | 12.48±0.74a |
| 干扰对照组 | 10 | 123.44±7.69a | 10.47±0.80a |
| 干扰KLF5组 | 10 | 101.02±4.46b | 20.39±0.80b |
HpSlyD组、干扰对照组细胞VIL1、TFF2、CDX2 mRNA和蛋白表达明显高于空白对照组(P<0.05), 干扰KLF5组细胞VIL1、TFF2、CDX2 mRNA和蛋白表达明显低于HpSlyD组(P<0.05). 见表3、图4.
| 分组 | VIL1 | TFF2 | CDX2 | |||
| mRNA | 蛋白 | mRNA | 蛋白 | mRNA | 蛋白 | |
| 空白对照组 | 1.01±0.02 | 1.00±0.04 | 1.00±0.03 | 1.00±0.01 | 1.00±0.06 | 1.00±0.03 |
| HpSlyD组 | 2.41±0.06a | 2.40±0.10a | 2.36±0.04a | 2.57±0.09a | 2.39±0.07a | 2.49±0.08a |
| 干扰对照组 | 2.38±0.09a | 2.38±0.09a | 2.38±0.09a | 2.49±0.10a | 2.41±0.09a | 2.50±0.10a |
| 干扰KLF5组 | 1.05±0.06b | 1.09±0.05b | 1.12±0.07b | 1.08±0.07b | 1.03±0.10b | 1.01±0.04b |
HpSlyD组、干扰对照组细胞Wnt3a、β-catenin、CDX2 mRNA表达明显高于空白对照组(P<0.05), 干扰KLF5组细胞Wnt3a、β-catenin、CDX2 mRNA表达明显低于HpSlyD组(P<0.05). 而Wnt激动剂+干扰KLF5组Wnt3a、β-catenin、CDX2 mRNA表达明显高于干扰KLF5组(P<0.05). 见表4.
| 分组 | 样本数 | Wnt3a | β-catenin | CDX2 |
| 空白对照组 | 10 | 1.00±0.05 | 1.00±0.03 | 1.00±0.06 |
| HpSlyD组 | 10 | 2.31±0.06a | 2.30±0.06a | 2.39±0.07a |
| 干扰对照组 | 10 | 2.27±0.07a | 2.24±0.09a | 2.41±0.09a |
| 干扰KLF5组 | 10 | 1.10±0.05b | 1.11±0.10b | 1.03±0.10b |
| Wnt激动剂组 | 10 | 2.25±0.07 | 2.22±0.09 | 2.26±0.07 |
| Wnt激动剂+干扰KLF5组 | 10 | 2.22±0.08c | 2.21±0.11c | 2.27±0.08c |
我国胃癌发病率高居常见恶性肿瘤第二位, 已成为严重的社会公共卫生问题. 肠化生和异型增生是重要的胃黏膜癌前病变, 往往首先导致胃中央凹的形态学改变, 表现为病灶黏膜的不同程度萎缩、糜烂, 肠化的发生可提高胃癌发生风险10倍以上[7], 因此探讨GIM的病变机制, 继续寻找胃癌可能的早期诊断和可能的治疗靶点是非常重要的.
KLF5属于KLF家族, 人源性KLF5基因位于第13号染色体长臂21区1带, 由4个外显子、3个内含子组成. KLF5基因编码的蛋白是一种核转录激活剂, 细胞质翻译完成后, 其可通过核孔进入细胞核结合靶基因启动子5'端上游的特定序列, 对相关基因的表达起调节作用. KLF5在肿瘤发生和发展过程中涉及到多种病理过程和基因的修饰[8]. 相关资料显示, KLF5参与多种信号通路影响加速通过G1/S期和G2/M期来促进细胞增殖, 然而也有一部分学者认为KLF5在雌激素受体阳性的乳腺癌细胞中起抑制增殖的作用, 因为其可能降低雌激素受体对促增殖基因的激活, 最终消除后者促进细胞增殖的作用[9]. 此外KLF5还可通过影响细胞凋亡实现对细胞生物学行为的调控, 国外有学者通过研究发现, KLF5可通过激活c-Jun氨基末端激酶上游关键性激酶促进食管癌细胞凋亡[10]. 近年来有学者研究发现KLF5协同其他因子可促进胃癌的发生发展[11]. 本研究采用HpSlyD诱导胃黏膜细胞, 观察干扰KLF5表达对GIM发生的作用机制, 结果显示 KLF5、Wnt3a mRNA和蛋白表达量在肠化生组织中明显升高, 提示KLF5可能在GIM发生过程中起着重要作用. 进一步研究发现HpSlyD可促进细胞GES1细胞增殖、并抑制凋亡, 而干扰KLF5表达后可抑制HpSlyD对细胞增殖、凋亡的影响. 有研究发现, KLF5可促进乳腺癌细胞增殖、迁移等恶性生物学行为, 并促进癌症的发展, 与本研究结果一致[12].
VIL1是一种重要的细胞支架蛋白, 可使肌动蛋白成束聚集在微绒毛组成结构上, 在肠化生组织中可以检测到VIL1表达上调, 其在炎性疾病和肿瘤发生过程中发生了质和量的改变[13]. 有研究发现VIL1为CDX2转录调控的靶基因, CDX2可直接促进多种肠细胞特异因子转录表达, 两者在GIM发生过程中发挥着非常关键的作用. TFF主要功能为保护黏膜并促进修复. VIL1、CDX2、TFF为肠上皮化生的标志蛋白[14]. 本研究结果显示, 干扰KLF5表达可抑制HpSlyD对VIL1、TFF2、CDX2 mRNA和蛋白的上调作用. 越来越多的研究表明Wnt信号通路参与肿瘤的发生发展过程, Wnt蛋白为细胞分泌的一类的蛋白质, 过度表达可产生致癌作用[15,16]. 本研究结果显示, Wnt激动剂干预后, 干扰KLF5 表达对Wnt3a、β-catenin、CDX2 mRNA的影响被抑制, 提示KLF5 可能通过Wnt/β-catenin通路促进HpSlyD诱导的肠上皮化生.
综上所述, 干扰KLF5表达可显著抑制HpSlyD诱导的胃黏膜化生的发生, KLF5可能通过激活Wnt/β-Catenin促进HpSlyD诱导的胃黏膜化生, 为胃癌的临床预防提供了新的靶点.
Krüppel样因子5(krüppel-like factor 5, KLF5)基因在多种肿瘤组织中表达水平上调, 发挥促癌基因的作用, 但其在胃癌中作用机制目前尚不十分清楚. 研究表明, 沉默干扰KLF5可以通过调节Wnt/β-catenin通路抑制结肠癌细胞的生长、迁移和侵袭, 但KLF5是否调节Wntβ-catenin通路影响胃黏膜肠化生细胞生物学特性尚不清楚.
本研究拟明确KLF5基因是否通过调节Wntβ-catenin通路促进胃黏膜肠化生细胞增殖、抑制细胞凋亡, 旨在阐明KLF5基因在胃癌及胃黏膜化生的作用机制.
本研究结果显示沉默干扰KLF5基因可抑制GES1细胞增殖, 促进细胞凋亡, 进一步明确了KLF5基因的功能, 为动物实验、临床实验提供了基础.
体外培养胃黏膜上皮细胞GES1, 构建沉默干扰KLF5的GES1细胞, 采用MTT法、流式细胞仪分别检测沉默干扰KLF对细胞增殖、凋亡情况, 采用RT-PCR法检测肠化生和Wnt β-catenin通路相关基因的表达. Western blot法检测肠化生相关蛋白的表达.
KLF5在胃黏膜肠化生组织中表达上调, 沉默干扰KLF5可抑制GES1细胞增殖, 并促进细胞凋亡, 抑制肠化生相关基因和蛋白的表达, Wnt激动剂干预后, 沉默干扰KLF5 表达Wnt β-catenin通路相关基因表达的影响被抑制.
沉默干扰KLF5可抑制Wnt β-catenin通路, 抑制胃黏膜上皮细胞GES1增殖, 并促进细胞凋亡.
本研究仅初步证实KLF5在胃黏膜肠化生的作用可能与调节Wnt β-catenin通路有关, 在未来的研究中, 我们将继续探索KLF5与Wnt β-catenin通路特异性结合的相关分子靶向, 并通过免疫组化等技术进一步提高说服力.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Song KH, Hwang JA, Kim SM, Ko HS, Kang MK, Ryu KH, Koo HS, Lee TH, Huh KC, Choi YW, Kang YW. Acetic acid chromoendoscopy for determining the extent of gastric intestinal metaplasia. Gastrointest Endosc. 2017;85:349-356. [PubMed] [DOI] |
| 2. | Malik TH, Zhao C, Alahmed JM, Alam SA, Hong X. Gastric Intestinal Metaplasia Is the Most Common Histopathological Phenotype among Endoscopically Diagnosed Atrophic Gastritis Patients in North-East China. Open Journal of Gastroenterology. 2017;7:65-74. [DOI] |
| 3. | Chedgy FJQ, Kandiah K, Barr H, De Caestecker J, Dwerryhouse S, Eross B, Gordon C, Green S, Li A, Brown J, Longcroft-Wheaton G, Bhandari P. Development and validation of a training module on the use of acetic acid for the detection of Barrett's neoplasia. Endoscopy. 2017;49:121-129. [PubMed] [DOI] |
| 4. | Ng CK, Cheng Y, Abraham JM, Meltzer SJ. Abstract 3077: Krüppel-like factor 5 and its connection to Sonic Hedgehog signaling in Barrett's esophagus and esophageal adenocarcinoma. Cancer Research. 2018;78:3077-3077. [DOI] |
| 5. | Eichstaedt CA, Song J, Viales RR, Pan Z, Benjamin N, Fischer C, Hoeper MM, Ulrich S, Hinderhofer K, Grünig E. First identification of Krüppel-like factor 2 mutation in heritable pulmonary arterial hypertension. Clin Sci (Lond). 2017;131:689-698. [PubMed] [DOI] |
| 6. | Sun L, Liu T, Zhang S, Guo K, Liu Y. Oct4 induces EMT through LEF1/β-catenin dependent WNT signaling pathway in hepatocellular carcinoma. Oncol Lett. 2017;13:2599-2606. [PubMed] [DOI] |
| 7. | Uedo N, Yamaoka R, Yao K. Multiple white flat lesions in the gastric corpus are not intestinal metaplasia. Endoscopy. 2017;49:615-616. [PubMed] [DOI] |
| 8. | Ng CK, Ma K, Cheng Y, Miyashita T, Harmon JW, Meltzer SJ. Krüppel-like Factor 5 Promotes Sonic Hedgehog Signaling and Neoplasia in Barrett's Esophagus and Esophageal Adenocarcinoma. Transl Oncol. 2019;12:1432-1441. [PubMed] [DOI] |
| 9. | Sun X, Huang H, Pan X, Li S, Xie Z, Ma Y, Hu B, Wang J, Chen Z, Shi P. EGR1 promotes the cartilage degeneration and hypertrophy by activating the Krüppel-like factor 5 and β-catenin signaling. Biochim Biophys Acta Mol Basis Dis. 2019;1865:2490-2503. [PubMed] [DOI] |
| 10. | Kyung KC, Kasmika M, Bialkowska AB, Yang VW. 596-KRüPPEL-Like Factor 5 is Critical for Intestinal Stem Cell Functions During Self-Renewal and Tissue Regeneration Post-Irradiation Injury. Gastroenterology. 2018;154:S126-S127. [DOI] |
| 11. | Hirata Y, Toyono T, Kokabu S, Obikane Y, Kataoka S, Nakatomi M, Masaki C, Hosokawa R, Seta Y. Krüppel-like factor 5 (Klf5) regulates expression of mouse T1R1 amino acid receptor gene (Tas1r1) in C2C12 myoblast cells. Biomed Res. 2019;40:67-78. [PubMed] [DOI] |
| 12. | Liu R, Chen H, Zhao P, Chen CH, Liang H, Yang C, Zhou Z, Zhi X, Liu S, Chen C. Mifepristone Derivative FZU-00,003 Suppresses Triple-negative Breast Cancer Cell Growth partially via miR-153-KLF5 axis. Int J Biol Sci. 2020;16:611-619. [PubMed] [DOI] |
| 13. | Sung GH, Chang H, Lee JY, Song SY, Kim HS. Pancreatic-cancer-cell-derived trefoil factor 2 impairs maturation and migration of human monocyte-derived dendritic cells in vitro. Anim Cells Syst (Seoul). 2018;22:368-381. [PubMed] [DOI] |
| 14. | Nolte S, Zlobec I, Lugli A, Hohenberger W, Croner R, Merkel S, Hartmann A, Geppert CI, Rau TT. Construction and analysis of tissue microarrays in the era of digital pathology: a pilot study targeting CDX1 and CDX2 in a colon cancer cohort of 612 patients. J Pathol Clin Res. 2017;3:58-70. [PubMed] [DOI] |
| 15. | Carmon KS, Lin Q, Gong X, Thomas A, Liu Q. Correction for Carmon et al., "LGR5 Interacts and Cointernalizes with Wnt Receptors To Modulate Wnt/β-Catenin Signaling". Mol Cell Biol. 2017;37. [PubMed] [DOI] |
| 16. | Kim W, Khan SK, Gvozdenovic-Jeremic J, Kim Y, Dahlman J, Kim H, Park O, Ishitani T, Jho EH, Gao B, Yang Y. Hippo signaling interactions with Wnt/β-catenin and Notch signaling repress liver tumorigenesis. J Clin Invest. 2017;127:137-152. [PubMed] [DOI] |