Copyright
©The Author(s) 2021. Published by Baishideng Publishing Group Inc. All rights reserved.
肠道M细胞的功能与疾病的研究进展
李秋璇, 郭玥盺, 华嵘暄, 尚宏伟, 李利生, 徐敬东
李秋璇, 郭玥盺, 华嵘暄, 首都医科大学临床医学"5+3一体化"专业 北京市 100069
李秋璇, 首都医科大学2017级临床医学"5+3一体化"专业, 研究方向为消化生理学与临床医学.
尚宏伟, 首都医科大学基础医学院形态学实验中心 北京市 100069
李利生, 首都医科大学基础医学院机能实验中心 北京市 100069
徐敬东, 北京市首都医科大学生理学与病理生理学系 北京市 100069
基金项目: 国家自然科学基金资助项目, No. 81274173和No.81673671; 国家重点研发计划"重大慢性非传染性疾病防控研究"重点专项课题, No. 2016YFC1306305.
作者贡献分布: 本综述由李秋璇和徐敬东完成; 图片由李秋璇、郭玥盺和华嵘萱绘制; 尚宏伟和李利生负责部分文献搜集与整理; 徐敬东审校.
收稿日期: 2020-11-25
修回日期: 2020-12-24
接受日期: 2021-01-18
在线出版日期: 2021-02-28
M细胞(microfold cell, M cell)来源于肠隐窝Lgr5+干细胞, 成熟的M细胞基底膜向上突起, 呈"囊袋状". M细胞分布广泛, 在肠道相关淋巴组织(gut associated lymphoid tissue, GALT)、鼻咽相关淋巴组织(nasopharyngeal lymphoid tissue, NALT)和支气管相关淋巴组织(bronchial-associated lymphoid tissue, BALT)均有分布. M细胞分化主要通过两条途径调控, 非经典核因子κB(nuclear factor kappa-B, NF-κB)通路和经典NF-κB通路. 其中, NF-κB受体活化因子配体(receptor activator of NF-κB ligand, RANKL)和S100A4蛋白至关重要. M细胞在免疫系统中是一把双刃剑, 既能摄取转运抗原, 引发免疫应答; 又是各种病原体侵袭机体的门户. 结核病、朊蛋白病和克罗恩病的发生发展都与M细胞息息相关.
关键词: M细胞; 信号通路; 肠道免疫; 分化; 克罗恩病; 肺结核
核心提要: M细胞来源于肠隐窝Lgr5+干细胞, 成熟的M细胞基底膜向上突起, 呈"囊袋状", 该结构提高了M细胞摄取转运抗原的效率. M细胞可引发免疫应答, 却又是病原体侵袭人体的靶点, 其分化过程中RANKL和S100A4蛋白至关重要.
引文著录: 李秋璇, 郭玥盺, 华嵘暄, 尚宏伟, 李利生, 徐敬东. 肠道M细胞的功能与疾病的研究进展. 世界华人消化杂志 2021; 29(4): 197-203
New insight into function and dysfunction of gut microfold cells
Qiu-Xuan Li, Yue-Xin Guo, Rong-Xuan Hua, Hong-Wei Shang, Li-Sheng Li, Jing-Dong Xu
Qiu-Xuan Li, Yue-Xin Guo, Rong-Xuan Hua, Clinical Medicine of "5+3" Program, Capital Medical University, Beijing 100069, China
Hong-Wei Shang, Morphological Experiment Center, School of Basic Medical Sciences, Capital Medical University, Beijing 100069, China
Li-Sheng Li, Functional Experiment Center, School of Basic Medical Sciences, Capital Medical University, Beijing 100069, China
Jing-Dong Xu, Department of Physiology and Pathophysiology, School of Basic Medical Sciences, Capital Medical University, Beijing 100069, China
Supported by: National Natural Science Foundation of China, No. 81673671 and No.81274173; National Key Research and Development Plan "Major Chronic Non-communicable Disease Prevention and Control Research" Key Special Project, No. 2016YFC1306305.
Corresponding author: Jing-Dong Xu, Associate Professor, Department of Physiology and Pathphysiology, School of Basic Medical Sciences, Capital Medical University, No. 10 Youanmenwai West Toutiao, Fengtai District, Beijing 100069, China. xujingdong@ccmu.edu.cn
Received: November 25, 2020
Revised: December 24, 2020
Accepted: January 18, 2021
Published online: February 28, 2021
0 引言
随着肠道与机体其他脏器之间的健康与疾病之间的相关性日益受到关注, 许多疾病的起源于肠道的猜想引起广大医务工作者的高度重视. 然而, 目前仍有一些问题无法解决. M细胞作为肠道上皮屏障重要的组成, 其生物学特性以及与机体的健康关系近年来成为研究的热点.
1922年日本科学家Kenzaburo Kumagai首次发现并报道了滤泡关联上皮(follicle-associated epithelium, FAE)部位的抗原内化; 由于研究技术的羁绊, 在经历了漫长的过程后, 于1972年由美国科学家Robert Owen借助扫描电镜在人类派氏结(Peyer's patches, PPs)发现了一种形态上不同于周围上皮细胞的特殊细胞. 这种细胞表面没有丰富的微绒毛, 而是有许多"微褶皱", 基底膜内陷呈"囊袋状". 因此, 将它命名为微褶皱细胞(microfold cell, M cell)[1]. 大量的研究表明M细胞来源于肠隐窝Lgr5+干细胞, 其分化和成熟是多途径分子机制的调控, 其中核因子κB受体活化因子配体(receptor activator of NF-κB ligand, RANKL)和S100A4蛋白尤为重要. RANKL缺乏会导致M细胞分化障碍, 导致幼稚M细胞增加; 而S100A4缺乏会导致成熟M细胞的缺乏[2]. 由于M细胞在肠道免疫调节中发挥重要作用, 它既能转运抗原, 又是病原体进入机体的入口. 而成熟M细胞缺乏, 导致肠道抗原转运受阻, 从而无法启动肠道免疫应答. 最新研究表明M细胞与多种疾病有密切关系. 本综述从生物学角度和免疫学角度阐述M细胞的作用, 并就其与疾病的相关性进行阐述.
1 M细胞的生物学特性
肠相关淋巴组织(gut associated lymphoid tissue, GALT)分为两部分, 有结构的组织粘膜滤泡和弥漫淋巴组织[3]. 粘膜滤泡是免疫诱导区, 是免疫应答的淋巴传入区; 弥漫淋巴组织是免疫应答的淋巴传出区[4]. 免疫诱导区包括PPs、肠系膜淋巴结(msenteric Lymph Node, MLN)、孤立淋巴滤泡等肠道淋巴组织. PPs由FAE、上皮下圆顶(sub-epithelium dome, SED)和B细胞滤泡(B cells follicle)组成[5]. M细胞主要存在于FAE, 同时M细胞在支气管相关淋巴组织(bronchial-associated lymphoid tissue, BALT)和鼻咽相关淋巴组织(nasopharyngeal lymphoid tissue, NALT)分布.
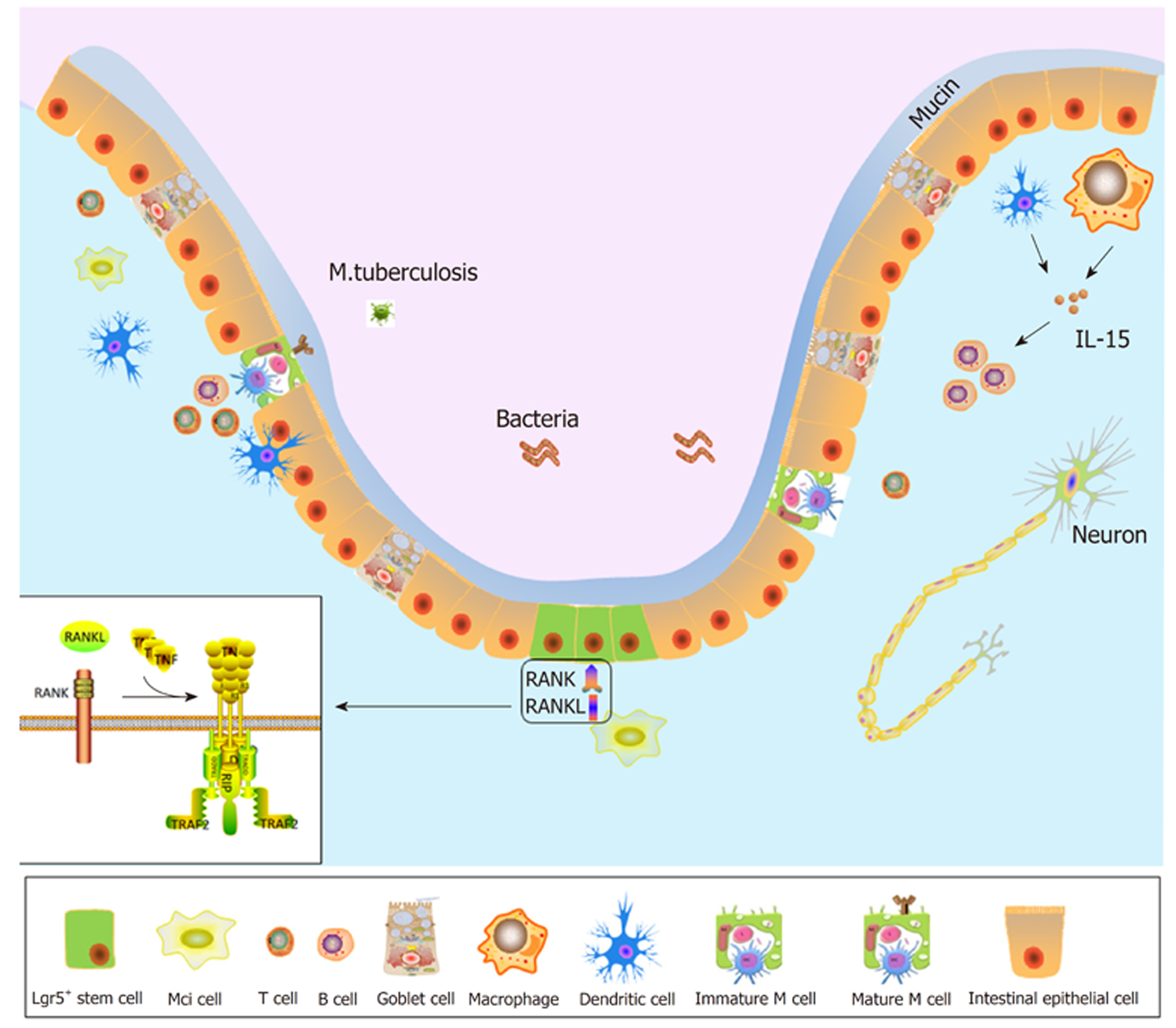
M细胞基底膜内陷, 形成"M细胞囊袋(M cell pocket)", 凹陷处包含着树突状细胞(dendritic cells, DCs)、淋巴细胞等免疫相关细胞[6](图1). "M细胞囊袋"是M细胞分化成熟的标志. "囊袋"结构减少了M细胞摄取抗原、转运抗原的距离, 提高了转运和吞吐抗原作用的效率. 腔内抗原可以被快速转运至M细胞基底膜, 并递送至DCs, 触发肠道免疫反应[7]. 相较于其他肠上皮细胞, M细胞溶酶体活性较低, 所以肠腔抗原信息可以完整的转运至DCs. DCs通过三种途径进行免疫应答, DCs将抗原继续呈递至T细胞、B细胞; 负载抗原的DCs通过淋巴引流, 直接进入MLN; DCs借助M细胞在腔内直接捕获抗原[8,9], 这种方式更加快捷, 在肠道的速发型的免疫调节中具有重要作用. 由于M细胞表面存在高度糖基化、可以被凝集素靶向识别的区域[10], 荆豆凝集素-1(ulex europaeus agglutinin 1, UEA-1)可以和M细胞顶端表面的α胞顶端岩藻糖残基特异性结合; 唾液酸结合免疫球蛋白样凝集素(Siglec)中的Siglec-F可以特异性靶向与M细胞结合[11]. M细胞表面表达病原体识别受体(pathogen recognition receptors, PRR), 肠道病原体可以和PRR结合, 以达到靶向M细胞的作用. M细胞表面还表达糖蛋白2(glycoprotein 2, GP2), GP2可和细菌外膜Ⅰ型菌毛尾端的黏附素FimH特异性结合[12]. FAE中的M细胞可以根据GP2的表达特点分为两种亚型, 一种是高表达GP2的M细胞, 另一种是低表达或不表达GP2的M细胞[13]. 高表达GP2的M细胞可摄取肠腔抗原, 低表达或不表达GP2的M细胞几乎不摄取肠腔内抗原. 通过免疫组化技术证实Spi-B和Sox8分子表达之后在细胞膜上出现GP2+蛋白. 在GP2-/-或GP2low/-小鼠发现, M细胞的正常形态或功能受损. 由此可见GP2+的M细胞是成熟的、功能性的M细胞的标志[6]. 重组人同种异体移植炎症因子1(allograft inflammatory fator 1, Aif1)表达于被排斥的移植心脏上, FAE的M细胞也表达Aif1[14]. 与野生型小鼠相比, Aif1-/-小鼠FAE区域M细胞摄取转运抗原能力下降, 但幼稚M细胞的分化不受影响. β1整合素(integrin beta-1, ITGB1)在M细胞膜上表达, 也是小肠结肠炎耶尔森菌(Y.enterocolitica)的受体[15], 然而Aif1-/-小鼠中ITGB1明显减少, 提示ITGB1表达与Aif1相关[14]. 同时, 研究证实ITGB1还有促进细胞粘附, 连通细胞内外环境的作用, 是内外环境沟通的"桥梁"[14]. 由此可见, ITGB1是M细胞发挥抗原呈递功能的生物学标志. 综上所述, UEA-1、Siglec-F、GP2、ITGB1均是M细胞的生物学标志. 由于M细胞表面有多种生物学标志, 由此可见M细胞具有复杂的生物学功能.
图1 肠道环境中M细胞示意图.
M细胞来源于肠隐窝Lgr5+干细胞, 基底膜内陷, 呈"囊袋状". GP2是M细胞成熟的标志蛋白分子. 树突状细胞和巨噬细胞分泌IL-15, IL-15可促进B细胞增殖分化. 肠腔内有细菌存在, 可通过M细胞进入人体. 左下角是RANK和RANKL结合的分子模式图. GP2: 糖蛋白2; IL-15: 白细胞介素-15; RANK: 核因子κB受体活化因子; RANKL: 核因子κB受体活化因子配体.
2 M细胞分化的分子机制
M细胞源于肠隐窝Lgr5+干细胞[16], RANKL在GALT的SED大量存在, 是由M细胞诱导(M-cell inducer, Mci)细胞分泌的细胞因子[17], Mci细胞是高度表达膜结合型RANKL的上皮下间质细胞. RANKL是Ⅱ型膜结合蛋白, 是肿瘤坏死因子(tumor necrosis factor, TNF)家族中的一员, 可以和NF-κB受体活化因子(receptor activator of NF-κB, RANK)相结合[18]. RANKL可以被金属蛋白酶裂解[19], 其分布广泛, 在骨骼肌、胸腺、肝脏、结肠、小肠、肾上腺等组织均表达[20]. M细胞分化主要通过两条途径调控, 非经典NF-κB通路和经典NF-κB通路.
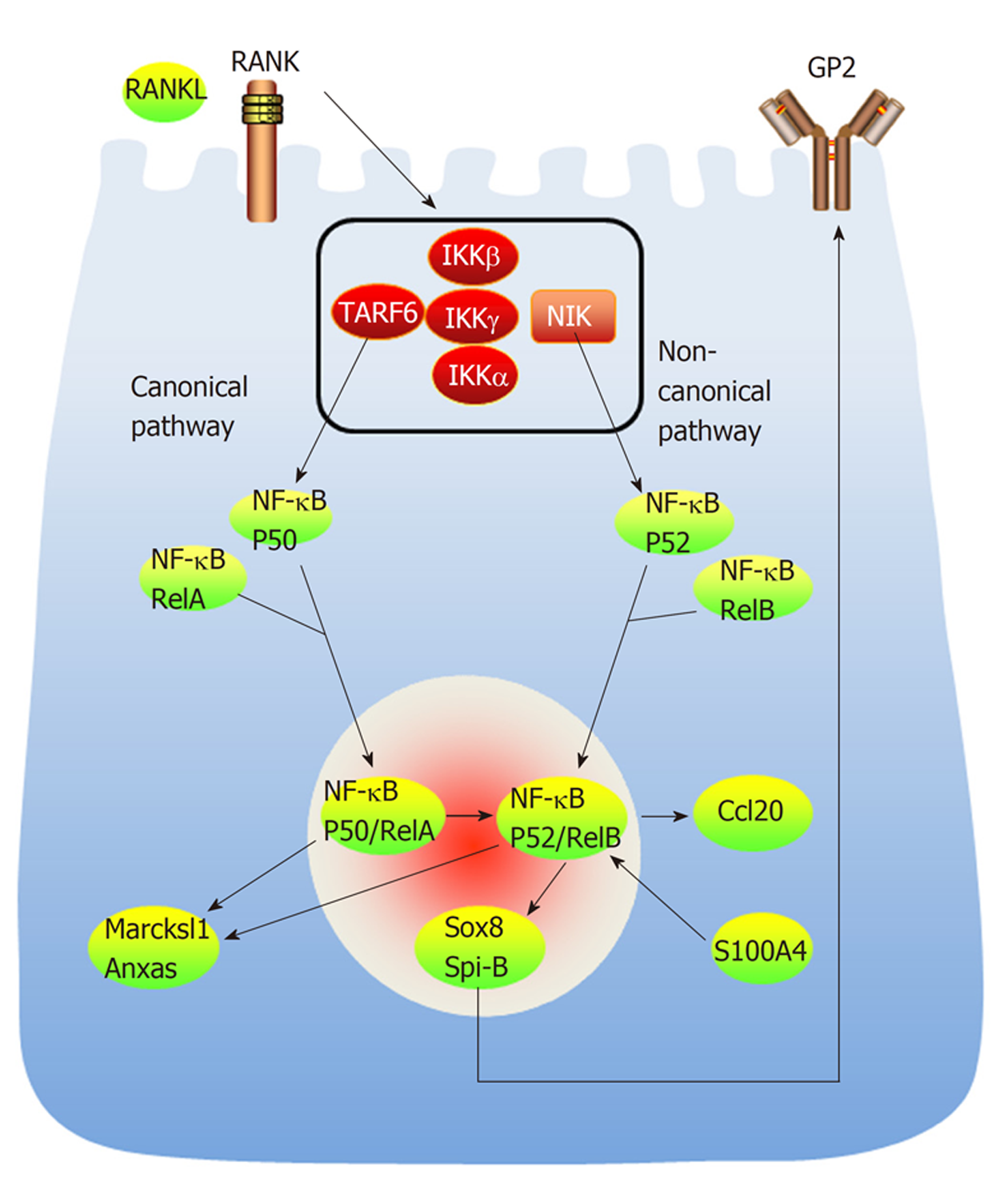
非经典NF-κB通路是由RANKL和RANK结合启动[21]. RANKL和RANK结合后激活NF-κB诱导激酶(NF-κB-inducing kinase, NIK), 促进p52/RelB蛋白的表达. 实验发现, 选择性敲除Mci细胞上的膜结合型RANKL后, FAE区域幼稚M细胞无法发育成熟; Nik-/-小鼠缺乏成熟的M细胞. 以上研究证明, 非经典NF-κB通路是M细胞成熟的必须途径. 同时, 肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6, TRAF6)是经典NF-κB通路所必须的[22]. 在类器官培养系统中, 用RANKL处理肠道类器官时, GP2表达上调. TRAF6-/-小鼠PPs中M细胞的完全丧失, 肠道抗原摄取转运障碍[22]. P50/RelA蛋白的表达可以促进P52/RelB蛋白表达, P50/RelA蛋白和P52/RelB蛋白均可促进Marcksl1 mRNA和Anxas蛋白的表达[22]. 以上研究结果提示, 经典NF-κB通路对M细胞分化发育不可或缺, 并且通过多条途径间接影响非经典NF-κB通路. 实验表明, 转录因子Spi-B缺乏时, Ccl9、Tnfaip2和Gp2无法正常表达, 但Marksl1和Anxa5仍可正常表达[23], 转录因子Spi-B或Sox8二者缺其一时, GP2+ M细胞未能检测到; 当二者同时缺乏时, GP2+ M细胞缺乏; 只有Spi-B和Sox8同时正常表达, GP2+ M细胞才能正常表达. 由此可见, Spi-B和Sox8对GP2+ M细胞的分化与成熟不可或缺(如图2所示).
图2 M细胞分化的信号转导通路分子机制图.
RANKL是M细胞分化的重要信号分子, 非经典通路和经典通路均与之相关. S100A4蛋白是调控M细胞成熟的重要环境因子, 可通过S100A4-RelB-SOX8通路, 和RANKL共同调控M细胞的成熟. RANKL: 核因子κB受体活化因子配体.
研究表明富含溶菌酶的树突状细胞、先天淋巴细胞可以合成S100A4蛋白. S100A4蛋白是由人类S100A4基因编码的蛋白质, 存在于细胞质和细胞核中, 参与细胞发育和分化的调控, 在细胞运动、侵袭和微管蛋白聚合中发挥作用[24]. DOCK8基因定位于人类9号染色体p24.3, 其编码的DOCK8蛋白可激活Rho-GTP酶, 调节细胞功能, 尤其是肌动蛋白细胞骨架调控、影响细胞迁移活动. 研究发现, 当缺乏DOCK8时, S100A4+细胞数量减少, S100A4减少会导致M细胞成熟障碍. 肠道类器官系统培养中肠隐窝Lgr5+干细胞可以被诱导分化成M细胞, 使用S100A4后幼稚M细胞减少, 而成熟M细胞增加; DOCK-/-小鼠S100A4含量显著下降, 幼稚M细胞无法分化成熟, 导致摄取转运肠腔内抗原能力下降[2]. 推测S100A4是调控M细胞成熟的重要的因子, 通过S100A4-RelB-SOX8通路调控M细胞的成熟[2](如图2所示).
3 M细胞与免疫应答
M细胞的抗原摄取作用对特异性免疫应答至关重要. 研究表明[25], RANK-/-小鼠缺乏成熟M细胞, 导致抗原摄取障碍和PPs中杯状细胞(goblet cell, GC)减少, 肠道固有层的免疫球蛋白A(immunoglobulin A, IgA)阳性B细胞减少, 肠道中s-IgA含量下降[25]. 与RANK-/-小鼠相似, SOX8-/-小鼠IgA含量也减少, 但IgA含量较RANK-/-小鼠减少程度更轻. 在葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导小鼠溃疡性结肠炎(ulcerative colitis, UC)模型和败血症小鼠模型中, NIK-/-小鼠缺乏成熟M细胞, IgA和白细胞介素17(interleukin17, IL-17)含量下降, IgA和IL-17含量下降会增加小鼠对UC和败血症的易感性[21], 提示M细胞和IgA、IL-17的分泌有关, M细胞相关的IgA、IL-17可以预防小鼠UC和败血症的发生. 除此之外, M细胞的抗原摄取作用还有助于诱导全身性抗原特异性IgG反应. 因此, M细胞不仅在肠道免疫应答中发挥作用, 在全身免疫反应中也至关重要.
4 M细胞与疾病
M细胞不仅可以启动肠道免疫应答, 还是病原体入侵机体的门户. M细胞与许多疾病的发生都密切相关, 这与它特殊的"囊袋状"结构有关. 该结构提高了M细胞摄取、转运抗原的效率, 同时也给病原体提供了侵袭人体的入口. 结核病、朊蛋白病和克罗恩病(Crohn's disease, CD)的发生都与M细胞密切相关. 结核分枝杆菌(M.tuberculosis, Mtb)和朊病毒将M细胞作为入侵机体的靶点, CD患者免疫系统紊乱的加剧与M细胞有关.
4.1 M细胞与结核病
过去一直认为结核病开始于Mtb侵入肺泡巨噬细胞和树突状细胞, 但是这种观点缺乏数据支持. 目前研究证实在活动性结核病病例中, 大约10%只有颈部淋巴窦(cervical lymph nodes, cLN)感染, 无肺部感染, 这表明活动性结核病可能不需要肺部感染, 因此肺部感染可能不是必须的[26]. 这个疑惑困扰着许多临床医务工作者.
众所周知, Spi-B−/−小鼠GALT和NALT的成熟M细胞数量减少. 给Spi-B−/−小鼠和WT小鼠分别接种相同剂量Mtb, 7 d后发现, 相较于野生型小鼠, Spi-B−/−小鼠cLN中的Mtb更少; WT小鼠和Spi-B−/−小鼠肺部都未检测到Mtb[26]. 由此可见, 成熟M细胞减少会抑制Mtb的转运和扩散. 为了探究WT小鼠M细胞受抑制后, Mtb的转运扩散是否会受到抑制, 使用WT小鼠注射抗小鼠RANKL单克隆抗体IK22-5, 并且接种同等剂量的Mtb, 发现cLN中Mtb数量只有开始接种的一半. 由此推测, 通过IK22-5抑制M细胞成熟可抑制Mtb从NALT向cLN扩散. 因此, 可以推断出M细胞是Mtb入侵机体的门户, 这对于疫苗的研究也有着重大的意义, 成为目前疫苗研究开发的热点, 受到科研工作者的关注[26].
4.2 M细胞与朊蛋白病
朊蛋白病是一种人类和多种动物均可患的传染性退行性脑病, 感染因子是朊病毒. 宿主细胞正常朊蛋白(PrPC)的一级结构和朊蛋白(PrPSc)一级结构相同, PrPC错误折叠后转变为PrPSc, 而且PrPSc会促使PrPC转变成PrPSc[27]. 朊病毒病包括库鲁病(Kuru disease)、克雅氏综合症(Ceutzfeldt-jakob disease , CJD)、格斯特曼综合症(Gustman syndrome, GSS)及致死性家庭性失眠症(fatal family insomnia, FFI). 有研究表明M细胞是朊病毒从肠腔侵入PPs和各个器官的重要目标靶点. 使用抗小鼠RANKL单克隆抗体处理IK22-5小鼠后, 幼稚M细胞无法发育成熟[28]. 实验动物口腔暴露朊病毒一段时间后, 对照组PPs、MLNs和脾脏中检测到大量PrPSc; 而M细胞缺如的实验组PPs、MLNs和脾脏中未检测到PrPSc. 341 d后, 对照组小鼠死于朊蛋白病; 454 d之前, 实验组小鼠均未出现朊病毒感染相关症状[28]. 上述实验表明, M细胞的消除可阻止朊病毒的入侵和播散, 阻止朊病毒对脑的损害. 因此, 肠道M细胞与朊病毒病原体的运输和侵入人体有关[29]. 目前普遍认为M细胞是朊病毒入侵机体的靶点, 但也成为研究和预防朊蛋白病的重要靶点.
4.3 M细胞与克罗恩病
CD是炎症性肠病(inflammatory bowel disease, IBD)的一种. CD患者的固有免疫系统和适应性免疫系统紊乱, 有研究表明[30], 40%病人体内出现胰腺自身抗体, 而自身抗体的抗原恰恰是胰腺腺泡中的GP2. 胰腺可以合成并分泌GP2, 因此胰腺腺泡细胞中存在大量GP2, GP2还会随着胰液进入肠腔[31]. 肠道免疫系统功能紊乱可能会促进GP2抗体的产生[32]. 炎症性肠病产生炎症性细胞因子, 炎症性细胞因子与M细胞的发育和功能密切相关. 炎症性细胞因子TNFα会诱发产生PP型M细胞[33]. 有研究证实CD患者结肠中M细胞数量明显增加[34], 该变化提示随着M细胞数量增加, 其抗原呈递能力升高可能会加强免疫系统对GP2自身抗体的应答. 同时对患者结肠活组织进行单细胞转录分析, 发现M细胞中Spi-B和Sox8的表达上调[35]. 全基因组关联研究(GWAS)显示, M细胞中IBD高度易感基因ccl20, nr5a2, jak2, ptger4, sh2b3, ahr表达上调[35]; 而缺乏M细胞时, 小鼠出现严重的感染性结肠炎, 肠道细菌出现多样性的变化以及移位. 由此可见, M细胞也是形成肠道屏障重要的调节者之一, 在肠道稳态的维持中不可或缺[36]. M细胞的数量变化可作为IBD的临床诊断指标[37].
5 结论
综上所述, "囊袋状"的M细胞其结构的特殊性决定功能的复杂性与多样性. 其摄取转运肠腔抗原至抗原呈递细胞, 参与肠道和机体的免疫反应. 同时, M细胞的分化受多种因子调控, 其中RANKL最为重要. 成熟的M细胞表面有多种生物学标志, 其中GP2是M细胞成熟的标志. M细胞是多种病原体入侵机体的入口, 因此M细胞是感染性疾病研究的重要靶点之一. M细胞不仅仅和肠道疾病相关, 还和神经退行性脑病联系密切, 这提示M细胞对于机体健康不可忽视. 当然, M细胞在疾病中更多细节性问题还有待进一步发现、研究和探讨.