修回日期: 2020-12-28
接受日期: 2021-01-18
在线出版日期: 2021-02-28
已有研究表明肝癌的发生发展与多种信号通路有关. 其中, Wnt配体/β-连环蛋白(Wnt/β-catenin)信号通路参与肝脏疾病进展的所有阶段, 从最初的肝损伤到炎症、纤维化、肝硬化以及肿瘤的发生及进展均有所参与. 异常的Wnt/β-catenin信号会促进包括癌症在内的不同肝脏疾病的发生和进展. 在这篇综述中, 我们将在介绍Wnt/β-catenin信号通路的激活、生物学功能及调控机制的基础上, 讨论Wnt/β-catenin信号通路在肝癌的发生和进展的中的作用, 并将对目前小分子抑制剂、中药提取物及微小RNAs(microRNAs, miRNAs)等能够抑制Wnt/β-catenin信号通路的相关因子进行阐述, 为肝癌的基础与临床研究提供参考.
核心提要: 本综述重点介绍了近五年来, Wnt配体/β-连环蛋白(Wnt/β-catenin)信号通路在肝癌的发生和进展的中的作用, 并将对目前小分子抑制剂、中药提取物及微小RNAs(microRNAs, miRNAs)等能够抑制Wnt/β-catenin信号通路的相关因子进行阐述, 为肝癌的基础与临床研究提供参考.
引文著录: 倪彩菊, 覃小珊, 黄赞松. Wnt/β-catenin信号通路与肝癌发生发展的研究进展. 世界华人消化杂志 2021; 29(4): 190-196
Revised: December 28, 2020
Accepted: January 18, 2021
Published online: February 28, 2021
Studies have shown that the occurrence and development of liver cancer are related to a variety of signaling pathways. The Wnt/β-catenin signaling pathway is involved in all stages of liver disease progression, from initial liver damage to inflammation, fibrosis, and cirrhosis, as well as the occurrence and progression of tumors. Abnormal Wnt/β-catenin signaling promotes the development and progression of different liver diseases, including cancer. This review introduces the activation, biological function, and regulatory mechanism of the Wnt/β-catenin signaling pathway, discusses the role of ngthis pathway in the occurrence and progression of liver cancer, and describes factors that can inhibit the Wnt/β-catenin signaling pathway, such as small molecule inhibitors, traditional Chinese medicine extracts, and microRNAs, with an aim to provide reference for the basic and clinical research of liver cancer.
- Citation: Ni CJ, Qin XS, Huang ZS. Role of Wnt/β-catenin signaling pathway in occurrence and development of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2021; 29(4): 190-196
- URL: https://www.wjgnet.com/1009-3079/full/v29/i4/190.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i4.190
肝癌是全球范围内常见的致命恶性肿瘤, 国家癌症中心的流行病学数据显示, 2015年中国居民肝癌死亡率为23.72/10万, 仅次于肺癌的45.87/10万的死亡率[1]. 肝癌的发生和进展与多种信号通路有关, 例如, Wnt配体/β-连环蛋白(Wnt/β-catenin)信号通路[2]、酪氨酸激酶/信号转导子和转录激活子(janus kinase/signal transducere and activetor of transcription, JAK/STAT)JAK/STAT信号通路[3]、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路[4]、转化生长因子-β(transforming growth factor-β, TGF-β)信号通路[5]、核因子-κB(nuclear factor-κB, NF-κB)信号通路[6]等. 其中, Wnt/β-catenin信号通路参与肝脏疾病进展的所有阶段, 从最初的肝损伤到炎症、纤维化、肝硬化以及肿瘤的发生及进展均有所参与, 重要的是, 已经有多项研究报道了调控该信号通路实现肝癌抑制的潜在价值[7,8]. 开发以Wnt/β-catenin信号通路的组成成分为靶点的新型药物和干预手段, 是提高肝癌治疗效果的新的研究方向. 本文将对Wnt/β-catenin信号通路在肝癌发展过程中的最新研究进行综述.
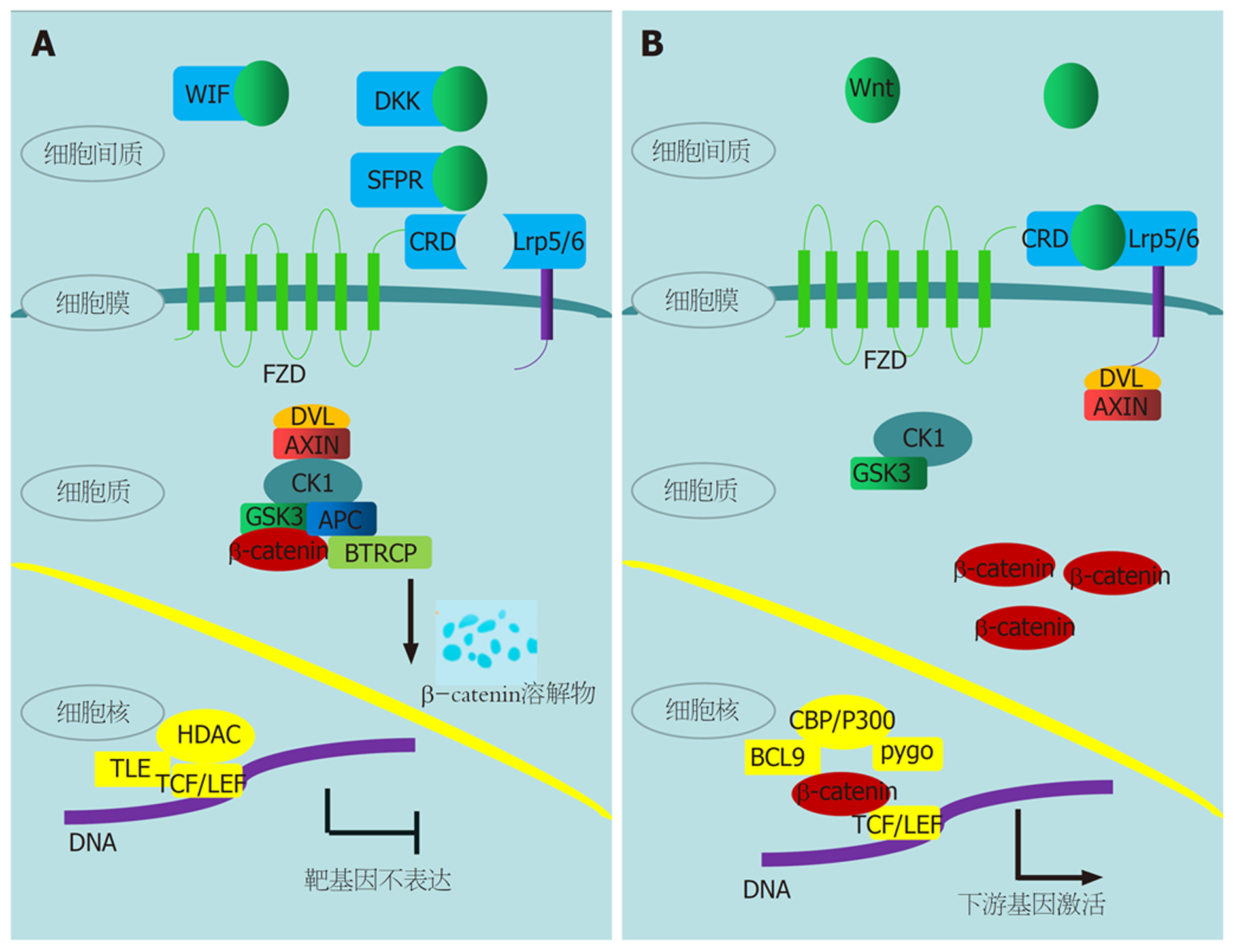
Wnt/β-catenin信号通路是Wnt通路的经典通路, 另外两条Wnt通路为平面细胞极化信号通路以及Wnt/Ca2+信号通路. 哺乳动物中有19种Wnt蛋白亚型. Wnt蛋白在体内并非一直存在, 其自身存在一个产生→修饰→分泌→转运的过程, 当机体微环境中不存在Wnt蛋白时, Wnt/β-catenin信号通路处于闭合状态(Wnt off); 当机体微环境中存在Wnt蛋白时, Wnt/β-catenin信号通路处于激活状态(Wnt on), Wnt状态不同时, β-catenin的存在形式亦不相同.
当不存在Wnt时, β-catenin作为Wnt的分子效应器处于沉默状态, 此时的β-catenin与轴蛋白(Axin蛋白)和腺瘤性结肠息肉病(adenomatous polyposis coli, APC)蛋白形成Axin/APC/β-catenin多蛋白复合物(破坏复合物), 糖原合成酶激酶-3β(glucogen Synthase Kinase 3β, GSK3β)和酪蛋白激酶1α(casein kinase 1α, CK1α)负责复合物的磷酸化, β-catenin的N-端结构域的Ser45、Ser33、Ser37和Thr41处于磷酸化状态[9]. 磷酸化的复合物进一步被E3泛素蛋白连接酶(E3 ubiquitin protein ligase)泛素化, 随后被蛋白水解酶水解.
当存在Wnt时, β-catenin发挥中枢效应因子作用. Wnt与卷曲蛋白(frizzled protein, FZD)蛋白及低密度脂蛋白受体相关蛋白5/6(LDL receptor-associated protein 5/6, LRP5/6)蛋白结合, FZD/Wnt/LRP5/6受体复合物, 受体复合物招募细胞质中的散乱蛋白(dishevelled, DVL), 并与FZD的C端末端结合, 形成"受体-DVL"复合物, 这种复合物与Axin支架蛋白相互作用, β-catenin的磷酸化及降解过程被终止, Axin/APC/β-catenin多蛋白复合物解体, 促进了β-catenin的稳定性, 稳定的β-catenin能够在细胞质中积累并转运到细胞核, 最终在细胞核中调控靶基因的表达[10].
在肝脏中, Wnt/β-catenin信号对许多重要功能至关重要, 该信号通路的异常导致多种肝癌的发生和进展, 包括肝脏恶性肿瘤, 如肝母细胞瘤、肝细胞癌和胆管癌等, Wnt/β-catenin信号通路在肝癌发生发展中的作用简图如图1所示.
在肝癌组织和细胞中, Wnt/β-catenin信号通路的多个关键基因或蛋白的异常表达已经被证实.
Han等[11]通过比较肝癌肿瘤组织与相应的邻近非肿瘤组织WNT家族基因表达水平, 发现共8个WNT家族基因(WNT2、WNT2B、WNT4、WNT5A、WNT7B、WNT10B、WNT11、WNT16)在肿瘤组织与非肿瘤组织中表达存显著差异. Dong等[12]分析了Wnt配体家族的19个成员(Wnt1-Wnt16)在360例肝癌肿瘤组织和50例邻近非肿瘤组织中进行了表达分析. 结果显示, Wnt2B、Wnt3A、Wnt6、Wnt8B、Wnt10B在原发性肝肿瘤组织中的表达水平明显高于邻近非肿瘤组织. 而Wnt2、Wnt5B、Wnt7A、Wnt7B、Wnt9A、Wnt11在肝肿瘤组织中的表达水平明显降低. 其余Wnt配体Wnt1、Wnt3、Wnt4、Wnt5A、Wnt8A、Wnt9B、Wnt10A、Wnt16在肝肿瘤间表达差异不显著.
Regel等[13]分析了WNT拮抗剂Dickkopf相关蛋白1(dickkopf-related protein 1, DKK1)、分泌型卷曲相关蛋白1(secreted frizzled-related proteins, SFRP1)和Wnt抑制因子1(wnt inhibitory factor 1, WIF1)蛋白在肝母细胞瘤中的表达情况, 该小组选择肝母细胞瘤细胞系HuH-6、HepT1、Hep-T3和HepG2, 并比较其与正常儿童肝组织的表达水平, 结果显示, SFRP1在4个癌变细胞系中均下调; 而DKK1和WIF1则呈现异质表达模式, DKK1在HuH-6、HepT1和Hep-T3细胞中表达增加, WIF1在Hep-T3细胞中表达增加.
APC是形成破坏复合物的关键蛋白, 其表达基因发生失活突变后将减少肝癌细胞中APC的表达, 有研究表明APC发生失活突变的比例为1.4%. AXIN则是形成破坏复合物的支架蛋白, AXIN1和AXIN2在肝癌发生失活突变的比例分别为10.4%和3.3%. 这些负性调节因子的突变降低了破坏复合物的生物学功能, 从而有利于β-catenin的积累[14].
CTNNB1是编码β-catenin的基因, 多项研究表明, CTNNB1外显子3的激活突变能够编码突变的β-catenin, 突变的β-catenin无法被GSK3β等磷酸化, 从而无法形成破坏复合物[15,16].
2.2.1 miRNAs调控Wnt/β-catenin信号通路影响肝癌进展: MiRNAs与肝癌的发生发展具有密切关系, 例如, miR-181a在乙型肝炎病毒(hepatitis B virus, HBV)相关的肝癌发生发展中作为原癌基因起作用[17]. miR-1246与AXIN2 mRNA及GSK3β mRNA序列均存在互补片段[18], miR-1246能够通过抑制AXIN2和GSK3β的表达激活Wnt/β-catenin通路. miR-452能够通过抑制Sox7的表达后, 激活Wnt/β-catenin信号通路, 从而导致肝癌的发生及促进肝细胞癌的干细胞样细胞增殖[19]. miR-500a则通过直接结合GSK-3β mRNA的3'-非翻译区(3'-untranslated region, 3'-UTR), 抑制GSK-3β的表达[20], 进而激活Wnt/β-catenin信号通路. 过表达miR-153可促进β-catenin转录活性, 导致肝癌细胞周期进展、增殖和集落形成[21]. 高miR-197表达的转移性肝癌细胞有Wnt/β-catenin信号激活, 在门静脉转移患者的肝癌标本中发现miR-197高表达; miR-197高表达与Axin2、DKK2的表达相关[22].
2.2.2 LncRNAs调控Wnt/β-catenin信号通路影响肝癌进展: 长链非编码RNAs(long non-coding RNAs, LncRNAs)与肝癌侵袭转移、预后、化疗耐药等密切相关[23], 沉默LncRNA-H19可促进肝癌细胞HepG2细胞增殖, 抑制细胞凋亡[24]. 我们的最新研究显示, LncRNA LL22NC03-N14H11.1可通过激活MAPK通路诱导线粒体分裂, 促进肝癌进展[25]. 多种致癌LncRNAs通过Wnt/β-catenin信号通路的关键组成成分相互作用进而调控β-catenin的表达, 从而促进肝癌的发展. APC降解复合物和β-catenin-TCF激活复合物是LncRNAs调控β-catenin稳定性和活化的主要靶点. 例如, LncAPC将组蛋白甲基化转移酶(Histone methyltransferase)招募到APC启动子, 抑制APC转录, 从而促进Wnt/β-catenin通路的激活和肝肿瘤起始细胞的自我更新过程[26]. LncLALA1通过将CCCTC结合因子(CCCTC binding factor, CTCF)召集到AXIN1启动子, 以阻断AXIN1转录, 抑制APC降解复合物的形成, 并激活Wnt/β-catenin信号通路[27]. 此外, 肝癌组织中过表达的Linc00210可与链接素相互作用蛋白1抗体(antibody to linin interacting protein 1, CTNNBIP1)结合, 从而损害CTNNBIP1-β-catenin相互作用, 促进β-catenin-TCF/LEF相互作用, 激活Wnt/β-catenin信号通路和肝肿瘤启动细胞自我更新[28]. β-catenin活性的改变直接影响肝肿瘤发生的发展. 与β-catenin相关的LncRNA β-Catm可以增强EZH2的表达, 促进β-catenin的甲基化, 抑制β-catenin的泛素化, 甲基化的β-catenin的积累导致了Wnt/β-catenin信号的激活[29].
2.2.3 上游调控因子调控Wnt/β-catenin信号通路影响肝癌进展: Qu等[30]发现, 丝氨酸/苏氨酸-蛋白激酶1(serine/threonine-protein kinase, SIK1)对肝肿瘤发育的影响至少部分是通过调控β-catenin发生的, SIK1过表达导致抑制了β-catenin转录活性, 而SIK1缺失则相反. 进一步发现, SMRT-T1391A逆转了SIK1的表型, 并促进了β-catenin的激活. Twist1被确定为SIK1/Wnt/β-catenin轴下游的一个关键因子, Twist1敲除逆转SIK1敲除介导的改变, 而SIK1和Twist1双敲除细胞在建立肿瘤生长和转移方面的效率低于SIK1敲除细胞. SIK1的启动子活性受到Twist1的负调控, 说明存在双负反馈回路. 重要的是, SIK1水平与Twist1在人类肝癌标本中的表达呈负相关. 通过结果可以发现, SIK1及其靶点在调节肝癌发展中的关键作用, 且与wnt/β-catenin信号通路有关, 为肝癌治疗提供了潜在的新候选者.
Yu等[31]探讨了CAV1在肝癌进展中的作用. 首先, CAV1在高侵袭性肝癌细胞株中比低侵袭性肝癌细胞株高表达. 转移性肝癌标本的免疫组化染色明显强于非转移性肝癌标本的组织微阵列. 其次, 在体外过表达CAV1增强了肝癌细胞的侵袭性, 在体内促进了致瘤性和肺转移. 相反, CAV1稳定敲除可显著减少这些恶性行为. 重要的是, 该小组发现CAV1可以通过Wnt/β-catenin通路诱导EMT过程, 促进肝癌转移. 该小组还发现基质金属蛋白酶-7(matrix metalloproteinase-7, MMP-7)是CAV1的一个新的下游靶点. CAV1介导Wnt/β-catenin通路激活可能在肝癌的转移进展中具有重要意义.
Y-box结合蛋白-1 (Y-box binding protein-1, YB-1)是一种多效分子, 在细胞核中结合在转录水平上调节基因, 在细胞质中结合RNA调节基因翻译. 在之前的研究中, YB-1被鉴定为一种胎儿肝蛋白, 可调节肝细胞的成熟, 并在肝再生过程中上调. 此外, YB-1已被证明在肝癌中表达. Chao等[32]进一步研究了YB-1在肝癌中的作用. 结果显示, 下调YB-1抑制了Wnt配体和β-catenin的表达, 损伤了Wnt/β-catenin信号通路, 降低了肝癌起始细胞数量.
2.2.4 Wnt/β-catenin信号通路下游靶目标影响肝癌进展: Li等[33]表明, Cyr61是Wnt/β-catenin信号通路的靶基因, Wnt/β-catenin通过调控Cyr61在肝细胞癌的进展中发挥重要作用. 具体而言, Cyr61是CCN复杂多功能蛋白家族的成员, 在多种肿瘤中也被发现过表达, 在肿瘤发生过程中发挥着显著不同的作用. 该小组发现, 虽然Cyr61蛋白在健康个体的肝组织中未检测到表达水平, 但其在肝癌和邻近组织中表达水平升高, 在癌旁肝硬化组织中显著升高. 在人类肝癌样本中, 过表达的Cyr61与升高的β-catenin水平呈正相关. 激活β-catenin信号通路可使HepG2细胞中Cyr61的mRNA水平升高, 而抑制β-catenin信号通路可使Cyr61的mRNA和蛋白水平降低. 该小组在人Cyr61基因启动子区域鉴定了两个TCF4结合元件, 证明了在体内, β-catenin/TCF4复合物特异性结合Cyr61启动子并直接调控其启动子活性. 这些结果表明, Cyr61是HCC中Wnt/β-catenin信号转导的直接靶点, 可能在肝癌的进展中发挥重要作用.
如前所述, 越来越多的证据表明, 异常激活的Wnt/β-catenin信号在肝癌的病理过程中的起关键作用. 这些证据表明靶向调控Wnt/β-catenin信号通路的组成成分有望抑制肝癌发生和进展. 目前已经发现多种小分子抑制剂、中药提取物及miRNAs等能够抑制Wnt/β-catenin信号通路, 从而抑制肝癌的发生和进展.
先前的研究表明, 相当数量的肝癌中存在β-catenin基因突变. 因此, 有效抑制该通路可能为治疗肝癌提供一种新的方法. 小分子制剂FH535是过氧化物酶体增殖活化受体(peroxisomes proliferate activated receptors, PPAR)和β-catenin/TCF/LEF的双抑制剂. FH535已被证明可以抑制肝癌和肝母细胞瘤细胞株的增殖, 其抑制β-catenin/TCF/LEF活性的特异性在肝母细胞瘤细胞株HepG2中得到证实. Gedaly等[34]的数据表明FH535可以抑制内源性和外源性表达的β-catenin对靶基因的激活, 此外, FH535以剂量依赖的方式抑制肝癌细胞系的增殖, 这与S期细胞百分比的下降相关, FH535能够降低两种β-catenin靶点Cyclin D1和Survivin的表达. 这些数据表明FH535在肝癌治疗中具有潜在的治疗价值. 该小组的另一项研究显示[35], FH535可靶向MAPK和Wnt/β-catenin通路协同抑制肝癌和肝癌干细胞增殖.
无毒性小分子化合物CWP232228(美国专利8, 101, 751, B2), 其功能首先在乳腺癌中被证实, 该化合物在细胞核内拮抗β-catenin与TCF结合, 可在体外和体内通过抑制乳腺干细胞和大体积肿瘤细胞的生长, 最终抑制肿瘤的形成和转移. Kim等[36]发现, CWP232228在肝癌中同样发挥抑癌功能, 通过抑制Wnt/β-catenin信号通路, 耗尽CD133+/ALDH+肝癌干细胞, 最终在体内外降低肝癌干细胞的自我更新能力, 降低其致瘤性. CWP232228可通过优先靶向肝癌干细胞作为肝癌的候选治疗药物.
Fako等[37]发现FDA批准的精神药物匹莫齐特(pimozide, PMZ)在表达上皮细胞粘附分子(epithelial cell adhesion molecule, EpCAM)的肝癌细胞系中具有抗癌特性, EpCAM是一种肝干细胞标记物, 是Wnt/β-catenin通路的功能下游靶点. 该小组证明了PMZ通过干扰Wnt/β-catenin信号通路和降低EpCAM表达, 有效抑制了肝癌细胞的生长. 因此, PMZ可能是一种有用的小分子抑制剂, 可以重新用于肝癌治疗的抗癌治疗.
Guo等[38]发现, 石斛提取物能够抑制肝癌细胞中细胞核内β-catenin的表达水平, 并且调控Wnt/β-catenin信号通路的下游靶基因的表达, 阻断Wnt/β-catenin信号通路, 从而抑制肝癌细胞增殖, 诱导肝癌细胞凋亡.
Huang等[39]从天竺螺中分离出一种能够减弱肝癌细胞迁移的蛇毒精氨酸酯酶(arginine esterase, agkihpin), 进一步的机制研究显示, 在agkihpin治疗的癌细胞中, FZD7和β-catenin表达降低、GSK3磷酸化(Ser9)和细胞核的β-catenin积累抑制了这一通路. 通过体外生物信息学分析和蛋白酶活性分析, 该小组发现agkihpin可能结合和降解FZD7. agkihpin可以通过裂解FZD7抑制Wnt/β-catenin信号通路, 导致TCF/LEF转录因子失活, 导致上皮间质转化(epithelial-mesenchymal transition, EMT)EMT反转, 最终减弱肝癌细胞的迁移和侵袭.
大量研究表明, miRNAs表达水平的改变与肝癌肿瘤进展有关, miRNAs也成为了肝癌治疗重要潜在靶点, 我们之前的研究显示, 苦参素和顺铂联合用药可通过调节miR-21和miR-122的表达抑制肝癌细胞的过度增殖, 从而发挥抗肿瘤作用[40], 其中, miRNA-21表达下调, 而miRNA-122表达上调[41], 并且苦参素可以通过抑制miR-181a表达逆转肝癌细胞耐药性[42], 且这种调节机制与耐药蛋白P-gp的水平有关[43]. 多项研究表明, 通过调节miRNAs表达水平可抑制Wnt/β-catenin信号通路.
CREPT蛋白是Wnt/β-catenin信号通路的重要调控因子[44,45], Bai等[46]认为, miR-300通过下调CRETP/Wnt/β-catenin信号通路抑制肝细胞癌细胞的生长. Quan等[47]发现, miR-504通过抑制FZD7介导的Wnt/β-catenin信号通路, 在肝癌中发挥抑癌作用. Cui等[48]发现, miR-337通过靶向高迁移率AT-hook 2调控PI3K/AKT和Wnt/β-catenin信号通路, 抑制肝癌进展. Cao等[49]认为, miR-298通过抑制CTNND1介导的Wnt/β-catenin信号通路抑制肝细胞癌进展. Yao等[50]研究表明, miR-3194-3p通过靶向BCL9降低Wnt/β-catenin信号通路, 抑制肝细胞癌的转移和上皮-间质转化.
总之, Wnt/β-catenin通路的分子调控是复杂的, 在信号通路激活过程中受到了多种因子的调控, 这其中既有间接调控又有直接调控, 本综述不仅揭示了Wnt/β-catenin通路的复杂性, 科学家们积累研究数据可能会为肝癌的靶向基因治疗提供大量的潜在靶点, 对Wnt/β-catenin的基础遗传学和生物学的进一步了解, 将为人类癌症的新化学预防和治疗策略的发展提供新的思路.
近几十年来对肝癌发生机制的探索丰富了临床工作者和研究人员对肝癌发展的认识. Wnt/β-catenin信号通路获得了广泛的研究. 通过对文献的梳理, 我们发现, Wnt/β-catenin与肝癌显著相关. Wnt/β-catenin信号传导的异常激活在肝癌进展过程中普遍存在. 而小分子抑制剂、中药提取物以及miRNAs等抑制Wnt/β-catenin信号通路的潜在药物的出现, 为通过Wnt/β-catenin信号通路提高肝癌治疗效果及应用价值提供了更多可能性.
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | 郑 荣寿, 孙 可欣, 张 思维, 曾 红梅, 邹 小农, 陈 茹, 顾 秀瑛, 魏 文强, 赫 捷. 2015年中国恶性肿瘤流行情况分析. 中华肿瘤杂志. 2019;41:19-28. [DOI] |
| 2. | Tortelote GG, Reis RR, de Almeida Mendes F, Abreu JG. Complexity of the Wnt/βcatenin pathway: Searching for an activation model. Cell Signal. 2017;40:30-43. [PubMed] [DOI] |
| 3. | Xia XH, Xiao CJ, Shan H. Facilitation of liver cancer SMCC7721 cell aging by sirtuin 4 via inhibiting JAK2/STAT3 signal pathway. Eur Rev Med Pharmacol Sci. 2017;21:1248-1253. [PubMed] |
| 4. | Zhang L, Li S, Wang R, Chen C, Ma W, Cai H. Cytokine augments the sorafenib-induced apoptosis in Huh7 liver cancer cell by inducing mitochondrial fragmentation and activating MAPK-JNK signalling pathway. Biomed Pharmacother. 2019;110:213-223. [PubMed] [DOI] |
| 5. | Chen J, Gingold JA, Su X. Immunomodulatory TGF-β Signaling in Hepatocellular Carcinoma. Trends Mol Med. 2019;25:1010-1023. [PubMed] [DOI] |
| 6. | Czauderna C, Castven D, Mahn FL, Marquardt JU. Context-Dependent Role of NF-κB Signaling in Primary Liver Cancer-from Tumor Development to Therapeutic Implications. Cancers (Basel). 2019;11. [PubMed] [DOI] |
| 8. | Monga SP. β-Catenin Signaling and Roles in Liver Homeostasis, Injury, and Tumorigenesis. Gastroenterology. 2015;148:1294-1310. [PubMed] [DOI] |
| 9. | Pan J, Lian Z, Wallet S, Feitelson MA. The hepatitis B x antigen effector, URG7, blocks tumour necrosis factor alpha-mediated apoptosis by activation of phosphoinositol 3-kinase and beta-catenin. J Gen Virol. 2007;88:3275-3285. [PubMed] [DOI] |
| 10. | Hua Y, Yang Y, Li Q, He X, Zhu W, Wang J, Gan X. Oligomerization of Frizzled and LRP5/6 protein initiates intracellular signaling for the canonical WNT/β-catenin pathway. J Biol Chem. 2018;293:19710-19724. [PubMed] |
| 11. | Han Q, Wang X, Liao X, Han C, Yu T, Yang C, Li G, Han B, Huang K, Zhu G, Liu Z, Zhou X, Su H, Shang L, Gong Y, Song X, Peng T, Ye X. Diagnostic and prognostic value of WNT family gene expression in hepatitis B virusrelated hepatocellular carcinoma. Oncol Rep. 2019;42:895-910. [PubMed] [DOI] |
| 12. | Dong JJ, Ying L, Shi KQ. Expression of the Wnt ligands gene family and its relationship to prognosis in hepatocellular carcinoma. Cancer Cell Int. 2019;19:34. [PubMed] [DOI] |
| 13. | Regel I, Eichenmüller M, Mahajan UM, Hagl B, Benitz S, Häberle B, Vokuhl C, von Schweinitz D, Kappler R. Downregulation of SFRP1 is a protumorigenic event in hepatoblastoma and correlates with beta-catenin mutations. J Cancer Res Clin Oncol. 2020;146:1153-1167. [PubMed] [DOI] |
| 14. | Wang W, Pan Q, Fuhler GM, Smits R, Peppelenbosch MP. Action and function of Wnt/β-catenin signaling in the progression from chronic hepatitis C to hepatocellular carcinoma. J Gastroenterol. 2017;52:419-431. [PubMed] [DOI] |
| 15. | Fujimoto A, Totoki Y, Abe T, Boroevich KA, Hosoda F, Nguyen HH, Aoki M, Hosono N, Kubo M, Miya F, Arai Y, Takahashi H, Shirakihara T, Nagasaki M, Shibuya T, Nakano K, Watanabe-Makino K, Tanaka H, Nakamura H, Kusuda J, Ojima H, Shimada K, Okusaka T, Ueno M, Shigekawa Y, Kawakami Y, Arihiro K, Ohdan H, Gotoh K, Ishikawa O, Ariizumi S, Yamamoto M, Yamada T, Chayama K, Kosuge T, Yamaue H, Kamatani N, Miyano S, Nakagama H, Nakamura Y, Tsunoda T, Shibata T, Nakagawa H. Whole-genome sequencing of liver cancers identifies etiological influences on mutation patterns and recurrent mutations in chromatin regulators. Nat Genet. 2012;44:760-764. [PubMed] [DOI] |
| 16. | Perugorria MJ, Olaizola P, Labiano I, Esparza-Baquer A, Marzioni M, Marin JJG, Bujanda L, Banales JM. Wnt-β-catenin signalling in liver development, health and disease. Nat Rev Gastroenterol Hepatol. 2019;16:121-136. [PubMed] [DOI] |
| 18. | Chai S, Ng KY, Tong M, Lau EY, Lee TK, Chan KW, Yuan YF, Cheung TT, Cheung ST, Wang XQ, Wong N, Lo CM, Man K, Guan XY, Ma S. Octamer 4/microRNA-1246 signaling axis drives Wnt/β-catenin activation in liver cancer stem cells. Hepatology. 2016;64:2062-2076. [PubMed] [DOI] |
| 19. | Zheng Z, Liu J, Yang Z, Wu L, Xie H, Jiang C, Lin B, Chen T, Xing C, Liu Z, Song P, Yin S, Zheng S, Zhou L. MicroRNA-452 promotes stem-like cells of hepatocellular carcinoma by inhibiting Sox7 involving Wnt/β-catenin signaling pathway. Oncotarget. 2016;7:28000-28012. [PubMed] [DOI] |
| 20. | Guo Y, Chen L, Sun C, Yu C. MicroRNA-500a promotes migration and invasion in hepatocellular carcinoma by activating the Wnt/β-catenin signaling pathway. Biomed Pharmacother. 2017;91:13-20. [PubMed] [DOI] |
| 21. | Hua HW, Jiang F, Huang Q, Liao Z, Ding G. MicroRNA-153 promotes Wnt/β-catenin activation in hepatocellular carcinoma through suppression of WWOX. Oncotarget. 2015;6:3840-3847. [PubMed] [DOI] |
| 22. | Hu Z, Wang P, Lin J, Zheng X, Yang F, Zhang G, Chen D, Xie J, Gao Z, Peng L, Xie C. MicroRNA-197 Promotes Metastasis of Hepatocellular Carcinoma by Activating Wnt/β-Catenin Signaling. Cell Physiol Biochem. 2018;51:470-486. [PubMed] [DOI] |
| 24. | 黎 梨, 邓 凤莲, 黄 赞松, 廖 俊, 李 建基, 杨 哲. 长链非编码RNA-H19调控人肝癌HepG2细胞增殖与凋亡. 右江民族医学院学报. 2019;41:15-19+25. [DOI] |
| 25. | Yi T, Luo H, Qin F, Jiang Q, He S, Wang T, Su J, Song S, Qin X, Qin Y, Zhou X, Huang Z. LncRNA LL22NC03-N14H11.1 promoted hepatocellular carcinoma progression through activating MAPK pathway to induce mitochondrial fission. Cell Death Dis. 2020;11:832. [PubMed] [DOI] |
| 26. | Fu X, Lin J, Qin F, Yang Z, Ding Y, Zhang Y, Han L, Zhu X, Zhang Q. LncAPC drives Wnt/β-catenin activation and liver TIC self-renewal through EZH2 mediated APC transcriptional inhibition. Mol Carcinog. 2018;57:408-418. [PubMed] [DOI] |
| 27. | Xu D, Yang F, Yuan JH, Zhang L, Bi HS, Zhou CC, Liu F, Wang F, Sun SH. Long noncoding RNAs associated with liver regeneration 1 accelerates hepatocyte proliferation during liver regeneration by activating Wnt/β-catenin signaling. Hepatology. 2013;58:739-751. [PubMed] [DOI] |
| 28. | Fu X, Zhu X, Qin F, Zhang Y, Lin J, Ding Y, Yang Z, Shang Y, Wang L, Zhang Q, Gao Q. Linc00210 drives Wnt/β-catenin signaling activation and liver tumor progression through CTNNBIP1-dependent manner. Mol Cancer. 2018;17:73. [PubMed] [DOI] |
| 29. | Guo H, Hu G, Yang Q, Zhang P, Kuang W, Zhu X, Wu L. Knockdown of long non-coding RNA CCAT2 suppressed proliferation and migration of glioma cells. Oncotarget. 2016;7:81806-81814. [PubMed] [DOI] |
| 30. | Qu C, He, Lu X, Dong L, Zhu Y, Zhao Q, Jiang X, Chang P, Jiang X, Wang L, Zhang Y, Bi L, He J, Peng Y, Su J, Zhang H, Huang H, Li Y, Zhou S, Qu Y, Zhao Y, Zhang Z. Salt-inducible Kinase (SIK1) regulates HCC progression and WNT/β-catenin activation. J Hepatol. 2016;64:1076-1089. [PubMed] [DOI] |
| 31. | Yu H, Shen H, Zhang Y, Zhong F, Liu Y, Qin L, Yang P. CAV1 promotes HCC cell progression and metastasis through Wnt/β-catenin pathway. PLoS One. 2014;9:e106451. [PubMed] [DOI] |
| 32. | Chao HM, Huang HX, Chang PH, Tseng KC, Miyajima A, Chern E. Y-box binding protein-1 promotes hepatocellular carcinoma-initiating cell progression and tumorigenesis via Wnt/β-catenin pathway. Oncotarget. 2017;8:2604-2616. [PubMed] [DOI] |
| 33. | Li ZQ, Ding W, Sun SJ, Li J, Pan J, Zhao C, Wu WR, Si WK. Cyr61/CCN1 is regulated by Wnt/β-catenin signaling and plays an important role in the progression of hepatocellular carcinoma. PLoS One. 2012;7:e35754. [PubMed] [DOI] |
| 34. | Gedaly R, Galuppo R, Daily MF, Shah M, Maynard E, Chen C, Zhang X, Esser KA, Cohen DA, Evers BM, Jiang J, Spear BT. Targeting the Wnt/β-catenin signaling pathway in liver cancer stem cells and hepatocellular carcinoma cell lines with FH535. PLoS One. 2014;9:e99272. [PubMed] [DOI] |
| 35. | Galuppo R, Maynard E, Shah M, Daily MF, Chen C, Spear BT, Gedaly R. Synergistic inhibition of HCC and liver cancer stem cell proliferation by targeting RAS/RAF/MAPK and WNT/β-catenin pathways. Anticancer Res. 2014;34:1709-1713. [PubMed] |
| 36. | Kim JY, Lee HY, Park KK, Choi YK, Nam JS, Hong IS. CWP232228 targets liver cancer stem cells through Wnt/β-catenin signaling: a novel therapeutic approach for liver cancer treatment. Oncotarget. 2016;7:20395-20409. [PubMed] [DOI] |
| 37. | Fako V, Yu Z, Henrich CJ, Ransom T, Budhu AS, Wang XW. Inhibition of wnt/β-catenin Signaling in Hepatocellular Carcinoma by an Antipsychotic Drug Pimozide. Int J Biol Sci. 2016;12:768-775. [PubMed] [DOI] |
| 38. | Guo Z, Zhou Y, Yang J, Shao X. Dendrobium candidum extract inhibits proliferation and induces apoptosis of liver cancer cells by inactivating Wnt/β-catenin signaling pathway. Biomed Pharmacother. 2019;110:371-379. [PubMed] [DOI] |
| 39. | Huang M, Wu S, Hu Q, Wu H, Wei S, Xie H, Sun K, Li X, Fang L. Agkihpin, a novel SVAE may inhibit the migration and invasion of liver cancer cells associated with the inversion of EMT induced by Wnt/β-catenin signaling inhibition. Biochem Biophys Res Commun. 2016;479:283-289. [PubMed] [DOI] |
| 41. | 黄 赞松, 向 发良, 周 喜汉, 黄 衍强, 邓 志华, 仇 仪英. 苦参素对肝癌细胞HepG2细胞增殖和MicroRNA-122、MicroRNA-21表达的影响. 中国老年学杂志. 2014;34:3079-3081. [DOI] |
| 42. | 黄 桂柳, 冯 巍巍, 黄 赞松, 周 喜汉, 覃 月秋. 苦参素通过线粒体凋亡通路影响肝癌耐药细胞HepG2/ADM化学治疗的耐药性. 中华肝脏病杂志. 2019;27:24-27. [DOI] |
| 43. | 廖 俊, 张 彩灵, 黄 赞松, 覃 小珊, 陈 椿. 苦参素及 Mir-181a对人肝癌细胞耐药株 HepG2/ADM裸鼠移植瘤中耐药蛋白P-gp的影响. 右江民族医学院学报. 2020;42:1-6. [DOI] |
| 44. | Jin K, Chen H, Zuo Q, Huang C, Zhao R, Yu X, Wang Y, Zhang Y, Chang Z, Li B. CREPT and p15RS regulate cell proliferation and cycling in chicken DF-1 cells through the Wnt/β-catenin pathway. J Cell Biochem. 2018;119:1083-1092. [PubMed] [DOI] |
| 45. | Zhang Y, Liu C, Duan X, Ren F, Li S, Jin Z, Wang Y, Feng Y, Liu Z, Chang Z. CREPT/RPRD1B, a recently identified novel protein highly expressed in tumors, enhances the β-catenin·TCF4 transcriptional activity in response to Wnt signaling. J Biol Chem. 2014;289:22589-22599. [PubMed] [DOI] |
| 46. | Bai J, Gao Y, Du Y, Yang X, Zhang X. MicroRNA-300 inhibits the growth of hepatocellular carcinoma cells by downregulating CREPT/Wnt/β-catenin signaling. Oncol Lett. 2019;18:3743-3753. [PubMed] [DOI] |
| 47. | Quan H, Li B, Yang J. MicroRNA-504 functions as a tumor suppressor in hepatocellular carcinoma through inhibiting Frizzled-7-mediated-Wnt/β-catenin signaling. Biomed Pharmacother. 2018;107:754-762. [PubMed] [DOI] |
| 48. | Cui H, Song R, Wu J, Wang W, Chen X, Yin J. MicroRNA-337 regulates the PI3K/AKT and Wnt/β-catenin signaling pathways to inhibit hepatocellular carcinoma progression by targeting high-mobility group AT-hook 2. Am J Cancer Res. 2018;8:405-421. [PubMed] |
| 49. | Cao N, Mu L, Yang W, Liu L, Liang L, Zhang H. MicroRNA-298 represses hepatocellular carcinoma progression by inhibiting CTNND1-mediated Wnt/β-catenin signaling. Biomed Pharmacother. 2018;106:483-490. [PubMed] [DOI] |
| 50. | Yao B, Li Y, Wang L, Chen T, Niu Y, Liu Q, Liu Z. MicroRNA-3194-3p inhibits metastasis and epithelial-mesenchymal transition of hepatocellular carcinoma by decreasing Wnt/β-catenin signaling through targeting BCL9. Artif Cells Nanomed Biotechnol. 2019;47:3885-3895. [PubMed] [DOI] |