修回日期: 2020-12-25
接受日期: 2021-01-18
在线出版日期: 2021-02-28
目前, 肝癌根治术仍是治疗肝癌患者的最有效方法, 术后给予肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)治疗, 可进一步清除残留肿瘤组织, 可有效改善患者预后. 近年来, 肝癌的靶向治疗备受临床关注, 程序性死亡分子1 (PD-1)抑制剂可阻断PD-1与其受体配体的结合, 从而重新激活T淋巴细胞, 并产生持续的抗肿瘤效应, 抑制肿瘤生长. 卡瑞利珠单抗作为一种新型PD-1抑制剂逐渐应用于临床.
探讨卡瑞利珠单抗联合肝动脉化疗栓塞术(TACE)对伴微血管侵犯肝细胞癌患者根治术后血清类表皮生长因子域7 (Egfl7)、血管内皮生长因子(VEGF)、骨桥蛋白(OPN)水平及复发率的干预效果.
选取2019-06/2020-01我院收治的伴微血管侵犯肝细胞癌根治术后患者62例, 以简单随机化法分为研究组(n = 31)、对照组(n = 31). 两组均行常规肝癌根治术, 术后2 mo内, 对照组术后予以TACE治疗, 研究组术后予以卡瑞利珠单抗配合TACE治疗. 比较两组治疗前、治疗1 mo、3 mo后血清肿瘤标志物[糖类抗原199(CA199)、甲胎蛋白(AFP)、癌胚抗原(CEA)]、免疫功能指标(CD3+、CD4+、CD4+/CD8+)、Egfl7、VEGF、OPN水平和疼痛程度(VAS)、生活质量(QOL-LC), 并统计两组不良反应发生率、治疗结束后3 mo、6 mo复发率.
研究组治疗1 mo、3 mo后血清CA199、AFP、CEA水平低于对照组(P<0.05); 研究组治疗1 mo、3 mo后血清CD3+、CD4+、CD4+/CD8+水平高于对照组(P<0.05); 研究组治疗1 mo、3 mo后血清Egfl7、VEGF、OPN水平低于对照组(P<0.05); 研究组治疗1 mo、3 mo后VAS评分低于对照组, QOL-LC评分高于对照组(P<0.05); 研究组反应性毛细血管增生症发生率(61.29%)高于对照组(0.00%) (P<0.05); 研究组根治术后3 mo、6 mo复发率(6.45%、9.68%)与对照组(13.33%、23.33%)对比, 差异无统计学意义(P>0.05).
伴微血管侵犯肝细胞癌患者根治术后采用卡瑞利珠单抗配合TACE治疗, 能进一步下调血清肿瘤标志物水平, 改善细胞免疫功能, 且能有效调节血清Egfl7、VEGF、OPN水平, 减轻患者疼痛程度, 改善生活质量, 虽然加用卡瑞利珠单抗会明显增加不良反应发生率, 但均未轻微反应, 患者耐受性良好.
核心提要: 卡瑞利珠单抗配合肝动脉化疗栓塞术对根治术后的伴微血管侵犯肝细胞癌患者的治疗, 在耐受性良好的基础上, 可以改善患者血清中的肿瘤标志物水平, 提高患者术后恢复质量.
引文著录: 黄健翔, 骆旭航, 龚安安. 卡瑞利珠单抗配合TACE对伴微血管侵犯肝细胞癌患者根治术后血清Egfl7、VEGF、OPN水平及复发率影响的前瞻性研究. 世界华人消化杂志 2021; 29(4): 182-189
Revised: December 25, 2020
Accepted: January 18, 2021
Published online: February 28, 2021
At present, radical resection is still the most effective method for the treatment of patients with liver cancer. Postoperative hepatic transcatheter arterial chemoembolization (TACE) can further remove residual tumor tissue and effectively improve the prognosis of patients. In recent years, targeted therapy of liver cancer has attracted much attention. Programmed-death molecule 1 (PD-1) inhibitors can block the binding of PD-1 to its ligand, thus reactivating T lymphocytes and producing sustained anti-tumor effects to inhibit tumor growth. As a new type of PD-1 inhibitor, carrilizumab has been gradually applied in the clinic.
To investigate the effect of camrelizumab combined with transcatheter arterial chemoembolization (TACE) on serum epidermal growth factor-like domain 7 (Egfl7), vascular epithelial growth factor (VEGF), and osteopontin (OPN) levels and recurrence rate of patients with hepatocellular carcinoma with microvascular invasion after radical operation.
A total of 62 patients with hepatocellular carcinoma with microvascular invasion who were admitted to our hospital from June 2019 to January 2020 were selected. They were divided into either a study group (n = 31) or a control group (n = 31) by simple randomization method. Both groups underwent conventional radical resection of liver cancer. Within 2 mo after surgery, the control group received TACE after surgery, and the study group received camrelizumab + TACE after surgery. Serum levels of tumor markers [carbohydrate antigen 199 (CA199), alpha-fetoprotein (AFP), and carcinoembryonic antigen (CEA)], immune function indicators (CD3+, CD4+, and CD4+/CD8+), serum levels of Egfl7, VEGF, and OPN, pain degree (VAS), and quality of life (QOL-LC) before treatment and 1 mo and 3 mo after treatment were compared between the two groups. The incidence of adverse reactions in the two groups and the recurrence rate at 3 mo and 6 mo after the end of treatment were also calculated.
At 1 mo and 3 mo after treatment, serum levels of CA199, AFP, and CEA in the study group were significantly lower than those in the control group (P < 0.05); CD3+, CD4+, and CD4+/CD8+ ratio in the study group were significantly higher than those in the control group (P < 0.05); serum Egfl7, VEGF, and OPN levels in the study group were significantly lower than those in the control group (P < 0.05); and the VAS score of the study group was significantly lower than that of the control group, and the QOL-LC score was significantly higher than that of the control group (P < 0.05). The incidence of reactive capillary hyperplasia (61.29%) in the study group was higher than that in the control group (0.00%) (P < 0.05). Compared with the values of the control group (13.33% and 23.33%), the recurrence rates (6.45% and 9.68%) of the study group at 3 mo and 6 mo after radical operation were not statistically significant (P > 0.05).
Camrelizumab combined with TACE for hepatocellular carcinoma patients with microvascular invasion after radical resection can further lower serum tumor marker levels and improve cellular immune function, effectively regulate serum Egfl7, VEGF, and OPN levels, reduce the degree of pain, and improve the quality of life. Although the addition of carrelizumab significantly increases the incidence of adverse reactions, they are minor and well tolerated by the patients.
- Citation: Huang JX, Luo XH, Gong AA. Effects of camrelizumab combined with transcatheter arterial chemoembolization arterial chemoembolization on serum Egfl7, VEGF, and OPN levels and recurrence rate in patients with hepatocellular carcinoma with microvascular invasion after radical operation: A prospective study. Shijie Huaren Xiaohua Zazhi 2021; 29(4): 182-189
- URL: https://www.wjgnet.com/1009-3079/full/v29/i4/182.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i4.182
肝癌是我国第4位常见恶性肿瘤和第3位恶性肿瘤致死病因, 资料显示, 我国2015年有46.6万新发肝癌病例和42.1万死亡病例[1,2]. 肝细胞癌为最常见肝癌类型, 患病率占全部肝癌的85%以上, 严重地威胁人类生命及健康[3]. 肿瘤根治术是治疗肝癌的首选方法, 但根治术并不能完全清除肿瘤细胞, 一般术后需联合肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)以控制肿瘤复发, 但整体疗效仍有待提高[4,5]. 新近研究指出, 卡瑞利珠单抗治疗晚期肝细胞癌可获得较高有效率, 患者疾病进展后继续使用该药仍可获益, 且具有较好的安全性[6]. 此外, 研究证实影响肝癌转移、复发最重要的因素为肝癌的微血管侵犯[7,8]. 基于此, 本研究尝试探究卡瑞利珠单抗配合TACE对伴微血管侵犯肝细胞癌患者根治术后血清类表皮生长因子域7 (epidermal growth factor-like domain 7, Egfl7)、血管内皮生长因子(vascular epithelial growth factor, VEGF)、骨桥蛋白(osteopontin, OPN)水平及复发率的影响.
选取2019-06/2020-01我院收治的伴微血管侵犯肝细胞癌根治术后患者62例, 以简单随机化法分为研究组(n = 31)、对照组(n = 31). 对比两组性别、年龄、体质量指数(body mass index, BMI)、Child-Pugh分级[9]、临床分期[10]、合并症, 均无显著差异(P>0.05). 见表1.
| 项目 | 研究组(n = 31) | 对照组(n = 31) | t/χ2/u | P |
| 性别(女/男) | 9/22 | 11/20 | 0.295 | 0.587 |
| 年龄(岁) | 43-79 (61.58±8.69) | 41-80 (60.64±9.65) | 0.403 | 0.688 |
| BMI(kg/m2) | 20.4-28.3 (25.46±1.39) | 19.8-28.0 (25.13±1.43) | 0.921 | 0.361 |
| Child-Pugh分级 | 0.282 | 0.596 | ||
| A级 | 12 (38.71) | 10 (32.26) | ||
| B级 | 19 (61.29) | 21 (67.74) | ||
| 临床分期 | 0.007 | 0.994 | ||
| Ⅰ | 8 (25.81) | 9 (29.03) | ||
| Ⅱ | 16 (51.61) | 14 (45.16) | ||
| Ⅲa | 7 (22.58) | 8 (25.81) | ||
| 合并症 | ||||
| 高血压 | 15 (48.39) | 12 (38.71) | 0.591 | 0.442 |
| 冠心病 | 4 (12.90) | 6 (19.35) | 0.477 | 0.490 |
| 高脂血症 | 10 (32.26) | 13 (41.94) | 0.622 | 0.430 |
纳入标准: (1)符合肝癌诊断标准[10]; (2)经病理组织学检查明确有微血管侵犯; (3)Karnofsky功能状态评分[11]>70分; (4)Child-Pugh分级A-B级; (5)临床分期Ⅰ-Ⅲa期; (6)对本研究药物成分无过敏; (7)患者知晓本研究, 已签署同意书.
排除标准: (1)合并其他原发恶性肿瘤者; (2)自身免疫性疾病患者; (3)血液系统疾病患者; (4)严重感染性疾病患者; (5)严重心脑血管疾病、肾肺功能不全者; (6)复发性肝癌患者.
两组均行常规肝癌根治术, 手术由同一组医生完成, 术后2 mo内, 对照组术后予以TACE治疗, 采用改良Seldinger穿刺法, 在SIEMENS公司生产的DSA机引导下经股动脉穿刺置管, 行肝动脉造影, 观察肿瘤大小、位置、血供等, 针对性选择SP微导管或RH导管对肿瘤的供血动脉进行药物栓塞: 首先经导管匀速给予吉西他滨(山东安弘制药有限公司, 国药准字H20173043), 剂量0.8-1 g/m2, 85-100 mg/m2奥沙利铂(苏州二叶制药有限公司, 国药准字H20193119)+ 10-30 mL超液化碘油注入供血动脉, 采用明胶海绵颗粒栓塞, 1次/月, 共3次. 研究组术后予以卡瑞利珠单抗(苏州盛迪亚生物医药有限公司, 国药准字S20190027)配合TACE治疗, TACE治疗方法同对照组, 卡瑞利珠单抗用药以28 d为1个治疗周期, 每个治疗周期的第1 d、15 d静脉注射200 mg. 治疗3 mo后观察治疗效果.
观察指标: (1)两组治疗前、治疗1 mo、3 mo后血清肿瘤标志物, 包括糖类抗原199 (Carbohydrate antigen 199, CA199)、甲胎蛋白(alpha feto protein, AFP)、癌胚抗原(carcinoembryonic antigen, CEA), 采集各时间段空腹静脉血6 mL, 离心处理(10 cm半径, 3000 r/min转速) 10 min后取血清, 置于-80 ℃冷藏室保存, 由专业人员统一检测, 采用蛋白芯片-化学发光法检测上述指标水平, 试剂盒购自上海裕隆生物科技有限公司; (2)两组治疗前、治疗1 mo、3 mo后免疫功能指标, 包括CD3+、CD4+、CD4+/CD8+, 取各时间段血清标本, 采用艾森生物(杭州)有限公司生产的NovoCyte D2061R型流式细胞仪检测血清CD3+、CD4+、CD8+水平, 并计算CD4+/CD8+; (3)两组治疗前、治疗1 mo、3 mo后血清Egfl7、VEGF、OPN水平, 取各时间段血清标本, 采用酶联免疫吸附试验检测上述指标水平, 试剂盒购自厦门仑昌硕生物科技有限公司; (4)两组治疗前、治疗1 mo、3 mo后疼痛程度、生活质量, 分别采用视觉模拟评分法(visual analogue scales, VAS)[12]、肝癌患者生命质量测定量表(quality of life-liver cancer, QOL-LC)[13], VAS分值范围0-10分, 0分为无痛, 1-3分为轻度疼痛, 4-6分为中度疼痛, 7-10分为重度疼痛. QOL-LC包括躯体功能、心理功能、症状/不良反应、社会功能4个维度, 共22个条目, 采用Likert10级评分法, 分值范围22-220分, 得分越高生活质量越高; (5)统计两组不良反应发生率, 包括胃肠道反应、白细胞下降、发热、贫血、反应性毛细血管增生症; (6)统计两组治疗结束后3 mo、6 mo复发率.
统计学处理 数据处理采用SPSS 22.0软件, 计数资料以例数描述, 采用χ2检验, 计量资料采取Bartlett方差齐性检验与Kolmogorov-Smirnov正态性检验, 均确认具备方差齐性且服从正态分布, 以mean±SD描述, 两组间比较采用独立样本t检验, 均采用双侧检验, α = 0.05.
两组治疗前血清CA199、AFP、CEA水平相比, 差异无统计学意义(P>0.05); 治疗1 mo、3 mo后, 两组血清CA199、AFP、CEA水平均较治疗前降低, 且研究组低于对照组(P<0.05). 见表2.
| 时间 | 组别 | 例数 | CA199 (U/mL) | AFP (μg/L) | CEA (μg/L) |
| 治疗前 | 研究组 | 31 | 49.85±7.28 | 809.42±93.19 | 24.76±3.47 |
| 对照组 | 31 | 48.37±8.16 | 826.35±98.60 | 25.80±4.52 | |
| t | 0.754 | 0.695 | 1.016 | ||
| P | 0.454 | 0.490 | 0.314 | ||
| 治疗1 mo后 | 研究组 | 31 | 36.74±6.02a | 390.27±71.19a | 18.03±2.56a |
| 对照组 | 31 | 43.19±7.15a | 481.40±83.62a | 22.35±3.17a | |
| t | 3.842 | 4.620 | 5.903 | ||
| P | <0.001 | <0.001 | <0.001 | ||
| 治疗3 mo后 | 研究组 | 31 | 30.86±4.62a | 304.26±61.34a | 11.73±2.28a |
| 对照组 | 31 | 36.02±5.83a | 368.05±75.40a | 17.42±2.69a | |
| t | 5.836 | 3.654 | 8.984 | ||
| P | <0.001 | 0.001 | <0.001 |
两组治疗前血清CD3+、CD4+、CD4+/CD8+水平间差异无统计学意义(P>0.05); 治疗1 mo、3 mo后, 研究组血清CD3+、CD4+、CD4+/CD8+水平均较对照组高(P<0.05). 见表3.
| 时间 | 组别 | 例数 | CD3+ (%) | CD4+ (%) | CD4+/CD8+ |
| 治疗前 | 研究组 | 31 | 54.08±5.64 | 32.15±4.76 | 1.21±0.23 |
| 对照组 | 31 | 53.19±6.27 | 31.69±5.41 | 1.18±0.20 | |
| t | 0.588 | 0.355 | 0.548 | ||
| P | 0.559 | 0.724 | 0.586 | ||
| 治疗1 mo后 | 研究组 | 31 | 53.12±5.09 | 31.26±4.23 | 1.17±0.19 |
| 对照组 | 31 | 49.46±4.32a | 27.14±3.58a | 1.02±0.13a | |
| t | 3.052 | 4.140 | 3.628 | ||
| P | 0.003 | <0.001 | 0.001 | ||
| 治疗3 mo后 | 研究组 | 31 | 52.07±4.65 | 30.38±3.47 | 1.12±0.14 |
| 对照组 | 31 | 47.19±3.84a | 25.94±2.63a | 0.95±0.10a | |
| t | 4.506 | 5.678 | 5.502 | ||
| P | <0.001 | <0.001 | <0.001 |
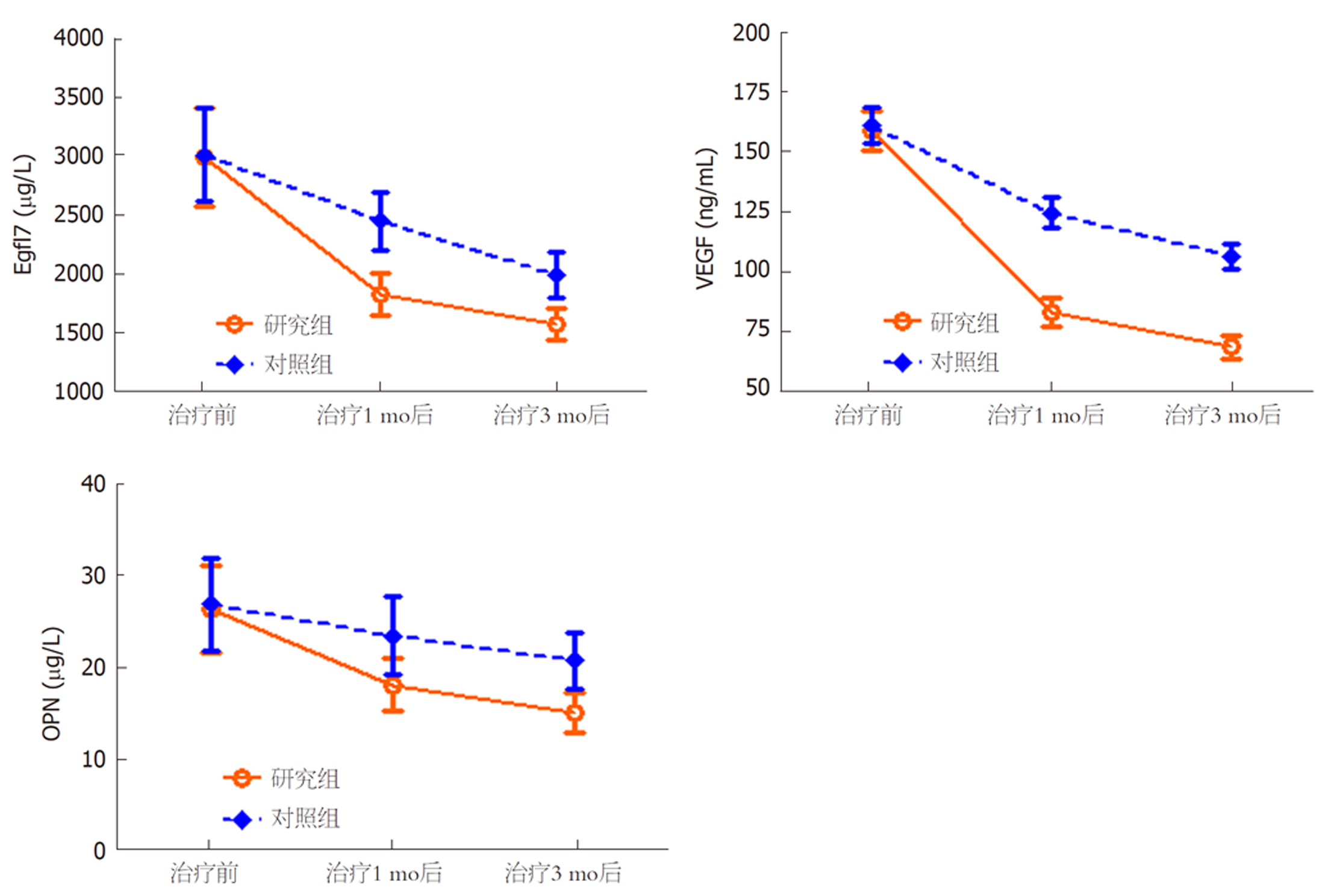
两组治疗前血清Egfl7、VEGF、OPN水平相比, 差异无统计学意义(P>0.05); 治疗1 mo、3 mo后, 两组血清Egfl7、VEGF、OPN水平均较治疗前降低, 且研究组低于对照组(P<0.05). 见表4、图1.
| 时间 | 组别 | 例数 | Egfl7 (μg/L) | VEGF (ng/mL) | OPN (μg/L) |
| 治疗前 | 研究组 | 31 | 3016.85±419.27 | 159.08±8.29 | 26.52±4.86 |
| 对照组 | 31 | 3038.69±397.48 | 161.26±7.57 | 27.08±5.14 | |
| t | 0.211 | 1.081 | 0.441 | ||
| P | 0.834 | 0.284 | 0.661 | ||
| 治疗1 mo后 | 研究组 | 31 | 1847.58±176.29a | 83.42±5.03a | 18.21±2.87a |
| 对照组 | 31 | 2473.97±246.84a | 124.85±6.36a | 23.62±4.29a | |
| t | 11.498 | 28.448 | 5.836 | ||
| P | <0.001 | <0.001 | <0.001 | ||
| 治疗3 mo后 | 研究组 | 31 | 1592.84±137.26a | 69.06±3.84a | 15.14±2.21a |
| 对照组 | 31 | 2015.96±194.52a | 106.91±5.13a | 20.87±3.16a | |
| t | 9.896 | 32.887 | 8.273 | ||
| P | <0.001 | <0.001 | <0.001 |
两组治疗前VAS、QOL-LC评分相比, 差异无统计学意义(P>0.05); 治疗1 mo、3 mo后, 两组VAS评分均较治疗前降低, 且研究组低于对照组, QOL-LC评分均较治疗前提高, 且研究组高于对照组(P<0.05). 见表5.
肝细胞癌具有恶性程度高、预后差的特点, 积极探寻改善患者预后的治疗方案, 一直是临床研究的重点之一. 目前临床治疗本病的方法呈多样化, 较常用的有肿瘤根治术、TACE等, 对于具备手术指征的患者, 应首选根治术治疗, 而术后通过TACE可进一步杀死残留肿瘤细胞, 有效抑制肿瘤进展、复发, 该治疗方案的疗效已获得国内外普遍认可[14,15].
近年来, 肝癌的靶向治疗和免疫治疗取得了飞跃进展, 使得肝癌患者预后得到明显改善. 肿瘤免疫逃逸是恶性肿瘤发生发展的重要机制, 程序性死亡分子1(programmed death-1, PD-1)是目前研究较多的免疫抑制分子, 属于CD28家族的成员, 是表达于活化T淋巴细胞的跨膜受体[16]. 国内外多项研究[17,18]证实PD-1通过抑制T淋巴细胞功能发挥抑制自身免疫应答的作用, 可防止自身免疫性疾病发生, PD-1与其受体配体相互作用在肿瘤免疫逃逸中发挥了重要的作用. PD-1抑制剂可阻断PD-1与其受体配体的结合, 从而重新激活T淋巴细胞, 并产生持续的抗肿瘤效应, 抑制肿瘤生长[19]. 卡瑞利珠单抗是一种新型PD-1抑制剂, 该药于2019-05-29被国家食品药品监督管理局批准上市, 用于治疗至少经过二线系统化疗的复发或难治性经典霍奇金淋巴瘤. 2019-03-06, 江苏恒瑞医药发布公告称卡瑞利珠单抗正式获得国家药品监督管理局批准, 用于接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者的治疗, 这是中国首个获批肝癌适应症的PD-1抑制剂, 标志着我国肝癌免疫治疗取得新突破[20]. 2019版国家肝癌诊疗规范也将卡瑞利珠单抗纳入肝癌治疗推荐药物[21]. 但目前关于卡瑞利珠单抗治疗肝癌的研究较少, 其临床效果仍缺乏大量数据支持. 文献报道[22]指出, 超过50%的肝癌患者存在微血管侵犯, 且微血管侵犯阳性患者的远期生存率以及无进展生存时间均明显低于微血管侵犯阴性患者. 因此将微血管侵犯纳入肝癌患者的治疗研究中, 对于评估疗效具有重要意义. 本研究发现, 伴微血管侵犯肝细胞癌患者根治术后采用TACE治疗, 患者血清CD3+、CD4+、CD4+/CD8+水平均呈逐渐降低趋势, 提示TACE治疗可加重机体免疫功能紊乱, 而联合应用卡瑞利珠单抗能明显抑制血清CD3+、CD4+、CD4+/CD8+水平降低, 可见卡瑞利珠单抗在改善患者细胞免疫功能方面具有明显优势, 可有效增强T淋巴细胞活性, 并产生持续的抗肿瘤效应, 抑制肿瘤生长, 从而明显下调血清CA199、AFP、CEA水平, 减轻患者疼痛程度, 提高生活质量. 本研究还发现, 卡瑞利珠单抗配合TACE可进一步下调患者血清Egfl7、VEGF、OPN水平, 其中Egfl7属于分泌型蛋白, 可有效提高血管内皮和成纤维细胞迁移能力, 经定向趋化信号刺激, 是导致肿瘤侵袭转移的重要始动因素之一[23]. VEGF是肿瘤血管生成的主要推动因子, 其水平升高具有促进肿瘤细胞增殖作用[24]. OPN是一种黏附性的基化磷蛋白, 可促进肿瘤细胞的生长、侵袭, 且能刺激肿瘤内的血管生成[25]. 由此可见, 联合应用卡瑞利珠单抗可有效抑制肝癌细胞的增殖、侵袭转移, 这可能也是其抗肿瘤机制之一. 然而, 本研究发现加用卡瑞利珠单抗会明显增加反应性毛细血管增生症发生率, 发热、贫血发生率也有一定提高, 但上述不良反应大多数为轻微反应, 患者耐受性良好, 不影响治疗顺利进行. 本研究通过随访发现, 联合应用卡瑞利珠单抗并未明显降低术后复发率, 这可能与本研究样本量少、随访时间短有关, 有待进一步探讨.
综上可知, 卡瑞利珠单抗配合TACE能明显改善伴微血管侵犯肝细胞癌患者根治术后细胞免疫功能, 进一步下调血清肿瘤标志物水平, 抑制肿瘤的增殖、侵袭、转移, 减轻患者疼痛程度, 提高生活质量, 且药物不良反应在患者可耐受程度内, 是一种安全有效的治疗方案. 本研究仍存在一定不足之处, 如研究对象选取范围狭窄, 一定程度限制了研究结果的泛化, 有待通过多中心、大样本研究进一步探讨.
肝癌根治术是治疗肝癌的主要手段, 但是有不能完全清楚的局限性, 这对患者术后的恢复以及生存质量造成很大影响. 肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)技术以控制肿瘤复发, 但整体疗效仍有待提高, 同时卡瑞利珠单抗可以用于晚期肝癌的治疗, 可延长患者的生存期限.
本研究主要针对伴微血管侵犯肝癌患者根治术后癌细胞残留的问题, 通过TACE技术与靶向药物卡瑞利珠单抗的联合进一步清除残余的癌细胞, 促进患者术后的恢复.
通过卡瑞利珠单抗配合TACE对伴微血管侵犯肝细胞癌患者根治术后的治疗, 下调了血清中表皮生长因子域7 (epidermal growth factor-like domain 7, Egfl7)、血管内皮生长因子(vascular epithelial growth factor, VEGF)、骨桥蛋白(osteopontin, OPN)的水平, 降低了肝癌的复发率, 为延长伴微血管侵犯肝癌患者生存期以及生活质量具有进一步的意义.
本文采用了临床实验、数据分析和调查等方法进行研究. 优势在于靶向药物与传统技术的相结合, 在术后TACE清除的基础上, 基因不采取靶向性药物的双重杀伤, 已达到消灭癌细胞的目的.
治疗1 mo、3 mo后, 研究组血清CA199、AFP、CEA、Egfl7、VEGF、OPN水平低于对照组. 研究组血清CD3+、CD4+、CD4+/CD8+水平高于对照组. 研究组VAS评分低于对照组, QOL-LC评分高于对照组. 研究组反应性毛细血管增生症发生率高于对照组.
本研究发现卡瑞利珠单抗配合TACE能明显改善伴微血管侵犯肝细胞癌患者根治术后细胞免疫功能, 进一步下调血清肿瘤标志物水平,且药物不良反应在患者可耐受程度内, 是一种安全有效的治疗方案. 该方法在抑制肝癌的增殖、侵袭、转移, 减轻患者疼痛程度, 提高生活质量上具有较大的应用价值, 由于癌细胞有共有的信号通路控制, 因此可能对其他相关癌症的治疗也有一定的借鉴.
本研究仍存在一定不足之处, 如研究对象选取范围狭窄, 一定程度限制了研究结果的泛化, 有待通过多中心、大样本研究进一步探讨.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑: 张砚梁
| 1. | 李 国辉, 郝 志英, 陈 喆, 柴 丽敏, 周 海燕, 刘 广宣, 戴 媛媛, 刘 江, 黄 红兵, 徐 珽, 黄 萍, 翟 青, 王 晨, 刘 玉国, 张 文周, 刘 向红, 蒋 刚, 曹 俊岭, 王 丽霞, 刘 国强, 孙 言才, 姜 明燕, 吕 永宁, 卢 晓阳, 刘 茂柏, 梁 宁生, 宋 燕青, 李 朋梅, 董 梅, 姚 敦武, 李 桂茹, 孔 树佳, 谢 瑞祥, 王 建华, 魏 青, 贾 乐川, 李 玫, 孟 珺, 曹 舫, 张 雯, 孙 永琨, 鄢 丹, 白 在先, 戴 助, 赫 捷. 抗肿瘤药物处方审核专家共识--肝癌. 中国药学杂志. 2019;54:1539-1542. [DOI] |
| 2. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 6. | Qin S, Ren Z, Meng Z, Chen Z, Chai X, Xiong J, Bai Y, Yang L, Zhu H, Fang W, Lin X, Chen X, Li E, Wang L, Chen C, Zou J. Camrelizumab in patients with previously treated advanced hepatocellular carcinoma: a multicentre, open-label, parallel-group, randomised, phase 2 trial. Lancet Oncol. 2020;21:571-580. [PubMed] [DOI] |
| 9. | 李 栩聪, 林 谦益, 陶 克奇, 麦 永钜. 不同Child-Pugh分级的原发性肝癌并发食管静脉曲张破裂出血套扎术后患者的生存分析. 分子影像学杂志. 2018;41:77-80. [DOI] |
| 11. | Thuluvath PJ, Thuluvath AJ, Savva Y. Karnofsky performance status before and after liver transplantation predicts graft and patient survival. J Hepatol. 2018;69:818-825. [DOI] |
| 12. | Sung YT, Wu JS. The Visual Analogue Scale for Rating, Ranking and Paired-Comparison (VAS-RRP): A new technique for psychological measurement. Behav Res Methods. 2018;50:1694-1715. [PubMed] [DOI] |
| 14. | Korean Liver Cancer Association; National Cancer Center. 2018 Korean Liver Cancer Association-National Cancer Center Korea Practice Guidelines for the Management of Hepatocellular Carcinoma. Gut Liver. 2019;13:227-299. [PubMed] [DOI] |
| 15. | 四川大学华西医院肝癌MDT团队. 肝细胞肝癌全程多学科规范化管理: 华西医院多学科专家共识(第二版). 中国普外基础与临床杂志. 2020;27:1062-1077. |
| 16. | Sato H, Jeggo PA, Shibata A. Regulation of programmed death-ligand 1 expression in response to DNA damage in cancer cells: Implications for precision medicine. Cancer Sci. 2019;110:3415-3423. [PubMed] [DOI] |
| 17. | Alsaab HO, Sau S, Alzhrani R, Tatiparti K, Bhise K, Kashaw SK, Iyer AK. PD-1 and PD-L1 Checkpoint Signaling Inhibition for Cancer Immunotherapy: Mechanism, Combinations, and Clinical Outcome. Front Pharmacol. 2017;8:561. [PubMed] [DOI] |
| 19. | Fang W, Yang Y, Ma Y, Hong S, Lin L, He X, Xiong J, Li P, Zhao H, Huang Y, Zhang Y, Chen L, Zhou N, Zhao Y, Hou X, Yang Q, Zhang L. Camrelizumab (SHR-1210) alone or in combination with gemcitabine plus cisplatin for nasopharyngeal carcinoma: results from two single-arm, phase 1 trials. Lancet Oncol. 2018;19:1338-1350. [PubMed] [DOI] |
| 20. | Qin SK, Ren ZG, Meng ZQ, Chen ZD, Chai XL, Xiong JP, Bai YX, Yang L, Zhu H, Fang WJ, Lin XY, Chen XM, Li EX, Xia Y, Zou JJ. A randomized multicentered phase II study to evaluate SHR-1210 (PD-1 antibody) in subjects with advanced hepatocellular carcinoma (HCC) who failed or intolerable to prior systemic treatment. Ann Oncol. 2018;29:719-720. [DOI] |