修回日期: 2020-12-29
接受日期: 2021-01-25
在线出版日期: 2021-02-28
胃癌(Gastric cancer, GC)是人类消化系统最常见的癌症类型, 发生局部或全身转移是导致患者预后差的主要原因. 微小RNA(microRNA, miRNA)是胃癌发生发展的重要调控因子. 然而, miR-139-5p对胃癌细胞侵袭和转移的影响及机制尚不清楚.
探究miR-139-5p靶向p21活化的激酶5(PAK5)基因调控Wnt/β-catenin信号通路对胃癌细胞侵袭和迁移的影响.
采用实时荧光定量PCR(qRT-PCR)和Western blot分别检测永生化胃黏膜细胞GES1和不同胃癌细胞SGC-7901、AGS和BGC-823中miR-139-5p和PAK5的表达情况; 在胃癌SGC-7901细胞中转染miR-139-5p mimics, qRT-PCR检测转染效果; Transwell侵袭和划痕实验检测过表达miR-139-5p对SGC-7901细胞侵袭和迁移能力的影响; 双荧光素酶报告基因实验和Western blot检测miR-139-5p对PAK5的靶向调控关系; Western blot检测过表达miR-139-5p对Wnt/β-catenin信号通路激活的影响.
胃癌细胞中miR-139-5p的表达水平明显低于正常胃黏膜细胞(P<0.05), 而PAK5 mRNA和蛋白表达水平均明显高于正常胃黏膜细胞(P<0.05); 转染miR-139-5p mimics能够上调SGC-7901细胞中miR-139-5p的表达; 过表达miR-139-5p可明显抑制SGC-7901细胞侵袭和迁移能力; 双荧光素酶报告基因实验和Western blot检测结果显示, miR-139-5p可靶向负调控PAK5的表达; 过表达miR-139-5p后, SGC-7901细胞中Wnt3a、β-连环蛋白(β-catenin)、细胞周期蛋白D1(CyclinD1)蛋白表达均明显下调.
miR-139-5p靶向PAK5并通过阻断Wnt/β-catenin信号通路抑制胃癌细胞侵袭和迁移能力.
核心提要: miR-139-5p在胃癌细胞中低表达, miR-139-5p靶向负调控PAK5, 过表达miR-139-5p靶向抑制PAK5并阻断Wnt/β-catenin信号通路抑制胃癌细胞的侵袭和迁移.
引文著录: 何璠, 郑伟伟, 陈冰冰, 曾耀明. miR-139-5p靶向PAK5基因通过Wnt/β-catenin信号通路对胃癌细胞侵袭和迁移的影响. 世界华人消化杂志 2021; 29(4): 174-181
Revised: December 29, 2020
Accepted: January 25, 2021
Published online: February 28, 2021
Gastric cancer (GC) is the most common type of cancer of the digestive system. Local or systemic metastasis is the main cause of poor prognosis. MicroRNAs (miRNAs) are an important regulatory factor in the development of gastric cancer. However, the effect and mechanism of miR-139-5p on the invasion and metastasis of gastric cancer cells are still unclear.
To explore the effect of miR-139-5p on the invasion and migration of gastric cancer cells and the underlying mechanism.
Real-time fluorescent quantitative PCR (qRT-PCR) and Western blot were used to detect the expression of miR-139-5p and PAK5, respectively, in immortalized gastric mucosal cell line GES1 and gastric cancer cell lines SGC-7901, AGS, and BGC-823. MiR-139-5p mimic was transfected into gastric cancer SGC-7901 cells, and qRT-PCR was used detect the transfection efficiency. Transwell invasion and scratch assays were used to detect the effect of overexpression of miR-139-5p on the invasion and migration of SGC-7901 cells. Dual luciferase reporter gene assay and Western blot were used to detect the targeted regulation of miR-139-5p on PAK5. Western blot was used to detect the effect of overexpression of miR-139-5p on the activation of Wnt/β-catenin signaling pathway.
The expression level of miR-139-5p in gastric cancer cells was significantly lower than that of normal gastric mucosal cells (P < 0.05), and the expression of PAK5 mRNA and protein was significantly higher than that of normal gastric mucosal cells (P < 0.05). Transfection of miR-139-5p mimic up-regulated the expression of miR-139-5p in SGC-7901 cells. Overexpression of miR-139-5p significantly inhibited the invasion and migration of SGC-7901 cells. The results of dual luciferase reporter gene assay and Western blot showed that miR-139-5p can target and negatively regulate the expression of PAK5. After overexpression of miR-139-5p, the expression of Wnt3a, β-catenin, and Cyclin D1 proteins in SGC-7901 cells was significantly down-regulated.
MiR-139-5p inhibits the invasion and migration of gastric cancer cells by targeting the PAK5 gene to block the Wnt/β-catenin signaling pathway.
- Citation: He F, Zheng WW, Chen BB, Zeng YM. MiR-139-5p inhibits invasion and migration of gastric cancer cells by targeting PAK5 gene to block Wnt/β-catenin signaling pathway. Shijie Huaren Xiaohua Zazhi 2021; 29(4): 174-181
- URL: https://www.wjgnet.com/1009-3079/full/v29/i4/174.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i4.174
胃癌是最常见的上皮恶性肿瘤, 也是全球癌症相关死亡的第二大原因[1]. 胃癌治疗是一个综合过程, 涉及手术、放射治疗和化疗等, 胃癌患者接受根治性切除术, 但由于癌细胞的侵袭性和转移性, 导致患者的5年生存率很低[2]. 因此, 更好地了解胃癌的发病机制并探索新的治疗靶点是胃癌临床治疗的当务之急. 微小RNA(microRNA, miRNA)是由18-25个核苷酸组成的一类小的、内源性非编码RNA, 其可通过结合靶mRNA的3'-非翻译区(3'-untranslated region, 3'-UTR)起作用, 导致靶mRNA降解或翻译抑制. 据报道, 异常表达的miRNA通过影响细胞增殖、侵袭和迁移等与癌症的发生相关[3,4]. 因此, 研究miRNA的功能可能为开发癌症的新治疗策略提供理论基础. 研究表明[5-7], miR-139-5p是一种潜在的调节性miRNA, 在包括结膀胱癌、卵巢癌和肺癌等恶性肿瘤中表达下调, 发挥抑癌因子的作用. 之前的研究显示, miR-139-5p在胃癌组织中呈低表达, 其低表达与患者TNM分期、淋巴结转移等密切相关[8]. 但未见关于miR-139-5p对人胃癌细胞侵袭和迁移能力影响作用机制的研究. p21活化的激酶5(p21-Activated kinase 5, PAK5)基因又称PAK7, 是一种致癌基因, 在促进肿瘤发生中的细胞迁移和侵袭方面具有至关重要的作用[9]. 目前研究已证实, Wnt/β-catenin信号通路参与肿瘤的发生和发展过程[10]. 本研究旨在揭示miR-139-5p对胃癌细胞侵袭和迁移的影响, 并探究其对PAK5的靶向调控及可能的作用机制, 以期为发掘胃癌的治疗新靶点提供实验依据.
细胞和主要试剂: 人胃黏膜细胞株GES1及人胃癌细胞株SGC-7901、AGS和BGC-823均为美国ATCC产品; PRIM-1640培养基为美国HyClone公司产品; RNA提取试剂盒为北京天根公司产品; Transwell小室和Matrigel基质胶均为美国Coring公司产品; miR-139-5p mimics和阴性对照mimis control(引用文献[11])均为广州市锐博生物公司产品; 脂质体Lipofectamine 2000试剂为美国Invitogen公司产品; 荧光素酶报告基因载体及Dual-Luciferase荧光素酶报告基因检测试剂盒均为美国Promega公司成品; PAK5-Wt及PAK5-Mut重组荧光素酶报告基因载体均为上海生工生物工程有限公司产品; 鼠抗人PAK5、Wnt3a、β-catenin、Cyclin D1和内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体均为美国CST公司产品; 山羊抗鼠二抗为北京中杉金桥生物技术有限公司产品.
1.2.1 细胞培养: 人正常胃黏膜细胞GES1和胃癌细胞SGC-7901、AGS和BGC-823均培养在含10%胎牛血清的PRIM-1640培养基中, 培养液中含1×103 U/mL青霉素和100 mg/L链霉素双抗, 将细胞放置在体积分数5%CO2、37 ℃恒温培养中, 并将相对湿度设置为95%. 每隔1 d换液1次, 每隔2 d传代一次.
1.2.2 细胞转染和分组: 对数期SGC-7901细胞以胰蛋白酶消化, 在转染前1 d种植到6孔板中, 放置在37 ℃培养箱过夜培养, 待细胞达50%-60%融合时, 参照Lipofectamine 2000制造商说明书分别将miR-139-5p mimics或阴性对照mimis control转染至SGC-7901细胞, 分别命名为miR-139-5p组和miR-NC组, 同时设置空白对照记为Control组.
1.2.3 qRT-PCR检测miR-139-5p以及PAK5 mRNA的表达: 收集对数生长期的正常胃黏膜细胞GES1和胃癌细胞SGC-7901、AGS、BGC-823以及转染48 h后各组SGC-7901细胞, 以RNA提取试剂盒提取RNA. 合成第一链cDNA. 以U6为内参, 使用实时荧光定量PCR检测试剂盒检测细胞中miR-139-5p相对表达量, 以β-actin为内参检测细胞中PAK5 mRNA相对表达量. 所用引物序列: miR-139-5p正向引物为5'-GCCTCTACAGTGCACGTGTCTC-3'; 反向引物为5'-CGCTGTTCTCATCTGTCTCGC-3'. U6正向引物为5'-GCTTCGGCAGCACATATACTAAAAT-3'; 反向引物为5'-CGCTTCACGAATT TGCGTGTCAT-3'. PAK5正向引物为5'-GGCGTCCTCTTGTGTCTTC-3'; 反向引物为5'-GTACTGAGTCCTTCTGATTTGC-3'. β-actin正向引物为5'-GTGGACATCCGCAAAGAC-3'; 反向引物为5'-AAAGGGTGTAACGCAACTA-3'. 采用2-△△Ct法分析基因表达量.
1.2.4 Western blot检测蛋白表达: 收集GES1、SGC-7901、AGS、BGC-823和转染48 h后各组SGC-7901细胞, 提取蛋白质, BCA法测定蛋白浓度, 电泳分离蛋白, 转膜膜, 封闭, 洗膜并加入一抗, PAK5一抗稀释比1:500、Wnt3a一抗稀释比1:800、β-catenin一抗稀释比1:800、Cyclin D1一抗稀释比1:800, 4 ℃孵育过夜, 再加入稀释比1:300的二抗, 室温孵育2 h, 采用ECL化学法显影曝光条带, 采用GAPDH进行表达, 用Image J软件计算条带灰度值.
1.2.5 Transwell侵袭实验检测细胞侵袭能力: 用稀释的Matrigel胶包被Transwell小室的上室. 转染48 h后各组SGC-7901细胞以无血清培养液洗涤并调整密度为1×105个/mL, 上室添加100 μL细胞悬液, 下室添加含10%胎牛血清培养液500 μL, 培养24 h. PBS冲洗小室, 拭去上室膜的细胞, 多聚甲醛固, 结晶紫染色, 计数穿膜至小室的细胞数.
1.2.6 细胞划痕实验检测细胞迁移能力: 转染48 h后各组SGC-7901细胞以胰酶消化, 铺板6孔板, 待细胞贴壁后呈单层汇合时, 使用无菌枪头做划痕, 观察并记录划痕距离, 继续培养24 h后, 再次观察并记录划痕宽度, 细胞迁移率(%) = (0 h划痕距离-24 h划痕距离)/0 h划痕距离×100%.
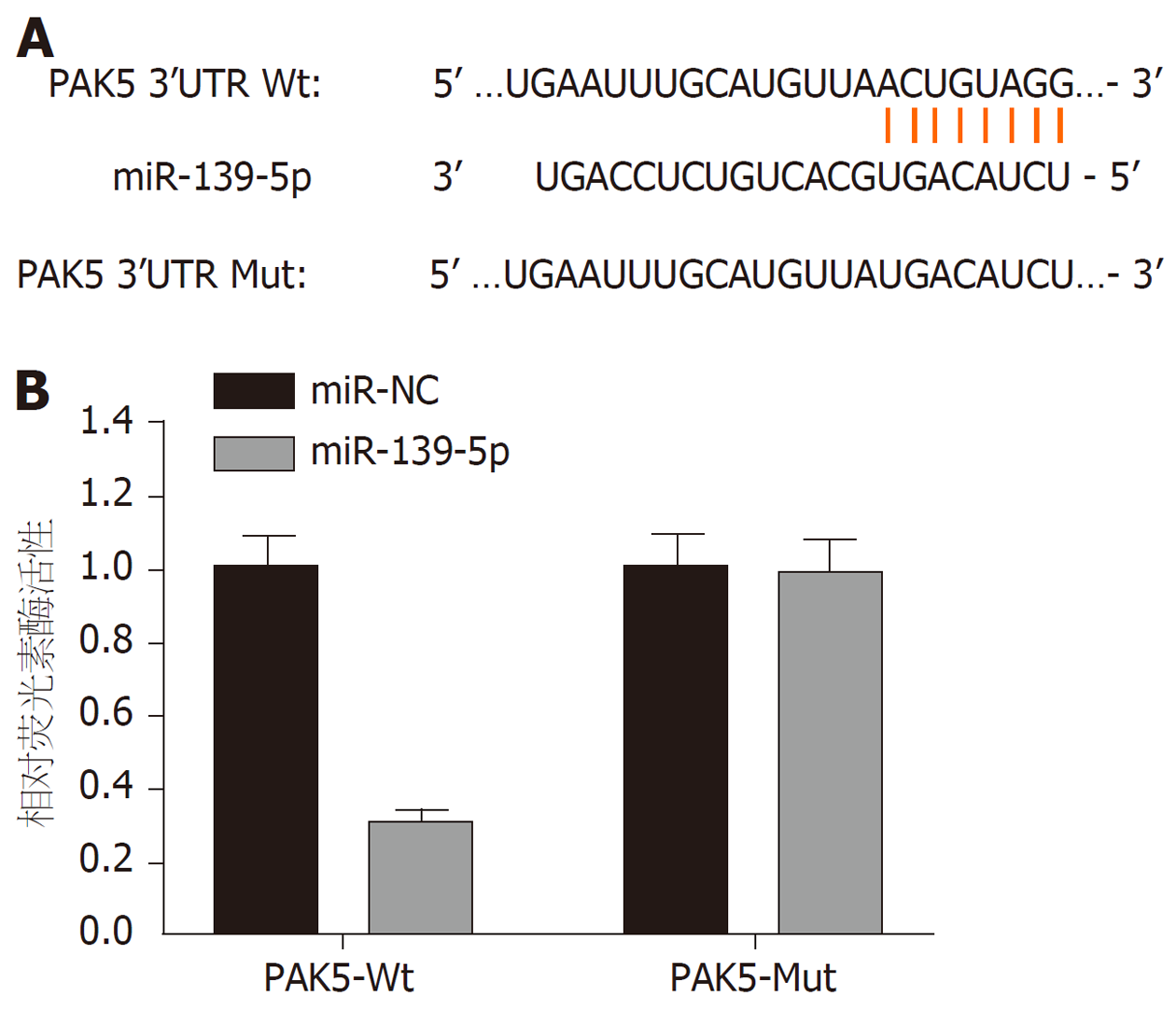
1.2.7 双荧光素酶报告基因实验: TargetScan在线软件预测显示miR-139-5p和PAK5 3'UTR上存在相互结合碱基位点, 提示PAK5可能是miR-139-5p下游的靶基因. 分别将野生型PAK5-Wt和突变型PAK5-Mut重组荧光素酶报告基因载体与miR-139-5p mimics及对照共转染SGC-7901细胞, 培养48 h, 使用双荧光素酶报告基因检测系统测定细胞的相对荧光素酶活性.
统计学处理 采用SPSS 21.0版软件进行统计分析, 以上实验重复3次, 实验数据以mean±SD表示, 采用单因素方差分析比较多组间差异, 采用SNK-q检验分析两两组间差异, 以P<0.05表示差异具有统计学意义.
TargetScan在线软件预测发现, miR-139-5p与PAK5 3'UTR序列之间具有靶向结合位点, 表明PAK5可能是miR-139-5p的直接靶基因. 本实验双荧光素酶报告基因实验检测结果发现, 过表达miR-139-5p后, PAK5-Wt细胞相对荧光素酶活性明显下将(P<0.05), 而PAK5-Mut细胞相对荧光素酶活性无显著变化. 见图1. 提示miR-139-5p和PAK5存在靶向关系.
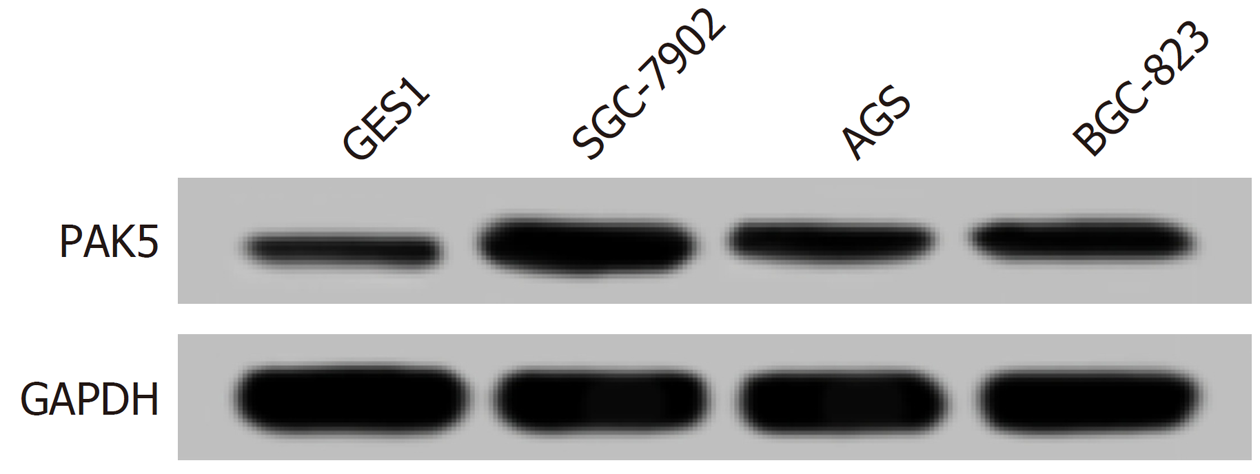
qRT-PCR和Western blot结果显示, 胃癌细胞SGC-7901、AGS和BGC-823中miR-139-5p的表达水平明显低于正常胃黏膜细胞GES1(P<0.05), 而PAK5 mRNA和蛋白的表达显著高于胃黏膜细胞(P<0.05). 实验结果显示, 胃癌SGC-7901细胞中miR-139-5p的表达水平最低, PAK5的表达水平最高. 见图2和表1所示. 因此选用胃癌SGC-7901细胞为研究对象进行后续实验探究.
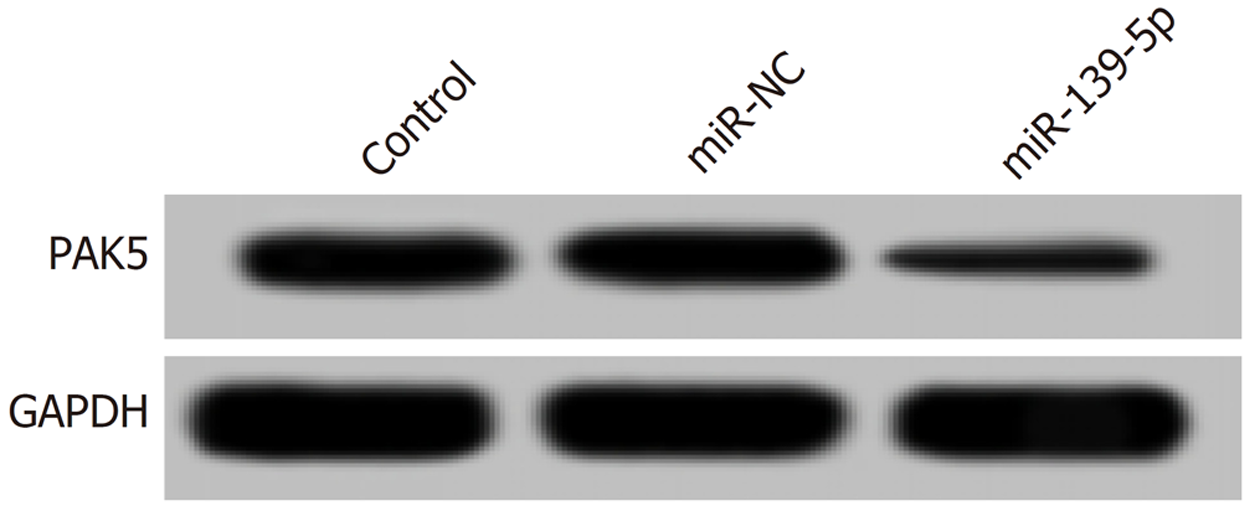
qRT-PCR结果显示, 与miR-NC组比较, 胃癌SGC-7901细胞转染miR-139-5p mimics后, miR-139-5p组中miR-139-5p表达水平明显升高(P<0.05), 而Control组中miR-139-5p表达水平无无明显变化. Western blot检测发现, 与miR-NC组相比, miR-139-5p组中PAK5蛋白表达显著降低(P<0.05), 而Control组细胞中PAK5蛋白表达水平无明显变化. 见表2和图3所示. 表明在SGC-7901细胞转染miR-139-5p mimics能够有效上调miR-139-5p的表达, 且miR-139-5p能够靶向负调控PAK5蛋白表达.
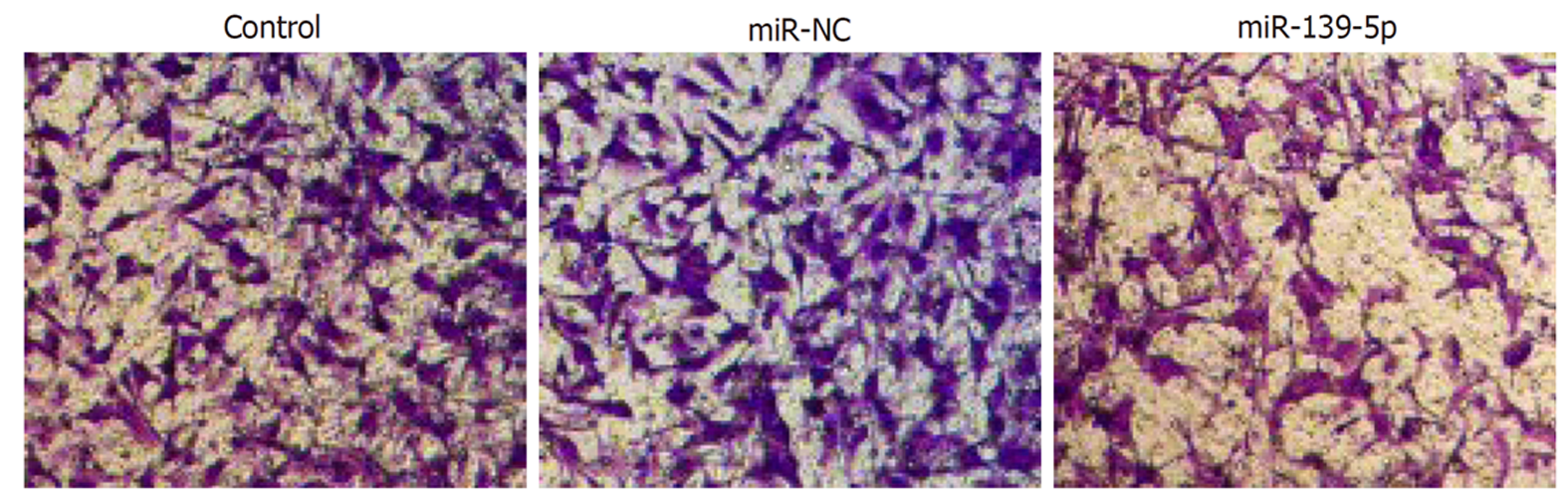
Transwell实验发现, 与miR-NC组相比, miR-139-5p组中穿膜细胞数显著减少(P<0.05), 而Control组穿膜细胞数无明显变化. 见图4和表3所示. 表明过表达miR-139-5p能够有效抑制胃癌SGC-7901细胞侵袭能力.
| 组别 | 穿膜细胞数 |
| Control | 202.15±15.30 |
| miR-NC | 196.42±14.86 |
| miR-139-5p | 91.04±7.29a |
| F值 | 207.999 |
| P值 | 0.000 |
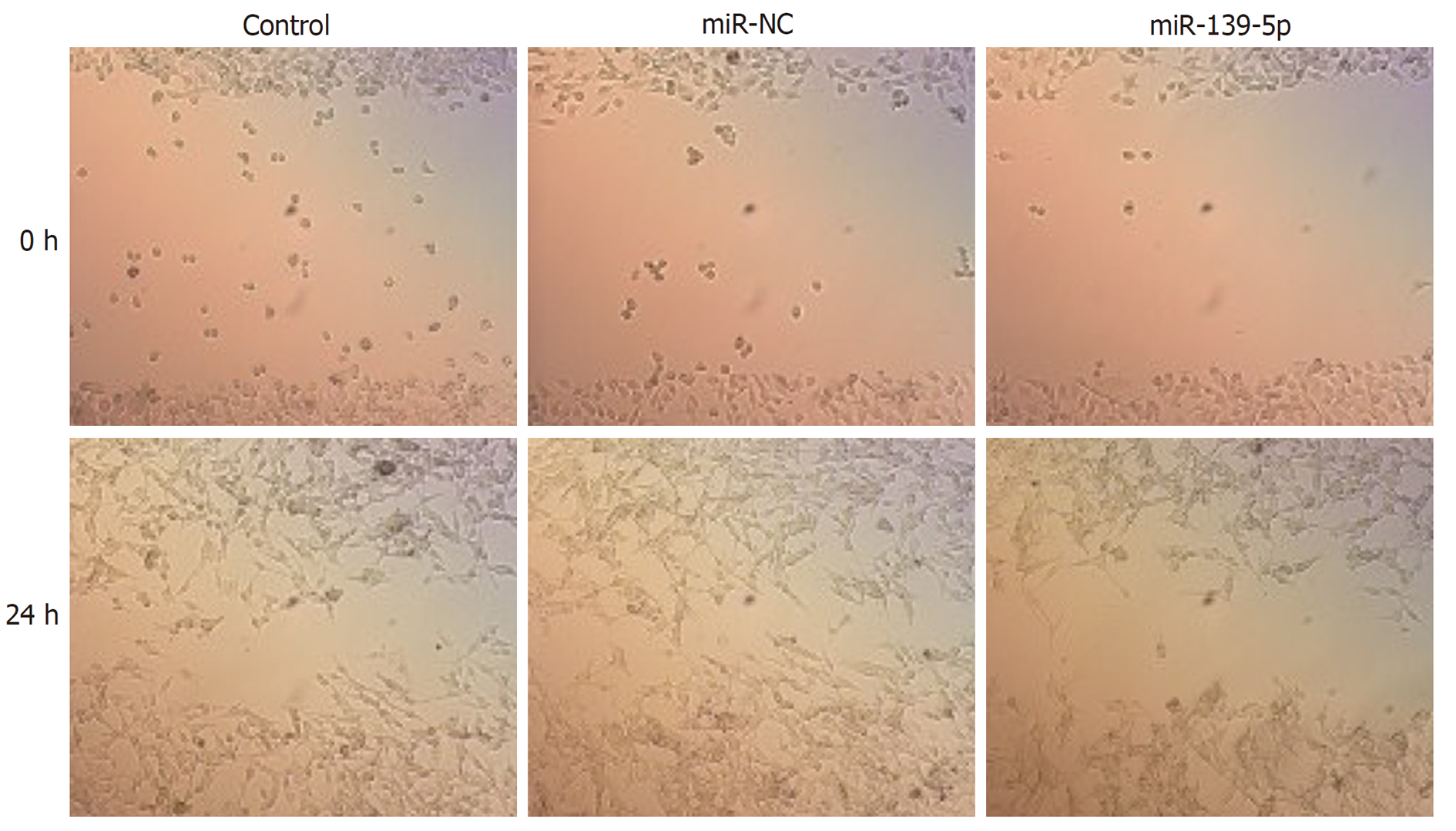
划痕实验结果显示, 与miR-NC组比较, miR-139-5p组细胞迁移率明显降低(P<0.05), 而Control组细胞迁移率无明显变化. 见图5和表4所示. 表明过表达miR-139-5p可明显抑制胃癌SGC-7901细胞的迁移.
| 组别 | 细胞迁移率(%) |
| Control | 67.64±5.16 |
| miR-NC | 65.88±5.22 |
| miR-139-5p | 32.79±4.02a |
| F值 | 148.592 |
| P值 | 0.000 |
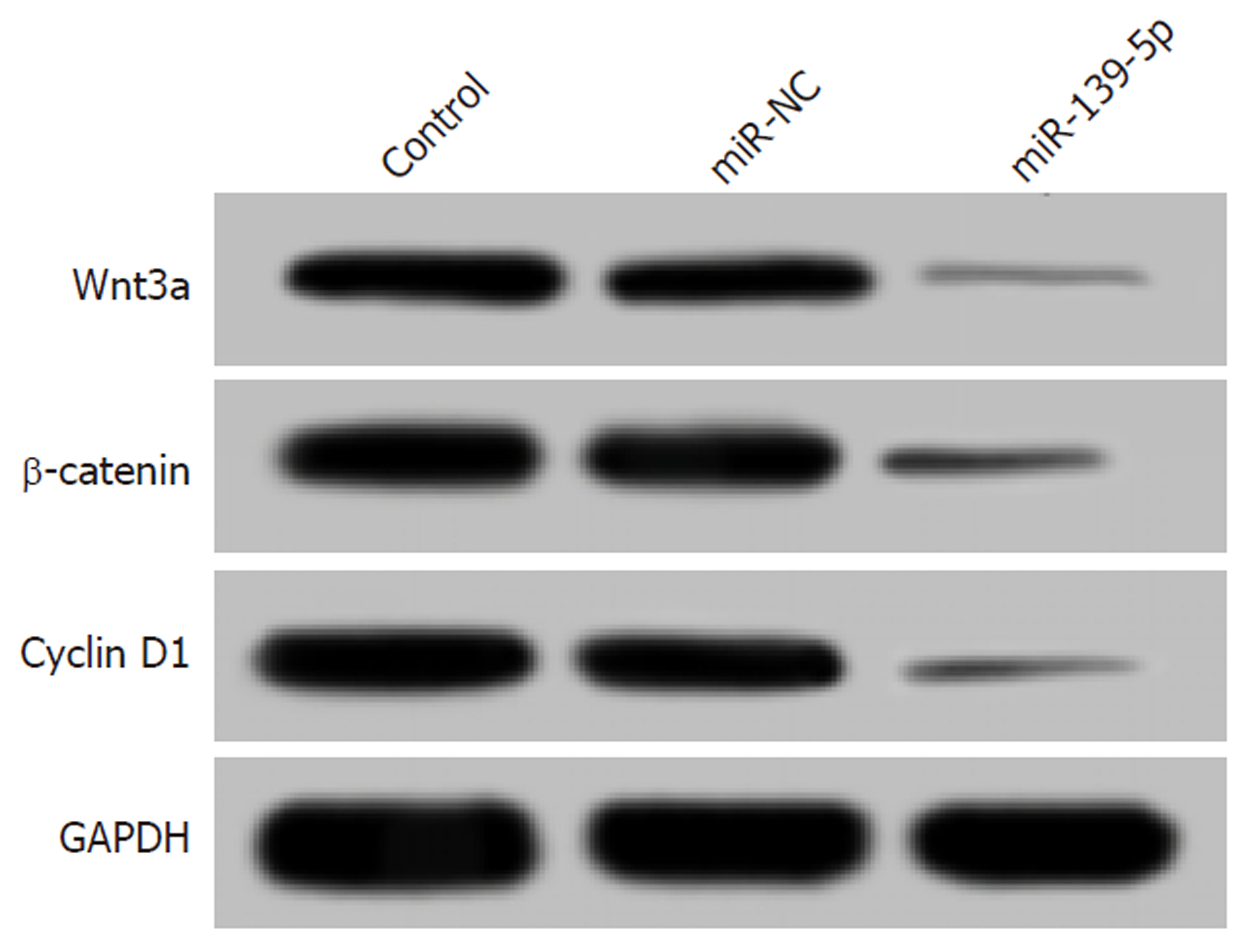
Western blot结果显示, 与miR-NC组比较, miR-139-5p组细胞中Wnt3a、β-catenin和Cyclin D1蛋白表达水平明显降低(P<0.05), 而Control组细胞中Wnt3a、β-catenin和Cyclin D1蛋白表达水平无明显变化. 见图6和表5. 说明过表达miR-139-5p能够有效阻断Wnt/β-catenin信号通路的激活.
胃癌是第三大最常见的癌症类型, 也是中国癌症相关死亡的主要原因之一. 侵袭和转移是恶性肿瘤的主要生物学特征, 也是手术、放疗和化疗失败的主要原因[12]. 因此, 探究胃癌侵袭和转移的机制对开发有效治疗胃癌的策略具有重要意义. 近几十年来, miRNA在肿瘤发生发展、转移及肿瘤诊断和治疗等方面的作用受到广大学者的极大关注[13]. miR-139-5p在人类多种类型肿瘤中呈低表达, 且抑制肿瘤细胞侵袭和迁移[13-16]. 最近Zhang等人[17]研究显示, miR-139-5p靶向调控SLC39A7, 并通过Akt/mTOR信号通路影响胃癌细胞的增殖、迁移和凋亡. Hou等人[18]研究结果显示, miR-139-5p的过度表达显著抑制了胃癌细胞的生长和增殖, 并抑制了裸鼠移植胃癌细胞的肿瘤生长, 机制研究显示, miR-139-5p可通过靶向NF-κB信号通路负性调节PMP22的表达影响胃癌的进展. 以往研究显示[17,18], miR-139-5p在胃癌中能够抑制侵袭和迁移, 然而其潜在机制仍需深入探究. 本实验qRT-PCR检测结果发现, 与以往研究一致, 3株胃癌细胞系中miR-139-5p的表达量显著低于正常胃黏膜细胞系, 这提示miR-139-5p可能在胃癌中发挥抑癌基因的作用.
本实验在miR-139-5p基础表达量最低的胃癌SGC-7901细胞中转染miR-139-5p mimics来探究其对胃癌细胞侵袭和迁移的影响, Transwell及划痕实验发现, 过表达miR-139-5p后, SGC-7901细胞侵袭和迁移能力显著降低. miRNA通常通过调控靶基因发挥其生物学功能, 本实验通过生物信息学方法预测了miR-139-5p的潜在基因效应子, 结果显示PAK5基因3'UTR区域有miR-139-5p的靶向结合序列. 本实验双荧光素酶报告基因实验结果显示PAK5为miR-139-5p的靶基因, 且miR-139-5p可负向调控PAK5蛋白表达. PAK5是最近发现的PAK家族成员, 在膀胱癌、骨肉瘤和黑色素瘤等多种肿瘤中过表达, 具有促进肿瘤行为的潜在能力[19-21]. 多项研究[22,23]发现PAK5在促进肿瘤发生中的细胞迁移和侵袭方面具有至关重要的作用. 本实验发现PAK5在胃癌细胞系中的表达明显升高, 这与以前PAK5在胃癌中高表达的研究相符. 近期Li等[24]研究表明PAK5作为一种致癌基因, 通过激活Wnt/β-catenin信号通路参与乳腺癌的进展. Wnt/β-catenin信号通路在调节多种生物过程中起着至关重要的作用, 包括细胞增殖、分化、侵袭和迁移[25]. 据报道[26,27], Wnt/β-catenin信号通路的异常激活与人类癌症的发生和发展密切相关. 在本研究中, miR-139-5p过表达导致胃癌SGC-7901细胞中Wnt/β-catenin信号通路中三个关键靶点Wnt3a、β-catenin和Cyclin D1蛋白表达水平的下调. 以上数据表明miR-139-5p能够通过直接靶向抑制PAK5的表达来阻断Wnt/β-catenin信号传导途径.
总之, 本实验结果显示, miR-139-5p在胃癌细胞中呈低表达, 过表达miR-139-5p通过负向调控PAK5的表达阻断Wnt/β-catenin信号通路的激活来阻碍胃癌细胞迁移以及侵袭能力. 然而尚未涉及PAK5功能恢复实验进行验证尚显不足, 后续实验将进行补充验证. 本实验结果提示miR-139-5p和PAK5有可能是胃癌治疗的新作用靶点.
胃癌(Gastric cancer, GC)作为消化系统常见的恶性肿瘤, 具有早期转移、晚期预后差的特点, 随着社会环境和饮食习惯的改变, 其发病率和死亡率呈上升趋势, 手术和化疗仍然是GC患者的主要治疗方法, 但疗效不佳. 鉴于目前的不利形势, 寻找一种对胃癌的诊断和治疗具有高度敏感性的生物标志物对胃癌患者具有重要的临床意义. 近年来, 微小RNA(microRNA, miRNA)被证明可作为抑癌基因或癌前基因, 其异常表达可能与肿瘤的发生有关. 表达与肿瘤的发生和发展密切相关, 因此通常被认为是癌症诊断或治疗的目标方向. miRNA作为一种小的非编码RNA, 通过与靶基因的3'UTR结合来调控靶基因的表达. 本研究从miRNA靶向基因方面探究其对胃癌细胞侵袭和迁移的影响及潜在机制.
本研究的主题是miR-139-5p对胃癌细胞侵袭和迁移的影响, 拟解决的问题是了解miR-139-5p如何影响胃癌细胞侵袭和迁移以及其和PAK5之间的关系, 随后探究miR-139-5p在胃癌发生发展的潜在机制, 以期为胃癌临床治疗提供新的靶点.
研究的主要目标是miR-139-5p对胃癌细胞侵袭和迁移影响的机制, 研究得到miR-139-5p在胃癌细胞中呈低表达, 而PAK5呈高表达, 过表达miR-139-5p能够抑制胃癌细胞侵袭和迁移, 且miR-139-5p能够靶向负调控PAK5, 此外, 过表达miR-139-5p能够阻断Wnt/β-catenin信号通路的激活. 本研究为胃癌的治疗提供新的思路.
本研究首先通过qRT-PCR和Western blot分别检测miR-139-5p和PAK5在胃癌细胞中的表达情况, 通过转染构建过表达miR-139-5p的细胞株, Transwell和划痕实验检测细胞侵袭和迁移能力, Western blot检测Wnt/β-catenin信号通路相关蛋白表达情况, 双荧光素酶报告基因实验检测miR-139-5p和PAK5之间的靶向关系.
本研究结果是miR-139-5p在胃癌细胞中低表达, 而PAK5在胃癌细胞中异常高表达. 过表达miR-139-5p能够抑制胃癌细胞侵袭和迁移能力, 且能够靶向抑制PAK5的表达, 此外, 过表达miR-139-5p能够抑制Wnt/β-catenin信号通路的激活, 达到了本研究的目的, 对胃癌发生和发展的分子机制有了进一步的的了解, 可应用于胃癌的临床治疗.
miR-139-5p能够靶向负调控PAK5的表达, 过表达miR-139-5p可通过阻断Wnt/β-catenin信号通路抑制胃癌细胞的侵袭和迁移. 尽管关于miRNA在胃癌中的作用机制的报道很多, 但其上游和下游机制仍然难以捉摸, 这是我们未来研究的另一个目的.
本研究只在体外细胞中研究了miR-139-5p对胃癌细胞侵袭和迁移能力的影响, 未涉及体内模型实验尚显不足, 且到临床上的应用相差甚远, 因此后续实验需在小鼠体内进行验证, 并且在未来的实验中, 我们开展更多的基础实验, 以弥补我们研究的不足.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Nie Y, Wu K, Yu J, Liang Q, Cai X, Shang Y, Zhou J, Pan K, Sun L, Fang J, Yuan Y, You W, Fan D. A global burden of gastric cancer: the major impact of China. Expert Rev Gastroenterol Hepatol. 2017;11:651-661. [PubMed] [DOI] |
| 2. | Song Z, Wu Y, Yang J, Yang D, Fang X. Progress in the treatment of advanced gastric cancer. Tumour Biol. 2017;39:1010428317714626. [PubMed] [DOI] |
| 3. | Hao NB, He YF, Li XQ, Wang K, Wang RL. The role of miRNA and lncRNA in gastric cancer. Oncotarget. 2017;8:81572-81582. [PubMed] [DOI] |
| 4. | Hosseinahli N, Aghapour M, Duijf PHG, Baradaran B. Treating cancer with microRNA replacement therapy: A literature review. J Cell Physiol. 2018;233:5574-5588. [PubMed] [DOI] |
| 5. | Hu Y, Deng C, Zhang H, Zhang J, Peng B, Hu C. Long non-coding RNA XIST promotes cell growth and metastasis through regulating miR-139-5p mediated Wnt/β-catenin signaling pathway in bladder cancer. Oncotarget. 2017;8:94554-94568. [PubMed] [DOI] |
| 7. | Xu S, Yang F, Liu R, Li X, Fan H, Liu J, Wei S, Chen G, Chen J, Da Y. Serum microRNA-139-5p is downregulated in lung cancer patients with lytic bone metastasis. Oncol Rep. 2018;39:2376-2384. [PubMed] [DOI] |
| 8. | Liang WQ, Xi HQ, Liu YH, Wang LL, Zhang W, Zhuang ZW, Wang C, Cai AZ, Wu XS, Wei B, Chen L. MiR-139-5p inhibits the proliferation of gastric cancer cells by targeting Regulation of Nuclear Pre-mRNA Domain Containing 1B. Biochem Biophys Res Commun. 2020;527:393-400. [PubMed] [DOI] |
| 9. | Huo FC, Pan YJ, Li TT, Mou J, Pei DS. PAK5 promotes the migration and invasion of cervical cancer cells by phosphorylating SATB1. Cell Death Differ. 2019;26:994-1006. [PubMed] [DOI] |
| 10. | Nusse R, Clevers H. Wnt/β-Catenin Signaling, Disease, and Emerging Therapeutic Modalities. Cell. 2017;169:985-999. [PubMed] [DOI] |
| 11. | Pajic M, Froio D, Daly S, Doculara L, Millar E, Graham PH, Drury A, Steinmann A, de Bock CE, Boulghourjian A, Zaratzian A, Carroll S, Toohey J, O'Toole SA, Harris AL, Buffa FM, Gee HE, Hollway GE, Molloy TJ. miR-139-5p Modulates Radiotherapy Resistance in Breast Cancer by Repressing Multiple Gene Networks of DNA Repair and ROS Defense. Cancer Res. 2018;78:501-515. [PubMed] [DOI] |
| 12. | Goetze OT, Al-Batran SE, Chevallay M, Mönig SP. Multimodal treatment in locally advanced gastric cancer. Updates Surg. 2018;70:173-179. [PubMed] [DOI] |
| 13. | Wang H, Liu S, Jia L, Chu F, Zhou Y, He Z, Guo M, Chen C, Xu L. Nanostructured lipid carriers for MicroRNA delivery in tumor gene therapy. Cancer Cell Int. 2018;18:101. [PubMed] [DOI] |
| 14. | Du F, Cao T, Xie H, Li T, Sun L, Liu H, Guo H, Wang X, Liu Q, Kim T, Franklin JL, Graves-Deal R, Han W, Tian Z, Ge M, Nie Y, Fan D, Coffey RJ, Lu Y, Zhao X. KRAS Mutation-Responsive miR-139-5p inhibits Colorectal Cancer Progression and is repressed by Wnt Signaling. Theranostics. 2020;10:7335-7350. [PubMed] [DOI] |
| 15. | Huang LL, Huang LW, Wang L, Tong BD, Wei Q, Ding XS. Potential role of miR-139-5p in cancer diagnosis, prognosis and therapy. Oncol Lett. 2017;14:1215-1222. [PubMed] [DOI] |
| 16. | Hua S, Lei L, Deng L, Weng X, Liu C, Qi X, Wang S, Zhang D, Zou X, Cao C, Liu L, Wu D. miR-139-5p inhibits aerobic glycolysis, cell proliferation, migration, and invasion in hepatocellular carcinoma via a reciprocal regulatory interaction with ETS1. Oncogene. 2018;37:1624-1636. [PubMed] [DOI] |
| 17. | Zhang Y, Bai J, Si W, Yuan S, Li Y, Chen X. SLC39A7, regulated by miR-139-5p, induces cell proliferation, migration and inhibits apoptosis in gastric cancer via Akt/mTOR signaling pathway. Biosci Rep. 2020;40. [PubMed] [DOI] |
| 18. | Hou J, Zhuo H, Chen X, Cheng J, Zheng W, Zhong M, Cai J. MiR-139-5p negatively regulates PMP22 to repress cell proliferation by targeting the NF-κB signaling pathway in gastric cancer. Int J Biol Sci. 2020;16:1218-1229. [PubMed] [DOI] |
| 19. | Ismail AF, Oskay Halacli S, Babteen N, De Piano M, Martin TA, Jiang WG, Khan MS, Dasgupta P, Wells CM. PAK5 mediates cell: cell adhesion integrity via interaction with E-cadherin in bladder cancer cells. Biochem J. 2017;474:1333-1346. [PubMed] [DOI] |
| 20. | Han K, Zhou Y, Tseng KF, Hu H, Li K, Wang Y, Gan Z, Lin S, Sun Y, Min D. PAK5 overexpression is associated with lung metastasis in osteosarcoma. Oncol Lett. 2018;15:2202-2210. [PubMed] [DOI] |
| 21. | LaPak KM, Vroom DC, Garg AA, Guan X, Hays JL, Song JW, Burd CE. Melanoma-associated mutants within the serine-rich domain of PAK5 direct kinase activity to mitogenic pathways. Oncotarget. 2018;9:25386-25401. [PubMed] [DOI] |
| 22. | Pan YJ, Wei LL, Wu XJ, Huo FC, Mou J, Pei DS. MiR-106a-5p inhibits the cell migration and invasion of renal cell carcinoma through targeting PAK5. Cell Death Dis. 2017;8:e3155. [PubMed] [DOI] |
| 24. | Li K, Xu X, He Y, Tian Y, Pan W, Xu L, Ma Y, Gao Y, Gao J, Qi Y, Wei L, Zhang J. P21-activated kinase 7 (PAK7) interacts with and activates Wnt/β-catenin signaling pathway in breast cancer. J Cancer. 2018;9:1821-1835. [PubMed] [DOI] |
| 25. | Bahrami A, Amerizadeh F, ShahidSales S, Khazaei M, Ghayour-Mobarhan M, Sadeghnia HR, Maftouh M, Hassanian SM, Avan A. Therapeutic Potential of Targeting Wnt/β-Catenin Pathway in Treatment of Colorectal Cancer: Rational and Progress. J Cell Biochem. 2017;118:1979-1983. [PubMed] [DOI] |
| 26. | Karimaian A, Majidinia M, Bannazadeh Baghi H, Yousefi B. The crosstalk between Wnt/β-catenin signaling pathway with DNA damage response and oxidative stress: Implications in cancer therapy. DNA Repair (Amst). 2017;51:14-19. [PubMed] [DOI] |
| 27. | Katoh M, Katoh M. Molecular genetics and targeted therapy of WNT-related human diseases (Review). Int J Mol Med. 2017;40:587-606. [PubMed] [DOI] |