修回日期: 2021-09-25
接受日期: 2021-11-08
在线出版日期: 2021-12-28
原发性肝细胞癌(hepatocellular carcinoma, HCC)属于富血供恶性肿瘤, 血供状态与其发生发展密切相关. 超声造影(contrast-enhanced ultrasound, CEUS)能定量分析HCC组织微循环血流状态, 继而间接反映其病理学特征, 评估疗效, 并指导临床治疗.
探讨经导管肝动脉化疗栓塞(transcatheter artery chemoembolization, TACE)术治疗后HCC残留病灶的超声造影参数特征, 及其与血清缺氧诱导因子-1a (hypoxia inducible factor-1a, HIF-1a)的相关性.
选取接受TACE术治疗的HCC患者86例作为研究对象. 根据是否残留分为无残留组(52例)和残留组(34例). 所有患者术前3 d内, 术后30 d均行超声造影检查, 测定血流灌注参数: 最大强度(maximum intensity, IMAX), 达峰时间(time to peak, TTP), 上升时间(rise time, RT), 廓清时间(clearance time, WT). 同期, 采用酶联免疫吸附法测定血清HIF-1a与血管内皮生长因子(vascular endothelial growth factor, VEGF)水平. 比较两组患者治疗前后超声造影血流灌注参数、血清HIF-1a及VEGF水平变化.
治疗前, 两组的IMAX、RT、TTP、WT、血清HIF-1a及VEGF水平比较, 差异均无统计学意义(P>0.05); 治疗后, 无残留组的血清HIF-1a及VEGF水平较治疗前明显下降, 差异有统计学意义(P<0.05), 且超声造影显示, 病灶未见明显血流灌注; 治疗后, 残留组的血清HIF-1a及VEGF水平较治疗前明显升高, 差异有统计学意义(P<0.05); 治疗后, 残留组的IMAX较治疗前明显下降, 差异有统计学意义(P<0.05); 治疗后, 残留组的RT、TTP和WT较治疗前明显延长, 差异有统计学意义(P<0.05); 残留组治疗后, IMAX与血清HIF-1a水平呈正相关(R2 = 0.74, P<0.05), TTP、RT、WT均与血清HIF-1a水平呈负相关(R2 = 0.56, R2 = 0.42, R2 = 0.48, P<0.05).
超声造影能直观反映TACE术治疗后HCC病灶的血流灌注变化, 而残留组织的血流灌注参数(IMAX、TTP、RT、WT)与血清HIF-1a水平具有良好相关性, 可为临床综合评估TACE术疗效提供参考依据.
核心提要: 超声造影是一种纯血池示踪技术, 不仅能实时动态显示目标组织的血流灌注全程, 而且能定量分析其血流参数, 可为临床提供一种无创性疗效评估方法.
引文著录: 盛荣军, 董惠惠, 李军. TACE术后HCC残留病灶超声造影参数与缺氧诱导因子-1a的相关性. 世界华人消化杂志 2021; 29(24): 1428-1433
Revised: September 25, 2021
Accepted: November 8, 2021
Published online: December 28, 2021
Hepatocellular carcinoma (HCC) is a malignant tumor with rich blood supply. The blood supply is closely related to its occurrence and development. Contrast-enhanced ultrasound (CEUS) can quantitatively analyze the microcirculation blood flow of HCC, indirectly reflect its pathological characteristics, evaluate the curative effect, and guide clinical treatment.
To investigate the characteristics of CEUS parameters of HCC residual lesions after transcatheter artery chemoembolization (TACE), and analyze their correlation with serum hypoxia inducible factor-1a (HIF-1a).
Eighty-six HCC patients treated with TACE were selected as the subjects. They were divided into either a no residual lesion group (52 cases) or a residual lesion group (34 cases). All patients underwent CEUS within 3 d before treatment and 30 d after treatment. The following perfusion parameters were measured: Maximum intensity (IMAX), time to peak (TTP), rise time (RT), and washout time (WT). The levels of serum HIF-1a and vascular endothelial growth factor (VEGF) were measured by enzyme-linked immunosorbent assay. The changes of perfusion parameters, and serum HIF-1a and VEGF levels before and after treatment were compared between the two groups.
Before treatment, there was no significant difference in IMAX, RT, TTP, WT, or serum HIF-1a and VEGF between the two groups (P > 0.05). After treatment, the levels of serum HIF-1a and VEGF in the no residual lesion group were significantly lower than those before treatment (P < 0.05), and CEUS showed that there was no obvious perfusion in the lesions. In the residual lesion group, after treatment, the levels of serum HIF-1a and VEGF were significantly higher (P < 0.05), IMAX was significantly lower (P < 0.05), and RT, TTP, and WT were significantly longer than those before treatment (P < 0.05). After treatment, IMAX in the residual lesion group was positively correlated with the levels of HIF-1a (R2 = 0.74, P < 0.05), and TTP, RT, and WT were negatively correlated with the levels of HIF-1a (R2 = 0.56, 0.42, and 0.48, respectively; P < 0.05).
CEUS can directly reflect the changes of HCC perfusion after TACE treatment, and the perfusion parameters (IMAX, TTP, RT, and WT) of residual tissues have a good correlation with the levels of serum HIF-1a, which can provide a reference for the comprehensive evaluation of the curative effect of TACE.
- Citation: Sheng RJ, Dong HH, Li J. Correlation between contrast-enhanced ultrasound parameters and hypoxia inducible factor-1a in hepatocellular carcinoma residual lesions after transcatheter artery chemoembolization. Shijie Huaren Xiaohua Zazhi 2021; 29(24): 1428-1433
- URL: https://www.wjgnet.com/1009-3079/full/v29/i24/1428.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i24.1428
原发性肝细胞癌(hepatocellular carcinoma, HCC)的发生发展具有极高隐匿性, 大多数患者发现时已为中晚期, 失去手术切除治疗机会. 经导管肝动脉化疗栓塞(transcatheter artery chemoembolization, TACE)术是非手术治疗HCC的重要方法, 但是TACE术后残留复发率高, 早期准确评估TACE疗效意义重大[1]. 新生血管是HCC侵袭转移、复发进展的关键, 而缺氧诱导因子-1a (hypoxia inducible factor-1a, HIF-1a)以及血管内皮生长因子(vascular endothelial growth factor, VEGF)过表达在新生血管形成过程中发挥着重要作用[2]. 超声造影作为一种量化分析的超声新技术, 不仅能精确提供肿瘤微循环血流动力学信息, 而且能动态显示肿瘤血液灌注全过程, 已被广泛应用于肿瘤辅助诊断中[3]. 本研究旨在探讨运用超声造影分析TACE治疗后HCC残留病灶的血流灌注特征, 及其与血清HIF-1a水平的相关性, 为临床综合评估疗效提供参考.
选取2019-05/2021-07期间, 我院肝胆外科收治并接受TACE术治疗的86例HCC患者作为研究对象, 其中男65例, 女21例, 年龄32-72岁, 平均(51.18±11.08)岁. 根据是否残留分为无残留组(52例)和残留组(34例). 纳入标准: (1)均经肝穿刺病理确诊为HCC; (2)首次发病, 术前未曾接受任何治疗; (3)肝功能分级为Child-Pugh A级或B级; (4)凝血功能正常; (5)均知情并签署知情同意书. 排除标准: (1)不能耐受手术者; (2)合并重要脏器功能障碍, 肾功能不全者; (3)严重感染者; (4)有精神疾病者. 共86个病灶, 直径为2.4-8.7 cm, 平均(4.63±1.07) cm. 患者于术前3 d内, 术后30 d接受超声造影检查及血清HIF-1a与VEGF水平测定.
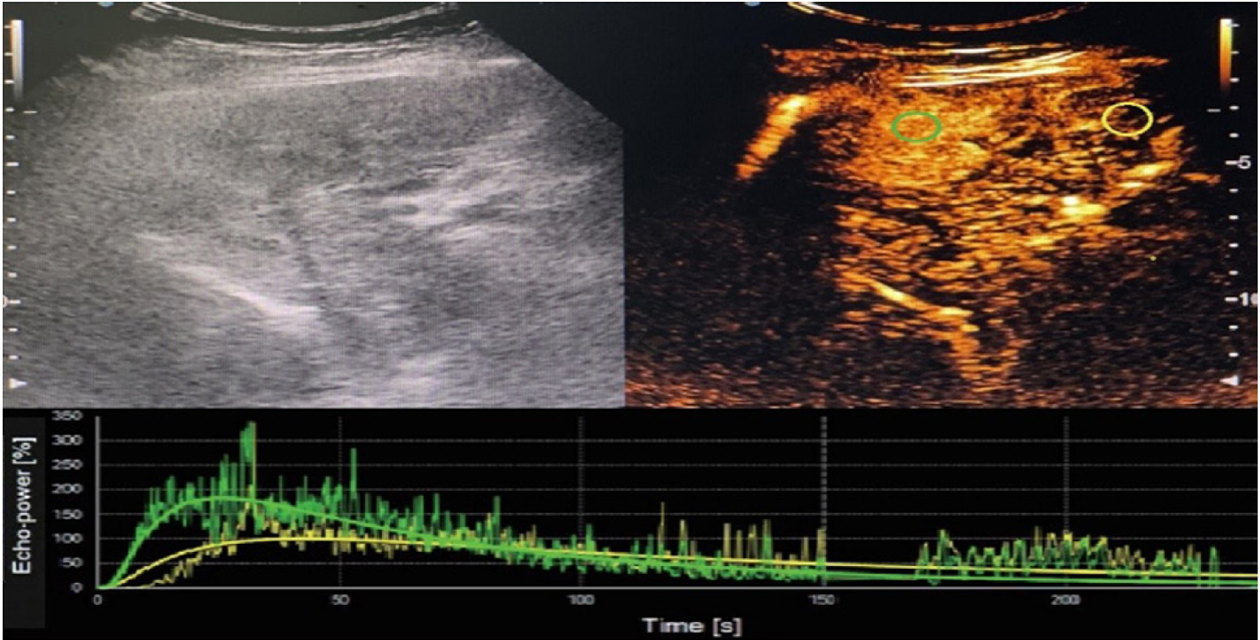
1.2.1 仪器: 超声造影检查[4]: 采用Acuson S2000超声诊断仪, 配备4C1探头, 频率为4.0 MHz, 内置对比脉冲系列成像技术. 首先行常规超声检查, 观察病灶位置、形态、大小、内部回声及血流分布等一般情况. 清晰显示病灶, 固定探头位置, 启动超声造影显像模式, 用5 mL生理盐水稀释超声造影剂Sono Vue (Bracco公司, 意大利), 抽取2.4 mL, 经肘部浅静脉快速团注, 尾随生理盐水5 mL冲管, 同步计时, 观察存储5 min以上动态造影全过程. 避开坏死组织及大血管, 选取多个感兴趣区, 运用时间-强度曲线测定并记录病灶血流灌注参数: 最大强度(maximum intensity, IMAX), 达峰时间(time to peak, TTP), 上升时间(rise time, RT), 廓清时间(clearance time, WT). 数据测量多次, 取平均值作为最终取值. 见图1.
1.2.2 TACE术治疗: 常规消毒铺巾, 局部麻醉, 采用Seldinger技术穿刺右侧股动脉, 将导管经股动脉置入肝动脉, 送达病灶主要供血动脉, 然后缓慢灌注药物: 20-40 mg表阿霉素、0.5-1 g 5-氟脲嘧啶、100-200 mg卡铂和4-10 mL混合碘油, 使病灶供血动脉栓塞, 以达到病灶缺血坏死目的.
1.2.3 HIF-1a与VEGF检测: 清晨, 空腹, 采集肘正中静脉静脉血5 mL, 以10000 r/min离心速度分离血清, 保存于-20 ℃冰箱待测. 使用瑞士罗氏全自动生化分析仪及相应试剂盒, 运用酶联免疫吸附法检测血清HIF-1a与VEGF水平. 试剂盒内配有质控标准品及质控血清, 所有操作均严格按照试剂盒说明书进行操作完成.
统计学处理 采用SPSS 20.0统计学分析软件, 计量资料以(mean±SD)表示, 组内治疗前后数据比较采用配对样本t检验, 组间数据比较采用独立样本t检验. 相关性分析采用Pearson相关分析. P<0.05认为差异有统计学意义.
治疗前, 两组的血清HIF-1a及VEGF水平比较, 差异均无统计学意义(P>0.05); 治疗后, 无残留组的血清HIF-1a及VEGF水平较治疗前明显下降, 差异有统计学意义(P<0.05); 治疗后, 残留组的血清HIF-1a及VEGF水平较治疗前明显升高, 差异有统计学意义(P<0.05). 见表1.
| 组别 | HIF-1a (pg/mL) | T值/P值 | VEGF (pg/mL) | T值/P值 |
| 无残留组(52例) | ||||
| 治疗前 | 166.52±40.29 | 4.463/.000 | 293.20±60.17 | 7.673/0.000 |
| 治疗后 | 132.80±37.79 | 225.78±43.89 | ||
| 残留组(34例) | ||||
| 治疗前 | 173.69±49.10 | -11.889/.000 | 289.30±50.60 | -11.539/0.000 |
| 治疗后 | 252.66±67.43 | 341.63±64.92 |
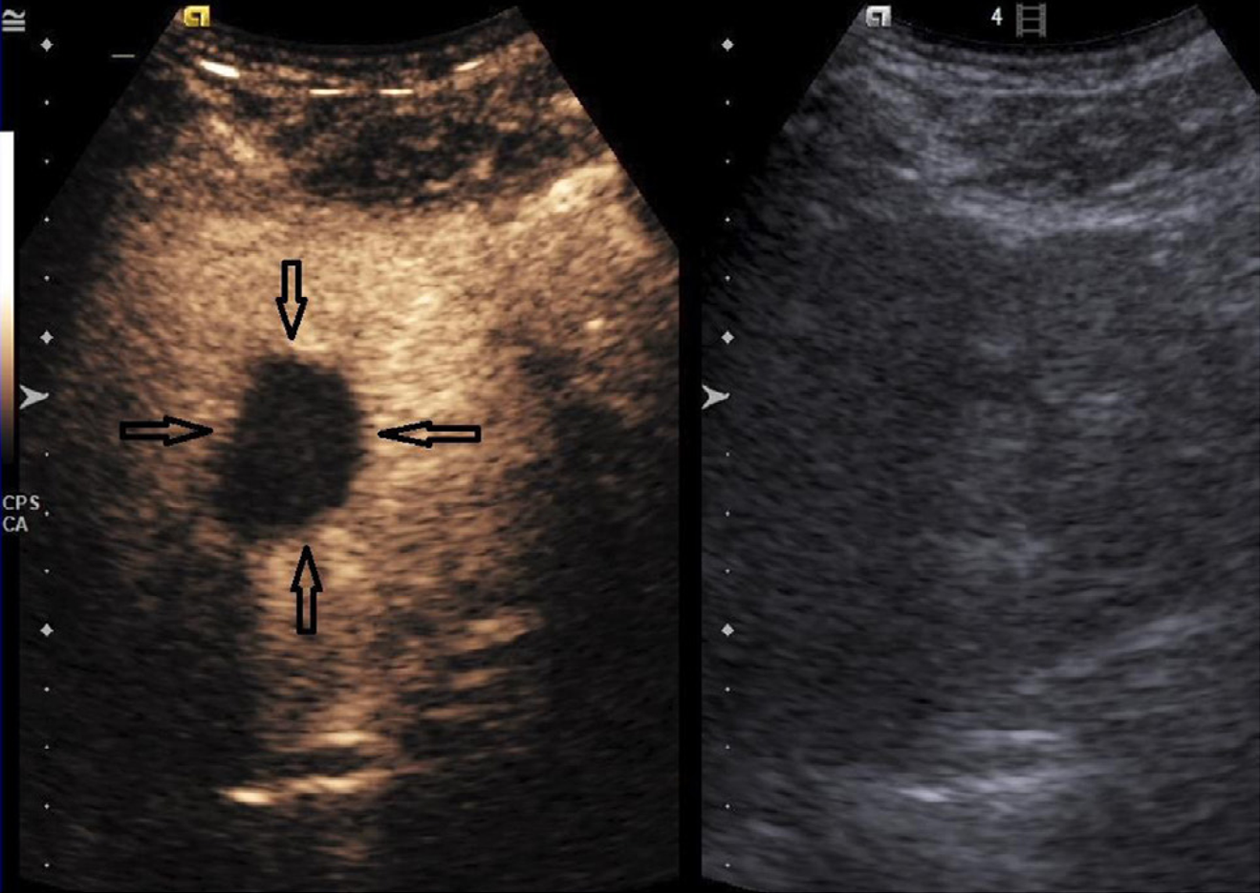
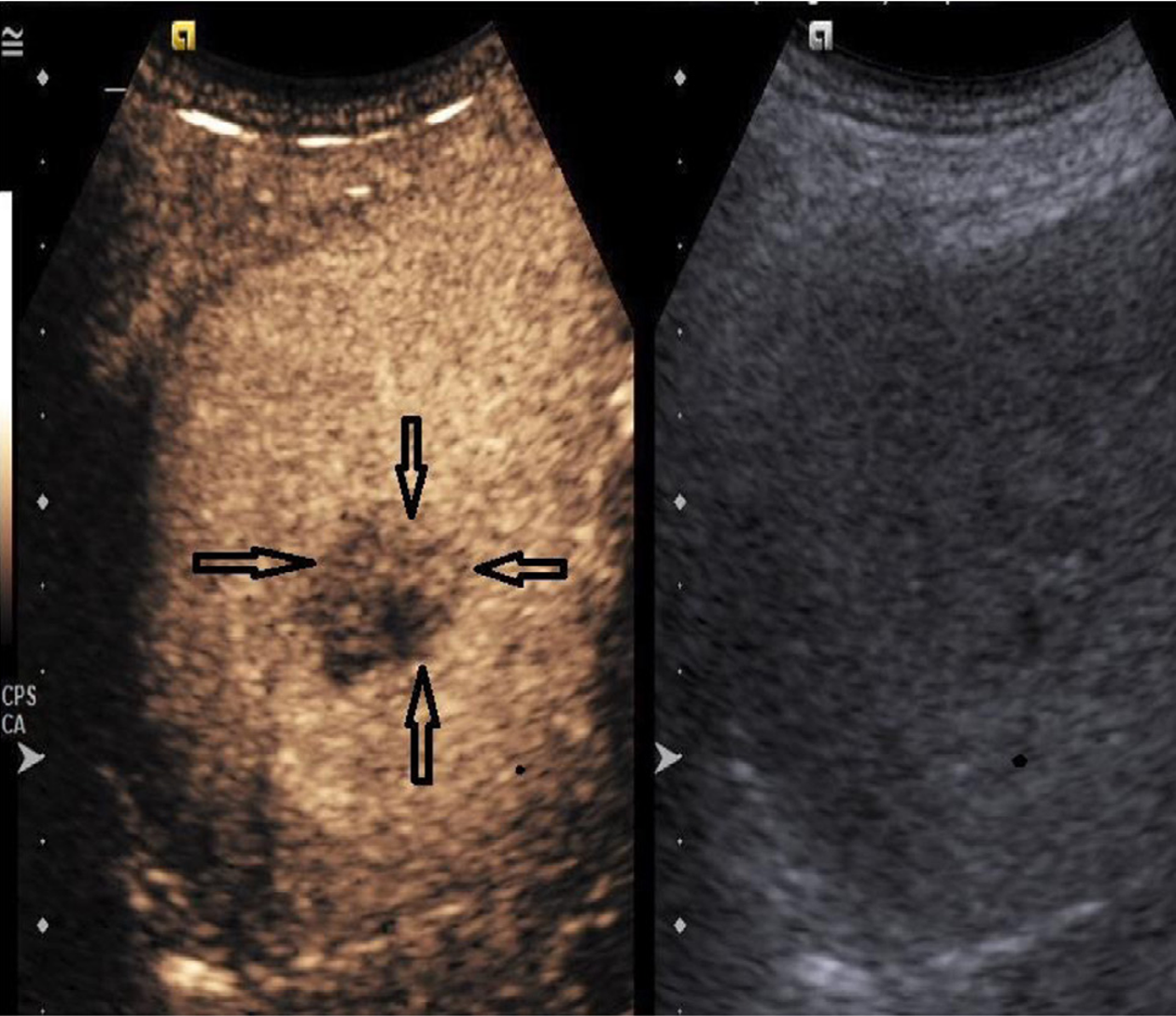
治疗前, 两组的IMAX、RT、TTP、WT比较, 差异均无统计学意义(P>0.05); 治疗后, 无残留组超声造影显示, 病灶未见明显血流灌注(图2); 治疗后, 残留组超声造影显示病灶局部存在增强区域(图3), 残留组的IMAX较治疗前明显下降, 差异有统计学意义(P<0.05), 而RT、TTP和WT较治疗前明显延长, 差异有统计学意义(P<0.05). 见表2.
| 参数 | 无残留组(52例) | 残留组(34例) | ||||
| 治疗前 | 治疗后 | T值/P值 | 治疗前 | 治疗后 | T值/P值 | |
| IMAX(%) | 151.18±19.87 | 0 | 54.874/.000 | 148.25±16.72 | 119.41±14.65 | 11.967/0.000 |
| RT(S) | 11.92±3.18 | 0 | 27.040/.000 | 11.61±3.68 | 13.71±2.77 | -2.707/0.011 |
| TTP(S) | 17.13±3.55 | 0 | 34.744/.000 | 17.55±3.73 | 19.32±4.31 | -6.369/0.000 |
| WT(S) | 22.94±3.88 | 0 | 42.628/.000 | 23.65±4.19 | 26.65±4.64 | -3.446/0.002 |
残留组治疗后, IMAX与血清HIF-1a水平呈正相关, R2 = 0.74, P<0.05; TTP与血清HIF-1a水平呈负相关, R2 = 0.56, P<0.05; RT与血清HIF-1a水平呈负相关, R2 = 0.42, P<0.05; WT与血清HIF-1a水平呈负相关, R2 = 0.48, P<0.05. 其中IMAX与血清HIF-1a水平的相关性最高.
TACE术是一种疗效确切的HCC非手术治疗手段, 通过阻断肿瘤供血动脉, 灌注碘剂和药物, 诱导肿瘤组织发生缺血坏死, 达到控制肿瘤进展, 灭活肿瘤目的[5]. 但TACE术后, 肿瘤组织易通过形成新生微小血管, 建立侧支循环对抗TACE打击, 增加癌细胞逃逸及存活复发机会[6]. 因此, 早期准确评估TACE疗效有助于临床制定下一步治疗方案.
超声造影作为一种真正意义的血管示踪技术, 微泡造影剂能随血流灌注肿瘤组织各级动静脉分支, 实时显示肿瘤内部及周围微循环血流灌注全过程, 可间接反映肿瘤组织血管新生状态, 且与肿瘤组织MVD密切相关[7]. 超声造影不受病灶碘油沉积影响, 当病灶有残存区域时, 表现为病灶局部出现血流灌注区. 运用时间-强度曲线能进一步定量分析该区域的血流灌注参数[8]. 本研究结果中, 治疗后, 无残留组超声造影显示, 病灶未见明显血流灌注, 提示HCC肿瘤组织被彻底灭活, 无侧枝循环及微小血管生成, TACE疗效显著. 本研究结果中, 治疗后, 残留组超声造影显示病灶局部存在增强区域, 提示TACE术后病灶局部存在血流灌注, 即病灶残留, 需作进一步治疗. 定量分析结果显示, 残留组的IMAX较治疗前明显下降, 而RT、TTP和WT较治疗前明显延长(P<0.05), 提示运用超声造影能为临床评估TACE疗效提供客观可靠的血流动力学变化信息, 有助于提高疗效评估的客观性、全面性及准确性. 考虑原因可能是, TACE术对HCC肿瘤组织的微循环血流灌注系统产生不同程度的破坏, 超声造影血流灌注参数随之发生改变.
缺氧状态可刺激机体产生多种氧依赖转录激活因子, 而HIF-1a作为其中重要一员, 可通过结合低氧反应元件, 引发VEGF基因转录, 继而刺激血管内皮细胞增殖, 促进微小血管生成[9]. 而VEGF作为一种强效血管生长因子, 参与肿瘤血管生长全过程[10,11]. 本研究结果显示, 治疗后, 无残留组的血清HIF-1a及VEGF水平较治疗前明显下降(P<0.05), 证实了TACE术治疗HCC的有效性. 考虑原因可能是大量HCC肿瘤组织细胞被杀灭, 其分泌的HIF-1a以及VEGF随之减少, 氧化应激反应抑制, 新生血管减少. 本研究结果中, 治疗后, 残留组的血清HIF-1a及VEGF水平较治疗前明显升高(P<0.05), 提示HCC肿瘤血管生成活跃以及肿瘤再生增加, 预示TACE术后复发转移风险较高, 而监测血清HIF-1a及VEGF水平可作为评估TACE疗效的临床参考指标. 考虑原因可能是HCC肿瘤组织残留, 在缺血缺氧环境下, 癌细胞分泌大量HIF-1a及VEGF以对抗TACE打击. 既往研究表明TACE术后, HIF-1a及VEGF水平上升是肝癌残留的重要预测因子, 与TACE术后不良预后密切相关[12].
相关性分析结果显示, 残留组治疗后, IMAX与血清HIF-1a水平呈正相关(R2 = 0.74, P<0.05), 而TTP、RT、WT均与血清HIF-1a水平呈负相关(R2 = 0.56, R2 = 0.42, R2 = 0.48, P<0.05). 提示随着血清HIF-1a水平高表达, HCC残留肿瘤组织血管生成被促进, 反映在超声造影参数上为IMAX增大, TTP、RT、WT缩短. 考虑原因可能是, TACE术后, HCC残留肿瘤组织再生复发机制激活, 癌细胞分泌大量HIF-1a, 上调VEGF, 促进大量微小血管生成, 微血管密度增加[13]; 同时, 新生微小血管内皮细胞未成熟, 血管通透性高, 彼此间存在大量动静脉短路, 血流阻力低, 导致残留肿瘤组织血流量上升, 灌注速度加快, 超声造影参数随之发生相应变化.
综上所述, 运用超声造影可直观反映TACE术后HCC肿瘤组织的灭活状态以及微血管生成情况, 其血流灌注参数IMAX、TTP、RT、WT均与血清HIF-1a水平具有良好相关性, 可用于定量评估TACE术后HCC血流灌注变化及疗效, 有助于进一步提高疗效评估的准确性及客观性.
超声造影(contrast-enhanced ultrasound, CEUS)能清晰显示原发性肝细胞癌(hepatocellular carcinoma, HCC)微循环血流, 准确评估经导管肝动脉化疗栓塞(transcatheter artery chemoembolization, TACE)术后病灶残留和微血管生成情况, 有助于疗效评估.
运用CEUS定量评估TACE术后HCC血流变化, 分析血流参数与血清缺氧诱导因子-1a (hypoxia inducible factor-1a, HIF-1a)水平相关性, 以期为临床评估疗效提供有价值参考.
本篇论文研究的主要目标是运用CEUS分析TACE术后HCC残留病灶血流特征, 及其与血清HIF-1a水平相关性. 结果显示残留组治疗后血清HIF-1a、血管内皮生长因子(vascular endothelial growth factor, VEGF)水平及各血流参数均较治疗前发生改变, 且残留组治疗后各血流参数与血清HIF-1a水平具有良好相关性.
本篇论文运用CEUS分析TACE术后HCC残留病灶血流特征与血清HIF-1a水平相关性. CEUS是一种纯血池示踪技术, 能定量反映目标组织血流灌注状态.
本篇论文研究达到了实验目标, 研究结果显示, 残留组治疗后血清HIF-1a及VEGF水平较治疗前升高, 而最大强度(maximum intensity, IMAX)较治疗前下降, 上升时间(rise time, RT)、达峰时间(time to peak, TTP)和廓清时间(clearance time, WT)较治疗前延长; 残留组治疗后IMAX、TTP、RT、WT均与血清HIF-1a水平相关性良好. 本研究结果说明CEUS可有效评估TACE术后HCC残留病灶血流状态及血管生成状态, 从而评估疗效.
HCC血流参数与血清HIF-1a水平相关性良好. 运用CEUS定量评估TACE术后HCC血流变化及疗效. CEUS能定量分析HCC血流, 评估TACE治疗前后血流变化, 继而评估疗效, 指导治疗. CEUS可从血流动力学角度评估TACE疗效, 为下一步治疗提供参考. CEUS能评估HCC的TACE疗效, 其血流参数与血清HIF-1a水平具有相关性. 运用CEUS分析HCC经TACE治疗前后血流变化, 从而无创性评估疗效. IMAX与血清HIF-1a水平呈正相关, 而TTP、RT、WT均与血清HIF-1a水平呈负相关. HCC血流参数与血清HIF-1a水平具有良好相关性, 可用于监测TACE疗效, 指导治疗. CEUS可为临床定量评估TACE术后疗效提供一种无创性影像学手段.
病灶位于膈顶, 肠道旁时, CEUS容易受气体干扰, 影响图像质量及结果, 可通过改变体位, 喝水, 加压等方法进行改善. CEUS定量预测TACE对HCC的治疗效果. 实时三维CEUS定量评估TACE对HCC的治疗效果.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): E, E
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Liang L, Li C, Diao YK, Jia HD, Xing H, Pawlik TM, Lau WY, Shen F, Huang DS, Zhang CW, Yang T. Survival benefits from adjuvant transcatheter arterial chemoembolization in patients undergoing liver resection for hepatocellular carcinoma: a systematic review and meta-analysis. Therap Adv Gastroenterol. 2020;13:1756284820977693. [PubMed] [DOI] |
| 2. | 孙 建英, 陈 禧钰, 王 理, 叶 文欣, 沈 水杰, 杨 君伶, 姚 敏, 姚 登福. 缺氧诱导因子-1α介导和调控肝癌相关血管生成因子的表达. 中华肝脏病杂志. 2020;28:942-948. [DOI] |
| 3. | Beckmann S, Simanowski JH. Update in Contrast-Enhanced Ultrasound. Visc Med. 2020;36:476-486. [PubMed] [DOI] |
| 4. | 林 礼务, 林 学英, 薛 恩生, 何 以敉, 高 上达, 俞 丽云, 林 晓东. 原发性肝癌的超声造影表现与生物学特性关系探讨. 中华超声影像学杂志. 2006;15:354-356. [DOI] |
| 5. | Jiang C, Cheng G, Liao M, Huang J. Individual or combined transcatheter arterial chemoembolization and radiofrequency ablation for hepatocellular carcinoma: a time-to-event meta-analysis. World J Surg Oncol. 2021;19:81. [PubMed] [DOI] |
| 6. | Xu X, Chen C, Liu Q, Huang X. A Meta-analysis of TAE/TACE Versus Emergency Surgery in the Treatment of Ruptured HCC. Cardiovasc Intervent Radiol. 2020;43:1263-1276. [PubMed] [DOI] |
| 7. | Wessner CE, Shaw CM, Stanczak M, Forsberg F, Lyshchik A, Tan A, Eisenbrey JR. Contrast-enhanced Ultrasound Identifies Patent Feeding Vessels in Transarterial Chemoembolization Patients With Residual Tumor Vascularity. Ultrasound Q. 2020;36:218-223. [PubMed] [DOI] |
| 8. | 汪 玲, 陆 英慧, 王 天佑. 原发性肝癌患者超声造影定量灌注参数与分化程度及微血管密度的关系. 郑州大学学报(医学版). 2020;55:681-685. [DOI] |
| 9. | Surov A, Schmidt SA, Prasad V, Beer AJ, Wienke A. FDG PET correlates weakly with HIF-1α expression in solid tumors: a meta-analysis. Acta Radiol. 2021;62:557-564. [PubMed] [DOI] |
| 10. | Vanderborght B, Lefere S, Vlierberghe HV, Devisscher L. The Angiopoietin/Tie2 Pathway in Hepatocellular Carcinoma. Cells. 2020;9. [PubMed] [DOI] |
| 11. | El Shorbagy S, abuTaleb F, Labib HA, Ebian H, Harb OA, Mohammed MS, Rashied HA, Elbana KA, Haggag R. Prognostic Significance of VEGF and HIF-1 α in Hepatocellular Carcinoma Patients Receiving Sorafenib Versus Metformin Sorafenib Combination. J Gastrointest Cancer. 2021;52:269-279. [PubMed] [DOI] |
| 13. | 任 勇军, 杨 林, 翟 昭华, 缪 南东, 邓 进, 胡 晓, 张 小明. 原发性肝癌TACE治疗后血清VEGF水平变化及临床意义. 中华临床医师杂志(电子版). 2011;5:2053-2055. [DOI] |