修回日期: 2021-09-26
接受日期: 2021-10-08
在线出版日期: 2021-12-28
炎症性肠病(inflammatory bowel disease, IBD)是一种慢性非特异性肠道炎症疾病, 是一种免疫性疾病, 目前尚无根治疗法, 肠道免疫是炎症性肠病的研究重点, 本文就Th17细胞及其相关细胞因子在炎症性肠病中的新研究进行综述, 包括炎症性肠病病因、与适应性免疫的关系、与Th17细胞的关系, Th17细胞介绍、其相关细胞因子的介绍, 和它们在IBD的研究状况, 最后展望Th17细胞与IBD的未来研究方向.
核心提要: 在炎症性肠病(inflammatory bowel disease, IBD)的发生发展过程中, TH17细胞及其相关细胞因子发挥着促炎和抗炎的双重作用, TH17细胞本身及IL-17、IL-23发挥着促炎的作用, 而TH17细胞分泌的IL-22、IL-10发挥着保护作用, TH17细胞在炎症因子环境中, 具有很大的可塑性, IL-6、TGF-β、IL-12、IL-23、IL-21、IL-22等会参与的不同的调控机制, 进而影响TH17细胞相关的多种平衡, 为IBD中TH17细胞建立框架提供新思路.
引文著录: 袁余懿, 刘与进, 范恒. Th17细胞及其相关细胞因子在IBD中研究新进展. 世界华人消化杂志 2021; 29(24): 1402-1409
Revised: September 26, 2021
Accepted: October 8, 2021
Published online: December 28, 2021
Inflammatory bowel disease (IBD) is a chronic non-specific intestinal inflammatory disease. IBD is an immune disease, and there is no cure for it at present. Intestinal immunity is the research focus of IBD. Focusing on Th17 cells and related cytokines, this article reviews the updated research on IBD, including its etiology, its relationship with adaptive immunity, and its relationship with Th17 cells. We also introduce Th17 cells and related cytokines, and their research in IBD. Finally, we point out the future research direction of Th17 cells in IBD.
- Citation: Yuan YY, Liu YJ, Fan H. New progress in research of Th17 cells and related cytokines in inflammatory bowel disease. Shijie Huaren Xiaohua Zazhi 2021; 29(24): 1402-1409
- URL: https://www.wjgnet.com/1009-3079/full/v29/i24/1402.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i24.1402
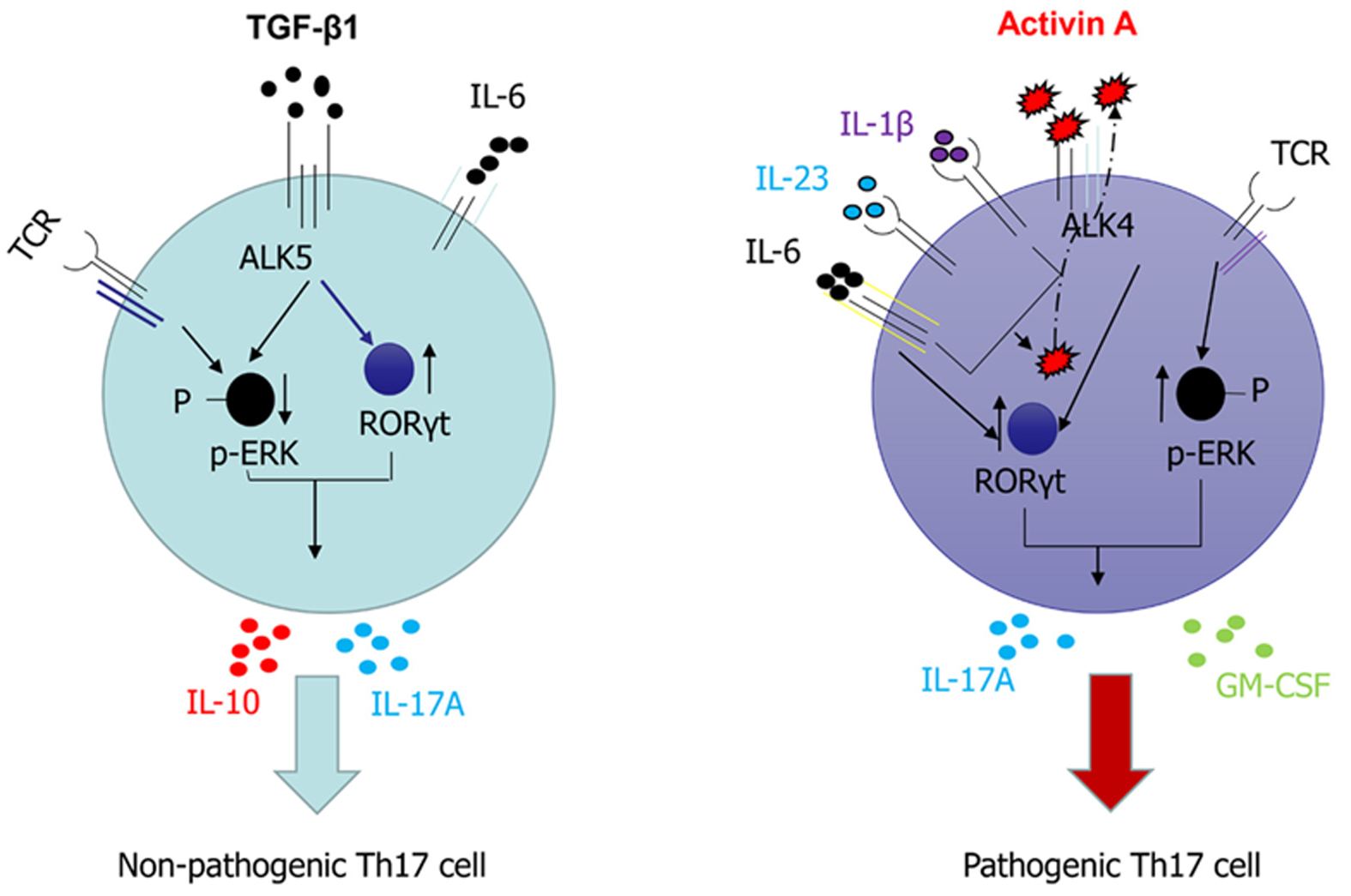
炎症性肠病(inflammatory bowel disease, IBD)主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD), 其病变多累及结直肠或整个消化道, 临床多表现为腹泻腹痛、粘液脓血便等症状[1]. 研究表明, IBD的发病与遗传、环境、肠道微生物菌群及免疫等因素有关, 其病理过程与肠道菌群及其代谢物异常、肠黏膜免疫系统紊乱和肠道黏膜屏障功能障碍等密切相关[2]. 目前发现的关于IBD遗传易感基因位点的数量在不断增加, UC和CD共同的遗传易感基因位点有70多个, 但是迄今为止能解释的易感基因位点仅占少数[3]. IBD发病的环境因素主要包括吸烟、饮食、药物、地理、社会压力和心理等, 甚至和维生素D的缺乏、抗生素的使用、抑郁和焦虑及空气污染等有关. IBD的病因也与肠道菌群种类的稳定性有关, 有研究表明[3,4]IBD患者粪便微生物群的生物多样性显著降低. 而肠黏膜免疫系统紊乱是近几十年来IBD病因研究的重点, 其包括肠黏膜先天性免疫和适应性免疫的异常. 肠道先天性免疫系统概括起来包括两道防线, 其中第一道防线是"黏液", 第二道防线是肠上皮细胞分泌的抗菌肽和先天免疫细胞[5]. 目前IBD先天性免疫相关研究主要包括肠道上皮屏障的完整性、自噬等; IBD适应性免疫相关研究的主要集中于肠黏膜固有层B细胞和T细胞介导的炎症反应[4,5], 早期研究多认为IBD与肠黏膜适应性免疫Th1/Th2细胞功能异常密切相关[6], 认为CD多是由Th1细胞介导的疾病, 而UC则与Th2细胞功能异常密切相关[7]. 既往研究表明CD患者肠道固有层存在的Th1细胞能加剧肠道炎症反应, 并且已有以Th1型细胞因子为靶点的药物在临床上试用, 但其效果并不理想. UC患者体内增加的自身抗体主要为Th2相关的抗体类型; 此外EB病毒诱导产生的细胞因子现在被认为是Th2型细胞因子, 而这种细胞因子在UC患者的体内明显增加[8]. 除Th1和Th2细胞外, Treg细胞在肠黏膜免疫系统也具有重要的作用, Treg细胞可以通过产生TGF-β和IL-10抑制黏膜巨噬细胞和效应性T细胞的促炎功能[9]. 研究表明Treg细胞还能促进肿瘤细胞发生免疫逃逸, 间接加速肿瘤细胞的增殖, 增强了肿瘤细胞的浸润能力, 因此Treg细胞在人体的增殖是相对较少的, 这同时也决定了它不足以发挥其完美的抗炎效果, Treg细胞作为免疫稳态的调节细胞, 它的作用是必不可少, 但其作用途径较为复杂, 仍需更为广泛的研究[9]. 近年来, 研究发现Treg细胞和Th17细胞的平衡影响着IBD的炎症状态, Treg细胞和Th17细胞的平衡可以受到诸如T细胞受体、共刺激信号、细胞因子信号、胆汁酸代谢产物和肠道微生物等因素影响[9]. 本文所述Th17细胞涉及多种自身免疫性疾病, 特别是其在IBD中能调节上皮细胞物理屏障的完整性, Th17细胞的激活有非病理性和病理性两种机制, 如图1. 在病理条件下, Th17会分泌促炎介质以加重疾病进展和预后, Th17细胞不仅与粘膜屏障有关, 还与炎症有关[10].
本文就Th17细胞及其相关细胞因子与IBD研究进展进行综述.
Th17细胞在IBD病理过程中中有着重要的作用, Th17细胞是以产生大量IL-17A、IL-17F、IL-21和IL-22等细胞因子为特征的T细胞亚群(它们是由IL-6和TGF-β联合诱导的), 主要分布于小肠[10]. Th17细胞分泌的IL-17A, 作为炎症浸润的主要细胞因子, 它可以招募大量中性粒细胞等炎症细胞介导炎症反应[10]. Th17细胞表面标志性表达IL-23R, 而IL-23及IL-23R在IBD的发病中有着重要的作用[11], Th17细胞中IL-23受体的拮抗显示与IBD炎症减轻有关, 并已证明抗IL-12/23p40抗体(乌司他单抗)可有效控制中重度的CD[12]. 另有研究表明Th17细胞表面表达的IL-23受体, 与B细胞分泌IgG抗体有关, 通过进一步分析, 阻断Th17细胞上IL-23受体可以影响随后B细胞的表型和IgG的致病性[13]. 并且有研究表面连接固有免疫和适应性免疫得细胞因子是IL-23, 它作用于适应性免疫系统的细胞是Th17细胞, 因此Th17细胞与固有免疫系统也存在千丝万缕的联系[14]. Th17细胞成熟后可以产生IL-21, IL-21反过来增加Th17细胞表面IL-23R的表达, IL-23与IL-23R结合又会促进Th17细胞的增殖, 这样就会产生一个正向的自我调节从而加强炎症组织Th17细胞的浸润. 其分泌的IL-17A会加重炎症反应, 所以IBD中Th17细胞的表达总是高于正常肠黏膜[15].
现有发现表明, IBD肠道中高表达的Th17细胞可能存在两个功能群, 一种是组织滞留稳态Th17细胞, 它是被共生节段丝状细菌(symbiotic segmentedfila-mentous bacteria, SFB)识别的, 一般不参与炎症状态, 而被刺激产生的Th17细胞多进行糖酵解, 介导炎症反应, 如分泌IFN-γ等[15]. IBD与Th17相关细胞因子的关系也可证明Th17细胞的重要性, 例如缺乏调节性细胞因子, 敲除IL-2、IL-10的基因小鼠, 可自发为实验性结肠炎[15]. IL-10大多来源于Treg细胞, Treg细胞与Th17细胞又存在平衡, IL-10的缺失会导致实验性结肠炎, 进而推测自发性结肠炎有Th17细胞的参与. 在遗传学的一些研究也表明, Th17细胞以及其他免疫细胞分泌的细胞因子与IBD愈发有关[2,16].
Th17细胞是Th0细胞在IL-6和TGF-β的刺激下诱导分化形成的辅助性T细胞, Th17细胞可以产生IL-17A、IL-17F、IL-21和IL-22等细胞因子, 维甲酸相关孤儿受体(retinoic acid-related orphan receptor, RORγ)是其重要的转录因子[16]. 研究表明Th17细胞的分化有3个阶段: IL-6和TGF-β启动Th17分化、IL-21扩大Th17分化状态、IL-23在分化后期维持Th17稳定成熟[7,16].
Th17细胞是近年来的研究热点, Th17细胞在IBD患者肠道组织中明显增加, 并以回肠末端增多为主[17]. 系统的了解Th17功能和功能的分子基础, 这对于明确组织中Th17细胞在慢性炎症如IBD中的病理作用是十分重要的.
研究表明Th17细胞的分化和病理生理作用是受到众多细胞内部和外部信号调节的[17], 在体内Th17细胞是幼稚Th细胞在专业抗原提呈细胞(antigen-presenting cells, APC)和特殊的细胞因子(包括IL-6、IL-21和TGF-β)刺激下分化而成. 幼稚T细胞在IL-6-JAK-STAT3轴刺激下上调转录因子RORγt和RORα表达水平, 促进Th17细胞的分化, Th17细胞分泌标志性细胞因子IL-17A、IL-17F和IL-22. 这些细胞因子可以诱导上皮细胞分泌抗菌肽, 而抗菌肽是宿主黏膜抵御细胞外细菌和真菌过程中必不可少的物质[17]. 同时在炎症状态下Th17细胞也能通过诱导趋化因子来招募中性粒细胞介导炎症的发生发展. 因此在体内, TGF-β或RORγ的缺乏会损害Th17分化及随后介导的免疫反应[17]. 另外环境刺激也会对Th17分化产生影响, 如转录因子缺氧诱导因子1(hypoxia inducible factor-1, HIF-1)是一种关键的代谢感受器, 它是通过直接激活Th17相关转录因子RORyt和IL-17来调控Th17细胞分化过程和效应功能. 有研究表明靶向HIF-1α-ABC转运蛋白可以为IBD提供新的治疗途径[18], 可以通过抑制HIF-1α或抑制ABC转运蛋白以增加非结合胆红素(一种芳香烃受体的内源性配体)(unconjugated bilirubin, UCB)利用率, UCB进一步激活AHR来减轻炎症反应, 从而起到治疗这种疾病的作用[18]. 生物体内通过整合了这些正/负调控因子, 并通过IL-1β和IL-23的刺激, 最终可以稳定Th17细胞的分化[19]. 稳定后的Th17细胞会分泌相关细胞因子(如IL-1、IL-6、TNF-α)和化学增活素(如IL-8、CXCL1、CXCL8), 基质金属蛋白酶等, 来触动炎症通路, 介导炎症与抗炎的发生[13,19].
Th17细胞在自身免疫病如人类Th17细胞介导的自身免疫病牛皮藓、牛皮藓关节炎、强直性关节炎和类风湿性关节炎等中的作用不容忽视[12,19].
在类风湿关节炎中, Th17刺激FLSs(类风湿关节炎中的一种滑膜细胞), 促进破骨细胞分化, 并募集大量中性粒细胞和更多Th17细胞, 通过IL-17启动关节炎症, 从而导致慢性炎症的加深[17,19]. 临床研究表明[17,19,20], 强直性脊柱炎患者血清中IL-35和IL-17的关系呈反比, IL-17的含量比较高, IL-35则降低, 这将导致IL-35刺激的Treg细胞减少, 进而朝着Th17细胞分化的趋势变大, IL-17会加剧Th17细胞的浸润, 从而导致炎症的加深, 可以得出在这些自身免疫病中, IL-17和Th17细胞始终有着重要的影响.
研究表明CD和UC患者肠道固有层Th17细胞相关细胞因子如IL-17A和IL-17F明显增加, 其中IL-17A作为标志性细胞因子在IBD中高于正常肠粘膜[20], Th17细胞的浸润可促进肿瘤的发生, 并且可以降低结肠癌患者的生存率[12,20]. 现有研究表明Th17具有很强的可塑性, 因其表达FOXP3+(是调节性T细胞的标志性分子)时, 可在病原体杀死完成后抑制RORγt, RORγt广泛表达于淋巴器官间隔细胞, 此细胞也称为CD4+CD8+双阳性细胞, 这群细胞可诱导Th17细胞的产生. 所以抑制RORγt可以抑制Th17细胞的产生从而减轻炎症反应. 因此, Th17细胞的可塑性在调节体内平衡和清除肠道病原体中发挥核心作用[12,20,21].
Th17细胞介导的IBD的肠道炎症主要与它产生的细胞因子密切相关, Th17细胞既可以产生抗炎细胞因子(如IL-22、IL-10)也可以产生促炎细胞因子(如IL-17和IL-21)[12,21]. 抗炎作用有一些是通过激活控制上皮细胞的增殖、伤口的愈合和抗菌蛋白的产生(如防御素、粘蛋白、REG3β和REG3γ); 促炎作用则是上调TNF、IL-1β、IL-6和IL-8等, 以及募集中性粒细胞和肠成纤维细胞分泌的基质金属蛋白酶. 其中基质金属蛋白酶是一类能降解细胞外各种蛋白质成分的大家族, 其可以破坏肿瘤细胞侵袭的组织学屏障, 在肿瘤侵袭转移中起关键性作用, 被认为是该过程中主要的蛋白水解酶, 从而在肿瘤浸润转移中的作用日益受到重视, 促炎的Th17细胞也有其有益的一方面[21].
Th17细胞介导IBD炎症除与其相关细胞因子有关, 更表现出独特转录特征, 如前文所说IL-23受体(IL-23R)的表达增加, 可以进一步稳定增殖浸润的基础就是IL-23介导的正向反馈调节, 该过程促使了Th17细胞的增多[21]; 相反, 非治病性Th17细胞表现出缺乏IFN-γ, 同时表达IL-17A和IL-10, IL-10的缺乏通常可以诱导结肠炎的发生, Th17分泌IL-10在IBD中较常见的表现的是一种抗炎的保护作用. 亦有研究表明Th17是通过抑制Th1的发育和功能来减轻结肠炎, Treg细胞与Th17细胞之间的平衡, 微生物粪便移植治疗与Th17细胞在肠道的比例也都或多或少预示着未来关于靶向Th17细胞治疗IBD的新策略[7,21]. 以下将从动物、细胞、人体临床样本几个方面来讨论Th17细胞与IBD的相关性.
研究表明三硝基苯磺酸诱导的大鼠脾脏和MLN(肠系膜淋巴结)中分离出的CD4+IL-17+细胞亚群频率高于正常大鼠, 而miR-155抑制组显著降低了脾脏和MLN中Th17细胞的水平[7,21], 所以Th17细胞在IBD中可能广泛表现为一个促炎的细胞, 降低Th17细胞的增殖和分化, 对IBD可以起到一定的治疗作用. 但也有研究发现: 苏金单抗阻断IL-17A的显著失败表明IBD不是典型的Th17细胞介导的自身免疫病[21].
动物实验研究表明降低AhR信号传导来减轻症状和炎性结肠炎, 从而降低IL-6, STAT3和RORγt的表达, 而增加FOXP3的表达, 最后是通过降低Th17细胞的比例和增加Treg细胞的比例, 来减轻IBD得炎症程度[22].
临床人体样本检测实验通过检测20/40例患者的肠组织标本及血清标本发现在肠道固有层中, 活动期的UC和CD患者CD4/IL-17较正常组增加, 其中活动期CD患者IL-22水平明显高于UC患者[23]. Th17相关细胞因子在活动期IBD患者的肠粘膜和血清中高表达, 此外, 这些细胞因子与疾病活动性指数、C反应蛋白(C-reactive protein, CRP)和血小板计数(platelet count, PLT)水平、内镜下疾病活动性分级和组织学活动性分级呈正相关[1,23]. IL-17A与IFN-γ呈正相关[23]. 这提示了Th17相关细胞因子mRNA的表达与Th1相关细胞因子IFN-γ的表达呈正相关[23]. 我们知道CD多是Th1细胞介导的, IL-23参与Th1细胞介导CD炎症的过程, 而在UC中IL-23则参与Th2细胞介导的炎症反应[23], 可以看到Th17细胞及Th17相关细胞因子在IBD的发生发展中起重要作用, 并发现Th1和Th17细胞因子似乎在IBD中起协同作用[24].
总之, Th17细胞的发现使我们超越了Th1/Th2范式的自身免疫性疾病的分子基础, 使我们对各种免疫介导的疾病的临床应用有了新的认识.
2.3.1 IL-17在IBD中的作用: IL-17是T细胞来源细胞因子, 该家族包括6个成员的配体(IL-17A-IL-17F)和5个受体(IL-17RA-IL-17RD和SEF). 该细胞因子在抵抗微生物的宿主防御和炎性疾病的发展中起着至关重要的作用[25]. IL-17是一种多效性细胞因子, 它通过丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)途径诱导IL-6和IL-8的产生, 从而促进中性粒细胞在炎症部位的募集, 触发T细胞增殖, 上调一些促炎分子, 如诱导型一氧化氮合酶和IL-1β的表达[25]. 此外, IL-17诱导巨噬细胞产生促炎细胞因子, 在天然免疫和获得性免疫之间建立联系, 并在宿主抵抗细菌, 特别是在粘膜表面发挥关键作用[25].
IL-17A是该家族中被研究最广泛的细胞因子, 它多表现为促炎作用, 其诱导的炎症反应比IL-17F强10-30倍[5,25], 在一些条件下IL-17A也能有保护作用. IL-17A作用于肠道细胞, 通过信号转导和转录激活因子3(signal transducer and activator of transcription 3, STAT3)和核因子-κB(NF-κB)激活促进结肠癌细胞的生长, 介导了结肠癌的进展, 也可以通过MAPK途径诱导一系列炎性介质的产生[12,13,21,25]. IL-17RA作为受体介导IL-17A和IL-17F的功能活动, 而IL-17A抗体对DSS结肠炎和T细胞转移性结肠炎有保护作用, 这一事实同时表明, 在肠道中致病的是IL-17A, 而不是IL-17F. 然而缺乏IL-17F的小鼠在很大程度上对DSS-结肠炎有抵抗力[26], 所以我们不能单一得认为IL-17F是致病的不良细胞因子, 因为作为细胞因子IL-17F和IL-17A都是宿主抵抗细菌和真菌病原体的主要贡献者, 并通过中性粒细胞募集、抗微生物分子和急性时相蛋白的产生发挥作用, 那么如何区分应该结合具体的条件去分析, 或者说仍有待进一步完善理论体系[26].
关于IL-17的受体, IL-17受体家族由5个成员组成(IL-17RA、RB、RC、RD和RE), 研究表明IL-17通过由IL-17RA和IL-17RC组成的异二聚体受体复合物发出信号[10,26], 并通过肿瘤坏死因子受体相关蛋白6(tumor necrosis factor receptor-associated factor, TRAF6)非依赖性途径诱导mRNA稳定, 在调节促炎细胞因子和趋化因子的协同表达中起到重要作用[26]. IL-17与受体的结合触发了一系列磷酸化和泛素化事件, 例如USP25(去泛素化酶)可能通过限制TRAF5和TRAF6的泛素化状态(从细胞内选出靶蛋白分子并对靶蛋白分子修饰的过程)来负向调节IL-17信号[11,26]. 研究发现近端衔接子Act1是所有IL-17细胞因子信号传导过程中的常见介体, 因此参与IL-17介导的宿主防御和IL-17驱动的自身免疫疾病, 靶向Act1可成为治疗手段[26].
关于IL-17的一些实验发现, 如在小鼠实验中, 皮内注射IL-23导致皮肤增生和棘皮病, 而IL-17RA缺乏、IL-17A缺乏或抗IL-17抗体中和IL-17可减轻这种情况[26], 矛盾的是, IL-17信号的丢失增加了牛皮癣的易感性[2,7,9,21,26], 这些现象表明, 尽管IL-17A本身是一种促炎细胞因子, 但它有助于免疫稳态, 在缺乏其信号的情况下, 可以导致其他促炎细胞因子的失调和过度地产生[9,26]. 所以更好地理解炎症和自身免疫环境中的IL-17信号对于发现新的治疗靶点至关重要.
对于IL-17在IBD中的研究, 可以结合其在牛皮藓疾病、银屑病、强直性脊柱炎中的作用, 及大量的临床用药样本来分析, 抗IL-17 抗体治疗可以通过下调胶原蛋白3和几种促纤维化细胞因子的表达, 显著减轻TNBS诱导的小鼠结肠直肠纤维化[27]. 亦有研究表明IL-17拮抗剂的使用与IBD的新发有某种关系, 可能会降低IBD的发生, 甚至可以抑制IBD病情的加重, 但在构建小鼠结肠炎模型中发现, IL-17A抑制、IL-17RA抑制、IL-17相关基因敲除会诱导或加重结肠炎, 且苏金单抗的失败表明IL-17拮抗剂的使用是否能稳定且显著降低已经患有IBD的患者的病情仍有待进一步商榷[28-31]. 在针对CD的抗 IL-17 抗体和抗IL-17受体的对照试验中, 安慰剂组的表现优于治疗组[32], 所以抗IL-17治疗IBD并不一定是优势的. IL-23/Th17轴在肠道炎症中的关键作用是通过消除某些增强疾病炎症程度的成分, 抗IL-17抗体的使用会抑制IL-12和IL-23的转录, 从而加重IBD的炎症, 这也验证了前文所说的观点[33]. 一篇系统评价和Meta分析的文章共纳入66项研究, 涉及14390名接受IL-17拮抗剂诱导治疗的患者和 19380名接受IL-17拮抗剂诱导和/或维持治疗的患者. 在诱导期间, 报告了11例IBD病例, 结论是接受IL-17拮抗剂治疗的患者发生IBD的风险并未升高[33]. IL-17拮抗剂的使用综合来说是一个可以选择的治疗方案, 但要监测其是否会引起IBD恶化, 一旦出现恶化, 则需立即停止抗IL-17抗体治疗. 未来针对IL-17抗体或拮抗剂药物的使用, 需要进一步规范化, 明确指出IL-17抗体适用人群及常用剂量是重中之重.
2.3.2 IL-23在IBD中的作用: IL-23产生于巨噬细胞和树突状细胞, 激活粘膜免疫细胞, 增加肿瘤坏死因子(tumor necrosis factor, TNF)的产生并稳定效应TH17细胞的表型[34]. IL-23已被证明可以通过诱导与淋巴组织诱导细胞表型相同的先天淋巴细胞(innate lymphoid cells, ILCs)产生Th17细胞, 并进一步产生相关细胞因子[35], 如产生IL-21, IL-21增加IL-23R在Th17细胞膜上的表达, IL-23与IL-23R结合促进更多的Th17细胞产生.
IL-23如前文所述可稳定Th17激活后所需要的基因表达[35], 并且IL-23是先天免疫和获得性免疫中的关键细胞因子, 是两者之间的桥梁[35]. 现有研究认为益生菌可以通过减少IL-23的分泌来抑制IL-17的产生和功能, 这证实了益生菌可通过这种方式改善肠道炎症, 说明IL-23在驱动针对微生物对抗炎症的早期反应中也是占有一席之地[4,35].
在几种结肠炎的鼠模型中发现, IL-12/IL-23 p40, IL-23 p19或IL-23R功能的抑制导致肠道炎症的明显抑制. 这一发现与IL-23相关靶细胞(例如Th17细胞, ILC3细胞)的生成减少有关, 还和粒细胞和自然杀伤细胞以及促炎细胞因子的产生受损有关. 基于这些发现, 靶向IL-23成为抑制肠道炎症和与炎症相关的癌症生长的重要概念[35].
另外在一些临床试验研究发现, 在UC患者中, 我们发现新诊断疾病的IL-23的粘膜基因表达水平显着高于长期UC. 无论是新诊断的还是长期存在的UC和CD, 与对照组相比差异都非常显着[23,35]. 并且已经有针对IL-23 p40和IL-23 p19的中和抗体已成功用于CD治疗的临床试验[35]. 因此, IL-23抑制及IL-23R抑制可能对未来IBD患者的治疗具有重要意义.
Th17细胞在IBD中的保护作用本文就其细胞因子IL-10和IL-22综述.
2.4.1 Th17细胞分泌IL-10在IBD中发挥保护作用: IL-10的来源并非只有T细胞亚群, 体内几乎所有淋巴细胞均能合成IL-10, 体内最重要的来源主要是单核巨噬细胞和T辅助细胞, 其他淋巴细胞则是在特定的刺激或某种免疫反应时间点产生[36]. IL-10也称为细胞因子合成抑制因子(cytokine synthesis inhibitory factor, CSIF), 是一种多效性细胞因子, 可以在多种类型细胞中发挥免疫抑制或免疫刺激的作用[37]. 在炎症反应方面, IL-10能通过下调单核细胞表面主要组织相容性抗原Ⅱ的表达, 降低其抗原呈递作用, 下调T淋巴细胞活性, 抑制炎性细胞的激活、迁移和粘附; 同时, IL-10也能抑制炎症因子的合成与释放. IL-10的细胞受体IL-10R属于2型细胞因子家族, 它们是跨膜糖蛋白, 活化的IL-10R是一个信号转导复合体, 包含了2种不同的受体链: IL-10R1和IL-10R2[28,37]. 复合体IL-10/IL-10R1/IL-10R2具有生物活性, 可激活JAK激酶, 进而引起STAT因子的磷酸化, 从而影响mRNA的转录, 影响一系列该通路上的细胞因子的产生, 发挥IL-10的调节作用[28,37]. IL-10的保护作用主要体现在抑制炎症反应和细胞免疫反应, 加强与适应性免疫反应在机体的耐受性, 抑制由单核细胞和巨噬细胞产生的促炎因子, 以及提高B细胞的存活率, 促进B细胞的增殖、MHCⅡ类抗原表达以及免疫球蛋白的分泌, 抑制NK细胞因子的产生[37], 并与Th2所产生的IL-4、IL-5有协同的抗炎作用[37]. IL-10具有双向免疫调节作用, IL-10可以通过抗原提呈细胞发挥免疫抑制, 通过T细胞发挥负调节作用, 在肿瘤环境中对免疫应答具有负向调节作用; IL-10的双向调节作用自从被发现起就一直被关注, 它不仅影响免疫系统, 而且可以通过调节生长因子、细胞因子影响许多病理生理过程, 包括血管生成、肿瘤形成和感染, 还能通过诱导调节性T细胞在外周耐受中建立作用; 对CD、类风湿性关节炎银屑病、丙型病毒性肝炎病毒感染、艾滋病病毒感染等疾病都发挥着重要作用[28,37].
近来在发现在人类中, IL-10、IL-10Rα和IL-10Rβ的多态性已被发现与极早发病的结肠炎有关, 以及全基因组进一步发现IL-10通过抑制CD45RBhiCD4+T细胞重组小鼠Th1细胞产生干扰素-γ并降低Th17应答[38]. 对肠道微生物菌群中的短链脂肪酸的研究表明, 短链脂肪酸可以维持胃肠肠道内环境的稳定, 而短链脂肪酸可以促进Th17细胞分泌IL-10, 还可通过G蛋白偶联受体43[39]诱导Th1细胞分泌抗原性IL-10, 可见是IL-10在其中发挥了关键的保护作用[39]. 缺乏IL-10或IL-10Rα的Treg细胞容易发生自发性结肠炎, 表明IL-10使Treg细胞能够抑制结肠炎中致病性Th17细胞的反应, Treg细胞中c-MAF的失活会导致IL-10产生功能出现障碍, 而IL-10又是由Th17产生, 这样就能使Th17自身获得调节肠道炎症的特性来起到保护作用[10,39], 前文所说Treg细胞和Th17细胞的平衡或许就涉及IL-10的平衡. 经研究发现肠巨噬细胞对IL-10信号敏感, 巨噬细胞对于控制炎症粘膜炎症是必不可少的, 所以在结肠炎条件下, 再一次阐明IL-10起到保护作用[10,39]. 大多数时候IL-10其实是维持肠内稳态所必须的, 尽管如此, 其下游信号通路及其分子基础仍未得到充分研究[39], 且在肠癌的这些作用可能涉及更复杂的机制.
通过对IL-10保护机制的研究发现, 由于一些研究显示抗单一的效应细胞因子对IBD的治疗结果不太理想且机制较为冗余复杂, 未来针对T细胞亚群本身或者同时靶向多种细胞因子可能为炎症性肠病的治疗带来希望, 并有机会找到高特异性和高效率确定的靶点[3,39].
2.4.2 Th17细胞分泌IL-22在IBD中发挥保护作用: IL-22是IL-10家族成员, 一般认为起到保护作用, 通过诱导抗微生物分子增殖和抗凋亡途径来增强肠道屏障的完整性和上皮的固有免疫功能[28,39]. 而IL-22的受体(IL-22R)的表达仅限于肠道和呼吸道等非造血细胞[40]. 在先天免疫系统中, Th17细胞被认为是产生IL-22的重要来源, 也产生于γδT(属于一类固有免疫细胞)和αβT细胞, 中性粒细胞和DC细胞中, IL-22可以激活上皮细胞产生抗菌肽, 诱导上皮细胞增殖, 并通过STAT3激活促进肿瘤发展[32,40]. IL-22在肿瘤发生过程中具有双重效应: 短期产生的IL-22能保护机体免受遗传毒性应激, 而不受控制的IL-22活性则促进肿瘤生长. 而IL-22在炎症过程中调节肠道平衡也起着重要作用, IL-22不仅是通过STAT3信号通路促进上皮细胞活化, 还可诱导多种抗菌肽(Claudin-2和Fut-2), 增强肠道固有防御功能[32,40]. IL-22的功能被比喻为"披着狼皮的绵羊"或"双头细胞因子", 因为它既能加剧炎症反应, 又能改善炎症反应[40]. 因此, 对IL-22的严格调控至关重要[41].
IL-22在许多慢性炎症性疾病中都有表达, 包括类风湿性关节炎和牛皮癣, 其上调通常与疾病活动性有关[40]. IL-22既由免疫系统的适应性细胞(如CD4T细胞亚群)表达, 也由天然淋巴细胞(包括NK细胞和LTI样细胞)表达[40].
对小鼠结肠细胞因子的分析显示, 给药后伴随着Th1细胞因子的抑制和IL-22的上调. 用中和抗体阻断IL-22可逆转FICZ(芳香烃受体激动剂)对TNBS-结肠炎小鼠的治疗效果, 从而表明诱导IL-22的产生是AhR(芳香烃受体)信号控制肠道致病反应的主要机制之一[18,40]. 通过AhR激活IL-22途径已在临床试验中显示出对溃疡性结肠炎具有很强的治疗作用[40,41].
IL-22已被证明以一种STAT3依赖的方式改善组织学评分, 在人类结直肠癌组织中, CCR6+CD4+T细胞被证明负责分泌全部数量的IL-22(145). IL-22激活癌细胞中的STAT3磷酸化级联, 诱导干细胞标记物(SOX2、NANOG和Pou5f1)的表达, 从而增加癌症的干性和致瘤潜能[10,41]. 此外, 上皮细胞中STAT3的激活依赖于IL-22而不是IL-6, 表明靶向肠上皮细胞(intestinal epithelial cell, IECS)中的STAT3信号通路是治疗IBD患者的一种有前途的方法. 然而其具体机制的尚不明确, 在癌症的不同发展阶段, IL-22可能会导致不同的后果, 作为潜在的治疗靶点, IL-22的基础研究还有待进一步发掘[41]. 临床上治疗溃疡结肠炎时常用的中药青黛及抗TNF-α这两种疗法中似乎都能看到IL-22的影子, 但具体利弊还需要更深远的研究[42].
IBD中关于Th1和Th2细胞分化途径的研究或多或少已被抛弃, 焦点早已经转向决定CD和UC两种临床表型的Th1和Th17谱之间的平衡, 或者Th17与Treg细胞之间的平衡, 微生物菌群与Th17细胞之间的可塑性[23]. Th17细胞转分化为耐受性的Treg细胞、以及可分泌IFN-γ的Th1细胞和分泌IL-22的Th22样细胞, 可以微调免疫应答, 使Th17细胞成为维持免疫平衡的中心细胞, 但不幸的是, IBD患者因为诸如遗传、转录因子、表观基因组、肠道菌群、微环境和外部环境等因素失去了这种平衡[21], 研究这种平衡的内在关系(可以总结为Th17细胞的可塑性)将会是非常有意义的[21].
综合全文分析, 我们看到Th17细胞在暴露于大量细胞因子环境时, 比其他T细胞类别具有更大的可塑性[21], 并且由IL-6、TGF-β、IL-12、IL-23、IL-21等参与的不同的调控机制, Th17细胞毋庸置疑的在调节IBD的炎症过程中起着关键作用[23], 因此对于Th17细胞的研究需要进一步建立框架, 探索与Th17细胞相关的多种平衡.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | McCombie AM, Mulder RT, Gearry RB. How IBD patients cope with IBD: a systematic review. J Crohns Colitis. 2013;7:89-106. [PubMed] [DOI] |
| 2. | Zhang YZ, Li YY. Inflammatory bowel disease: pathogenesis. World J Gastroenterol. 2014;20:91-99. [PubMed] [DOI] |
| 3. | Neurath MF. Targeting immune cell circuits and trafficking in inflammatory bowel disease. Nat Immunol. 2019;20:970-979. [PubMed] [DOI] |
| 4. | Ganji-Arjenaki M, Rafieian-Kopaei M. Probiotics are a good choice in remission of inflammatory bowel diseases: A meta analysis and systematic review. J Cell Physiol. 2018;233:2091-2103. [PubMed] [DOI] |
| 5. | Geremia A, Biancheri P, Allan P, Corazza GR, Di Sabatino A. Innate and adaptive immunity in inflammatory bowel disease. Autoimmun Rev. 2014;13:3-10. [PubMed] [DOI] |
| 6. | Neurath MF. Cytokines in inflammatory bowel disease. Nat Rev Immunol. 2014;14:329-342. [PubMed] [DOI] |
| 7. | Liu Y, Dong Y, Zhu X, Fan H, Xu M, Chen Q, Nan Z, Wu H, Deng S, Liu X, Zuo D, Yang J. MiR-155 inhibition ameliorates 2, 4, 6-Trinitrobenzenesulfonic acid (TNBS)-induced experimental colitis in rat via influencing the differentiation of Th17 cells by Jarid2. Int Immunopharmacol. 2018;64:401-410. [PubMed] [DOI] |
| 8. | Chen ML, Sundrud MS. Cytokine Networks and T-Cell Subsets in Inflammatory Bowel Diseases. Inflamm Bowel Dis. 2016;22:1157-1167. [PubMed] [DOI] |
| 9. | Yan JB, Luo MM, Chen ZY, He BH. The Function and Role of the Th17/Treg Cell Balance in Inflammatory Bowel Disease. J Immunol Res. 2020;2020:8813558. [PubMed] [DOI] |
| 10. | Zhao J, Lu Q, Liu Y, Shi Z, Hu L, Zeng Z, Tu Y, Xiao Z, Xu Q. Th17 Cells in Inflammatory Bowel Disease: Cytokines, Plasticity, and Therapies. J Immunol Res. 2021;2021:8816041. [PubMed] [DOI] |
| 11. | Neurath MF. IL-23 in inflammatory bowel diseases and colon cancer. Cytokine Growth Factor Rev. 2019;45:1-8. [PubMed] [DOI] |
| 12. | MacDonald JK, Nguyen TM, Khanna R, Timmer A. Anti-IL-12/23p40 antibodies for induction of remission in Crohn's disease. Cochrane Database Syst Rev. 2016;11:CD007572. [PubMed] [DOI] |
| 13. | Castro-Dopico T, Colombel JF, Mehandru S. Targeting B cells for inflammatory bowel disease treatment: back to the future. Curr Opin Pharmacol. 2020;55:90-98. [PubMed] [DOI] |
| 14. | Cai J, Zhang Z. An Analysis of IL-10/IL-10R Genetic Factors Related to Risk of Colon Cancer and Inflammatory Bowel Disease in a Han Chinese Population. Clin Lab. 2016;62:1147-1154. [PubMed] [DOI] |
| 15. | Perez LG, Kempski J, McGee HM, Pelzcar P, Agalioti T, Giannou A, Konczalla L, Brockmann L, Wahib R, Xu H, Vesely MCA, Soukou S, Steglich B, Bedke T, Manthey C, Seiz O, Diercks BP, Gnafakis S, Guse AH, Perez D, Izbicki JR, Gagliani N, Flavell RA, Huber S. TGF-β signaling in Th17 cells promotes IL-22 production and colitis-associated colon cancer. Nat Commun. 2020;11:2608. [PubMed] [DOI] |
| 16. | Yang J, Sundrud MS, Skepner J, Yamagata T. Targeting Th17 cells in autoimmune diseases. Trends Pharmacol Sci. 2014;35:493-500. [PubMed] [DOI] |
| 17. | Yasuda K, Takeuchi Y, Hirota K. The pathogenicity of Th17 cells in autoimmune diseases. Semin Immunopathol. 2019;41:283-297. [PubMed] [DOI] |
| 18. | Xie A, Robles RJ, Mukherjee S, Zhang H, Feldbrügge L, Csizmadia E, Wu Y, Enjyoji K, Moss AC, Otterbein LE, Quintana FJ, Robson SC, Longhi MS. HIF-1α-induced xenobiotic transporters promote Th17 responses in Crohn's disease. J Autoimmun. 2018;94:122-133. [PubMed] [DOI] |
| 19. | Nakase H. Treatment of inflammatory bowel disease from the immunological perspective. Immunol Med. 2020;43:79-86. [PubMed] [DOI] |
| 20. | Niedbala W, Wei XQ, Cai B, Hueber AJ, Leung BP, McInnes IB, Liew FY. IL-35 is a novel cytokine with therapeutic effects against collagen-induced arthritis through the expansion of regulatory T cells and suppression of Th17 cells. Eur J Immunol. 2007;37:3021-3029. [PubMed] [DOI] |
| 21. | Ueno A, Jeffery L, Kobayashi T, Hibi T, Ghosh S, Jijon H. Th17 plasticity and its relevance to inflammatory bowel disease. J Autoimmun. 2018;87:38-49. [PubMed] [DOI] |
| 22. | Zhang M, Fan H, Tan S, Tang Q, Liu X, Zuo D, Liao Y, Nan Z, Tan C. The Chinese medicinal herb decoction QRZSLXF enhances anti-inflammatory effect in TNBS-induced colitis via balancing Th17/Tregs differentiation. J Ethnopharmacol. 2020;251:112549. [PubMed] [DOI] |
| 23. | Olsen T, Rismo R, Cui G, Goll R, Christiansen I, Florholmen J. TH1 and TH17 interactions in untreated inflamed mucosa of inflammatory bowel disease, and their potential to mediate the inflammation. Cytokine. 2011;56:633-640. [PubMed] [DOI] |
| 24. | Jiang W, Su J, Zhang X, Cheng X, Zhou J, Shi R, Zhang H. Elevated levels of Th17 cells and Th17-related cytokines are associated with disease activity in patients with inflammatory bowel disease. Inflamm Res. 2014;63:943-950. [PubMed] [DOI] |
| 25. | Gu C, Wu L, Li X. IL-17 family: cytokines, receptors and signaling. Cytokine. 2013;64:477-485. [PubMed] [DOI] |
| 26. | Monteleone I, Sarra M, Pallone F, Monteleone G. Th17-related cytokines in inflammatory bowel diseases: friends or foes? Curr Mol Med. 2012;12:592-597. [PubMed] [DOI] |
| 27. | Latella G, Viscido A. Controversial Contribution of Th17/IL-17 Toward the Immune Response in Intestinal Fibrosis. Dig Dis Sci. 2020;65:1299-1306. [PubMed] [DOI] |
| 28. | Omidian Z, Ahmed R, Giwa A, Donner T, Hamad ARA. IL-17 and limits of success. Cell Immunol. 2019;339:33-40. [PubMed] [DOI] |
| 29. | Petitpain N, D'Amico F, Yelehe-Okouma M, Jouzeau JY, Netter P, Peyrin-Biroulet L, Gillet P. IL-17 Inhibitors and Inflammatory Bowel Diseases: A Postmarketing Study in Vigibase. Clin Pharmacol Ther. 2021;110:159-168. [PubMed] [DOI] |
| 30. | Burisch J, Eigner W, Schreiber S, Aletaha D, Weninger W, Trauner M, Reinisch W, Narula N. Risk for development of inflammatory bowel disease under inhibition of interleukin 17: A systematic review and meta-analysis. PLoS One. 2020;15:e0233781. [PubMed] [DOI] |
| 31. | Yamada A, Wang J, Komaki Y, Komaki F, Micic D, Sakuraba A. Systematic review with meta-analysis: risk of new onset IBD with the use of anti-interleukin-17 agents. Aliment Pharmacol Ther. 2019;50:373-385. [PubMed] [DOI] |
| 32. | Hohenberger M, Cardwell LA, Oussedik E, Feldman SR. Interleukin-17 inhibition: role in psoriasis and inflammatory bowel disease. J Dermatolog Treat. 2018;29:13-18. [PubMed] [DOI] |
| 33. | Cătană CS, Berindan Neagoe I, Cozma V, Magdaş C, Tăbăran F, Dumitraşcu DL. Contribution of the IL-17/IL-23 axis to the pathogenesis of inflammatory bowel disease. World J Gastroenterol. 2015;21:5823-5830. [PubMed] [DOI] |
| 34. | Moschen AR, Tilg H, Raine T. IL-12, IL-23 and IL-17 in IBD: immunobiology and therapeutic targeting. Nat Rev Gastroenterol Hepatol. 2019;16:185-196. [PubMed] [DOI] |
| 35. | Davies SC, Nguyen TM, Parker CE, MacDonald JK, Jairath V, Khanna R. Anti-IL-12/23p40 antibodies for maintenance of remission in Crohn's disease. Cochrane Database Syst Rev. 2019;12:CD012804. [PubMed] [DOI] |
| 36. | Neumann C, Scheffold A, Rutz S. Functions and regulation of T cell-derived interleukin-10. Semin Immunol. 2019;44:101344. [PubMed] [DOI] |
| 37. | Wei HX, Wang B, Li B. IL-10 and IL-22 in Mucosal Immunity: Driving Protection and Pathology. Front Immunol. 2020;11:1315. [PubMed] [DOI] |
| 38. | Zhu L, Shi T, Zhong C, Wang Y, Chang M, Liu X. IL-10 and IL-10 Receptor Mutations in Very Early Onset Inflammatory Bowel Disease. Gastroenterology Res. 2017;10:65-69. [PubMed] [DOI] |
| 39. | Sun M, Wu W, Chen L, Yang W, Huang X, Ma C, Chen F, Xiao Y, Zhao Y, Ma C, Yao S, Carpio VH, Dann SM, Zhao Q, Liu Z, Cong Y. Microbiota-derived short-chain fatty acids promote Th1 cell IL-10 production to maintain intestinal homeostasis. Nat Commun. 2018;9:3555. [PubMed] [DOI] |
| 40. | Mizoguchi A, Yano A, Himuro H, Ezaki Y, Sadanaga T, Mizoguchi E. Clinical importance of IL-22 cascade in IBD. J Gastroenterol. 2018;53:465-474. [PubMed] [DOI] |
| 41. | Sugimoto K, Ogawa A, Mizoguchi E, Shimomura Y, Andoh A, Bhan AK, Blumberg RS, Xavier RJ, Mizoguchi A. IL-22 ameliorates intestinal inflammation in a mouse model of ulcerative colitis. J Clin Invest. 2008;118:534-544. [PubMed] [DOI] |
| 42. | Mizoguchi A. Healing of intestinal inflammation by IL-22. Inflamm Bowel Dis. 2012;18:1777-1784. [PubMed] [DOI] |