修回日期: 2021-09-28
接受日期: 2021-10-14
在线出版日期: 2021-12-08
既往研究显示柚皮素(naringenin, Nar)可在急性肝损伤动物模型中发挥肝保护作用. 而Nar对酒精性肝病(alcoholic liver disease, ALD)中的作用尚不清楚.
探讨Nar对ALD模型大鼠的肝损伤的影响及作用机制.
将40只SD大鼠随机分为对照组、模型组、低剂量Nar组和高剂量Nar组, 每组10只. 通过酒精诱导法建立大鼠ALD模型. 给药方案结束后, 收集大鼠血样和肝组织. 用全自动生化分析仪检测血清中谷丙转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(aspartate aminotransferase, AST)水平; 用HE染色法观察肝脏组织形态学表现; 用试剂盒法检测肝组织中谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)活性、超氧化物歧化酶(superoxide dismutase, SOD)活性、丙二醛(malondialdehyde, MDA)含量以及活性氧(reactive oxygen species, ROS)生成水平; 用免疫组织化学方法检测肝组织中肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和白介素-6(interleukin-6, IL-6)的水平; 用Western blot检测肝组织中Nrf-2、HO-1和p-NF-κB P65表达水平.
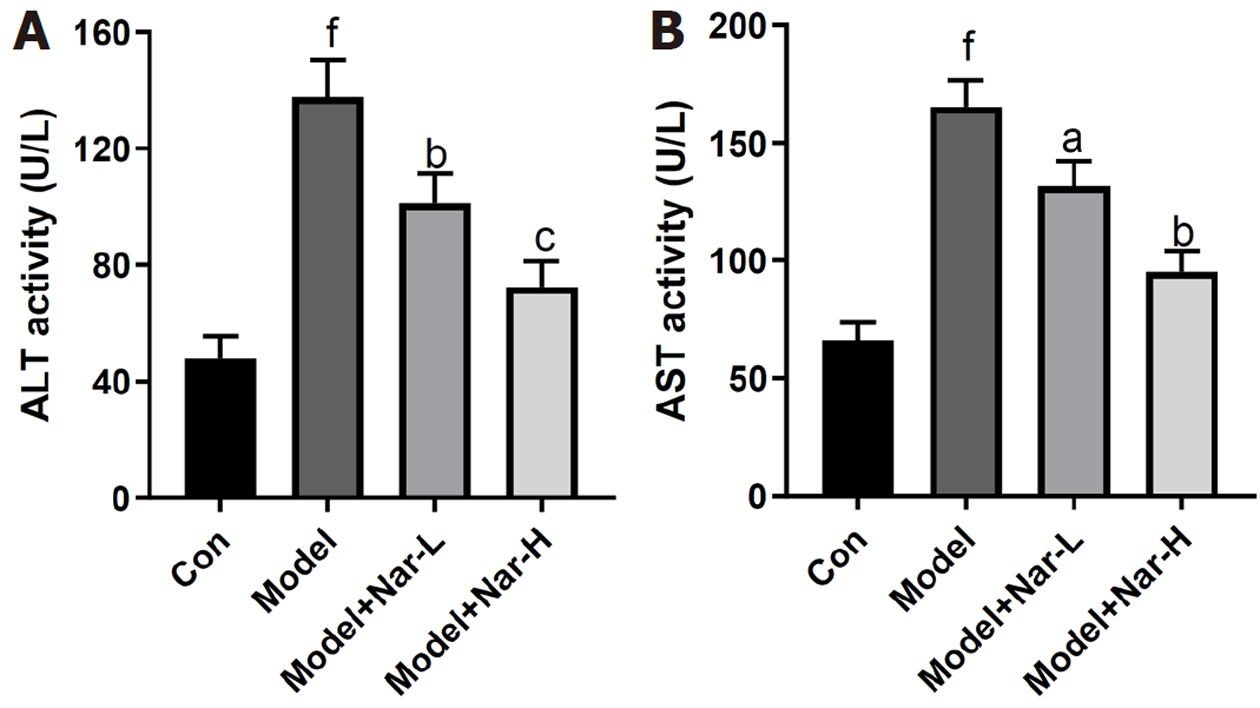
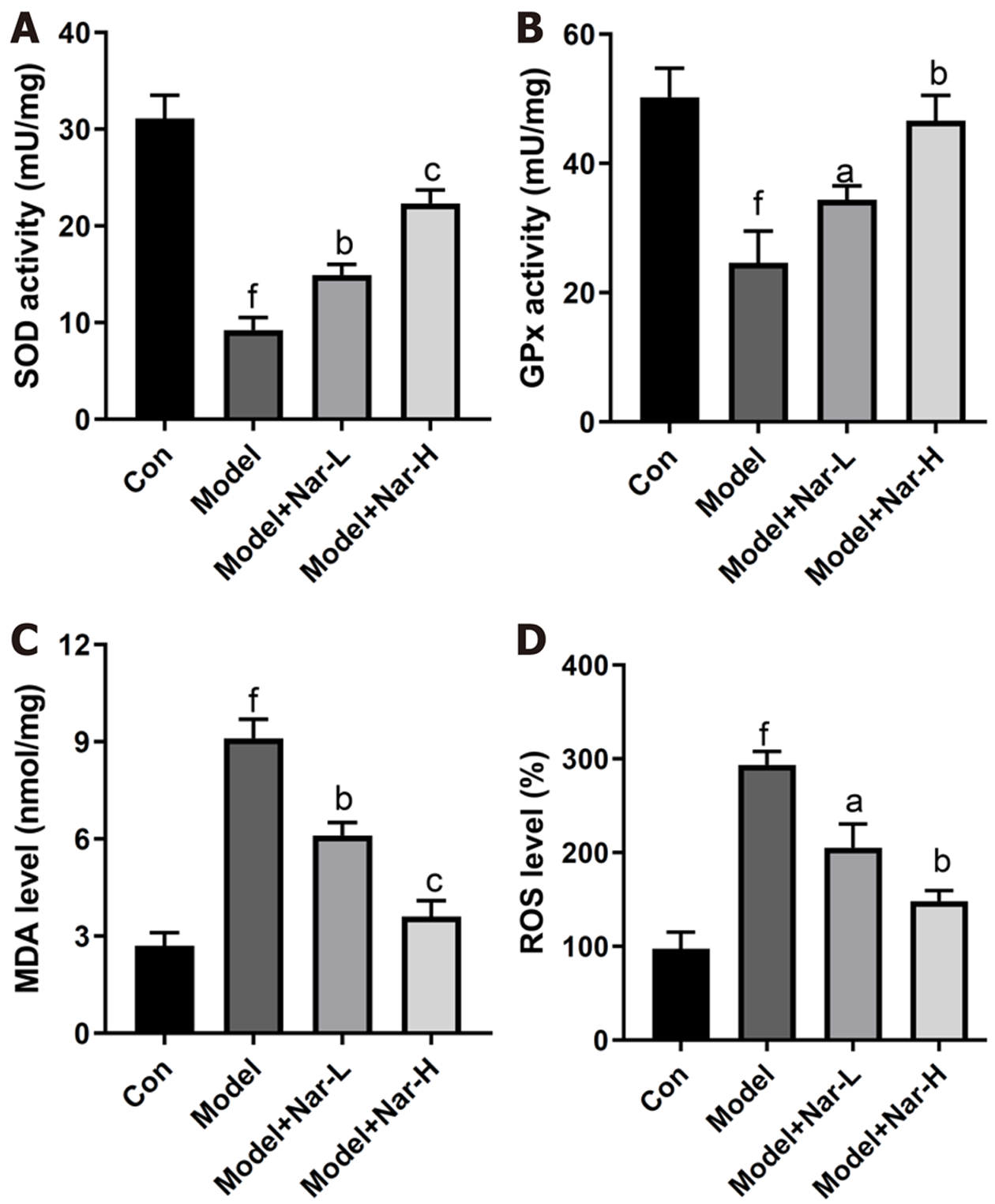
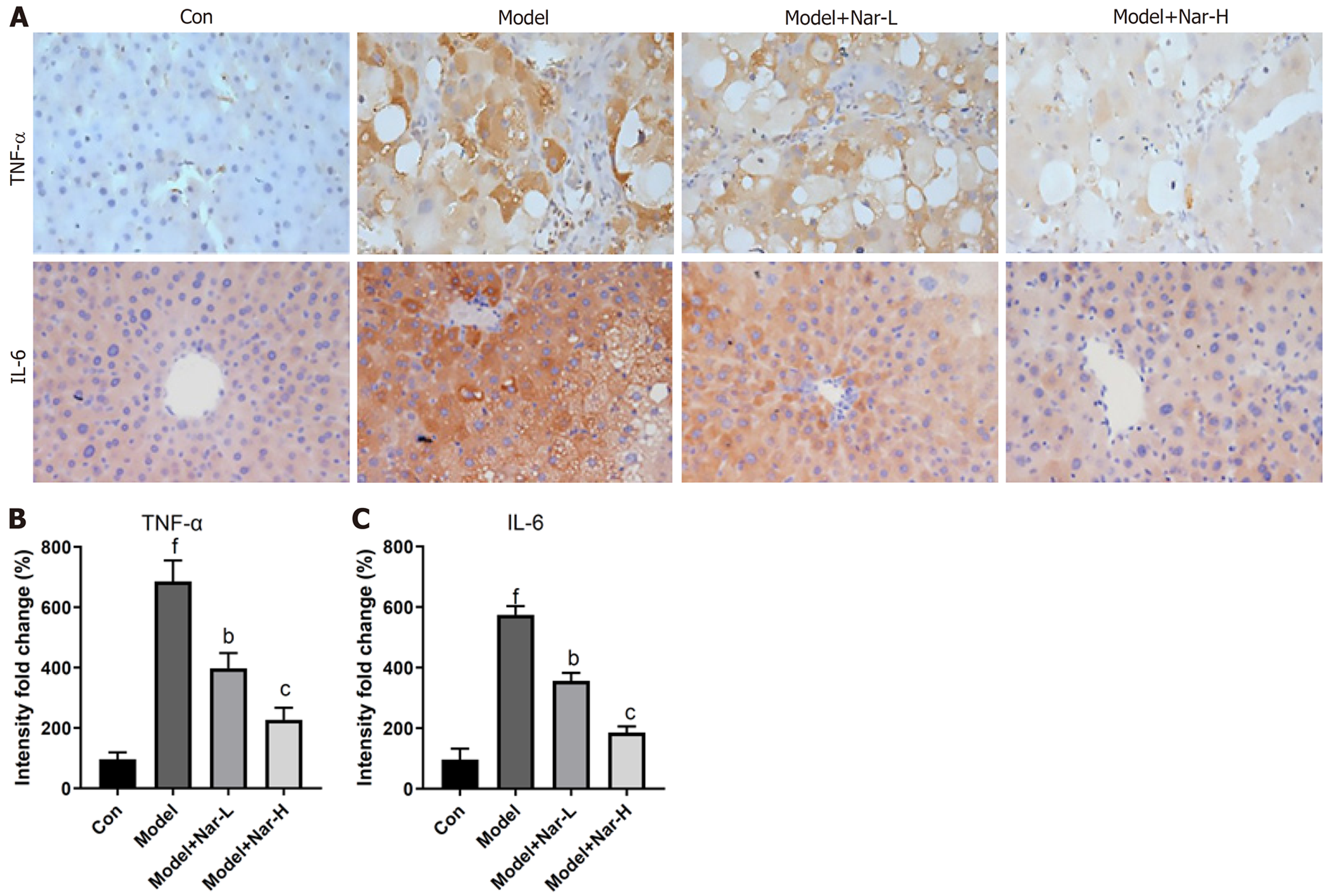
与模型组比较, 不同剂量Nar组大鼠血清中AST和AST水平均明显降低, 肝组织中SOD和GPx活性以及Nrf-2和HO-1表达水平均明显升高, MDA含量、ROS生成水平、TNF-α、IL-6和p-NF-κB P65的表达水平均明显降低, 其中高剂量组效果尤为明显.
Nar能减轻ALD大鼠的肝损伤, 且这一作用可能与其降低肝组织中氧化应激和炎性反应相关.
核心提要: 柚皮素可能通过增强肝组织中超氧化物歧化酶和肝组织中谷胱甘肽过氧化物酶的活性以及降低丙二醛、活性氧以及肝组织中肿瘤坏死因子-α和白介素-6的水平来预防酒精诱发的肝损伤.
引文著录: 喻秀峰, 周增丽, 卢旭东, 龙思琴. 柚皮素对酒精性肝病模型大鼠的肝保护作用. 世界华人消化杂志 2021; 29(23): 1334-1340
Revised: September 28, 2021
Accepted: October 14, 2021
Published online: December 8, 2021
Previous studies have shown that naringenin (Nar) can play a protective role in animal models with acute liver injury, but its role in alcoholic liver disease (ALD) remains unclear.
To explore the effect of Nar on ALD rats and the possible mechanism involved.
Forty Sprague-Dawley rats were randomly divided into a control group, model group, low-dose Nar group, and high-dose Nar group, with 10 rats in each group. A rat model of ALD was generated by alcohol induction. Blood samples and liver tissues were collected at the end of the regimen. The levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in serum were determined with an automatic biochemical analyzer. The morphology of the liver was observed by HE staining. Glutathione peroxidase (GPX) and superoxide dismutase (SOD) activities, malondialdehyde (MDA) content, and reactive oxygen species (ROS) production level in the liver were determined with commercial kits. The levels of tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) in liver tissues were detected by immunohistochemical staining. The expression levels of Nrf-2, HO-1, and p-NF-κB P65 in liver tissues were detected by Western blot.
Compared with the model group, the levels of AST and AST in serum of rats in the low- and high-dose Nar groups were significantly decreased, the activities of SOD and GPx and the expression levels of Nrf-2 and HO-1 in liver tissue were significantly increased, and MDA content, ROS level, and TNF-α, IL-6, and p-NF-κB P65 expression levels were significantly decreased, especially in the high-dose group.
Nar can alleviate liver injury in ALD rats, and this effect may be related to the reduction of oxidative stress and inflammatory response in liver tissue.
- Citation: Yu XF, Zhou ZL, Lu XD, Long SQ. Hepatoprotective effect of naringenin in rats with alcoholic liver disease. Shijie Huaren Xiaohua Zazhi 2021; 29(23): 1334-1340
- URL: https://www.wjgnet.com/1009-3079/full/v29/i23/1334.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i23.1334
酗酒已经成为当今世界普遍存在的严重社会问题, 近年来随着经济的发展和人们生活方式的改变, 我国酒精制品的消费规模大幅增加[1]. 大量研究结果均证实, 肝脏是乙醇代谢和解毒的主要器官, 而长期过量摄入乙醇会引起肝损伤[1,2]. 现今, 随着我国酗酒人数的不断增加, 酒精已经成为仅次于肝炎病毒的导致慢性肝病的第二大原因[3]. 酒精性肝病(alcoholic liver disease, ALD)的病程一般包括酒精性脂肪肝、脂肪性肝炎、肝纤维化和肝硬化, 若无有效的干预措施, ALD甚至会发展成肝细胞癌并最终导致患者死亡[4].
柚皮素(naringenin, Nar)是一种具有抗炎和抗氧化作用的类黄酮天然化合物[5]. 目前研究发现, Nar可在如对乙酰氨基酚[6]、四氯化碳[7]和高效氯氟氰菊酯[8]等因素所致急性肝损伤动物模型中发挥肝保护作用. 而, Nar对ALD中是功效以及具体作用机制尚不清楚. 本研究应用ALD大鼠模型探讨Nar对ALD是否发挥肝保护作用以及机制.
试剂与抗体: 柚皮素(Nar; 纯度>98%)购自南京春秋生物工程有限公司; 谷丙转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(aspartate aminotransferase, AST)检测试剂盒购自南京建成生物工程研究所; 谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)以及活性氧(reactive oxygen species, ROS)检测试剂盒购自上海碧云天生物科技有限公司; Bio-Rad蛋白测定盒购自美国Bio-Rad公司; 兔源肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和白介素-6(interleukin-6, IL-6)抗体购自美国Abcam公司; 生物素偶联山羊抗兔IgG和辣根过氧化物酶标记的链霉素亲和素复合物购自北京中杉金桥生物技术有限公司; 兔源核因子(nuclear factor, NF)-κB P65、兔源p-NF-κB P65、兔源核因子红细胞2相关因子2 (nuclear factor erythroid derived 2-related factor 2, Nrf-2)和兔源血红素氧合酶1(heme oxygenase 1, HO-1)和兔源GAPDH抗体以及辣根过氧化物酶标记的山羊抗兔IgG购自万类生物技术有限公司.
实验动物: 40只清洁级6-7周龄SD雄性大鼠(体重185-200 g)购于浙江维通利华实验动物技术有限公司(生产许可证号: SCXK(浙)2019-0001), 所有大鼠均饲养于维持室温22 ℃-25 ℃、湿度50%-65%和光照/黑暗12 h/12 h循环的动物房, 大鼠可自由饮水饮食. 本研究的动物实验操作符合动物福利伦理要求, 且获得了丽水市人民医院动物伦理委员会批准.
1.2.1 动物模型建立与分组处理: 大鼠经适应性饲养3 d后, 将其随机分为4组: 对照组, 模型组(Model组), 低剂量Nar组(Model+Nar-L组)和高剂量Nar组(Model+Nar-H组), 每组10只. 结合文献[9-11]的方法, 除对照组外, 所有大鼠用10%酒精(8 mL/kg/d, 分为早晚各1次)灌胃1 wk, 用15%酒精(8 mL/kg/d, 分为早晚各1次)灌胃1 wk, 用30%酒精(8 mL/kg/d, 分为早晚各1次)灌胃1 wk, 用56%酒精(8 mL/kg/d, 分为早晚各1次)灌胃7 wk, 对照组用等体积蒸馏水灌胃10 wk. 其中, 结合文献[7,8,12,13]的剂量, Model+Nar-L组与Model+Nar-H组在第4-10周分别灌胃给药25 mg/kg/d和100 mg/kg/d Nar. 在第10周结束后, 所有大鼠用水合氯醛麻醉后, 收集血液样本和肝组织以进行进一步检测.
1.2.2 血清转氨酶水平检测: 根据试剂盒说明书的步骤, 取大鼠血清通过AU480全自动生化分析仪(Beckman Coulter, 美国)对血清中ALT和AST含量进行检测.
1.2.3 肝组织生化检测: 每只大鼠称取200 mg肝组织, 在1.8 mL预冷的生理盐水中匀浆, 1500×g离心5 min, 收集匀浆液. 取匀浆液首先按照Bio-Rad蛋白测定盒方法检测匀浆液中蛋白浓度. 然后, 再取匀浆液, 分别按照检测试剂盒说明书步骤, 检测匀浆液中GPx活性、SOD活性、MDA含量和ROS生成水平. 最后, 将匀浆液中上述因子的含量按照蛋白浓度进行标准化处理.
1.2.4 组织病理学观察: 用4%的多聚甲醛固定肝组织, 然后按照常规流程进行石蜡包埋. 将石蜡组织, 切为5 μm厚的石蜡切片, 并在脱蜡至水后, 用HE染色, 在光学显微镜下观察肝组织形态学表现.
1.2.5 免疫组织化学染色: 取肝组织石蜡切片(5 μm厚)依次经脱蜡、水化和3%双氧水封闭内源性过氧化氢酶后, 用山羊血清封闭切片20 min. 然后, 将切片在4 ℃条件下用TNF-α和IL-6抗体(1:100稀释)孵育过夜, PBS洗切片3次, 用生物素偶联抗兔二抗(1:100稀释)室温孵育45 min, PBS洗切片3次, 用辣根过氧化物酶标记的链霉素亲和素复合物(1:200稀释)室温孵育30 min. PBS洗切片3次, 用DAB显色并用苏木精复染. 显微镜下观察, 并使用Image-Pro plus系统对肝组织中TNF-α和IL-6的表达进行统计分析.
1.2.6 Western blot: 取各组肝组织, 匀浆并提取蛋白后, 行Western blot检测肝组织中Nrf-2、HO-1和p-NF-κB P65蛋白表达情况. Nrf-2、HO-1和NF-κB P65抗体的稀释度为1:3000, p-NF-κB P65抗体的稀释度为1:1000, 选用GAPDH作为内参, 以过氧化物酶标记的山羊抗兔IgG为二抗(稀释度为1:1000). 用ECL发光底物显像后, 用Image-Pro plus系统对肝组织中Nrf-2、HO-1和p-NF-κB P65蛋白的表达进行统计分析.
统计学处理 结果表示为均数±标准差(mean±SD), 多组数据间均数的两两比较采用单因素方差分析事后SNK-q检验. 以P<0.05时, 认为差异具有统计意义.
如图1所示, 与对照组比较, 模型组大鼠血清中ALT和AST活性显著升高(P<0.001); 与模型组相比, 不同剂量Nar组大鼠血清中ALT和AST活性均降低(P<0.05, P<0.01或P<0.001), 且高剂量组更显著(P<0.001). 这些结果说明, Nar能减轻ALD大鼠的肝损伤.
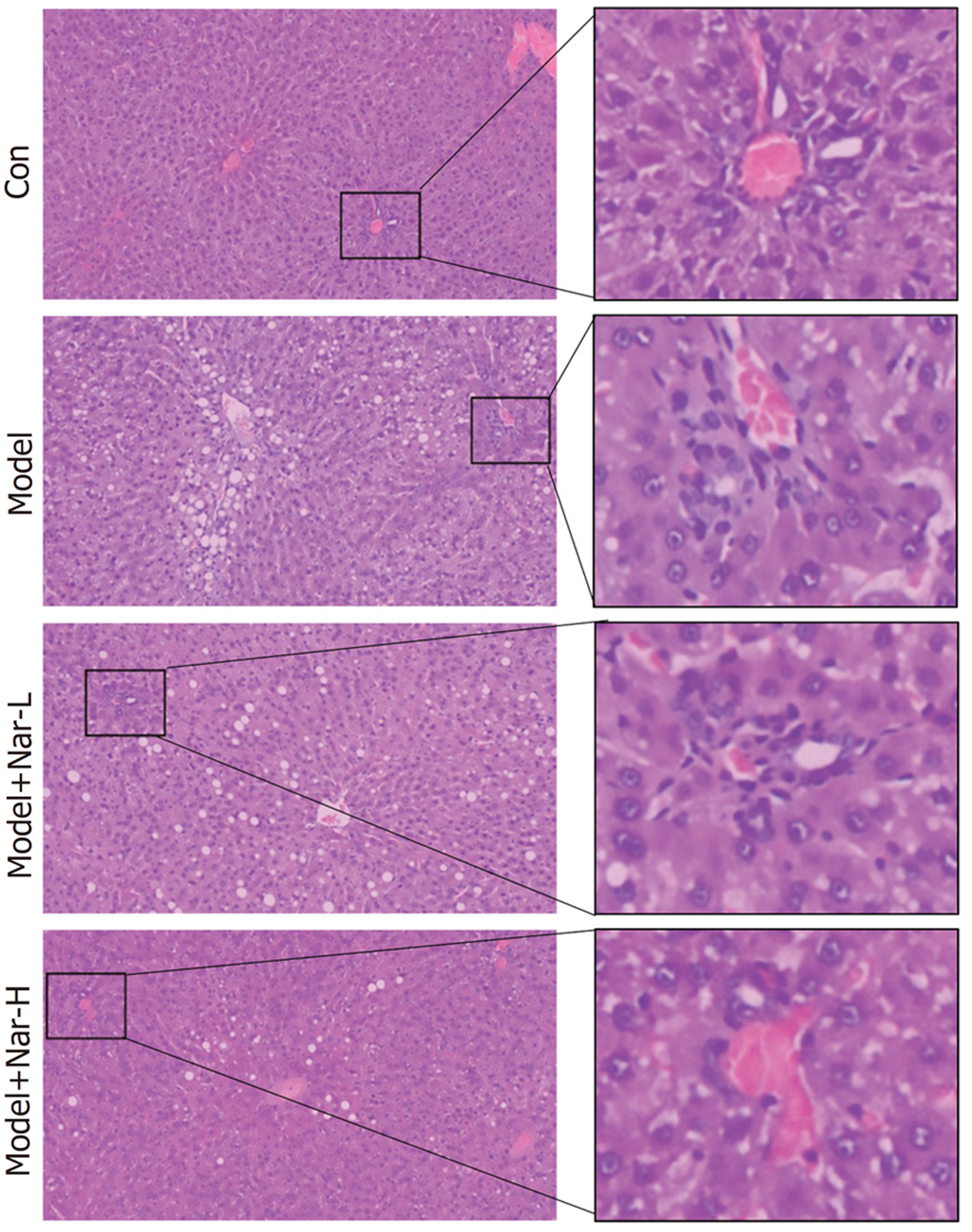
对照组大鼠的肝小叶结构清晰, 肝细胞排列规则, 无变性坏死及炎细胞浸润. 模型组大鼠的肝小叶结构紊乱, 肝细胞体积增大且存在不同程度气球样变和脂肪变, 部分细胞坏死, 部分汇管区可见炎细胞浸润. 不同剂量Nar组大鼠肝组织细胞气球样变、脂肪变范围以及变性坏死和炎细胞浸润程度相对模型组有明显改善, 且高剂量组效果更为明显(图2).
图3A和3B结果显示, 与对照组相比, 模型组大鼠肝组织中的抗氧化酶SOD和GPx活性均明显降低(P<0.001); 与模型组相比, 不同剂量Nar组大鼠肝组织中SOD和GPx活性均明显升高(P<0.05, P<0.01或P<0.001), 且高剂量组更显著(P<0.001). 此外, 与对照组相比, 模型组大鼠肝组织中MDA含量明显升高(P<0.001), 反映ALD大鼠体内脂质过氧化程度升高; 与模型组相比, 不同剂量Nar组大鼠肝组织中MDA含量明显降低(P<0.01或P<0.001), 其中高剂量组效果尤为明显(P<0.001)(图3C). 对大鼠肝脏中ROS水平的检测显示, 与对照组相比, 模型组大鼠肝组织中ROS生成水平增加(P<0.001); 与模型组相比, 不同剂量Nar组大鼠肝组织中ROS生成水平明显降低(P<0.05或P<0.01), 其中高剂量组效果尤为明显(P<0.01)(图3D). 以上结果说明, Nar能降低ALD大鼠肝组织的氧化应激水平.
免疫组织化学结果(图4)显示, 与对照组相比, 模型组大鼠肝组织中TNF-α和IL-6水平明显升高(P<0.001); 与模型组相比, 不同剂量Nar组大鼠肝组织中TNF-α和IL-6水平均明显降低(P<0.01或P<0.001), 且高剂量组更显著(P<0.001). 以上结果说明, Nar能降低ALD大鼠肝组织的炎性反应.
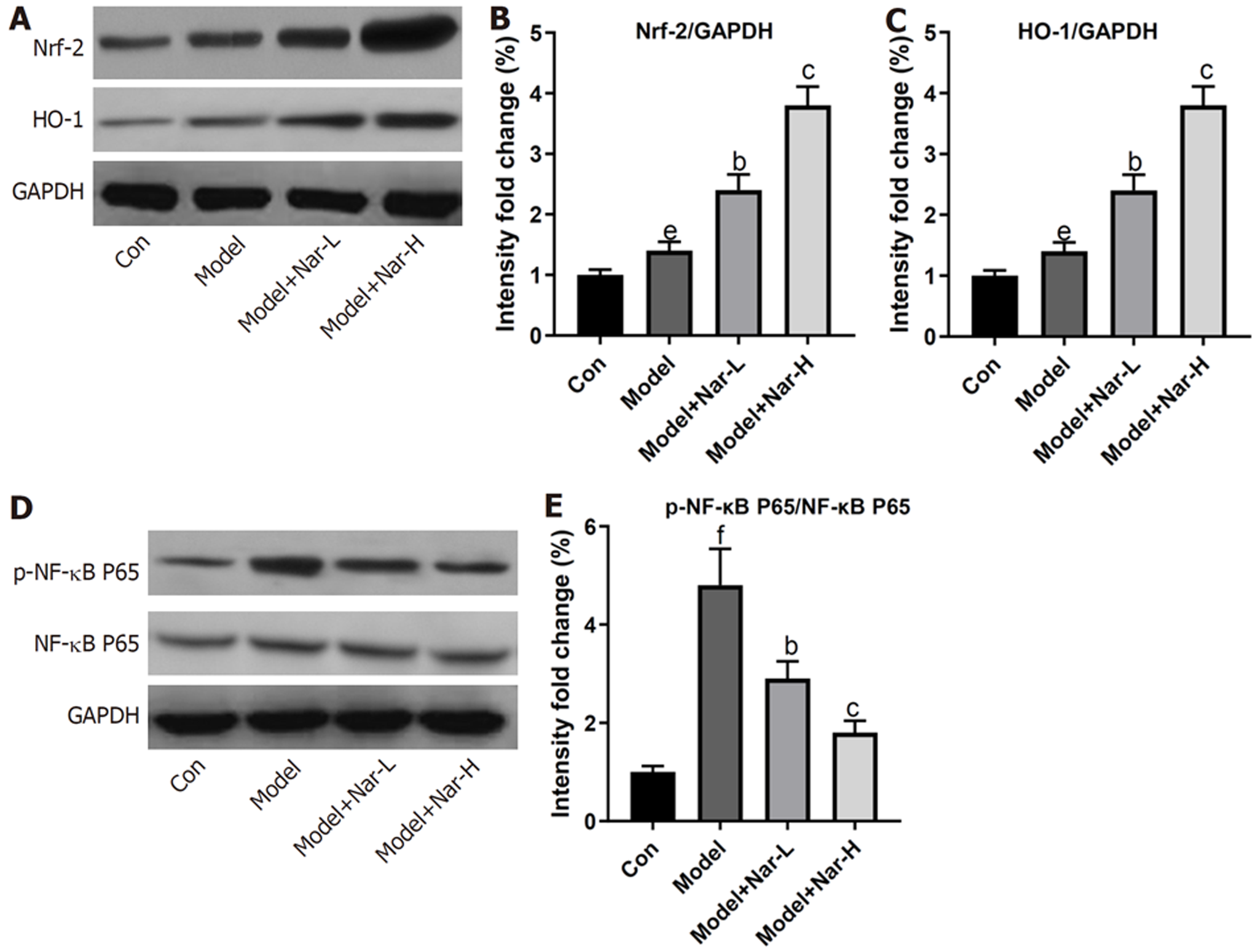
Western blot结果(图5)显示, 与对照组相比, 模型组大鼠肝组织中Nrf-2、HO-1和p-NF-κB P65蛋白水平均明显升高(P<0.05或P<0.001); 与模型组相比, 不同剂量Nar组大鼠肝组织中Nrf-2和HO-1蛋白水平均进一步升高(P<0.01或P<0.001), 而p-NF-κB P65蛋白水平则明显降低(P<0.01或P<0.001), 且高剂量组更显著(P<0.001). 以上结果说明, Nar能增强ALD大鼠肝组织中Nrf-2/HO-1信号活性和减弱NF-κB信号活性.
长期酗酒可导致肝损伤、肝纤维化形成, 并最终出现肝硬化甚至肝癌[4]. 由于ALD发生和发展的病理机制复杂, 造成目前大多用于治疗慢性肝损伤的西药对ALD未获得令人满意的治疗效果[14]. 从天然中药材中筛选具有低毒、肝保护、抗炎和抗氧化等生物活性的天然小分子化合物逐渐成为这类肝病治疗的新方向[15,16]. Nar是一种具有抗炎和抗氧化作用的二氢黄酮类化合物[5], 其已被发现在各种因素所致急性肝损伤动物模型中发挥肝保护作用[6-8,13]. 而, Nar对ALD中是功效以及具体作用机制尚不清楚. 因此, 本研究通过酒精诱导法建立大鼠ALD模型, 并观察Nar对ALD作用及可能机制.
本研究首先通过检测Nar对ALD模型大鼠的肝功能和病理形态学的影响来评估其疗效. AST和ALT作为评估肝脏功能的关键生物学指标, 能够直接反应肝脏损害的程度[17]. 病理形态学改变能直观体现到肝损伤情况. 本研究结果显示, ALD模型大鼠的血清ALT和AST水平显著增加和肝脏组织形态学发生明显改变, 而Nar处理可以降低ALT和AST水平和改善肝脏组织形态学, 说明Nar是潜在的抗ALD的药物.
本研究进一步对Nar减轻酒精导致的肝损伤的机制进行探索. 长期的氧化应激和炎性反应是影响肝损伤进展的主要驱动因素[18,19]. Nrf-2信号是机体氧化/还原调控系统最主要的信号途径. 当肝脏外界刺激时, Nrf-2被激活, 进一步增强Nrf-2活性可通过促进下游抗氧化基因如SOD和GPx表达, 对ROS诱导的肝氧化损伤起到关键的防御作用[20,21]. SOD可通过催化自由基的歧化反应来防止自由基与膜脂和蛋白质间发生继发反应来减少对肝细胞的损伤[18]; GPx则是一种重要的过氧化物分解代谢酶, 可以清除自由基并保护细胞膜和蛋白质免受自由基损害[22]. 本研究结果表明, Nar不仅能增强ALD大鼠肝组织中Nrf-2表达以及GPx和SOD的活性还能抑制MDA含量和ROS生成水平, 从而保护大鼠肝脏使其免受酒精引起的氧化应激损伤; 这与前人的研究结果(Nar可通过降低氧化应激水平来达到抑制对乙酰氨基酚、高效氯氟氰菊酯和阿霉素造成的肝损伤)相符合[6,8,23]. 此外, 长期饮酒能使肝组织对炎性反应敏感, 且高水平的促炎因子能加剧肝损伤. 已有研究[24,25]报道, 增强Nrf-2活性可进一步促进抗氧化剂HO-1的蛋白表达, 以维持氧化平衡的方式抑制NF-κB信号活性, 从而抑制肝脏中的炎性反应. 我们的研究结果表明, Nar可促进酒精引起的肝组织中HO-1的蛋白表达以及降低p-NF-κB P65表达和促炎因子TNF-α和IL-6的水平; 提示, 在ALD大鼠肝组织中, Nar可能通过增强Nrf-2/HO-1信号活性并降低NF-κB活化来达到抗炎的效应.
总之, 本研究结果表明, Nar可能通过抗氧化和抗炎的作用来预防酒精诱发的肝损伤.
长期酗酒会引起酒精性肝病(alcoholic liver disease, ALD), ALD不仅能引起肝损伤还可能导致肝硬化和肝细胞癌.
柚皮素(naringenin, Nar)已被证明其具有抗炎和抗氧化作用, 且还发现其具有肝保护作用. 而Nar是否能抑制ALD以及其机制并不清楚.
以ALD大鼠模型探讨Nar对ALD大鼠肝损伤的影响并分析其作用机制.
用酒精诱导法建立ALD大鼠模型, 并给予Nar治疗. 收集血样和肝组织, 并用生化法、组织学法和Western blot法检测Nar对肝损伤标记物谷丙转氨酶和谷草转氨酶、炎症因子肿瘤坏死因子-α和白介素-6、氧化应激相关标记物谷胱甘肽过氧化物酶、超氧化物歧化酶、丙二醛和活性氧簇、以及Nrf-2/HO-1和NF-κB信号活性的影响.
Nar可降低ALD大鼠的肝损伤、氧化应激水平以及炎症, 并能增强肝组织中Nrf-2/HO-1活性和减弱NF-κB活性.
Nar能通过抗氧化和抗炎途径在ALD大鼠中发挥肝保护作用.
Nar可能是潜在的用于ALD治疗的肝保护剂.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Rehm J, Mathers C, Popova S, Thavorncharoensap M, Teerawattananon Y, Patra J. Global burden of disease and injury and economic cost attributable to alcohol use and alcohol-use disorders. Lancet. 2009;373:2223-2233. [PubMed] [DOI] |
| 2. | Asrani SK, Devarbhavi H, Eaton J, Kamath PS. Burden of liver diseases in the world. J Hepatol. 2019;70:151-171. [PubMed] [DOI] |
| 3. | Wang WJ, Xiao P, Xu HQ, Niu JQ, Gao YH. Growing burden of alcoholic liver disease in China: A review. World J Gastroenterol. 2019;25:1445-1456. [PubMed] [DOI] |
| 4. | Osna NA, Donohue TM, Kharbanda KK. Alcoholic Liver Disease: Pathogenesis and Current Management. Alcohol Res. 2017;38:147-161. [PubMed] |
| 5. | Zeng W, Jin L, Zhang F, Zhang C, Liang W. Naringenin as a potential immunomodulator in therapeutics. Pharmacol Res. 2018;135:122-126. [PubMed] [DOI] |
| 6. | Lv Y, Zhang B, Xing G, Wang F, Hu Z. Protective effect of naringenin against acetaminophen-induced acute liver injury in metallothionein (MT)-null mice. Food Funct. 2013;4:297-302. [PubMed] [DOI] |
| 7. | Esmaeili MA, Alilou M. Naringenin attenuates CCl4 -induced hepatic inflammation by the activation of an Nrf2-mediated pathway in rats. Clin Exp Pharmacol Physiol. 2014;41:416-422. [PubMed] [DOI] |
| 8. | El-Saad AMA, Abdel-Wahab WM. Naringenin Attenuates Toxicity and Oxidative Stress Induced by Lambda-cyhalothrin in Liver of Male Rats. Pak J Biol Sci. 2020;23:510-517. [PubMed] [DOI] |
| 11. | Huang H, Lin Z, Zeng Y, Lin X, Zhang Y. Probiotic and glutamine treatments attenuate alcoholic liver disease in a rat model. Exp Ther Med. 2019;18:4733-4739. [PubMed] [DOI] |
| 12. | Wang J, Zhu H, Lin S, Wang K, Wang H, Liu Z. Protective effect of naringenin against cadmium-induced testicular toxicity in male SD rats. J Inorg Biochem. 2021;214:111310. [PubMed] [DOI] |
| 13. | Ustuner D, Kolac UK, Ustuner MC, Tanrikut C, Ozdemir Koroglu Z, Burukoglu Donmez D, Ozen H, Ozden H. Naringenin Ameliorate Carbon Tetrachloride-Induced Hepatic Damage Through Inhibition of Endoplasmic Reticulum Stress and Autophagy in Rats. J Med Food. 2020;23:1192-1200. [PubMed] [DOI] |
| 14. | Stickel F, Datz C, Hampe J, Bataller R. Pathophysiology and Management of Alcoholic Liver Disease: Update 2016. Gut Liver. 2017;11:173-188. [PubMed] [DOI] |
| 15. | Zhang HY, Wang HL, Zhong GY, Zhu JX. Molecular mechanism and research progress on pharmacology of traditional Chinese medicine in liver injury. Pharm Biol. 2018;56:594-611. [PubMed] [DOI] |
| 16. | Ding L, Wo L, Du Z, Tang L, Song Z, Dou X. Danshen protects against early-stage alcoholic liver disease in mice via inducing PPARα activation and subsequent 4-HNE degradation. PLoS One. 2017;12:e0186357. [PubMed] [DOI] |
| 17. | Xiong X, Ren Y, Cui Y, Li R, Wang C, Zhang Y. Obeticholic acid protects mice against lipopolysaccharide-induced liver injury and inflammation. Biomed Pharmacother. 2017;96:1292-1298. [PubMed] [DOI] |
| 18. | Khan HA, Ahmad MZ, Khan JA, Arshad MI. Crosstalk of liver immune cells and cell death mechanisms in different murine models of liver injury and its clinical relevance. Hepatobiliary Pancreat Dis Int. 2017;16:245-256. [PubMed] [DOI] |
| 19. | Kim HG, Huang M, Xin Y, Zhang Y, Zhang X, Wang G, Liu S, Wan J, Ahmadi AR, Sun Z, Liangpunsakul S, Xiong X, Dong XC. The epigenetic regulator SIRT6 protects the liver from alcohol-induced tissue injury by reducing oxidative stress in mice. J Hepatol. 2019;71:960-969. [PubMed] [DOI] |
| 20. | Li L, Liu Q, Fan L, Xiao W, Zhao L, Wang Y, Ye W, Lan F, Jia B, Feng H, Zhou C, Yue X, Xing G, Wang T. Protective effects of oxymatrine against arsenic trioxide-induced liver injury. Oncotarget. 2017;8:12792-12799. [PubMed] [DOI] |
| 21. | Prasanna PL, Renu K, Valsala Gopalakrishnan A. New molecular and biochemical insights of doxorubicin-induced hepatotoxicity. Life Sci. 2020;250:117599. [PubMed] [DOI] |
| 22. | Rua RM, Ojeda ML, Nogales F, Rubio JM, Romero-Gómez M, Funuyet J, Murillo ML, Carreras O. Serum selenium levels and oxidative balance as differential markers in hepatic damage caused by alcohol. Life Sci. 2014;94:158-163. [PubMed] [DOI] |
| 23. | Wali AF, Rashid S, Rashid SM, Ansari MA, Khan MR, Haq N, Alhareth DY, Ahmad A, Rehman MU. Naringenin Regulates Doxorubicin-Induced Liver Dysfunction: Impact on Oxidative Stress and Inflammation. Plants (Basel). 2020;9. [PubMed] [DOI] |
| 24. | Ahmad A, Alkharfy KM, Bin Jardan YA, Shahid M, Ansari MA, Alqahtani S, Jan BL, Al-Jenoobi FI, Raish M. Sinapic acid mitigates methotrexate-induced hepatic injuries in rats through modulation of Nrf-2/HO-1 signaling. Environ Toxicol. 2021;36:1261-1268. [PubMed] [DOI] |
| 25. | Ali FEM, Saad Eldien HM, Mostafa NAM, Almaeen AH, Marzouk MRA, Eid KM, Ghoziz AHE, Ebrahiem AF, Hagag MG, Ghogar OM. The Impact of Royal Jelly against Hepatic Ischemia/Reperfusion-Induced Hepatocyte Damage in Rats: The Role of Cytoglobin, Nrf-2/HO-1/COX-4, and P38-MAPK/NF-κB-p65/TNF-α Signaling Pathways. Curr Mol Pharmacol. 2021;14:88-100. [PubMed] [DOI] |