修回日期: 2021-08-25
接受日期: 2021-10-14
在线出版日期: 2021-11-28
circ_0000212是一种新发现的非编码RNA, 其高表达可促进结直肠癌进展. 然而, circ_0000212在肝癌中的表达模式和作用仍然未知.
探讨circ_0000212靶向miR-139-5p对肝癌细胞增殖、迁移、侵袭、凋亡以及紫杉醇敏感性的影响.
RT-qPCR检测circ_0000212和miR-139-5p在肝癌组织、癌旁组织中的表达. Pearson相关分析确定肝癌组织中circ_0000212和miR-139-5p表达的关系. 双荧光素酶报告实验验证circ_0000212和miR-139-5p靶向关系. 将肝癌细胞HCC9204分为对照组、干扰circ_0000212组、干扰circ_0000212 +miR-139-5p抑制物组、紫杉醇组、紫杉醇+干扰circ_0000212组、紫杉醇+干扰circ_0000212+miR-139-5p抑制物组. CCK-8法检测HCC9204细胞抑制率; 集落形成实验检测HCC9204细胞集落形成数; 流式细胞术检测HCC9204细胞凋亡率; Transwell实验检测HCC9204细胞迁移和侵袭数.
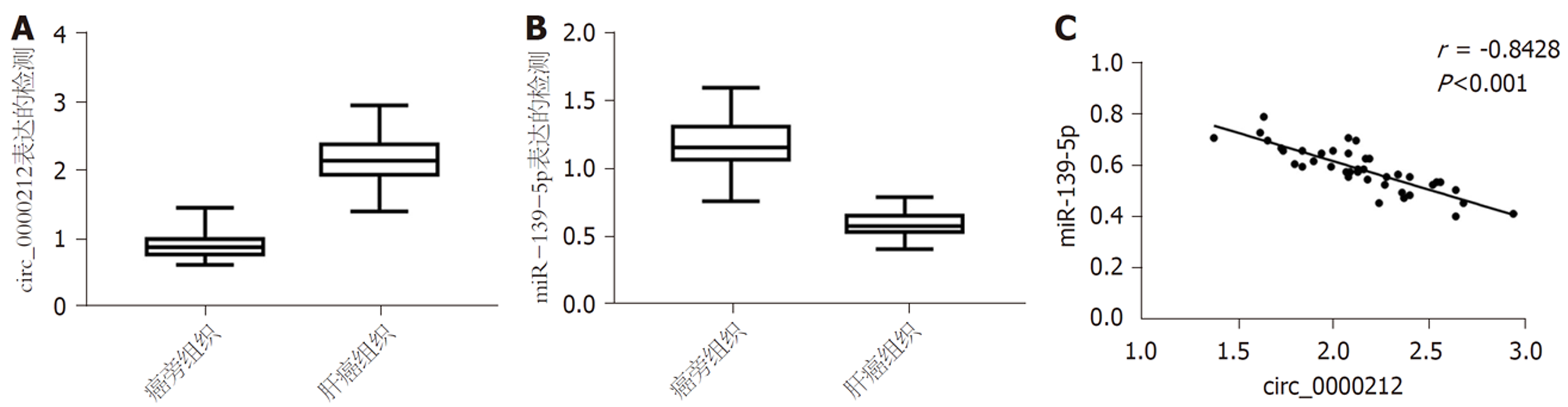
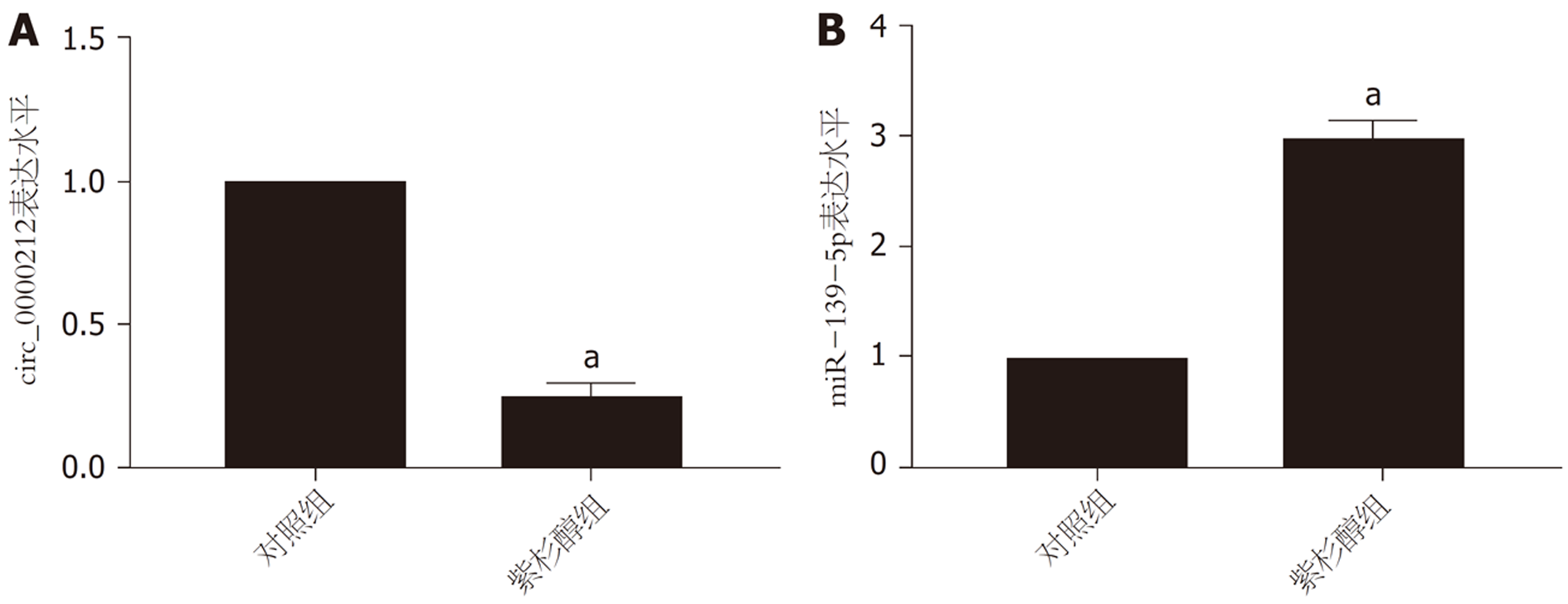
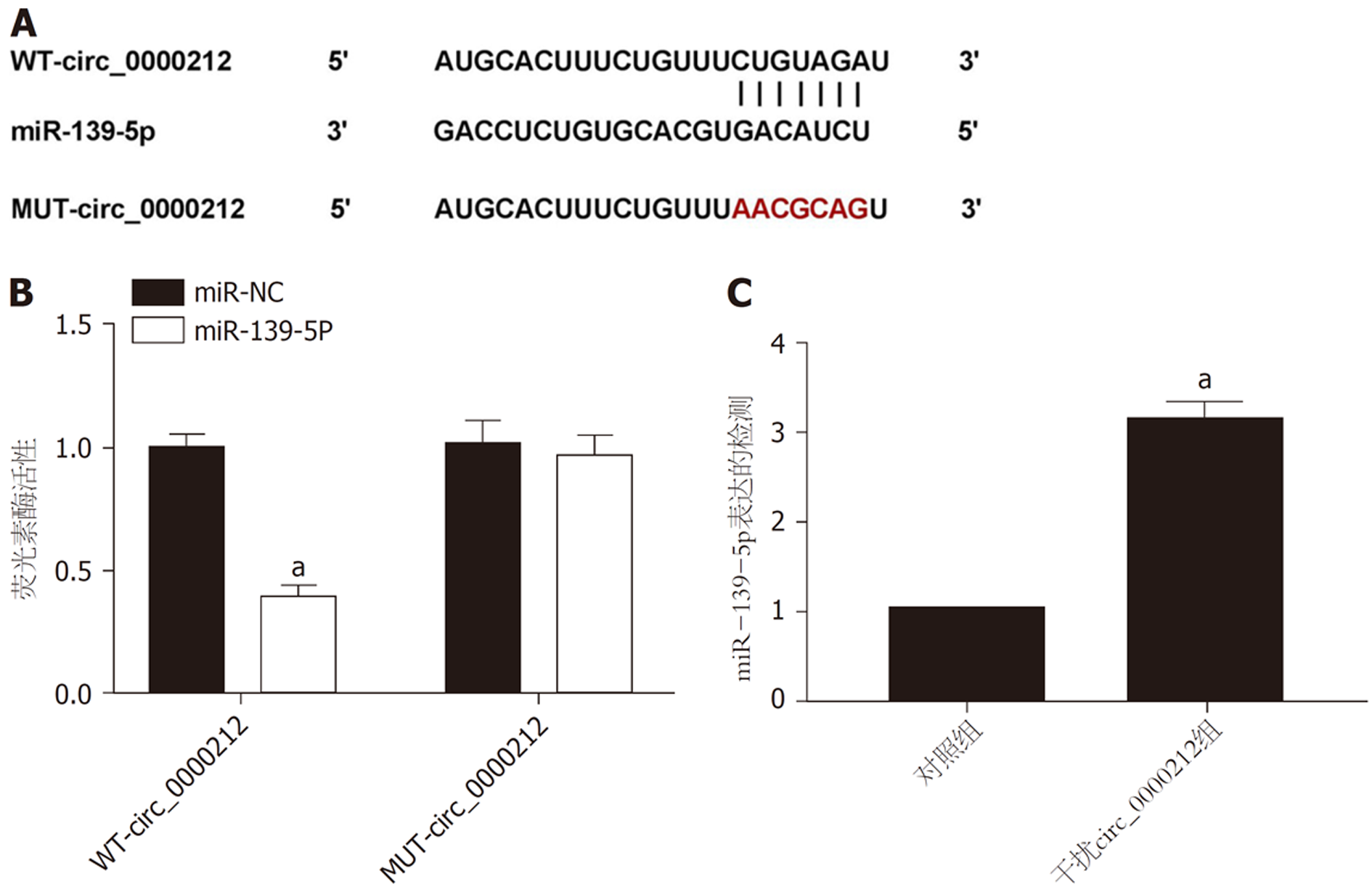
与癌旁组织比较, 肝癌组织中circ_0000212表达水平显著升高(P<0.05), miR-139-5p表达水平显著降低(P<0.05). 肝癌组织中circ_0000212和miR-139-5p表达呈负相关关系. circ_0000212和miR-139-5p存在直接相互作用. 与对照组比较, 紫杉醇组HCC9204细胞circ_0000212表达水平显著降低(P<0.05), miR-139-5p表达水平显著升高(P<0.05). 与对照组比较, 干扰circ_0000212组、紫杉醇组HCC9204细胞克隆形成数、迁移数、侵袭数显著降低(P<0.05), 抑制率、凋亡率显著升高(P<0.05). 与干扰circ_0000212组比较, 干扰circ_0000212 +miR-139-5p抑制物组HCC9204细胞克隆形成数、迁移数、侵袭数显著升高(P<0.05), 抑制率、凋亡率显著降低(P<0.05). 与紫杉醇组比较, 紫杉醇+干扰circ_0000212组HCC9204细胞克隆形成数、迁移数、侵袭数显著降低(P<0.05), 抑制率、凋亡率显著升高(P<0.05). 与紫杉醇+干扰circ_0000212组比较, 紫杉醇+干扰circ_0000212+miR-139-5p抑制物组HCC9204细胞克隆形成数、迁移数、侵袭数显著升高(P<0.05), 抑制率、凋亡率显著降低(P<0.05).
干扰circ_0000212通过靶向上调miR-139-5p可抑制肝癌细胞增殖、迁移、侵袭能力, 诱导细胞凋亡, 并提高其对紫杉醇的敏感性.
核心提要: 肝癌组织中circ_0000212表达上调, miR-139-5p表达下调. circ_0000212可靶向负调控miR-139-5p表达. 干扰circ_0000212通过靶向上调miR-139-5p可抑制肝癌细胞增殖、迁移、侵袭能力, 诱导细胞凋亡, 并提高其对紫杉醇的敏感性. circ_0000212和miR-139-5p可能是紫杉醇化疗增敏、抑制肝癌进展的潜在靶点.
引文著录: 张惠忠, 张晓东, 黄建新. circ_0000212靶向miR-139-5p对肝癌细胞增殖、迁移、侵袭、凋亡以及紫杉醇敏感性的影响. 世界华人消化杂志 2021; 29(22): 1276-1285
Revised: August 25, 2021
Accepted: October 14, 2021
Published online: November 28, 2021
Circ_0000212 is a newly discovered non-coding RNA whose high expression promotes the progression of colorectal cancer. However, the expression patterns and roles of circ_0000212 in liver cancer remain unknown.
To investigate the effect of circ_0000212 targeting miR-139-5p on cell proliferation, migration, invasion, apoptosis, and paclitaxel sensitivity in liver cancer.
RT-qPCR was applied to detect the expression of circ_0000212 and miR-139-5p in liver cancer tissues and adjacent tissues. Pearson correlation analysis was performed to determine the relationship between circ_0000212 and miR-139-5p expression in liver cancer tissues. Dual luciferase reporter assay was used to verify the targeting relationship between circ_0000212 and miR-139-5p. Liver cancer HCC9204 cells were divided into a control group, circ_0000212 interference group, circ_0000212 interference + miR-139-5p inhibitor group, paclitaxel group, paclitaxel + circ_0000212 interference group, and paclitaxel + circ_0000212 interference + miR-139-5p inhibitor group. The rate of inhibited HCC9204 cells was detected using CCK-8 method; the number of clones formed by HCC9204 cells was calculated using colony formation assay; the apoptotic rate of HCC9204 cells was evaluated by flow cytometry; and the migration and invasion of HCC9204 cells were detected by Transwell assay.
Compared with adjacent tissue, the expression level of circ_0000212 in liver cancer tissue was significantly increased (P < 0.05), while the expression level of miR-139-5p was significantly decreased (P < 0.05). There was a negative correlation between the expression of circ_0000212 and miR-139-5p in liver cancer tissues. Circ_0000212 directly interacted with miR-139-5p. Compared with the control group, circ_0000212 expression in HCC9204 cells in the paclitaxel group was significantly reduced (P < 0.05), while miR-139-5p expression was significantly increased (P < 0.05). Compared with the control group, the numbers of clones formed and migrating and invading HCC9204 cells in the interference circ_0000212 group and paclitaxel group were significantly reduced (P < 0.05), and the inhibition rate and apoptosis rate were significantly increased (P < 0.05). Compared with the circ_0000212 interference group, the numbers of clone formed and migrating and invading HCC9204 cells in the interference circ_0000212+miR-139-5p inhibitor group were significantly increased (P < 0.05), and the inhibition rate and apoptosis rate were significantly reduced (P < 0.05). Compared with the paclitaxel group, the numbers of clones formed and migrating and invading HCC9204 cells in the paclitaxel + circ_0000212 interference group were significantly reduced (P < 0.05), and the inhibition rate and apoptosis rate were significantly increased (P < 0.05). Compared with the paclitaxel + circ_0000212 interference group, the numbers of clones formed and migrating and invading HCC9204 cells in the paclitaxel + circ_0000212 interference + miR-139-5p inhibitor group were significantly increased (P < 0.05), and the inhibition rate and apoptosis rate were significantly reduced (P < 0.05).
Interfering with circ_0000212 can inhibit cell proliferation, migration, and invasion, induce cell apoptosis, and increase its sensitivity to paclitaxel in liver cancer cells by targeting and up-regulating miR-139-5p.
- Citation: Zhang HZ, Zhang XD, Huang JX. Circ_0000212 affects proliferation, migration, invasion, apoptosis, and paclitaxel sensitivity of liver cancer cells by targeting miR-139-5p. Shijie Huaren Xiaohua Zazhi 2021; 29(22): 1276-1285
- URL: https://www.wjgnet.com/1009-3079/full/v29/i22/1276.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i22.1276
肝癌是世界上最常见的恶性肿瘤之一, 具有恶性程度高、预后差等特点, 严重危害人们的生命健康. 手术切除、经导管动脉化疗栓塞、靶向药物治疗的应用虽然延长了肝癌患者的生存时间, 但由于肝血供丰富, 术后复发和转移仍是肝癌患者死亡的主要原因[1]. 紫杉醇是治疗肝癌的常用化疗药物, 然而在连续治疗后肝癌细胞通常对紫杉醇脱敏, 这严重限制其临床疗效[2]. 阐明肝癌进展、紫杉醇耐药的分子机制, 对开发新的肝癌治疗策略至关重要. 环状RNA (circRNA)是起源于外显子、内含子或基因间区域的闭环结构RNA分子, 其可能通过与特定微小RNA (miRNA)结合而扮演竞争性内源RNA (ceRNAs)角色, 从而调控下游基因表达, 参与癌细胞增殖、转移、耐药等一系列生物学过程[3,4]. 研究报道circ_0000212在结直肠癌组织中表达增加, circ_0000212通过靶向miR-491和调节叉头框蛋白4(FOXP4)表达来促进结直肠癌细胞增殖[5]. 生物信息学分析发现miR-139-5p是circ_0000212的潜在靶点. miR-139-5p低表达被报道与肝癌患者预后差相关, 上调miR-139-5p可抑制肝癌细胞的糖酵解代谢、增殖和转移[6]. 然而, circ_0000212是否靶向miR-139-5p参与癌症进展仍有待研究. 本研究从细胞增殖、迁移、侵袭、凋亡和紫杉醇耐药角度探讨circ_0000212和miR-139-5p在肝癌进展中的作用, 旨在为抑制肝癌进展、克服紫杉醇耐药提供可用靶点.
1.1.1 一般资料: 肝癌组织和对应癌旁组织(正常组织)取自2018-05/2019-05在我院接受手术治疗的41例肝癌患者. 男性37例, 女性4例, 年龄在48-73岁之间, 中位年龄57岁. 切除后将组织快速冷冻, 然后在-80 ℃下保存.
1.1.2 细胞和试剂: 人肝癌细胞HCC9204购自美国ATCC; Trizol试剂盒、逆转录试剂盒购自美国Thermo fisher公司; SYBR Green mix试剂盒购自大连Takara公司; DMEM培养基、青链霉素混合液、胎牛血清购自武汉普诺赛生物公司; 紫杉醇(纯度99.9%)购自上海研生生化试剂有限公司; 细胞计数试剂盒(CCK-8)、si-circ_0000212、miR-139-5p inhibitor购自上海生工生物工程公司; 膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒购自南京诺维赞生物公司; Transwell小室购自美国Corning公司; 山羊抗兔IgG二抗(ab205718)、兔cleaved-caspase3多克隆抗体(ab2302)兔磷酸甘油醛脱氢酶(GAPDH)多克隆抗体(ab245355)购自美国Abcam公司.
1.2.1 RT-qPCR检测肝癌组织中circ_0000212和miR-139-5p表达: 用Trizol试剂盒从组织中提取总RNA, 根据逆转录试剂盒说明书合成cDNA, 采用SYBR Green mix试剂盒进行RT-qPCR. 反应条件为94 ℃ 2 min; 然后94 ℃ 15 s和60 ℃ 1 min, 循环40次. 2-ΔΔCt法计算circ_0000212和miR-139-5p表达水平. circ_0000212上游引物5′-GTT TGG GAG GCT TCT TGG TAA T-3′, circ_0000212下游引物5′-AAA GCC AGT TTC CTC CAA GC-3′; GAPDH上游引物5′-CAC CCA CTC CTC CAC CTT TG-3′, GAPDH下游引物5′-CCA CCA CCC TGT TGC TGT AG-3′; miR-139-5p上游引物5′-TCT ACA GTG CAC GTG TCT CCA G-3′, miR-139-5p下游引物5′-GTG CAG GGT CCG AGG T-3′; U6上游引物5′-TGC GGG TGC TCG CTT CGG CAG C-3′, U6下游引物5′-GTG CAG GGT CCG AGG T-3′.
1.2.2 细胞培养: HCC-9204细胞接种到1%青链霉素双抗+10%胎牛血清+89%DMEM培养基的培养皿, 置于37 ℃、CO2体积分数为5%的培养箱孵育. 当细胞融合度达到80%时, 胰蛋白酶消化细胞, 1:2-1:3传代.
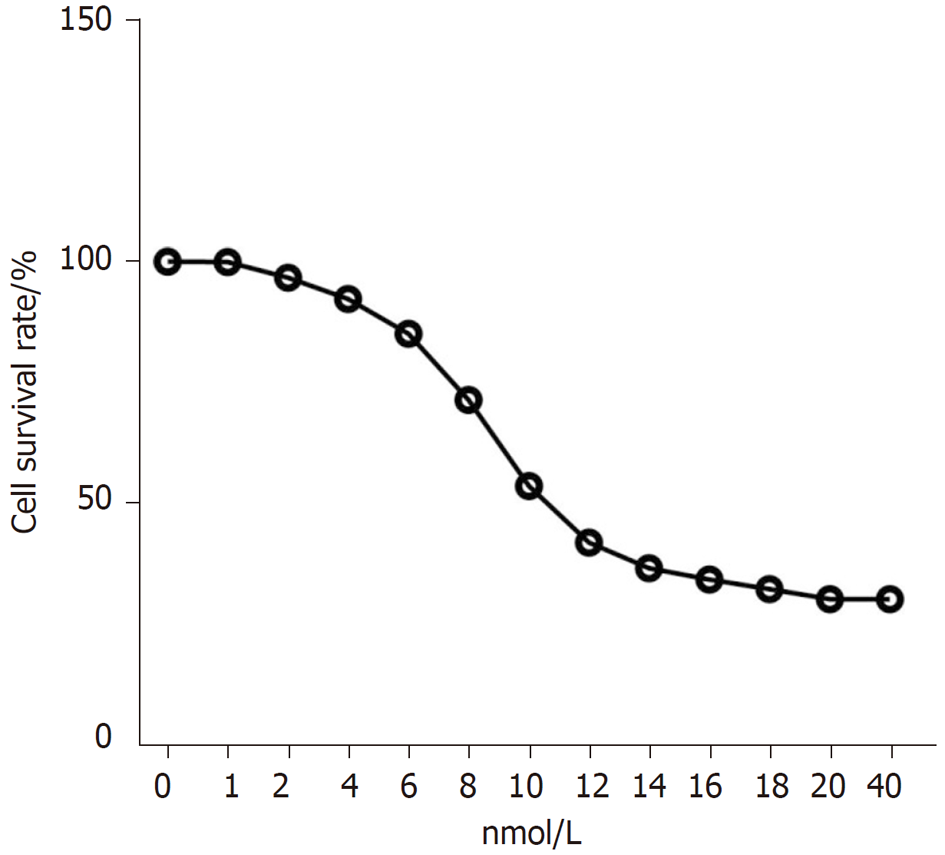
1.2.3 紫杉醇浓度筛选: 将对数期HCC-9204细胞按照5×103个/孔接种于96孔板, 分别用含1-40 nmol/L紫杉醇的培养液孵育细胞48 h, 向各孔内添加10 μL CCK-8试剂, 在37 ℃下继续孵育2 h. 酶标仪检测450 nm处各孔的光密度(OD)值. 存活率(%) = 实验A/对照A×100%. 选择12 nmol/L紫杉醇进行实验.
1.2.4 实验分组: 将对数期HCC-9204细胞按照2×104个/孔接种于96孔板, 用Lipofectamine 2000分别将si-circ_0000212、si-circ_0000212+miR-139-5p inhibitor分别转染融合度为50%HCC-9204细胞, 培养48 h后收集细胞. 实验分组: 未做任何处理的HCC-9204细胞记为对照组; 转染si-circ_0000212、转染si-circ_0000212+miR-139-5p inhibitor的细胞分别记为干扰circ_0000212组、干扰circ_0000212+miR-139-5p inhibitor组; 用含12 nmol/L紫杉醇培养液孵育HCC-9204细胞, 记为紫杉醇组; 用含12 nmol/L紫杉醇培养液孵育转染si-circ_0000212、转染si-circ_0000212+miR-139-5p inhibitor的细胞, 分别记为紫杉醇+干扰circ_0000212组、紫杉醇+干扰circ_0000212+miR-139-5p inhibitor组.
1.2.5 双荧光素酶报告基因实验: 含有野生型(WT)circ_0000212序列的荧光素酶报告载体WT-circ_0000212, 或者含有突变型(MUT)circ_0000212序列的荧光素酶报告载体MUT-circ_0000212由上海生工公司提供. 将WT-circ_0000212分别与miR-NC或miR-139-5p mimic共转染到HCC9204细胞中; 同时, 将MUT-circ_0000212分别与miR-NC或miR-139-5p mimic共转染到HCC9204细胞中. 培养48 h后, 收集细胞并使用双荧光素酶检测试剂盒测定相对荧光素酶活性.
1.2.6 CCK-8和集落形成实验检测细胞增殖: CCK-8法: 将未转染细胞、转染si-circ_0000212细胞或转染si-circ_0000212+miR-139-5p inhibitor细胞按照5×103个/孔接种于96孔板, 根据1.2.4实验分组分别给予紫杉醇(12 nmol/L)或不加药物的含血清培养基孵育细胞48 h. 向各孔内添加10 μL CCK-8试剂, 在37 ℃下继续孵育2 h. 酶标仪检测450 nm处各孔的OD值. 抑制率(%) = (1-实验OD/对照OD)×100%
集落形成实验: 将各组HCC9204细胞按照5×102个/孔接种于6孔板, 每2-3 d更换一次培养液, 培养约2 w直到HCC9204细胞形成集落, 用甲醇固定细胞集落, 用0.1%结晶紫染色. 在显微镜下计数大于50个细胞的集落数.
1.2.7 Transwell实验检测细胞迁移和侵袭: 每组取1×104个HCC9204细胞重悬在200 μL无血清培养基中, 并接种在包被matrigel涂层的Transwell上室. 同时, 向24孔板下室加入600 μL含10%胎牛血清的培养基. 培养48 h后, 棉签擦去未侵袭细胞, 用4%聚甲醇固定膜下表面附着细胞, 然后用0.1%结晶紫染色. 显微镜下随机选择5个视野拍照并计数, 以平均值表示HCC9204细胞侵袭数量. 迁移测定时选择未包被matrigel涂层的Transwell上室, 其余步骤同侵袭实验一致.
1.2.8 流式细胞仪检测细胞凋亡: 收集各组HCC9204细胞, 2000 rpm离心5 min, PBS洗涤3次. 用500 μL的1×结合缓冲液重悬细胞, 分别加入5 μL annexin V/FITC和碘化丙啶(PI). 暗室孵育15 min后, 使用流式细胞仪分析HCC9204细胞的凋亡情况. annexin V或PI染色的细胞计数为凋亡细胞.
1.2.9 Western blot检测Cleaved-caspase3蛋白表达: 使用RIPA缓冲液裂解各组细胞, 取约40 μg的提取蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离, 并湿法转移到聚偏氟乙烯(PVDF)膜. 用5%牛血清白蛋白阻断PVDF膜, 并与抗Cleaved-caspase3的一抗溶液4 ℃孵育12 h. 随后将PVDF至于辣根过氧化物酶偶联的二抗中室温孵育1 h. 将PVDF膜置于塑料薄膜上, 滴加化学发光试剂进行显色反应. 以Image J软件测得的Cleaved-caspase 3和GAPDH条带灰度值的比值表示蛋白表达水平.
统计学处理 每组设置3个复孔, 实验独立重复3次, 所有数据以均数±标准差(mean±SD)表示, 采用SPSS 22.0进行统计学分析. 两组间差异采用独立样本t检验, 多组间差异采用单因素方差分析和SNK-q检验. Pearson相关分析确定circ_0000212和miR-139-5p表达在肝癌组织中的关系. P<0.05为差异有统计学意义.
与癌旁组织比较, 肝癌组织中circ_0000212表达水平显著升高(P<0.05), miR-139-5p表达水平显著降低(P<0.05), 见图1A和图1B. 肝癌组织中circ_0000212和miR-139-5p表达水平呈负相关关系(r = -0.9928), 见图1C.
用不同浓度的紫杉醇处理HCC9204细胞48 h, 随着紫杉醇浓度的增加HCC9204细胞存活率逐渐降低, 紫杉醇对HCC9204细胞的IC50值为11.89 nmol/L. 见图2. 用12 nmol/L的紫杉醇孵育HCC9204细胞, 与对照组比较, 紫杉醇组HCC9204细胞circ_0000212表达水平显著降低(P<0.05), miR-139-5p表达水平显著升高(P<0.05), 见图3.
Circular RNA interactome预测结果见图4A, circ_0000212和miR-139-5p存在互补的核苷酸序列. miR-139-5p mimics和WT-circ_0000212共转染组HCC9204细胞的相对荧光素酶活性与miR-NC和WT-circ_0000212共转染组比较显著降低(P<0.05); miR-139-5p mimics和MUT-circ_0000212共转染组HCC9204细胞的相对荧光素酶活性与miR-NC和MUT-circ_0000212共转染组比较差异无统计学意义, 见图4B. 干扰circ_0000212组HCC9204细胞miR-139-5p表达水平与对照组比较显著升高(P<0.05), 见图4C.
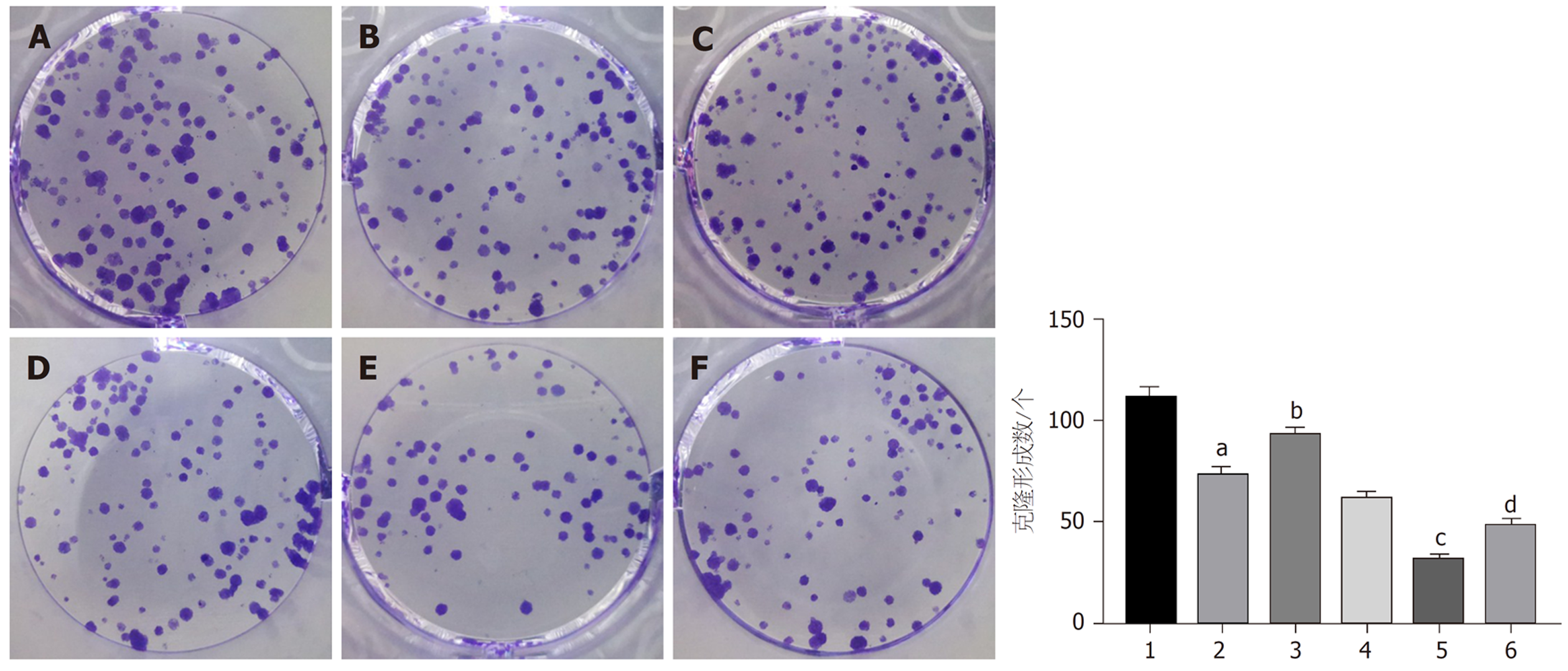
与对照组比较, 干扰circ_0000212组、紫杉醇组HCC9204细胞抑制率显著升高(P<0.05), 克隆形成数显著减少(P<0.05); 与干扰circ_0000212组比较, 干扰circ_0000212+miR-139-5p inhibitor组HCC9204细胞抑制率显著降低(P<0.05), 克隆形成数显著增加(P<0.05); 与紫杉醇组比较, 紫杉醇+干扰circ_0000212组HCC9204细胞抑制率显著升高(P<0.05), 克隆形成数显著减少(P<0.05); 与紫杉醇+干扰circ_0000212组比较, 紫杉醇+干扰circ_0000212+ miR-139-5p inhibitor组HCC9204细胞抑制率显著降低(P<0.05), 克隆形成数显著增加(P<0.05), 见图5和表1.
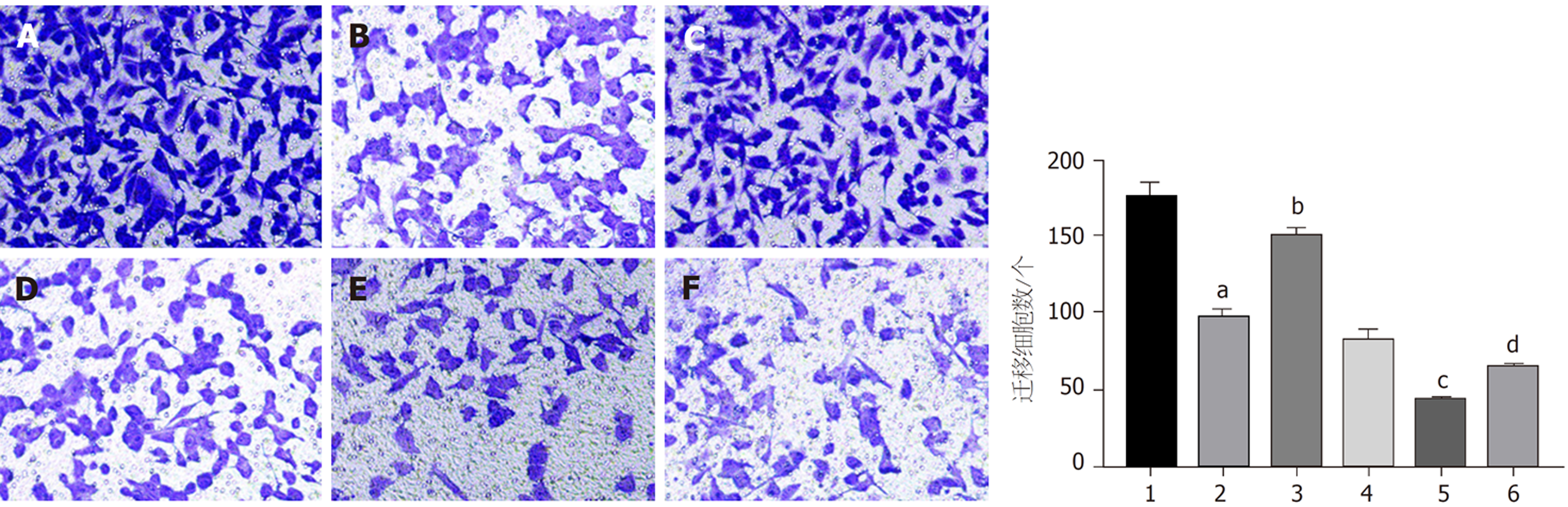
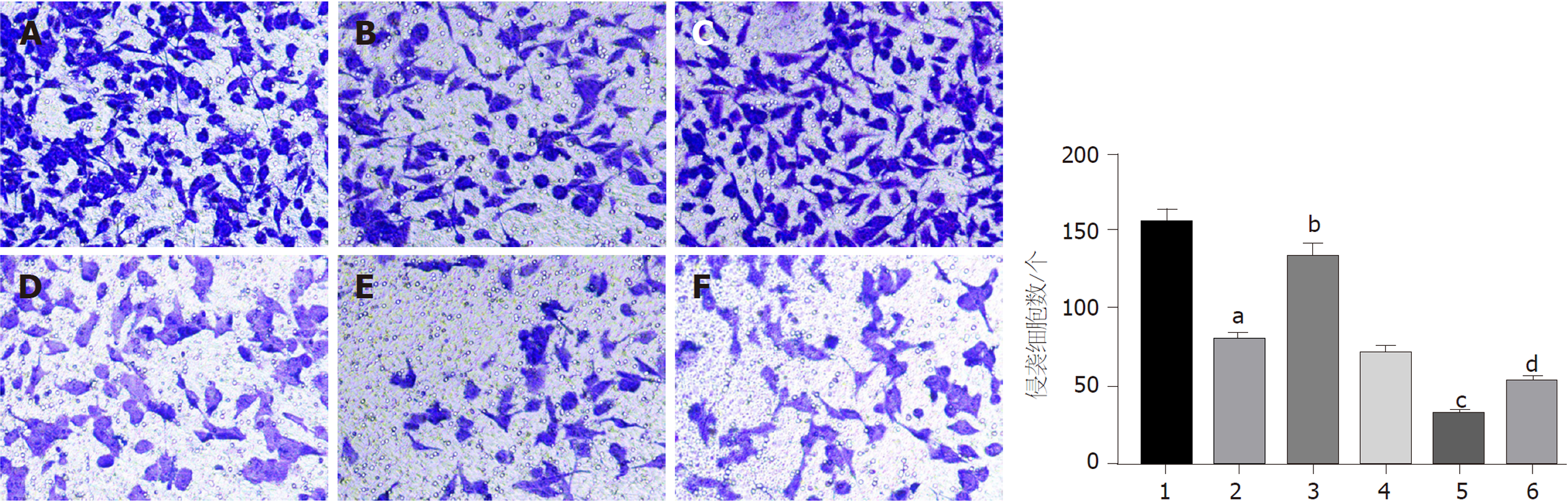
与对照组比较, 干扰circ_0000212组、紫杉醇组HCC9204细胞迁移数、侵袭数显著减少(P<0.05); 与干扰circ_0000212组比较, 干扰circ_0000212+miR-139-5p inhibitor组HCC9204细胞迁移数、侵袭数显著增加(P<0.05); 与紫杉醇组比较, 紫杉醇+干扰circ_0000212组HCC9204细胞迁移数、侵袭数显著减少(P<0.05); 与紫杉醇+干扰circ_0000212组比较, 紫杉醇+干扰circ_0000212+miR-139-5p inhibitor组HCC9204细胞迁移数和侵袭数显著增加(P<0.05), 见图6、图7和表2.
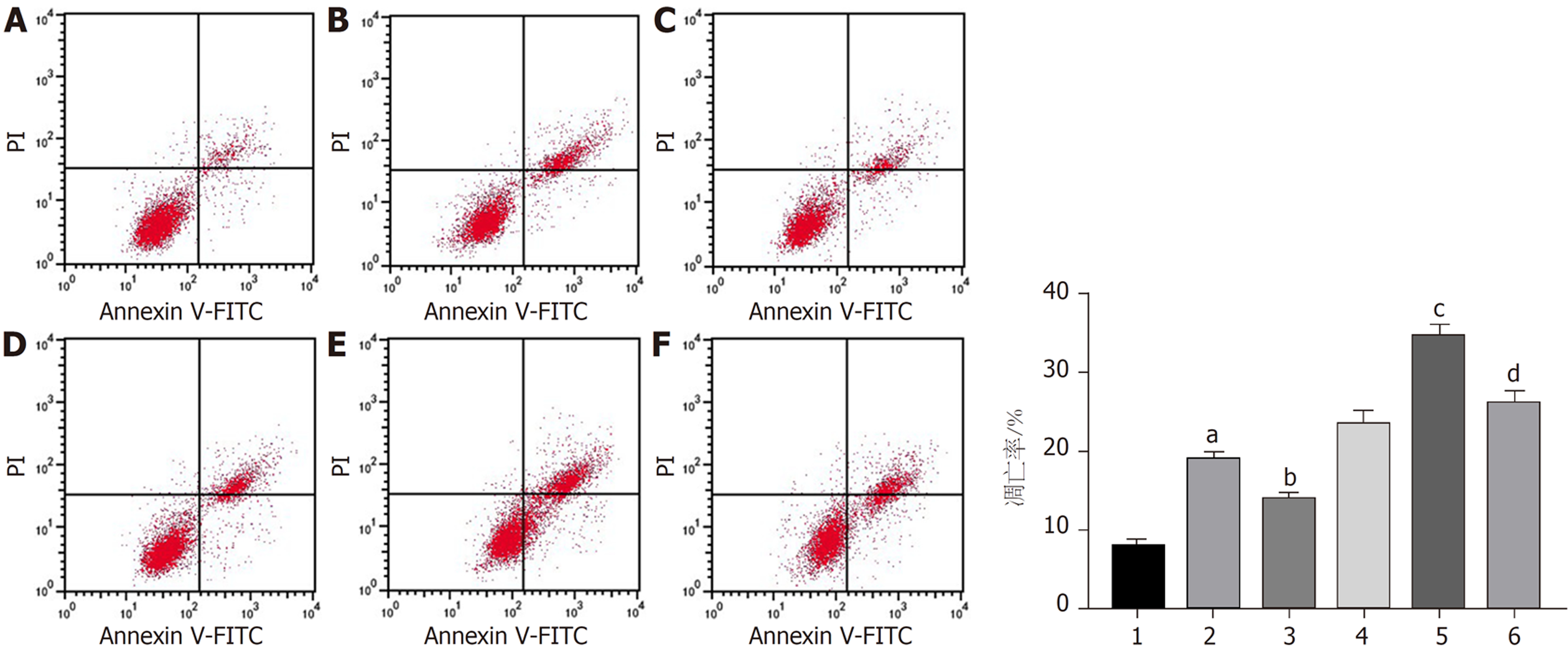
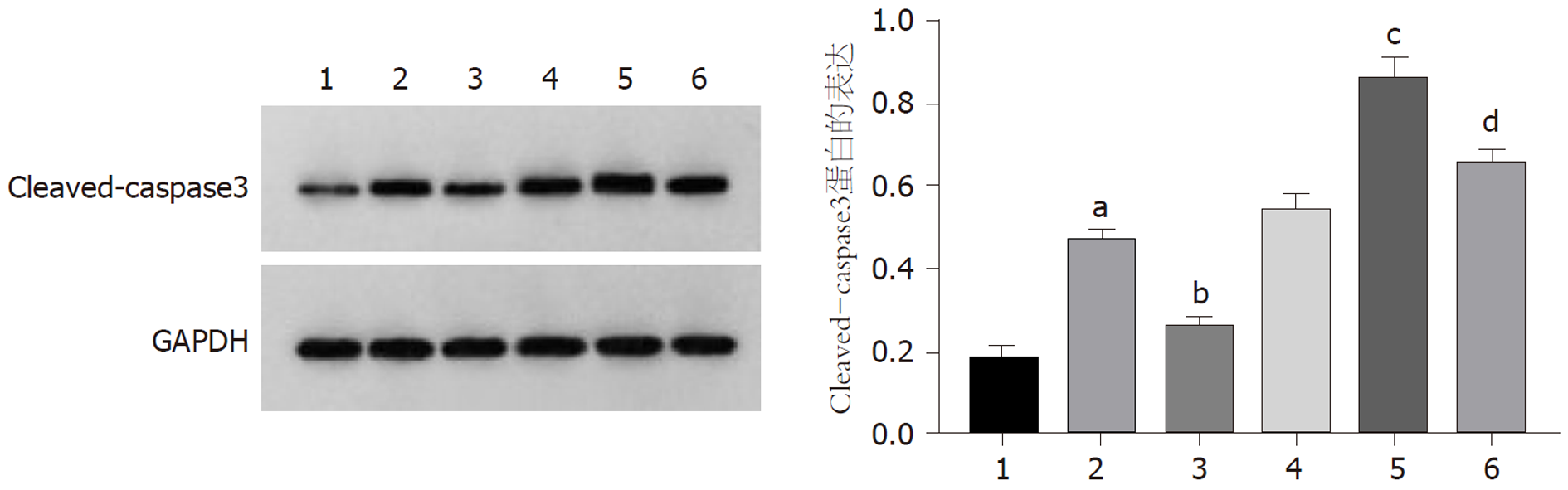
与对照组比较, 干扰circ_0000212组、紫杉醇组HCC9204细胞凋亡率、Cleaved-caspase3蛋白表达显著升高(P<0.05); 与干扰circ_0000212组比较, 干扰circ_0000212+miR-139-5p inhibitor组HCC9204细胞凋亡率、Cleaved-caspase3蛋白表达显著降低(P<0.05); 与紫杉醇组比较, 紫杉醇+干扰circ_0000212组HCC9204细胞抑凋亡率、Cleaved-caspase3蛋白表达显著升高(P<0.05); 与紫杉醇+干扰circ_0000212组比较, 紫杉醇+干扰circ_0000212 +miR-139-5p inhibitor组HCC9204细胞凋亡率、Cleaved-caspase3蛋白表达显著降低(P<0.05), 见图8、图9和表3.
circRNA已被报道参与肝癌进展的各个方面, 例如circ_100395表达水平与肝癌肿瘤分化、微血管浸润和门静脉肿瘤血栓形成有关, 上调circ_100395表达可诱导肝癌细胞凋亡, 抑制上皮间质转化(epithelial-mesenchymal transition, EMT), 降低迁移和侵袭能力[7]. circ_0091570低表达能够促进肝癌细胞周期转换, 促进细胞增殖能力, 促进体内肿瘤生长[8]. circ_0003418通过Wnt/β连环蛋白(β-catenin)通路抑制肝癌肿瘤发生和顺铂化疗耐药[9]. circRNA杆状病毒IAP重复序列蛋白6基因(circ-BIRC6)低表达介导紫杉醇对肝癌肿瘤发生的抑制作用[10]. 本研究发现circ_0000212在肝癌组织中的表达显著升高, 提示circ_0000212可能参与肝癌进展. 体外功能分析表明, 干扰circ_0000212可抑制肝癌HCC9204细胞增殖、迁移和侵袭能力, 上调Cleaved-caspase3蛋白表达, 诱导细胞凋亡, 表明circ_0000212在肝癌中发挥致癌作用. Wang等[11]报道circ_0000212可促进宫颈癌细胞的增殖和侵袭能力, 抑制细胞凋亡, 在宫颈癌中起促肿瘤作用, 这与本研究发现类似. 紫杉醇处理可抑制HCC9204细胞增殖、迁移和侵袭能力, 上调Cleaved-caspase3蛋白表达, 诱导细胞凋亡, 下调circ_0000212表达水平, 且干扰circ_0000212表达显著增强紫杉醇对HCC9204细胞的抗增殖、抗迁移、抗侵袭和促凋亡作用, 这提示干扰circ_0000212表达可提高HCC9204细胞对紫杉醇的敏感性. 以上研究表明, 干扰circ_0000212表达可能是抑制肝癌进展、紫杉醇化疗增敏的重要靶点.
目前研究显示circ_0000212在癌症进展中的作用均与调控miRNA表达有关[5,11]. miR-139-5p为子宫内膜癌[12]、乳腺癌[13]等多种肿瘤的抑制因子, 研究报道miR-139-5p低表达与非小细胞肺癌临床分期、病理分型、肿瘤大小、淋巴结转移相关[14]. 过表达miR-139-5p可抑制结直肠癌细胞体外增殖、迁移和侵袭能力, 使肿瘤对化疗敏感, 抑制肿瘤体内生长和转移[15]. 在肝癌中miR-139-5p对癌细胞活力、侵袭均有抑制作用, 并抑制肝癌EMT和转移[16,17]. 本研究发现miR-139-5p在肝癌组织表达下调, 且肝癌组织中miR-139-5p和circ_0000212表达呈负相关关系. 此外, 紫杉醇处理显著上调miR-139-5p表达水平. 双荧光素酶报告基因检测证实miR-139-5p是circ_0000212的特异性靶点, 这提示circ_0000212可能靶向miR-139-5p调控肝癌进展和紫杉醇敏感性. 深入研究发现, 抑制miR-139-5p表达显著减弱干扰circ_0000212表达对HCC9204细胞恶性生物行为的抑制作用, 且减弱干扰circ_0000212表达联合紫杉醇处理对HCC9204细胞恶性生物行为的抑制作用, 这进一步证实circ_0000212靶向miR-139-5p调控肝癌进展和紫杉醇敏感性.
综上所述, circ_0000212在肝癌组织中表达增加, 干扰circ_0000212通过靶向上调miR-139-5p表达诱导肝癌细胞凋亡, 抑制其增殖、迁移和侵袭能力, 并提高其对紫杉醇的敏感性. 这些发现表明, circ_0000212和miR-139-5p可能是紫杉醇化疗增敏、抑制肝癌进展的潜在靶点.
手术切除、经导管动脉化疗栓塞、靶向药物治疗的应用虽然延长了肝癌患者的生存时间, 但由于肝血供丰富, 术后复发和转移仍是肝癌患者死亡的主要原因. 紫杉醇是治疗肝癌的常用化疗药物, 然而在连续治疗后肝癌细胞通常对紫杉醇脱敏, 这严重限制其临床疗效. circRNA作为非编码RNA, 其可吸附miRNA参与癌细胞增殖、转移、耐药等一系列生物学过程. 因此, 亟需寻找新型circRNA作为肝癌的治疗靶点.
circ_0000212在结直肠癌中表达升高, 并可作为癌基因参与结直肠癌进展, 但circ_0000212在肝癌中的表达方式和作用尚不清楚. 靶基因预测显示miR-139-5p与circ_0000212存在结合位点, miR-139-5p在肝癌中表达降低, 上调miR-139-5p可抑制肝癌细胞的糖酵解代谢、增殖和转移, 因此本研究主要探索circ_0000212靶向miR-513b-5p在肝癌进展中的作用.
验证circ_0000212在肝癌进展中发挥致癌作用, circ_0000212通过靶向调控miR-139-5p从而调控肝癌细胞恶性行为和紫杉醇敏感性.
采用RT-qPCR检测circ_0000212和miR-139-5p在肝癌组织、癌旁组织中的表达. 双荧光素酶报告实验验证circ_0000212和miR-139-5p靶向关系. CCK-8法检测细胞增殖抑制率; 集落形成实验检测细胞集落形成能力; 流式细胞术检测细胞凋亡率; Transwell实验检测细胞迁移和侵袭数.
肝癌组织中circ_0000212表达上调, miR-139-5p表达下调. circ_0000212可靶向负调控miR-139-5p表达. 干扰circ_0000212可抑制肝癌细胞增殖、迁移、侵袭能力, 诱导细胞凋亡, 并提高其对紫杉醇的敏感性. circ_0000212靶向负调控miR-139-5p表达. 抑制miR-139-5p表达显著减弱干扰circ_0000212表达对肝癌细胞增殖、迁移、侵袭、凋亡以及紫杉醇敏感性的影响.
干扰circ_0000212通过靶向上调miR-139-5p可抑制肝癌细胞增殖、迁移、侵袭能力, 诱导细胞凋亡, 并提高其对紫杉醇的敏感性.
circ_0000212和miR-139-5p可能是紫杉醇化疗增敏、抑制肝癌进展的潜在靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Kudo M. Systemic Therapy for Hepatocellular Carcinoma: 2017 Update. Oncology. 2017;93 Suppl 1:135-146. [PubMed] [DOI] |
| 2. | Zhou L, Ding L, Liu J, Zhang Y, Luo X, Zhao L, Ren J. Four-and-a-half LIM protein 1 promotes paclitaxel resistance in hepatic carcinoma cells through the regulation of caspase-3 activation. J Cancer Res Ther. 2018;14:S767-S773. [PubMed] [DOI] |
| 3. | Sang Y, Chen B, Song X, Li Y, Liang Y, Han D, Zhang N, Zhang H, Liu Y, Chen T, Li C, Wang L, Zhao W, Yang Q. circRNA_0025202 Regulates Tamoxifen Sensitivity and Tumor Progression via Regulating the miR-182-5p/FOXO3a Axis in Breast Cancer. Mol Ther. 2019;27:1638-1652. [PubMed] [DOI] |
| 4. | Wang L, Wang P, Su X, Zhao B. Circ_0001658 promotes the proliferation and metastasis of osteosarcoma cells via regulating miR-382-5p/YB-1 axis. Cell Biochem Funct. 2020;38:77-86. [PubMed] [DOI] |
| 5. | Wu H, Tao Y, Zhang W, Wang G, Zhang Q. circ0000212 promotes cell proliferation of colorectal cancer by sponging miR491 and modulating FOXP4 expression. Mol Med Rep. 2021;23. [PubMed] [DOI] |
| 6. | Hua S, Lei L, Deng L, Weng X, Liu C, Qi X, Wang S, Zhang D, Zou X, Cao C, Liu L, Wu D. miR-139-5p inhibits aerobic glycolysis, cell proliferation, migration, and invasion in hepatocellular carcinoma via a reciprocal regulatory interaction with ETS1. Oncogene. 2018;37:1624-1636. [PubMed] [DOI] |
| 7. | Chen Q, Chen Z, Cao S, Guo B, Chen Y, Feng Z, Wang J, Guo G, Chen X, Huang X. Role of CircRNAs_100395 in Proliferation and Metastases of Liver Cancer. Med Sci Monit. 2019;25:6181-6192. [PubMed] [DOI] |
| 8. | Wang YG, Wang T, Ding M, Xiang SH, Shi M, Zhai B. hsa_circ_0091570 acts as a ceRNA to suppress hepatocellular cancer progression by sponging hsa-miR-1307. Cancer Lett. 2019;460:128-138. [PubMed] [DOI] |
| 9. | Chen H, Liu S, Li M, Huang P, Li X. circ_0003418 Inhibits Tumorigenesis And Cisplatin Chemoresistance Through Wnt/β-Catenin Pathway In Hepatocellular Carcinoma. Onco Targets Ther. 2019;12:9539-9549. [PubMed] [DOI] |
| 10. | Liu Y, Guo J, Shen K, Wang R, Chen C, Liao Z, Zhou J. Paclitaxel Suppresses Hepatocellular Carcinoma Tumorigenesis Through Regulating Circ-BIRC6/miR-877-5p/YWHAZ Axis. Onco Targets Ther. 2020;13:9377-9388. [PubMed] [DOI] |
| 11. | Wang Y, Miao C, Gao X. TCEB3 is Regulated by Circ-0000212/miR-140-3p Axis to Promote the Progression of Cervical Cancer. Onco Targets Ther. 2021;14:2853-2865. [PubMed] [DOI] |
| 12. | Liu J, Li C, Jiang Y, Wan Y, Zhou S, Cheng W. Tumor-suppressor role of miR-139-5p in endometrial cancer. Cancer Cell Int. 2018;18:51. [PubMed] [DOI] |
| 13. | Gu SQ, Luo JH, Yao WX. The regulation of miR-139-5p on the biological characteristics of breast cancer cells by targeting COL11A1. Math Biosci Eng. 2019;17:1428-1441. [PubMed] [DOI] |
| 14. | Yong-Hao Y, Xian-Guo W, Ming X, Jin-Ping Z. Expression and clinical significance of miR-139-5p in non-small cell lung cancer. J Int Med Res. 2019;47:867-874. [PubMed] [DOI] |
| 15. | Du F, Cao T, Xie H, Li T, Sun L, Liu H, Guo H, Wang X, Liu Q, Kim T, Franklin JL, Graves-Deal R, Han W, Tian Z, Ge M, Nie Y, Fan D, Coffey RJ, Lu Y, Zhao X. KRAS Mutation-Responsive miR-139-5p inhibits Colorectal Cancer Progression and is repressed by Wnt Signaling. Theranostics. 2020;10:7335-7350. [PubMed] [DOI] |
| 16. | Qiu G, Lin Y, Zhang H, Wu D. miR-139-5p inhibits epithelial-mesenchymal transition, migration and invasion of hepatocellular carcinoma cells by targeting ZEB1 and ZEB2. Biochem Biophys Res Commun. 2015;463:315-321. [PubMed] [DOI] |
| 17. | Li P, Xiao Z, Luo J, Zhang Y, Lin L. MiR-139-5p, miR-940 and miR-193a-5p inhibit the growth of hepatocellular carcinoma by targeting SPOCK1. J Cell Mol Med. 2019;23:2475-2488. [PubMed] [DOI] |