修回日期: 2021-08-28
接受日期: 2021-10-08
在线出版日期: 2021-11-28
肠道菌群在人类健康和疾病中的作用逐渐被人们重视. 目前已有一些关于肠道菌群与胰腺炎关系的研究报道, 这些报道揭示了肠道菌群在胰腺炎发生发展过程中发挥着某些重要作用. 目前还不清楚这些具体作用机制, 但肠道菌群失调被认为促进胰腺炎症变化的假说已经有了初步的共识. 本文概述了肠道菌群与胰腺炎的相关性, 旨在为今后的进一步研究提供某些参考和思路.
核心提要: 肠道的微生物丰富, 物种多样性高, 肠道菌群与疾病密不可分. 菌群与胰腺炎也不例外, 它们之间存在着一个生物交互系统, 即菌群-肠道-胰腺轴. 肠道细菌通过"肠漏"、影响胰腺外分泌、分子交叉或模拟等机制来促进胰腺炎症的发生. 益生菌及其相关微生物制剂的使用可以改善胰腺炎症程度及减轻症状.
引文著录: 温华, 李茜, 路宁, 苏媛媛, 马培晗, 张明鑫. 肠道菌群与胰腺炎: 现状及未来. 世界华人消化杂志 2021; 29(22): 1269-1275
Revised: August 28, 2021
Accepted: October 8, 2021
Published online: November 28, 2021
The role of intestinal flora in human health and diseases has attracted more and more attention. At present, there have been some reports on the relationship between intestinal flora and pancreatitis. These reports reveal that intestinal flora plays some important roles in the occurrence and development of pancreatitis. The specific mechanisms of action are unclear, but there is preliminary consensus that intestinal microbiome dysregulation promotes inflammatory changes in the pancreas. This paper summarizes the correlation between intestinal flora and pancreatitis, in order to provide some references and ideas for further research.
- Citation: Wen H, Li Q, Lu N, Su YY, Ma PH, Zhang MX. Intestinal flora and pancreatitis: Present and future. Shijie Huaren Xiaohua Zazhi 2021; 29(22): 1269-1275
- URL: https://www.wjgnet.com/1009-3079/full/v29/i22/1269.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i22.1269
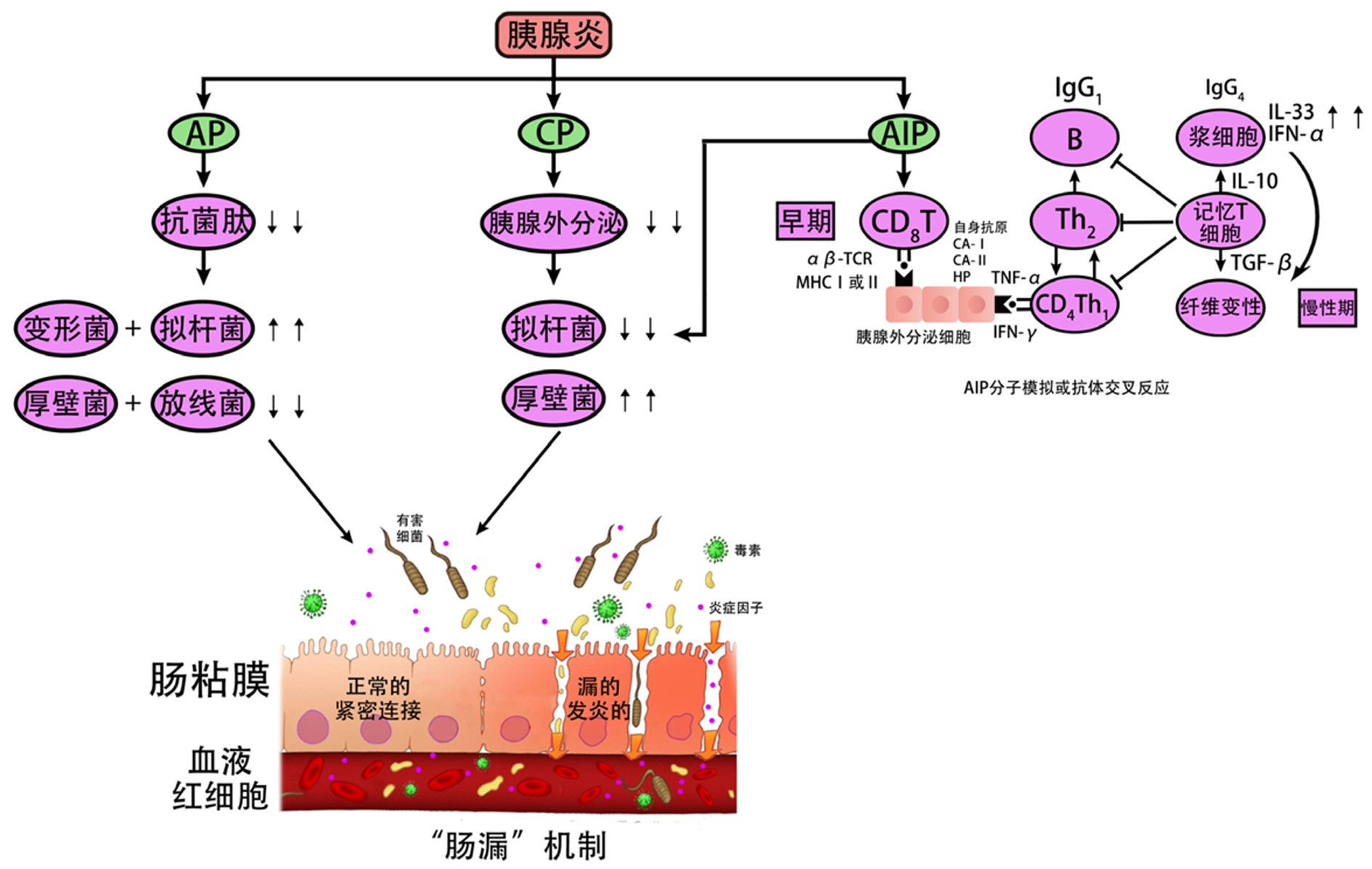
健康人肠道菌群的特点是微生物丰富, 物种多样性高. 有人把肠道菌群称作"第二基因组". 据报道人类肠道菌群包含1013-1014个微生物, 以及超过5×106个决定了肠道菌群的基因[1,2]. 在这种微环境中, 细菌为优势菌, 分为有害菌、中性菌及有益菌. 其中厚壁菌门和拟杆菌门是主要的细菌门, 占微生物总数的85%-90%, 而放线菌门和变形菌门数量较少, 最多占10%[3](表1). 一般情况下, 中性菌及有益菌种类比有害细菌种类多. 但是, 当肠道微生态被打乱时, 有害细菌就会增多, 一些菌群生理功能就会相应丧失[4,5]. 在这种不良环境中, 肠细胞之间的紧密连接减少, 导致粘膜屏障完整性的功能受损; 这种被称为"肠漏"的变化有时会导致细菌移位(图1), 并在胃肠道和全身性疾病的发展中起着关键作用[6]. 近年来, 人们逐渐意识到肠道菌群在人类健康和疾病中起着重要的作用, 如炎症性肠病、肠易激综合征、阿尔茨海默病和糖尿病等疾病均跟肠道菌群有关[1-10]. 同理, 肠道菌群对胰腺炎也有着重要的作用及影响[11], 研究者们相信肠道菌群与胰腺之间存在着一个生物交互系统, 即"菌群-肠道-胰腺轴"[12]. 本文就肠道菌群与胰腺炎的相互影响, 做了相关论述, 希望能为这方面的研究者提供一些借鉴和思考.
急性胰腺炎(acute pancreatitis, AP)是腺泡内胰蛋白酶原和其他蛋白水解酶过早激活的结果, 导致胰腺腺泡损伤、炎症介质上调、细胞因子释放、全身炎症反应和微循环损伤[13], 多跟暴饮暴食、胆石症、酒精、高脂血症、高钙血症及家族遗传史等这些因素有关. 多项研究表明肠道菌群跟AP也密切相关.
Zhang等[14]研究显示AP患者的样本含有更多的拟杆菌和变形杆菌, 而厚壁菌和放线菌较少(表1). 既往研究也发现AP患者肠球菌、肠杆菌等潜在致病菌含量显著高于非感染组, 而双歧杆菌等益生菌含量显著低于非感染组; 由此可见, 肠道菌群失衡可能是导致AP易位感染的的重要原因. 尽管细菌可能不是胰腺炎的诱因, 但炎症环境可能使这些微生物进入胰腺, 并使局部和全身炎症状况恶化. 有研究表明AP患者的淋巴结样本、浆膜标本、血液标本中可以培养出细菌, 这些细菌大多来自下消化道, 其中最常见的微生物是大肠杆菌(54%)[15].
AP改变肠道菌群的机制可能是炎症导致肠屏障功能受损[16](图1), 从而增加了肠道的通透性. 这可能是通过降低claudin 2/4的表达改变肠道的紧密连接来实现的[17]. 器官衰竭和更大程度坏死的AP患者中具有较多的致病菌群[18,19]. Tsiotos等[20,21]研究也显示约30%胰腺坏死的无菌病例, 最终会被感染致病菌群, 而且具有更高的致死率(20%-30%). 这些研究都为"肠漏"机制提供了证据.
慢性胰腺炎(chronic pancreatitis, CP)是一种以胰腺腺泡、导管和胰岛细胞持续性破坏及进行性纤维化为主要特征的慢性炎症性疾病, 因为胰腺结构的破坏从而导致外分泌和内分泌功能受损[30,31]. 临床表现主要有腹痛、胰腺外分泌功能不全和高血糖等, 严重影响生活质量[32], 同时CP患者也表现出与病原菌生长相关的生物失调[33].
和AP一样, 肠道菌群与CP也存在着相互影响. 有研究指出CP患者肠道菌群中拟杆菌的相对丰度显著增加, 厚壁菌的相对丰度降低[34]. CP通过影响胰腺外分泌功能, 从而可以改变肠道菌群的种类和数量[35]. 肠道菌群的改变可以使肠道屏障功能受损及通透性增加, 进而促使肠道菌群移位至胰腺, 进一步加重CP[36-38](图1). 目前肠道菌群具体通过什么途径进入胰腺还不清楚, 需要进一步的研究.
胰酶替代疗法(pancreatic enzyme replacement therapy, PERT)是胰腺外分泌不足(pancreatic exocrine insufficiency, PEI)治疗的基石. 通常认为粪便排泄异常, 脂肪泻和体重减轻的患者是PERT的适用人群, PERT可以帮助CP患者脂肪吸收, 改善患者的营养状况[39]. 一些研究认为PERT可以直接改变肠道菌群, 但具体机制目前仍不清楚. 有研究发现用PERT治疗的小鼠中有相对丰富的阿克曼菌(Akkermansia muciniphila)和罗伊拉杆菌(Latobacillus reuteri). 特别是阿克曼菌, 在PERT组中发现高达58倍, ,它可以通过促进粘液厚度和紧密连接蛋白表达来增强肠屏障功能, 从而减少"肠漏"[40,41]. 综上, PERT可能有助于改善肠道菌群, 从而缓解CP患者症状.
自身免疫性胰腺炎(autoimmune pancreatitis, AIP)是一种特殊类型的胰腺炎, 常以梗阻性黄疸或腹痛为主要症状, 且伴有胰腺组织淋巴浆细胞浸润及纤维化, 治疗上对类固醇激素敏感[45,46]. 它有两种不同的表型, 分为1型和2型. 目前, 1型AIP被认为是系统性免疫球蛋白G4相关疾病(IgG4-RD)的胰腺表现[47], 它与血清IgG4浓度升高、淋巴浆细胞浸润和胰腺静脉炎有关. 与1型AIP不同, 2型AIP只影响胰腺, 血清IgG4浓度正常, 组织学上表现为中性粒细胞炎症[48]. 有研究指出AIP和CP的肠道菌群在门类水平上无明显差异, 但是卵形拟杆菌、芦苇链球菌、戈登链球菌、乳酸发酵梭菌、拉瓦尔梭菌在CP患者中较AIP患者更常见[49](表1).
近期有人研究了幽门螺杆菌(Helicobacter pylori, H. pylori)感染与AIP之间的可能联系[50-53]. Guarneri等[53]提出H. pylori感染可能通过分子模拟或抗体交叉反应在遗传个体中引发AIP(图1). Frulloni等[50]研究表明H. pylori的a-碳酸酐酶(a-CA)与人类的a-碳酸酐酶-Ⅱ(a-CA-Ⅱ)以及H. pylori的纤溶酶原结合蛋白(PBP)与胰腺腺泡上皮细胞的泛素蛋白连接酶E3-n识别蛋白2存在一定同源性, 同区段含有DRB1*0405的结合序, 大多数AIP患者也表现出IgG反应活性. 同时, 95%的AIP患者血清抗体PBP阳性, 这提示H. pylori与胰腺自身蛋白的分子拟态可能是AIP发病的刺激因子. 所以, H. pylori感染易感人群后可能会通过分子模拟诱发异常的免疫应答, 造成严重的组织损伤, 导致AIP发病.
近年来已有一些关于肠道菌群与胰腺炎关系的研究报道(表2). 肠道有益菌群可以通过维持肠道完整性和调节肠道屏障通透性可以抵御病原微生物, 所以理论上菌群的调节可能有助于胰腺炎和相关并发症的治疗. 但目前SAP患者是否应该使用益生菌治疗尚未达成共识. 益生菌可能对于改善SAP的肠黏膜屏障有一定作用, 但尚需进一步临床评价[58]. 另外, 不同菌株的表现也不尽相同, 因为不同的细菌有不同的粘附位点和不同的免疫效果[59,60]. 因此, 益生菌的种类可能导致临床结果的差异. 比如Cui等[61]发现类似于双歧杆菌的益生菌可以显著改善感染程度及减轻症状. 而Gou等[62]认为益生菌对预测SAP患者的临床结局既无益处也无副作用; 他们的研究还发现在益生菌的类型、剂量和治疗时间方面存在显著的异质性, 这可能导致了临床结局的异质性.
| 参考文献 | 研究类型 | 方法 | 疾病 | 结果 | 结论 |
| [27] | 前瞻性随机对照试验 | 45例AP患者: 22例植物乳杆菌299(LP299) 活菌, 23例热杀灭LP299; 各治疗1周 | AP | 治疗组感染性胰腺坏死1/22例, 对照组7/23例(P = 0.023) | 补充活LP299可以减少手术治疗和胰腺相关脓毒症的次数 |
| [28] | 前瞻性随机对照试验 | 74例AP患者中, 36例给予植物乳杆菌肠内喂养, 38例给予肠外营养 | AP | 肠内营养组38.9%的患者被多种微生物定植, 肠外营养组73.7% (P<0.01); 肠内营养组30.6%的患者被潜在致病菌定植, 肠外营养组为50% (P<0.05) | 经肠内喂养可降低疾病严重程度, 并有较好的临床效果 |
| [40] | 前瞻性随机对照试验 | 对照组给予自来水. 胰酶处理组用胰淀粉酶、脂肪酶和蛋白酶的混合物处理 | CP | 经胰酶处理的小鼠的细菌组成与对照组有显著差异. AKK菌是肠道中的一种关键的有益细菌, 在胰酶处理的样本中显示出更高的相对丰度 | PERT诱导有益细菌的定植, 从而有助于减少PEI相关症状, 并改善营养状态 |
| [42] | 前瞻性随机对照试验 | 60例慢性胰腺炎患者: 干预组给予联合用药, 对照组给予麦芽糊精12g/d | CP | 治疗组大便次明显减少:治疗前平均每天次数: 2.33(P<0.153); 治疗2月: 1.47 (P = 0.002); 治疗3月: 1.37 (P = 0.012); 对照组大便次数无变化(P = 0.157) | 益生元改善了CP患者的临床和实验室结果, 这提示合生剂可能是一种治疗选择 |
| [50] | 前瞻性随机对照试验 | 从20例自身免疫性胰腺炎患者中筛选免疫球蛋白混合肽库. 从患者血清标本中检测肽特异性抗体 | AIP | 18/20例血清标本识别出肽AIP(1-7). 该肽与幽门螺杆菌PBP的氨基酸序列和胰腺腺泡细胞中高表达的泛素-蛋白连接酶E3组分n-识别蛋白2(UBR2)同源 | 在大多数自身免疫性胰腺炎患者中检测出特异性抗体 |
| [57] | 前瞻性随机对照试验 | 我们研究了反复给药100 g聚肌苷-胞苷酸[poly (I:C)]对MRL/MpJ小鼠实验性AIP诱导的肠道菌群先天免疫的作用 | AIP | 广泛使用抗生素的肠道灭菌可以抑制产生IFN-和IL-33的pDCs的胰腺积累, 从而抑制AIP的发展 | 肠道失调通过激活产生IFN-和IL-33的pDCs增加小鼠对实验性AIP的敏感性 |
目前在不同研究中使用的益生菌类型和治疗策略还有较大差异, 所以在进行临床试验之前, 应考虑益生菌及其制剂的适当剂量和治疗时间. 另外, 考虑到一些益生菌的风险, 进一步的临床试验应该仔细设计, 以避免任何潜在的有害影响. 同时, 对胰腺炎相关菌群检测技术的选择及升级也很重要, 菌群检测常见的方法有细菌培养、聚合酶链式反应技术(PCR)、基于PCR基础上的16SrRNA技术、荧光原位杂交、基因芯片、宏基因组测序以及单一菌株或者人体完整菌群的移植、用免疫系统确认致病原因、用机器学习等高级算法整合多组学数据等, 有时候选择合适的检测技术及方法, 往往能达到事半功倍的效果. 当然, 菌群特异性改变的分析还可以利用易于收集的样本, 如根据血液、唾液和粪便等来开发出用于相应检测的新工具.
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Marchesi JR, Adams DH, Fava F, Hermes GD, Hirschfield GM, Hold G, Quraishi MN, Kinross J, Smidt H, Tuohy KM, Thomas LV, Zoetendal EG, Hart A. The gut microbiota and host health: a new clinical frontier. Gut. 2016;65:330-339. [PubMed] [DOI] |
| 2. | Thaiss CA, Zmora N, Levy M, Elinav E. The microbiome and innate immunity. Nature. 2016;535:65-74. [PubMed] [DOI] |
| 3. | Rinninella E, Raoul P, Cintoni M, Franceschi F, Miggiano GAD, Gasbarrini A, Mele MC. What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases. Microorganisms. 2019;7. [PubMed] [DOI] |
| 4. | Zhang YJ, Li S, Gan RY, Zhou T, Xu DP, Li HB. Impacts of gut bacteria on human health and diseases. Int J Mol Sci. 2015;16:7493-7519. [PubMed] [DOI] |
| 5. | Forbes JD, Van Domselaar G, Bernstein CN. The Gut Microbiota in Immune-Mediated Inflammatory Diseases. Front Microbiol. 2016;7:1081. [PubMed] [DOI] |
| 6. | Camilleri M. Leaky gut: mechanisms, measurement and clinical implications in humans. Gut. 2019;68:1516-1526. [PubMed] [DOI] |
| 7. | Agahi A, Hamidi GA, Daneshvar R, Hamdieh M, Soheili M, Alinaghipour A, Esmaeili Taba SM, Salami M. Does Severity of Alzheimer's Disease Contribute to Its Responsiveness to Modifying Gut Microbiota? A Double Blind Clinical Trial. Front Neurol. 2018;9:662. [PubMed] [DOI] |
| 8. | Fischer M. Recent Research on Fecal Microbiota Transplantation in Inflammatory Bowel Disease Patients. Gastroenterol Hepatol (NY). 2019;15:44-47. [PubMed] |
| 9. | Wang Z, Xu CM, Liu YX, Wang XQ, Zhang L, Li M, Zhu SW, Xie ZJ, Wang PH, Duan LP, Zhu HQ. Characteristic dysbiosis of gut microbiota of Chinese patients with diarrhea-predominant irritable bowel syndrome by an insight into the pan-microbiome. Chin Med J (Engl). 2019;132:889-904. [PubMed] [DOI] |
| 10. | Zhang B, Yue R, Chen Y, Yang M, Huang X, Shui J, Peng Y, Chin J. Gut Microbiota, a Potential New Target for Chinese Herbal Medicines in Treating Diabetes Mellitus. Evid Based Complement Alternat Med. 2019;2019:2634898. [PubMed] [DOI] |
| 11. | Pagliari D, Saviano A, Newton EE, Serricchio ML, Dal Lago AA, Gasbarrini A, Cianci R. Gut Microbiota-Immune System Crosstalk and Pancreatic Disorders. Mediators Inflamm. 2018;2018:7946431. [PubMed] [DOI] |
| 12. | Thomas RM, Jobin C. Microbiota in pancreatic health and disease: the next frontier in microbiome research. Nat Rev Gastroenterol Hepatol. 2020;17:53-64. [PubMed] [DOI] |
| 13. | Lerch MM, Gorelick FS. Models of acute and chronic pancreatitis. Gastroenterology. 2013;144:1180-1193. [PubMed] [DOI] |
| 14. | Zhang XM, Zhang ZY, Zhang CH, Wu J, Wang YX, Zhang GX. Intestinal Microbial Community Differs between Acute Pancreatitis Patients and Healthy Volunteers. Biomed Environ Sci. 2018;31:81-86. [PubMed] [DOI] |
| 15. | O'Boyle CJ, MacFie J, Mitchell CJ, Johnstone D, Sagar PM, Sedman PC. Microbiology of bacterial translocation in humans. Gut. 1998;42:29-35. [PubMed] [DOI] |
| 16. | Llorente C, Jepsen P, Inamine T, Wang L, Bluemel S, Wang HJ, Loomba R, Bajaj JS, Schubert ML, Sikaroodi M, Gillevet PM, Xu J, Kisseleva T, Ho SB, DePew J, Du X, Sørensen HT, Vilstrup H, Nelson KE, Brenner DA, Fouts DE, Schnabl B. Gastric acid suppression promotes alcoholic liver disease by inducing overgrowth of intestinal Enterococcus. Nat Commun. 2017;8:837. [PubMed] [DOI] |
| 17. | Sonika U, Goswami P, Thakur B, Yadav R, Das P, Ahuja V, Saraya A. Mechanism of Increased Intestinal Permeability in Acute Pancreatitis: Alteration in Tight Junction Proteins. J Clin Gastroenterol. 2017;51:461-466. [PubMed] [DOI] |
| 18. | Büchler MW, Gloor B, Müller CA, Friess H, Seiler CA, Uhl W. Acute necrotizing pancreatitis: treatment strategy according to the status of infection. Ann Surg. 2000;232:619-626. [PubMed] [DOI] |
| 19. | Isenmann R, Rünzi M, Kron M, Kahl S, Kraus D, Jung N, Maier L, Malfertheiner P, Goebell H, Beger HG; German Antibiotics in Severe Acute Pancreatitis Study Group. Prophylactic antibiotic treatment in patients with predicted severe acute pancreatitis: a placebo-controlled, double-blind trial. Gastroenterology. 2004;126:997-1004. [PubMed] [DOI] |
| 20. | Tsiotos GG, Luque-de León E, Söreide JA, Bannon MP, Zietlow SP, Baerga-Varela Y, Sarr MG. Management of necrotizing pancreatitis by repeated operative necrosectomy using a zipper technique. Am J Surg. 1998;175:91-98. [PubMed] [DOI] |
| 21. | Ahuja M, Schwartz DM, Tandon M, Son A, Zeng M, Swaim W, Eckhaus M, Hoffman V, Cui Y, Xiao B, Worley PF, Muallem S. Orai1-Mediated Antimicrobial Secretion from Pancreatic Acini Shapes the Gut Microbiome and Regulates Gut Innate Immunity. Cell Metab. 2017;25:635-646. [PubMed] [DOI] |
| 22. | Gallo RL, Kim KJ, Bernfield M, Kozak CA, Zanetti M, Merluzzi L, Gennaro R. Identification of CRAMP, a cathelin-related antimicrobial peptide expressed in the embryonic and adult mouse. J Biol Chem. 1997;272:13088-13093. [PubMed] [DOI] |
| 23. | Kościuczuk EM, Lisowski P, Jarczak J, Strzałkowska N, Jóźwik A, Horbańczuk J, Krzyżewski J, Zwierzchowski L, Bagnicka E. Cathelicidins: family of antimicrobial peptides. A review. Mol Biol Rep. 2012;39:10957-10970. [PubMed] [DOI] |
| 24. | Bradley EL. A fifteen year experience with open drainage for infected pancreatic necrosis. Surg Gynecol Obstet. 1993;177:215-222. [PubMed] |
| 25. | Haruta I, Yanagisawa N, Kawamura S, Furukawa T, Shimizu K, Kato H, Kobayashi M, Shiratori K, Yagi J. A mouse model of autoimmune pancreatitis with salivary gland involvement triggered by innate immunity via persistent exposure to avirulent bacteria. Lab Invest. 2010;90:1757-1769. [PubMed] [DOI] |
| 26. | Ukai T, Shikata S, Inoue M, Noguchi Y, Igarashi H, Isaji S, Mayumi T, Yoshida M, Takemura YC. Early prophylactic antibiotics administration for acute necrotizing pancreatitis: a meta-analysis of randomized controlled trials. J Hepatobiliary Pancreat Sci. 2015;22:316-321. [PubMed] [DOI] |
| 27. | Oláh A, Belágyi T, Issekutz A, Gamal ME, Bengmark S. Randomized clinical trial of specific lactobacillus and fibre supplement to early enteral nutrition in patients with acute pancreatitis. Br J Surg. 2002;89:1103-1107. [PubMed] [DOI] |
| 28. | Qin HL, Zheng JJ, Tong DN, Chen WX, Fan XB, Hang XM, Jiang YQ. Effect of Lactobacillus plantarum enteral feeding on the gut permeability and septic complications in the patients with acute pancreatitis. Eur J Clin Nutr. 2008;62:923-930. [PubMed] [DOI] |
| 29. | Morrow LE, Gogineni V, Malesker MA. Synbiotics and probiotics in the critically ill after the PROPATRIA trial. Curr Opin Clin Nutr Metab Care. 2012;15:147-150. [PubMed] [DOI] |
| 30. | Beyer G, Habtezion A, Werner J, Lerch MM, Mayerle J. Chronic pancreatitis. Lancet. 2020;396:499-512. [PubMed] [DOI] |
| 31. | Patel V, Willingham F. The Management of Chronic Pancreatitis. Med Clin North Am. 2019;103:153-162. [PubMed] [DOI] |
| 32. | Lévy P, Domínguez-Muñoz E, Imrie C, Löhr M, Maisonneuve P. Epidemiology of chronic pancreatitis: burden of the disease and consequences. United European Gastroenterol J. 2014;2:345-354. [PubMed] [DOI] |
| 33. | Witt H, Apte MV, Keim V, Wilson JS. Chronic pancreatitis: challenges and advances in pathogenesis, genetics, diagnosis, and therapy. Gastroenterology. 2007;132:1557-1573. [PubMed] [DOI] |
| 34. | Han MM, Zhu XY, Peng YF, Lin H, Liu DC, Li L. The alterations of gut microbiota in mice with chronic pancreatitis. Ann Transl Med. 2019;7:464. [PubMed] [DOI] |
| 35. | Jandhyala SM, Madhulika A, Deepika G, Rao GV, Reddy DN, Subramanyam C, Sasikala M, Talukdar R. Altered intestinal microbiota in patients with chronic pancreatitis: implications in diabetes and metabolic abnormalities. Sci Rep. 2017;7:43640. [PubMed] [DOI] |
| 36. | Louis P, Flint HJ. Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine. FEMS Microbiol Lett. 2009;294:1-8. [PubMed] [DOI] |
| 37. | Wrzosek L, Miquel S, Noordine ML, Bouet S, Joncquel Chevalier-Curt M, Robert V, Philippe C, Bridonneau C, Cherbuy C, Robbe-Masselot C, Langella P, Thomas M. Bacteroides thetaiotaomicron and Faecalibacterium prausnitzii influence the production of mucus glycans and the development of goblet cells in the colonic epithelium of a gnotobiotic model rodent. BMC Biol. 2013;11:61. [PubMed] [DOI] |
| 38. | Martín R, Miquel S, Chain F, Natividad JM, Jury J, Lu J, Sokol H, Theodorou V, Bercik P, Verdu EF, Langella P, Bermúdez-Humarán LG. Faecalibacterium prausnitzii prevents physiological damages in a chronic low-grade inflammation murine model. BMC Microbiol. 2015;15:67. [PubMed] [DOI] |
| 39. | Domínguez-Muñoz JE. Pancreatic exocrine insufficiency: diagnosis and treatment. J Gastroenterol Hepatol. 2011;26 Suppl 2:12-16. [PubMed] [DOI] |
| 40. | Nishiyama H, Nagai T, Kudo M, Okazaki Y, Azuma Y, Watanabe T, Goto S, Ogata H, Sakurai T. Supplementation of pancreatic digestive enzymes alters the composition of intestinal microbiota in mice. Biochem Biophys Res Commun. 2018;495:273-279. [PubMed] [DOI] |
| 41. | Grander C, Adolph TE, Wieser V, Lowe P, Wrzosek L, Gyongyosi B, Ward DV, Grabherr F, Gerner RR, Pfister A, Enrich B, Ciocan D, Macheiner S, Mayr L, Drach M, Moser P, Moschen AR, Perlemuter G, Szabo G, Cassard AM, Tilg H. Recovery of ethanol-induced Akkermansia muciniphila depletion ameliorates alcoholic liver disease. Gut. 2018;67:891-901. [PubMed] [DOI] |
| 42. | Dos Santos PQ, Guedes JC, de Jesus RP, Santos RRD, Fiaconne RL. Effects of using symbiotics in the clinical nutritional evolution of patients with chronic pancreatitis: Study prospective, randomized, controlled, double blind. Clin Nutr ESPEN. 2017;18:9-15. [PubMed] [DOI] |
| 43. | Dylag K, Hubalewska-Mazgaj M, Surmiak M, Szmyd J, Brzozowski T. Probiotics in the mechanism of protection against gut inflammation and therapy of gastrointestinal disorders. Curr Pharm Des. 2014;20:1149-1155. [PubMed] [DOI] |
| 44. | Kawaguchi K, Koike M, Tsuruta K, Okamoto A, Tabata I, Fujita N. Lymphoplasmacytic sclerosing pancreatitis with cholangitis: a variant of primary sclerosing cholangitis extensively involving pancreas. Hum Pathol. 1991;22:387-395. [PubMed] [DOI] |
| 45. | Yoshida K, Toki F, Takeuchi T, Watanabe S, Shiratori K, Hayashi N. Chronic pancreatitis caused by an autoimmune abnormality. Proposal of the concept of autoimmune pancreatitis. Dig Dis Sci. 1995;40:1561-1568. [PubMed] [DOI] |
| 46. | Hart PA, Zen Y, Chari ST. Recent Advances in Autoimmune Pancreatitis. Gastroenterology. 2015;149:39-51. [PubMed] [DOI] |
| 47. | Sureka B, Rastogi A. Autoimmune Pancreatitis. Pol J Radiol. 2017;82:233-239. [PubMed] [DOI] |
| 48. | Hamada S, Masamune A, Nabeshima T, Shimosegawa T. Differences in Gut Microbiota Profiles between Autoimmune Pancreatitis and Chronic Pancreatitis. Tohoku J Exp Med. 2018;244:113-117. [PubMed] [DOI] |
| 49. | Raderer M, Wrba F, Kornek G, Maca T, Koller DY, Weinlaender G, Hejna M, Scheithauer W. Association between Helicobacter pylori infection and pancreatic cancer. Oncology. 1998;55:16-19. [PubMed] [DOI] |
| 50. | Frulloni L, Lunardi C, Simone R, Dolcino M, Scattolini C, Falconi M, Benini L, Vantini I, Corrocher R, Puccetti A. Identification of a novel antibody associated with autoimmune pancreatitis. N Engl J Med. 2009;361:2135-2142. [PubMed] [DOI] |
| 51. | Khan J, Pelli H, Lappalainen-Lehto R, Järvinen S, Sand J, Nordback I. Helicobacter pylori in alcohol induced acute pancreatitis. Scand J Surg. 2009;98:221-224. [PubMed] [DOI] |
| 52. | Risch HA, Lu L, Kidd MS, Wang J, Zhang W, Ni Q, Gao YT, Yu H. Helicobacter pylori seropositivities and risk of pancreatic carcinoma. Cancer Epidemiol Biomarkers Prev. 2014;23:172-178. [PubMed] [DOI] |
| 53. | Guarneri F, Guarneri C, Benvenga S. Helicobacter pylori and autoimmune pancreatitis: role of carbonic anhydrase via molecular mimicry? J Cell Mol Med. 2005;9:741-744. [PubMed] [DOI] |
| 54. | Arai Y, Yamashita K, Kuriyama K, Shiokawa M, Kodama Y, Sakurai T, Mizugishi K, Uchida K, Kadowaki N, Takaori-Kondo A, Kudo M, Okazaki K, Strober W, Chiba T, Watanabe T. Plasmacytoid Dendritic Cell Activation and IFN-α Production Are Prominent Features of Murine Autoimmune Pancreatitis and Human IgG4-Related Autoimmune Pancreatitis. J Immunol. 2015;195:3033-3044. [PubMed] [DOI] |
| 55. | Watanabe T, Yamashita K, Arai Y, Minaga K, Kamata K, Nagai T, Komeda Y, Takenaka M, Hagiwara S, Ida H, Sakurai T, Nishida N, Strober W, Kudo M. Chronic Fibro-Inflammatory Responses in Autoimmune Pancreatitis Depend on IFN-α and IL-33 Produced by Plasmacytoid Dendritic Cells. J Immunol. 2017;198:3886-3896. [PubMed] [DOI] |
| 56. | Kamata K, Watanabe T, Minaga K, Strober W, Kudo M. Autoimmune Pancreatitis Mouse Model. Curr Protoc Immunol. 2018;120:15.31.1-15.31.8. [PubMed] [DOI] |
| 57. | Kamata K, Watanabe T, Minaga K, Hara A, Yoshikawa T, Okamoto A, Yamao K, Takenaka M, Park AM, Kudo M. Intestinal dysbiosis mediates experimental autoimmune pancreatitis via activation of plasmacytoid dendritic cells. Int Immunol. 2019;31:795-809. [PubMed] [DOI] |
| 58. | 中华医学会消化病学分会胰腺疾病学组, 《中华胰腺病杂志》编委会, 《中华消化杂志》编委会. 中国急性胰腺炎诊治指南(2019年, 沈阳). 临床肝胆病杂志. 2019;35:2706-2711. [DOI] |
| 59. | Meijerink M, van Hemert S, Taverne N, Wels M, de Vos P, Bron PA, Savelkoul HF, van Bilsen J, Kleerebezem M, Wells JM. Identification of genetic loci in Lactobacillus plantarum that modulate the immune response of dendritic cells using comparative genome hybridization. PLoS One. 2010;5:e10632. [PubMed] [DOI] |
| 60. | Macho Fernandez E, Valenti V, Rockel C, Hermann C, Pot B, Boneca IG, Grangette C. Anti-inflammatory capacity of selected lactobacilli in experimental colitis is driven by NOD2-mediated recognition of a specific peptidoglycan-derived muropeptide. Gut. 2011;60:1050-1059. [PubMed] [DOI] |
| 61. | Cui LH, Wang XH, Peng LH, Yu L, Yang YS. [The effects of early enteral nutrition with addition of probiotics on the prognosis of patients suffering from severe acute pancreatitis]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue. 2013;25:224-228. [PubMed] [DOI] |