修回日期: 2021-06-06
接受日期: 2021-08-24
在线出版日期: 2021-10-08
肿瘤相关巨噬细胞(Tumor-associated macrophages, TAMs)是肿瘤微环境重要的组成部分, 其在肿瘤组织和远处转移部位均有分布, 与肿瘤的进展和预后有关. M2型TAMs可促进肿瘤增殖、侵袭转移、抑制凋亡等肿瘤生物学过程, 与肿瘤患者的不良预后明显相关. 近年来, 长链非编码RNA (long non-coding RNAs, lncRNAs)调控巨噬细胞极化的作用逐渐被揭示, 其可通过调控巨噬细胞极化方向来影响肿瘤的发生和发展. 研究表明lncRNAs在胃癌巨噬细胞极化过程发挥重要作用, 现就相关研究报道进行综述, 以期为干预TAMs极化过程抑制胃癌进展的相关研究提供思路.
核心提要: 近年来的研究发现长链非编码RNA (long non-coding RNAs, lncRNAs)参与了巨噬细胞的极化过程, 影响肿瘤的进展和预后. 本文就lncRNAs调控胃癌巨噬细胞极化的研究进展进行了概括.
引文著录: 锁瑞洋, 王芝馀, 王健生, 张广健, 张佳. 长链非编码RNA调控胃癌巨噬细胞极化研究进展. 世界华人消化杂志 2021; 29(19): 1096-1101
Revised: June 6, 2021
Accepted: August 24, 2021
Published online: October 8, 2021
Tumor-associated macrophages (TAMs) are an important part of the tumor microenvironment. They are distributed in tumor tissues and distant metastatic sites, and are related to tumor progression and prognosis. TAMs M2 can promote tumor biological processes such as tumor proliferation, invasion, and metastasis, and inhibit apoptosis, and are obviously related to the poor prognosis of tumor patients. In recent years, the role of long non-coding RNAs (lncRNAs) in regulating the polarization of macrophages has gradually been revealed, which can affect the occurrence and development of tumors by adjusting the polarization of macrophages. Studies have shown that lncRNAs play an important role in the polarization process of gastric cancer macrophages. This article summarizes the related research reports, hoping to provide ideas for studies that interfere with the polarization process of TAMs to inhibit tumor progression.
- Citation: Suo RY, Wang ZY, Wang JS, Zhang GJ, Zhang J. Role of long non-coding RNA in regulating polarization of gastric cancer macrophages. Shijie Huaren Xiaohua Zazhi 2021; 29(19): 1096-1101
- URL: https://www.wjgnet.com/1009-3079/full/v29/i19/1096.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i19.1096
胃癌是一类消化系统的恶性肿瘤, 是全球第五大恶性肿瘤, 也是全球癌症死亡相关的第二大原因[1]. 由于饮食习惯、幽门螺杆菌感染率高等因素, 中国是胃癌的高发国家, 尽管早期胃癌内镜下筛查已经取得了一定的效果, 但是大约35%的胃癌发现时已发生远处转移, 且转移性胃癌5年生存率仅为5%-20%[2,3]. 晚期肿瘤患者失去手术机会, 目前晚期胃癌主要治疗方法包括放化疗、分子靶向和免疫治疗, 截止目前仍未取得理想的效果. 肿瘤相关巨噬细胞(tumor-associated macrophage, TAMs)被认为是肿瘤微环境的重要组成部分, 易受局部微环境信号对其影响而发生极化. 长链非编码RNA (long non-coding RNA, lncRNAs)是广泛存在于机体内的一段超过200个核苷酸的不编码蛋白质的RNA分子, 近年来的研究发现其参与了巨噬细胞极化过程, 影响肿瘤的进展和预后. 胃癌初期症状大多比较隐蔽, 很难早期诊断[4]. 因此寻找其特异性的生物标志物并依据其开发新的诊断、治疗方法对胃癌诊治具有重要意义.
研究表示, 胃癌的侵袭和转移与肿瘤微环境(tumor microenvironment, TME)密切相关, 肿瘤与环境相互依存, 相互影响[5]. TME指肿瘤生长的特殊环境, 由血管内皮细胞、免疫细胞等一系列细胞构成, TAMs是其重要组成部分, 是微环境中浸润数目最多的免疫细胞, 与肿瘤血管生成和预后相关[6-8]. 研究表明, TAMs能促进多种肿瘤的发生和[9]. 巨噬细胞具有明显的可塑性, 在不同的微环境信号刺激下可改变自身形态和功能, 分化成不同的细胞群, 即巨噬细胞极化. 根据活化状态, 主要将其分为经典激活的巨噬细胞(classically activated macrophage, M1)和替代活化巨噬细胞(alternatively activated macrophage, M2). M1和M2型是巨噬细胞极化的两个极端类型, 二者可相互转化, 正常时处于动态平衡之中, 局部M1和M2型巨噬细胞的动态失衡将影响疾病的发生和发展[10-13]. 在肿瘤组织中能同时发现M1和M2型巨噬细胞, M1型巨噬细胞可杀伤肿瘤细胞, 抑制肿瘤血管和淋巴管生成. TAMs被认为是倾向于M2型分化特异的巨噬细胞, 恶性肿瘤初始和发展的标志之一就是巨噬细胞类型从M1型向M2型的极化[14,15]. 报道显示, 阻断TAMs和肿瘤细胞之间的相互作用、抑制巨噬细胞M2极化都可以防止肿瘤的发生和转移[16-19]. 因此, 巨噬细胞极化机制的研究有望为肿瘤的治疗提供新靶点.
人类基因组包含的大量核苷酸序列经过转录和翻译后转化为蛋白质, 然而仅有大约2%的RNA可以编码蛋白. 近年来发现剩余部分的RNA虽不编码蛋白质, 但在细胞生物学功能中发挥重要作用, 这部分RNA被称为非编码RNA (non-coding RNA, ncRNAs)[20]. 长度超过200个核苷酸的非编码RNA被称为lncRNAs, 其广泛存在于哺乳动物体内[21]. 根据lncRNAs在基因组上相对于蛋白质编码基因的位置, 可将其分为正义链(sense)、反义链(antisense)、双向链(bidirectional)、内含子间(intronic)和基因间(intergenic)五种, 也可根据在细胞中分布的位置分为核lncRNAs和细胞质lncRNAs, 并且可以根据各自的位置来推断其具有的功能[22,23]. lncRNAs通过与大量生物分子, 如RNA、DNA和蛋白质等相互作用, 对基因表达的转录、转录后表观遗传调控来影响基因表达, 参与细胞增殖、分化、凋亡等生命活动过程, 在恶性肿瘤基因表达中发挥着重要调控作用[24-28]. 研究发现LncRNA HIF1A-AS2[29]和LncRNA GAPLINC[30]在胃癌细胞系中过表达, lncRNAs的生物学功能和肿瘤的发生之间的关系已经得到证实[31], 但是其具体的机制有待进一步的研究和阐释. 目前的研究发现lncRNAs在固有免疫中发挥重要的调控作用, 新近的一些研究提示lncRNAs调节巨噬细胞极化过程参与疾病进展[32,33]. lncRNAs表达谱分析有助于胃癌的诊断和预后判断, 可作为胃癌介入治疗的有效靶点.
以往针对lncRNAs的研究着眼于基因组印记、发育过程和癌症, 但是越来越多的证据指向lncRNAs在巨噬细胞极化进程中发挥重要调控作用. 例如, 腺癌转移相关转录本1 (long non-coding RNA metastasis-associated lung adenocarcinoma transcript 1, LncRNA MALAT1)抑制M1极化过程[34,35]; 巨噬细胞M2极化调制物(LncRNA MM2P)促进了M2的极化[36], 乳腺癌脑转移蛋白(LncRNA BM)也参与了巨噬细胞的极化过程, 发挥促进M2极化的作用, 这些研究提示LncRNAs参与了肿瘤微环境中巨噬细胞极化的过程[37]. 研究发现, LINC00240通过miR-124-3p/DNMT3B轴促进胃癌细胞增殖、迁移[38]. 胃癌局部微环境中, lncRNAs通过调控转录因子, 进一步改变巨噬细胞极化方向.
尽管研究者一直致力于研究lncRNAs调控基因表达的机制, 但是在表征决定巨噬细胞M2极化的功能性lncRNAs方面的研究进展甚微. LINC00662促进M2极化过程在肝癌中发挥癌基因的作用, 其可能通过ceRNA机制竞争性结合miR-15a, miR-16、miR-107, 从而促进WNT3A的分泌, 同时其也通过旁分泌途径激活Wnt/β-catenim信号通路, 继而促进M2极化[39].
大量的研究证明lncRNAs与包括胃癌在内的诸多肿瘤的发生和发展有着密切的关联. 例如Sang等[40]人筛选发现了LncRNA-CamK-A调控信号介导的肿瘤微环境的重塑, 这一报道表明了lncRNAs对肿瘤微环境中Ca+依赖信号转导途径的重要性, 可能会为人类提供一个肿瘤免疫治疗的潜在靶点; Sun等[41]人报道了LncRNA GAS5抑制胶质小细胞M2极化, 加剧脱髓鞘 , 因而GAS5有希望成为治疗脱髓鞘疾病的一个靶点. 此外还有Chen等[42]报道的LncRNA LNMAT1通过CCL2依赖型巨噬细胞募集促进膀胱癌淋巴转移, 以及Wang等[37]报道的JAK2结合长链非编码RNA促进乳腺癌脑转移. 此外, 在卵巢癌[43], 肺癌[44]、食管癌[45]、甲状腺癌[46,47]、肝癌[48]等多种肿瘤的发生、发展中均观察到lncRNAs的身影.
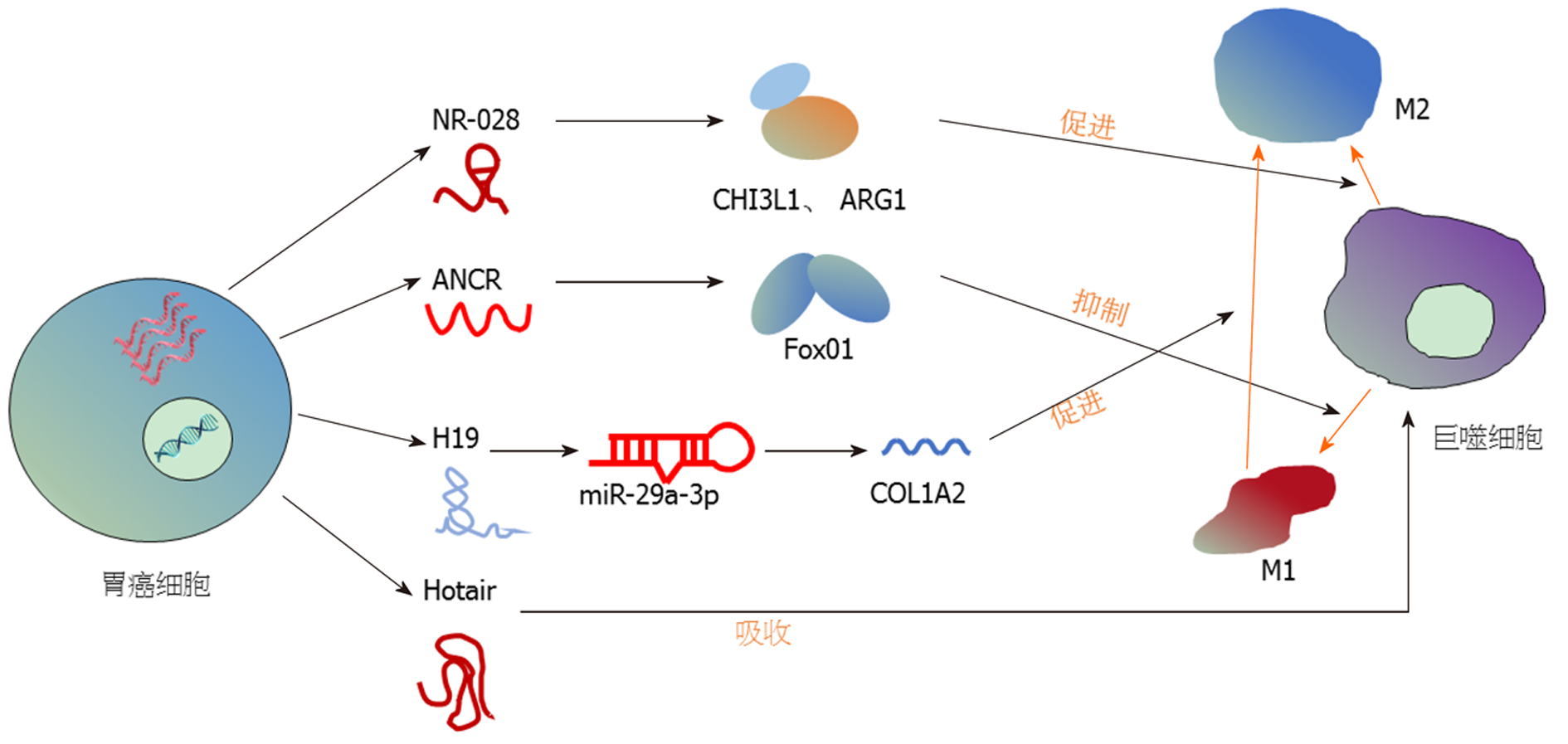
吴昊[49]在人的胃癌组织和癌旁组织中分离出的M2型巨噬细胞中检测出LncRNA NR_028高表达, 敲低其表达可以使肿瘤的转移和大小明显减弱, 表明其可能促进胃癌的进展, CHI3L1和ARG1蛋白可能参与这一相互作用的过程. Xie等[50]发现LncRNA ANCR过表达可下调[51]Fox01抑制巨噬细胞向M1的极化, 促进胃癌细胞的侵袭和转移. Nie等[52]人发现一条新的LncRNA-miRNA-mRNA (H19-miR-29a-3p-COL1A2)轴可能参与巨噬细胞极化过程, 为胃癌的治疗提供新的策略. 李燕等[53]人发现胃癌细胞的LncRNA Hotair能够被巨噬细胞摄取, 并且将其转化为癌症相关巨噬细胞, 表现出一定的促癌特性, 这为胃癌的治疗提供新的可能的靶点. 此外, 黄自坤等[51]在小鼠RAW264.7巨噬细胞实验中发现LncRNA-cox2参与调控极化过程, 为针对以M1极化为靶点的相关疾病诊治提供理论依据和实验依据. 蒋莉等[54]人报道了LncRNA-MM2P可能通过转录因子STAT6的磷酸化水平来调控巨噬细胞极化, 干扰其表达可抑制肿瘤生长. 但有趣的是沉默此lncRNA, 对M2型巨噬细胞促肿瘤细胞迁移能力无影响, 这提示通过靶向单一LncRNA来控制肿瘤的效果可能不是很好. 越来越多的实验证据表明lncRNAs在调控胃癌巨噬细胞极化方面有着重要的作用. 从目前所得的结果来看, 通过阻断肿瘤巨噬细胞极化过程来实现肿瘤的治疗是有希望的(图1). 尽管目前发现了一些lncRNAs调节胃癌巨噬细胞极化的过程, 但是完整的调节通路并没有揭示, 这有待解决(表1).
| 作者 | LncRNA | 因子 | 对M1/M2极化的影响 | Ref. |
| 吴昊 | LncRNA NR_028 | CHI3L1; ARG1 | 促进M2 | 49 |
| Xie | LncRNA ANCR | Fox01 | 抑制M1 | 50 |
| Nie | LncRNA H19 | miR-29a-3p; COL1A2 | 促进M1向M2 | 52 |
| 李燕 | LncRNA Hotair | 促进M2 | 53 | |
| 黄自坤 | LncRNA-cox2 | 促进M1、抑制M2 | 51 | |
| 蒋莉 | LncRNA MM2P | STAT | 促进M2 | 54 |
此外, 关于lncRNAs在胃癌中的其他调节通路的研究也取得了诸多的进展. 如Kong等[55]人报道了一种新的LncRNA ZFPM2-AS1通过稳定迁移抑制因子(migration inhibition factor, MIF)减弱p53通路(ZFPM2-AS1/MIF/p53轴), 促进癌症的发生. Li等[38]的报道表明LINC00240通过miR-124-3p/DNMT3B轴促进胃癌细胞增殖、迁移. 喻大军等[56]的报道显示, LncRNA NEAT1在胃癌中可能通过调控miR-103a/STAMBPL1轴改变胃癌细胞增殖及侵袭能力. 诸多的研究表明了lncRNAs在肿瘤发生和发展中的重要作用, 有望通过其作为靶点进行诊断和治疗.
大多数胃癌患者发现时已经处于晚期, 失去了手术根治的机会, 放化疗、免疫治疗等方式疗效有限, 因此迫切需要寻找胃癌早期生物标志物. 越来越多的证据表明, 胃癌患者血清标本lncRNAs表达谱不同于健康者. lncRNAs在血浆中以高度稳定的形式被检测到, 有作为胃癌早期肿瘤标志物的巨大潜力. Arita等[57]发现胃癌患者血浆H19水平高于正常、术后可降低[58]. 血浆中lncRNAs FAM49B-AS、GUSBP11和CTDHUT组合也有很大潜力成为胃癌诊断无创性生物标志物[59,60]. 此外, 肿瘤预后的预测和评估是肿瘤诊治中的另一个要点. CASC19高表达患者的生存率明显低于低表达者, CASC19被认为是进展期胃癌患者总生存率的独立预后因素[61]. lncRNA NEAT1的过表达程度与临床分期、组织学类型、远处转移或淋巴转移呈正相关. 单因素和多因素分析均显示NEAT1的过表达是胃癌患者预后不良的独立因素[62]. 循环中CASC19和lncRNA NEAT1均可能成为胃癌患者新的预后标志物. 此外, 胃癌患者血清LncRNA CUDR 等的异常表达, 为使用lncRNAs作为胃癌潜在肿瘤标志物进行诊断和预后提供依据[63]. 尽管近年来胃癌患者的5年生存率有所提升, 但是还未达到理想水平. 因此, 筛选新的胃癌标记物用于早期诊断和干预对改善患者预后至关重要. 此外, 胃癌中Hotair表达上调与肿瘤大小、晚期病理分期、转移和患者低生存率等相关, 也可以作为患者预后不良的标志物[64,65]. 因此lncRNAs在胃癌的诊断、治疗以及评估预后等方面的价值应当引起人们的注意.
胃癌是一种异质性疾病, 尽管幽门螺杆菌的控制显著改善了胃癌的发病现状, 但是进展期和转移性胃癌的治疗现状仍不能令人满意. 目前, 许多新的治疗方式和新的诊治靶点的研究正在进行当中. 肿瘤微环境对胃癌的异质性有一定作用, 而作为微环境中主要的成分, TAMs的研究无疑是胃癌诊治的重点. 现有的RT-PCR、LncRNA微阵列等LncRNA筛选技术的进步为相关研究提供了巨大的便利, 但是临床需要更加简捷的技术来筛选相关的lncRNAs, 以期为相关研究提供大容量的临床数据和更加有力的证据. 尽管目前已有诸多研究着眼于胃癌和lncRNAs信号通路的研究, 并且已有了大量的成果. 但是对于lncRNAs调节胃癌巨噬细胞极化方面的研究不多, 少量的结果也并未很好的揭示相关通路的全貌, 离将其作为靶点进行治疗还有一定的距离, 期待后期有更多的研究. 下一步除了继续筛选可作为肿瘤标志物的单个或者组合lncRNA外, 应该有相当一部分工作集中于筛选与M2型巨噬细胞极化相关的lncRNA, 并且要回答其如何影响巨噬细胞极化过程, 从而寻求治疗靶点. 并且从现有研究来看, 多个lncRNA参与这一调控过程, 寻找共同路径或各路径交集对相关的治疗研究有深远意义. 相信lncRNAs相关的研究将能够为胃癌的精准化诊断、治疗提供新的靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70:7-30. [PubMed] [DOI] |
| 3. | Wagner AD, Syn NL, Moehler M, Grothe W, Yong WP, Tai BC, Ho J, Unverzagt S. Chemotherapy for advanced gastric cancer. Cochrane Database Syst Rev. 2017;8:CD004064. [PubMed] [DOI] |
| 4. | 綦 芳, 武 霞, 刘 颖. 高表达CXCL12、IGF1胃癌组织临床病理特征及预后分析. 中华普外科手术学杂志(电子版). 2018;12:306-308. [DOI] |
| 5. | Balkwill F, Mantovani A. Inflammation and cancer: back to Virchow? Lancet. 2001;357:539-545. [PubMed] [DOI] |
| 6. | Naora H. Heterotypic cellular interactions in the ovarian tumor microenvironment: biological significance and therapeutic implications. Front Oncol. 2014;4:18. [PubMed] [DOI] |
| 7. | Kim J, Bae JS. Tumor-Associated Macrophages and Neutrophils in Tumor Microenvironment. Mediators Inflamm. 2016;2016:6058147. [PubMed] [DOI] |
| 8. | Chanmee T, Ontong P, Konno K, Itano N. Tumor-associated macrophages as major players in the tumor microenvironment. Cancers (Basel). 2014;6:1670-1690. [PubMed] [DOI] |
| 9. | Pollard JW. Tumour-educated macrophages promote tumour progression and metastasis. Nat Rev Cancer. 2004;4:71-78. [PubMed] [DOI] |
| 10. | Sica A, Erreni M, Allavena P, Porta C. Macrophage polarization in pathology. Cell Mol Life Sci. 2015;72:4111-4126. [PubMed] [DOI] |
| 12. | 李 小鹏, 张 伦理. 巨噬细胞极化现象与结核病的关系. 中华微生物学和免疫学杂志. 2014;34:247-250. [DOI] |
| 13. | Yoon J, Um HN, Jang J, Bae YA, Park WJ, Kim HJ, Yoon MS, Chung IY, Jung Y. Eosinophil Activation by Toll-Like Receptor 4 Ligands Regulates Macrophage Polarization. Front Cell Dev Biol. 2019;7:329. [PubMed] [DOI] |
| 14. | Guo X, Zhao Y, Yan H, Yang Y, Shen S, Dai X, Ji X, Ji F, Gong XG, Li L, Bai X, Feng XH, Liang T, Ji J, Chen L, Wang H, Zhao B. Single tumor-initiating cells evade immune clearance by recruiting type II macrophages. Genes Dev. 2017;31:247-259. [PubMed] [DOI] |
| 15. | Mantovani A, Marchesi F, Malesci A, Laghi L, Allavena P. Tumour-associated macrophages as treatment targets in oncology. Nat Rev Clin Oncol. 2017;14:399-416. [PubMed] [DOI] |
| 16. | Zhou Q, Xian M, Xiang S, Xiang D, Shao X, Wang J, Cao J, Yang X, Yang B, Ying M, He Q. All-Trans Retinoic Acid Prevents Osteosarcoma Metastasis by Inhibiting M2 Polarization of Tumor-Associated Macrophages. Cancer Immunol Res. 2017;5:547-559. [PubMed] [DOI] |
| 17. | Dong R, Gong Y, Meng W, Yuan M, Zhu H, Ying M, He Q, Cao J, Yang B. The involvement of M2 macrophage polarization inhibition in fenretinide-mediated chemopreventive effects on colon cancer. Cancer Lett. 2017;388:43-53. [PubMed] [DOI] |
| 18. | Li X, Yao W, Yuan Y, Chen P, Li B, Li J, Chu R, Song H, Xie D, Jiang X, Wang H. Targeting of tumour-infiltrating macrophages via CCL2/CCR2 signalling as a therapeutic strategy against hepatocellular carcinoma. Gut. 2017;66:157-167. [PubMed] [DOI] |
| 19. | Sprinzl MF, Puschnik A, Schlitter AM, Schad A, Ackermann K, Esposito I, Lang H, Galle PR, Weinmann A, Heikenwälder M, Protzer U. Sorafenib inhibits macrophage-induced growth of hepatoma cells by interference with insulin-like growth factor-1 secretion. J Hepatol. 2015;62:863-870. [PubMed] [DOI] |
| 20. | Evans JR, Feng FY, Chinnaiyan AM. The bright side of dark matter: lncRNAs in cancer. J Clin Invest. 2016;126:2775-2782. [PubMed] [DOI] |
| 21. | Bhan A, Soleimani M, Mandal SS. Long Noncoding RNA and Cancer: A New Paradigm. Cancer Res. 2017;77:3965-3981. [PubMed] [DOI] |
| 22. | Rinn JL, Chang HY. Genome regulation by long noncoding RNAs. Annu Rev Biochem. 2012;81:145-166. [PubMed] [DOI] |
| 23. | St Laurent G, Wahlestedt C, Kapranov P. The Landscape of long noncoding RNA classification. Trends Genet. 2015;31:239-251. [PubMed] [DOI] |
| 24. | Lau E. Non-coding RNA: Zooming in on lncRNA functions. Nat Rev Genet. 2014;15:574-575. [PubMed] [DOI] |
| 25. | Yang ZG, Gao L, Guo XB, Shi YL. Roles of long non-coding RNAs in gastric cancer metastasis. World J Gastroenterol. 2015;21:5220-5230. [PubMed] [DOI] |
| 26. | Sigova AA, Mullen AC, Molinie B, Gupta S, Orlando DA, Guenther MG, Almada AE, Lin C, Sharp PA, Giallourakis CC, Young RA. Divergent transcription of long noncoding RNA/mRNA gene pairs in embryonic stem cells. Proc Natl Acad Sci USA. 2013;110:2876-2881. [PubMed] [DOI] |
| 27. | Mathy NW, Chen XM. Long non-coding RNAs (lncRNAs) and their transcriptional control of inflammatory responses. J Biol Chem. 2017;292:12375-12382. [PubMed] [DOI] |
| 28. | Li LJ, Leng RX, Fan YG, Pan HF, Ye DQ. Translation of noncoding RNAs: Focus on lncRNAs, pri-miRNAs, and circRNAs. Exp Cell Res. 2017;361:1-8. [PubMed] [DOI] |
| 29. | Chen WM, Huang MD, Kong R, Xu TP, Zhang EB, Xia R, Sun M, De W, Shu YQ. Antisense Long Noncoding RNA HIF1A-AS2 Is Upregulated in Gastric Cancer and Associated with Poor Prognosis. Dig Dis Sci. 2015;60:1655-1662. [PubMed] [DOI] |
| 30. | Yan X, Hu Z, Feng Y, Hu X, Yuan J, Zhao SD, Zhang Y, Yang L, Shan W, He Q, Fan L, Kandalaft LE, Tanyi JL, Li C, Yuan CX, Zhang D, Yuan H, Hua K, Lu Y, Katsaros D, Huang Q, Montone K, Fan Y, Coukos G, Boyd J, Sood AK, Rebbeck T, Mills GB, Dang CV, Zhang L. Comprehensive Genomic Characterization of Long Non-coding RNAs across Human Cancers. Cancer Cell. 2015;28:529-540. [PubMed] [DOI] |
| 31. | Damas ND, Marcatti M, Côme C, Christensen LL, Nielsen MM, Baumgartner R, Gylling HM, Maglieri G, Rundsten CF, Seemann SE, Rapin N, Thézenas S, Vang S, Ørntoft T, Andersen CL, Pedersen JS, Lund AH. SNHG5 promotes colorectal cancer cell survival by counteracting STAU1-mediated mRNA destabilization. Nat Commun. 2016;7:13875. [PubMed] [DOI] |
| 32. | Li L, Dang Q, Xie H, Yang Z, He D, Liang L, Song W, Yeh S, Chang C. Infiltrating mast cells enhance prostate cancer invasion via altering LncRNA-HOTAIR/PRC2-androgen receptor (AR)-MMP9 signals and increased stem/progenitor cell population. Oncotarget. 2015;6:14179-14190. [PubMed] [DOI] |
| 33. | Zhang D, Ding L, Li Y, Ren J, Shi G, Wang Y, Zhao S, Ni Y, Hou Y. Midkine derived from cancer-associated fibroblasts promotes cisplatin-resistance via up-regulation of the expression of lncRNA ANRIL in tumour cells. Sci Rep. 2017;7:16231. [PubMed] [DOI] |
| 34. | Cui H, Banerjee S, Guo S, Xie N, Ge J, Jiang D, Zörnig M, Thannickal VJ, Liu G. Long noncoding RNA Malat1 regulates differential activation of macrophages and response to lung injury. JCI Insight. 2019;4. [PubMed] [DOI] |
| 35. | Zhao G, Su Z, Song D, Mao Y, Mao X. The long noncoding RNA MALAT1 regulates the lipopolysaccharide-induced inflammatory response through its interaction with NF-κB. FEBS Lett. 2016;590:2884-2895. [PubMed] [DOI] |
| 36. | Cao J, Dong R, Jiang L, Gong Y, Yuan M, You J, Meng W, Chen Z, Zhang N, Weng Q, Zhu H, He Q, Ying M, Yang B. LncRNA-MM2P Identified as a Modulator of Macrophage M2 Polarization. Cancer Immunol Res. 2019;7:292-305. [PubMed] [DOI] |
| 37. | Wang S, Liang K, Hu Q, Li P, Song J, Yang Y, Yao J, Mangala LS, Li C, Yang W, Park PK, Hawke DH, Zhou J, Zhou Y, Xia W, Hung MC, Marks JR, Gallick GE, Lopez-Berestein G, Flores ER, Sood AK, Huang S, Yu D, Yang L, Lin C. JAK2-binding long noncoding RNA promotes breast cancer brain metastasis. J Clin Invest. 2017;127:4498-4515. [PubMed] [DOI] |
| 38. | Li Y, Yan J, Wang Y, Wang C, Zhang C, Li G. LINC00240 promotes gastric cancer cell proliferation, migration and EMT via the miR-124-3p / DNMT3B axis. Cell Biochem Funct. 2020;38:1079-1088. [PubMed] [DOI] |
| 39. | Tian X, Wu Y, Yang Y, Wang J, Niu M, Gao S, Qin T, Bao D. Long noncoding RNA LINC00662 promotes M2 macrophage polarization and hepatocellular carcinoma progression via activating Wnt/β-catenin signaling. Mol Oncol. 2020;14:462-483. [PubMed] [DOI] |
| 40. | Sang LJ, Ju HQ, Liu GP, Tian T, Ma GL, Lu YX, Liu ZX, Pan RL, Li RH, Piao HL, Marks JR, Yang LJ, Yan Q, Wang W, Shao J, Zhou Y, Zhou T, Lin A. LncRNA CamK-A Regulates Ca2+-Signaling-Mediated Tumor Microenvironment Remodeling. Mol Cell. 2018;72:71-83.e7. [PubMed] [DOI] |
| 41. | Sun D, Yu Z, Fang X, Liu M, Pu Y, Shao Q, Wang D, Zhao X, Huang A, Xiang Z, Zhao C, Franklin RJ, Cao L, He C. LncRNA GAS5 inhibits microglial M2 polarization and exacerbates demyelination. EMBO Rep. 2017;18:1801-1816. [PubMed] [DOI] |
| 42. | Chen C, He W, Huang J, Wang B, Li H, Cai Q, Su F, Bi J, Liu H, Zhang B, Jiang N, Zhong G, Zhao Y, Dong W, Lin T. LNMAT1 promotes lymphatic metastasis of bladder cancer via CCL2 dependent macrophage recruitment. Nat Commun. 2018;9:3826. [PubMed] [DOI] |
| 43. | Zeng XY, Xie H, Yuan J, Jiang XY, Yong JH, Zeng D, Dou YY, Xiao SS. M2-like tumor-associated macrophages-secreted EGF promotes epithelial ovarian cancer metastasis via activating EGFR-ERK signaling and suppressing lncRNA LIMT expression. Cancer Biol Ther. 2019;20:956-966. [PubMed] [DOI] |
| 44. | Sun Y, Xu J. TCF-4 Regulated lncRNA-XIST Promotes M2 Polarization Of Macrophages And Is Associated With Lung Cancer. Onco Targets Ther. 2019;12:8055-8062. [PubMed] [DOI] |
| 45. | Liu Y, Wang L, Liu H, Li C, He J. The Prognostic Significance of Metabolic Syndrome and a Related Six-lncRNA Signature in Esophageal Squamous Cell Carcinoma. Front Oncol. 2020;10:61. [PubMed] [DOI] |
| 46. | Li JH, Zhang SQ, Qiu XG, Zhang SJ, Zheng SH, Zhang DH. Long non-coding RNA NEAT1 promotes malignant progression of thyroid carcinoma by regulating miRNA-214. Int J Oncol. 2017;50:708-716. [PubMed] [DOI] |
| 47. | Huang JK, Ma L, Song WH, Lu BY, Huang YB, Dong HM, Ma XK, Zhu ZZ, Zhou R. LncRNA-MALAT1 Promotes Angiogenesis of Thyroid Cancer by Modulating Tumor-Associated Macrophage FGF2 Protein Secretion. J Cell Biochem. 2017;118:4821-4830. [PubMed] [DOI] |
| 48. | Lin YH, Wu MH, Yeh CT, Lin KH. Long Non-Coding RNAs as Mediators of Tumor Microenvironment and Liver Cancer Cell Communication. Int J Mol Sci. 2018;19. [PubMed] [DOI] |
| 50. | Xie C, Guo Y, Lou S. LncRNA ANCR Promotes Invasion and Migration of Gastric Cancer by Regulating FoxO1 Expression to Inhibit Macrophage M1 Polarization. Dig Dis Sci. 2020;65:2863-2872. [PubMed] [DOI] |
| 51. | 黄 自坤, 姚 芳苡, 罗 清, 叶 建青, 邓 桢, 呙 阳, 江 红, 李 俊明. lincRNA-cox2对小鼠RAW264.7巨噬细胞极化的影响. 中华微生物学和免疫学杂志. 2016;36:881-886. [DOI] |
| 52. | Nie K, Zheng Z, Wen Y, Pan J, Liu Y, Jiang X, Yan Y, Jiang K, Liu P, Xu S, Liu F, Li P. A novel ceRNA axis involves in regulating immune infiltrates and macrophage polarization in gastric cancer. Int Immunopharmacol. 2020;87:106845. [PubMed] [DOI] |
| 53. | 李 燕, 周 雄坤, 刘 静, 苟 亚军. 长链非编码RNA Hotair通过调控巨噬细胞表型转换促进胃癌细胞增殖与侵袭. 中华细胞与干细胞杂志(电子版). 2019;9:23-28. [DOI] |
| 54. | 蒋 莉, 董 蓉, 龚 彦玲, 袁 梦, 朱 虹, 应 美丹, 何 俏军, 曹 戟, 杨 波. LncRNA-MM2P:特异性调控巨噬细胞M2型极化的长链非编码RNA. 2018年药理学前沿国际研讨会暨浙江省药理学会浙江省药学会药理专业委员会学术年会. 2018;. |
| 55. | Kong F, Deng X, Kong X, Du Y, Li L, Zhu H, Wang Y, Xie D, Guha S, Li Z, Guan M, Xie K. ZFPM2-AS1, a novel lncRNA, attenuates the p53 pathway and promotes gastric carcinogenesis by stabilizing MIF. Oncogene. 2018;37:5982-5996. [PubMed] [DOI] |
| 56. | 喻 大军, 郭 晨旭, 李 靖, 朱 超, 金 鑫, 王 庆康, 钱 军. lncRNA NEAT1/miR-103a/STAMBPL1轴对胃癌细胞增殖和侵袭的调控作用. 山西医科大学学报. 2020;51:883-887. [DOI] |
| 57. | Arita T, Ichikawa D, Konishi H, Komatsu S, Shiozaki A, Shoda K, Kawaguchi T, Hirajima S, Nagata H, Kubota T, Fujiwara H, Okamoto K, Otsuji E. Circulating long non-coding RNAs in plasma of patients with gastric cancer. Anticancer Res. 2013;33:3185-3193. [PubMed] |
| 58. | Yang Y, Shao Y, Zhu M, Li Q, Yang F, Lu X, Xu C, Xiao B, Sun Y, Guo J. Using gastric juice lncRNA-ABHD11-AS1 as a novel type of biomarker in the screening of gastric cancer. Tumour Biol. 2016;37:1183-1188. [PubMed] [DOI] |
| 59. | Zheng R, Liang J, Lu J, Li S, Zhang G, Wang X, Liu M, Wang W, Chu H, Tao G, Zhao Q, Wang M, Du M, Qiang F, Zhang Z. Genome-wide long non-coding RNAs identified a panel of novel plasma biomarkers for gastric cancer diagnosis. Gastric Cancer. 2019;22:731-741. [PubMed] [DOI] |
| 60. | Tan H, Zhang S, Zhang J, Zhu L, Chen Y, Yang H, Chen Y, An Y, Liu B. Long non-coding RNAs in gastric cancer: New emerging biological functions and therapeutic implications. Theranostics. 2020;10:8880-8902. [PubMed] [DOI] |
| 61. | Wang WJ, Guo CA, Li R, Xu ZP, Yu JP, Ye Y, Zhao J, Wang J, Wang WA, Zhang A, Li HT, Wang C, Liu HB. Long non-coding RNA CASC19 is associated with the progression and prognosis of advanced gastric cancer. Aging (Albany NY). 2019;11:5829-5847. [PubMed] [DOI] |
| 62. | Fu JW, Kong Y, Sun X. Long noncoding RNA NEAT1 is an unfavorable prognostic factor and regulates migration and invasion in gastric cancer. J Cancer Res Clin Oncol. 2016;142:1571-1579. [PubMed] [DOI] |
| 63. | Dong L, Qi P, Xu MD, Ni SJ, Huang D, Xu QH, Weng WW, Tan C, Sheng WQ, Zhou XY, Du X. Circulating CUDR, LSINCT-5 and PTENP1 long noncoding RNAs in sera distinguish patients with gastric cancer from healthy controls. Int J Cancer. 2015;137:1128-1135. [PubMed] [DOI] |
| 64. | Xia T, Chen S, Jiang Z, Shao Y, Jiang X, Li P, Xiao B, Guo J. Long noncoding RNA FER1L4 suppresses cancer cell growth by acting as a competing endogenous RNA and regulating PTEN expression. Sci Rep. 2015;5:13445. [PubMed] [DOI] |
| 65. | Li L, Jia F, Bai P, Liang Y, Sun R, Yuan F, Zhang L, Gao L. Association between polymorphisms in long non-coding RNA PRNCR1 in 8q24 and risk of gastric cancer. Tumour Biol. 2016;37:299-303. [PubMed] [DOI] |