修回日期: 2021-04-29
接受日期: 2021-07-27
在线出版日期: 2021-09-08
结直肠癌是最常见的恶性肿瘤之一, 能够找到早期发现和评估肿瘤预后的生物标志物十分必要. 近年来研究发现, HOX转录反义RNA(HOX transcript antisense RNA, HOTAIR)在包括结直肠癌的各种癌症中表达升高, 但由于各个研究样本量较小, 说服力不强.
采用Meta分析的方法对HOTAIR表达水平与结直肠癌患者预后的关系进行探讨.
通过对PubMed 、Medline、CNKI、CBM和Cochrane图书馆的搜索, 检索2020-12发表的有关HOTAIR表达水平与结直肠癌患者预后关系的文献. 两名评价员独立进行纳入文献的质量评价和数据提取, 计算总生存期(overall survival, OS)的危险比(hazard ratio, HR)以及淋巴结转移(lymph node metastasis, LNM)和远处转移(distant metastasis, DM)的优势比(odds ratios, OR), 以评估关联强度.
符合纳入标准的7篇文献被纳入. 其中6篇比较了HOTAIR表达水平与OS的相关性, 结果显示两组间差异有统计学意义(OR = 2.36, 95%CI: 1.74-3.19, P<0.05). 5篇比较了HOTAIR表达水平与LNM的相关性, 两组间差异有统计学意义(OR = 4.07, 95%CI: 1.38-12.0, P<0.05). 4篇比较了HOTAIR表达水平与DM的相关性, 两组间差异有统计学意义(OR = 4.32, 95%CI: 1.60-11.62, P<0.05).
结直肠癌组织中HOTAIR的高表达与OS降低和LNM、DM有显著的相关性, 提示HOTAIR有可能作为一种判断肿瘤预后的新型生物标志物, 对结直肠癌患者的预后监测具有一定的意义.
核心提要: HOX转录反义RNA(HOX transcript antisense RNA, HOTAIR)的高表达与结直肠癌患者总生存期降低以及淋巴结转移和远处转移存在相关性, 提示HOTAIR高表达与患者不良预后相关, 可能作为预测结直肠癌患者预后的生物学标志物.
引文著录: 王柏清, 王珏磊, 张宝芹, 李甜甜, 王超, 孙光斌. HOTAIR表达水平与结直肠癌患者预后关系的分析. 世界华人消化杂志 2021; 29(17): 984-989
Revised: April 29, 2021
Accepted: July 27, 2021
Published online: September 8, 2021
Colorectal cancer is one of the most common malignant tumors. It is essential to find biomarkers for the early detection and evaluation of tumor prognosis. In recent years, studies have revealed that the expression of Hox transcription antisense RNA (HOTAIR) increases in various cancers, including colorectal cancer. However, due to the small sample size of each study, the persuasiveness is not strong.
To perform a meta-analysis to explore the relationship between the expression of HOTAIR and the prognosis of colorectal cancer.
PubMed, MEDLINE, CNKI, CBM, and The Cochrane Library were searched for articles published before December 2020 on the relationship between HOTAIR expression and the prognosis of patients with colorectal cancer. Two reviewers independently evaluated the quality of the included articles and extracted the data. The risk ratio (HR) of overall survival (OS) and the odds ratio of lymph node metastasis (LNM) and distant metastasis (DM) were calculated to evaluate the association strength.
Seven articles that met the inclusion criteria were included. Six of them compared the correlation between HOTAIR expression level and OS, and the results suggested that there existed a significant correlation between them (OR = 2.36, 95%CI: 1.74-3.19, P < 0.05). The correlation between HOTAIR expression level and LNM was compared in five articles, with a statistically significant correlation observed (OR = 4.07, 95%CI: 1.38-12.0, P < 0.05). Four articles compared the correlation between HOTAIR expression level and DM, and there was a statistically significant correlation between them (OR = 4.32, 95%CI: 1.60-11.62, P < 0.05).
The high expression of HOTAIR in colorectal cancer is significantly correlated with decreased OS, LNM, and DM, which indicates that HOTAIR may be a new biomarker for evaluating the prognosis of colorectal cancer.
- Citation: Wang BQ, Wang JL, Zhang BQ, Li TT, Wang C, Sun GB. Prognostic role of HOTAIR in colorectal cancer: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2021; 29(17): 984-989
- URL: https://www.wjgnet.com/1009-3079/full/v29/i17/984.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i17.984
HOX转录反义RNA(HOX transcript antisense RNA, HOTAIR)由2158个核苷酸组成, 可以与PRC2结合, 导致组蛋白甲基化和转录沉默. 研究发现, HOTAIR在各种癌症中表达升高, 并与肿瘤转移和预后相关[1-5]. Kogo等[6]通过定量PCR检测了100例结直肠癌的患者, 结果表明, HOTAIR在结直肠癌肝转移组织中的表达水平高于癌旁正常组织, HOTAIR高表达与大肠癌肝转移的密切相关, 也为结直肠癌的靶向治疗提供了新的思路. 但由于各个研究样本量较小, 说服力不强, 因此本研究采用Meta分析的方法探讨HOTAIR表达水平与结直肠癌患者预后的关系, 以期对临床诊治提供指导.
通过对PubMed 、Medline、CNKI、CBM和Cochrane图书馆的搜索, 检索2013-01/2020-12, 有关HOTAIR表达水平与结直肠癌患者预后关系的文献. 两位评价员独立评估被收录文章的质量并提取数据, 计算总生存期(overall survival, OS)的危险比以及淋巴结转移(lymph node metastasis, LNM)和远处转移(distant metastasis, DM), 以评估关联强度. 分别以"HOTAIR", "HOX transcript antisense RNA", "colorectal cancer", "colorectal carcinoma"为主题词和自由词, 检索PubMed、Medline、Cochrane图书馆; 以"HOTAIR", "HOX转录反义RNA", "结直肠癌"为检索词, 检索知网、万方、中国生物医学文献数据库, 参考文献作为补充.
1.2.1 纳入排除标准: 纳入标准: 收入文献均满足: (1)检测HOTAIR在结直肠癌组织中的表达水平, 描述相关的临床特征参数, 根据HOTAIR的表达水平对患者进行分组; (2)提供HOTAIR的表达水平与OS和/或LNM、DM关系的数据.
排除标准: (1)没有可用数据的研究; (2)重复出版物.
1.2.2 数据提取和质量控制: 两名研究者独立地从符合条件的研究中提取数据, 通过与第三名研究者讨论来解决分歧. 对于每项研究, 记录检测方法和病例数量、LNM和DM的数量、OS. 我们用纽卡斯尔-渥太华量表(NOS)进行质量评估, ≥7分为高质量研究, 6分为中等质量研究, ≤5分为低质量研究, 如有分歧, 通过与第三名研究者讨论来解决.
统计学处理 采用卡方Q检验和I2统计量评价数据的异质性. 对于Q检验, 小于0.05的P值表示存在异质性; 对于统计, I2大于50%表示存在异质性, 统计学意义定义为P值小于0.05. 若P>0.05时, 表明各研究间不存在明显异质性, 采用固定效应模型; P<0.05, 表明存在异质性, 使用随机效应模型进行数据分析, 并尽可能行亚组分析判断产生异质性的原因. 疗效分析的统计量: OS采用风险比(hazard ratio, HR)和95%可信区间(95% confidence interval, 95%CI), LMN和DM采用比值比(odds ratio, OR)和95%CI作为效应指标. 由于我们所收录的文献都是公开发表的, 可能有发表偏倚, 我们采用失效安全数和漏斗图来分析偏倚. 失效安全数Nfs0.05 = (∑z/1.645)2-k, (∑z为各研究z值之和, k为研究个数), 值越大说明发表偏倚影响越小.
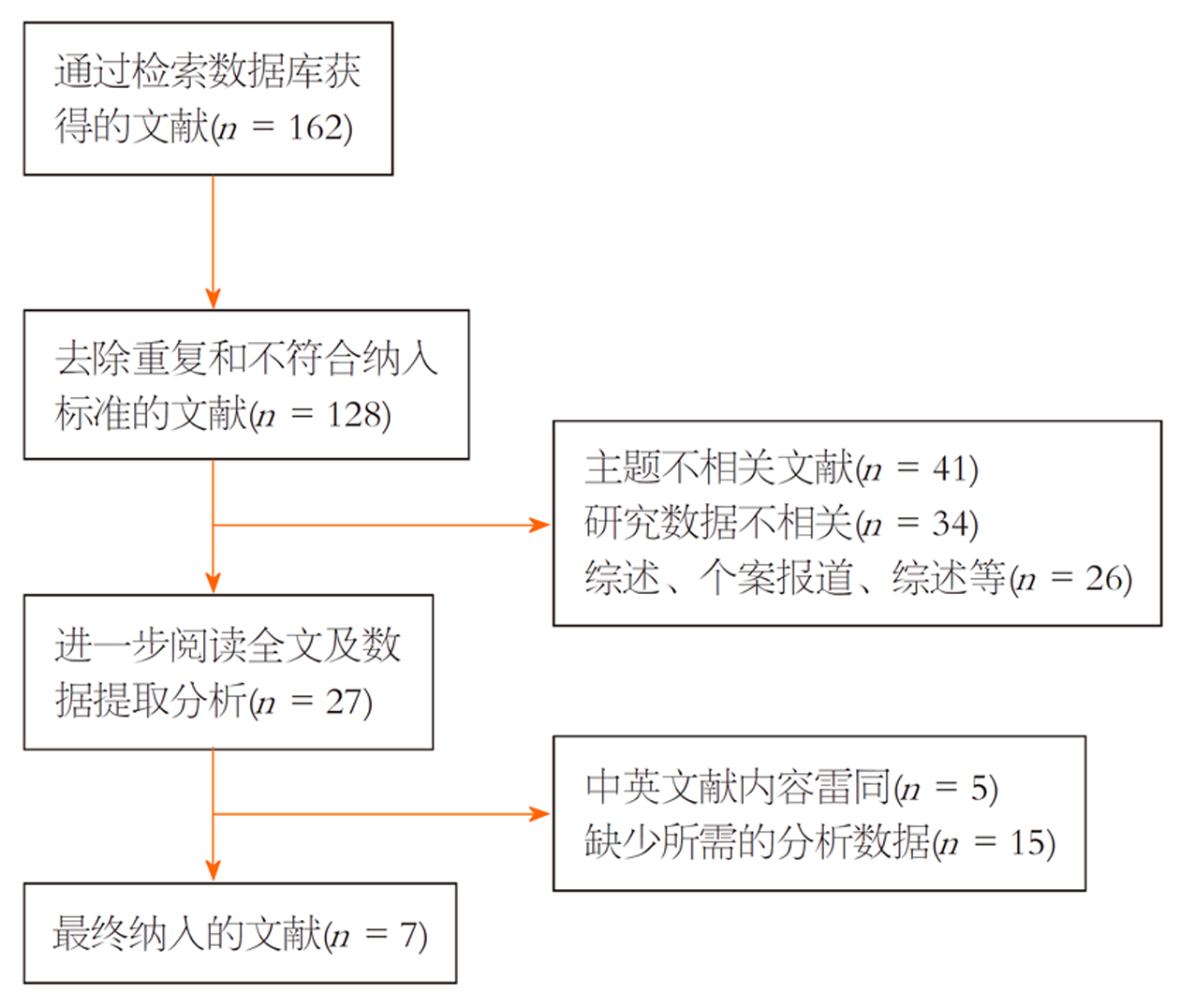
初步检索发现162篇文献, 消除重复文献和通过阅读标题、摘要排除不符合要求的文献128篇, 通过精读全文排除所需数据不全的文献27篇, 最后7篇文献[6-12]研究纳入本Meta分析, 如图1. 文献质量用纽卡斯尔-渥太华量表进行评估, 均≥6分, 为中高质量研究, 纳入文献的特征, 如表1.
| 作者 | 发表时间 | 国家 | 样本量 | HOTAIR表达 | HR(95%CI) | ||||||
| 高表达 | 高表达中淋巴结转移 | 高表达中远处转移 | 低表达 | 低表达中淋巴结转移 | 低表达中远处转移 | 实验方法 | |||||
| Kogo等[6] | 2011 | 日本 | 100 | 20 | 10 | 5 | 80 | 32 | 3 | qRT-PCR | 5.62(1.78-11.24) |
| Li等[7] | 2017 | 中国 | 152 | 96 | 51 | 29 | 56 | 25 | 7 | qRT-PCR | 2.66(1.32-5.62) |
| Xiao等[8] | 2018 | 中国 | 104 | 52 | 39 | 11 | 52 | 21 | 8 | qRT-PCR | 2.13(1.06-4.01) |
| Tatangelo等[9] | 2018 | 意大利 | 80 | - | - | - | - | - | - | qRT-PCR | 1.78(1.13-2.98) |
| Wu等[10] | 2014 | 中国 | 120 | 40 | 27 | 12 | 80 | 5 | 2 | qRT-PCR | 3.915(1.226-12.499) |
| Svoboda等[11] | 2014 | 捷克 | 73 | - | - | - | - | - | - | qRT-PCR | 4.43(1.02- 19.19) |
| Luo等[12] | 2016 | 中国 | 72 | 56 | 23 | - | 16 | 2 | - | qRT-PCR | - |
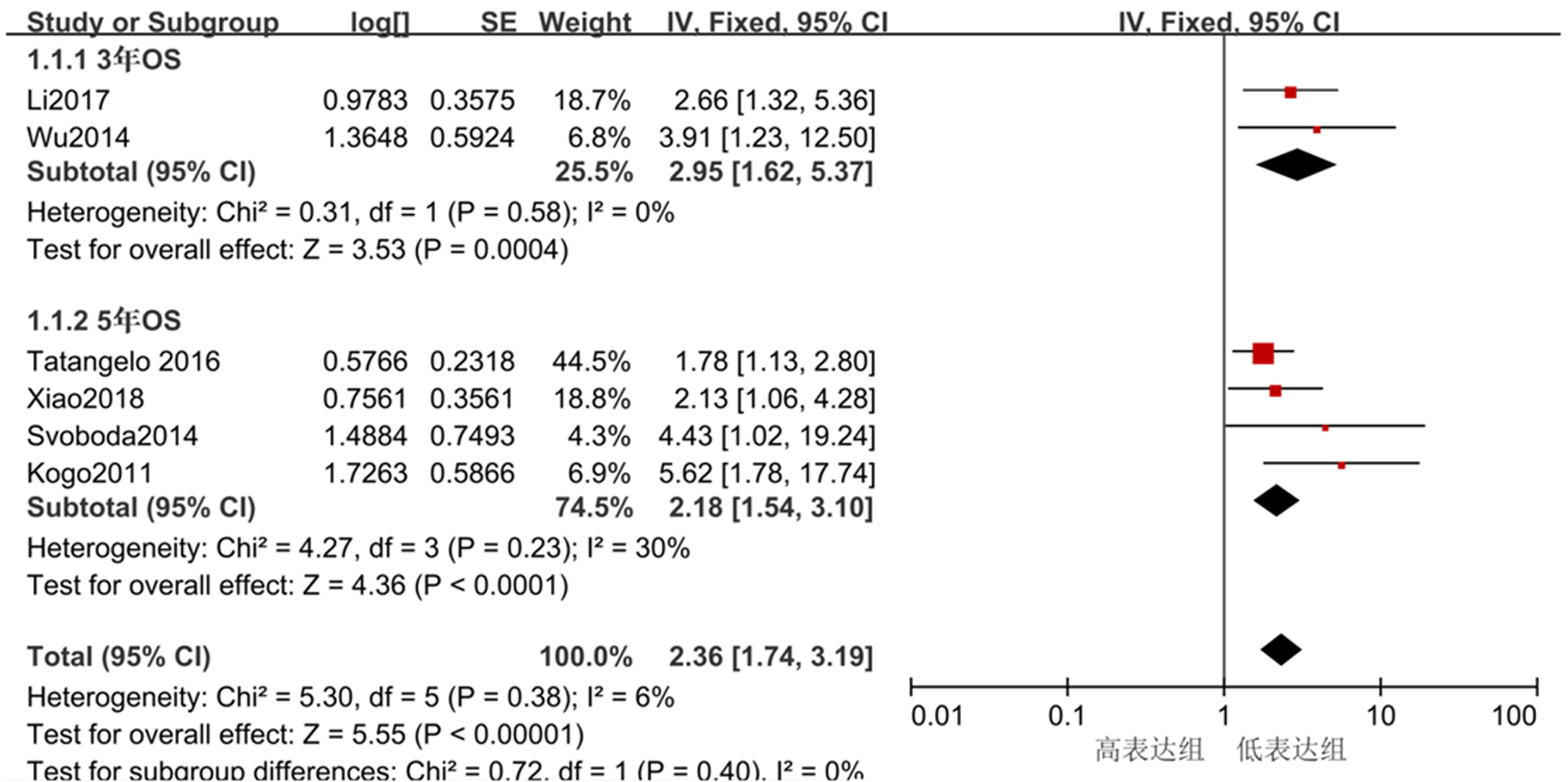
6篇比较了HOTAIR表达水平与结直肠癌患者OS的关系, I2 = 6%, P>0.05, 纳入研究无明显异质性, 统计分析采用固定效应模型. 结果显示两组间差异有统计学意义(OR = 2.36, 95%CI: 1.74-3.19, P<0.05). 考虑HR是带有时间效应的指标, 我们分别对5年OS和3年OS进行亚组分析. 结果显示3年OS, I2 = 0%, P>0.05, 统计分析采用固定效应模型, 结果显示两组间差异有统计学意义(OR = 2.93, 95%CI: 1.62-5.37, P<0.05); 5年OS, I2 = 30%, P>0.05, 采用固定效应模型, 结果显示两组间差异有统计学意义 (OR = 2.18, 95%CI: 1.54-3.10, P<0.05), 见图2.
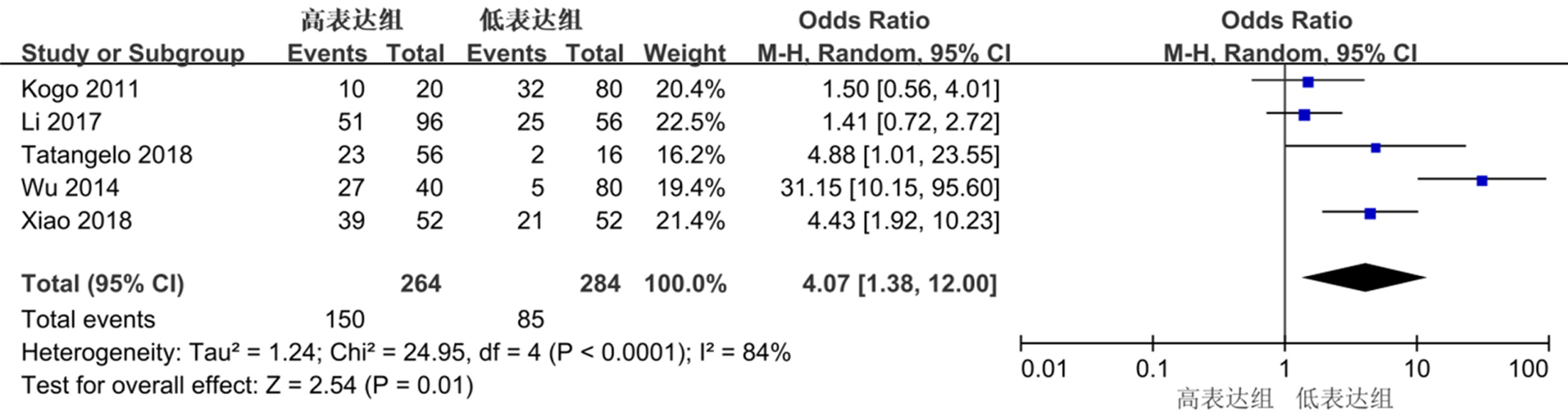
5篇比较了HOTAIR表达水平与结直肠癌患者LNM的关系, I2 = 84%, P<0.05, 纳入研究存在异质性, 统计分析采用随机效应模型.结果显示两组间差异有统计学意义(OR = 4.07, 95%CI:1.38-12.0, P<0.05), 见图3.
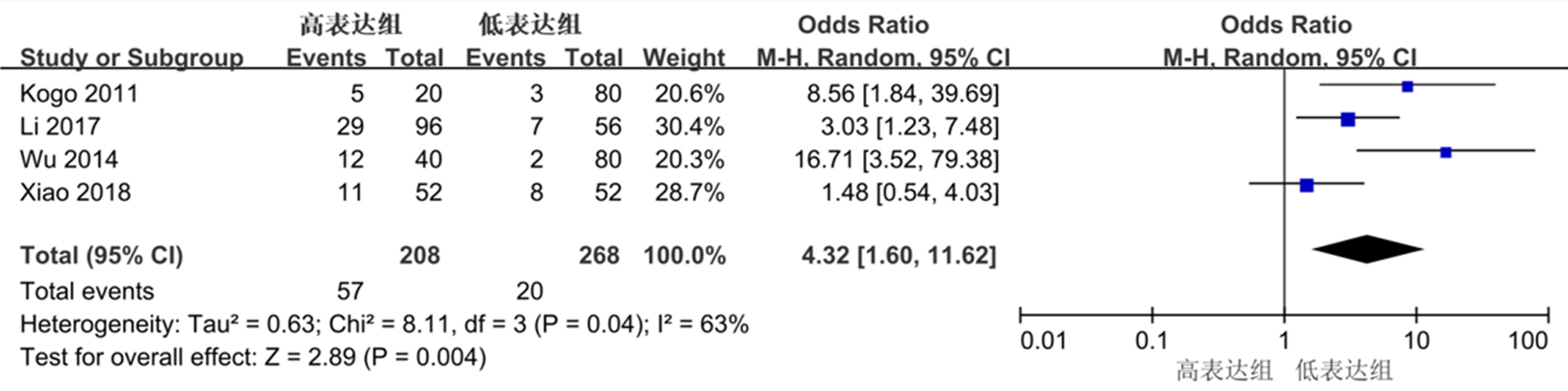
4篇比较了HOTAIR表达水平与结直肠癌患者DM的关系, I2 = 63%, P<0.05, 纳入研究存在异质性, 统计分析采用随机效应模型.结果显示两组间差异有统计学意义(OR = 4.32, 95%CI:1.60-11.62, P<0.05), 见图4.
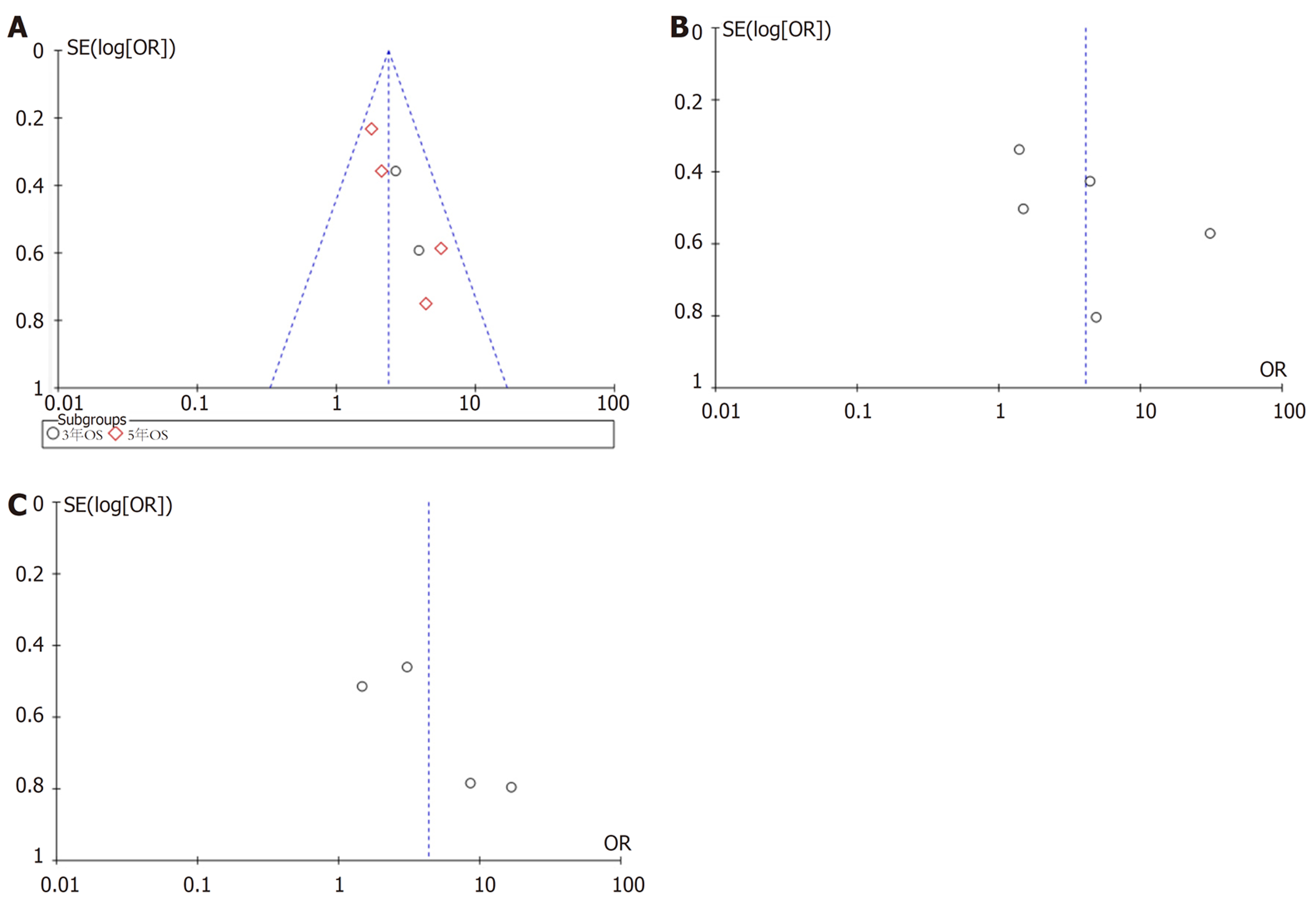
由于我们所收录的文献都是公开发表的, 可能存在发表偏倚, 所以我们采用失效安全和漏斗图来分析偏倚, 见图5. HOTAIR表达水平与OS关系的Meta分析, 失安全系数为203; HOTAIR表达水平与LNM关系的Meta分析, 失安全系数为75; HOTAIR表达水平与DM关系的Meta分析, 失安全系数为100, 均远高于纳入的文献数. 将纳入的文献逐一剔除, 再对其余研究进行分析, 不影响最终结果, 说明Meta分析对单个数据不敏感, 结果较稳定. 但漏斗图显示均显示左右不对称, 提示纳入文献存在一定的发表偏倚.
结直肠癌是最常见的恶性肿瘤之一, 尽管外科手术、放化疗等在治疗方面取得了很大进展, 但结直肠癌的死亡率仍较高, 表明标准化治疗、预测预后和长期随访的重要性. 因此, 找到适合结直肠癌的预后生物标志物至关重要, 这有助于制定临床策略和提高大肠癌患者的生存率[13,14]. LncRNA是癌症相关研究的热点, 有证据表明LncRNA在癌症患者的诊治和预后方面发挥重要作用, 但目前的发现只是冰山一角, 还有许多未知有待进一步探索. HOTAIR作为HOX反义基因间RNA, 以反转录方式调节基因表达, 可以与PRC2结合, 导致组蛋白甲基化和HOXD位点转录沉默[15]. Svoboda[11]等研究提示HOTAIR表达诊断结肠癌的敏感度67%, 特异度92.5%. 黎武等[16]发现, 血清HOTAIR表达与淋巴结转移呈正相关, 血清HOTAIR表达诊断结肠癌的敏感度81.8%, 特异度79.4%; 判断淋巴结转移的敏感度75.0%, 特异度88.9%. Kim等[17]发现, HOTAIR可通过其5'端与EZH2结合, EZH2在胰腺癌中的表达增加, 如果EZH2表达下调, 则具有抗肿瘤作用的miRNA, 包括miR-34a的表达增加. 而敲除HOTAIR后, EZH2对miR-34a的抑制作用减弱, 这也为靶向治疗提供了新的途径[18].也有Meta分析也发现HOTAIR基因高表达与胃癌和食管癌患者的不良预后有关[19,20].
本研究结果显示: HOTAIR表达水平与总生存期降低以及淋巴结转移和远处转移存在相关性, 提示HOTAIR高表达与患者不良预后相关. HOTAIR可能作为预测结直肠癌患者预后的生物学标志物, 对结直肠癌的预后监测具有一定的临床意义.
本Meta分析也有一定的局限性, 纳入研究的文献存在一定的异质性. 考虑HR是带有时间效应的指标, 我们分别对5年OS和3年OS进行了亚组分析, 结果显示HOTAIR高表达与3年OS和5年OS降低存在相关性. 虽然我们尽最大努力增加纳入研究的样本量, 但样本量不足仍然是一个问题. Meta分析提示个别文献研究结果提示两研究组无差异, 考虑患者的年龄、性别, 肿瘤的大小, 恶性程度, 分期及治疗方式等均可能影响预后, 也是异质性来源之一. 但由于文献提供信息有限, 我们均没有进行亚组分析. 由于大多数作者和期刊倾向于报道阳性结果, 因此我们采用漏斗图和失效安全数来分析偏倚, 但漏斗图均显示不对称性, 提示存在发表偏倚的可能, 计算的综合效应值可能高估了HOTAIR高表达对结肠癌患者预后的影响. 而失效安全数均远高于纳入的文献数, 将纳入的文献逐一剔除, 再对其余研究进行分析, 也不影响最终结果, 说明Meta分析结果有一定的可靠性.
综上所述, HOTAIR高表达与结直肠癌患者总生存期降低以及淋巴结转移和远处转移存在相关性, 提示HOTAIR高表达与患者不良预后相关, 可能作为预测结直肠癌患者预后的生物学标志物, 尚需更大规模的前瞻性研究进一步验证.
结直肠癌的死亡率仍较高, 相关的标志物包括癌胚抗原、糖类抗原199、糖类抗原242和某些microRNAs等, 其特异性和敏感性仍相对较低.
寻找更有助于结直肠癌早期发现和预后评估的生物学标志物.
探讨HOX转录反义RNA(HOX transcript antisense RNA, HOTAIR)表达水平与结直肠癌患者预后的关系, 以期对临床诊治提供指导.
采用Meta分析的方法对纳入文献数据进行分析, 研究HOTAIR表达水平与结直肠癌患者预后的关系.
HOTAIR高表达与结直肠癌患者总生存期降低以及淋巴结转移和远处转移存在相关性.
HOTAIR高表达与患者不良预后相关, 可能作为预测结直肠癌患者预后的生物学标志物.
HOTAIR有可能作为一种判断肿瘤预后的新型生物标志物, 对结直肠癌患者的预后监测具有一定的意义, 但尚需更大规模的前瞻性研究进一步验证.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Mattick JS, Rinn JL. Discovery and annotation of long noncoding RNAs. Nat Struct Mol Biol. 2015;22:5-7. [PubMed] [DOI] |
| 2. | Huang X, Zhi X, Gao Y, Ta N, Jiang H, Zheng J. LncRNAs in pancreatic cancer. Oncotarget. 2016;7:57379-57390. [PubMed] [DOI] |
| 3. | Zhao W, Geng D, Li S, Chen Z, Sun M. LncRNA HOTAIR influences cell growth, migration, invasion, and apoptosis via the miR-20a-5p/HMGA2 axis in breast cancer. Cancer Med. 2018;7:842-855. [PubMed] [DOI] |
| 4. | Xiao J, Lai H, Wei SH, Ye ZS, Gong FS, Chen LC. lncRNA HOTAIR promotes gastric cancer proliferation and metastasis via targeting miR-126 to active CXCR4 and RhoA signaling pathway. Cancer Med. 2019;8:6768-6779. [PubMed] [DOI] |
| 5. | Wang W, He X, Zheng Z, Ma X, Hu X, Wu D, Wang M. Serum HOTAIR as a novel diagnostic biomarker for esophageal squamous cell carcinoma. Mol Cancer. 2017;16:75. [PubMed] [DOI] |
| 6. | Kogo R, Shimamura T, Mimori K, Kawahara K, Imoto S, Sudo T, Tanaka F, Shibata K, Suzuki A, Komune S, Miyano S, Mori M. Long noncoding RNA HOTAIR regulates polycomb-dependent chromatin modification and is associated with poor prognosis in colorectal cancers. Cancer Res. 2011;71:6320-6326. [PubMed] [DOI] |
| 7. | Li P, Zhang X, Wang L, Du L, Yang Y, Liu T, Li C, Wang C. lncRNA HOTAIR Contributes to 5FU Resistance through Suppressing miR-218 and Activating NF-κB/TS Signaling in Colorectal Cancer. Mol Ther Nucleic Acids. 2017;8:356-369. [PubMed] [DOI] |
| 8. | Xiao Z, Qu Z, Chen Z, Fang Z, Zhou K, Huang Z, Guo X, Zhang Y. LncRNA HOTAIR is a Prognostic Biomarker for the Proliferation and Chemoresistance of Colorectal Cancer via MiR-203a-3p-Mediated Wnt/ß-Catenin Signaling Pathway. Cell Physiol Biochem. 2018;46:1275-1285. [PubMed] [DOI] |
| 9. | Tatangelo F, Di Mauro A, Scognamiglio G, Aquino G, Lettiero A, Delrio P, Avallone A, Cantile M, Botti G. Posterior HOX genes and HOTAIR expression in the proximal and distal colon cancer pathogenesis. J Transl Med. 2018;16:350. [PubMed] [DOI] |
| 10. | Wu ZH, Wang XL, Tang HM, Jiang T, Chen J, Lu S, Qiu GQ, Peng ZH, Yan DW. Long non-coding RNA HOTAIR is a powerful predictor of metastasis and poor prognosis and is associated with epithelial-mesenchymal transition in colon cancer. Oncol Rep. 2014;32:395-402. [PubMed] [DOI] |
| 11. | Svoboda M, Slyskova J, Schneiderova M, Makovicky P, Bielik L, Levy M, Lipska L, Hemmelova B, Kala Z, Protivankova M, Vycital O, Liska V, Schwarzova L, Vodickova L, Vodicka P. HOTAIR long non-coding RNA is a negative prognostic factor not only in primary tumors, but also in the blood of colorectal cancer patients. Carcinogenesis. 2014;35:1510-1515. [PubMed] [DOI] |
| 12. | Luo ZF, Zhao D, Li XQ, Cui YX, Ma N, Lu CX, Liu MY, Zhou Y. Clinical significance of HOTAIR expression in colon cancer. World J Gastroenterol. 2016;22:5254-5259. [PubMed] [DOI] |
| 13. | Chen S, Zhang C, Feng M. Prognostic Value of LncRNA HOTAIR in Colorectal Cancer: A Meta-analysis. Open Med (Wars). 2020;15:76-83. [PubMed] [DOI] |
| 14. | Zhu L, Liu J, Ma S, Zhang S. Long Noncoding RNA MALAT-1 Can Predict Metastasis and a Poor Prognosis: a Meta-Analysis. Pathol Oncol Res. 2015;21:1259-1264. [PubMed] [DOI] |
| 15. | Rinn JL, Kertesz M, Wang JK, Squazzo SL, Xu X, Brugmann SA, Goodnough LH, Helms JA, Farnham PJ, Segal E, Chang HY. Functional demarcation of active and silent chromatin domains in human HOX loci by noncoding RNAs. Cell. 2007;129:1311-1323. [PubMed] [DOI] |
| 17. | Kim K, Jutooru I, Chadalapaka G, Johnson G, Frank J, Burghardt R, Kim S, Safe S. HOTAIR is a negative prognostic factor and exhibits pro-oncogenic activity in pancreatic cancer. Oncogene. 2013;32:1616-1625. [PubMed] [DOI] |
| 18. | 葛 繁梅, 刘 宥君. 长链非编码RNA HOTAIR与实体肿瘤相关研究进展. 延安大学学报(医学科学版). 2019;17:80-83. [DOI] |
| 19. | 朱 海霞. LncRNA HOTAIR基因与胃癌预后的研究. 南京: 南京医科大学 2019; . |
| 20. | 安 入征. 长链非编码RNA HOTAIR表达与食管鳞癌患者预后关系的meta分析. 河北: 河北医科大学, 2018. |