修回日期: 2021-05-18
接受日期: 2021-06-18
在线出版日期: 2021-08-08
铁死亡是近年发现的一种铁依赖性脂质过氧化和活性氧(reactive oxygen species, ROS)诱导的调节性细胞死亡, 其发生过程中伴有ROS水平升高和抗氧化系统的下降--如酶抗氧化剂中谷胱甘肽过氧化物酶和非酶抗氧化剂中谷胱甘肽等. 谷胱甘肽是细胞内普遍存在的低分子量抗氧化剂, 其稳态水平依赖于所需氨基酸前体吸收速率、酶活性、谷胱甘肽二硫化物的回收以及氧化还原之间的平衡等. 目前, 靶向谷胱甘肽代谢已被广泛研究用于癌症治疗, 与组合疗法相比, 作为单一治疗策略的谷胱甘肽耗竭产生了显著的治疗效果. 因此, 深入认识谷胱甘肽在铁死亡发生过程中的作用, 将为癌症治疗提供新的思路和方向.
核心提要: 谷胱甘肽(glutathione, GSH)作为一种生物体内重要的抗氧化剂, 其靶向代谢也已被广泛研究用于癌症治疗, 进一步明确GSH在肿瘤细胞发生铁凋亡过程中的作用, 以其代谢的各个步骤为靶点制定具体的治疗策略, 将为肿瘤的治疗提供新的思路和方向.
引文著录: 杨凤娟, 谭宁, 张天禹, 程潭. 谷胱甘肽在肿瘤细胞发生铁死亡过程中的作用研究. 世界华人消化杂志 2021; 29(15): 901-907
Revised: May 18, 2021
Accepted: June 18, 2021
Published online: August 8, 2021
Ferroptosis is a type of iron-dependent lipid peroxidation and reactive oxygen species (ROS)-induced regulatory cell death discovered in recent years, which is accompanied by the increase of ROS level and the decrease of antioxidant system components, such as glutathione peroxidase in enzyme antioxidants and glutathione in non-enzyme antioxidants. Glutathione (GSH) is the predominant low-molecular-weight antioxidant with a ubiquitous distribution inside the cell, and its steady-state level depends on the absorption rate of amino acid precursors, enzyme activity, recovery of glutathione disulfide, and the balance between oxidation and reduction. At present, targeted glutathione metabolism has been used in cancer treatment widely. Compared with combination therapy, GSH depletion as a single treatment strategy has a significant effect. Therefore, further understanding of the role of GSH in ferroptosis will provide new ideas and directions for cancer treatment.
- Citation: Yang FJ, Tan N, Zhang TY, Cheng T. Role of glutathione in ferroptosis of tumor cells. Shijie Huaren Xiaohua Zazhi 2021; 29(15): 901-907
- URL: https://www.wjgnet.com/1009-3079/full/v29/i15/901.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i15.901
2003年, Dolma等[1]发现一种名为Erastin的新化合物, 其可能导致基因RAS突变的肿瘤细胞以不同于传统细胞凋亡的方式死亡. 2008年, Yang等[2]发现了RSL3和RSL5两种与Erastin具有相同作用的新化合物, 并确定这种新的细胞死亡可被铁螯合剂、去铁胺B甲烷磺酸盐和捕获过氧自由基的抗氧化剂维生素E所抑制, 证实这种形式的细胞死亡与细胞内铁和活性氧有关. 2012年, Stockwell实验室将由依赖于铁和脂质活性氧积累引起的细胞死亡类型命名为铁死亡[3].
根据该实验室最初的研究, 铁死亡在形态学、生化和遗传水平上明显不同于其他类型的调节性细胞死亡, 如凋亡、坏死和自噬等, 铁死亡的形态学特征是特异性的线粒体皱缩、膜密度增加、线粒体嵴减少或消失[3]; 细胞在发生铁死亡的同时还会释放信号分子(如HMGB1), 从而引起炎症反应; 铁死亡的生化特征主要有: (1)铁和活性氧的积累; (2)抑制胱氨酸谷氨酸逆向转运体(System Xc-)降低胱氨酸摄取、谷胱甘肽(glutathione, GSH)耗竭与NADPH氧化增加; (3)MAPKs系统的激活等[2], 其中GSH耗竭在铁死亡的发生过程中起着至关重要的作用.
GSH化学名为三肽γ-L-谷氨酰-L-胱氨酰甘氨酸, 是人体内最丰富的内源性抗氧化剂, 约90%的GSH储存于细胞胞浆中, 其余10%位于线粒体、细胞核和内质网中[4]. GSH主要以三种形式存在, 分别为还原型GSH、谷胱甘肽二硫化物(glutathione disulphide, GSSG)和谷胱甘肽蛋白混合二硫化物. 生理情况下, 还原型GSH比氧化型GSH即GSSG丰富10-100倍, GSH/GSSG氧化还原偶联不仅决定生物系统中的氧化还原状态, 还有许多其他功能, 如影响细胞周期进程、细胞死亡、转录因子活性等[5].
在这篇综述中, 我们主要讨论了GSH的稳态调控, GSH在铁死亡发生过程中的作用, 以及以GSH为靶点诱导肿瘤细胞发生铁死亡, 为肿瘤的治疗提供一种新思路.
胞膜脂上的多聚不饱和脂肪酸(polyunsaturated fatty acid, PUFA)链易被活性氧(reactive oxygen species, ROS)氧化, 形成脂质过氧化物, 在铁离子的介导下, 脂质过氧化物转变成有毒的脂质自由基(LO-), 导致细胞膜脂的多聚不饱和脂肪酸破碎[1], 引发细胞死亡. 铁死亡主要受铁代谢途径、System Xc-/GPX4途径和脂质代谢途径的共同调控.
铁对几乎所有生物的生存都是必不可少的, 因为它是一系列生化过程的辅助因子, 包括氧气储存、氧化磷酸化和细胞增殖所需的酶反应, 铁也是脂质过氧化物的积累和铁死亡的发生所必需的元素之一[6]. 因此, 铁的输入、排出、储存和流通量都会影响铁死亡的发生. 当胞质中存在过量游离亚铁离子(Fe2+)时, 大量聚集的Fe2+具有极强的氧化性, Fe2+容易与H2O2发生Fenton反应产生ROS而导致脂质过氧化和铁死亡的发生[6]. 循环铁以Fe3+依附在转铁蛋白的形式存在, Fe3+通过膜上的转铁蛋白受体1 (transferrin receptor 1, TFR1)进入细胞, 然后定位于细胞内. 在核内体中, 铁还原酶将Fe3+还原为Fe2+. 最后, 二价金属转运体1 (Divalent metal transporter 1, DMT1, 也称为SLC11A2)介导铁离子从核内体释放到不稳定的细胞质铁池中, 多余的铁储存在铁蛋白轻链多肽(ferritin light chain, FTL)与铁蛋白重链多肽1 (ferritin heavy chain 1, FTH1)组成的铁储存蛋白复合物中. 铁离子的出膜是由膜蛋白铁(也叫铁射流泵, 也称为SLC11A3)激动的, 其能将Fe2+氧化成Fe3+. 病理状态下, 通过研究铁死亡经典诱导剂Erastin作用于人类癌细胞, 热休克预处理和过表达热休克蛋白B1可抑制TFR1表达, 蛋白激酶C介导的铁代谢主要转录因子铁反应元件结合蛋白2被抑制, 显著增加FTL与FTH1表达, 降低细胞内亚铁离子浓度和脂质活性氧的产生; 而血红素氧合酶-1能够通过补充细胞内铁离子及产生活性氧, 加速Erastin诱导的铁死亡[7]. 这表明, 铁蛋白调控和铁代谢稳态可能成为铁死亡机制的重要调节点.
科学研究表明胱氨酸谷氨酸逆向转运体System Xc-/GPX4通路是铁死亡主要的发生途径之一[2], 其中System Xc-对谷胱甘肽的合成至关重要. System Xc-是由机体细胞膜上SLC7A11和SLC3A2两个亚基组成的重要抗氧化体系, 可按1:1比例将细胞外胱氨酸摄取入胞内, 将谷氨酸排出至胞外, 胱氨酸进入细胞后被迅速还原成半胱氨酸, 参与胞内重要自由基清除剂GSH的合成[8]. 谷胱甘肽过氧化物酶(glutathione peroxidase, GPXs)家族有许多成员, 包括 GPX1-GPX8, 其中GPX4在铁死亡中扮演着更加重要的角色. GPX4作为哺乳动物中修复脂质细胞氧化损伤的硒蛋白, 通过将底物GSH转化为GSSG的同时将细胞内毒性脂质过氧化物还原为无毒脂醇醇(L-OH)或将游离的H2O2转化为水, 保护细胞膜结构及功能不受过氧化物的干扰及损害[9].
研究发现[8]p53可通过下调SLC7A11的表达从而抑制System Xc-吸收胱氨酸, 导致谷胱甘肽合成障碍, 谷胱甘肽又是GPXs发挥作用的必要辅助因子, 谷胱甘肽合成障碍将导致GPXs活性降低, 细胞抗过氧化能力降低, 脂质活性氧堆积, 引起细胞发生铁死亡; Erastin[7]、柳氮磺胺吡啶[8]等都是通过作用于System Xc-诱导细胞发生铁死亡. RSL3与Erastin都是铁死亡诱导剂, 两者均能引起脂质活性氧的上升, 但与Erastin的作用方式不同的是, RSL3能够直接抑制GPX4活性, 致细胞抗氧化能力下降, 脂质活性氧上升, 最终引起铁死亡[8].
细胞膜或细胞器膜, 由于其富含多不饱和脂肪酸, 特别容易受到ROS损伤, 称为"脂质过氧化", 脂质过氧化也是铁死亡发生所必须的元素之一. 脂氧合酶的活性可以催化含有PUFA的磷脂发生过氧化反应, 促进铁死亡发生. 基于CRISPR的遗传筛选确定了两种脂质代谢调节剂, 溶血磷脂酰胆碱酰基转移酶3 (LPCAT3)和酰基辅酶A合成酶长链家族成员4 (ACSL4), 它们促进由GPX4抑制诱导的KBM7细胞发生铁死亡; 应用脂质组学研究, 含有花生四烯酸(C20:4)或其延长产物肾上腺酸(C22:4)的磷脂酰乙醇胺(PE)是脂质氧化作用并驱使细胞朝向铁死亡发生的关键磷脂, 而ACSL4和LPCAT3参与多不饱和脂肪酸的生物合成和重塑, 通过补充花生四烯酸或其他多不饱和脂肪酸的细胞表现出对铁死亡的高灵敏, 执行铁死亡发生的重要步骤[10]. 研究人员Doll和Bersuker等[11,12]发现线粒体凋亡诱导因子2能与脂质过氧化自由基清除剂-辅酶Q10协同作用抑制细胞铁死亡, 并将其更名为铁死亡抑制蛋白1 (ferroptosis-suppressor-protein 1, FSP1). 基于此, 研究发现[11]iF-SP1可在过表达FSP1的GPX4基因缺失细胞系中抑制FSP1活性并促进脂质过氧化反应对细胞造成损伤(表1). 经典的自由基清除剂他汀类药物-Ferrostatin以及脂质过氧化酶抑制剂-脂溶性抗氧化剂维生素E (Vitamin E)等均能通过影响脂质氧化过程实现对细胞发生铁死亡的调控[3,13]. 表1总结显示了与铁死亡调控相关的作用物质及作用靶点.
在铁死亡涉及的System Xc-/GPX4通路中, System Xc-是参与GSH合成的重要转运体, GPX4通过催化GSH转化为GSSG发挥抗氧化作用, GSH处于该通路的中心. GSH作为体内重要的抗氧化剂, 可以清除ROS和活性氮, 也可以用作解毒剂发挥整合解毒作用. 一般内源性抗氧化系统包括: (1)酶抗氧化剂, 如超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和硫氧还蛋白; 和(2)非酶抗氧化剂, 包括GSH、维生素或其类似物(维生素A、C和E; 辅酶Q10; 和类黄酮)、矿物质(硒和锌), 以及代谢产物(胆红素和褪黑素)等[14].
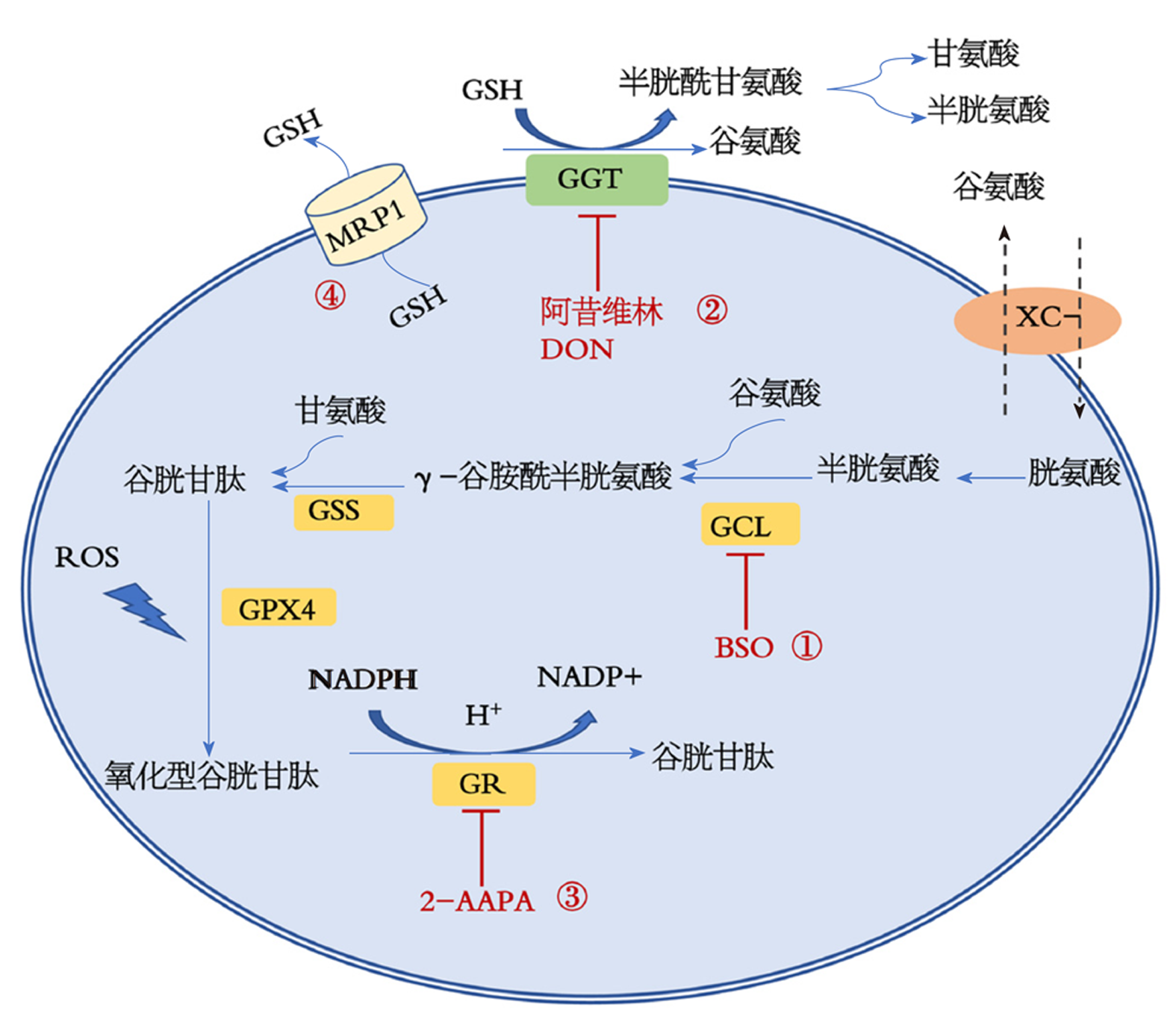
作为消除活性氧的非酶系抗氧化体系, 谷胱甘肽的代谢平衡与铁死亡的发生关系密切.谷胱甘肽的合成是由半胱氨酸、谷氨酸和甘氨酸在胞浆中通过两种ATP依赖的酶反应进行的. 第一步(也是限制性的一步)是半胱氨酸与谷氨酸结合形成γ-谷氨酰半胱氨酸, 该反应由γ-谷氨酰半胱氨酸连接酶(GCL)催化. 在第二个反应中, 谷胱甘肽合成酶(glutathione synthetase, GSS)将甘氨酸添加到γ-谷氨酰半胱氨酸中并产生GSH. 半胱氨酸残基是GSH发挥还原作用的主要结构. 半胱氨酸残基的存在使得GSH被非酶自由基或ROS/RNs氧化为GSSG, 并由属于谷胱甘肽过氧化物酶家族的酶进行酶促氧化. GSSG的积累对细胞具有潜在的毒性, 因为它起着助氧化剂的作用, 与烟酰胺腺嘌呤二核苷酸磷酸(NADP/NADPH)和硫氧还蛋白(Trx(SH)2/TrxSS)系统一起, GSH/GSSG氧化还原偶决定了生物系统的氧化还原状态[5], GSSG通过谷胱甘肽还原酶(glutathione reductase, GR)迅速还原成GSH, 这一步需要由NADPH提供H+, 而NADPH主要由戊糖磷酸途径(PPP)的氧化支链产生[5,15]. γ-谷氨酰转移酶(glutamyltransferase, GGT)是一种膜结合酶, 催化细胞外GSH的降解, 有利于合成细胞内GSH所需的组分谷氨酸和半胱氨酸. 该途径又称γ-谷氨酰循环, 是从头生物合成途径的一种替代途径, 在维持细胞内GSH和半胱氨酸方面起着重要作用. 特异性转运体可以将GSH降解产生的所有氨基酸带回细胞内(图1). 特别是System Xc-对于胱氨酸的摄取、半胱氨酸的氧化形式和用于GSH从头合成的限速底物是必不可少[8]. 最近, 已有新的酶已被证明在细胞质中降解GSH, 扩大GSH周转的复杂性[15].
适度的ROS水平可以通过激活信号通路来支持生存和增殖, 从而在应激性肿瘤微环境中促进肿瘤生长, 然而过量的ROS积累、适当的清除机制的失效或抗氧化剂的缺乏都会导致生物分子的严重损伤, 从而引发细胞死亡[16]. 过量的ROS能够与富含PUFA的质膜发生反应, 在铁离子的介导下生成有毒性的脂质自由基, 诱导质膜破碎, 发生铁死亡. 由于ROS对肿瘤细胞起双重作用, GSH对氧化应激和癌症的发生和发展的影响也很复杂. 它在致癌物的清除和解毒中起着至关重要的作用[4], 而这一途径的改变可以对细胞存活产生深远影响, 另一方面, 研究表明[16]肿瘤细胞中GSH水平的升高能够及时清除过多的ROS, 避免细胞发生铁死亡, 保护骨髓癌、乳腺癌以及结肠癌细胞等, 使它们对几种化疗药物产生耐药性并促进肿瘤细胞发生远处转移.
由于线粒体功能紊乱、代谢改变和频繁的基因突变, 癌细胞中ROS的产生显著增加, 导致大量氧化蛋白、DNA损伤和脂质的积累. 因此, 作为一种适应性反应, 癌细胞体内GSH水平也随之升高. GSH稳态取决于GSH合成限速酶活性、前体氨基酸吸收速率以及GSH/GSSG稳态平衡等.
NRF2是细胞对抗应激反应的关键调节器. 在细胞核中, NRF2与其它蛋白结合后能够促进靶抗氧化基因的转录, 其中包括GCL. GCL是一种由73kd催化亚基(GCLc)和31kd调节亚基(GCLm)组成的异二聚体[4]. GCLm空突变体小鼠细胞中GSH含量<25%, 但其存活率令人惊讶. 相反, GCLm的高表达被发现与乳腺癌的治疗抵抗有关. 此外, 在肉瘤、乳腺癌和淋巴瘤小鼠模型中, GCLm突变导致肿瘤发生延迟, 使GCLm成为对抗这些癌症化疗耐药的有效药物靶点[17]. 低氧诱导因子1通路在缺氧条件下激活GCL表达和GSH合成, 促进化疗后乳腺癌干细胞的聚集[18]. 在卵巢透明细胞癌中, 肝细胞核因子-1β是一种转录因子, 在器官发生中起重要作用, 在多种癌症类型中过表达, 研究显示[19]其能够调节GCL表达, 扩展了与氧化应激相关的谷胱甘肽合成因子的网络. GCL介导GSH合成的第一步, 其活性也受产物GSH的反馈抑制调节. GSS酶参与催化GSH从头合成的第二步, 不受GSH反馈抑制的调控. 然而, GSS活性在某些疾病条件下也很重要, 在某些疾病条件下, GSS酶活性降低会导致γ-谷氨酰半胱氨酸的积累, 可通过γ-谷氨酰环转移酶转化为5-氧代丙烷, 引起严重的溶血性贫血、代谢性酸中毒和中枢神经系统损伤[20]. 目前, GSS在癌症中的作用尚未被详细研究, 也很少有研究发现GSS活性的抑制剂和调节因子, 这仍然是一个活跃的研究领域, 有助于探索GSS作为癌细胞可能的治疗靶点.
除了从头合成外, 肿瘤细胞增加GSH含量的另一种方法是上调PPP[21]. GSSG通常在面临高水平氧化应激的肿瘤细胞中积累, 对细胞有潜在的毒性, 但癌细胞通常含有较高的GR活性, 使GSH维持还原状态, 该过程需要PPP氧化支链产生的NADPH提供H+.
GGT催化细胞外GSH的降解, 有利于合成细胞内GSH所需的组分谷氨酸和半胱氨酸, GGT活性在几种肿瘤类型中上调, 其表达与乳腺癌和肾癌患者的治疗抵抗和不良预后相关. GSH在肿瘤微环境中的关键作用也正在显现, 特别是, 癌症相关的成纤维细胞(CAFs)显示, 以依赖谷胱甘肽的方式减少肿瘤细胞中基因毒性剂的积累, CAFs能够释放高水平的硫醇, 包括谷胱甘肽和半胱氨酸, 增加了肿瘤细胞内GSH水平, 抵消药物介导的氧化应激和凋亡反应[22].
许多癌症类型, 包括肝、肺、乳腺和结肠癌, 显示出相对于正常组织的GSH水平升高,并利用GSH的解毒能力来抵消抗肿瘤药物的活性[4]. 因此, GSH系统引起了研究者的注意, 并提出了一些旨在减少细胞内GSH的策略, 以阻止肿瘤细胞的生长, 提高现有抗癌治疗的效率.
降低GSH水平最直接的策略是使用丁硫氨酸磺酰亚胺(L-buthionine-S, R-sulfoximine, BSO), BSO是GSH合成的第一步也是限制性一步所需的酶, 即GCL的不可逆抑制剂. 虽然BSO在抑制大多数癌细胞的增殖方面不是很有效, 但有研究表明[23]BSO降低了MMTV-PyMT小鼠的乳腺肿瘤负担, 并提高了常用抗癌药物顺铂和卡铂的疗效[24,25]. 由BSO引起的GSH耗竭引起了铁死亡, 诱导铁死亡可能至少部分解释了GSH耗竭与抗癌药物的协同作用, 并可能应用于规避某些肿瘤细胞典型的抗凋亡能力[22]. 美法仑是一种常用于治疗多发性骨髓瘤的烷基化剂[26], 在临床前的体内模型中, BSO增强了美法仑的功效. 目前, 已在一些癌症患者中进行了BSO和美法仑的组合治疗临床实验. 然而, BSO的半衰期短[3], 这需要延长输注时间以维持BSO稳定的血药浓度, 并且在某些临床研究中观察到白细胞减少症和血小板减少症的增加可能会限制BSO在临床治疗中的使用.
降低GSH水平的另一种方法是降低GSH前体的可用性[4]. 一个确定的靶点是胱氨酸谷氨酸逆向转运体System Xc-, 其抑制降低了胱氨酸的摄取, 因此降低了GSH水平[8]. Xc-抑制物柳氮磺吡啶在Ⅰ/Ⅱ期研究中用于治疗进展期恶性胶质瘤, 但由于缺乏反应和严重毒性, 该研究早就终止了[27]. 最近, 另一种Xc-抑制剂, Erastin, 被证明能增强结肠癌细胞系中凋亡诱导因子肿瘤坏死因子相关凋亡诱导配体(TRAIL)的作用[28]. Erastin还通过诱导铁死亡有效地杀死遗传性平滑肌瘤病和肾癌细胞, 其特征是富马酸水合酶(FH)失活[29]. 与BSO类似, 对胱氨酸输入的抑制激活了铁死亡, 并被认为有助于降低肺癌细胞对放疗的抵抗力[30]. GSH经GGT降解后, 细胞也可获得GSH前体. GGT的许多抑制剂已被生产和测试, 如阿昔维林和6-重氮-5-氧代-去甲亮氨酸(DON), 但是因为毒性问题阻止了其在体内的使用[31].
GSH可缓冲多种抗癌药物产生的氧化应激, 形成GSSG[32], 增加GSSG的细胞内浓度被认为是诱导肿瘤细胞死亡的一个好方法[4]. GSSG被GR迅速还原为GSH, 以防止GSSG的积累而导致氧化还原介导的细胞死亡[5]. 不可逆GR抑制剂2-AAPA的治疗使一些癌细胞系对X射线辐射敏感, 并与GSSG和总二硫化物的大量增加相关[32]. 抑制PPP的第一种酶, 即葡萄糖6磷酸脱氢酶, 增加体内的氧化应激水平, 阻止体内头颈部鳞状细胞的生长, 并使顺铂耐药细胞重新对其敏感[21]. 在一项Ⅱ期研究中[33], NOV-002还与阿霉素和环磷酰胺联合用于乳腺癌患者, 显示病理完全缓解率增加.
细胞内GSH的稳态不仅由GSH的合成速率维持, 还由其通过质膜转运体的输出维持 [15]. 因此, 促进GSH的外排可以降低GSH的含量, 使癌细胞对化疗敏感. ATP结合盒(ABC)-家族转运蛋白多药耐药蛋白1 (multidrug resistance protein 1, MRP1)在多种肿瘤类型中上调, 并与多药耐药相关, 它也负责GSH的外排[34]. 正如Dixon[35]研究小组最近所证实的那样, 表达高水平MRP1的细胞对促凋亡药物的敏感性较低, 但与此同时, 它们对促铁死亡药物的敏感性更高. 我们已经证明[36], 在营养缺乏的情况下, 癌细胞系通过MRP1使GSH外排增加, 从而调节自噬的激活. 限制热量摄入或断续禁食是目前备受关注的提高抗癌治疗效果的有效方案, 并取得了令人鼓舞的结果. 验证这种方法是否对MRP1水平高的肿瘤特别有效, 即这种肿瘤可能比MRP1水平低的肿瘤失去更多的GSH, 并且对氧化应激更敏感(表2: 总结显示了与谷胱甘肽代谢相关的抗癌药物及作用靶点).
铁死亡作为新发现的调节性细胞死亡类型中的一种, 其机制是胞内氧化还原系统的失衡. 铁死亡已被证明与人类神经系统疾病的发生密切相关, 更在抑制某些肿瘤细胞的生长过程中发挥了关键作用. GSH作为一种生物体内重要的抗氧化剂, 人们早就知道它在癌细胞中的解毒反应, 其靶向代谢也已被广泛研究用于癌症治疗. 进一步明确GSH在肿瘤细胞发生铁死亡过程中的作用, 以其代谢的各个步骤为靶点制定具体的治疗策略, 将为肿瘤的治疗提供新的思路和方向.
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Dolma S, Lessnick SL, Hahn WC, Stockwell BR. Identification of genotype-selective antitumor agents using synthetic lethal chemical screening in engineered human tumor cells. Cancer Cell. 2003;3:285-296. [PubMed] [DOI] |
| 2. | Yang WS, Stockwell BR. Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells. Chem Biol. 2008;15:234-245. [PubMed] [DOI] |
| 3. | Dixon SJ, Lemberg KM, Lamprecht MR, Skouta R, Zaitsev EM, Gleason CE, Patel DN, Bauer AJ, Cantley AM, Yang WS, Morrison B, Stockwell BR. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 2012;149:1060-1072. [PubMed] [DOI] |
| 4. | Desideri E, Ciccarone F, Ciriolo MR. Targeting Glutathione Metabolism: Partner in Crime in Anticancer Therapy. Nutrients. 2019;11. [PubMed] [DOI] |
| 5. | Hanschmann EM, Godoy JR, Berndt C, Hudemann C, Lillig CH. Thioredoxins, glutaredoxins, and peroxiredoxins--molecular mechanisms and health significance: from cofactors to antioxidants to redox signaling. Antioxid Redox Signal. 2013;19:1539-1605. [PubMed] [DOI] |
| 6. | Cao JY, Dixon SJ. Mechanisms of ferroptosis. Cell Mol Life Sci. 2016;73:2195-2209. [PubMed] [DOI] |
| 7. | Manz DH, Blanchette NL, Paul BT, Torti FM, Torti SV. Iron and cancer: recent insights. Ann NY Acad Sci. 2016;1368:149-161. [PubMed] [DOI] |
| 8. | Lewerenz J, Hewett SJ, Huang Y, Lambros M, Gout PW, Kalivas PW, Massie A, Smolders I, Methner A, Pergande M, Smith SB, Ganapathy V, Maher P. The cystine/glutamate antiporter system x(c)(-) in health and disease: from molecular mechanisms to novel therapeutic opportunities. Antioxid Redox Signal. 2013;18:522-555. [PubMed] [DOI] |
| 9. | Yang WS, SriRamaratnam R, Welsch ME, Shimada K, Skouta R, Viswanathan VS, Cheah JH, Clemons PA, Shamji AF, Clish CB, Brown LM, Girotti AW, Cornish VW, Schreiber SL, Stockwell BR. Regulation of ferroptotic cancer cell death by GPX4. Cell. 2014;156:317-331. [PubMed] [DOI] |
| 10. | Kagan VE, Mao G, Qu F, Angeli JP, Doll S, Croix CS, Dar HH, Liu B, Tyurin VA, Ritov VB, Kapralov AA, Amoscato AA, Jiang J, Anthonymuthu T, Mohammadyani D, Yang Q, Proneth B, Klein-Seetharaman J, Watkins S, Bahar I, Greenberger J, Mallampalli RK, Stockwell BR, Tyurina YY, Conrad M, Bayır H. Oxidized arachidonic and adrenic PEs navigate cells to ferroptosis. Nat Chem Biol. 2017;13:81-90. [PubMed] [DOI] |
| 11. | Doll S, Freitas FP, Shah R, Aldrovandi M, da Silva MC, Ingold I, Goya Grocin A, Xavier da Silva TN, Panzilius E, Scheel CH, Mourão A, Buday K, Sato M, Wanninger J, Vignane T, Mohana V, Rehberg M, Flatley A, Schepers A, Kurz A, White D, Sauer M, Sattler M, Tate EW, Schmitz W, Schulze A, O'Donnell V, Proneth B, Popowicz GM, Pratt DA, Angeli JPF, Conrad M. FSP1 is a glutathione-independent ferroptosis suppressor. Nature. 2019;575:693-698. [PubMed] [DOI] |
| 12. | Bersuker K, Hendricks JM, Li Z, Magtanong L, Ford B, Tang PH, Roberts MA, Tong B, Maimone TJ, Zoncu R, Bassik MC, Nomura DK, Dixon SJ, Olzmann JA. The CoQ oxidoreductase FSP1 acts parallel to GPX4 to inhibit ferroptosis. Nature. 2019;575:688-692. [PubMed] [DOI] |
| 13. | Angeli JPF, Shah R, Pratt DA, Conrad M. Ferroptosis Inhibition: Mechanisms and Opportunities. Trends Pharmacol Sci. 2017;38:489-498. [PubMed] [DOI] |
| 14. | Espinosa-Diez C, Miguel V, Mennerich D, Kietzmann T, Sánchez-Pérez P, Cadenas S, Lamas S. Antioxidant responses and cellular adjustments to oxidative stress. Redox Biol. 2015;6:183-197. [PubMed] [DOI] |
| 15. | Wu G, Fang YZ, Yang S, Lupton JR, Turner ND. Glutathione metabolism and its implications for health. J Nutr. 2004;134:489-492. [PubMed] [DOI] |
| 16. | Bansal A, Simon MC. Glutathione metabolism in cancer progression and treatment resistance. J Cell Biol. 2018;217:2291-2298. [PubMed] [DOI] |
| 17. | Lu SC. Regulation of glutathione synthesis. Mol Aspects Med. 2009;30:42-59. [PubMed] [DOI] |
| 18. | Lu H, Samanta D, Xiang L, Zhang H, Hu H, Chen I, Bullen JW, Semenza GL. Chemotherapy triggers HIF-1-dependent glutathione synthesis and copper chelation that induces the breast cancer stem cell phenotype. Proc Natl Acad Sci USA. 2015;112:E4600-E4609. [PubMed] [DOI] |
| 19. | Lopes-Coelho F, Gouveia-Fernandes S, Gonçalves LG, Nunes C, Faustino I, Silva F, Félix A, Pereira SA, Serpa J. HNF1β drives glutathione (GSH) synthesis underlying intrinsic carboplatin resistance of ovarian clear cell carcinoma (OCCC). Tumour Biol. 2016;37:4813-4829. [PubMed] [DOI] |
| 20. | Ke HL, Lin J, Ye Y, Wu WJ, Lin HH, Wei H, Huang M, Chang DW, Dinney CP, Wu X. Genetic Variations in Glutathione Pathway Genes Predict Cancer Recurrence in Patients Treated with Transurethral Resection and Bacillus Calmette-Guerin Instillation for Non-muscle Invasive Bladder Cancer. Ann Surg Oncol. 2015;22:4104-4110. [PubMed] [DOI] |
| 21. | Li B, Qiu B, Lee DS, Walton ZE, Ochocki JD, Mathew LK, Mancuso A, Gade TP, Keith B, Nissim I, Simon MC. Fructose-1,6-bisphosphatase opposes renal carcinoma progression. Nature. 2014;513:251-255. [PubMed] [DOI] |
| 22. | Wang W, Kryczek I, Dostál L, Lin H, Tan L, Zhao L, Lu F, Wei S, Maj T, Peng D, He G, Vatan L, Szeliga W, Kuick R, Kotarski J, Tarkowski R, Dou Y, Rattan R, Munkarah A, Liu JR, Zou W. Effector T Cells Abrogate Stroma-Mediated Chemoresistance in Ovarian Cancer. Cell. 2016;165:1092-1105. [PubMed] [DOI] |
| 23. | Harris IS, Treloar AE, Inoue S, Sasaki M, Gorrini C, Lee KC, Yung KY, Brenner D, Knobbe-Thomsen CB, Cox MA, Elia A, Berger T, Cescon DW, Adeoye A, Brüstle A, Molyneux SD, Mason JM, Li WY, Yamamoto K, Wakeham A, Berman HK, Khokha R, Done SJ, Kavanagh TJ, Lam CW, Mak TW. Glutathione and thioredoxin antioxidant pathways synergize to drive cancer initiation and progression. Cancer Cell. 2015;27:211-222. [PubMed] [DOI] |
| 24. | Rocha CR, Garcia CC, Vieira DB, Quinet A, de Andrade-Lima LC, Munford V, Belizário JE, Menck CF. Glutathione depletion sensitizes cisplatin- and temozolomide-resistant glioma cells in vitro and in vivo. Cell Death Dis. 2015;6:e1727. [PubMed] [DOI] |
| 25. | Fath MA, Ahmad IM, Smith CJ, Spence J, Spitz DR. Enhancement of carboplatin-mediated lung cancer cell killing by simultaneous disruption of glutathione and thioredoxin metabolism. Clin Cancer Res. 2011;17:6206-6217. [PubMed] [DOI] |
| 26. | Tagde A, Singh H, Kang MH, Reynolds CP. The glutathione synthesis inhibitor buthionine sulfoximine synergistically enhanced melphalan activity against preclinical models of multiple myeloma. Blood Cancer J. 2014;4:e229. [PubMed] [DOI] |
| 27. | Robe PA, Martin DH, Nguyen-Khac MT, Artesi M, Deprez M, Albert A, Vanbelle S, Califice S, Bredel M, Bours V. Early termination of ISRCTN45828668, a phase 1/2 prospective, randomized study of sulfasalazine for the treatment of progressing malignant gliomas in adults. BMC Cancer. 2009;9:372. [PubMed] [DOI] |
| 28. | Lee YS, Lee DH, Jeong SY, Park SH, Oh SC, Park YS, Yu J, Choudry HA, Bartlett DL, Lee YJ. Ferroptosis-inducing agents enhance TRAIL-induced apoptosis through upregulation of death receptor 5. J Cell Biochem. 2019;120:928-939. [PubMed] [DOI] |
| 29. | Kerins MJ, Milligan J, Wohlschlegel JA, Ooi A. Fumarate hydratase inactivation in hereditary leiomyomatosis and renal cell cancer is synthetic lethal with ferroptosis induction. Cancer Sci. 2018;109:2757-2766. [PubMed] [DOI] |
| 30. | Pan X, Lin Z, Jiang D, Yu Y, Yang D, Zhou H, Zhan D, Liu S, Peng G, Chen Z, Yu Z. Erastin decreases radioresistance of NSCLC cells partially by inducing GPX4-mediated ferroptosis. Oncol Lett. 2019;17:3001-3008. [PubMed] [DOI] |
| 31. | Joyce-Brady M, Hiratake J. Inhibiting Glutathione Metabolism in Lung Lining Fluid as a Strategy to Augment Antioxidant Defense. Curr Enzym Inhib. 2011;7:71-78. [PubMed] [DOI] |
| 32. | Zhao Y, Seefeldt T, Chen W, Carlson L, Stoebner A, Hanson S, Foll R, Matthees DP, Palakurthi S, Guan X. Increase in thiol oxidative stress via glutathione reductase inhibition as a novel approach to enhance cancer sensitivity to X-ray irradiation. Free Radic Biol Med. 2009;47:176-183. [PubMed] [DOI] |
| 33. | Montero AJ, Diaz-Montero CM, Deutsch YE, Hurley J, Koniaris LG, Rumboldt T, Yasir S, Jorda M, Garret-Mayer E, Avisar E, Slingerland J, Silva O, Welsh C, Schuhwerk K, Seo P, Pegram MD, Glück S. Phase 2 study of neoadjuvant treatment with NOV-002 in combination with doxorubicin and cyclophosphamide followed by docetaxel in patients with HER-2 negative clinical stage II-IIIc breast cancer. Breast Cancer Res Treat. 2012;132:215-223. [PubMed] [DOI] |
| 34. | Munoz M, Henderson M, Haber M, Norris M. Role of the MRP1/ABCC1 multidrug transporter protein in cancer. IUBMB Life. 2007;59:752-757. [PubMed] [DOI] |