修回日期: 2021-04-16
接受日期: 2021-06-02
在线出版日期: 2021-07-28
通过Meta分析方法对癌胚抗原(carcinoembryonic antigen, CEA)、CA 19-9、CA242联合检测用于结直肠癌诊断的研究进行综合分析, 对其在结直肠癌诊断中的临床价值进行探讨.
探讨CEA、CA 19-9和CA242平行联检在结直肠癌检出率和诊断价值中的应用.
检索PubMed、Embase、Cochrane Library、CNKI、Wanfang database、Sinomed数据库, 检索关于CEA、CA 19-9和CA242用于结直肠癌检测的诊断试验, 检索时限为建库至2019-10-25. 两位研究员在QUADAS-2工具的基础上独立完成了数据提取和质量评估. 采取双变量回归模型, 得出了合并后的灵敏度(SEN合并)、特异度(SPE合并)、阳性似然比(PLR合并)、阴性似然比(NLR合并)、诊断比值比(DOR合并)、曲线下面积(AUC合并)及相应95%可信区间(CI). 采用Meta回归和亚组分析探讨异质性的可能来源.
共计18项研究(3534个病人)纳入本Meta分析. 对于单个肿瘤标志物检测, CA 19-9[0.37(0.32, 0.43)]的SEN合并低于CEA[0.50(0.46, 0.55)]而CEA[0.73(0.68, 0.76)]的AUC合并小于CA 19-9[0.82(0.78, 0.85)]和CA242[0.87(0.83, 0.89)]. 肿瘤标志物联合检测结果显示, 任意两个或三个肿瘤标志物的SEN合并均高于单个肿瘤标志物. 对于AUC合并, 肿瘤标志物联检和除CEA外的单个肿瘤标志物之间无统计学差异. 异质性检验结果显示, 研究规模是CEA和CA 19-9用于单肿瘤标志物检测时异质性可能来源, 而临界值是CA242异质性的可能来源.
联合应用CEA、CA 19-9和CA 242可显著提高结直肠癌诊断的灵敏度. 除CEA外的单个肿瘤标志物与肿瘤标志物联合检测对结直肠癌的诊断价值无明显差异.
核心提要: 既往对联合检测癌胚抗原(carcinoembryonic antigen, CEA)、CA 19-9和CA 242在结直肠癌诊断中的灵敏度和诊断价值有无提升存在争议, 我们采取Meta分析方法得出结论: 联合CEA、CA 19-9和CA 242可显著提高结直肠癌诊断的灵敏度. 除CEA外的单个肿瘤标志物与肿瘤标志物联合检测相比诊断价值无明显差异.
引文著录: 张竞宇, 吴小威, 王绪, 王锐, 刘文天. CEA、CA 19-9和CA242联合检测能否提高结直肠癌诊断的敏感性和诊断价值: Meta分析. 世界华人消化杂志 2021; 29(14): 825-834
Revised: April 16, 2021
Accepted: June 2, 2021
Published online: July 28, 2021
In this study, the combination of CEA, CA19-9, and CA242 in the diagnosis of colorectal cancer (CRC) was analyzed by Meta-analysis, and the clinical value of combined CEA, CA19-9, and CA242 in the diagnosis of CRC was discussed.
To investigate whether combined detection of CEA, CA 19-9, and CA242 can improve detection rate and diagnostic value compared to single biomarkers for CRC.
We searched PubMed, Embase, Cochrane Library, CNKI, Wanfang database and Sinomed up to October 25, 2019. Diagnostic tests on CEA, CA 19-9, and CA242 used for CRC were included in this Meta-analysis. Two reviewers finished data extraction and quality assessment on the basis of Diagnostic Accuracy Studies 2. By using bivariate regression model, we analyzed the pooled sensitivity, specificity, positive likelihood ratio (PLR), negative likelihood ratio (NLR), diagnostic odds ratio (DOR), area under the curve (AUC), and corresponding 95% credible interval (CI). Meta-regression and subgroup analyses were employed to explore possible source of heterogeneity.
Eighteen studies (3534 patients) were included. For single biomarkers, the pooled sensitivity of CA 19-9 [0.37(0.32, 0.43)] was lower than that of CEA [0.50 (0.46, 0.55)] and the pooled AUC of CEA [0.73 (0.68, 0.76)] was lower than that of CA 19-9 [0.82 (0.78, 0.85)] and CA242 [0.87 (0.83, 0.89)]. For biomarker combination, the sensitivity of any two or three biomarkers was greater than that of any single biomarker. For AUC, there was no statistically significant difference between biomarker combinations and single biomarkers but CEA. The result of heterogeneity exploration showed that subject number was the heterogeneity source of CEA and CA 19-9 while cut-off value was the heterogeneity source of CA242.
Combination of CEA, CA 19-9, and CA242 can remarkably improve the diagnostic sensitivity for CRC compared to single biomarkers. There is no discernable differences between biomarker combinations and single biomarkers except CEA in diagnostic value for CRC.
- Citation: Zhang JY, Wu XW, Wang X, Wang R, Liu WT. Can combination of CEA, CA 19-9, and CA242 improve diagnostic sensitivity and diagnostic value for colorectal cancer? A Meta-analysis. Shijie Huaren Xiaohua Zazhi 2021; 29(14): 825-834
- URL: https://www.wjgnet.com/1009-3079/full/v29/i14/825.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i14.825
结直肠癌是严重威胁人类健康的恶性肿瘤之一[1], 根据International Agency for Research on Cancer (IRAC)的研究数据, 每年有约180万新发结直肠癌患者和90万结直肠癌相关死亡病例. 在所有肿瘤中, 结直肠癌的发病率仅次于肺癌和乳腺癌[2]. 从结直肠癌的临床前体、腺瘤, 到进展为结直肠癌往往需要数年的时间[3]. 此外, 早期结直肠癌患者的5年生存率约为90%, 但伴远处转移的晚期结直肠癌患者的5年生存率低于20%[4]. 因此, 尽早发现、尽早诊断、尽早治疗是改善结直肠癌远期预后的关键措施. 在新发临床症状时, 结直肠癌的诊断主要依赖于内镜及活组织检查. 但由于内镜手术具有操作复杂、花费较高、侵入性、术后出血、穿孔等并发症的不足, 患者依从性往往较差[5]. 同时临床症状的出现往往意味着结直肠癌的进展, 因此迫切需要一种早期筛查结直肠癌的方法[6]. The National Institutions of Health Biomarker Definition Work Group将"生物标志物"定义为"在正常生理、病理或对治疗干预的药物应答过程中可以客观测量的指标[7]. 生物标志物可以先于临床症状出现, 这有助于通过测量其存在或浓度变化来实现结直肠癌早期诊断. 此外, 生物标志物具有方便、经济、有效、无创、易被患者接受等优点[8]. 肿瘤标志物可以提示肿瘤的存在, 但由于其分泌部位的广泛性, 单个的肿瘤标志物不能用于鉴别各类肿瘤. 在各种肿瘤标志物中, 癌胚抗原(carcinoembryonic antigen, CEA)、CA 19-9、CA242、CA-50是临床上常用的结直肠癌相关肿瘤标志物[9]. 一项关于蛋白芯片用于12种结直肠癌常用肿瘤标志物检测的研究表明, CEA、CA 19-9、CA242在结直肠癌诊断中显著优于其他肿瘤标志物[10]. 然而, 临床实践证明, 单个血清肿瘤标志物的检测不能达到结直肠癌早期诊断的要求[11,12]. 因此, 寻找新的具有良好灵敏度和特异度的肿瘤标志物以及肿瘤标志物的联合检测是肿瘤标志物在结直肠癌早期诊断临床应用中的两个方向. CEA、CA 19-9、CA242在结直肠癌诊断中具备较高的特异度, 但灵敏度并不理想, 临床中常常采取多种肿瘤标志物的平行联检来提高诊断试验的灵敏度. 然而, 联合检测CEA、CA 19-9和CA242是否能有效提高结直肠癌的灵敏度和诊断价值仍存在争议. 在Chen等[10]的研究中, 十二种常见的用于结直肠癌诊断的肿瘤标志物中居前的五个(CEA、CA242、CA 19-9、CA125和Fr PSA)之间的任何组合相较于单个标志物均不能提高诊断试验灵敏度. 但仲召阳等[13]发现联合应用CEA、CA 19-9和CA242可以提高结直肠癌诊断的准确性和灵敏度. 因此, 本文旨在探讨联合检测CEA、CA 19-9和CA242在结直肠癌诊断中的灵敏度和诊断价值.
我们在PRISMA原则基础上完成了Meta分析并于PROSPERO网站进行了注册(CRD4200152574)[14].
1.1.1 纳入与排除标准: 两位研究员根据纳入与排除标准独立完成了文献筛选. 两人之间的分歧通过与第三位研究员的协商解决. 纳入Meta分析的研究必须符合以下纳入标准: (1)以结直肠癌患者为实验组, 健康人或良性疾病患者为对照组的诊断性研究; (2)提供足够的数据计算"2×2"表[真阳性(tp)、假阳性(fp)、真阴性(tn), 假阴性(fn)]; (3)给出与CEA、CA 19-9和CA242用于结直肠癌诊断参考的金标准; (4)研究中明确指出相关肿瘤标志物的临界值. 符合以下排除标准的文献予以排除: (1)与CEA、CA 19-9和CA242用于结直肠癌诊断无关的研究; (2)未提供足够的信息获得"2×2"表; (3)未给出诊断试验金标准; (4)未给出肿瘤标志物临界值; (5)综述、信件、会议论文和Meta分析.
1.1.2 检索策略: 在PubMed、Embase、Cochrane Library、CNKI、Wanfang database和Sinomed等数据库进行检索. 检索时限为建库至 2019-10-25. 采用自由词与主题词相结合的方式进行检索. 为了减少文章数量, 我们将搜索字段限制为"摘要"和"标题". 英文检索词为"Colorectal Neoplasms""Colorectal Carcinoma" "Colorectal Cancer" "Carcinoembryonic Antigen""CA-19-9 Antigen""CA-242 antigen". 中文检索词为"结直肠癌""癌胚抗原""CA 19-9抗原""CA242抗原". 以Pubmed为例, 具体检索策略见补充材料1.
数据提取与质量评价: 数据从两个方面进行提取: 研究特征, 包括作者、发表年份、研究人数等; 肿瘤标志物特征, 包括检测方法, 临界值和"2×2"表. 如果纳入文献涉及到肿瘤标志物的联合检测, 我们还提取出联合检测的"2×2"表. 对肿瘤标志物联合检测, 如果任一肿瘤标志物的检测值大于临界值, 则平行联检的结果视为阳性. 在QUADAS-2工具的基础上, 两位研究员分别就研究的偏倚和适用性进行了评价. 偏倚评价包括病例选择、待评价试验、金标准、病例流程及进展情况组成; 而适用性由病例选择、待评价试验、金标准三个部分组成. 所有模块的评价都分为高风险、低风险和不清楚[15]. 两位研究员之间的分歧通过与第三位研究员协商解决.
统计学处理 原始数据直接在文中或按研究人数、灵敏度和特异度计算后获取. Higgins I²检验用于评价异质性: (1)0%-40%: 轻度异质性; (2)30%-60%: 中度异质性; (3)50%-90%: 高度异质性; (4)75%-100%: 显著异质性[16]. 首先使用Meta-disc1.4软件计算阈值效应. 得出的P<0.05表明异质性来源于阈值效应. 否则采用Meta回归和亚组分析来探讨异质性可能来源. 使用Stata 15.1进行数据合并, 使用双变量回归模型来计算合并后的灵敏度(SEN合并)、特异度(SPE合并)、阳性似然比(PLR合并)、阴性似然比(NLR合并)、诊断比值比(DOR合并)、曲线下面积(AUC合并)及相应95%可信区间(CI). 另外我们也计算了CEA、CA 19-9和CA242联合检测用于诊断结直肠癌的上述指标. 通过Deeks漏斗图进行发表偏倚评估[17]. P<0.05表明存在发表偏倚. 采取Z检验定量比较两个观察指标在SEN合并、SPE合并和AUC合并是否有显著性差异 [18].
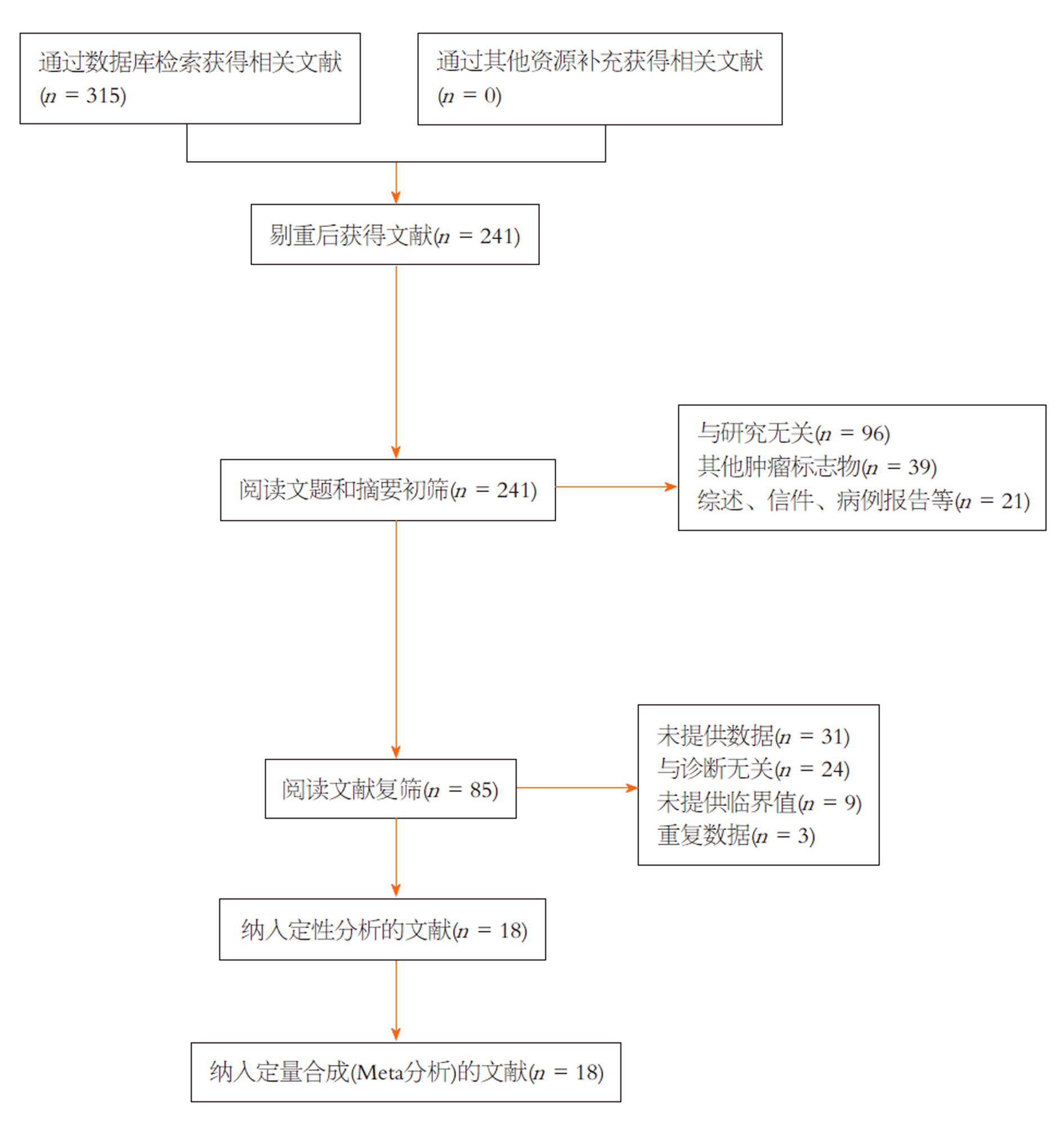
通过相关数据库检索, 初步检索出315篇文章. 剔除74篇重复文章后, 对241篇文章的标题和摘要进行了仔细的浏览, 排除了其余156篇不相关文章. 结合纳入与排除标准, 详细阅读其余85篇文章全文. 最终, 因下述原因剔除67篇文章: 31篇未提供相关数据, 24篇与诊断无关, 9篇未提供临界值, 3篇数据重复. 最终, 本Meta分析纳入了18个研究[13,19-35]. 筛选流程如图1所示.
所有研究的基本特征见表1. 本Meta分析共纳入1931例结直肠癌患者、385例良性疾病患者和1218例健康人. 在18个研究中有7项研究涉及肿瘤标志物联合检测. 肿瘤标志物联合检测特征见表2.
| 纳入研究 | 年份 | CEA | CA19-9 | CA242 | ||||||
| 检测方法 | 临界值(ng/mL) | tp/fp/fn/tn | 检测方法 | 临界值(U/mL) | tp/fp/fn/tn | 检测方法 | 临界值(U/mL) | tp/fp/fn/tn | ||
| 陈文彰等[19] | 2007 | RIA | 15 | 32/1/30/29 | RIA | 37 | 27/0/35/30 | RIA | 25 | 32/0/30/30 |
| 程金玲[20] | 2014 | CLIA | 5 | 29/17/31/66 | CLIA | 37 | 21/15/39/68 | CLIA | 20 | 24/12/36/71 |
| Dong等[21] | 2018 | ECLI | 5 | 76/10/32/46 | ECLI | 37 | 47/4/61/52 | ECLI | 20 | 29/3/79/53 |
| 何乐等[22] | 2016 | Protein chip | 5 | 71/2/79/168 | Protein chip | 35 | 28/4/122/166 | Protein chip | 20 | 36/1/114/169 |
| 胡红永等[23] | 2010 | CLIA | 8 | 41/2/48/48 | CLIA | 35 | 40/3/49/47 | RIA | 25 | 50/1/39/49 |
| 江波等[24] | 2006 | ELISA | 2.4 | 80/7/70/193 | ELISA | 27.4 | 49/15/101/185 | ELISA | 11 | 87/22/63/178 |
| 荆卫娟等[25] | 2015 | CLIA | 5 | 45/23/38/67 | CLIA | 37 | 34/4/49/86 | CLIA | 20 | 33/2/50/88 |
| 龙驰等[26] | 2012 | Protein chip | 5 | 53/6/77/102 | Protein chip | 35 | 36/10/94/98 | Protein chip | 20 | 40/4/90/104 |
| 彭莉等[27] | 2006 | ECLI | 3.4 | 58/2/34/34 | ECLI | 37 | 45/5/47/31 | ECLI | 20 | 54/4/38/32 |
| 王兵济等[28] | 2010 | Protein chip | 5 | 79/5/121/95 | Protein chip | 35 | 46/4/154/96 | Protein chip | 20 | 38/2/162/98 |
| 王科学[29] | 2016 | CLIA | 5 | 67/12/61/174 | CLIA | 37 | 60/15/68/171 | CLIA | 25 | 72/10/56/176 |
| 王堃等[30] | 2017 | CLIA | 7.2 | 46/4/55/100 | CLIA | 27 | 41/4/60/100 | CLIA | 20 | 31/3/70/101 |
| 张辉等[31] | 2017 | ECLI | 5 | 37/9/49/77 | ECLI | 37 | 23/7/63/79 | ECLI | 20 | 21/8/65/78 |
| 章万忠等[32] | 2007 | RIA | 5 | 23/2/7/28 | RIA | 37 | 16/0/14/30 | RIA | 20 | 23/1/7/29 |
| 钟志等[33] | 2014 | Protein chip | 5 | 26/2/34/28 | Protein chip | 35 | 19/3/41/37 | Protein chip | 20 | 17/2/43/38 |
| 仲召阳等[13] | 2007 | Protein chip | 5 | 99/8/140/71 | Protein chip | 35 | 64/5/175/74 | Protein chip | 20 | 61/5/178/74 |
| 朱美芹[34] | 2016 | CLIA | 5.093 | 33/13/28/104 | CLIA | 37 | 28/10/33/107 | CLIA | 15 | 22/10/39/107 |
| 邹超世等[35] | 2018 | CLIA | 5 | 50/1/52/37 | CLIA | 27 | 62/5/40/33 | CLIA | 25 | 73/4/29/34 |
| 纳入研究 | 年份 | CEA+CA19-9(tp/fp/fn/tn) | CEA+CA242(tp/fp/fn/tn) | CA19-9+CA242(tp/fp/fn/tn) | CEA+CA19-9+CA242(tp/fp/fn/tn) |
| 胡红永等[23] | 2010 | 59/3/30/47 | NA | 61/4/28/46 | 76/6/13/44 |
| 江波等[24] | 2006 | 109/27/41/173 | 89/19/61/181 | 88/23/62/173 | 110/27/40/173 |
| 彭莉等[27] | 2006 | 62/5/30/31 | 71/7/21/29 | 64/6/28/30 | 73/7/19/29 |
| 章万忠等[32] | 2007 | NA | NA | NA | 25/4/5/26 |
| 钟志等[33] | 2014 | 34/5/26/35 | 38/4/22/36 | 32/5/28/35 | NA |
| 朱美芹[34] | 2016 | NA | NA | NA | 51/17/10/100 |
| 邹超世等[35] | 2018 | NA | NA | NA | 79/4/23/34 |
结果见表3.
| 纳入研究 | 偏倚评价 | 适用性 | |||||
| 病例选择 | 待评价试验 | 金标准 | 病例流程和进展情况 | 病例选择 | 待评价试验 | 金标准 | |
| 陈文彰等[19] | 高风险 | 不清楚 | 不清楚 | 低风险 | 高风险 | 低风险 | 低风险 |
| 程金玲[20] | 低风险 | 不清楚 | 低风险 | 低风险 | 不清楚 | 低风险 | 低风险 |
| Dong等[21] | 不清楚 | 低风险 | 低风险 | 低风险 | 低风险 | 低风险 | 低风险 |
| 何乐等[22] | 高风险 | 不清楚 | 低风险 | 低风险 | 不清楚 | 低风险 | 低风险 |
| 胡红永等[23] | 高风险 | 低风险 | 低风险 | 低风险 | 高风险 | 低风险 | 低风险 |
| 江波等[24] | 不清楚 | 不清楚 | 低风险 | 低风险 | 不清楚 | 不清楚 | 低风险 |
| 荆卫娟等[25] | 不清楚 | 低风险 | 低风险 | 低风险 | 不清楚 | 低风险 | 低风险 |
| 龙驰等[26] | 不清楚 | 低风险 | 低风险 | 低风险 | 不清楚 | 低风险 | 低风险 |
| 彭莉等[27] | 高风险 | 低风险 | 低风险 | 低风险 | 不清楚 | 低风险 | 低风险 |
| 王兵济等[28] | 低风险 | 低风险 | 低风险 | 低风险 | 低风险 | 低风险 | 低风险 |
| 王科学[29] | 不清楚 | 不清楚 | 低风险 | 低风险 | 低风险 | 低风险 | 低风险 |
| 王堃等[30] | 不清楚 | 不清楚 | 低风险 | 低风险 | 不清楚 | 低风险 | 低风险 |
| 张辉等[31] | 高风险 | 低风险 | 低风险 | 低风险 | 高风险 | 低风险 | 低风险 |
| 章万忠等[32] | 高风险 | 低风险 | 低风险 | 低风险 | 高风险 | 低风险 | 低风险 |
| 钟志等[33] | 不清楚 | 低风险 | 低风险 | 低风险 | 不清楚 | 低风险 | 低风险 |
| 仲召阳等[13] | 低风险 | 低风险 | 低风险 | 不清楚 | 低风险 | 低风险 | 低风险 |
| 朱美芹[34] | 高风险 | 不清楚 | 低风险 | 低风险 | 高风险 | 低风险 | 低风险 |
| 邹超世等[35] | 高风险 | 不清楚 | 低风险 | 高风险 | 不清楚 | 低风险 | 低风险 |
CEA、CA 19-9、CA242和CEA+CA 19-9+CA242的spearman相关系数和P值分别为0.257和0.303、0.116和0.510、0.336和0.173、-0.029和0.957, 提示不存在阈值效应. CEA、CA 19-9、CA242和CEA+CA 19-9+CA242的Higgins I²值分别为95%、93%、97%和0. 因此, 我们使用双变量回归模型来计算观察指标.
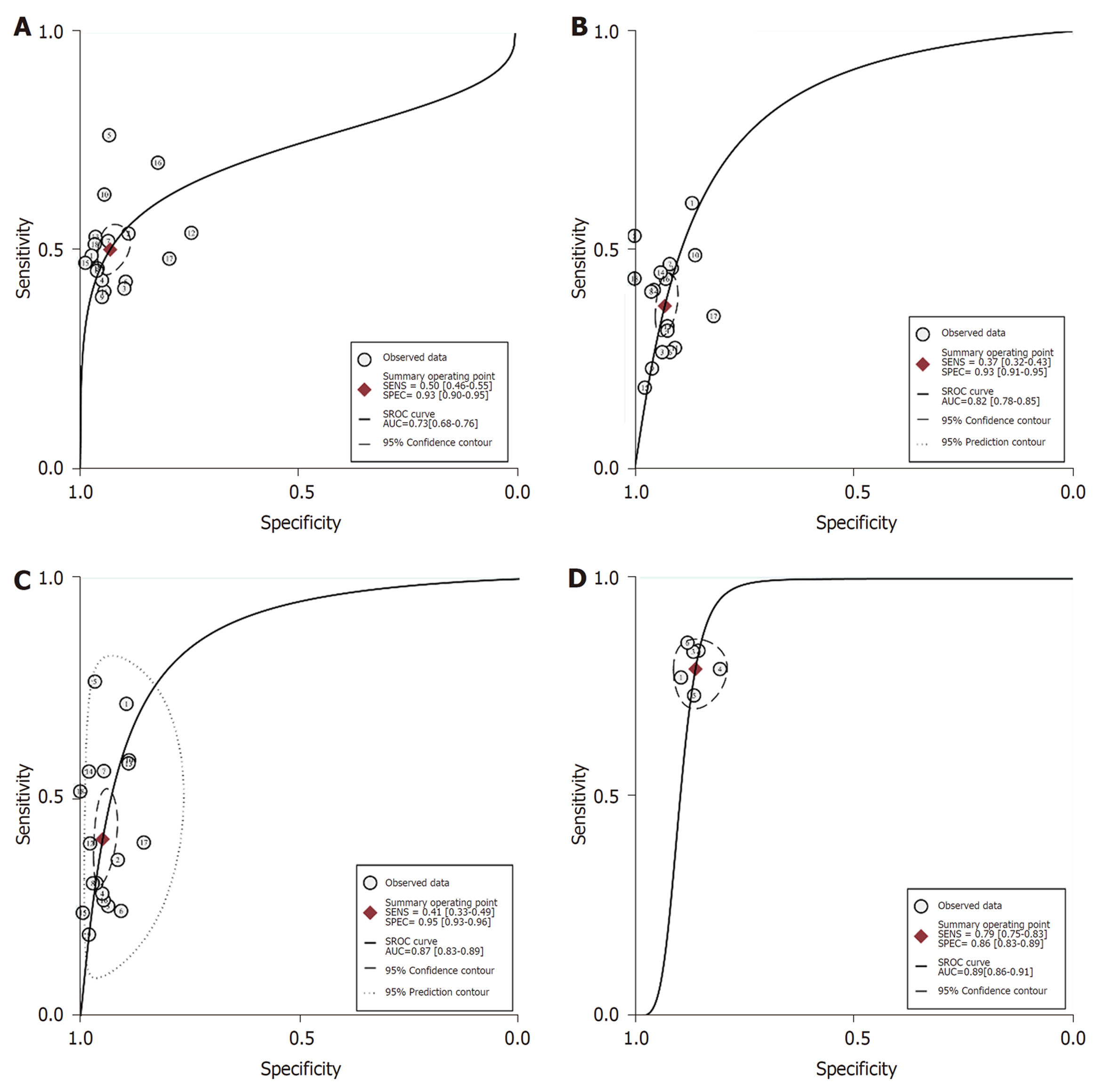
图2是CEA、CA 19-9、CA242和CEA+CA 19-9+CA242的合并灵敏度和特异度的森林图. 图3是CEA、CA 19-9、CA242和CEA+CA 19-9+CA242的SROC曲线.
2.5.1 单个肿瘤标志物分析: CEA、CA 19-9、CA242的SEN合并、SPE合并、PLR合并、NLR合并、DOR合并、AUC合并及相应95%可信区间(CI)是0.50(0.46,0.55), 0.93(0.90,0.95), 7.3(5.1,10.6), 0.53(0.49,0.58), 14(9,21), 0.73(0.68,0.76), 0.37(0.32,0.43), 0.93(0.91,0.95), 5.4(4.2,7.0), 0.67(0.62,0.73), 8(6,11), 0.82(0.78,0.85); 0.41(0.33,0.49), 0.95(0.93,0.96), 8.0(5.6,11.4), 0.62(0.55,0.71), 13(8,20), 0.87(0.83,0.89). 此外, 我们对单个肿瘤标志物的观察指标进行了两两比较. 结果见补充材料表4.
CA 19-9[0.37(0.32,0.43)]的SEN合并低于CEA [0.50 (0.46,0.55)], CEA [0.73 (0.68,0.76)]的AUC合并小于CA 19-9 [0.82 (0.78,0.85)]和CA242 [0.87 (0.83,0.89)].
2.5.2 肿瘤标志物联合检测: CEA+CA 19-9、CEA+CA242、CA 19-9+CA242和CEA+CA 19-9+CA242的观察指标及配对比较结果见补充材料表5. 显然, 在灵敏度方面, 任何两个或三个肿瘤标志物的组合都优于单个肿瘤标志物, 而特异性没有明显下降. 对于AUC合并, 肿瘤标志物联检和除CEA以外的单个肿瘤标志物之间的差异无统计学意义.
对于CEA单独检测, 在所有评估变量中, 研究规模是异质性的可能来源(ap = 0.02). 而对于CA 19-9, 研究规模也是异质性可能来源(bp = 0.03).
临界值是CA242的异质性可能来源(cp = 0.02).
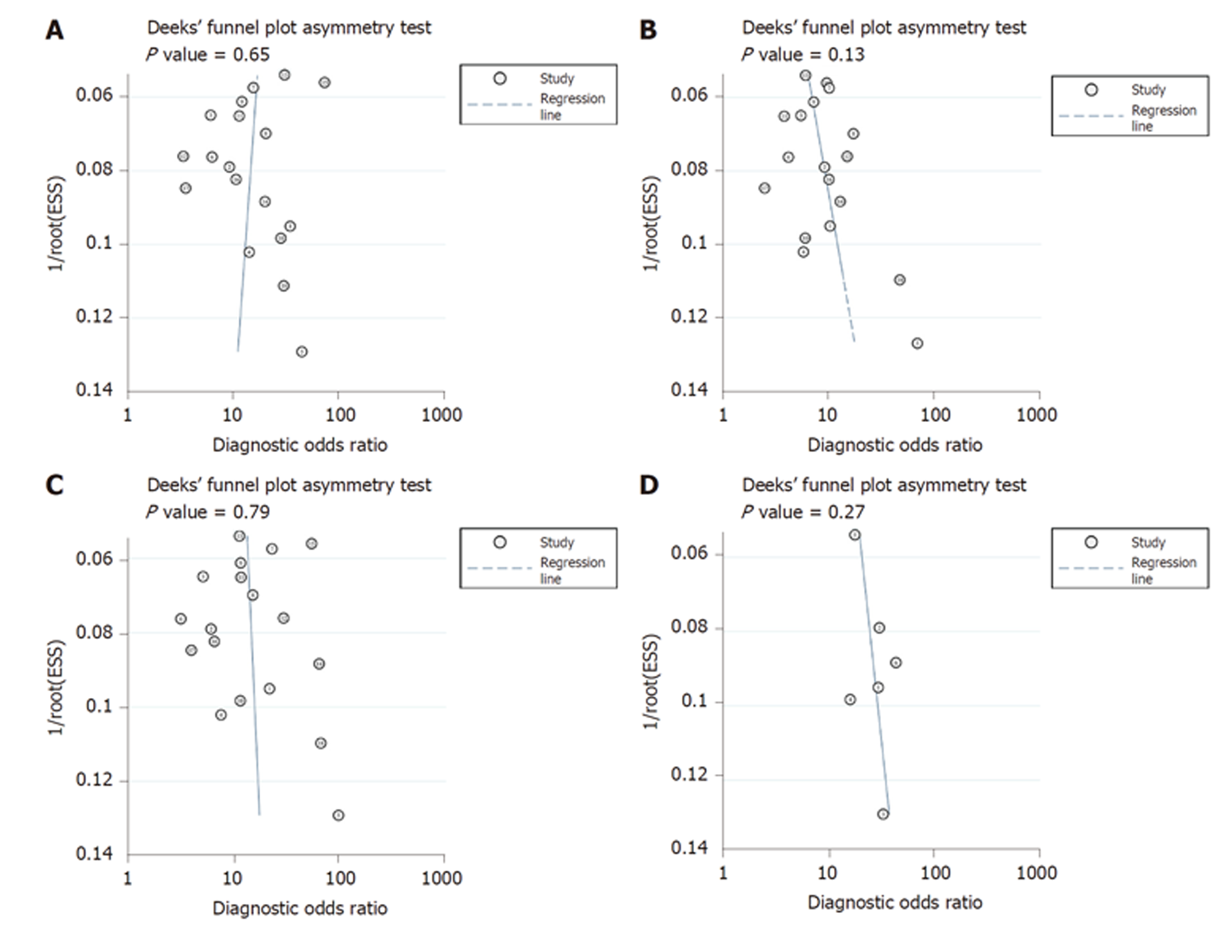
发表偏倚漏斗图如图4所示. CEA、CA 19-9、CA242和CEA+CA 19-9+CA242的P值分别为0.65、0.13、0.79和0.27, 提示不存在发表偏倚.
肿瘤标志物在结直肠癌早期诊断、术后监测、远期预后中具有相当重要的地位. 临床上常见的用于结直肠癌诊断的肿瘤标志物有CEA、CA 19-9、CA242等. CEA作为最常用的结直肠癌肿瘤标志物, 在早期结直肠癌诊断中灵敏度往往偏低. CA 19-9在胰腺癌、胆囊癌的诊断中作为首选肿瘤标志物, 也用于结直肠癌的诊断, 但阳性率较低. CA242增高常见于胰腺癌、直肠癌, 也有研究报道其在结直肠癌诊断中检出率高于CEA[23,24]. 但是由于肿瘤标志物广泛的分泌部位, 单个肿瘤标志物检测往往达不到早期诊断要求. 因此, 本文对结直肠癌相关肿瘤标志物联合检测做一Meta分析.
我们的研究结论之一是更多肿瘤标志物的加入有助于提升结直肠癌的检出率. 与相关研究 [23,24,27,33]结论相符, CEA、CA 19-9、CA 242中任意两者的组合均可以有效提升检出率. 此外, 我们的研究表明, 肿瘤标志物两两组合之间检出率并无明显差别. 与这一结论相反, 江波[24]与彭莉[27]等人的研究则显示CEA+CA242的组合在检出率方面优于其他两种组合, 甚至与三项联合检测无明显差异. 这可能是由于CEA及CA242在单项联合检测中灵敏度高于CA 19-9所致. 而我们的研究显示三项联合检测的结直肠癌检出率明显高于任意两项联合检测. 这一争议仍需进一步的临床研究来探索, 以寻求结直肠癌诊断中的肿瘤标志物最佳组合.
在诊断效能方面, 之前程朝等人[36]的Meta分析结果显示, CEA、CA 19-9及CA242三项联合检测与CA242单独检测相比明显提升了结直肠癌的诊断效应, 这与之前的一些研究[13,23]结果相符合. 但该研究存在一些不足之处, 首先, 该研究仅仅比较了CA242单独检测与三项肿瘤标志物联检的诊断效能. 其次, 在两者诊断效能的比较中并未使用统计学方法进行评价, 结论的得出有待商榷. 我们的研究优势之处在于采用Z检验比较了三个肿瘤标志物单独及其两两或三者组合的诊断效能和灵敏度. 不同于程朝等人的结果, 我们的结果表明, 相较于单个肿瘤标志物, 更多肿瘤标志物的加入并不能提升对结直肠癌的诊断价值. 同时, 肿瘤标志物的加入也意味着更高的检出率和更高昂的花费. 因此, 如何在检出率、诊断价值和成本之间寻求一个合适的平衡点仍是进一步研究的方向.
当然, 在我们的研究中, 异质性的存在是不容忽视的. 对于CEA和CA 19-9, 研究规模是异质性的可能来源. 亚组分析结果显示, 研究人群大于200的亚组检出率低于小于200的亚组. 在未来的研究中, 可能需要增加纳入人群数量, 以减少来自小样本数据的误差, 这同时也是Meta分析的优势所在. 对CA242, 当临界值不等于20 ng/mL时, 具有较高的检出率和诊断价值. 这表明需要更多的研究来确定更准确的临界值.
本Meta分析也有一些局限性. 首先, 纳入研究以病例对照研究为主. 正如表3所示, 一些研究在病例选择有较高的偏倚风险. 此外, 回顾性研究往往存在来自于研究者的选择偏倚, 这是异质性的可能来源之一. 其次, 许多纳入的研究没有提供肿瘤标志物联合检测的相关数据. 如表2所示, 仅有6项研究给出了CEA+CA 19-9+CA242用于结直肠癌联合检测的数据. 它们的I2值为0, 即可以认为它们是同源的. 以上6项研究的肿瘤标志物联合检测的结论是可信的. 然而, 其他研究的缺失数据可能会影响现有的结论. 第三, 单个肿瘤标志物检测的异质性较高. 虽然通过Meta回归发现了异质性的可能来源, 但相关结论的可靠性仍值得进一步研究. 根据上述异质性来源, 在进一步的研究中可以选择一个同源群体进行研究, 但这可能导致选择偏倚. 最后, 在我们的研究中, 大多数人都是亚洲人. 由于发病率和死亡率存在地区差异, 现有结论仍需通过对其他人种的研究加以验证[37].
综上所述, 我们的研究采取Meta分析方法对CEA、CA 19-9和CA242在结直肠癌诊断中的临床应用进行了探讨, 并得出以下结论: 与单一肿瘤标志物检测相比, 更多肿瘤标志物的加入能够有效提升结直肠癌的检出率, 但未必能提升结直肠癌诊断价值.
目前临床上缺乏有效的早期结直肠癌无创筛查手段, 而肿瘤标志物异常在早期结直肠癌的检出中具有一定警示作用. 受限于肿瘤标志物分泌部位的广泛性, 单一肿瘤标志物检测目前难以满足结直肠癌早期诊断的要求, 因此肿瘤标志物联合检测是结直肠癌早期检出的重要手段.
临床上采用的结直肠癌肿瘤标志物不尽相同, 用于结直肠癌诊断时的灵敏度与诊断价值亦有所出入, 本研究旨在通过Meta分析方法得出经济有效的肿瘤标志物组合.
本文选取了临床上最常用于结直肠癌诊断的肿瘤标志物癌胚抗原(carcinoembryonic antigen, CEA)、CA 19-9和CA242, 对于上述肿瘤标志物在结直肠癌诊断中单独及联合检测的灵敏度与诊断价值做一Meta分析, 以期得出更加经济有效的肿瘤标志物组合.
根据纳入及排除标准最终纳入18项诊断性实验研究, 采用双变量回归模型对上述研究计算得出合并后的灵敏度, 特异度及曲线下面积. 采取Z检验比较上述指标在肿瘤标志物单独及联合检测中有无显著差异.
通过Meta分析方法得出: (1)与单一肿瘤标志物检测相比, 更多肿瘤标志物的加入能够有效提升结直肠癌的检出率; (2)与除CEA以外的其余两项肿瘤标志物单独检测相比, 肿瘤标志物联合检测并未有效提升结直肠癌诊断价值.
与单一肿瘤标志物检测相比, 更多的肿瘤标志物的加入能够有效提升结直肠癌的检出率, 但未必能有效提升结直肠癌诊断价值.
本文纳入的研究人群以亚洲人为主, 未来尚需通过多中心、大样本的研究来加以验证.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D, D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Zhang A, Sun H, Yan G, Wang P, Han Y, Wang X. Metabolomics in diagnosis and biomarker discovery of colorectal cancer. Cancer Lett. 2014;345:17-20. [PubMed] [DOI] |
| 2. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 3. | Brenner H, Hoffmeister M, Stegmaier C, Brenner G, Altenhofen L, Haug U. Risk of progression of advanced adenomas to colorectal cancer by age and sex: estimates based on 840,149 screening colonoscopies. Gut. 2007;56:1585-1589. [PubMed] [DOI] |
| 4. | Siegel RL, Miller KD, Fedewa SA, Ahnen DJ, Meester RGS, Barzi A, Jemal A. Colorectal cancer statistics, 2017. CA Cancer J Clin. 2017;67:177-193. [PubMed] [DOI] |
| 5. | Jung G, Hernández-Illán E, Moreira L, Balaguer F, Goel A. Epigenetics of colorectal cancer: biomarker and therapeutic potential. Nat Rev Gastroenterol Hepatol. 2020;17:111-130. [PubMed] [DOI] |
| 6. | Okugawa Y, Grady WM, Goel A. Epigenetic Alterations in Colorectal Cancer: Emerging Biomarkers. Gastroenterology. 2015;149:1204-1225.e12. [PubMed] [DOI] |
| 7. | Biomarkers Definitions Working Group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther. 2001;69:89-95. [PubMed] [DOI] |
| 8. | Wu L, Qu X. Cancer biomarker detection: recent achievements and challenges. Chem Soc Rev. 2015;44:2963-2997. [PubMed] [DOI] |
| 9. | Li Q, Dai W, Li Y, Xu Y, Li X, Cai S. Nomograms for predicting the prognostic value of serological tumor biomarkers in colorectal cancer patients after radical resection. Sci Rep. 2017;7:46345. [PubMed] [DOI] |
| 10. | Chen C, Chen LQ, Yang GL, Li Y. The application of C12 biochip in the diagnosis and monitoring of colorectal cancer: systematic evaluation and suggestion for improvement. J Postgrad Med. 2008;54:186-190. [PubMed] [DOI] |
| 11. | Voorzanger-Rousselot N, Garnero P. Biochemical markers in oncology. Part I: molecular basis. Part II: clinical uses. Cancer Treat Rev. 2007;33:230-283. [PubMed] [DOI] |
| 12. | Duffy MJ, van Dalen A, Haglund C, Hansson L, Holinski-Feder E, Klapdor R, Lamerz R, Peltomaki P, Sturgeon C, Topolcan O. Tumour markers in colorectal cancer: European Group on Tumour Markers (EGTM) guidelines for clinical use. Eur J Cancer. 2007;43:1348-1360. [PubMed] [DOI] |
| 13. | 仲 召阳, 王 东, 李 增鹏, 李 梦侠, 戴 楠, 曹 晓静, 王 佳, 关 伟. 多肿瘤标志物蛋白质芯片检测系统对结直肠癌诊断的临床意义. 重庆医学. 2007;23:2406-2408. [DOI] |
| 14. | Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JP, Clarke M, Devereaux PJ, Kleijnen J, Moher D. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. PLoS Med. 2009;6:e1000100. [PubMed] [DOI] |
| 15. | Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, Leeflang MM, Sterne JA, Bossuyt PM; QUADAS-2 Group. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011;155:529-536. [PubMed] [DOI] |
| 16. | Ohlsson A, Aher SM. Early erythropoiesis-stimulating agents in preterm or low birth weight infants. Cochrane Database Syst Rev. 2017;11:CD004863. [PubMed] [DOI] |
| 17. | Deeks JJ, Macaskill P, Irwig L. The performance of tests of publication bias and other sample size effects in systematic reviews of diagnostic test accuracy was assessed. J Clin Epidemiol. 2005;58:882-893. [PubMed] [DOI] |
| 18. | Ruan L, Chen GY, Liu Z, Zhao Y, Xu GY, Li SF, Li CN, Chen LS, Tao Z. The combination of procalcitonin and C-reactive protein or presepsin alone improves the accuracy of diagnosis of neonatal sepsis: a meta-analysis and systematic review. Crit Care. 2018;22:316. [PubMed] [DOI] |
| 21. | Dong D, Zhang L, Jia L, Ji W, Wang Z, Ren L, Niu R, Zhou Y. Identification of Serum Periostin as a Potential Diagnostic and Prognostic Marker for Colorectal Cancer. Clin Lab. 2018;64:973-981. [PubMed] [DOI] |
| 22. | 何 乐, 杨 宇馨, 张 诗珩, 罗 佳, 戴 楠, 李 梦侠, 单 锦露, 王 宏毅, 王 东. 血清APE1自身抗体在结直肠癌诊断中的价值. 第三军医大学学报. 2016;38:1297-1301. [DOI] |
| 23. | 胡 红永, 汤 建林, 李 玉莹, 高 柳燕, 唐 秀萍. 肿瘤标志物CEA、CA19-9、CA242联检在结直肠癌患者诊断中的应用. 国际放射医学核医学杂志. 2010;2:97-99. [DOI] |
| 25. | 荆 卫娟, 任 传路, 丁 磊, 王 海刚, 丁 庆莉. 血清TuM2-PK、TSGF与CEA、CA19-9、CA242联合检测在结肠癌诊断中的临床价值. 标记免疫分析与临床. 2015;22:1121-1124. [DOI] |
| 28. | 王 兵济, 范 彪, 熊 斌. 血清多肿瘤标志物蛋白芯片检测系统在结直肠癌诊断中的价值. 武汉大学学报(医学版). 2010;31:83-86. [DOI] |
| 34. | 朱 美芹. CEA、CA199和CA242联合检测在结直肠肿瘤中的检测意义. 临床医药文献电子杂志. 2016;3:8299-8300. [DOI] |