修回日期: 2021-04-16
接受日期: 2021-05-25
在线出版日期: 2021-07-28
食管癌发病率及死亡率在全世界都极高, 且治疗效果不佳. 由于目前对食管癌发病机制尚未完全清楚, 这不利于食管癌特异性治疗药物的研究. 通过阅读大量文献发现, 热休克转录因子1 (heat shock transcription fact 1, HSF1)与多种恶性肿瘤的发生发展密切相关, 那么HSF1是否也与食管鳞状细胞癌的发生发展密切相关呢?HSF1是否会成为治疗食管鳞状细胞癌的生物靶标呢?在不同中晚期食管鳞状细胞癌患者中, 不同患者对放化疗敏感度不一样, 已有研究证明, 在肝细胞癌中, HSF1会削弱放化疗对肿瘤的毒性作用从而降低疗效, 那么HSF1是否会影响食管鳞状细胞癌对放化疗的敏感性呢?
探究HSF1在食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)中表达情况及其表达程度对ESCC放化疗敏感性的影响.
(1)将92例患者分成4组: ESCC Ⅰ、Ⅱ期手术切除组20例, ESCC Ⅲ、Ⅳ期手术切除组18例, ESCC Ⅲ、Ⅳ期放化疗组44例, 其中ESCC Ⅲ、Ⅳ期放化疗组分为HSF1低表达组16例和高表达组28例食管不典型增生组10例; 对照组: 食管炎症组10例; (2)取各组病理蜡块通过免疫组化及染色技术检测HSF1在各组表达情况; (3)通过ESCC Ⅲ、Ⅳ期患者HSF1低表达组及高表达组的非肿瘤病灶大小、肿瘤直径及癌胚抗原(carcinoembryonic antigen, CEA)值在放化疗前后的变化, 评估患者对放化疗治疗敏感性; (4)分析影响ESCC手术患者3年生存期的相关因素及ESCC患者3年总体生存率.
(1)HSF1在各ESCC组中高表达, 在食管炎症组及食管不典型增生组中低表达, 且各ESCC组与食管炎症组及食管不典型增生组的HSF1表达情况存在差异, P = 0.001, 有统计学意义; HSF1表达与年龄、性别、肿瘤部位、肿瘤大小、分化程度、T分期、N分期、M分期无关, P>0.05, 均无统计学意义; (2)放化疗后, ESCC Ⅲ、Ⅳ期放化疗组中HSF1低表达组与HSF1高表达组相比, 非肿瘤病灶减少更多, 肿瘤直径减小更大, CEA值下降更明显, P<0.005, 均有统计学意义; (3)在ESCC手术切除组中, 3年生存期与年龄(P = 0.019)、HSF1表达程度(P = 0.028)、T分期(P = 0.007)、N分期(P = 0.016)有关, 均有统计学意义, 与性别、肿瘤部位、肿瘤大小、分化程度无关, P>0.05, 均无统计学意义; HSF1低表达组3年总体生存率比HSF1高表达组高, P = 0.016, 有统计学意义; (4)在ESCC Ⅲ、Ⅳ期放化疗组中, HSF1低表达组1年、2年及3年生存率均比HSF1高表达组高, P<0.05, 有统计学意义; HSF1低表达组3年总体生存率比HSF1高表达组高, P = 0.03, 有统计学意义.
(1)HSF1在ESCC中高表达且HSF1表达越高, 患者预后越差, 且HSF1表达与患者临床特征无关; (2)在ESCC Ⅲ、Ⅳ期放化疗组中, HSF1表达越高, 患者对放化疗敏感性越差; (3)在ESCC手术切除组及ESCC Ⅲ、Ⅳ期放化疗组中, HSF1低表达组3年总体生存率比HSF1高表达组高.
核心提要: 热休克转录因子1 (heat shock transcription fact 1, HSF1)可通过控制细胞代谢、调控各种影响细胞周期及生长的信号通路、促进增殖、浸润、迁移及抗细胞凋亡而控制肿瘤的发生发展, 以在许多肿瘤中高表达. HSF1在食管鳞状细胞癌中也高表达. 中晚期食管癌主要以放化疗治疗为主, 但不同患者对放化疗敏感性不同. 放疗主要是促进凋亡, 化疗主要是抑制增殖而抑制肿瘤, 而HSF1可抑制凋亡及促进增殖从而促进肿瘤发生发展, 那么HSF1表达程度是否会影响放化疗敏感度呢?
引文著录: 黄妹, 徐梦婷, 韩明, 王桂良, 陈旋, 文剑波. HSF1在食管鳞状细胞癌中表达及其与放化疗敏感性的关系. 世界华人消化杂志 2021; 29(14): 775-787
Revised: April 16, 2021
Accepted: May 25, 2021
Published online: July 28, 2021
The morbidity and mortality of esophageal cancer are extremely high all over the world, and the treatment effect is not good. As the pathogenesis of esophageal cancer is not yet fully understood, this is not conducive to the study of specific therapeutic drugs for esophageal cancer. Heat shock transcription fact 1 (HSF1) is closely related to the occurrence and development of a variety of malignant tumors. Is HSF1 also closely related to the occurrence and development of esophageal squamous cell carcinoma (ESCC)? Will HSF1 become a biological target for the treatment of ESCC? Different patients with advanced ESCC have different sensitivity to radiotherapy and chemotherapy. Studies have shown that in hepatocellular carcinoma, HSF1 can weaken the toxic effect of radiotherapy and chemotherapy on tumors and reduce the curative effect. Does HSF1 affect the sensitivity of ESCC to radiotherapy and chemotherapy?
To investigate the expression of HSF1 in ESCC and its effect on the sensitivity of ESCC to radiotherapy and chemotherapy.
Ninety-two patients were divided into four groups: 20 stage Ⅰ/Ⅱ ESCC patients undergoing surgical resection, 18 stage Ⅲ/Ⅱ ESCC patients undergoing surgical resection, and 44 stage Ⅲ/Ⅱ ESCC patients undergoing radiotherapy and chemotherapy. Among the 44 stage Ⅲ/Ⅱ ESCC patients undergoing radiotherapy and chemotherapy, 16 had low HSF1 expression and 28 had high expression. Ten cases of esophageal dysplasia. Ten esophagitis tissues were used as a control group. The expression of HSF1 in each group was detected by immunohistochemistry. The changes of non-tumorous lesion size, tumor diameter, and CEA value were compared between the HSF1 low expression group and high expression group before and after radiotherapy and chemotherapy to assess the sensitivity of patients to radiotherapy and chemotherapy. Factors that might affect the 3-year survival of ESCC patients were identified, and the 3-year overall survival rate of ESCC patients was calculated.
HSF1 was highly expressed in each ESCC group, but lowly expressed in esophagitis group and esophageal dysplasia group, and there was a significant difference in the expression of HSF1 between each ESCC group and esophagitis group and esophageal dysplasia group (P = 0.001). HSF1 expression was not significantly associated with age, gender, tumor location , tumor size, degree of differentiation, T stage, N stage, or M stage (P > 0.05). In the HSF1 low expression group, the non-tumor lesion was more significantly relieved, the tumor diameter was more significantly reduced, and the CEA value was more significantly decreased after radiotherapy and chemotherapy compared with those in the HSF1 high expression group (P < 0.05). In the ESCC surgical resection group, the 3-year survival period was significantly related to age (P = 0.019), HSF1 expression (P = 0.028), T stage (P = 0.007), and N stage (P = 0.016), but not related to gender, tumor location, tumor diameter, or degree of differentiation (P > 0.05). In stage Ⅲ/Ⅱ ESCC patients undergoing radiotherapy and chemotherapy, the HSF1 low expression group had a significantly higher 3-year overall survival rate than the HSF1 high expression group (P = 0.016). The 1-, 2-, and 3-year survival rates of the HSF1 low expression group were significantly higher than those of the HSF1 high expression group (P < 0.05). The HSF1 low expression group had a significantly higher 3-year overall survival rate than the HSF1 high expression group (P = 0.03).
HSF1 is highly expressed in ESCC and the higher the HSF1 expression, the worse the prognosis of patients. HSF1 expression is not related to patients' clinical characteristics. In stage Ⅲ/Ⅳ ESCC patients receiving radiotherapy and chemotherapy, the higher the expression of HSF1, the worse the sensitivity of patients to radiotherapy and chemotherapy. In ESCC patients undergoing surgical resection and stage Ⅲ/Ⅳ ESCC patients receiving radiotherapy and chemotherapy, the 3-year overall survival rate is higher in the HSF1 low expression group than in the HSF1 high expression group.
- Citation: Huang M, Xu MT, Wang GL, Han M, Chen X, Wen JB. Relationship of expression of heat shock transcription factor 1 with sensitivity to radiotherapy and chemotherapy in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2021; 29(14): 775-787
- URL: https://www.wjgnet.com/1009-3079/full/v29/i14/775.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i14.775
食管癌是起源于食管鳞状细胞及柱状细胞的恶性肿瘤, 其中我国主要以鳞状细胞癌为主, 占90%以上, 而美国和欧洲主要以腺癌为主, 占70%左右[1]. 食管癌是严重威胁人类健康及生命的疾病, 在全球发生率位居第七, 死亡率位居第六[2]. 由于食管癌早期症状不明显及缺乏早期筛查的方法, 一般诊断食管癌时都已是中晚期[3]. 尽管目前治疗方法较前明显提高, 但由于中晚期食管癌的浸润、转移及高复发率, 其5年生存率低于20%, 预后仍然较差[4]. 但到目前为止食管癌发生的分子机制尚未完全清楚.
热休克转录因子1 (heat shock transcription fact 1, HSF1)是热休克转录因子(HSFs) DNA结合蛋白家族中的一员, 是热应激调节基因的直接转录激活因子, 可通过识别热休克原件的简单启动子结合位点, 编码热休克蛋白, 协助机体应对导致蛋白错误折叠的各种应激, 如休克、中毒、缺氧、辐射等[5]. 在正常组织中HSF1可协助机体度过各种外界应激而存活. 但在癌症组织中, HSF1可促进癌细胞的增值、浸润、转移及抑制凋亡, 从而促进肿瘤的生长[6]. 由于HSF1在肿瘤发生和肿瘤进展中的重要性, 靶向转录因子已被越来越多地接受. 由于缺乏抑制HSF1转录活性的有效和特异性药物, 靶向HSF1仍处于临床前测试阶段.
目前对于中晚期食管鳞状细胞癌出现食管狭窄而丧失手术机会的患者, 局部放疗、化疗及支架姑息治疗是首选[7]. 在临床治疗中发现, 不同的食管鳞状细胞癌患者对放化疗的敏感度不同, 实验研究发现HSF1在不同食管鳞状细胞癌患者中表达也不同. 那么HSF1的表达程度是否会影响食管鳞状细胞癌放化疗敏感度呢?目前国内外对此研究甚少. 本研究目的是要探究: 食管鳞状细胞癌中HSF1表达情况及其对放化疗敏感度是否有影响?这既为研究食管鳞状细胞癌的靶向治疗提供了方向, 又为临床评估食管鳞状细胞癌放化疗疗效及选择治疗方案提供临床参考意义.
1.1.1 标本入选标准: 观察组: 萍乡市人民医院2013-01-01/2018-01-30日食管鳞状细胞癌患者病理蜡块. 食管癌患者符合2018年版食管癌诊断标准, 符合以下要求: (1)病理确诊为食管鳞状细胞癌患者; (2)年龄为18岁-75岁; (3)确诊为食管鳞状细胞癌Ⅰ、Ⅱ期, 行手术治疗、术前未行放化疗治疗而术后行化疗的患者; (4)确诊为食管鳞状细胞癌Ⅲ、Ⅳ期, 行手术治疗、术前未行放化疗治疗而术后行化疗的患者; (5)确诊为食管鳞状细胞癌Ⅲ、Ⅳ期, 接受三维适行放疗及化疗而不手术治疗的患者; (6)病理确诊为食管不典型增生的患者". [纳入患者符合条件(1)和(2)和(3)或(4)或(5)或(6)其中一项]; 对照组: 病理确诊为食管炎症患者.
1.1.2 标本排除标准: (1)病理类型是非食管鳞状细胞癌患者; (2)接受手术治疗, 术前行放化疗治疗或术后未行化疗治疗的食管鳞状细胞癌患者; (3)确诊食管鳞状细胞癌Ⅰ、Ⅱ期而未行手术治疗患者; (4)确诊为食管鳞状细胞癌Ⅲ、Ⅳ期, 接受三维适行放疗及化疗后手术治疗的患者; (5)确诊为食管鳞状细胞癌Ⅲ、Ⅳ期, 接受非三维适行放疗患者; (6)有影响患者寿命的基础疾病, 如心衰、肺心病、肾衰、肝硬化、脑梗死等; (7)不是因为食管癌死亡的食管鳞状细胞癌患者.
1.2.1 免疫组织化学检测[8]: 操作步骤: (1)抗原/切片的准备: 切片厚度3 um, 60-65 ℃烤片4 h, 备用; (2)切片脱蜡, 水化: 依次为二甲苯Ⅰ→二甲苯Ⅱ→无水乙醇Ⅰ→无水乙醇Ⅱ→95%乙醇→90%乙醇→85%乙醇→75%乙醇各10 min; (3)1×PBS缓冲液(pH7.2)洗涤切片3×5 min; (4)石蜡切片组织抗原修复, 高压修复方式, 在高压锅喷气后开始记时, 时间2 min; (5)每张切片加1滴(50 μL)过氧化物酶阻断溶液, 以阻断内源性过氧化物酶的活性, 室温下孵育10 min; (6)PBS冲洗3×3 min; (7)甩去PBS液, 每张切片加1滴(50 μL)的非免疫性动物血清, 室温下孵育10 min; (8)甩去血清, 每张切片加1滴第一抗体(sp9000, 羊抗鼠/兔, 兔抗稀释1:250, ab52757, Abcam), 4 ℃过夜; (9)PBS冲洗3×5 min; (10)甩去PBS液, 每张切片加1滴或50 μL生物素标记的第二抗体(DAB显色试剂: 试剂B底物H2O2 (20x) 15 mL), 室温下孵育10 min; (11)PBS冲洗3×3 min; (12)甩去PBS液, 每张切片加1滴或50 μL链霉菌抗生物素-过氧化物酶溶液(DAB显色试剂: 试剂底物C: DAB显色剂(20x) 15 mL), 室温下孵育10 min; (13)PBS冲洗3×3 min; (14)甩去PBS液, 每张切片加1-2滴新鲜配制的DAB, 显微镜下观察3-10 min, 阳性显色为棕色或黄色; (15)自来水冲洗, 苏木素复染, 自来水冲洗10-15 min; (16)切片经过梯度酒精脱水干燥, 中性树胶封固; (17)每张片子在200倍镜下和400倍镜下各采一张图; (18)染色结果: 细胞浆呈现黄色或棕色部位是阳性结果. (DAB显色试剂资料: 产品编号Cat.No: DAB-0031/1031, 适用范围: 本试剂盒适用于辣根过氧化酶(HRP)系统的免疫组化染色如PAP、ABC和SP等. 产品形式: 液体. 含A: 缓冲液(20x) 15 mL; B: 底物H2O2 (20x) 15 mL; C: DAB显色剂(20x) 15 mL.
1.2.2 HSF1表达程度判读方法: (1)HSF1定性分析: 以染色阳性细胞率及强度判断HSF1表达程度[9]. 两名对临床病理学信息不了解的独立观察员通过评估: a: 阳性染色细胞的比例(0分, <5%; 1分, 6%-25%; 2分, 26%-50%; 3分, 51%-75%; 4分, >75%). b: 染色强度(0分, 阴性染色; 1分, 仅细胞质染色; 2分, 低核染色; 3分, 强核染色). 分数是a×b的乘积. HSF1高表达组: 肿瘤细胞中a×b≥7分; HSF1低表达组: 肿瘤细胞中a×b<7分. (2)HSF1半定量分析: 平均光密度值及平均灰度值[10]. 通过软件(motic 1.0)对图片的总区域亮度进行数据分析, 测得每张图片平均光密度值及平均灰度值. 光密度是染色图片中所有黄色像素点的强度值全部累加起来得到的值, 用得到的光密度值除以图片面积则是平均光密度值; 灰度是用来表示数字图像中像素颜色深浅的程度. 从最黑到最亮共分为256个灰度级, 最小值为0, 在图像显示屏上为最黑点;最大值为255, 在图像显示屏上为最亮点. 灰度值越小物体颜色越深. 平均灰度值是多次测得同张图片灰度值后求平均值. 光密度与平均灰度都能通过目标颜色的深浅程度而测量物质的含量.
1.2.3 三维适形放射治疗[11]: (1)三维适形放射治疗过程及方法: 患者实施仰卧位真空负压袋固定, 做好体表标记. 口服钡粥, 通过螺旋CT扫描, 层厚为3-5 mm, 对患者的全肺以及肿瘤部位加扫10层. 由2位资深肿瘤临床医师及1名影像学技师共同勾画肿瘤靶区、临床靶区、计划靶区以及危及器官. 肿瘤靶区总剂量为63 Gy, 2.1 Gy/次, 临床靶区总剂量为54 Gy, 1.8 Gy/次5次/周, 通常需要6 wk左右完成; (2)判断标准: 完全缓解、部分缓解、无变化、进展, 有效率 = (完全缓解例数+部分缓解例数)/总例数×100%.
RECIST(2000版)疗效判断标准: 靶病灶评价: (1)完全缓解: 所有靶病灶消失; (2)部分缓解: 靶病灶最长径之和与基线状态病灶比较, 至少较少30%; (3)病变稳定: 介于部分缓解及疾病进展之间; (4)病变进展: 靶病灶最长径之和与治疗开始之后所记录的最小靶病灶最长径之和比较, 增加20%, 或出现一个或多个新病灶. 非靶病灶评价: (1)完全缓解: 所有非靶病灶消失和肿瘤标志物恢复正常; (2)未完全缓解/稳定: 存在一个或多个非靶病灶和/或肿瘤标志物持续高于正常值; (3)病变进展: 出现一个或多个新病灶或已有的非靶病灶明确进展.
1.2.4 随访: 采用电话和门诊途径随访, 随访时间截止2021-01-30, 失访病例15例. 放疗后随访: 所有患者行同步放化疗治疗6 wk. 完成放化疗治疗疗程后第30 d复查CT、消化道钡餐造影、超声、胃镜、肿瘤标志物, 评估食管鳞状细胞癌患者肿瘤直径大小、非靶病灶变化(淋巴结大小及数量变化、转移病灶大小和病灶数量变化)及肿瘤标志物如癌胚抗原(CEA)数值的变化.
统计患者生存时间: 从确诊为食管鳞状细胞癌的日期到死亡或是最后一次随访的时间.
统计学处理 使用SPSS 22进行统计学分析, 数据均数以mean±SD表示; 组间比较: 经方差齐性检验后, 若方差齐, 两组间用t检验, 两组间以上比较用单因素方差分析; 若方差不齐, 则使用非参数检验; 计数资料采用χ2检验及Fisher确切概率法验证两组间的差异; 等级资料采用非参数检验; 使用Kaplan-Meier法统计食管鳞状细胞癌患者总体生存期, 并用Log-rank法检验不同组间生存率的差异; 统计值P<0.05有统计学意义.
2.1.1 各组HSF1的表达情况: 于病理科获取食管炎症组织组、食管不典型增生组、食管鳞状细胞癌Ⅰ、Ⅱ期手术切除组、食管鳞状细胞癌Ⅲ、Ⅳ期手术切除组及食管鳞状细胞癌Ⅲ、Ⅳ期放化疗组的病理蜡块, 通过免疫组化技术, 检测各组HSF1的表达情况.
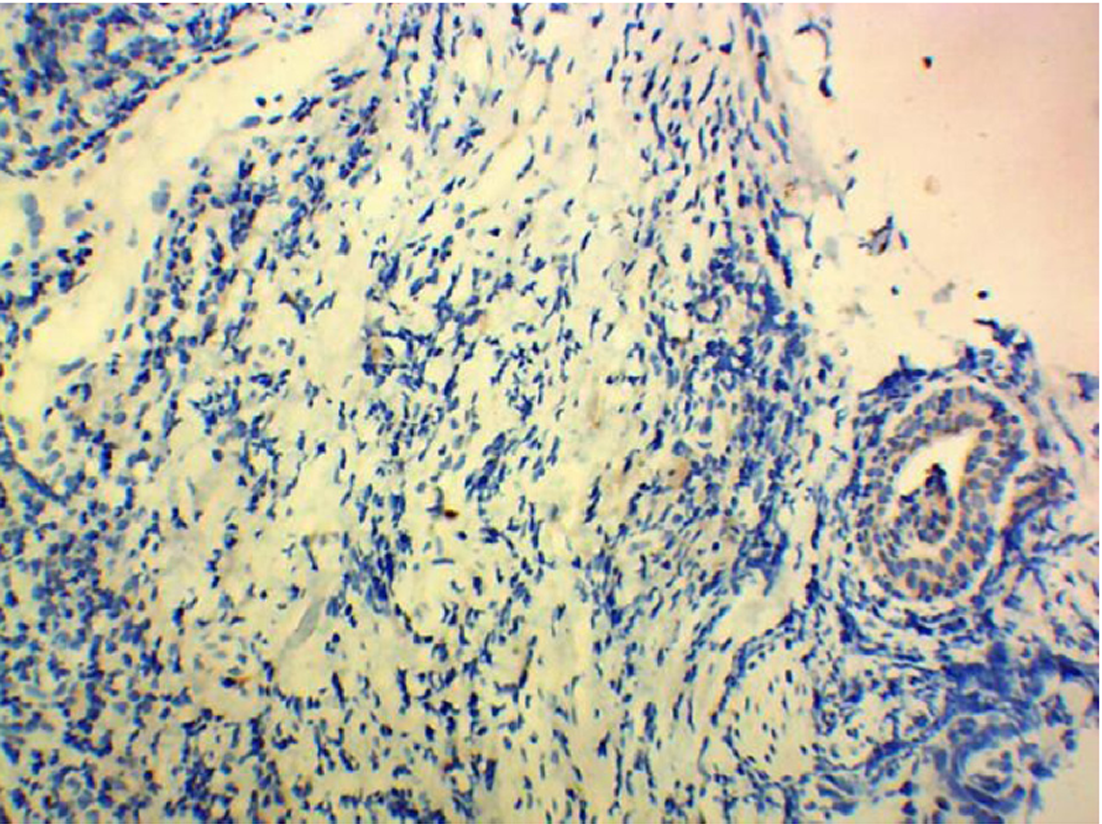
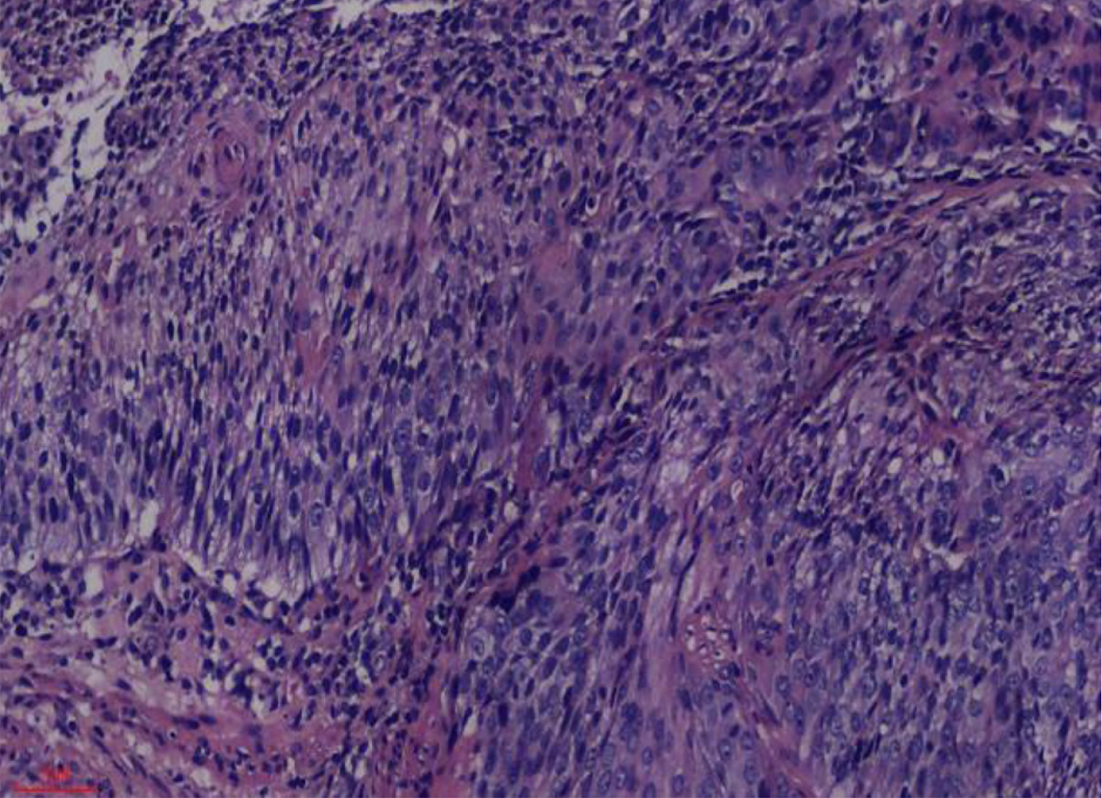
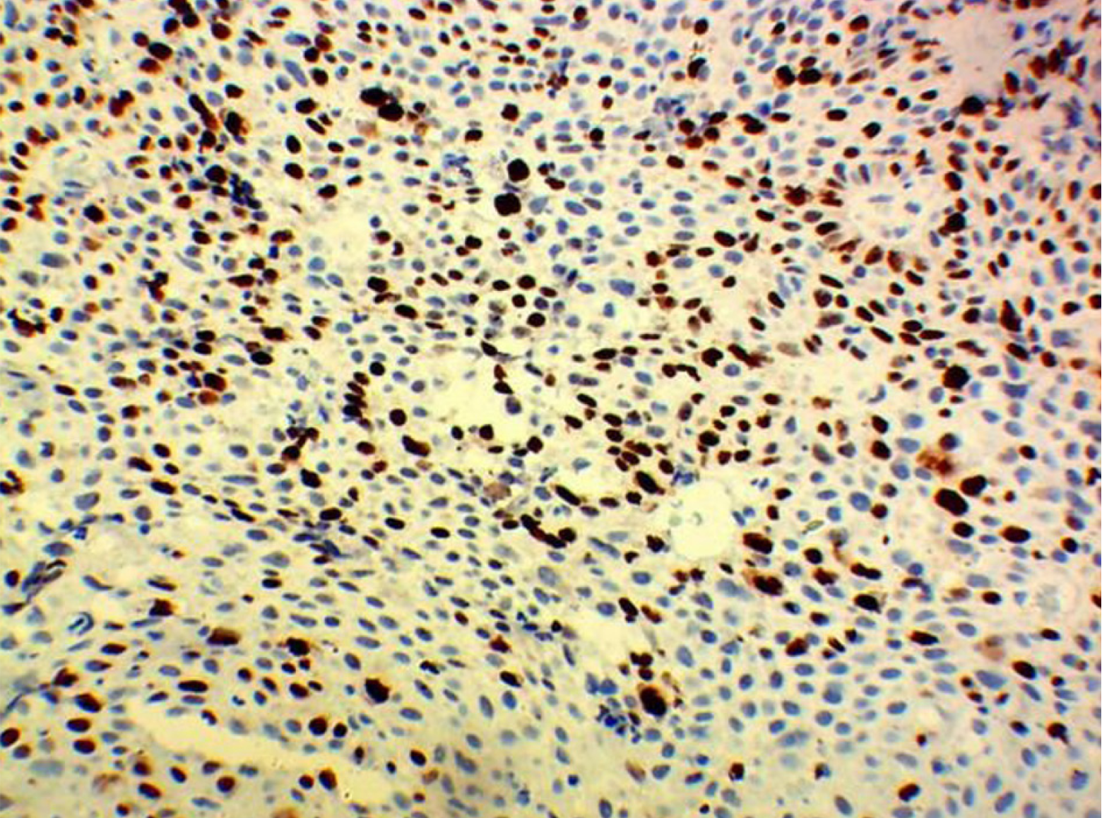
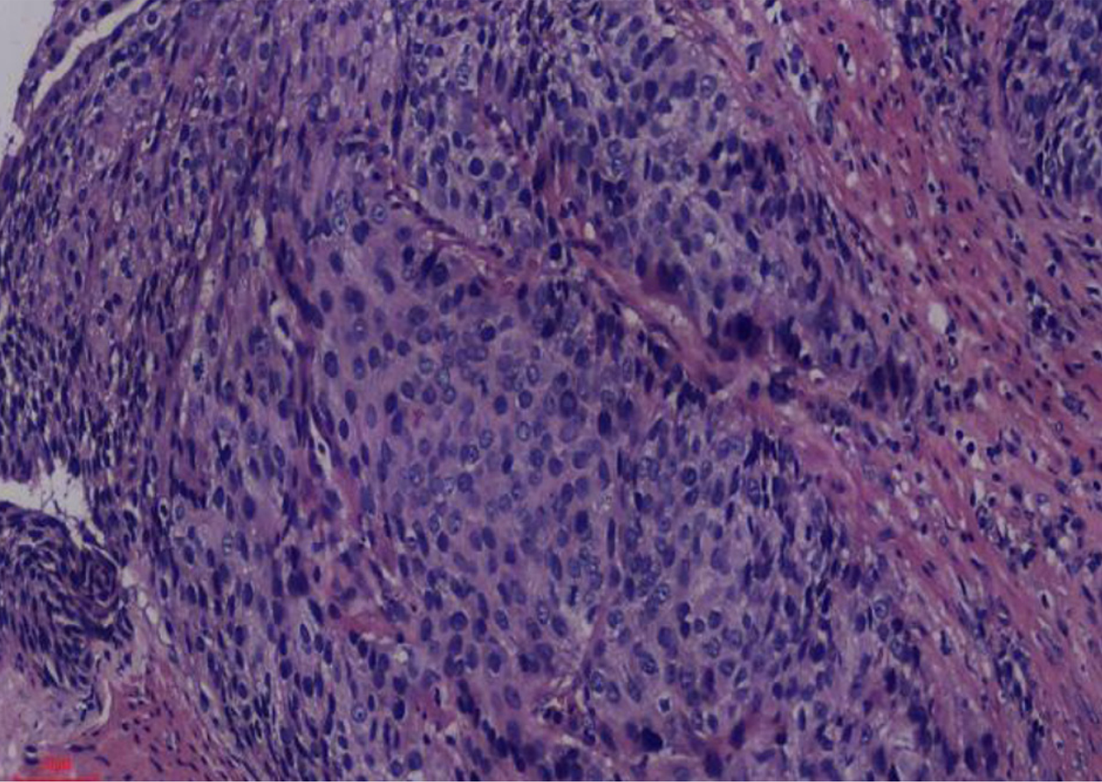
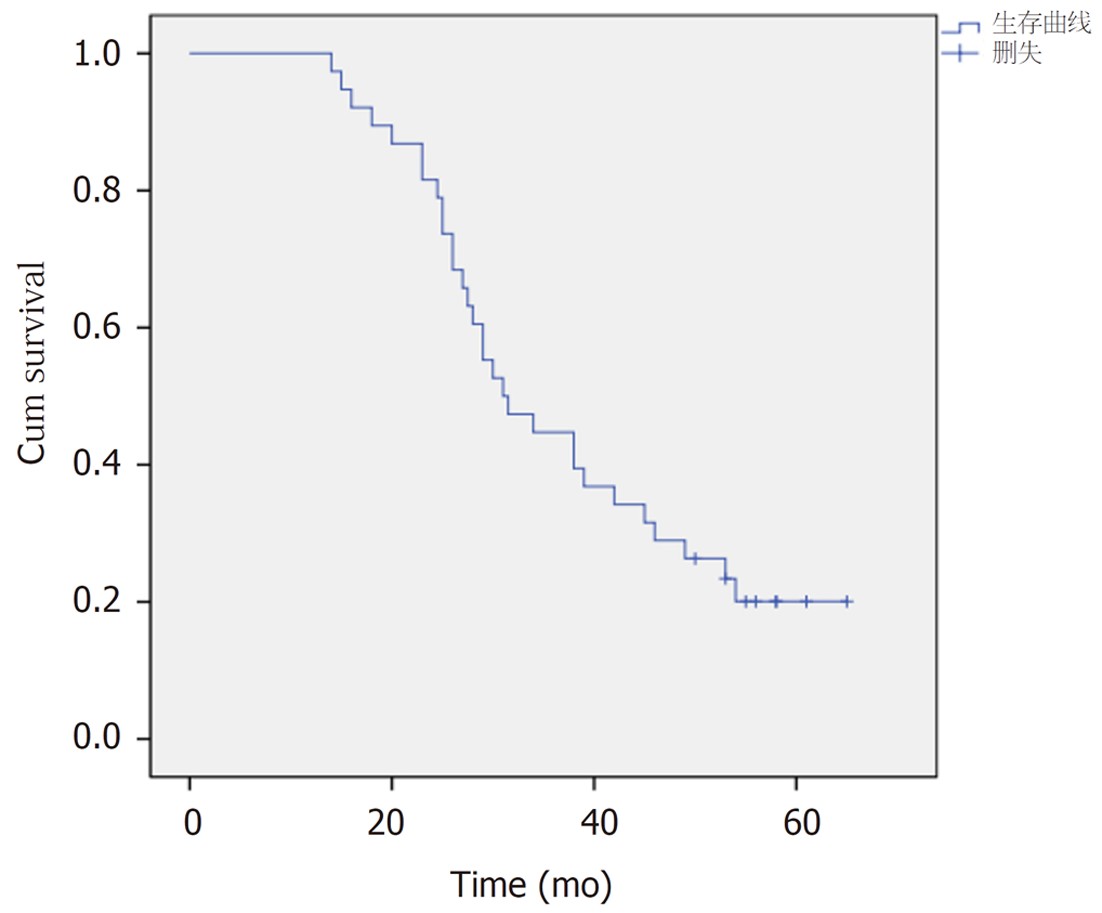
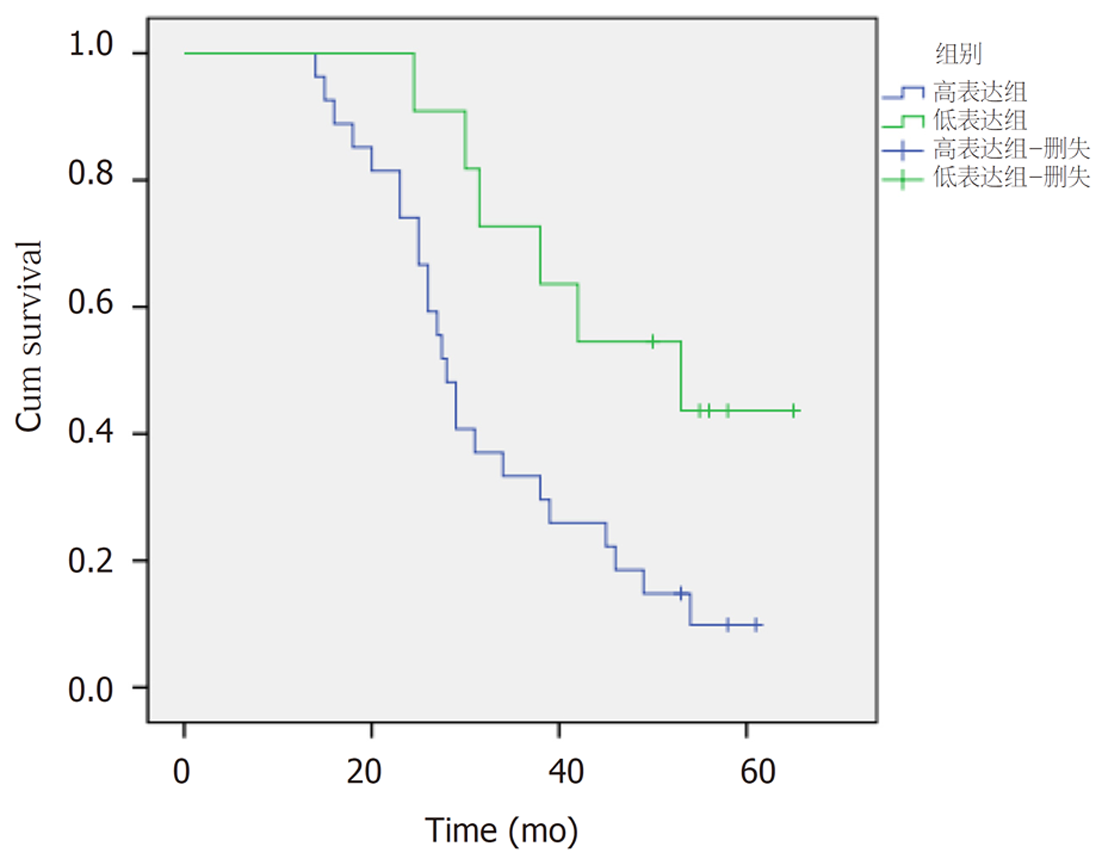
5组间HSF1表达存在差异, χ2 = 19.07, P = 0.001, 有统计学意义, 详见表1; 其中, 食管炎症组HSF1的表达与食管不典型增生组HSF1的表达无差异, P = 1.0, 无统计学意义; 各食管鳞状细胞癌组间HSF1的表达无差异, P>0.05, 均无统计学意义. 食管炎症组及食管不典型增生组HSF1的表达分别与各食管鳞状细胞癌组HSF1的表达有差异, P<0.05, 均有统计学意义. 食管鳞状细胞癌HSF1低表达及病理见图1与图2; 食管鳞状细胞癌HSF1高表达及病理见图3与图4.
| 组别 | n (人数) | HSF1表达 | χ2值 | P值 | |
| 高表达 | 低表达 | ||||
| 食管炎症组织组 | 10 | 1 | 9 | 19.07 | 0.001 |
| 食管不典型增生组 | 10 | 2 | 8 | ||
| 食管鳞状细胞癌Ⅰ、Ⅱ期手术切除组 | 20 | 13 | 7 | ||
| 食管鳞状细胞癌Ⅲ、Ⅳ期手术切除组 | 18 | 14 | 4 | ||
| 食管鳞状细胞癌Ⅲ、Ⅳ期放化疗组 | 44 | 28 | 16 | ||
2.1.2 不同组平均光密度值及平均灰度值: 通过平均光密度值及平均灰度值半定量分析所有组的HSF1表达情况, 得出结果如下: 不同组平均光密度值有差异, F = 13.092, P<0.001, 有统计学意义; 不同组平均灰度值有差异, F = 16.977, P<0.001, 有统计学意义. 在不同组间, 食管炎症组织组与食管不典型增生组平均光密度值及平均灰度值无差异, P>0.05, 均无统计学意义. 各食管鳞状细胞癌组间平均光密度值及平均灰度值无差异, P>0.05, 均无统计学意义; 食管炎症组织组及食管不典型增生组分别与各食管鳞状细胞癌组平均光密度值及平均灰度值有差异, P<0.05, 均有统计学意义. HSF1高表达组平均光密度值及平均灰度值与HSF1低表达组有差异, P<0.001, 均有统计学意义, 具体详见表2
| 组别 | 平均光密度值 | 平均灰度值 | F1值, P1值 | F2值, P2值 |
| 食管炎症组织组 | 0.0910±0.0055 | 206.65±2.65 | ||
| 食管不典型增生组 | 0.1173±0.0100 | 198.41±2.43 | ||
| 食管鳞状细胞癌Ⅰ、Ⅱ期手术切除组 | 0.1528±0.0056 | 180.03±2.43 | 13.092, <0.001 | 16.977, <0.001 |
| 食管鳞状细胞癌Ⅲ、Ⅳ期组 | 0.1553±0.0048 | 179.11±1.91 |
2.1.3 HSF1表达与食管鳞状细胞癌患者临床特征的关系: 在食管鳞状细胞癌患者中, HSF1表达情况与年龄、性别、肿瘤部位、肿瘤大小、分化程、T分期、N分期、M分期无关, 所有P>0.05, 均无统计学意义. HSF1高表达组平均年龄为64.7岁±9.0岁, HSF1低表达组平均年龄为64.5岁±8.7岁; HSF1高表达组平均肿瘤直径大小为5.02 cm±1.53 cm, HSF1低表达组平均肿瘤直径大小为5.27 cm±1.32 cm; 具体详见表3.
| 临床特征 | n (人数) | HSF1表达 | χ2值 | P值 | |
| 高(n) | 低(n) | ||||
| 性别 | |||||
| 男 | 58 | 38 | 20 | 0.217 | 0.641 |
| 女 | 24 | 17 | 7 | ||
| 年龄 | |||||
| ≤60岁 | 26 | 17 | 9 | 0.004 | 0.951 |
| >60岁 | 56 | 37 | 19 | ||
| 部位 | |||||
| 近端 | 17 | 10 | 7 | 0.324 | 0.85 |
| 中间 | 33 | 22 | 11 | ||
| 远端 | 32 | 21 | 11 | ||
| 肿瘤直径大小 | |||||
| ≤5cm | 49 | 35 | 14 | 0.553 | 0.457 |
| >5cm | 33 | 21 | 12 | ||
| 分化程度 | |||||
| 高 | 18 | 11 | 7 | 0.646 | 0.886 |
| 中 | 38 | 26 | 12 | ||
| 低 | 15 | 11 | 4 | ||
| 未 | 11 | 7 | 4 | ||
| T分期 | |||||
| 1 | 1 | 1 | 0 | 6.098 | 0.107 |
| 2 | 22 | 14 | 8 | ||
| 3 | 37 | 21 | 16 | ||
| 4 | 22 | 19 | 3 | ||
| N分期 | |||||
| 0 | 38 | 29 | 9 | 2.739 | 0.098 |
| 1、2、3 | 44 | 26 | 18 | ||
| M分期 | |||||
| 0 | 77 | 51 | 26 | Fisher's值 | 1 |
| 1 | 5 | 1 | 4 | ||
2.2.1 放化疗前后肿瘤直径及肿瘤标志物CEA数值变化: 统计食管鳞状细胞癌Ⅲ、Ⅳ期放化疗组中HSF1低表达组及HSF1高表达组放化疗前后肿瘤直径及肿瘤标志物CEA数值变化, 结果显示: (1)放化疗前, HSF1低表达组及HSF1高表达组肿瘤直径无明显差异, t = 0.148, P = 0.883, 无统计学意义. 放化疗后, HSF1低表达组肿瘤直径比HSF1高表达组减小更明显, t = 3.095, P = 0.003, 有统计学意义. HSF1低表达组及HSF1高表达组放化疗前后肿瘤直径大小均存在明显差异, P<0.05, 均有统计学意义; (2)放化疗前, HSF1高表达组CEA值比HSF1低表达组高, t = 3.794, P<0.001, 有统计学意义. 放化疗后, HSF1低表达组CEA值比HSF1高表达组下降更明显, t = 3.787, P<0.001, 有统计学意义. HSF1低表达组放化疗前后CEA数值明显下降, t = 3.324, P = 0.006, 有统计学意义. HSF1高表达组放化疗前后CEA数值不下降, t = 0.808, P = 0.426, 无统计学意义, 具体详见表4.
2.2.2 放化疗后, Ⅲ、Ⅳ期食管鳞状细胞癌患者获益情况: 食管鳞状细胞癌Ⅲ、Ⅳ期放化疗组中分成HSF1低表达组及HSF1高表达组, 统计两组中患者放化疗后非肿瘤病灶(淋巴节大小及数量, 转移灶大小及数量)的变化情况, 以评估患者接受放化疗后获益情况. 患者获益分为缓解(完全缓解及部分缓解)及稳定, 进展则视为不受益. 在放化疗后, HSF1低表达组的患者获益比HSF1高表达组的更明显, χ2 = 6.946, P = 0.031, 有统计学意义, 具体详见表5.
| 组别 | n | 非肿瘤病灶的变化 | χ2值 | P值 | ||
| 缓解 | 稳定 | 进展 | ||||
| HSF1低表达组 | 16 | 11 | 2 | 3 | 6.949 | 0.031 |
| HSF1高表达组 | 28 | 8 | 11 | 9 | ||
2.2.3 HSF1表达程度与食管鳞状细胞癌放化疗的敏感度关系: 统计食管鳞状细胞癌Ⅲ、Ⅳ期放化疗组中HSF1低表达组及HSF1高表达组放化疗敏感度关系, 结果显示: HSF1低表达组比HSF1高表达组对放化疗更敏感, Fisher'值: P = 0.005, 有统计学意义. 具体详见表6.
| 组别 | n | 非肿瘤病灶的变化 | χ2值 | P值 | ||
| 缓解 | 稳定 | 进展 | ||||
| HSF1低表达组 | 16 | 11 | 2 | 3 | 6.949 | 0.031 |
| HSF1高表达组 | 28 | 8 | 11 | 9 | ||
2.3.1 食管鳞状细胞癌手术切除患者3年生存期与各临床特征的关系: 统计食管癌手术切除(即第3组及第4组)患者临床相关特征, 结果显示: 食管癌手术切除患者3年生存期与年龄、HSF1表达程度、N分期及T分期有关, 所有P<0.05,均有统计学意义, 且年龄越大、HSF1表达程度越高、N分期及T分期越高, 患者3年生存期越低. 患者3年生存期与性别、肿瘤部位、肿瘤大小及分化程度无关, 所有P>0.05,均无统计学意义. 具体详见表7.
| 临床特征 | 总人数 | 3年存活情况 | χ2值 | P值 | |
| (N) | 存活(N) | 死亡(N) | |||
| 年龄 | |||||
| ≤60岁 | 15 | 11 | 4 | Fisher's值 | 0.019 |
| >60岁 | 23 | 7 | 16 | ||
| 性别 | |||||
| 男性 | 32 | 13 | 19 | Fisher's值 | 0.682 |
| 女性 | 6 | 3 | 3 | ||
| 肿瘤部位 | |||||
| 近端 | 8 | 2 | 6 | 1.336 | 0.513 |
| 中段 | 16 | 7 | 9 | ||
| 远端 | 14 | 7 | 7 | ||
| 肿瘤大小 | |||||
| ≤5 cm | 26 | 12 | 14 | Fisher's值 | 0.504 |
| >5 cm | 12 | 4 | 8 | ||
| 分化程度 | |||||
| 高分化 | 13 | 7 | 6 | ||
| 中分化 | 16 | 7 | 9 | Fisher's值 | 0.373 |
| 低分化 | 3 | 0 | 3 | ||
| 未分化 | 6 | 2 | 4 | ||
| HSF1表达程度 | |||||
| 高表达 | 27 | 8 | 19 | Fisher's值 | 0.028 |
| 低表达 | 11 | 8 | 3 | ||
| N分期 | |||||
| N0 | 24 | 14 | 10 | Fisher's值 | 0.016 |
| N1、2、3 | 14 | 2 | 12 | ||
| T分期 | |||||
| T1 | 1 | 0 | 1 | ||
| T2 | 22 | 15 | 7 | 12.223 | 0.007 |
| T3 | 5 | 0 | 5 | ||
| T4 | 10 | 2 | 8 | ||
2.3.2 食管鳞状细胞癌手术切除组患者3年总体生存率: 通过kaplan-meier法及Log-rank法检验食管鳞状细胞癌手术切除组患者中HSF1低表达组与HSF1高表达组3年总体生存率的差异. 结果显示: (1)所有食管鳞状细胞癌手术切除组患者3年总体生存率为33.3%, 平均生存时间为38.0 mo±2.7 mo, 95%可信区间[32.6, 43.3], 中位生存时间为31.0 mo±3.9 mo, 95%可信区间[23.5, 38.6]; (2)食管鳞状细胞癌手术切除组患者中HSF1低表达组3年总体生存率比HSF1高表达组3年总体生存率高χ2 = 5.851, P = 0.016,有统计学意义, 具体见图5及图6.
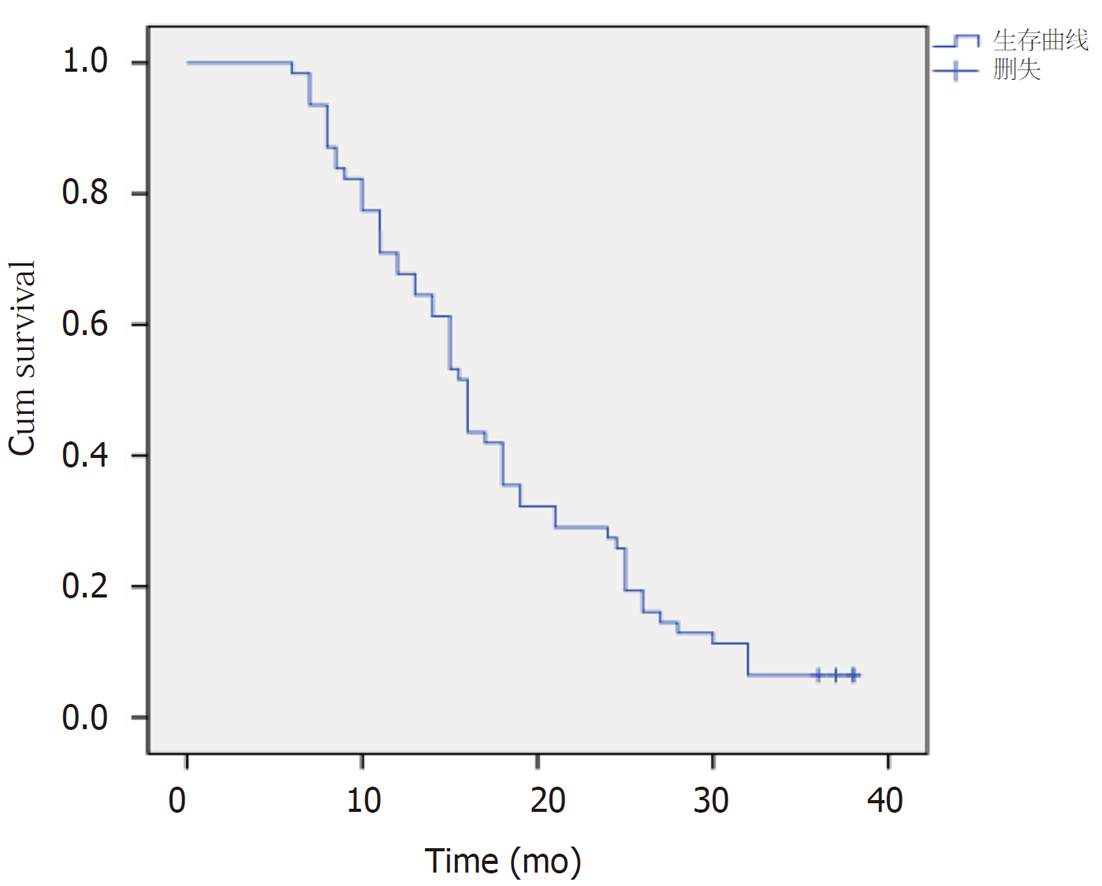
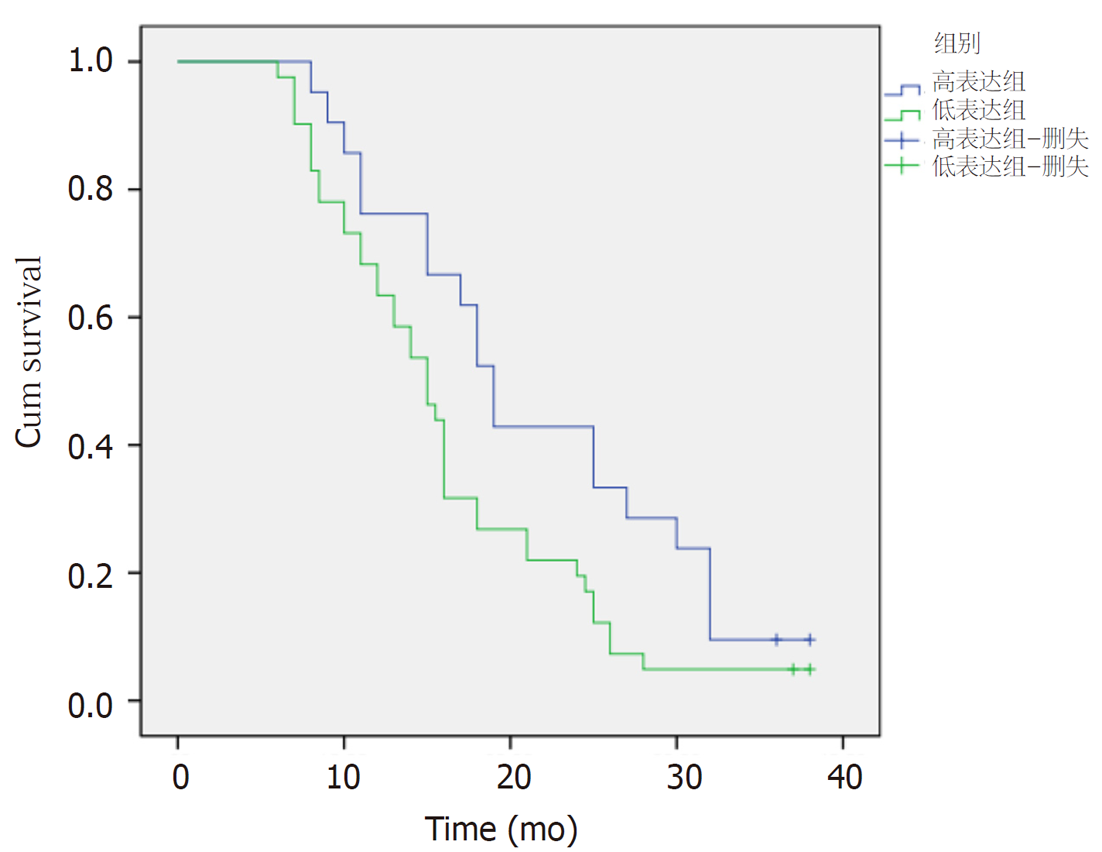
2.3.3 食管鳞状细胞癌Ⅲ、Ⅳ期放化疗患者3年总体生存率: 通过kaplan-meier法对食管鳞状细胞癌Ⅲ、Ⅳ期放化疗患者进行3年总体生存率分析, 结果显示: (1)食管鳞状细胞癌Ⅲ、Ⅳ期放化疗患者1年生存率为67.7%、2年生存率为27.4%、3年生存率为6.5%; 食管鳞状细胞癌Ⅲ、Ⅳ期放化疗患者平均生存时间为17.9 mo±1.1 mo, 95%可信区间[15.7, 20.1]; 食管鳞状细胞癌Ⅲ、Ⅳ期放化疗患者中位生存时间为16.0 mo±0.7 mo, 95%可信区间[14.6, 17.4].
通过kaplan-meier法及Log-rank法检验食管鳞状细胞癌Ⅲ、Ⅳ期放化疗患者中HSF1低表达组与HSF1高表达组之间3年总体生存率的差异. 结果显示: (1)在食管鳞状细胞癌Ⅲ、Ⅳ期放化疗患者中, HSF1低表达组1年、2年及3年的总体生存率比HSF1高表达组高, P<0.05, 有统计学意义, 具体详见表8; (2)食管鳞状细胞癌Ⅲ、Ⅳ期放化疗患者中HSF1低表达组3年总体生存率比HSF1高表达组3年总体生存率高, χ2 = 4.692, P = 0.03,有统计学意义, 具体详见图7、图8.
目前研究发现miRNA (微小RNA)、lncRNA (长非编码RNA)与食管鳞状细胞癌的发生密切相关, 而HSF1却可调控miRNA及lncRNA, 说明HSF1与食管鳞状细胞癌的发生有着某种联系. miRNA由20-24个核苷酸组成, 在许多与癌症相关的生物学过程中起着至关重要的作用, 例如分化, 增殖, 迁移和凋亡[12]. miRNA通常通过与靶mRNA的3'-非翻译区(3'-UTR)中存在的互补区段结合并在通过调节癌基因和抑癌基因参与肿瘤的发生和发展[13]. 目前研究发现miR-671-5p、miR-495、miR-143等miRNA与食管鳞状细胞癌密切相关[14-16]. lncRNA是一组长度超过200个核苷酸的RNA, 很少参与蛋白质编码,但以各种形式调节基因表达, 包括表观遗传调控, 衍生调控和转录后控制[17]. lncRNA还参与了胚胎干细胞多能性、细胞凋亡及细胞周期调控等过程[18]. 多种报道显示, lncRNA与肿瘤的发生及发展密切相关. 根据许多研究表明, HSF1可通过调节miRNAs及lncRNAs, 从而调控肿瘤细胞生长[19]. 这表明HSF1与食管鳞状细胞癌的发生有密切关系.
通过免疫组化技术检测各组食管鳞状细胞癌HSF1的表达情况发现, 各组食管鳞状细胞癌HSF1的表达均比正常组织及食管不典型增生组织中HSF1表达高. 而食管不典型增生为食管鳞状细胞癌的癌前病变, 其HSF1表达程度与正常组织相似, 未呈现有高表达趋势. 说明暂时未有证据能证明HSF1可作为食管鳞状细胞癌早期筛查的指标. 因为中晚期食管癌预后较差, 严重影响患者生活质量, 未来更应关注于发展食管癌早期的筛查技术及指标. 在许多研究中已发现: HSF1在胃癌[9]、肝细胞癌[20]、胰腺癌[21]、乳腺癌[22]、结肠癌[23]、肺小细胞癌[24]、骨肉瘤[25]、食管鳞状细胞癌[26]中呈高表达, 且其表达程度与患者预后不良有密切关系. 在肝细胞癌[20]中, HSF1通过激活BAG3-NF-κB信号通路及MAPK信号通路通过抗凋亡及促进细胞增殖而促进肝细胞癌的生长. 在胰腺癌[21,27]中, AMPK激活的缺失介导了HSF1的异常激活, 从而促进胰腺癌的侵袭和转移. 在乳腺癌[28,22]中, 蛋白激酶B(AKT)直接与HSF1相互作用, 并在Ser326处通过磷酸化激活HSF1. 这种活化的HSF1促进HER2过表达的乳腺癌细胞中上皮-间质转化(EMT). 同时HSF1高表达使得HSP70, HSP90, 抗凋亡Bcl-2蛋白和巨噬细胞迁移抑制因子的水平显着上升, 这些都有助于HER2阳性乳腺癌的发生及发展. 在结肠癌[23]中, HSF1通过调节BAG3-Mcl-1信号通道而抗凋亡以此促进结肠癌发展. 由此可见, HSF1在各种肿瘤中通过调节不同通路而促进肿瘤的发生发展. 目前HSF1在促进肿瘤发展的具体作用通路在不断被发掘与探究, 这将为临床治疗肿瘤提供一种选择. 本研究及其它研究也发现: HSF1在食管鳞状细胞癌中也呈现高表达状态, 但HSF1如何促进食管鳞状细胞癌的发生、发展、浸润、迁移与抗凋亡, 其具体通路仍然不清晰, 如若要研究HSF1作为食管鳞状细胞癌的特异性靶向治疗, 未来需要的更多基础研究进行探索. 由上述可知, HSF1在促进肿瘤的发展中至关重要, 未来它有望成为肿瘤生物治疗的关键靶点.
本研究显示, HSF1在食管鳞状细胞癌组织中高表达, 而HSF1的表示却与患者年龄、性别、肿瘤大小、肿瘤部位、肿瘤分化程度、肿瘤T分期、肿瘤N期、肿瘤M分期无关. 在Tsukao等[26]研究中, 发现在食管鳞状细胞癌中, HSF1也与患者临床特征无关. 但是在Liao等[29]研究中, 发现在食管鳞状细胞癌中, HSF1表达与肿瘤分期, 淋巴结转移和临床分期显着相关. 在Dai等[9]研究中, 发现在胃癌中, HSF1表达与肿瘤大小、晚期Bornmann分类、晚期浸润深度、淋巴结转移、远处转移和肿瘤淋巴结转移密切相关. 在Cui等[24]研究中, 发现在非小细胞肺癌中, HSF1表达与淋巴结转移和临床分期显着相关. 在Santagatas等[22]研究中, 发现在乳腺癌中, HSF1的表达与组织学分级, 肿瘤大小和诊断时淋巴结转移有关. 在Liang等[21]研究中, 发现在胰腺癌中, HSF1的表达与组织学分级、淋巴转移及血管浸润有关. 在Tao等[30]荟萃分析中也的到相同结果. 而本研究中却发现HSF1表达与各临床特征无关, 可能是病例数偏少, 使结果存在偏差, 为能进一步明确HSF1在食管鳞状细胞癌中表达是否与各临床特征有关, 未来还需要收集更大量、多中心的标本进行验证.
研究结果显示: HSF1高表达, 降低了食管鳞状细胞癌对放化疗的敏感度, 削弱了放化疗的疗效. HSF1可通过控制细胞代谢、促进增殖、浸润、迁移及抗细胞凋亡从而控制肿瘤的发生发展. 放射治疗主要是通过辐射破坏DNA, 促进细胞凋亡, 从而达到杀灭肿瘤的目的. 但由于食管鳞状细胞癌中HSF1高表达, 通过各方面增强细胞抗凋亡能力, 增加了细胞对外界恶性环境的耐受性, 从而导致肿瘤细胞在接受放射治疗时, 表现出抵抗辐射的毒副作用, 而继续存活[31]. 化疗是通过化疗药物控制DNA复制、RNA转录及蛋白质合成等生物过程, 抑制细胞增殖, 而遏制肿瘤细胞生长以达到抗肿瘤作用[32]. 同样, HSF1可通过各种信号通路促进细胞增殖, 而降低肿瘤细胞对化疗药物的敏感度. 在Zhang等[33]研究中显示: HSF1和自噬均可降低肝细胞癌细胞对化学治疗剂的敏感性. 而HSF1通过增强表柔比星诱导的保护性自噬, 显著减弱了表柔比星对HCC细胞的杀伤作用. HSF1是通过促进ATG4B基因启动子的转录活性而升高表达, 从而增强保护性自噬,减轻了肝细胞癌细胞对表柔比星的敏感性. 食管鳞状细胞癌中HSF1高表达患者能够降低化疗药物的疗效, 是否食管鳞状细胞癌中也存在HSF1增强保护性自噬的作用机制呢?这值得未来进一步探讨. 本研究证明HSF1可降低食管鳞状细胞癌放化疗的疗效, 这可为临床评估放化疗疗效及选择食管鳞状细胞癌治疗方案提供参考.
(1)HSF1在食管鳞状细胞癌中高表达, HSF1表达越高, 提示患者预后不良; HSF1高表达与患者临床特征无关; (2)在ESCC Ⅲ、Ⅳ期放化疗组中, HSF1表达越高, 患者对放化疗敏感性越差; (3)在ESCC手术切除组及ESCC Ⅲ、Ⅳ期放化疗组患者中, HSF1低表达组3年总体生存率比HSF1高表达组高.
食管癌发病率及死亡率在全世界都极高, 且治疗效果不佳. 由于目前对食管癌发病机制尚未完全清楚, 这不利于食管癌特异性治疗药物的研究. 通过阅读大量文献发现, 热休克转录因子1 (heat shock transcription fact 1, HSF1)与多种恶性肿瘤的发生发展密切相关, 那么HSF1是否也与食管鳞状细胞癌的发生发展密切相关呢?在不同中晚期食管鳞状细胞癌患者中, 不同患者对放化疗敏感度不一样, 已有研究证明, 在肝细胞癌中, HSF1会削弱放化疗对肿瘤的毒性作用从而降低疗效, 那么HSF1是否会影响食管鳞状细胞癌对放化疗的敏感性呢?
本文主要是研究HSF1在食管鳞状细胞癌中表达情况及其是否可成为治疗食管鳞状细胞癌的生物靶标; 研究HSF1表达对食管鳞状细胞癌患者放化疗敏感性的影响. 探究HSF1是否可成为评估食管鳞状细胞癌放化疗敏感性的指标.
本研究目的是验证HSF1在食管鳞状细胞癌中表达情况及HSF1表达与食管鳞状细胞癌患者预后关系; 分析HSF1表达与食管鳞状细胞癌患者对放化疗敏感性的关系及HSF1表达对食管鳞状细胞癌患者3年总体生存率的影响.
本文通过收集各组患者病理蜡块, 通过免疫组化方法检测各组中HSF1表达情况; 分析HSF1与食管鳞状细胞癌患者预后的关系; 分析放化疗组食管鳞状细胞癌患者在放化疗后非肿瘤病灶变化、肿瘤直径变化及CEA值变化的关从而探究HSF1对食管鳞状细胞癌患者放化疗敏感性的影响; 通过采用电话和门诊途径随访, 分析HSF1对患者3年总体生存率的影响; 所有数据使用SPSS 22进行统计学分析; 统计值P<0.05有统计学意义.
本实验结果为: (1)HSF1在各食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)组中高表达, 在食管炎症组及食管不典型增生组中低表达, 且各ESCC组与食管炎症组及食管不典型增生组的HSF1表达情况存在差异, 有统计学意义; (2)放化疗后, ESCC Ⅲ、Ⅳ期放化疗组中HSF1低表达组与HSF1高表达组相比, 非肿瘤病灶减少更多, 肿瘤直径减小更大, CEA值下降更明显, 均有统计学意义; (3)在ESCC手术切除组中, HSF1低表达组3年总体生存率比HSF1高表达组高, 有统计学意义; (4)在ESCC Ⅲ、Ⅳ期放化疗组中, HSF1低表达组1年、2年及3年生存率均比HSF1高表达组高, 有统计学意义; HSF1低表达组3年总体生存率比HSF1高表达组高, 有统计学意义. 这表明HSF1可能成为潜在治疗食管鳞状细胞癌的生物靶标, 也表明HSF1可成为评估食管鳞状细胞癌患者放化疗效果的指标.
本研究结论: (1)HSF1在食管鳞状细胞癌中高表达, HSF1表达越高, 提示患者预后不良; HSF1高表达与患者临床特征无关; (2)在ESCC Ⅲ、Ⅳ期放化疗组中, HSF1表达越高, 患者对放化疗敏感性越差; (3)在ESCC手术切除组及ESCC Ⅲ、Ⅳ期放化疗组患者中, HSF1低表达组3年总体生存率比HSF1高表达组高. 这为临床医生治疗食管鳞状细胞癌提供一定指导作用, 但未来仍需更多实验来进一步验证此实验结论.
众多研究已证明: HSF1在促进肿瘤的发展中至关重要, 未来它有望成为肿瘤生物治疗的关键靶点. 为了验证HSF1可成为治疗食管鳞状细胞癌的生物靶标, 未来还需要收集更大量、多中心的标本进行验证.
学科分类: 胃肠病学和肝病学
手稿来源地: 江西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Malhotra GK, Yanala U, Ravipati A, Follet M, Vijayakumar M, Are C. Global trends in esophageal cancer. J Surg Oncol. 2017;115:564-579. [PubMed] [DOI] |
| 2. | Fan J, Liu Z, Mao X, Tong X, Zhang T, Suo C, Chen X. Global trends in the incidence and mortality of esophageal cancer from 1990 to 2017. Cancer Med. 2020;9:6875-6887. [PubMed] [DOI] |
| 3. | Short MW, Burgers KG, Fry VT. Esophageal Cancer. Am Fam Physician. 2017;95:22-28. [PubMed] |
| 4. | Borggreve AS, Kingma BF, Domrachev SA, Koshkin MA, Ruurda JP, van Hillegersberg R, Takeda FR, Goense L. Surgical treatment of esophageal cancer in the era of multimodality management. Ann N Y Acad Sci. 2018;1434:192-209. [PubMed] [DOI] |
| 5. | Puustinen MC, Sistonen L. Molecular Mechanisms of Heat Shock Factors in Cancer. Cells. 2020;9. [PubMed] [DOI] |
| 6. | Dong B, Jaeger AM, Thiele DJ. Inhibiting Heat Shock Factor 1 in Cancer: A Unique Therapeutic Opportunity. Trends Pharmacol Sci. 2019;40:986-1005. [PubMed] [DOI] |
| 7. | Domper Arnal MJ, Ferrández Arenas Á, Lanas Arbeloa Á. Esophageal cancer: Risk factors, screening and endoscopic treatment in Western and Eastern countries. World J Gastroenterol. 2015;21:7933-7943. [PubMed] [DOI] |
| 8. | Janardhan KS, Jensen H, Clayton NP, Herbert RA. Immunohistochemistry in Investigative and Toxicologic Pathology. Toxicol Pathol. 2018;46:488-510. [PubMed] [DOI] |
| 9. | Dai W, Ye J, Zhang Z,Yang L, Ren H, Wu H, Chen J,Ma J, Zhai E, Cai S, He Y. Increased expression of heat shock factor 1 (HSF1) is associated with poor survival in gastric cancer patients. DIAGN PATHOL. 2018;13:80. |
| 11. | Fan XW, Wu JL, Wang HB, Liang F, Jiang GL, Wu KL. Three-dimensional conformal radiation therapy alone for esophageal squamous cell carcinoma: 10-year survival outcomes. Thorac Cancer. 2019;10:519-525. [PubMed] [DOI] |
| 12. | Tian W, Jiang C, Huang Z, Xu D, Zheng S. Comprehensive analysis of dysregulated lncRNAs, miRNAs and mRNAs with associated ceRNA network in esophageal squamous cell carcinoma. GENE. 2019;696:206-18. |
| 13. | Wei Q, Li X, Yu W, Zhao K, Qin G, Chen H, Gu Y, Ding F, Zhu Z, Fu X, Sun M. microRNA-messenger RNA regulatory network of esophageal squamous cell carcinoma and the identification of miR-1 as a biomarker of patient survival. J Cell Biochem. 2019;120:12259-12272. [PubMed] [DOI] |
| 14. | Li X, Nie C, Tian B, Tan X, Han W, Wang J, Jin Y, Li Y, Guan X, Hong A, Chen X. miR-671-5p Blocks The Progression Of Human Esophageal Squamous Cell Carcinoma By Suppressing FGFR2. Int J Biol Sci. 2019;15:1892-1904. [PubMed] [DOI] |
| 15. | Mao Y, Li L, Liu J, Wang L, Zhou Y. MiR-495 inhibits esophageal squamous cell carcinoma progression by targeting Akt1. Oncotarget. 2016;7:51223-51236. [PubMed] [DOI] |
| 16. | Skjefstad K, Johannessen C, Grindstad T, Kilvaer T, Paulsen EE, Pedersen M, Donnem T, Andersen S, Bremnes R, Richardsen E, Al-Saad S, Busund LT. A gender specific improved survival related to stromal miR-143 and miR-145 expression in non-small cell lung cancer. Sci Rep. 2018;8:8549. [PubMed] [DOI] |
| 17. | Li CY, Zhang WW, Xiang JL, Wang XH, Wang JL, Li J. Integrated analysis highlights multiple long noncoding RNAs and their potential roles in the progression of human esophageal squamous cell carcinoma. Oncol Rep. 2019;42:2583-2599. [PubMed] [DOI] |
| 18. | Yu J, Wu X, Huang K, Zhu M, Zhang X, Zhang Y, Chen S, Xu X, Zhang Q. Bioinformatics identification of lncRNA biomarkers associated with the progression of esophageal squamous cell carcinoma. Mol Med Rep. 2019;19:5309-5320. [PubMed] [DOI] |
| 19. | Yang F, Wen S, Zhang Y, Xu Y, Lv H, Zhu Y, Wang M, Su P, Huang C, Tian Z. Identifying potential metastasis-related long non-coding RNAs, microRNAs, and message RNAs in the esophageal squamous cell carcinoma. J Cell Biochem. 2019;120:13202-13215. [PubMed] [DOI] |
| 20. | Zhang JB, Guo K, Sun HC, Zhu XD, Zhang B, Lin ZH, Zhang BH, Liu YK, Ren ZG, Fan J. Prognostic value of peritumoral heat-shock factor-1 in patients receiving resection of hepatocellular carcinoma. Br J Cancer. 2013;109:1648-1656. [PubMed] [DOI] |
| 21. | Liang W, Liao Y, Zhang J, Huang Q, Luo W, Yu J, Gong J, Zhou Y, Li X, Tang B, He S, Yang J. Heat shock factor 1 inhibits the mitochondrial apoptosis pathway by regulating second mitochondria-derived activator of caspase to promote pancreatic tumorigenesis. J Exp Clin Cancer Res. 2017;36:64. [PubMed] [DOI] |
| 22. | Santagata S, Hu R, Lin NU, Mendillo ML, Collins LC, Hankinson SE, Schnitt SJ, Whitesell L, Tamimi RM, Lindquist S, Ince TA. High levels of nuclear heat-shock factor 1 (HSF1) are associated with poor prognosis in breast cancer. Proc Natl Acad Sci USA. 2011;108:18378-18383. [PubMed] [DOI] |
| 23. | Wang CY, Guo ST, Croft A, Yan XG, Jin L, Zhang XD, Jiang CC. BAG3-dependent expression of Mcl-1 confers resistance of mutant KRAS colon cancer cells to the HSP90 inhibitor AUY922. Mol Carcinog. 2018;57:284-294. [PubMed] [DOI] |
| 24. | Cui J, Tian H, Chen G. Upregulation of Nuclear Heat Shock Factor 1 Contributes to Tumor Angiogenesis and Poor Survival in Patients With Non-Small Cell Lung Cancer. Ann Thorac Surg. 2015;100:465-472. [PubMed] [DOI] |
| 25. | Zhou Z, Li Y, Jia Q, Wang Z, Wang X, Hu J, Xiao J. Heat shock transcription factor 1 promotes the proliferation, migration and invasion of osteosarcoma cells. Cell Prolif. 2017;50. [PubMed] [DOI] |
| 26. | Tsukao Y, Yamasaki M, Miyazaki Y, Makino T, Takahashi T, Kurokawa Y, Miyata H, Nakajima K, Takiguchi S, Mimori K, Mori M, Doki Y. Overexpression of heat-shock factor 1 is associated with a poor prognosis in esophageal squamous cell carcinoma. Oncol Lett. 2017;13:1819-1825. [PubMed] [DOI] |
| 27. | Lin Q, Xiao G, Wang G, He Q, Xu L, Qiu P, Tan S, Gong M, Wen J, Xiao X. Heat Shock Factor 1 in Relation to Tumor Angiogenesis and Disease Progression in Patients With Pancreatic Cancer. Pancreas. 2020;49:1327-1334. [PubMed] [DOI] |
| 28. | Gökmen-Polar Y, Badve S. Upregulation of HSF1 in estrogen receptor positive breast cancer. Oncotarget. 2016;7:84239-84245. [PubMed] [DOI] |
| 29. | Liao Y, Xue Y, Zhang L, Feng X, Liu W, Zhang G. Higher heat shock factor 1 expression in tumor stroma predicts poor prognosis in esophageal squamous cell carcinoma patients. J Transl Med. 2015;13:338. [PubMed] [DOI] |
| 30. | Wan T, Shao J, Hu B, Liu G, Luo P, Zhou Y. Prognostic role of HSF1 overexpression in solid tumors: a pooled analysis of 3,159 patients. Onco Targets Ther. 2018;11:383-393. [PubMed] [DOI] |
| 31. | Sinha S, Varagunam M, Park MH, Maynard ND, Trudgill N, Crosby T, Cromwell DA. Brachytherapy in the Palliation of Oesophageal Cancer: Effective but Impractical? Clin Oncol (R Coll Radiol). 2019;31:e87-e93. [PubMed] [DOI] |
| 32. | Babic B, Fuchs HF, Bruns CJ. [Neoadjuvant chemoradiotherapy or chemotherapy for locally advanced esophageal cancer?]. Chirurg. 2020;91:379-383. [PubMed] [DOI] |
| 33. | Zhang N, Wu Y, Lyu X, Li B, Yan X, Xiong H, Li X, Huang G, Zeng Y, Zhang Y, Lian J, Ni Z, He F. HSF1 upregulates ATG4B expression and enhances epirubicin-induced protective autophagy in hepatocellular carcinoma cells. Cancer Lett. 2017;409:81-90. [PubMed] [DOI] |