修回日期: 2021-04-09
接受日期: 2021-05-25
在线出版日期: 2021-07-08
重症心脏瓣膜病患者的术后康复非常关键, 术后易发生营养吸收不良, 严重的影响患者的生存质量, 早期肠内结合肠外营养支持在改善术后患者的身体恢复中有一定的作用.
探讨早期肠内结合肠外营养支持对重症心脏瓣膜病(heart valvular disease, HVD)患者术后营养参数、炎症免疫及预后情况影响, 以期为促进预后改善提供一定支持.
选取2017-08/2020-10我院重症HVD患者86例进行前瞻性随机对照研究, 以随机抽签法分为肠内结合肠外组(n = 43)、肠外组(n = 43). 两组均采取心脏瓣膜置换术, 术后进入ICU麻醉清醒后3-4 h肠外组给予肠外营养支持, 肠内结合肠外组给予肠外结合肠内营养支持, 均治疗1周. 比较两组治疗前、治疗5 d、1周后营养参数[血红蛋白(Hb)、白蛋白(ALB)、前白蛋白(PA)、三头肌皮褶厚度(TSF)、上臂肌围(AMC)]、炎症反应指标[超敏-C反应蛋白(hs-CRP)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)]、免疫功能(CD4+、CD8+、CD4+/CD8+)水平、急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)、序贯器官功能衰竭评估(SOFA)评分, 并统计预后情况(并发症发生率、ICU住院时间、总住院时间、住院病死情况).
(1)营养参数: 肠内结合肠外组治疗5 d、1周后血清Hb、ALB、PA水平以及治疗1周后TSF、AMC水平均高于肠外组(P<0.05); (2)炎症免疫: 肠内结合肠外组治疗5 d、1周后CD8+、血清hs-CRP、IL-6、TNF-α水平均低于肠外组, CD4+、CD4+/CD8+水平均高于肠外组(P<0.05); (3)预后: 肠内结合肠外组治疗5 d、1周后APACHEⅡ、SOFA评分及呕吐、腹泻、肺部感染发生率低于肠外组, ICU住院时间、总住院时间短于肠外组(P<0.05).
早期肠内结合肠外营养支持有助于调节重症HVD患者炎症免疫反应, 减轻营养不良, 促进预后改善.
核心提要: 早期肠内结合肠外营养支持有助于促进重症心脏瓣膜病(heart valvular disease, HVD)患者的预后改善, 降低炎症免疫反应和营养不良等现象.
引文著录: 贾义安, 黄小英, 朱锦江, 王烁. 早期肠内结合肠外营养支持对重症心脏瓣膜病患者术后营养参数、炎症免疫及预后情况的干预作用. 世界华人消化杂志 2021; 29(13): 707-714
Revised: April 9, 2021
Accepted: May 25, 2021
Published online: July 8, 2021
Postoperative rehabilitation of patients with severe valvular heart disease is very critical. Postoperative malabsorption of nutrients is prone to occur, which seriously affects the quality of life of patients. Early combined enteral and parenteral nutrition support plays an appreciated role in improving the physical recovery of patients after surgery.
To investigate the effect of early combined enteral and parenteral nutrition support on postoperative nutritional parameters, inflammatory immunity, and prognosis in patients with severe heart valvular disease (HVD).
From August 2017 to October 2020, 86 patients with severe HVD at our hospital were selected for a prospective randomized controlled study. They were randomly divided into either a combined enteral and parenteral nutrition group (n = 43) or a parenteral nutrition group (n = 43). Both groups underwent heart valve replacement surgery. The parenteral group was given parenteral nutrition support 3 to 4 h after entering the ICU following anesthesia awaking, and the combination group was given both enteral and parenteral nutrition support. Both groups were treated for 1 wk. The nutritional parameters before treatment, 5 d after treatment, and 1 wk after treatment [hemoglobin (Hb), albumin (ALB), prealbumin (PA), triceps skinfold thickness (TSF), and upper arm muscle circumference (AMC)], inflammatory response indicators [high-sensitivity-C-reactive protein (hs-CRP), interleukin-6 (IL-6), and tumor necrosis factor-α (TNF-α)], immune function (CD4+ T cells, CD8+ T cells, and CD4+ /CD8+ ratio), Acute Physiology and Chronic Health Evaluation II (APACHE II) score, Sequential Organ Failure Assessment (SOFA) score, and prognosis (complication rate, ICU stay in hospital, total hospital stay, and hospital deaths) were compared between the two groups.
The levels of serum Hb, ALB, and PA as well as TSF and AMC at 5 d and 1 wk after treatment were significantly higher in the combination group than in the parenteral nutrition group (P < 0.05). The levels of CD8+ T cells and serum hs-CRP, IL-6, and TNF-α at 5 d and 1 wk after treatment were significantly lower, and the levels of CD4+ T cells and CD4+/CD8+ ratio were significantly higher in the combination group than in the parenteral nutrition group (P < 0.05). APACHE score, SOFA score, and the incidence of vomiting, diarrhea, and lung infections at 5 d and 1 wk after treatment in the combination group were lower than those of the parenteral nutrition group. The length of ICU hospitalization and total hospital stay were significantly shorter in the combination group than in the parenteral nutrition group (P < 0.05).
Early enteral and parenteral nutrition support can help regulate the inflammatory immune response in patients with severe HVD, reduce malnutrition, and improve the prognosis.
- Citation: Jia YA, Huang XY, Zhu JJ, Wang S. Effect of early combined enteral and parenteral nutrition support on postoperative nutritional parameters, inflammatory immunity, and prognosis in patients with severe heart valvular disease. Shijie Huaren Xiaohua Zazhi 2021; 29(13): 707-714
- URL: https://www.wjgnet.com/1009-3079/full/v29/i13/707.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i13.707
心脏瓣膜病(heart valvular disease, HVD)是临床常见心脏性疾病之一, 起病较为隐匿, 若未予以及时有效干预, 易发展为重症HVD, 威胁生命安全[1-3]. 手术是目前治疗重症HVD患者主要手段, 可显著提高患者5年生存率与生存质量, 但术后患者静息耗氧量升高, 可降低糖利用率, 引起蛋白质分解, 提高尿氮排出量, 导致负氮失衡, 增加营养不良发生风险, 从而延长住院时间[4,5]. 因此, 早期予以有效营养支持是促进重症HVD预后改善的重要环节. 肠内营养与肠外营养是临床营养支持主要途径, 然而既往临床主要倾向于比较二者在重症HVD术后中的应用价值[6], 鲜少探讨二者联合对重症HVD患者术后营养状态、预后的影响. 基于此, 本研究尝试分析早期肠内结合肠外营养支持对重症HVD患者术后营养参数、炎症免疫及预后情况影响, 旨在促进患者预后恢复. 详情如下.
以急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分为结局指标, 为计量资料, 样本量计算公式为n = (Zα/2+Zβ)2·σ2/δ2, 经计算, 每组样本量为43. 本研究前瞻性随机选取2017-08/2020-10我院重症HVD患者86例, 以随机抽签法分为肠内结合肠外组(n = 43)、肠外组(n = 43). 两组性别、年龄、体质量指数、疾病类型、术前营养风险筛查2002(NRS-2002)评分、心胸比率、左室舒张末期内径(LVDd)、左室射血分数(LVEF)等基线资料均衡可比(P>0.05). 见表1. 本院伦理委员会经审核评议同意本研究, 研究对象均知情同意.
| 一般资料 | 肠内结合肠外组(n = 43) | 肠外组(n = 43) | t/χ2 | P |
| 男性 | 28(65.12) | 24(55.81) | 0.778 | 0.378 |
| 年龄(岁) | 50.29±5.27 | 49.35±7.18 | 0.692 | 0.491 |
| 体质量指数(kg/m2) | 21.16±1.39 | 20.57±2.04 | 1.567 | 0.121 |
| 疾病类型 | ||||
| 二尖瓣疾病 | 13(30.23) | 15(34.88) | 0.766 | 0.682 |
| 主动脉瓣疾病 | 9(20.93) | 6(13.95) | ||
| 联合瓣膜病变 | 21(48.84) | 22(51.16) | ||
| 术前NRS-2002评分 | 4.36±0.80 | 4.45±0.72 | 0.548 | 0.585 |
| 心胸比率 | 0.81±0.08 | 0.80±0.09 | 0.545 | 0.588 |
| LVDd(mm) | 75.29±2.81 | 74.83±3.36 | 0.689 | 0.493 |
| LVEF(%) | 40.83±4.27 | 41.45±3.49 | 0.737 | 0.463 |
纳入标准: (1)均符合《2014年AHA/ACC 心脏瓣膜病患者管理指南》[7]中HVD诊断标准; (2)美国纽约心脏病学会(NYHA)分级Ⅳ级; (3)心胸比率在0.7以上; (4)超声心电图检查可见LVDd>70 mm, 且双心室或左心室较为肿大.
排除标准: (1)存在心脏瓣膜置换术、肠内及肠外营养支持禁忌证者; (2)合并糖尿病、甲状腺功能亢进等影响营养与代谢疾病者; (3)入院前有输血、补充白蛋白或特殊营养支持者; (4)合并凝血机制紊乱或活动性出血者; (5)术后严重低心排血量, 且血流动力学不稳定者; (6)精神行为异常者.
两组均予以心脏瓣膜置换术, 术后进入ICU麻醉清醒后3-4 h予以营养支持. (1)肠外组予以肠外营养支持, 即根据患者基础能耗、总热量目标30 kcal/(kg∙d), 通过静脉通道缓慢输入脂肪乳氨基酸(17)葡萄糖(11%)注射液; (2)肠内结合肠外组在肠外组基础上应用长110 cm、直径0.46 cm的鼻胃管(购自荷兰纽迪西亚公司)进行早期肠内营养支持, 根据总热量目标30 kcal/(kg∙d)予以能量供应. 使用营养泵24 h内经鼻胃管匀速持续滴入能全力(购自华瑞制药有限公司), 温度控制在37-42 ℃, 第1 d剂量为500 mL/d, 第2 d增至1000 mL, 第3-7 d均为1500 mL; 第1 d滴入速度为20 mL/h, 后根据患者肠道耐受度对滴入速度进行调整, 逐步升高至肠内营养目标30 kcal/(kg∙d). 两组均连续治疗1周, 1周后改为完全经口进食, 每日定时监测血糖, 控制血糖浓度.
(1)比较两组治疗前、治疗5 d、1周后营养参数. 检测方法: 晨起空腹抽取外周静脉血3 mL(采血前禁食12 h), 采用深圳迈瑞生物医疗电子股份有限公司BS-600型全自动生化分析仪测定血红蛋白(Hb)、白蛋白(ALB)、前白蛋白(PA); 指导受检者上臂自然下垂, 取左上臂背侧肩胛骨肩峰至尺骨鹰嘴连线中点上方2 cm处, 将皮肤连同皮下脂肪捏起呈皱褶, 采用皮褶厚度计(压力为10 g/mm²)测量三头肌皮褶厚度(TSF); 上臂肌围(AMC) = 上臂围-3.4×TSF, 上臂围测量时上臂自然下垂, 取上臂中点, 用软尺测量; (2)比较两组治疗前、治疗5 d、1周后炎症反应指标. 检测方法: 晨起空腹抽取外周静脉血3 mL(采血前禁食12 h), 3000 r/min离心12 min(离心半径10 cm), 分离取上清液, 置于-20 ℃低温保存. 采用深圳市生科源技术有限公司免疫比浊法试剂盒测定血清超敏C反应蛋白(hs-CRP)水平; 采用上海继锦化学科技有限公司酶联免疫吸附试验试剂盒测定白细胞介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)水平; (3)比较两组治疗前、治疗5 d、1周后免疫功能指标. 检测方法: 晨起空腹抽取外周静脉血2 mL(采血前禁食12 h), 采用美国BD公司Accuri C6型流式细胞仪流式细胞仪检测CD4+、CD4+/CD8+水平; (4)采用APACHEⅡ[8]、序贯器官功能衰竭评估(sequential organ faliure assessment, SOFA)[9]对两组治疗前、治疗5 d、1周后预后进行评估, 其中APACHEⅡ评分主要由由急性生理学评分(总分值0-60 分)、年龄评分(0-6 分)、慢性健康状况评分(2-5 分), 3部分组成, 最高分71分, 得分与病情程度呈正相关; SOFA评分主要包含呼吸系统、血液系统、肝脏系统、心血管系统、中枢神经系统、肾脏等6项, 总分0-24分, 评分越低, 表示病情越轻, 预后越好; (5)统计两组并发症, 包括呕吐、腹泻、肺部感染、切口感染、败血症、胃潴留、消化道出血; (6)比较两组ICU住院时间、总住院时间、住院病死情况.
统计学处理 采用统计学软件SPSS 22.0处理数据, 计量资料采取Bartlett方差齐性检验与夏皮罗-威尔克正态性检验, 均确认具备方差齐性且近似服从正态布, 以mean±SD描述, 组内比较采用配对t检验, 组间比较采用独立样本t检验; 计数资料用n(%)表示、χ2检验. 均采用双侧检验, α = 0.05.
组内比较, 两组治疗5 d、1周后血清Hb、ALB、PA与TSF、AMC水平均较同组治疗前提高(P<0.05), 组间比较, 两组治疗前Hb、ALB、PA与TSF、AMC水平比较, 差异无统计学意义; 肠内结合肠外组治疗5 d、1周后血清Hb、ALB、PA水平以及治疗1周后TSF、AMC水平均高于肠外组(P<0.05). 见表2.
| 时间 | 组别 | 例数 | Hb(g/L) | ALB(g/L) | PA(mg/L) | TSF(cm) | AMC(cm) |
| 治疗前 | 肠内结合肠外组 | 43 | 101.38±7.53 | 27.97±4.37 | 278.72±8.49 | 12.38±1.73 | 22.59±3.48 |
| 肠外组 | 43 | 102.72±6.85 | 26.81±4.02 | 277.35±7.86 | 12.07±1.53 | 22.06±3.04 | |
| t | 0.863 | 1.281 | 0.777 | 0.880 | 0.752 | ||
| P | 0.391 | 0.204 | 0.440 | 0.381 | 0.454 | ||
| 治疗5 d后 | 肠内结合肠外组 | 43 | 115.29±9.32a | 32.74±5.38a | 297.26±13.85a | 13.85±2.02a | 24.62±2.73a |
| 肠外组 | 43 | 108.06±8.27a | 29.15±4.94a | 286.19±10.93a | 13.09±1.84a | 23.47±3.46a | |
| t | 3.805 | 3.223 | 4.114 | 1.824 | 1.711 | ||
| P | <0.001 | 0.002 | <0.001 | 0.072 | 0.091 | ||
| 治疗1周后 | 肠内结合肠外组 | 43 | 119.48±10.50a | 34.89±6.29a | 304.47±15.23a | 14.39±2.15a | 24.97±2.32a |
| 肠外组 | 43 | 112.06±9.84a | 31.63±5.72a | 292.36±12.48a | 13.48±1.94a | 23.86±2.75a | |
| t | 3.381 | 2.514 | 4.033 | 2.061 | 2.023 | ||
| P | 0.001 | 0.014 | <0.001 | 0.042 | 0.046 |
组内比较, 两组治疗5 d、1周后血清hs-CRP、IL-6、TNF-α水平均较同组治疗前降低(P<0.05), 组间比较, 两组治疗前血清hs-CRP、IL-6、TNF-α水平比较, 差异无统计学意义; 肠内结合肠外组治疗5 d、1周后血清hs-CRP、IL-6、TNF-α水平均低于肠外组(P<0.05). 见表3.
| 时间 | 组别 | 例数 | hs-CRP(mg/L) | IL-6(pg/L) | TNF-α(pg/mL) |
| 治疗前 | 肠内结合肠外组 | 43 | 13.49±2.58 | 167.92±12.86 | 33.56±6.48 |
| 肠外组 | 43 | 12.86±2.07 | 164.31±14.57 | 32.29±7.25 | |
| t | 1.249 | 1.218 | 0.856 | ||
| P | 0.215 | 0.227 | 0.394 | ||
| 治疗5 d后 | 肠内结合肠外组 | 43 | 3.68±0.72a | 119.03±9.79a | 17.83±4.06a |
| 肠外组 | 43 | 5.46±0.94a | 138.75±11.63a | 24.08±5.47a | |
| t | 9.858 | 8.506 | 6.016 | ||
| P | <0.001 | <0.001 | <0.001 | ||
| 治疗1周后 | 肠内结合肠外组 | 43 | 2.29±0.48a | 101.29±7.76a | 14.26±3.37a |
| 肠外组 | 43 | 2.83±0.59a | 116.02±9.14a | 19.87±4.58a | |
| t | 4.656 | 8.056 | 6.470 | ||
| P | <0.001 | <0.001 | <0.001 |
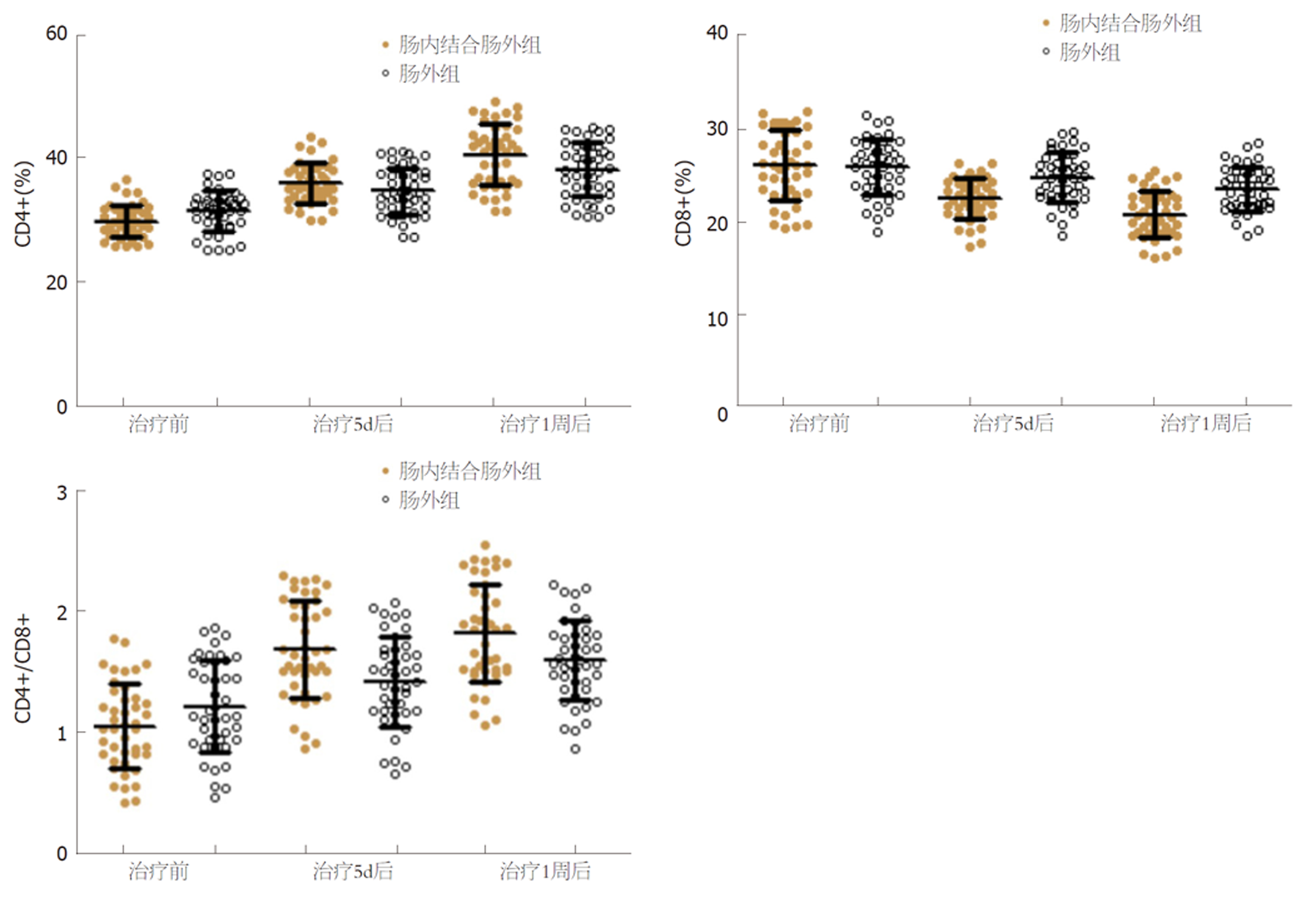
组内比较, 两组治疗5 d、1周后CD4+、CD4+/CD8+水平均较同组治疗前提高, CD8+水平均较同组治疗前降低(P<0.05), 组间比较, 两组治疗前CD4+、CD8+、CD4+/CD8+水平比较, 差异无统计学意义; 肠内结合肠外组治疗5 d、1周后CD4+、CD4+/CD8+水平均高于肠外组, CD8+水平均低于肠外组(P<0.05). 见表4、图1.
| 时间 | 组别 | 例数 | CD4+(%) | CD8+(%) | CD4+/CD8+ |
| 治疗前 | 肠内结合肠外组 | 43 | 30.29±2.74 | 26.41±4.05 | 1.15±0.41 |
| 肠外组 | 43 | 31.07±3.26 | 25.63±3.49 | 1.21±0.38 | |
| t | 1.201 | 0.957 | 0.704 | ||
| P | 0.233 | 0.342 | 0.484 | ||
| 治疗5 d后 | 肠内结合肠外组 | 43 | 37.05±4.59a | 22.52±2.67a | 1.65±0.49a |
| 肠外组 | 43 | 34.96±3.86a | 24.19±3.02a | 1.45±0.43a | |
| t | 2.285 | 2.717 | 2.012 | ||
| P | 0.025 | <0.001 | 0.048 | ||
| 治疗1周后 | 肠内结合肠外组 | 43 | 40.17±6.12a | 20.59±2.42a | 1.95±0.36a |
| 肠外组 | 43 | 37.32±5.08a | 23.04±2.73a | 1.62±0.30a | |
| t | 2.350 | 4.404 | 4.618 | ||
| P | 0.021 | <0.001 | <0.001 |
组内比较, 两组治疗5 d、1周后APACHEⅡ、SOFA评分均较同组治疗前降低(P<0.05), 组间比较, 两组治疗前APACHEⅡ、SOFA评分比较, 差异无统计学意义; 肠内结合肠外组治疗5 d、1周后APACHEⅡ、SOFA评分均低于肠外组(P<0.05). 见表5.
肠内结合肠外组呕吐、腹泻、肺部感染发生率低于肠外组(P<0.05), 两组切口感染、败血症、胃潴留、消化道出血发生率相比, 差异无统计学意义. 见表6.
| 组别 | 例数 | 呕吐 | 腹泻 | 切口感染 | 肺部感染 | 败血症 | 胃潴留 | 消化道出血 |
| 肠内结合肠外组 | 43 | 2(4.65) | 2(4.65) | 1(2.33) | 2(4.65) | 1(2.33) | 3(6.98) | 1(2.33) |
| 肠外组 | 43 | 8(18.60) | 9(20.93) | 5(11.63) | 8(18.60) | 2(4.65) | 5(11.63) | 1(2.33) |
| χ2 | 4.074 | 5.108 | 1.613 | 4.074 | 0.000 | 0.138 | - | |
| P | 0.044 | 0.024 | 0.204 | 0.044 | 1.000 | 0.711 | 1.000 |
由于重症HVD患者术后恢复情况及经口进食时间不一, 机体无法及时摄入有效营养物质, 故需利用其他途径补充[10]. 肠外营养支持作为临床常用营养补充途径, 不受患者食欲与消化功能影响, 能迅速补充蛋白质等机体所需营养物质, 纠正机体负氮失衡, 减轻机体营养不良[11,12], 但对于严重心功能不全者, 其可能引起电解质、糖脂代谢异常, 延缓肠道生理功能恢复进程. 因此, 积极探索一种合理高效营养补充途径是目前临床研究重点.
相关研究表明[13-15], 重症HVD术后患者处于高代谢应激状态, 可促使脂肪分解, 导致营养供应不足, 降低Hb、ALB、PA水平, 继而增加高糖血症与低蛋白血症发生风险. 梁微波等[16]研究显示, 早期肠内营养应用于ICU心脏手术后患者, 有助于改善营养状况, 及时纠正低蛋白血症. 在此基础上, 本研究针对重症HVD患者尝试采用早期肠内结合肠外营养支持, 结果显示, 二者结合有助于减轻重症HVD患者术后营养不良, 考虑这可能是由于早期肠内营养支持更符合机体生理需求, 可有效加快消化液分泌, 改善胃肠道蠕动, 阻断肠黏膜萎缩进程, 恢复正常新陈代谢[17,18], 与肠外营养支持结合, 发挥协同作用, 为机体提供充足且全面的各类营养底物, 利于肝脏蛋白质合成与代谢调节, 促进肠道吸收营养成分, 维持负氮平衡, 从而达到减少热量-蛋白质消耗量增加所致营养不良发生的目的.
《中国成人心脏外科围手术期营养支持治疗专家共识(2019)》指出[19], 因体外循环受损、凝血功能紊乱等, 心脏手术患者术后可释放大量促炎细胞因子, 从而增加全身炎症反应综合征发生危险性, 影响术后恢复进程. 而PCT、IL-6、TNF-α是评估机体炎症程度常用指标. 另外, 学者吴春涛等[20]指出, 心脏手术创伤所致应激反应, 不仅会提高肠壁通透性, 促使肠道上皮绒毛萎缩, 破坏肠黏膜屏障完整性, 还会加重机体代谢分解状态, 诱导免疫系统改变. 本研究对治疗前后炎症免疫指标进行分析, 两组治疗5 d、1周后CD8+、血清PCT、IL-6、TNF-α水平较治疗前下降, CD4+、CD4+/CD8+水平较治疗前升高, 提示早期肠外营养支持及结合肠内营养支持均能改善重症HVD患者炎症免疫反应. 进一步探讨两组治疗后炎症免疫指标可知, 肠内结合肠外组治疗5 d、1周后CD8+、血清PCT、IL-6、TNF-α水平均低于肠外组, CD4+、CD4+/CD8+水平均高于肠外组. 这一结果表明在早期肠外营养支持基础上结合肠内营养支持更能有效降低重症HVD患者炎症反应, 增强免疫功能, 这可能是由于肠内营养支持经鼻胃管匀速滴入能全力, 有助于缓解机体高分解代谢反应, 抑制炎性因子释放, 保护机体肠黏膜屏障功能与免疫防御功能, 增加CD4+淋巴免疫细胞, 减少肠道细菌移位, 继而降低感染发生率.
此外, 有文献指出[21,22], 受体外循环支持、异体瓣膜植入、心功能差、营养不良等因素作用, HVD患者术后肺部感染发生率较高. 同时, 由于重症HVD患者心功能差, 蛋白合成减少, 组织愈合能力较差, 患者术后可能发生切口感染情况. 本研究通过对比发现, 早期肠内结合肠外营养支持在降低重症HVD患者术后呕吐、腹泻、肺部感染发生率、加快康复进程方面优于早期肠外营养支持, 可能与二者结合可为机体细胞代谢提供所需营养与能量, 促进肠胃蠕动, 增强机体免疫功能有关. 但两组住院病死率比较无显著差异, 与梁微波等研究存在一定差异, 可能与样本量较少有关.
综上可知, 早期肠内结合肠外营养支持有助于调节重症HVD患者炎症免疫反应, 减轻营养不良, 促进预后改善. 但本研究样本量较少, 缺少对患者心功能的影响相关研究以及炎症免疫、营养及预后之间的相关性及如何相互影响研究, 今后需扩大样本量进一步深入探讨.
重症心脏瓣膜病患者目前最有效的治疗手段就是手术治疗, 术后恢复也成为患者康复的关键, 术后患者往往食欲不振, 会发生营养不良, 感染等症状, 加重病情, 影响体内其他器官的正常功能.
重症心脏瓣膜患者术后经常会发生消化吸收功能减退, 造成营养不良, 不利于身体的康复. 早期肠内结合肠外营养多用于消化道肿瘤术后的恢复治疗, 并取得了不错的效果.
本研究从解决重症患者术后营养的角度出发, 通过早期肠内结合肠外营养支持对重症心脏瓣膜病患者的治疗, 观察其对患者营养参数、炎症免疫及预后情况影响, 以期为促进预后改善提供一定支持.
本研究通过临床观察和指标检测的方法, 判断早期肠内结合肠外营养支持对术后患者在营养参数、炎症免疫及预后的情况.
5 d、1周后两组血清Hb、ALB、PA、TSF、AMC、hs-CRP、IL-6、TNF-α、CD4+、CD4+/CD8+、APACHEⅡ、SOFA评分水平均较同组治疗前提高, 肠内结合肠外组治疗血清Hb、ALB、PA、TSF、AMC、hs-CRP、IL-6、TNF-α、CD4+、CD4+/CD8+、APACHEⅡ、SOFA评分水平均高于肠外组. 肠内结合肠外组呕吐、腹泻、肺部感染发生率、ICU住院时间、总住院时间低于肠外组.
早期肠内结合肠外营养支持有助于调节重症心脏瓣膜患者炎症免疫反应, 减轻营养不良, 促进预后改善.
本研究为研究重症心脏瓣膜患者术后恢复提供了新的治疗方法, 但是为了使结果更有说服力, 需要进一步加大样本量, 进一步增加对相关机制的深入探讨.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D, D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP, Fleisher LA, Jneid H, Mack MJ, McLeod CJ, O'Gara PT, Rigolin VH, Sundt TM, Thompson A. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017;135:e1159-e1195. [PubMed] [DOI] |
| 3. | 袁 从虎, 钱 静, 郭 震, 于 广东, 纪 月珑. 重症心脏瓣膜病患者术中应用改良超滤技术处理剩余机血对凝血功能和液体负荷的影. 中国体外循环杂志. 2020;18:345-349. [DOI] |
| 5. | De Waele E, Nguyen D, De Bondt K, La Meir M, Diltoer M, Honoré PM, Spapen H, Pen JJ. The CoCoS trial: Caloric Control in Cardiac Surgery patients promotes survival, an interventional trial with retrospective control. Clin Nutr. 2018;37:864-869. [PubMed] [DOI] |
| 7. | Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP, Guyton RA, O'Gara PT, Ruiz CE, Skubas NJ, Sorajja P, Sundt TM, Thomas JD; American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2014;63:e57-185. [PubMed] [DOI] |
| 8. | Bahtouee M, Eghbali SS, Maleki N, Rastgou V, Motamed N. Acute Physiology and Chronic Health Evaluation II score for the assessment of mortality prediction in the intensive care unit: a single-centre study from Iran. Nurs Crit Care. 2019;24:375-380. [PubMed] [DOI] |
| 9. | Matics TJ, Sanchez-Pinto LN. Adaptation and Validation of a Pediatric Sequential Organ Failure Assessment Score and Evaluation of the Sepsis-3 Definitions in Critically Ill Children. JAMA Pediatr. 2017;171:e172352. [PubMed] [DOI] |
| 10. | 陈 岳威, 付 兵, 曹 怡. 早期肠内营养支持对高龄重症心脏瓣膜病患者术后康复的影响. 中华心脏与心律电子杂志. 2018;6:37-39. [DOI] |
| 13. | Lee K, Ahn JM, Kang DY, Ko E, Kwon O, Lee PH, Lee SW, Kim DH, Kim HJ, Kim JB, Choo SJ, Park DW, Park SJ. Nutritional status and risk of all-cause mortality in patients undergoing transcatheter aortic valve replacement assessment using the geriatric nutritional risk index and the controlling nutritional status score. Clin Res Cardiol. 2020;109:161-171. [PubMed] [DOI] |
| 15. | Stoppe C, Ney J, Lomivorotov VV, Efremov SM, Benstoem C, Hill A, Nesterova E, Laaf E, Goetzenich A, McDonald B, Peine A, Marx G, Fehnle K, Heyland DK. Prediction of Prolonged ICU Stay in Cardiac Surgery Patients as a Useful Method to Identify Nutrition Risk in Cardiac Surgery Patients: A Post Hoc Analysis of a Prospective Observational Study. JPEN J Parenter Enteral Nutr. 2019;43:768-779. [PubMed] [DOI] |
| 18. | 康 澍, 戚 继荣, 徐 诚, 寸 跃爽, 束 亚琴, 郁 迪, 王 龙, 莫 绪明. 早期肠内营养支持对先天性心脏病术后患儿营养状况和临床预后的影响. 中华胸心血管外科杂志. 2017;33:712-715. [DOI] |