修回日期: 2021-04-20
接受日期: 2021-05-25
在线出版日期: 2021-06-28
腹部推拿作为传统的中医外治法之一, 可以有效促进胃黏膜损伤修复, 但其作用机制尚不明确. 本研究假设腹部推拿作用于腹部后, 可以通过脑-肠轴刺激下丘脑, 并释放肠三叶因子(intestinal trefoil factor, ITF)作用于胃黏膜, 进而发挥修复胃黏膜的作用.
探讨腹部推拿促进胃黏膜损伤修复的作用机制, 验证脑-肠轴在其过程中的桥梁作用.
采用无水乙醇灌胃法复制胃黏膜损伤大鼠模型, 将造模后大鼠随机分为腹部推拿组和模型组, 另设空白对照组. 腹部推拿组每天予推拿干预, 模型组和空白对照组不进行任何干预. 21 d后, 采用ELISA法检测结肠组织和下丘脑中胃泌素(gastrin, GAS)、神经肽Y(neuropeptide Y, NPY)表达及血清中ITF含量, 免疫组化法、Western Blot法检测下丘脑c-fos蛋白的表达, 实时定量RT-PCR技术检测下丘脑和胃黏膜中ITF mRNA表达.
模型组大鼠较空白对照组下丘脑组织中GAS和NPY含量均显著降低, 结肠组织中GAS含量显著降低, NPY含量显著升高, 下丘脑c-fos蛋白的表达显著增强, 下丘脑及胃黏膜中ITF mRNA及血清中ITF水平降低; 而经腹部推拿干预后结肠组织和下丘脑中GAS和NPY含量均有改善, 下丘脑c-fos蛋白的表达显著降低, 且下丘脑及胃黏膜中ITF mRNA和血清ITF水平显著增加.
腹部推拿作用于胃黏膜损伤大鼠腹部可以改善结肠组织和下丘脑中GAS和NPY神经肽的含量, 对中枢神经系统起到调控作用, 验证了脑-肠轴的存在; 且腹部推拿可以调节下丘脑c-fos蛋白表达, 下调应激反应强度, 同时刺激下丘脑释放ITF入血, 并作用于胃黏膜, 从而发挥修复胃黏膜的作用.
核心提要: 肠三叶因子(intestinal trefoil factor, ITF)在急性胃黏膜损害过程中可以起到保护胃黏膜的作用, 而腹部推拿作用后可以上调下丘脑、血清及胃黏膜中ITF的含量, 提示了调节神经内分泌系统可能是腹部推拿促进胃黏膜损伤修复的途径之一.
引文著录: 海兴华, 刘芳, 骆雄飞, 李华南, 张玮, 王海腾, 孙庆. 基于脑-肠轴探讨腹部推拿对促进大鼠乙醇性胃黏膜损伤修复的作用机制. 世界华人消化杂志 2021; 29(12): 633-638
Revised: April 20, 2021
Accepted: May 25, 2021
Published online: June 28, 2021
As one of the external treatment methods of traditional Chinese medicine, abdominal massage can effectively promote the repair of gastric mucosal injury, but its mechanism is not clear. We hypothesized that abdominal massage can stimulate the hypothalamus through the brain-gut axis, result in the release of intestinal trefoil factor (ITF) to the gastric mucosa, and thus promote the repair of the gastric mucosa.
To explore the mechanism of abdominal massage to promote the repair of gastric mucosal injury, and to verify the role of the brain-gut axis in this process.
Rats were randomly divided into an abdominal massage group, a model group, and a blank control groupp. A rat model of gastric mucosal injury was reproduced by absolute ethanol gavage. The abdominal massage group was given massage intervention every day, and the model group and the blank control group were not given any intervention. After 21 d, the expression of gastrin (GAS) and neuropeptide Y (NPY) in the colon and hypothalamus, and the content of ITF in serum were detected by ELISA. The expression of c-fos protein in the hypothalamus was detected by immunohistochemistry and Western blot. The expression of ITF mRNA in the hypothalamus and gastric mucosa was detected by real-time quantitative RT-PCR.
Compared with the blank control group, the contents of GAS and NPY in the hypothalamus were significantly decreased, the content of GAS in the colon was significantly decreased, the content of NPY in the colon was significantly increased, the expression of c-fos protein in the hypothalamus was significantly increased, and the content of ITF in the hypothalamus and gastric mucosa was significantly increased in the model group. After abdominal massage intervention, the contents of GAS and NPY in the colon and hypothalamus were improved, the expression of c-fos protein in the hypothalamus was significantly decreased, and the levels of ITF mRNA in the hypothalamus and serum ITF and gastric mucosa were significantly increased.
Abdominal massage can improve the contents of GAS and NPY in the colon and hypothalamus of rats with gastric mucosal injury, and regulate the central nervous system, which confirms the existence of the brain-gut axis. Abdominal massage can regulate the expression of c-fos protein in the hypothalamus, downregulate the intensity of stress response, and stimulate the hypothalamus to release ITF into blood. ITF reaching the gastric mucosa via blood circulation can promote the repair of gastric mucosal injury.
- Citation: Hai XH, Liu F, Luo XF, Li HN, Zhang W, Wang HT, Sun Q. Exploration of mechanism of abdominal massage to promote repair of ethanol-induced gastric mucosal injury in rats based on brain-gut axis. Shijie Huaren Xiaohua Zazhi 2021; 29(12): 633-638
- URL: https://www.wjgnet.com/1009-3079/full/v29/i12/633.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i12.633
胃黏膜损伤是导致胃溃疡及急慢性胃炎的主要病理生理环节[1]. 腹部推拿作为传统的中医外治法之一, 相关临床研究已经证实其能够促进胃黏膜损伤修复, 是中医治疗胃黏膜损伤性疾病的有效方法[2-4]. 脑-肠轴是指通过中枢或外周神经系统将胃肠道与大脑联系起来的神经-内分泌网络, 具有双向调节作用[5], 目前认为是腹部推拿治疗消化系统疾病的基础[6,7]. 已有研究表明, 肠三叶因子(intestinal trefoil factor, ITF)在急性胃黏膜损害过程中可以起到保护胃黏膜的作用[8,9], 当胃黏膜损伤发生时, ITF则可通过神经内分泌途径到达胃脏, 从而发挥促进胃黏膜修复的作用[10]. 基于此, 本研究通过分析比较乙醇性胃黏膜损伤大鼠神经内分泌系统中相关因子的表达变化, 探讨腹部推拿促进胃黏膜损伤修复的作用机制, 并验证脑-肠轴在此过程中的桥梁作用.
1.1.1 实验动物: 选用SPF级健康成年SD大鼠30只, 6-8周龄, 雌雄不限, 体质量(200±20) g(北京华阜康生物科技股份有限公司, 合格证: SCXK(京)2014-0004).
1.1.2 主要试剂: 无水乙醇(科密欧, 天津); GAS ELISA kit(武汉云克隆科技股份有限公司 中国), NPY ELISA kit(武汉云克隆科技股份有限公司, 中国); UNIQ-10柱式Trizol总RNA抽提试剂盒(生工生物工程(上海)股份有限公司, 中国); Real-time qPCR试剂盒(Sigma, 美国); ITF ELISA kit(武汉云克隆科技股份有限公司, 中国).
1.1.3 主要仪器: AL204型分析天平(Mettler-toledo Instruments公司, 瑞士); KJ-201型振荡器(江苏康健医疗用品有限公司, 中国); DU800-核酸蛋白分析仪(Beckman Coulter公司, 美国); ABI7500型实时荧光定量PCR仪(Applied Biosystems 公司, 美国); DW-86L628型-80 ℃立式超低温保存箱(Haier公司, 中国).
1.2.1 造模方法: 采用无水乙醇灌胃法复制胃黏膜损伤大鼠模型. 适应性饲养7 d后, 除空白对照组外, 其余实验大鼠均禁食不禁水24 h后, 按照5 mL/kg的剂量行无水乙醇灌胃1次. 模型成功的标准是无水乙醇灌胃后实验大鼠胃黏膜出现条状出血坏死, 病理切片可见腺体破坏、炎性细胞浸润等损伤表现. 造模后2 h即进行实验观察.
1.2.2 分组与干预方法: 采用随机对照的研究方法, 运用随机数字表法将造模成功的胃黏膜损伤大鼠分为腹部推拿组和模型组, 每组各10只. 同时设置10只大鼠作为空白对照组. 腹部推拿组干预操作方法: 将实验大鼠仰卧位束缚于实验台上. 操作者右手食指、中指伸直并拢, 其余三指屈曲放松, 以食指、中指指腹于实验大鼠腹部, 利用腕关节带动二指做回旋揉动, 揉动频率为20-30 次/min, 操作10 min, 连续治疗21 d, 每日正常饲食喂水. 模型组每天将实验大鼠束缚于试验台10 min, 不予任何干预. 空白对照组不予任何干预.
1.2.3 标本采集: 血清: 所有大鼠断头处死后, 快速取血至离心管中, 离心机低温4 ℃离心20 min(3000转/分), 用移液枪收集上清液至冻存管中, 放入冰箱-20 ℃保存; 脑组织: 取血后立即分离出大脑组织用锡箔纸封存标记后浸入液氮中急冻, 后移至-80 ℃低温冰箱保存. 结肠组织: 脑组织取材后, 迅速打开腹腔, 立即剪取50-100 mg结肠组织, 放置于2 mL冻存管中, 于液氮中保存备用.
1.2.4 ELISA法检测结肠组织和下丘脑中GAS、NPY的表达: 将保存的脑组织分离出下丘脑组织, 连同结肠组织分别以无菌剪刀剪成匀浆; 将匀浆放入1.5 mL离心管中, 离心机离心半径75 mm, 2500 r/min离心20 min, 仔细收集上清液, 放入另外的1.5 mL离心管中; 采用ELISA法分别检测结肠组织和下丘脑样本中胃泌素(gastrin, GAS)、神经肽Y(neuropeptide Y, NPY)的水平, 操作严格按照说明书要求进行操作.
1.2.5 实时定量RT-PCR技术检测下丘脑和胃黏膜组织中ITF mRNA表达: Trizol法分别提取下丘脑和胃黏膜组织总RNA. 计算RNA浓度和纯度, 按照试剂盒说明进行反转录, 用引物(表1)扩增并检测. 反应条件: 50 ℃ 5 min, 95 ℃ 15 min, 95 ℃ 15 min, 60 ℃ 15 min. 扩增反应在ABI 7500型实时荧光定量PCR仪上进行, 反应结束后电脑自动绘制出标准曲线, 并由仪器自带软件进行分析. 溶解曲线分析: 先将PCR产物升温至95 ℃, 15 s后降温至60 ℃, 维持1 min后再升温到95 ℃维持15 s, 最后再降温至60 ℃维持15 s. 在此过程中连续收集荧光信号, 并绘制熔解曲线进行.
| 基因 | 引物 | 引物序列 (5'-3') | 扩增产物 (bp) |
| ITF | 上游 | tggtcctggccttgctgt | 212 |
| 下游 | ggcacactggtttgcagaca | ||
| β-actin | 上游 | aaatcgtgcgtgacatcaaa | 178 |
| 下游 | aaggaaggctggaaaagagc |
1.2.6 ELISA法测定血清中ITF的含量: 取实验大鼠血清进行ELISA法检测, 具体操作步骤同GAS和NPY含量检测.
统计学处理 实验数据采用mean±SD表示, 利用SPSS 19.0统计软件进行分析. 两组数据比较采用t检验, 多组数据两两比较, 采用方差分析后Bonfferoni-t检验. P<0.05为差异具有统计学意义.
表2显示, 与空白对照组比较, 模型组大鼠下丘脑组织中GAS和NPY含量均显著降低, 同时结肠组织中GAS含量显著降低, NPY含量显著升高, 差异均具有统计学意义(P<0.01); 与模型组比较, 腹部推拿组大鼠下丘脑组织中GAS含量显著升高(P<0.01), NPY含量有所升高(P<0.05), 同时结肠组织中GAS含量显著升高, NPY含量显著降低, 差异均具有统计学意义(P<0.01).
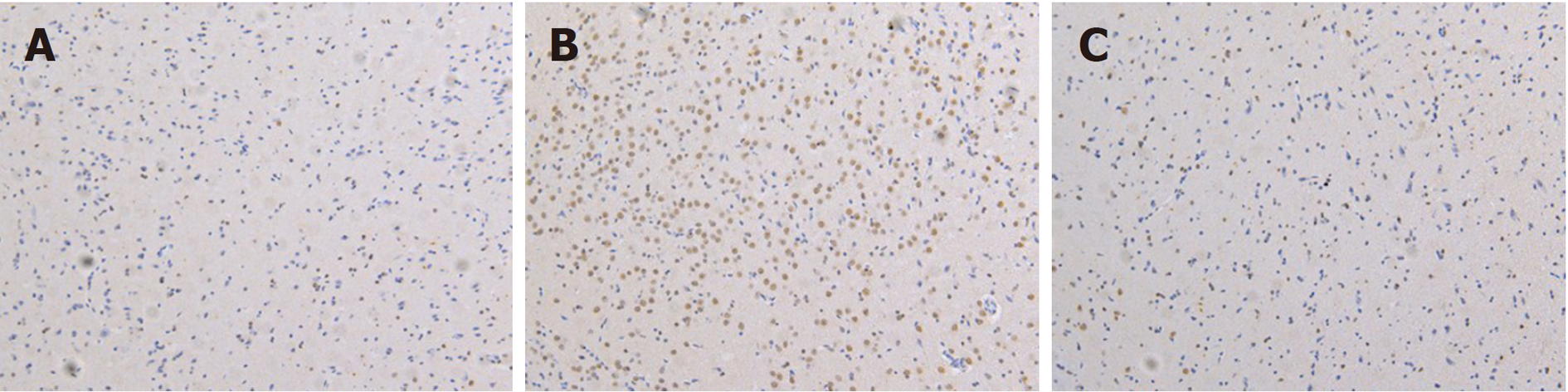
2.2.1 下丘脑中c-fos蛋白免疫组化实验结果: 图1显示, 相对于空白对照组, 模型组c-fos蛋白的表达显著增强; 经腹部推拿后, c-fos蛋白的表达显著降低.
2.2.2 下丘脑中c-fos蛋白Western Blot实验结果: 图2显示, 与空白对照组比较, 模型组c-fos蛋白表达被显著上调; 与模型组比较, 腹部推拿组c-fos蛋白的表达被显著下调, 与免疫组化结果一致.
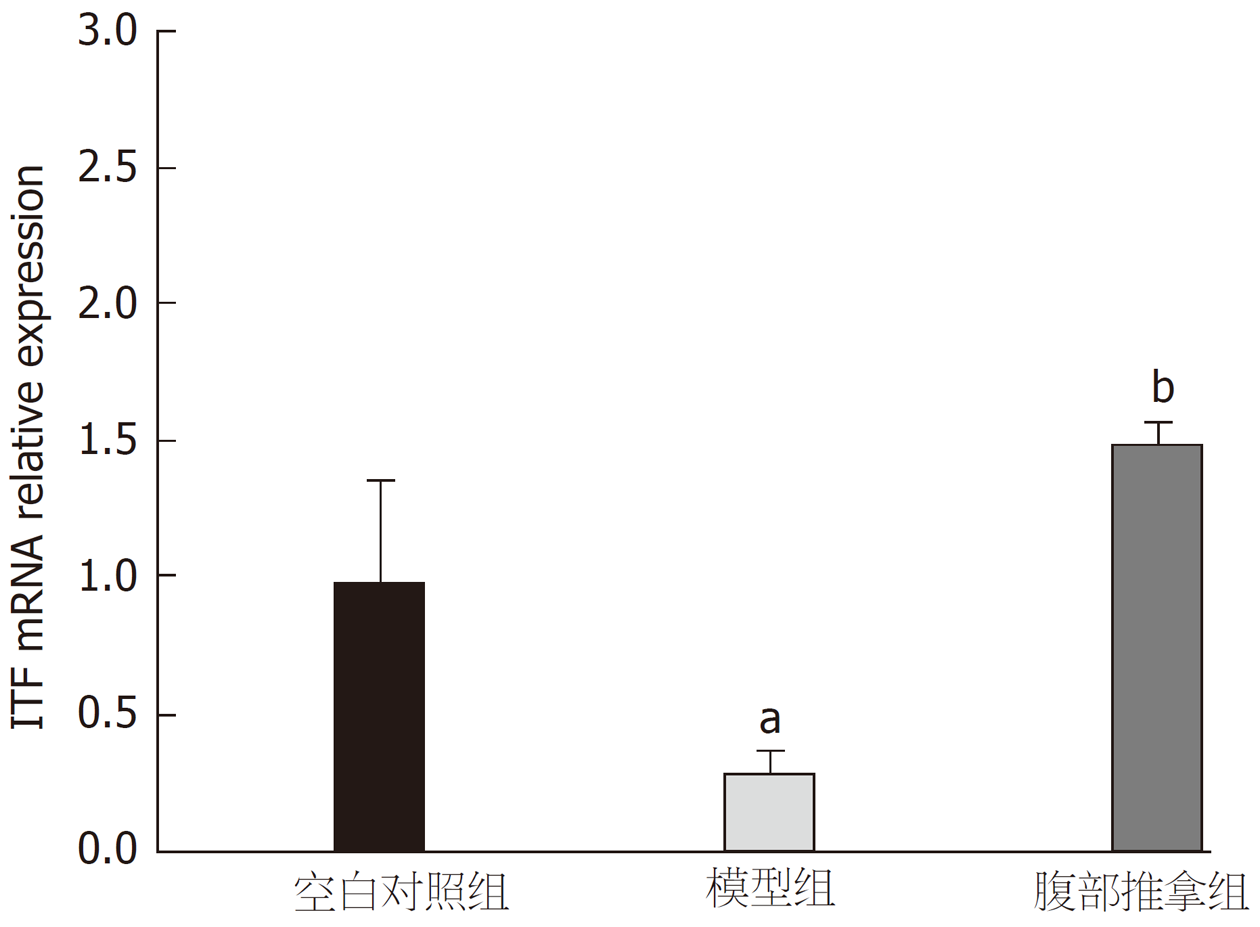
2.3.1 腹部推拿对下丘脑中ITF mRNA表达的影响: 图3显示, 与空白对照组比较, 模型组大鼠下丘脑中ITF mRNA表达水平下降, 差异具有统计学意义(P<0.05); 与模型组比较, 腹部推拿组大鼠下丘脑中ITF mRNA的表达水平显著上升, 差异具有统计学意义(P<0.01).
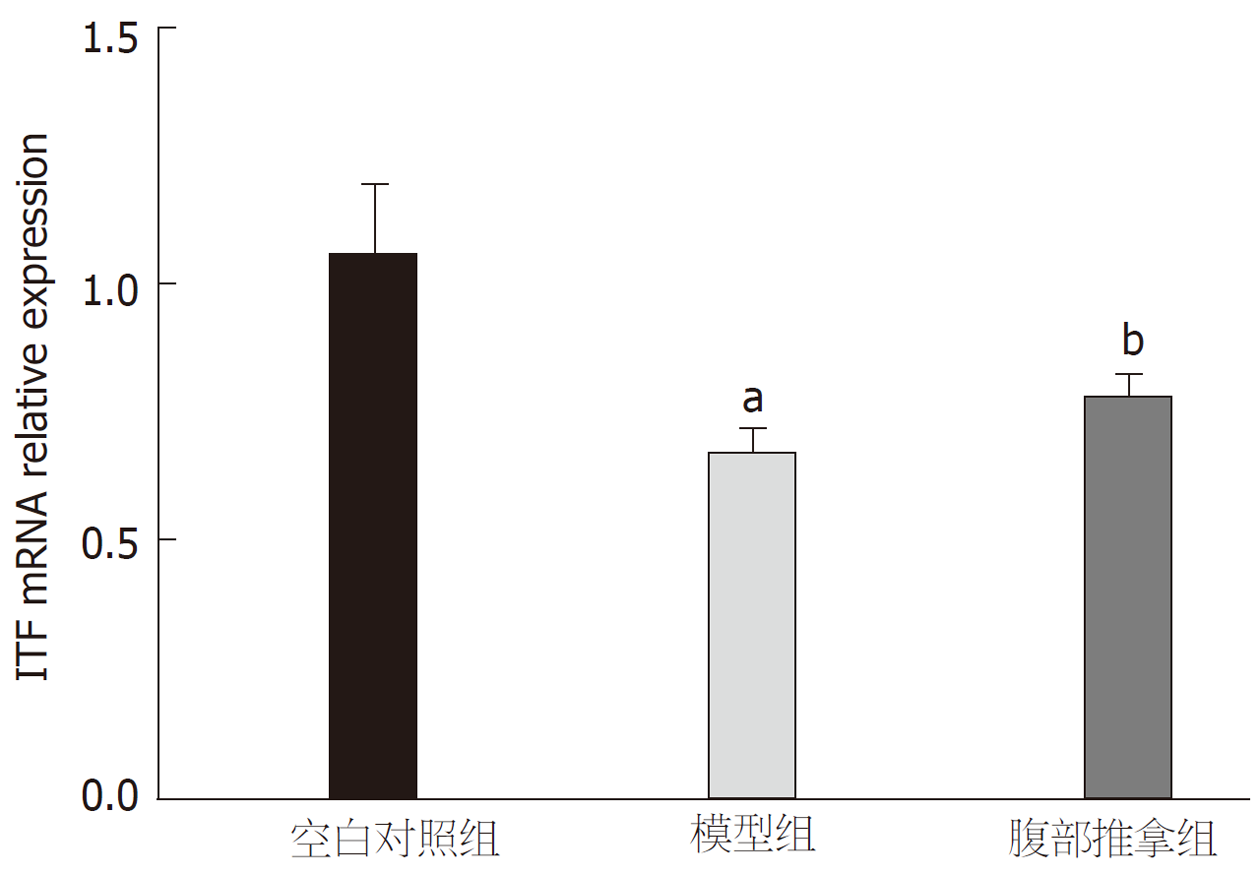
2.3.2 腹部推拿对胃黏膜中ITF mRNA表达的影响: 图4显示, 与空白对照组比较, 模型组大鼠胃黏膜中ITF mRNA表达水平显著下降, 差异具有统计学意义(P<0.01); 与模型组比较, 腹部推拿组大鼠胃黏膜中ITF mRNA的表达水平上升, 差异具有统计学意义(P<0.05).
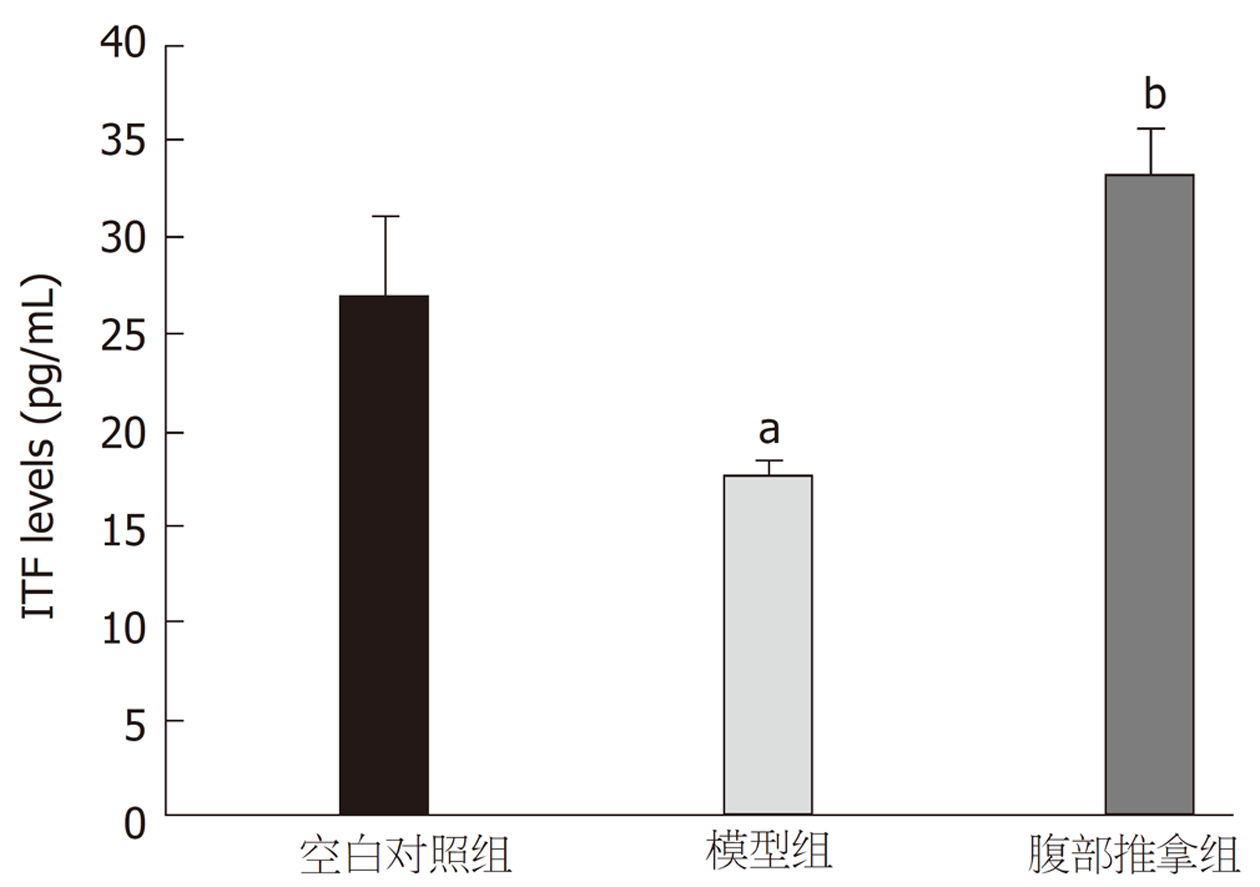
图5显示, 与空白对照组比较, 模型组血清中ITF水平被下调, 而给予腹部推拿后, 血清中ITF水平被显著上调, 差异具有统计学意义(P<0.01).
胃黏膜柔软、血供丰富, 是胃壁屏障的重要物质基础, 由于其与外界直接相通, 极易受到各种物理、化学因素等多种内外攻击因子的刺激, 发生损伤, 从而导致消化性溃疡、各型急慢性胃炎等胃黏膜损伤性疾病[11]. 目前认为胃黏膜损伤形成的主要病理环节为胃黏膜保护机制与损伤因素之间的失衡.
脑-肠轴是由肠神经系统、椎前神经节和中枢神经系统三个层次的神经调节系统共同组成的神经内分泌网络, 其将胃肠道与中枢神经系统紧密联系起来. 相关研究[6,7]已经证实了腹部推拿可以通过脑-肠轴调控中枢神经系统, 以达到治疗消化系统疾病的作用. 本研究发现, 造模后的胃黏膜损伤大鼠结肠组织和下丘脑中GAS和NPY神经肽的含量均有明显改变, 而经腹部推拿干预后大鼠结肠组织和下丘脑中GAS和NPY的含量均有改善, 提示腹部推拿可以同时改善胃黏膜损伤大鼠结肠组织和下丘脑中GAS和NPY神经肽的含量, 说明了腹部推拿作用于大鼠腹部后, 可以对中枢神经系统起到调控作用, 同时也进一步验证了脑-肠轴的存在, 以及脑-肠轴在腹部推拿促进胃黏膜损伤修复过程中的桥梁作用.
c-fos蛋白是神经元被激活的标志, 可有效地用于神经通路追踪和信使传递途径的研究[12]. 本研究显示, 腹部推拿干预可以减少下丘脑中c-fos蛋白的表达, 下调应激反应强度, 也充分证明腹部推拿可以激发下丘脑组织的神经内分泌功能, 具有中枢应激调节作用.
ITF是新型保护性因子三叶草因子家族中的一员, 有研究显示, 其主要由下丘脑合成, 较其他保护性因子表达更加迅速, 在胃黏膜损伤早期即可参与到损伤组织的修复过程中, 具有重要的临床价值[13,14]. 但本研究结果显示, 模型组大鼠下丘脑、血清及胃黏膜组织中ITF表达水平较空白对照组均有所下降, 可能与检测时间点较晚有关; 而腹部推拿干预后实验大鼠下丘脑、血清及胃黏膜组织中ITF的表达水平较模型组均显著增加, 证明了腹部推拿能刺激下丘脑释放ITF入血, 并作用于胃黏膜, 从而发挥修复胃黏膜的作用. 在以后的研究中, 可以通过增加样本量和检测时间点进一步观测各组织中ITF表达水平变化.
综上所述, 本研究证实了腹部推拿通过脑-肠轴激活神经内分泌系统达到促进胃黏膜修复的作用, 初步揭示了腹部推拿治疗胃黏膜损伤性疾病的作用机制, 对于未来进行更加深入的研究提供了理论基础, 同时对于腹部推拿治疗消化系统疾病的理论构建及临床推广具有重要的实际意义.
胃溃疡、急慢性胃炎等胃黏膜损伤性疾病的发病率呈逐年增加的趋势, 其严重危害患者的身心健康. 腹部推拿可以通过促进胃黏膜损伤修复达到治疗胃黏膜损伤性疾病的目的, 但其作用机制尚不明确, 亟待对其进行进一步探讨.
肠三叶因子(intestinal trefoil factor, ITF)在急性胃黏膜损害过程中可以起到保护胃黏膜的作用, 而腹部推拿通过何种途径促进ITF发挥作用尚不明确.
探讨腹部推拿对神经内分泌系统的影响, 并分析其促进胃黏膜损伤修复的作用机制.
ELISA法检测结肠组织和下丘脑中胃泌素(gastrin, GAS)、神经肽Y(neuropeptide Y, NPY)表达及血清中ITF含量, 免疫组化法、Western Blot法检测下丘脑c-fos蛋白的表达, 实时定量RT-PCR技术检测下丘脑和胃黏膜中ITF mRNA表达.
腹部推拿改善了胃黏膜损伤大鼠结肠组织和下丘脑中GAS和NPY神经肽的含量, 调节了下丘脑c-fos蛋白表达, 同时刺激下丘脑释放ITF入血, 并作用于胃黏膜, 发挥修复胃黏膜的作用.
腹部推拿可以通过脑-肠轴调节神经内分泌系统释放ITF, 达到促进胃黏膜损伤修复的作用.
本研究仅选取了一种保护性因子作为研究对象, 初步证实了腹部推拿可以调节神经内分泌系统促进胃黏膜损伤修复, 未来可以通过增加样本量、研究指标和观察时间点等方法做更加深入的研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 7. | 姜 庆宇, 李 华南, 张 玮, 赵 娜, 王 金贵. 腹部推拿对便秘型肠易激综合征患者组织中脑肠肽CGRP、SP、VIP、CCK的影响. 辽宁中医药大学学报. 2014;16:70-72. [DOI] |
| 8. | Schulze U, Hampel U, Sel S, Goecke TW, Thäle V, Garreis F, Paulsen F. Fresh and cryopreserved amniotic membrane secrete the trefoil factor family peptide 3 that is well known to promote wound healing. Histochem Cell Biol. 2012;138:243-250. [PubMed] [DOI] |
| 9. | Aikou S, Fukushima Y, Ogawa M, Nozaki K, Saito T, Matsui T, Goldenring JR, Kaminishi M, Nomura S. Alterations in gastric mucosal lineages before or after acute oxyntic atrophy in gastrin receptor and H2 histamine receptor-deficient mice. Dig Dis Sci. 2009;54:1625-1635. [PubMed] [DOI] |
| 10. | Hoffmann W. Trefoil factors TFF (trefoil factor family) peptide-triggered signals promoting mucosal restitution. Cell Mol Life Sci. 2005;62:2932-2938. [PubMed] [DOI] |
| 12. | 张 红梅, 刘 晓伟, 曲 宏达, 廖 剑, 戚 振红, 谢 子英, 杨 恬, 阎 伟伟. 左金丸对应激性溃疡大鼠下丘脑室旁核c-fos及HPA轴的调节作用. 中国中西医结合急救杂志. 2004;5:276-280. [DOI] |
| 14. | Kjellev S. The trefoil factor family - small peptides with multiple functionalities. Cell Mol Life Sci. 2009;66:1350-1369. [PubMed] [DOI] |