修回日期: 2021-03-24
接受日期: 2021-04-22
在线出版日期: 2021-05-28
胃黄斑瘤常被认为是胃部的良性病变, 是组织细胞或巨噬细胞吞噬大量脂质后堆积在固有层而形成的. 然而, 最近研究发现胃黄斑瘤可能与胃部的癌前病变和胃癌相关, 内镜下需与胃印戒细胞癌和胃透明细胞癌加以鉴别.
核心提要: 胃黄斑瘤可能与胃部的癌前病变和胃癌相关, 临床需加以重视.
引文著录: 陈鸿鑫, 易芳芳, 吴艳艳, 祁兴顺. 胃黄斑瘤的研究进展. 世界华人消化杂志 2021; 29(10): 537-542
Revised: March 24, 2021
Accepted: April 22, 2021
Published online: May 28, 2021
Gastric xanthelasma has always been considered a benign lesion of the stomach. It is formed by tissue cells or macrophages phagocytizing a large amount of lipid and accumulating in the lamina propria. However, recent studies have found that gastric xanthelasma is associated with precancerous lesions and gastric cancer, and should be differentiated from signet ring cell carcinoma and clear cell carcinoma of the stomach.
- Citation: Chen HX, Yi FF, Wu YY, Qi XS. Recent advances in research of gastric xanthelasma. Shijie Huaren Xiaohua Zazhi 2021; 29(10): 537-542
- URL: https://www.wjgnet.com/1009-3079/full/v29/i10/537.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i10.537
胃黄斑瘤又称脂质岛、胃黄色瘤, 是上消化道内镜检查中一种较为罕见的良性病变, 常单发, 内镜下外观呈黄白色, 大小在1-10 mm之间[1,2]. 胃黄斑瘤的病因及发病机制尚不明确, 可能的病因包括胃粘膜慢性炎症或老化、幽门螺杆菌感染 (Helicobacter pylori, H. pylori)、脂质代谢异常、胆汁返流等[3]. 上消化道黄斑瘤以胃黄斑瘤最为多见[4], 胃黄斑瘤需与胃印戒细胞癌等恶性病变相鉴别[5]. 本文对胃黄斑瘤的流行病学、发病机制、临床特征、临床意义、诊断及治疗作一综述.
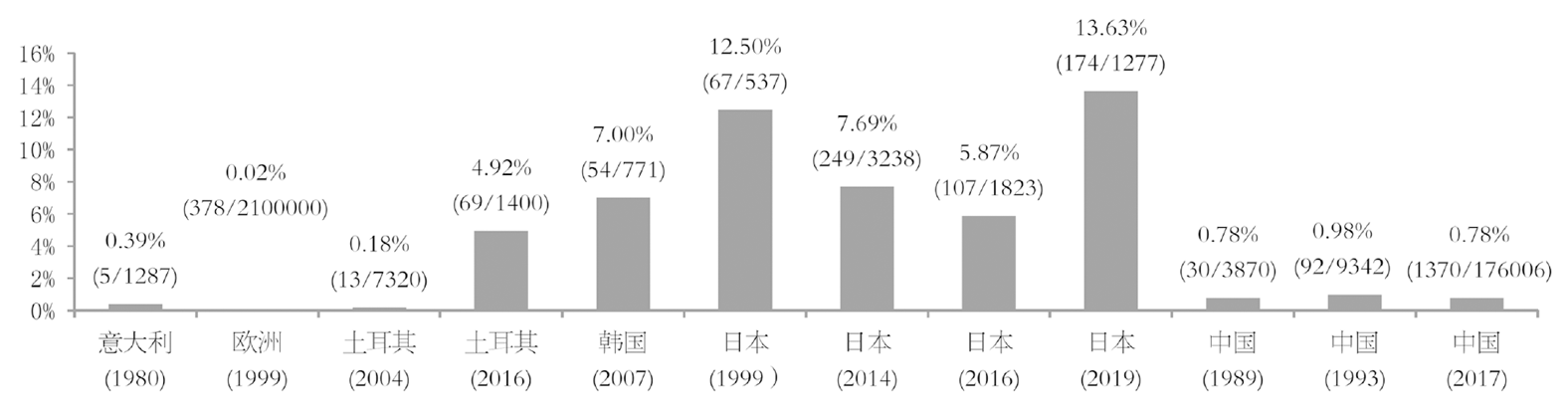
胃黄斑瘤男性较女性更为多见[6,7], 男/女患病率之比约为1.60-2.29: 1. 此病可见于所有年龄人群, 且随着年龄的增长, 胃黄斑瘤的患病率逐渐升高[8]; 年龄>65岁时, 胃黄斑瘤的患病率明显升高[6,7], 这也证明了胃黄斑瘤可能与胃粘膜老化有关[4]. 儿童患此病十分少见, 罕有报告[3,9-11]. 胃黄斑瘤的患病率存在着地域间的差异, 欧洲国家患病率相对较低, 亚洲国家(韩国和日本)患病率明显高于其他地区, 见图1.
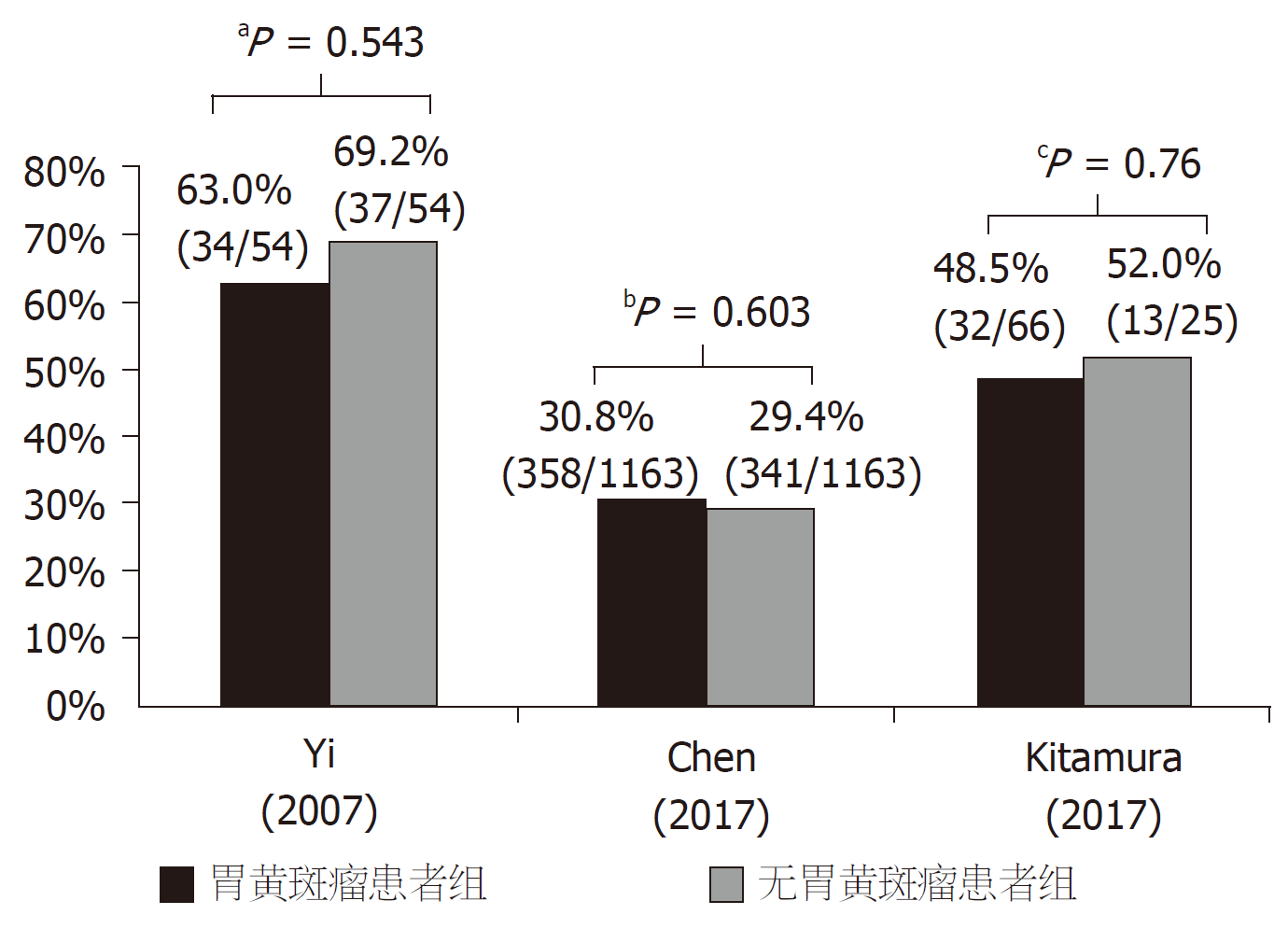
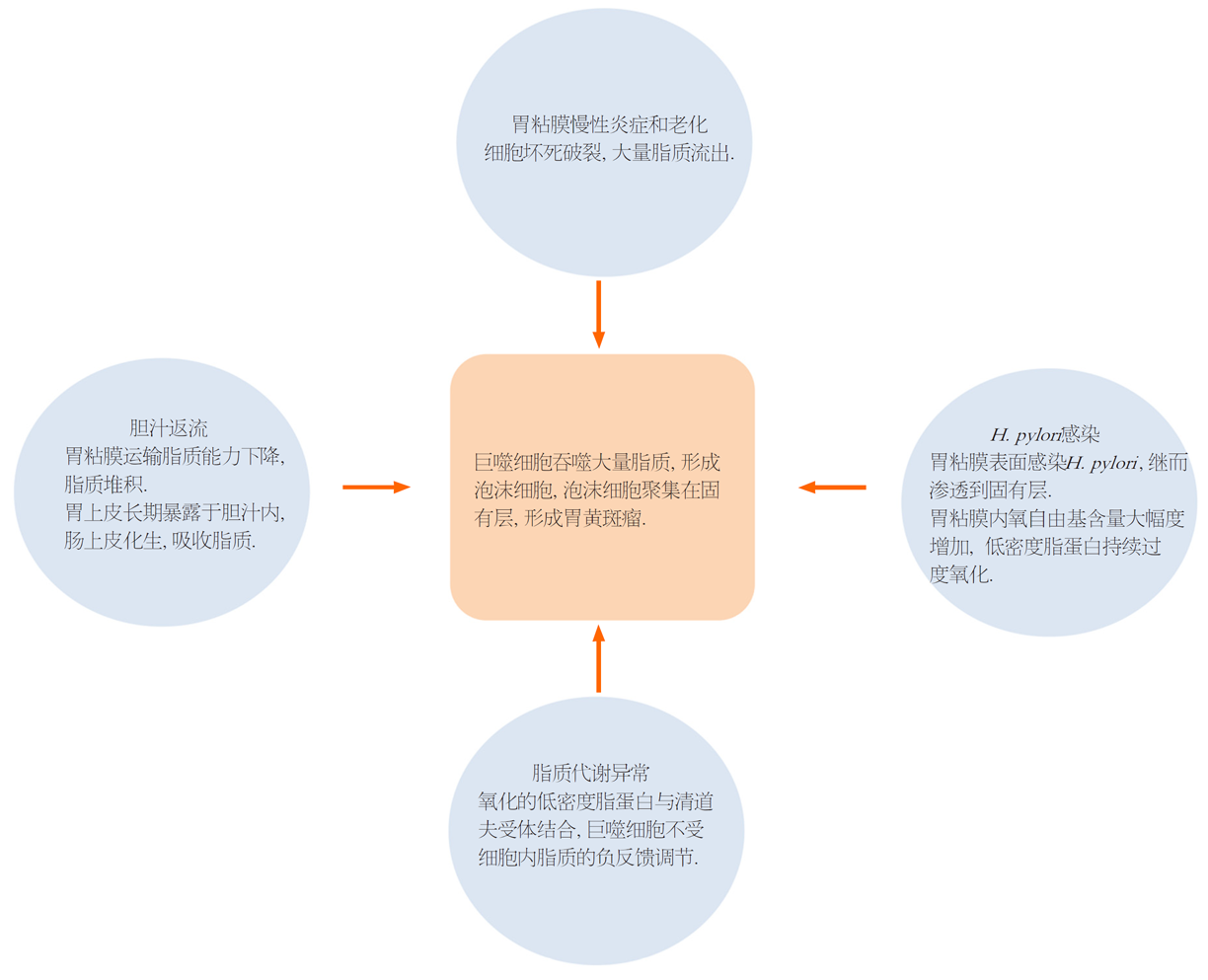
胃黄斑瘤与H. pylori感染的关系尚存争议. 有研究者认为H. pylori感染是胃黄斑瘤的病因之一, H. pylori感染可导致胃粘膜内氧自由基含量大幅度增加, 促使低密度脂蛋白持续过度氧化, 进而形成胃黄斑瘤[12]. Hori等[13]通过间接免疫过氧化酶法检测胃黄斑瘤组织切片的H. pylori抗原分布, 发现积聚在固有层的泡沫组织细胞胞浆中存在H. pylori抗原, 认为胃粘膜表面感染H. pylori后, 可渗透到固有层, 继而诱导巨噬细胞向泡沫细胞转化, 形成胃黄斑瘤. 然而, 在最近的三项病例对照研究中并未发现胃黄斑瘤与H. pylori感染有关, 两组H. pylori感染阳性率无统计学差异(图2)[1,2,14].
长期慢性炎症和细胞老化导致胃粘膜细胞坏死破裂, 大量脂质流出, 被间质组织细胞和巨噬细胞吞噬, 巨噬细胞内大量脂质堆积, 进而成为泡沫细胞, 泡沫细胞在固有层大量聚集, 最终形成了胃黄斑瘤[4,15].
低密度脂蛋白被自由基氧化或其他化学基团修饰, 氧化和乙酰化的低密度脂蛋白与一种或多种"清道夫受体"结合. 清道夫受体是一种多功能的脂蛋白结合受体, 在巨噬细胞上的表达不受细胞内脂质的负反馈调节, 即细胞可以无限制的摄入被氧化的低密度脂蛋白并沉积在细胞内, 形成泡沫细胞, 泡沫细胞聚集最终导致了胃黄斑瘤[16]. 脂质代谢异常与胃黄斑瘤形成之间关系尚存争议. 目前, 两项病例对照研究发现, 胃黄斑瘤患者组的高密度脂蛋白水平显著低于对照组, 甘油三酯水平显著高于对照组, 两组总胆固醇、低密度脂蛋白水平无统计学差异, 因此, 认为胃黄斑瘤可能与脂质代谢异常有关[2,17]. 有研究报道, 胃黄斑瘤合并脂质代谢异常的患者血脂正常后胃黄斑瘤也随之消失[18]. 然而, 亦有病例报告发现胃黄斑瘤患者的血脂水平无明显异常[19,20].
胃黄斑瘤患者多无典型临床症状, 可伴随腹痛、腹胀、消化不良、恶心等[2,4,24]. 胃黄斑瘤合并增生性息肉的患者临床表现为胃灼热、疼痛或胀气[20]. 弥漫性胃黄斑瘤的患者可表现为恶心[25]. 胃黄斑瘤合并胃印戒细胞癌的患者可出现反复上腹部不适以及消瘦[5].
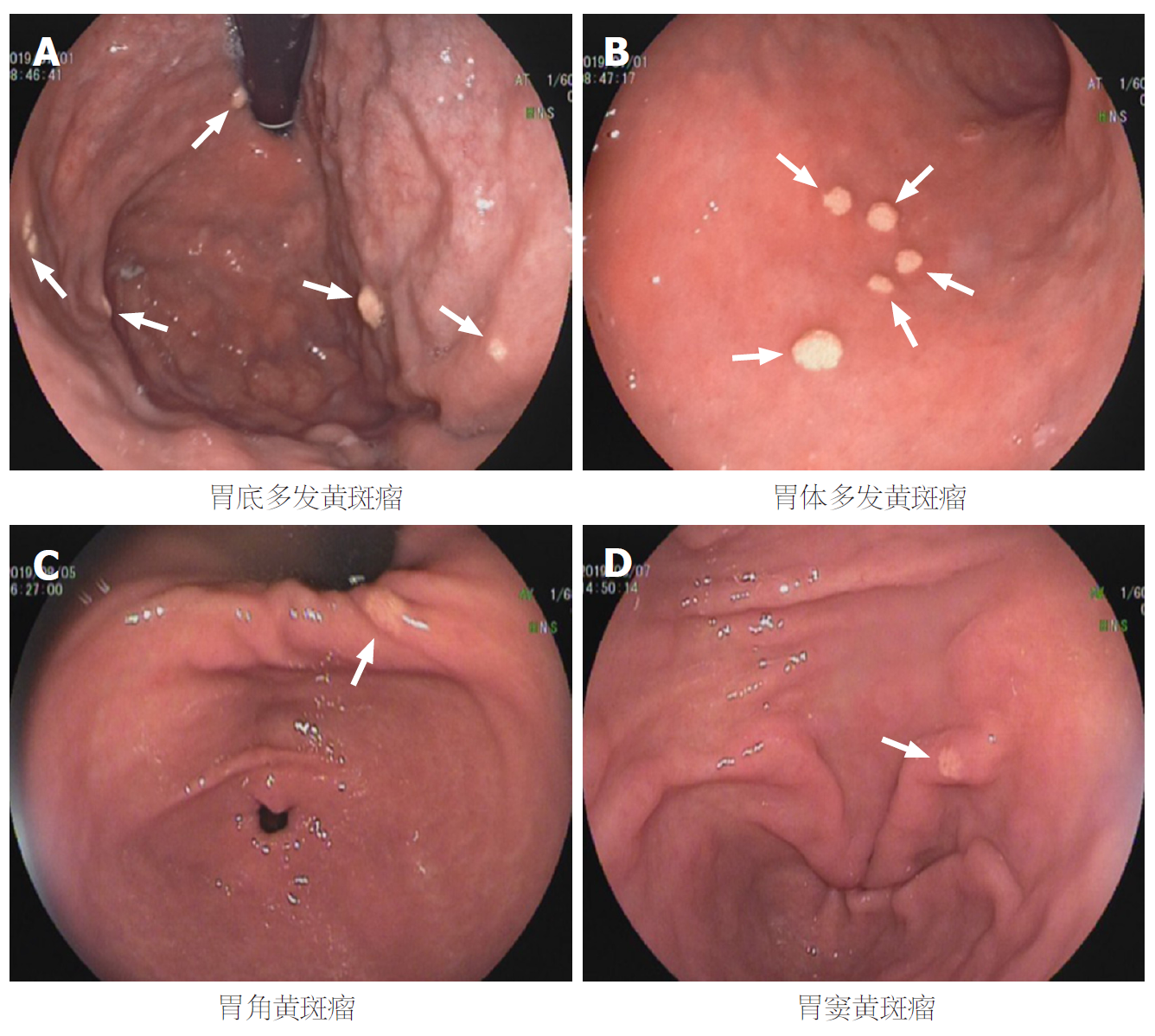
胃黄斑瘤可出现在胃的任何部位, 最常见于胃窦, 内镜下表现为黄白色、单发或多发、边界清楚的结节样或斑块样病变, 直径<10 mm[1,2,24,26](图3). 少数情况下, 胃黄斑瘤内镜下的表现与胃透明细胞癌和胃印戒细胞癌相似, 难以鉴别[5]. 弥漫性胃黄斑瘤内镜下表现为多个白色或黄色的结节状粘膜病变, 表面呈蕨类样; 直径多为3-8 mm的黄色结节样病变, 窄带成像显示胃内各部位多发白斑, 提示脂质沉积. 据病例报道提示, 4例弥漫性胃黄斑瘤患者中, 3例出现了脂质异常[25,27-29]. 胃黄斑瘤合并肠上皮化生的内镜下表现为胃部可见大量轻度隆起的黄白色粘膜病变, 表面不规则, 有小块的粉红色和白色区域[30]. 黄色增生性息肉罕见, 患病率为5/4497(0.11%); 内镜下表现为大小2-6 mm黄白色息肉样病变, 其特点为黄斑瘤生长在增生性息肉上[20].
胃黄斑瘤的组织病理学特点是固有层聚集大量的泡沫细胞. 这些泡沫细胞由组织细胞或巨噬细胞在吞噬大量脂质后形成, 在低温切片中发现泡沫细胞内含有胆固醇酯、脂肪酸、中性脂肪、低密度脂蛋白和氧化的低密度脂蛋白等. 同时, 存在少数平滑肌细胞、浆细胞、淋巴细胞、周细胞、成纤维细胞和含有脂滴的施万细胞[16]. 泡沫细胞呈多边形或圆形, 有明显的细胞膜, 细胞核偏小, 且位于细胞中心或稍偏离中心的位置, 呈圆形或卵圆形, 胞质稀疏, 内可见许多液泡[4]. 在新鲜标本中, 这些泡沫细胞经油红O染色呈强阳性, 马森三色染色呈弱阳性, 过碘酸雪夫反应染色呈阴性[24]. 组织切片检查可排除与胃黄斑瘤有关的胃粘膜癌前病变或者胃恶性肿瘤[31,32].
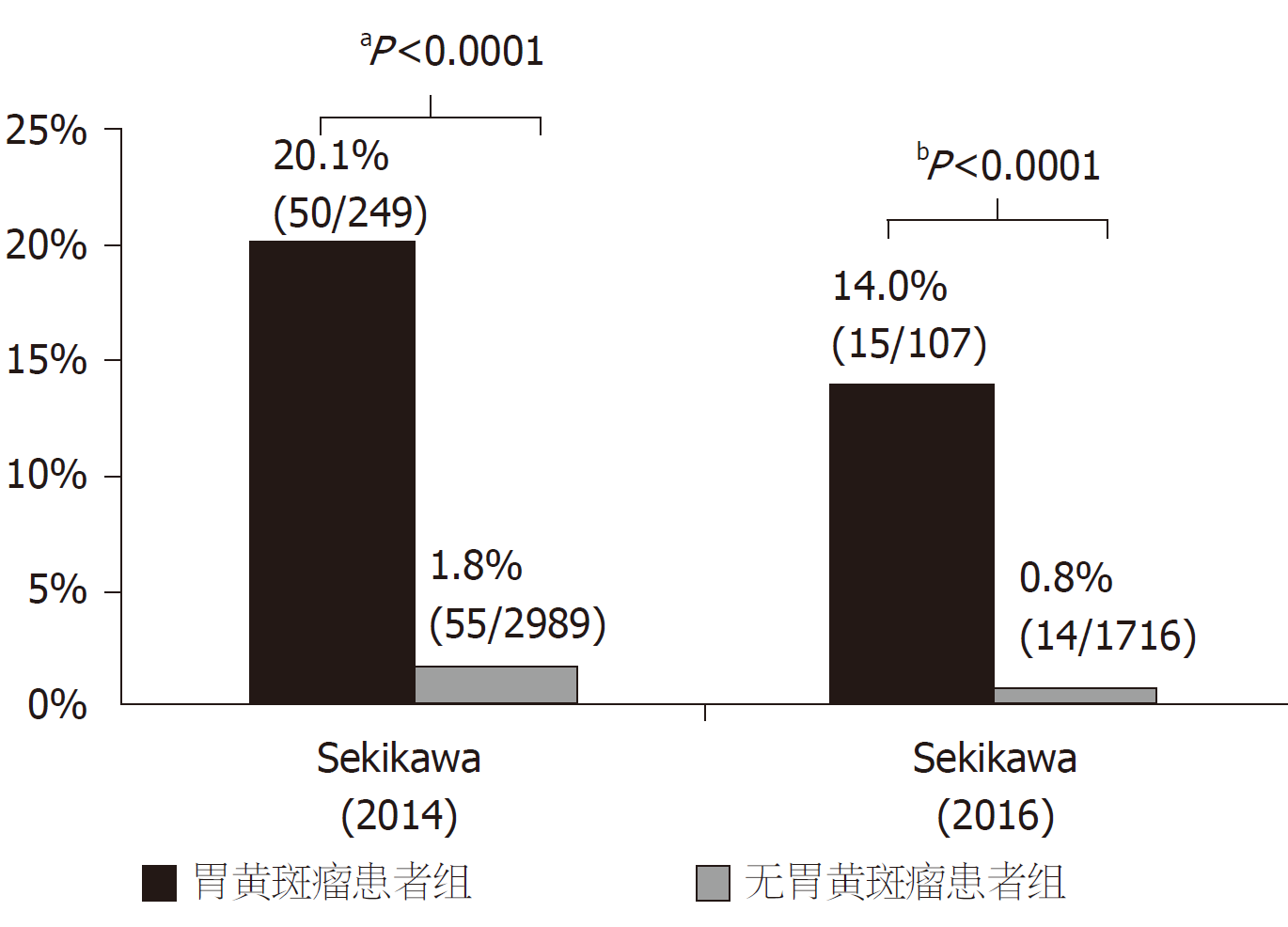
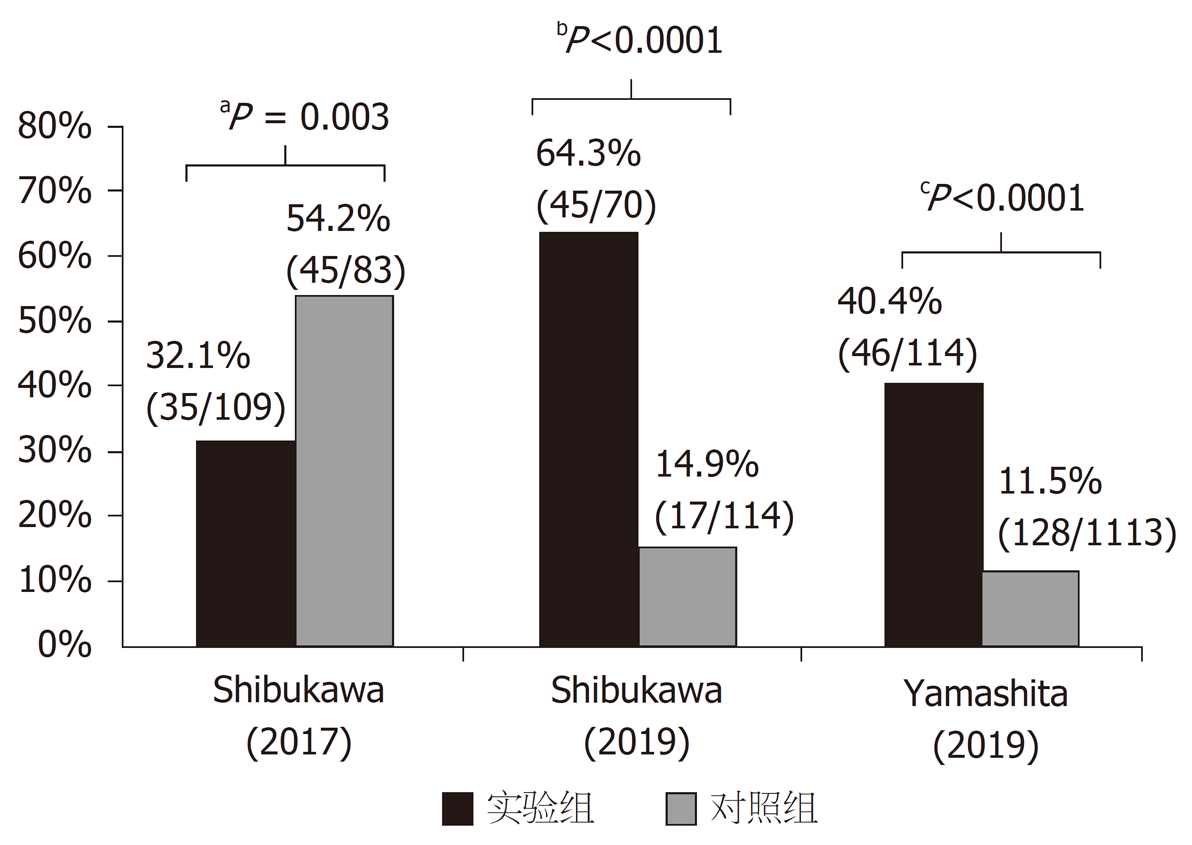
胃黄斑瘤常被认为是胃部的良性病变, 但近年多项研究发现, 胃黄斑瘤与胃癌密切相关[6,7,33-35]. Sekikawa等[7]分析了3238例行内镜检查的患者数据, 发现胃黄斑瘤患者胃癌的患病率明显高于无胃黄斑瘤患者 (20.1 vs 1.8%, P<0.0001). 匹配年龄、性别、胃萎缩程度后, 胃黄斑瘤患者胃癌患病率仍明显高于对照组 (20.8% vs 3.3%, P<0.0001), 提示胃黄斑瘤与胃癌相关, 图4. 一项对1832例患者进行3年内镜随访的回顾性分析发现[6], 107例胃黄斑瘤患者中有15例 (14.0%) 发生胃癌, 而1716例无胃黄斑瘤患者中仅有14例(0.8%)发生胃癌. 这提示胃黄斑瘤与胃癌的发生独立相关[Odds Ratio比值比(OR): 5.85, 95% Confidence Interval置信区间(CI): 2.67-12.82, P<0.001], 胃黄斑瘤是预测早期胃癌发生的标志, 图4. Shibukawa等[33]对192例胃癌患者进行了回顾性研究, 发现孤立性胃癌患者胃黄斑瘤的患病率显著低于同时性或异时性胃癌患者 (32.1% vs 54.2%, P = 0.003), 多变量分析显示胃黄斑瘤与同时性或异时性胃癌独立相关 (OR: 2.11, 95%CI: 1.14-3.99, P = 0.02), 故胃黄斑瘤是同时性或异时性胃癌的预测标志, 图5. 一项纳入184例根除H. pylori患者的回顾性研究中[34], 将根除H. pylori后的患者分为有无胃癌两组, 两组胃黄斑瘤患病率分别为(64.3% vs 14.9%, P<0.0001), 多变量分析显示胃黄斑瘤是根除H. pylori后发生胃癌的独立预测因素(OR: 5.64, 95%CI: 2.47-12.9, P<0.001); 匹配胃萎缩程度后, 仍证实胃黄斑瘤是根除H. pylori后胃癌发生的独立预测因素, 图5. 此外, Yamashita等[35]回顾性分析1127例患者内镜结果后发现, 胃癌患者胃黄斑瘤患病率明显高于无胃癌人群(40.4% vs 11.5%, P<0.0001), 图5. 综上, 胃黄斑瘤与胃癌的发生、存在以及根除H. pylori后胃癌发生有密切的关系.
胃黄斑瘤可在无任何治疗干预的情况下缩小或者消失, 所以通常无需治疗[29]. 当胃黄斑瘤合并增生性息肉或其他胃部疾病时, 可在胃黄斑瘤的基底部周围注射稀释的肾上腺素溶液 (0.0125 mg/mL) 后, 再用热活检钳或内镜下粘膜切除术的圈套器完整切除[4,36]. 也可通过内镜下氩离子束凝固术、热探头治疗胃黄斑瘤. 多数研究者认为胃黄斑瘤无需内镜随访[15,37], 然而, 考虑胃黄斑瘤与H. pylori感染、萎缩性胃炎、肠上皮化生等病变, 甚至胃癌关系密切, 胃黄斑瘤患者需要加强内镜随访, 观察上述病变的发生[9,36].
胃黄斑瘤是上消化道较为罕见的病变, 主要表现为胃粘膜表面黄白色结节或斑块样改变. 它可能与H. pylori感染、胃粘膜炎症与老化、脂质代谢异常、胆汁返流等有关, 图6. 胃黄斑瘤内镜下表现与恶性病变相似, 所以在内镜检查的过程中发现胃黄斑瘤时, 需仔细观察是否有其他癌前病变或恶性病变的存在, 并且胃黄斑瘤患者需进行内镜随访来观察是否发生胃癌. 由于胃黄斑瘤发病率低, 研究所能包括的样本量有限, 且以上报道均为单中心的研究结果, 研究方法缺乏大样本、多中心数据. 所以上述结果需要更多的研究来进一步证明.
学科分类: 胃肠病学和肝病学
手稿来源地: 辽宁省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Yi SY. Dyslipidemia and H pylori in gastric xanthomatosis. World J Gastroenterol. 2007;13:4598-4601. [PubMed] [DOI] |
| 2. | Chen Y, He XJ, Zhou MJ, Li YM. Gastric xanthelasma and metabolic disorders: A large retrospective study among Chinese population. World J Gastroenterol. 2017;23:7756-7764. [PubMed] [DOI] |
| 3. | Collins MH, Olazagasti JC, Fitzgerald J. Gastric xanthomas in a child. J Pediatr Gastroenterol Nutr. 1994;19:444-447. [PubMed] [DOI] |
| 4. | Gencosmanoglu R, Sen-Oran E, Kurtkaya-Yapicier O, Tozun N. Xanthelasmas of the upper gastrointestinal tract. J Gastroenterol. 2004;39:215-219. [PubMed] [DOI] |
| 5. | Ludvíkova M, Michal M, Datkova D. Gastric xanthelasma associated with diffuse signet ring carcinoma. A potential diagnostic problem. Histopathology. 1994;25:581-582. [PubMed] [DOI] |
| 6. | Sekikawa A, Fukui H, Sada R, Fukuhara M, Marui S, Tanke G, Endo M, Ohara Y, Matsuda F, Nakajima J, Henmi S, Saito S, Tsumura T, Maruo T, Kimura T, Osaki Y. Gastric atrophy and xanthelasma are markers for predicting the development of early gastric cancer. J Gastroenterol. 2016;51:35-42. [PubMed] [DOI] |
| 7. | Sekikawa A, Fukui H, Maruo T, Tsumura T, Kanesaka T, Okabe Y, Osaki Y. Gastric xanthelasma may be a warning sign for the presence of early gastric cancer. J Gastroenterol Hepatol. 2014;29:951-956. [PubMed] [DOI] |
| 8. | Naito M, Miura S, Funaki C, Tateishi T, Kuzuya F. [Gastric xanthomas in the elderly]. Nihon Ronen Igakkai Zasshi. 1991;28:683-687. [PubMed] [DOI] |
| 9. | Wetzler G, Felix AA, Lipton JF. Gastric xanthelasma. J Pediatr Gastroenterol Nutr. 2010;51:1. [PubMed] [DOI] |
| 10. | Gasparetto M, Gianmaria P, Francesca G, Mara C, Graziella G. A Rare Case of Pediatric Gastric Xanthoma: Diagnosis and Follow up. Journal of Gastroenterology and Hepatology Research. 2013;2:607-608. [DOI] |
| 11. | Halabi I, Yaseen M, Vesoulis Z. Multiple gastric xanthomas in a 3-year-old patient. Gastroenterol Hepatol (NY). 2010;6:181-183. [PubMed] |
| 12. | Isomoto H, Mizuta Y, Inoue K, Matsuo T, Hayakawa T, Miyazaki M, Onita K, Takeshima F, Murase K, Shimokawa I, Kohno S. A close relationship between Helicobacter pylori infection and gastric xanthoma. Scand J Gastroenterol. 1999;34:346-352. [PubMed] [DOI] |
| 13. | Hori S, Tsutsumi Y. Helicobacter pylori infection in gastric xanthomas: immunohistochemical analysis of 145 lesions. Pathol Int. 1996;46:589-593. [PubMed] [DOI] |
| 14. | Kitamura S, Muguruma N, Okamoto K, Tanahashi T, Fukuya A, Tanaka K, Fujimoto D, Kimura T, Miyamoto H, Bando Y, Takeuchi H, Shiba M, Takayama T. Clinicopathological Assessment of Gastric Xanthoma as Potential Predictive Marker of Gastric Cancer. Digestion. 2017;96:199-206. [PubMed] [DOI] |
| 15. | Lechago J. Lipid islands of the stomach: an insular issue? Gastroenterology. 1996;110:630-632. [PubMed] [DOI] |
| 16. | Kaiserling E, Heinle H, Itabe H, Takano T, Remmele W. Lipid islands in human gastric mucosa: morphological and immunohistochemical findings. Gastroenterology. 1996;110:369-374. [PubMed] [DOI] |
| 17. | Chang FY, Shih CY, Lee SD. Abnormal serum lipid levels in subjects with gastric xanthoma. Clin Chim Acta. 1993;217:233-235. [PubMed] [DOI] |
| 18. | Coates AG, Nostrant TT, Wilson JA, Dobbins WO, Agha FP. Gastric xanthomatosis and cholestasis. A causal relationship. Dig Dis Sci. 1986;31:925-928. [PubMed] [DOI] |
| 19. | Jeong YS, Park H, Lee DY, Lee SI, Park C. Gastric xanthomatosis. Gastrointest Endosc. 2004;59:399-400. [PubMed] [DOI] |
| 20. | Bassullu N, Turkmen I, Uraz S, Yagiz Korkmaz P, Memisoglu R, Gultekin OS, Bulbul Dogusoy G. Xanthomatous hyperplastic polyps of the stomach: clinicopathologic study of 5 patients with polypoid gastric lesions showing combined features of gastric xanthelasma and hyperplastic polyp. Ann Diagn Pathol. 2013;17:72-74. [PubMed] [DOI] |
| 21. | Domellof L, Eriksson S, Helander HF, Janunger KG. Lipid islands in the gastric mucosa after resection for benign ulcer disease. Gastroenterology. 1977;72:14-18. [PubMed] |
| 22. | Terruzzi V, Minoli G, Butti GC, Rossini A. Gastric lipid islands in the gastric stump and in non-operated stomach. Endoscopy. 1980;12:58-62. [PubMed] [DOI] |
| 23. | Heilmann K. Lipid islands in gastric mucosa. Beitr Pathol. 1973;149:411-419. [PubMed] |
| 24. | Kumar PV, Monabati A, Naini MA, Lankarani KB, Fattahi MR, Asadilari M. Gastric xanthoma: a diagnostic problem on brushing cytology smears. Acta Cytol. 2006;50:74-79. [PubMed] [DOI] |
| 25. | Basyigit S, Aktas B, Simsek G, Kucukazman M. Difuse gastric xantomatosis: an interesting endoscopic finding of xanthoma. Chin Med J (Engl). 2014;127:3427. [PubMed] |
| 26. | Chen YS, Lin JB, Dai KS, Deng BX, Xu LZ, Lin CD, Jiang ZG. Gastric xanthelasma. Chin Med J (Engl). 1989;102:639-643. [PubMed] |
| 27. | Wu JH. Gastric Xanthomatosis: A Rare Presentation of a Common Disorder. Clin Gastroenterol Hepatol. 2016;14:A18. [PubMed] [DOI] |
| 28. | Hashimoto R, Torralba EJ, Li X. Diffuse Gastric Xanthomatosis. Clin Gastroenterol Hepatol. 2020;18:e132. [PubMed] [DOI] |
| 29. | De Roberto G, Ravizza D, Fiori G, Trovato C, Maffini F, Tamayo D, Crosta C. A massive gastric xanthomatosis. Endoscopy. 2009;41 Suppl 2:E54-E55. [PubMed] [DOI] |
| 30. | Gravina AG, Iacono A, Alagia I, D'Armiento FP, Sansone S, Romano M. Gastric xanthomatosis associated with gastric intestinal metaplasia in a dyspeptic patient. Dig Liver Dis. 2009;41:765. [PubMed] [DOI] |
| 31. | Alzahrani M, Alqunaitir A, Alsohaibani M, Al-Rikabi AC. Gastric xanthelasma associated with hyperplastic polyp and mucosal erosions: report of an unusual case and literature review. Oxf Med Case Reports. 2018;2018:omy051. [PubMed] [DOI] |
| 32. | Oviedo J, Swan N, Farraye FA. Gastric xanthomas. Am J Gastroenterol. 2001;96:3216-3218. [PubMed] [DOI] |
| 33. | Shibukawa N, Ouchi S, Wakamatsu S, Wakahara Y, Kaneko A. Gastric xanthoma is a predictive marker for metachronous and synchronous gastric cancer. World J Gastrointest Oncol. 2017;9:327-332. [PubMed] [DOI] |
| 34. | Shibukawa N, Ouchi S, Wakamatsu S, Wakahara Y, Kaneko A. Gastric Xanthoma Is a Predictive Marker for Early Gastric Cancer Detected after Helicobacter pylori Eradication. Intern Med. 2019;58:779-784. [PubMed] [DOI] |
| 35. | Yamashita K, Suzuki R, Kubo T, Onodera K, Iida T, Saito M, Arimura Y, Endo T, Nojima M, Nakase H. Gastric Xanthomas and Fundic Gland Polyps as Endoscopic Risk Indicators of Gastric Cancer. Gut Liver. 2019;13:409-414. [PubMed] [DOI] |
| 36. | Dhakal M, Dhakal OP, Bhandari D, Gupta A. Gastric xanthelasma: an unusual endoscopic finding. BMJ Case Rep. 2013;2013. [PubMed] [DOI] |
| 37. | Jansen HJ, van Krieken JH, Romkens TE. Yellow-white lesions in the upper gastrointestinal tract. Gastric xanthelasmas. Neth J Med. 2009;67:360-361. [PubMed] |