修回日期: 2021-03-18
接受日期: 2021-04-02
在线出版日期: 2021-05-28
结直肠癌(colorectal carcinoma, CRC)是临床上最为常见的消化系统恶性肿瘤, 但结直肠癌细胞增殖和迁移的分子机制并为完全阐明. 胱氨酸/谷氨酸反转运体X(cystine/glutamate antiporter, xCT)被证实在多种肿瘤中高表达并与细胞的铁死亡有关.
探讨miR-128-3p靶向xCT基因抑制结直肠癌细胞增殖、侵袭的分子机制及其与患者临床病理特征关系.
癌症基因图谱(the cancer genome atlas, TCGA)、Oncomine数据库中比较胱氨酸/xCT基因在人结直肠癌及多种实体肿瘤中的表达. 肿瘤免疫(tumor immune estimation resource, TIMER)数据库中分析xCT表达水平与淋巴细胞浸润程度关系. 基因表达综合 (gene expression omnibus, GEO)数据库下载结直肠癌患者癌组织 vs 癌旁组织差异表达miRNA数据集GSE18392, 筛序癌组织与癌旁组织差异表达miRNA, 筛选条件为Log2FC>1, adjP<0.05. microRNA靶基因在线预测算法(Targetscan, miRDB和StarBase)预测xCT上游靶miRNA. GSE18392差异表达miRNA和预测靶基因取交集得到miR-128-3p. 并采用双荧光素酶报告实验验证miR-128-3p与xCT靶向调控关系. 实时荧光定量聚合酶链反应(real time fluorescent quantitative polymerase chain reaction, RT-PCR)检测人正常肠上皮细胞及人结直肠癌细胞系、38例结直肠癌患者癌组织和癌旁组织中xCT及miR-128-3p表达水平. 溴化噻唑蓝四氮唑[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT)]实验和划痕实验观察转染外源性miR-128-3p-mimic后人结癌细胞(SW480)增殖和迁移能力有无改变.
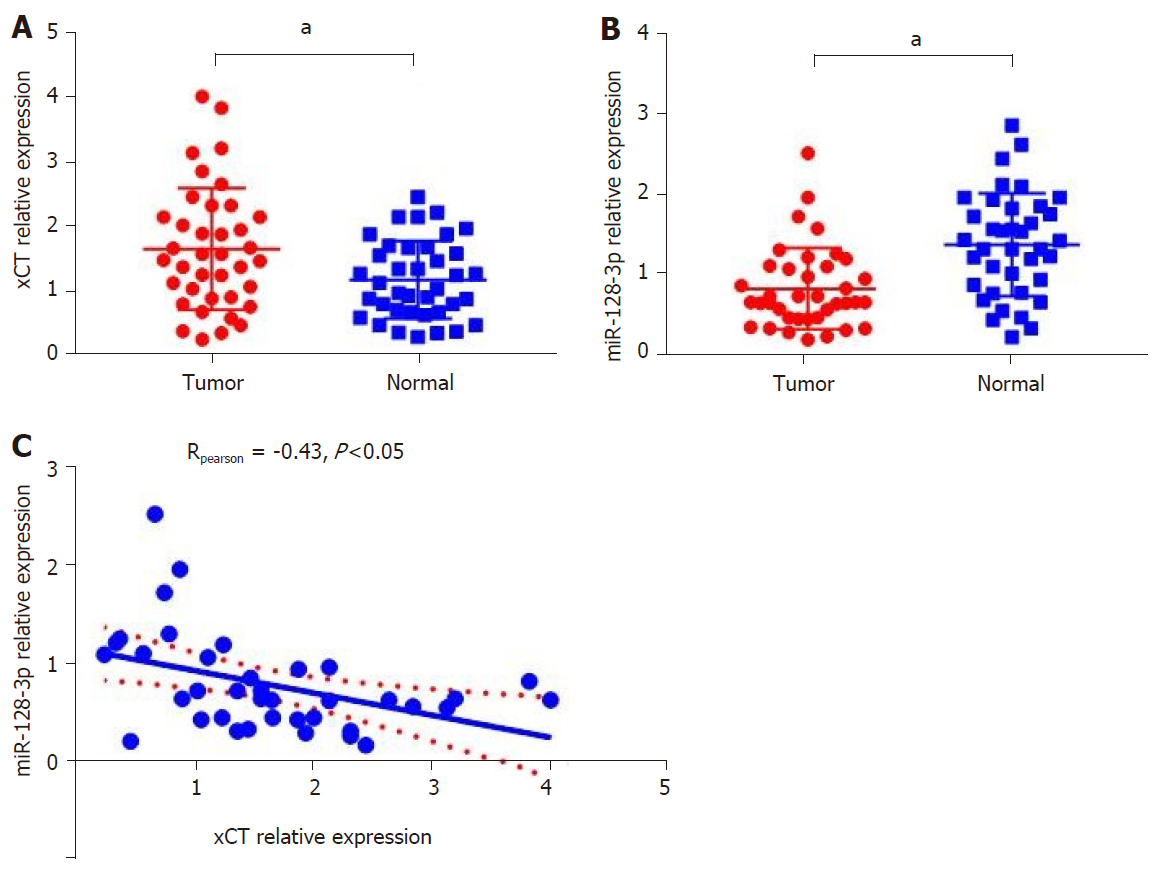
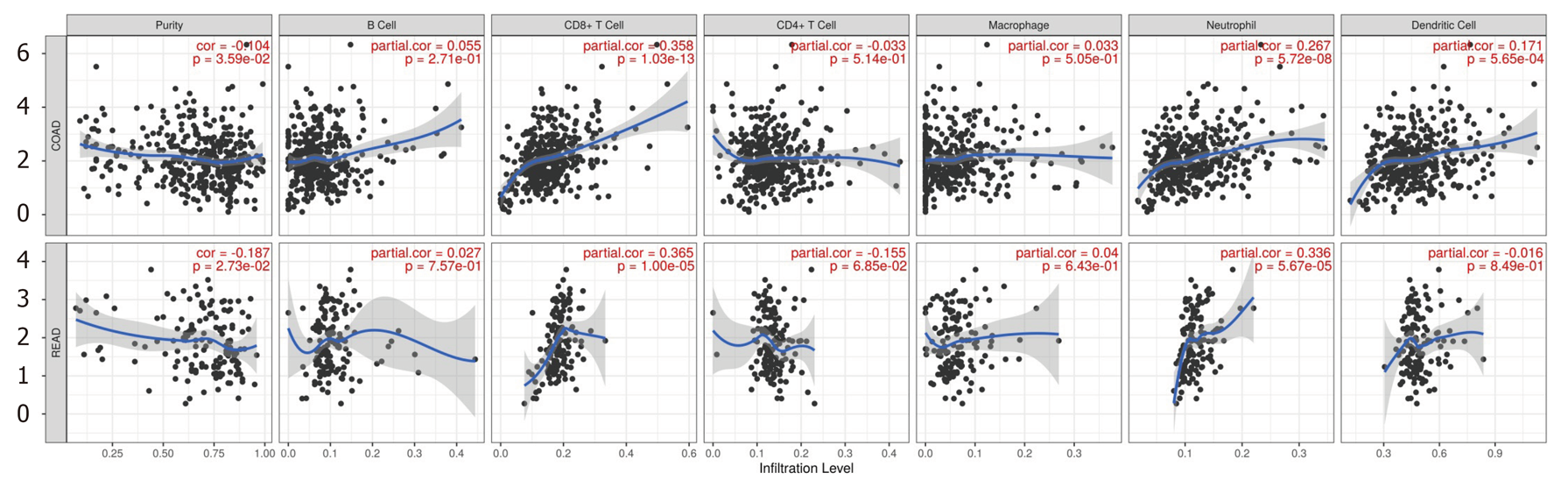
结直肠癌组织xCT表达水平显著高于癌旁正常组织(P<0.05).筛选并预测miR-128-3p为xCT上游靶向调控基因. 荧光素酶报告基因显示, miR-128-3p可靶向结合xCT基因3'UTR区域. xCT在人结直肠癌细胞系(HT-29, SW480, LoVo及SW620)中的表达水平显著高于正常肠上皮细胞(NCM460), (P<0.05), 而miR-128-3p在人结直肠癌细胞系中的表达水平显著低于正常肠上皮细胞异(P<0.05). 转染外源性miR-128-3p mimic可显著下调SW480细胞中xCT表达水平, 并抑制SW480细胞增殖和迁移能力. xCT在38例结直肠癌患者癌组织中的表达水平显著高于癌旁组织(P<0.05), 而miR-128-3p在癌组织中相对表达水平显著低于癌旁组织(P<0.05). 癌组织中miR-128-3p与xCT表达负相关(rpearson = -0.43, P<0.05). 免疫组化显示xCT阳性表达于细胞膜, 呈棕黄色颗粒, 在癌组织中阳性率63.2%. xCT阳性表达与肿瘤分化(P<0.05)和脉管浸润(P<0.05)有关. xCT表达水平与结肠癌CD8+T细胞, 中性粒细胞, 树突状细胞浸润有关(P<0.05), 与直肠癌CD8+T细胞和中性粒细胞浸润有关(P<0.05), 而于其他淋巴细胞浸润水平无关(P>0.05).
xCT在结直肠癌中表达上调, miR-128-3p可通过与xCT基因3'UTR结合抑制肠癌细胞的增殖和迁移, miR-128-3p/xCT通路有望成为肠癌靶向治疗新的潜在靶点.
核心提要: 氨酸反转运体X(cystine/glutamate antiporter, xCT)基因在人多种肿瘤及结直肠癌中表达水平增加, miR-128-3p可靶向调控xCT表达并影响肠癌细胞的生物学功能. 抑制结直肠癌miR-128-3p/xCT信号通路可能是肠癌靶向治疗的新靶点.
引文著录: 吴珺, 廖旭慧, 吴勤丽, 余伟. miR-128-3p靶向xCT基因在结直肠癌中的分子机制及其与肠癌患者临床病理特征的相关性. 世界华人消化杂志 2021; 29(10): 526-536
Revised: March 18, 2021
Accepted: April 2, 2021
Published online: May 28, 2021
Colorectal cancer (CRC) is the most common malignant tumor of the digestive system. However, the molecular mechanism of the proliferation and migration of colorectal cancer cells has not been fully elucidated. Cystine/glutamate antiporter (xCT) has been shown to be overexpressed in a variety of tumors and is associated with ferroptosis.
To investigate the molecular mechanism of Mir-128-3p targeting xCT gene in inhibiting the proliferation and invasion of colorectal cancer cells and the correlation with patients' clinicopathological characteristics.
The Cancer Genome Atlas (TCGA) and Oncomine databases were applied to compare the expression of xCT gene in tumor tissue and corresponding normal tissue of human colorectal cancer and various solid tumors. The relationship between xCT expression level and lymphocyte infiltration was analyzed in the tumor immune estimation resource (TIMER) database. GSE18392 was downloaded from gene expression omnibus (GEO) database to screen differentially expressed miRNAs between cancer tissues and adjacent normal tissues. The screening criteria were log2FC > 1 and adjP < 0.05. Online prediction algorithm of miRNA target genes (targetscan, Mirdb, and Starbase) was used to predict the upstream target miRNAs of xCT. The expression levels of xCT and miR-128-3p were detected by RT-PCR in normal human intestinal epithelial cells, colorectal cancer cell lines, and 38 pairs of colorectal cancer tissues and adjacent tissues. MTT and wound healing assays were applied to detect the cell proliferation and migration ability after transfection with miR-128-3p.
The expression level of xCT in colorectal cancer tissues was significantly higher than that in adjacent normal tissues (P < 0.05). MiR-128-3p was identified to target the xCT gene in the upstream. Luciferase reporter gene assay showed that miR-128-3p could bind to the 3' untranslated region (UTR) of xCT gene. xCT was overexpressed in human colon cancer cell lines compared to normal human colorectal cells (P < 0.05). However, miR-128-3p was downregulated in colorectal human colon cancer cell lines compared to normal human colorectal cells (P < 0.05). Transfection with miR-128-3p mimic could significantly downregulate the expression level of xCT in SW480 cells, and inhibit the proliferation and migration of SW480 cells. The expression level of xCT in 16 cases of colorectal cancer tissues was significantly higher than that of adjacent tissues (P < 0.05), while the relative expression level of miR-128-3p in cancer tissues was significantly lower than that of adjacent tissues (P < 0.05). The positive rate of xCT in cancer tissues (63.2%) was correlated tumor differentiation (P < 0.05) and vascular invasion (P < 0.05). The expression level of xCT was related to the infiltration of CD8 + T cells, neutrophils, and dendritic cells in colon cancer (P < 0.05), and the infiltration of CD8 + T cells and neutrophils in rectal cancer (P < 0.05), but not correlated with the infiltration of other lymphocytes (P > 0.05).
The expression of xCT is up-regulated in colorectal cancer. MiR-128-3p can inhibit the proliferation and migration of colorectal cancer cells by binding with the 3' UTR of xCT. The miR-128-3p/xCT pathway is expected to become a new potential target for colorectal cancer targeted therapy.
- Citation: Wu J, Liao XH, Wu QL, Yu W. MiR-128-3p targets xCT gene in colorectal cancer: Molecular mechanism and correlation with patients' clinicopathological features. Shijie Huaren Xiaohua Zazhi 2021; 29(10): 526-536
- URL: https://www.wjgnet.com/1009-3079/full/v29/i10/526.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i10.526
结直肠癌(colorectal cancer, CRC)是临床上最为常见的消化系统恶性肿瘤. 相关流行病学研究显示[1], 在全球范围内, 结直肠癌是第三种最常见的恶性肿瘤, 约占所有肿瘤患者的10%. 2018年, CRC新增病例109万例, 死亡55.1万人[2]. 虽然CRC每年造成数十万人的死亡, 但其发生、发展和侵袭转移的确切分子机制并未完全清晰. 近年来随着分子生物学、高通量测序及生物信息学的不断发展进步, 在高通量大规模水平上对肿瘤患者全基因组、转录组及蛋白组水平的分子机制研究成为了可能[3].
凋亡(Apoptosis)是抑制肿瘤的重要分子机制, 近年来人们又发现一种新的细胞死亡形式-铁死亡(ferroptosis)[4,5]. 铁死亡是一种依赖于铁的程序性细胞死亡, 以脂质过氧化物的积累为特征, 在遗传和生物化学上不同于其他形式的调节性细胞死亡, 如凋亡. 铁死亡是由谷胱甘肽依赖性抗氧化功能下降或缺失引起的, 导致不受控制的脂质过氧化和最终的细胞死亡[6,7]. 这种非凋亡形式的细胞死亡可以促进肿瘤细胞被选择性清除. xCT基因编码胱氨酸/谷氨酸反转运体X(cystine/glutamate antiporter, xCT), 可通过介导胱氨酸摄取和谷氨酸释放促进谷胱甘肽的合成, 保护细胞免受氧化应激, 维持细胞的氧化还原平衡, 阻止脂质过氧化诱导的细胞死亡[8]. 已有文献报道xCT在人多种实体肿瘤包括肺癌、乳腺癌、肝细胞癌、胃癌及结直肠癌中高表达并与患者的预后有关, 但其上游调控基因及相关信号通路并不十分清楚[9-11]. 因此, 在本研究中, 我们采用生物信息分析结合细胞实验及组织标本探讨xCT在结直肠癌中的表达及其可能的分子调控机制.
1.1.1 细胞株及结直肠癌组织: 正常人结肠上皮细胞株(NCM460)、人结直肠癌细胞株(HT-29, SW480, LoVo及SW62)购自美国ATCC细胞库. 38例结直肠癌患者组织标本来源于丽水市人民医院病理科, 对我院手术治疗的结直肠癌患者组织标本进行回顾性分析, 摘录患者的临床病例特征如年龄、性别、肿瘤分期、病理分级等. 组织标本获取经我院医学伦理委员会通过, 并患者知情同意.
1.1.2 仪器设备试剂: 细胞培养箱; 恒温水浴箱; 实时荧光定量聚合酶链反应(polymerase chain reaction, PCR)仪7900HT; 台式低速离心机; 超低温冰箱; 无菌操作台Steril CARD Ⅲ Advance; 倒置相差显微镜(TS100). 荧光定量PCR试剂SYBRRPremix Ex TaqTM; 反转录酶M-MLV Reverse Transcriptase; 胎牛血清; 小RNA提取试剂盒miRNeasyRMini Kit.
1.2.1 生物信息分析及xCT上游调控基因预测: 癌症基因图谱(the cancer genome atlas, TCGA) (https://Portal.gdc.cancer.gov/)以及Oncomine (http://www.oncomine.org/resource/login.html)数据库中比较xCT基因在人结直肠癌及多种实体肿瘤中的表达. 肿瘤免疫(tumor immune estimation resource, TIMER)(https://cistrome.shinyapps.io/timer/)数据库中分析xCT表达水平与淋巴细胞浸润程度关系. 基因表达综合(gene expression omnibus, GEO)数据库(http://www.ncbi.nlm.nih.gov/geo/)下载结直肠癌患者癌组织 vs 癌旁组织差异表达数据集GSE18392, 筛序癌组织与癌旁组织差异表达miRNA, 筛选条件为Log2FC>1, adjP<0.05. microRNA靶基因在线预测算法Targetscan(http://www.targetscan.org/vert_72/), miRDB(http://www.mirdb.org/)和StarBase(http://starbase.sysu.edu.cn/starbase2/)预测xCT上游靶miRNA. GSE18392差异表达miRNA和预测靶基因取交集得到miR-128-3p.
1.2.2 细胞培养: 正常人结肠上皮细胞株(NCM460)、人结直肠癌细胞株(HT-29, SW480, LoVo及SW62)购自美国ATCC细胞库.细胞采用DMEM培养基, 胎牛血清血清(FBS), 37 ℃, 5% CO2, 无菌培养箱中进行培养.
1.2.3 实时荧光定量PCR: 采用qRT-PCR法检测组织和细胞中xCT-AS1的表达水平. TRIzol法从组织和细胞中提取总RNA, 经反转录反应合成cDNA, 采用实时荧光定量PCR进行PCR反应, 条件为反应条件为: 94 ℃变性5 min, 40次循环, 94 ℃持续30 s, 58 ℃持续45 s, 72 ℃持续30 s、 然后在72 ℃下延长10 min. xCT和miR-128-3p分别以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)和U6为内参, 采用2-ΔΔCt法计算计算相对表达量. 引物序列为: FP: TGAGCTGGGAACGTGCATTA; RP: AGGGCGAATAACCAGCAGTT.
1.2.4 MTT实验: 将转染的SW460细胞配置为单细胞悬浮液, 加入培养皿分别在37 ℃、5% CO2下放置24 h、48 h和72 h. 加入MTT溶液20 μL, 继续培养4 h后弃去上清, 每孔加入150 μL DMSO, 置摇床上低速振荡10 min,检测OD490 nm处测量各孔的吸光值, 绘制细胞增殖曲线.
1.2.5 划痕实验: 取对数生长期SW460细胞, 制备成细胞悬液接种于六孔板,以50%的细胞密度接种, 置于37 ℃ 5% CO2孵箱中培养. 24 h转染miR-128-3p mimic和对照(NC mimic)后继续培养24 h, 然后用1000 μL枪头在贴壁细胞做垂直的划痕, 并拍照记录划痕宽度, 后继续培养并分别于培养24 h, 48 h和96 h拍照记录划痕宽度, 评价细胞迁移距离.
1.2.6 双荧光素酶报告实验: 野生型(WT)-xCT, 突变型(MUT)-含xCT设计并插入miR-128-3p的结合位点到pGL3荧光报告质粒(Promega). 荧光素酶报告基因分析, SW469细胞转染miR-128-3p mimic组和对照组与上述荧光素酶报告载体共转染. 转染48 h后, 通过双荧光素酶报告检测系统进行检测.
1.2.7 xCT表达水平与淋巴细胞浸润: 在TIMER(https://cistrome.shinyapps.io/timer/)数据库中分析xCT基因表达水平与结直肠癌淋巴细胞浸润的关系. 检索策略: Gene symbol选项为xCT, Cancer type选下为colorectal cancer. Immune infiltrates选项为Bcell, CD8+ T cell, CD4+ T cell, Macrophage, Neutrophil, Dendritic cell.
1.2.8 xCT相关信号通路: 在TCGA数据库中(http://www.cbioportal.org/)分析xCT基因及相关信号通路数据库, 检索基因为xCT, 物种为人类.
统计学处理 统计学分析采用R软件(http://www.r-project.org/)及在线分析软件完成, 计量资料用mean±SD表示, 组间比较采用t检验, 计数资料采用相对数表示, 行χ2检验, 双侧P<0.05为差别有统计学意义.
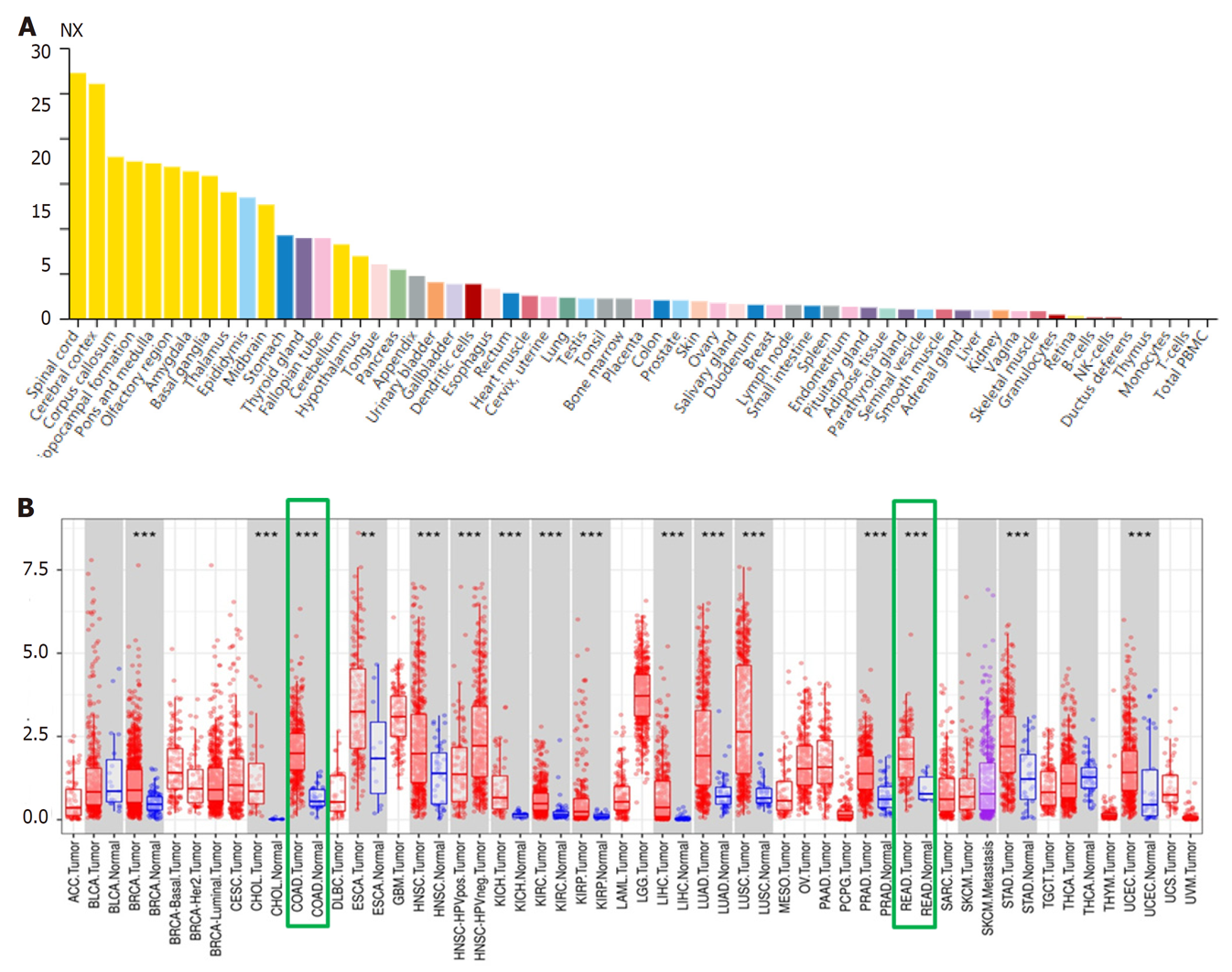
xCT基因表达水平在人体不同组织中存在明显差异(图1A)在大多数肿瘤患者癌组织中表达水平高于对应的癌旁正常组织(图1B).在结直肠癌患者中, 癌组织xCT表达水平显著高于癌旁正常组织, 且有统计学差异(P<0.05), 图2.
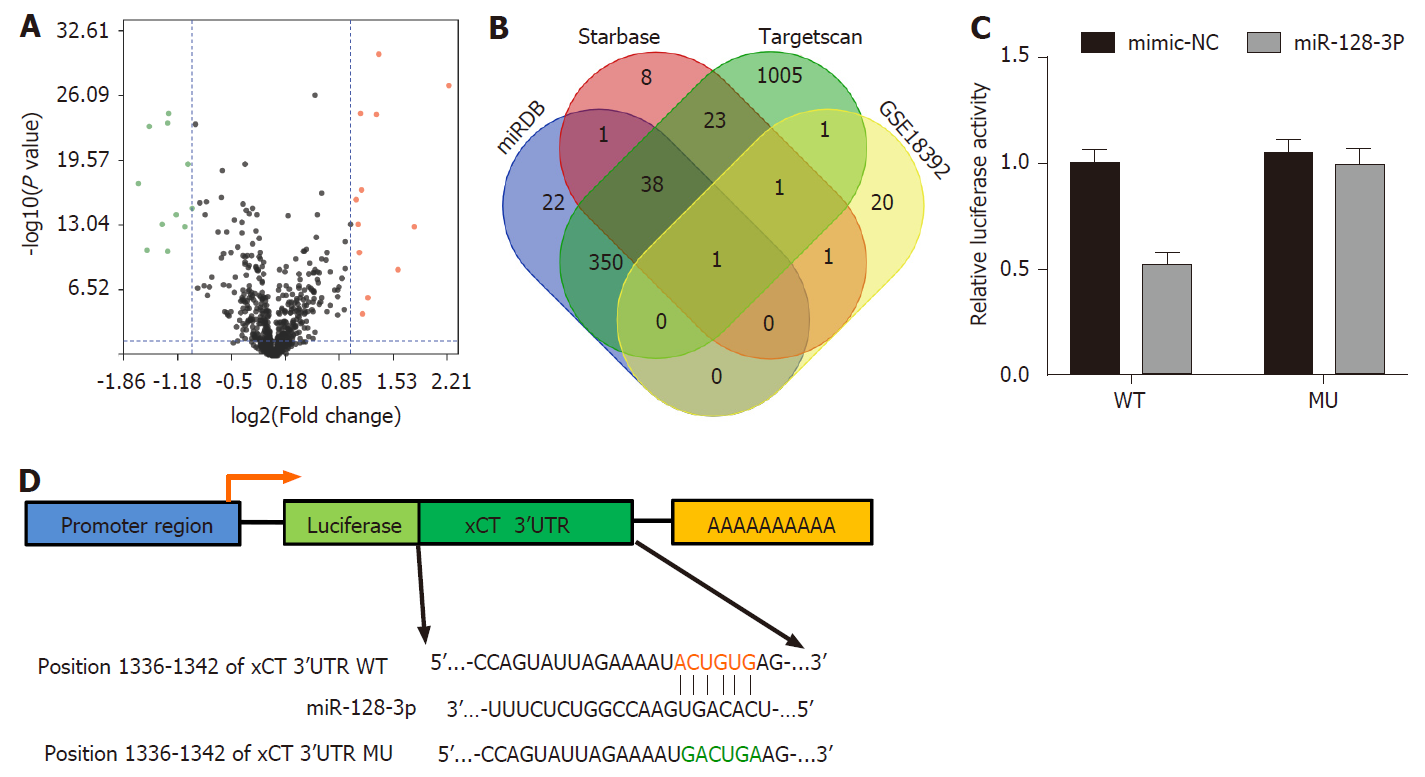
在GSE18392数据集中筛选出结直肠癌 vs 癌旁组织中差异表达microRNA 24个(图4A). miRNA靶基因预测软件miRDB, targetscan及StarBase预测xCT上游靶基因, 同时与GSE18392差异表达基因重合的miRNA为miR-128-3p(图4B). 荧光素酶报告基因显示, miR-128-3p可靶向结合xCT基因3'UTR区域(图4C), 结合位点序列如图4D所示.
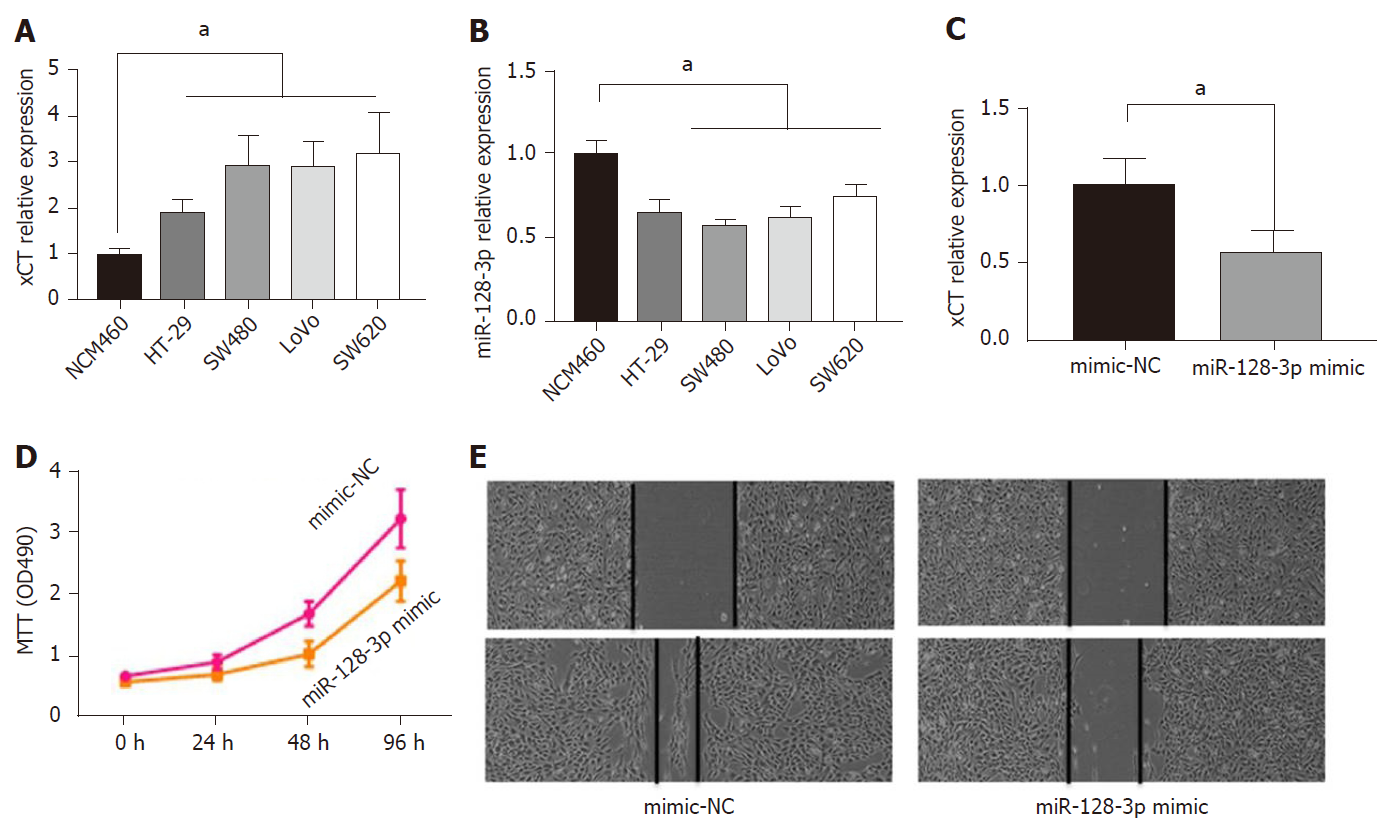
xCT在人结直肠癌细胞系(HT-29, SW480, LoVo及SW620)中的表达水平显著高于正常结肠上皮细胞(NCM460), 且有统计学差异(P<0.05), 图5A; miR-128-3p在人结直肠癌细胞系中(HT-29, SW480, LoVo及SW620)的表达水平显著低于正常结肠上皮细胞(NCM460), 且有统计学差异(P<0.05), 图5B; 外源性miR-128-3p mimic可显著下调SW480细胞中xCT表达水平, 图5C; miR-128-3p mimic抑制SW480细胞xCT表达后, 细胞增殖能力及细胞迁移能力减低, 图5D, E.
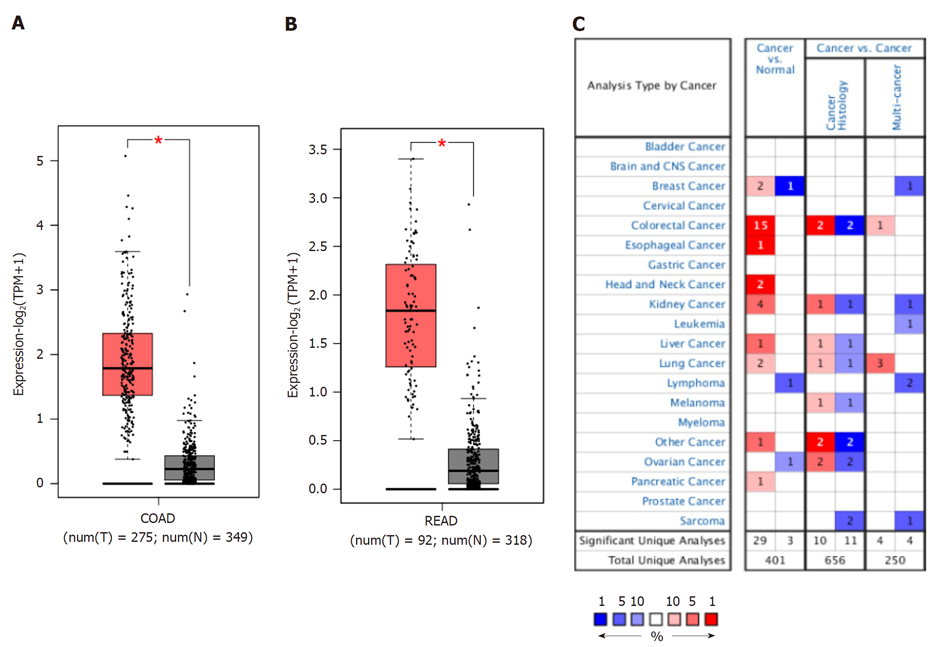
xCT在38例结直肠癌患者癌组织中的表达水平显著高于癌旁组织(P<0.05), 图6A, 而miR-128-3p在癌组织中相对表达水平显著低于癌旁组织(P<0.05), 图6B. 癌组织中miR-128-3p与xCT表达负相关(rpearson = -0.43, P<0.05), 图6C.
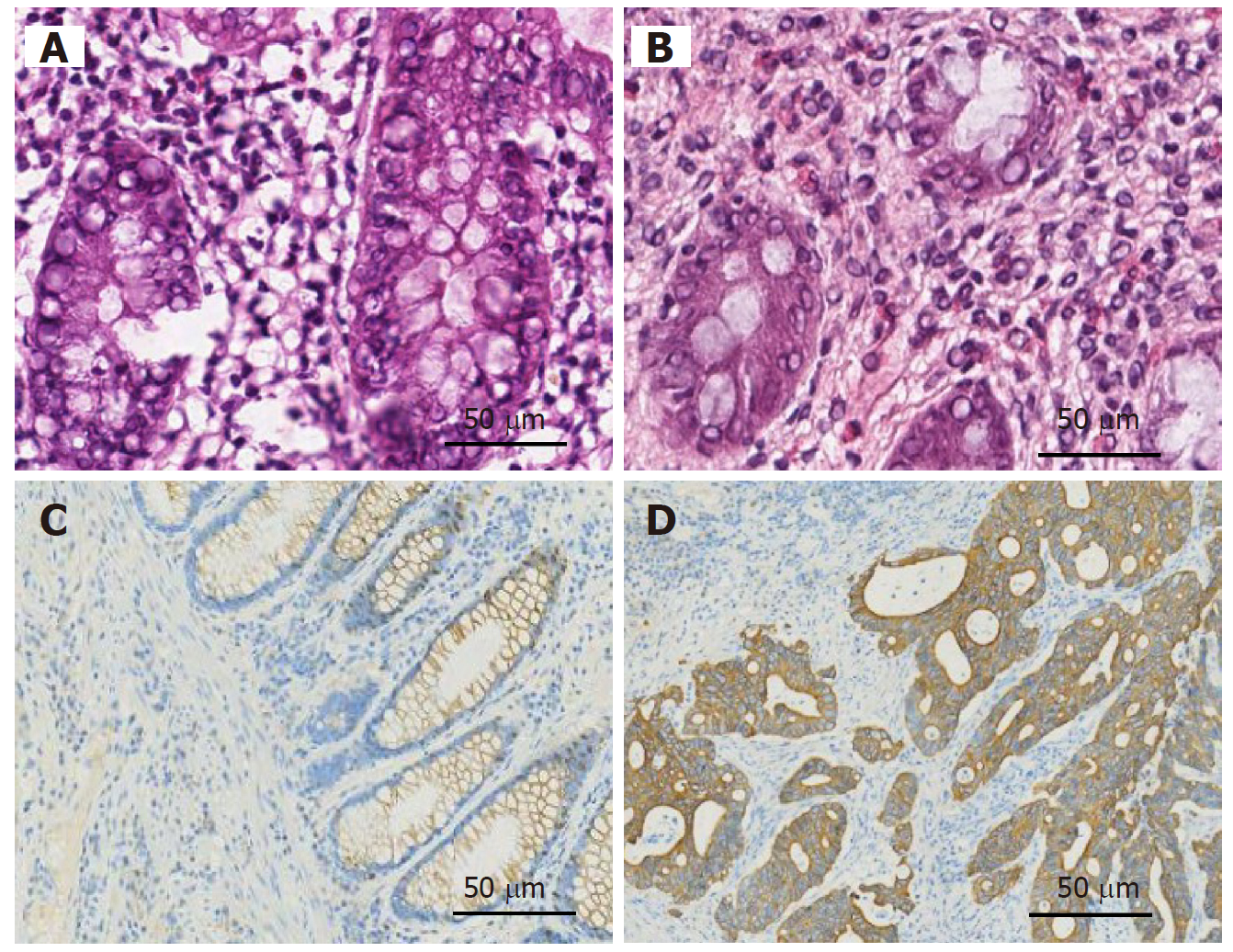
免疫组化显示xCT阳性表达于细胞膜, 呈棕黄色颗粒(图7). 38例结直肠癌组织中xCT阳性表达者24例(63.2%), 阴性表达者14例(36.8%). xCT阳性表达与肿瘤分化(P<0.05)和脉管浸润(P<0.05)有关, 表1.
| 特征 | 病例数(n = 38) | xCT | χ2 | P | |
| 阳性(n = 24) | 阴性(n = 14) | ||||
| 年龄(岁) | 0.18 | 0.67 | |||
| ≥65 | 20 | 12 | 8 | ||
| <65 | 18 | 12 | 6 | ||
| 性别 | 0.37 | 0.54 | |||
| 男 | 22 | 13 | 9 | ||
| 女 | 16 | 11 | 5 | ||
| 肿瘤类型 | 0.25 | 0.61 | |||
| 结肠癌 | 17 | 10 | 7 | ||
| 直肠癌 | 21 | 14 | 7 | ||
| 肿瘤分化 | 8.84 | 0.01 | |||
| 高 | 12 | 8 | 4 | ||
| 中 | 17 | 7 | 10 | ||
| 低 | 9 | 9 | 0 | ||
| 浸润深度 | 4.32 | 0.12 | |||
| T2 | 12 | 6 | 6 | ||
| T3 | 23 | 18 | 5 | ||
| T4 | 3 | 1 | 2 | ||
| 肿瘤直径 | 0.61 | 0.43 | |||
| ≥5cm | 27 | 16 | 11 | ||
| <5cm | 11 | 8 | 3 | ||
| 血管侵犯 | 4.15 | 0.04 | |||
| 阳性 | 6 | 6 | 0 | ||
| 阴性 | 32 | 18 | 14 | ||
xCT表达水平与结肠癌CD8+T细胞, 中性粒细胞, 树突状细胞浸润有关(P<0.05), 与直肠癌CD8+T细胞和中性粒细胞浸润有关(P<0.05), 而于其他淋巴细胞浸润水平无关(P>0.05), 图8.
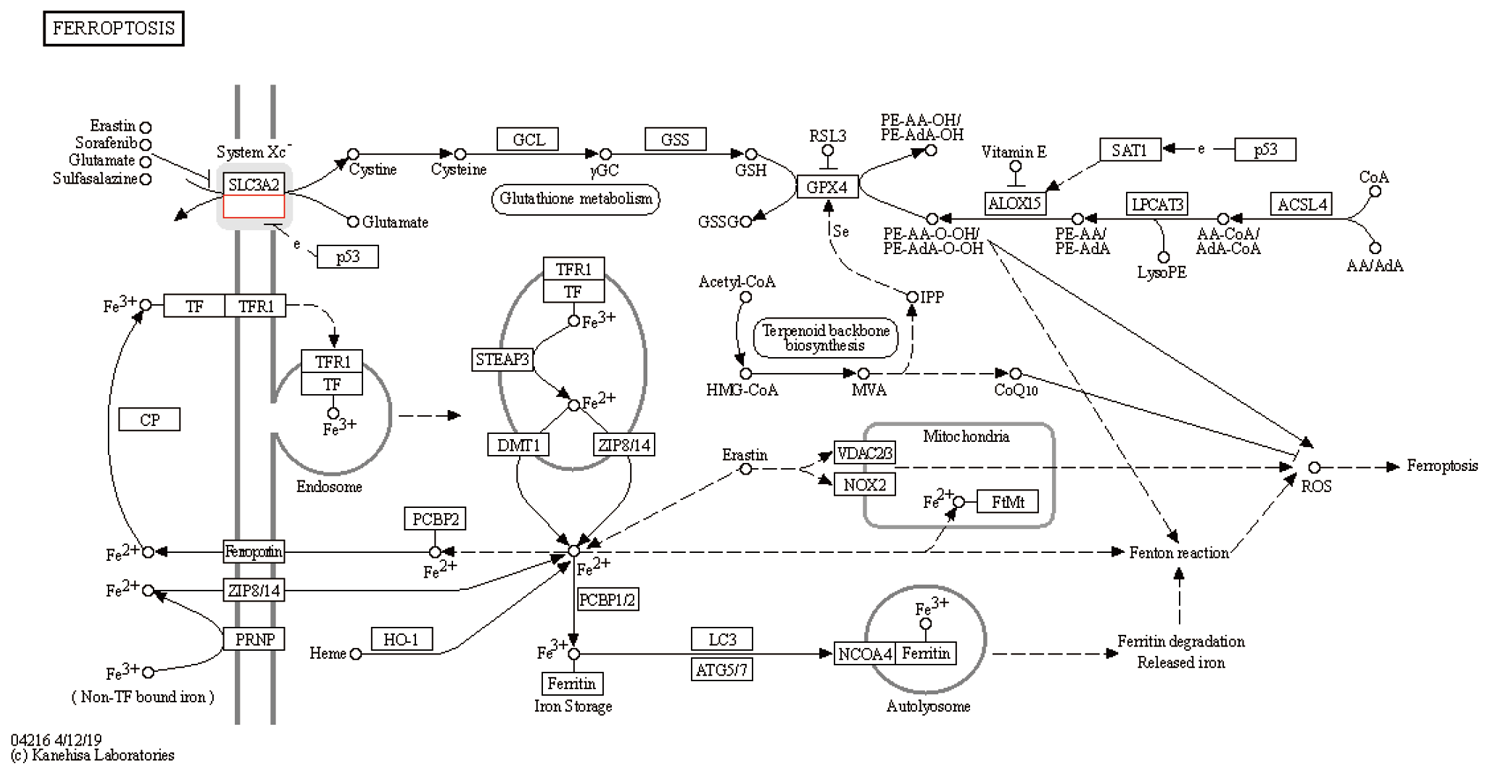
xCT参与的铁死亡是一种细胞死亡的调节形式, 其特征是由铁的积累和脂质过氧化产生活性氧(reactive oxygen species, ROS).在癌细胞和某些正常细胞中可由erastin、RSL3或临床药物如柳氮磺胺吡啶、索拉非尼诱导. xCT参与多种生理和病理过程, 如癌细胞死亡、神经退行性疾病、组织损伤和急性肾功能衰, 图9.
铁死亡(Ferroptosis)是近年来新发现的一种细胞死亡方式, 一种依赖于铁的程序性细胞死亡, 以脂质过氧化物的积累为特征. 铁死亡与细胞内的氧化还原稳态失衡相关.与凋亡、坏死等传统的死亡方式不同, 细胞内游离铁增多和脂质过氧化是铁死亡独特的代谢特征[12,13]. 已有诸多文献表明, 相对于人体正常体细胞, 肿瘤细胞往往需要更多的铁来维持自身的生长和增殖, 该特征导致肿瘤细胞对于铁死亡更加敏[14]. 铁死亡是由谷胱甘肽依赖性抗氧系统的失效引起的, 进而导致失控的脂质过氧化和最终的细胞死亡.尽管铁与脂质过氧化之间的联系多年来一直受到重视, 但直到2012年Brent Stockwell和Scott J. Dixon才发明了"铁死亡"一词用以描述不同于细胞凋亡的另一种细胞死亡过程[15].
xCT基因是目前已知的参与铁死亡的相关基因. 该基因定位于人体4q28.3, 编码一种胱氨酸-谷氨酸逆向转运蛋白, 该蛋白依赖于氯离子, 称为系统Xc-或xCT[16]. xCT是一个非钠离子依赖的异二聚体阴离子氨基酸转运系统的成员, 对胱氨酸和谷氨酸具有高度特异性. 这种逆向转运蛋白进口胱氨酸和出口谷氨酸, 这两种氨基酸. 逆向转运器的功能是一对一的逆向转运, 即一种物质在跨膜转运的同时, 另一种物质以相反的方向跨膜转运. 这种蛋白质的结构包括两条链: 一条特定的轻链xCT和一条重链4F2, 它们通过二硫键连接. xCT链有12个跨膜结构域, 由501个氨基酸组成, 4F2链在转运蛋白中高度保守(图10). 它通过刺激突触外受体来调节突触活动, 并释放谷氨酸. 该基因在星形胶质细胞中高度表达, 并将胱氨酸的摄取与谷氨酸的释放结合起来. xCT是构成System Xc-的底物特异性亚基, 负责将胱氨酸从细胞外运输到细胞内. 当细胞处于氧化应激和半胱氨酸缺乏的情况时, 核因子红细胞2相关因子2和转录因子4可诱导XCT的表达. 研究发现xCT在肿瘤组织中高表达, 并且xCT的高表达可以抑制ROS诱导的铁死亡[17]. 抑制细胞外胱氨酸进入细胞导致细胞内谷胱甘肽水平降低, 从而导致铁死亡. 从结构上看, xCT可能是上述Xc-系统维持正常运作的主要决定因素.
目前已有文献证实xCT在人体多种肿瘤组织中呈现高表达, 并与某些生物学行为如侵袭转移有关(表2)[9-11,18-21]. Timmerma及其同事分析乳腺癌细胞中xCT表达及其与患者预后关系发现, xCT在乳腺癌组织及细胞系中呈现高表达, 并与患者的预后不良有关[22]. Sugano[18]对304例结直肠癌患者的组织标本中xCT的表达水平进行了分析, 免疫组化结果发现68.4%(208例)的结直肠癌患者肿瘤组织中xCT蛋白呈现阳性表达, 并且阳性表达患者术后复发风险显著高于无表达者. 同时, 细胞实验也显示, 在恶性黑色素瘤细胞中过表达xCT后细胞增殖和迁移能力增强[21]. 上述研究均提示xCT在肿瘤中往往高表达, 并与细胞的增殖和侵袭有关. 同时, 高表达往往提示肿瘤患者预后不良. 然而, xCT上游靶向调控基因并不清楚.
在我们的研究中, 我们从生物信息学分析入手, 在生物信息数据库、细胞试验和组织标本方面探讨了xCT及其上游调控基因信号通路, 探讨了相关分子机制和对细胞生物学功能的影响. 结果miR-128-3p可与xCT基因3'UTR靶向结合并抑制其表达, 从而影响肠癌细胞的增殖和迁移等生物学行为. 这一发现丰富了xCT基因的生物学功能及调控信号通路, 同时为以miR-128-3p/xCT通路相关的靶向治疗药物研发提供了思路, 也丰富了铁死亡的相关研究内容.
结直肠癌(colorectal carcinoma, CRC)临床上较为常见, 但其发生、发展和侵袭转移的确切分子机制仍不清. 近年来铁死亡在肠癌生物学功能分子机制研究研究中日益受到关注. 铁死亡是由谷胱甘肽依赖性抗氧化功能下降或缺失引起的, 导致不受控制的脂质过氧化和最终的细胞死亡谷氨酸反转运体X(cystine/glutamate antiporter, xCT)可通过介导胱氨酸摄取和谷氨酸释放促进谷胱甘肽的合成, 保护细胞免受氧化应激, 维持细胞的氧化还原平衡, 阻止脂质过氧化诱导的细胞死亡. xCT被证实在多种肿瘤中高表达并与细胞的铁死亡有关.
通过生物信息学检索相关数据库、细胞分子实验及临床组织标本探讨xCT在人多种肿瘤和结直肠癌中的表达, 分析xCT基因上游靶基因及其抑制结直肠癌细胞增殖、侵袭的分子机制.
探讨xCT基因在结直肠癌中的表达情况, 筛选出xCT基因上游靶基因及其调控的信号通路及分子机制, 评估xCT表达与结直肠癌患者临床病例特征关系.
首先采用生物信息分析方法比较xCT基因在人结直肠癌及多种实体肿瘤中的表达及其与淋巴细胞浸润程度关系. 筛序结直肠癌组织与癌旁组织差异表达miRNA并预测靶基为miR-128-3p. 并采用双荧光素酶报告实验验证miR-128-3p与xCT靶向调控关系. 细胞学实验验证miR-128-3p与xCT的靶向关系及其对细胞生物学功能的影响. 免疫组织化学发评价xCT蛋白表达水平及其与结直肠癌患者临床病理特征关系.
结直肠癌组织xCT表达水平显著增高. miR-128-3p可靶向结合xCT基因3'UTR区域并抑制SW480细胞增殖和迁移能力. xCT在结直肠癌患者癌组织中的表达水平显著高于癌旁组织(P<0.05), 而miR-128-3p在癌组织中相对表达水平显著低于癌旁组织(P<0.05). 癌组织中miR-128-3p与xCT表达负相关(rpearson = -0.43, P<0.05). xCT阳性表达与肿瘤分化和脉管浸润有关. xCT表达水平与结肠癌CD8+T细胞, 中性粒细胞, 树突状细胞浸润有关(P<0.05), 与直肠癌CD8+T细胞和中性粒细胞浸润有关(P<0.05).
xCT在结直肠癌中表达水平明显升高, miR-128-3p可靶向抑制xCT基因表达从而抑制肠癌细胞的增殖和迁移, miR-128-3p/xCT通路为肠癌靶向药物的研发提供了新的思路.
小干扰RNA miR-128-3p可靶向调控xCT表达并影响肠癌细胞的生物学功能. 抑制结直肠癌miR-128-3p/xCT信号通路可能是肠癌靶向治疗的新靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 2. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019;69:7-34. [PubMed] [DOI] |
| 4. | Wang Y, Wei Z, Pan K, Li J, Chen Q. The function and mechanism of ferroptosis in cancer. Apoptosis. 2020;25:786-798. [PubMed] [DOI] |
| 5. | Elgendy SM, Alyammahi SK, Alhamad DW, Abdin SM, Omar HA. Ferroptosis: An emerging approach for targeting cancer stem cells and drug resistance. Crit Rev Oncol Hematol. 2020;155:103095. [PubMed] [DOI] |
| 6. | Wu Y, Yu C, Luo M, Cen C, Qiu J, Zhang S, Hu K. Ferroptosis in Cancer Treatment: Another Way to Rome. Front Oncol. 2020;10:571127. [PubMed] [DOI] |
| 7. | Chen X, Yu C, Kang R, Tang D. Iron Metabolism in Ferroptosis. Front Cell Dev Biol. 2020;8:590226. [PubMed] [DOI] |
| 8. | Choi J, Li W, Schindell B, Ni L, Liu S, Zhao X, Gong J, Nyachoti M, Yang C. Molecular cloning, tissue distribution and the expression of cystine/glutamate exchanger (xCT, SLC7A11) in different tissues during development in broiler chickens. Anim Nutr. 2020;6:107-114. [PubMed] [DOI] |
| 9. | Ji X, Qian J, Rahman SMJ, Siska PJ, Zou Y, Harris BK, Hoeksema MD, Trenary IA, Heidi C, Eisenberg R, Rathmell JC, Young JD, Massion PP. xCT (SLC7A11)-mediated metabolic reprogramming promotes non-small cell lung cancer progression. Oncogene. 2018;37:5007-5019. [PubMed] [DOI] |
| 10. | Zhong W, Weiss HL, Jayswal RD, Hensley PJ, Downes LM, St Clair DK, Chaiswing L. Extracellular redox state shift: A novel approach to target prostate cancer invasion. Free Radic Biol Med. 2018;117:99-109. [PubMed] [DOI] |
| 11. | Lanzardo S, Conti L, Rooke R, Ruiu R, Accart N, Bolli E, Arigoni M, Macagno M, Barrera G, Pizzimenti S, Aurisicchio L, Calogero RA, Cavallo F. Immunotargeting of Antigen xCT Attenuates Stem-like Cell Behavior and Metastatic Progression in Breast Cancer. Cancer Res. 2016;76:62-72. [PubMed] [DOI] |
| 12. | Zheng J, Conrad M. The Metabolic Underpinnings of Ferroptosis. Cell Metab. 2020;32:920-937. [PubMed] [DOI] |
| 13. | Reichert CO, de Freitas FA, Sampaio-Silva J, Rokita-Rosa L, Barros PL, Levy D, Bydlowski SP. Ferroptosis Mechanisms Involved in Neurodegenerative Diseases. Int J Mol Sci. 2020;21. [PubMed] [DOI] |
| 14. | Čepelak I, Dodig S, Dodig DČ. Ferroptosis: regulated cell death. Arh Hig Rada Toksikol. 2020;71:99-109. [PubMed] [DOI] |
| 15. | Dixon SJ, Lemberg KM, Lamprecht MR, Skouta R, Zaitsev EM, Gleason CE, Patel DN, Bauer AJ, Cantley AM, Yang WS, Morrison B, Stockwell BR. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 2012;149:1060-1072. [PubMed] [DOI] |
| 16. | Liu J, Xia X, Huang P. xCT: A Critical Molecule That Links Cancer Metabolism to Redox Signaling. Mol Ther. 2020;28:2358-2366. [PubMed] [DOI] |
| 17. | Wang SF, Chen MS, Chou YC, Ueng YF, Yin PH, Yeh TS, Lee HC. Mitochondrial dysfunction enhances cisplatin resistance in human gastric cancer cells via the ROS-activated GCN2-eIF2α-ATF4-xCT pathway. Oncotarget. 2016;7:74132-74151. [PubMed] [DOI] |
| 18. | Sugano K, Maeda K, Ohtani H, Nagahara H, Shibutani M, Hirakawa K. Expression of xCT as a predictor of disease recurrence in patients with colorectal cancer. Anticancer Res. 2015;35:677-682. [PubMed] [DOI] |
| 19. | Yin F, Yi S, Wei L, Zhao B, Li J, Cai X, Dong C, Liu X. Microarray-based identification of genes associated with prognosis and drug resistance in ovarian cancer. J Cell Biochem. 2019;120:6057-6070. [PubMed] [DOI] |
| 20. | Polewski MD, Reveron-Thornton RF, Cherryholmes GA, Marinov GK, Aboody KS. SLC7A11 Overexpression in Glioblastoma Is Associated with Increased Cancer Stem Cell-Like Properties. Stem Cells Dev. 2017;26:1236-1246. [PubMed] [DOI] |
| 21. | Shin SS, Jeong BS, Wall BA, Li J, Shan NL, Wen Y, Goydos JS, Chen S. Participation of xCT in melanoma cell proliferation in vitro and tumorigenesis in vivo. Oncogenesis. 2018;7:86. [PubMed] [DOI] |
| 22. | Timmerman LA, Holton T, Yuneva M, Louie RJ, Padró M, Daemen A, Hu M, Chan DA, Ethier SP, van 't Veer LJ, Polyak K, McCormick F, Gray JW. Glutamine sensitivity analysis identifies the xCT antiporter as a common triple-negative breast tumor therapeutic target. Cancer Cell. 2013;24:450-465. [PubMed] [DOI] |