修回日期: 2020-03-11
接受日期: 2020-03-15
在线出版日期: 2020-03-28
胃癌(gastric cancer, GC)已成为威胁人类生命安全的恶性肿瘤之一, 目前GC发生及发展的分子机制尚未完全阐明, 长链非编码RNA(long-chain noncoding RNA, lncRNA)在肿瘤中异常表达并可能参与肿瘤发生及发展过程, 但仍有部分lncRNA在GC发生及转移过程中的调控作用尚未阐明.
探讨lncRNA KCNQ1重叠转录物1(KCNQ1 opposite strand/antisense transcript 1, KCNQ1OT1)对HGC-27细胞增殖、侵袭、迁移和顺铂敏感性的影响.
将转染KCNQ1OT1-siRNA的HGC-27细胞作为KCNQ1OT1-siRNA组, 转染阴性对照的HGC-27细胞作为NC-siRNA组, 正常培养的细胞作为对照组. 顺铂处理KCNQ1OT1-siRNA组、NC-siRNA组细胞后, 采用细胞计数试剂盒法检测细胞活力并计算细胞的半数抑制浓度(half- maximal inhibitory concentration, IC50)值. 采用实时荧光定量聚合酶链式反应、Transwell小室、流式细胞仪和免疫印迹法分别检测KCNQ1OT1表达水平、细胞增殖活力、侵袭与迁移、周期分布和细胞中上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、P-糖蛋白(P-glycoprotein, P-gp)、多药耐药关联蛋白1(multidrug resistance associated protein 1, MRP1)表达情况.
与对照组比较, NC-siRNA组中各指标差异无统计学意义(P>0.05); 与对照组或NC-siRNA组比较, KCNQ1OT1-siRNA组细胞中KCNQ1OT1表达水平、细胞在S期与G2/M期所占百分比和细胞增殖、侵袭、迁移能力以及细胞中N-cadherin、Vimentin蛋白表达水平均明显降低, 而细胞在G0/G1期所占百分比和E-cadherin蛋白表达水平明显升高(P<0.05); 与NC-siRNA组比较, KCNQ1OT1-siRNA组P-gp蛋白水平显著降低(P<0.05), MRP1蛋白水平显著升高(P<0.05), IC50值明显降低(P<0.05).
下调KCNQ1OT1表达可抑制HGC-27细胞增殖、侵袭、迁移并增强细胞对顺铂的敏感性.
核心提要: 本研究首次证实KCNQ1OT1在胃癌(gastric cancer, GC)细胞中呈高表达, 抑制KCNQ1OT1表达可抑制GC细胞增殖、迁移及侵袭, 还可增强顺铂敏感性.
引文著录: 王亮, 张龙, 石伟. 下调长链非编码RNA KCNQ1重叠转录物1表达对胃癌HGC-27细胞生长和顺铂敏感性的影响. 世界华人消化杂志 2020; 28(6): 210-216
Revised: March 11, 2020
Accepted: March 15, 2020
Published online: March 28, 2020
Gastric cancer (GC) had become one of the malignant tumors that threaten the safety of human life. At present, the molecular mechanism of the occurrence and development of GC has not been fully elucidated. The regulatory role of long-chain noncoding RNAs in these processes has not yet been elucidated.
To investigate the effect of KCNQ1 overlapping transcript 1 (KCNQ1OT1) on the proliferation, invasion, migration, and cisplatin sensitivity of HGC-27 cells.
HCN-27 cells transfected with KCNQ1OT1-siRNA were used as a KCNQ1OT1-siRNA group, HGC-27 cells transfected with negative control siRNA were used as an NC-siRNA group, and normally cultured cells were used as a control group. After treatment of cells in the KCNQ1OT1-siRNA group and NC-siRNA group with cisplatin, cell viability was measured by Cell Counting Kit-8 assay, and the half-maximal inhibitory concentration (IC50) was calculated. Real-time quantitative polymerase chain reaction, Transwell assay, flow cytometry, and Western blot were used to detect KCNQ1OT1 expression level, cell proliferation, invasion, and migration, cycle distribution, and the expression of E-cadherin, N-cadherin, Vimentin, P-glycoprotein (P-gp), and multidrug resistance associated protein 1 (MRP1), respectively.
Compared with the control group, there was no significant change in the indexes in the NC-siRNA group (P > 0.05). Compared with the control group or NC-siRNA group, the expression level of KCNQ1OT1, the percentages of cells in S phase and G2/M phase, the ability of cell proliferation, invasion, and migration, and the expression levels of N-cadherin and Vimentin in cells of the KCNQ1OT1-siRNA group were significantly reduced, while the percentage of cells in G0/G1 phase was significantly reduced (P > 0.05). Compared with the NC-siRNA group, the protein levels of P-gp and MRP1 in the KCNQ1OT1-siRNA group were significantly reduced (P < 0.05), and the IC50 was significantly reduced (P < 0.05).
KCNQ1OT1 knockdown can inhibit the proliferation, invasion, and migration of HGC-27 cells and enhance their sensitivity to cisplatin.
- Citation: Wang L, Zhang L, Shi W. Effect of knockdown of long-chain noncoding RNA KCNQ1 overlapping transcript 1 on growth and cisplatin sensitivity of HGC-27 cells. Shijie Huaren Xiaohua Zazhi 2020; 28(6): 210-216
- URL: https://www.wjgnet.com/1009-3079/full/v28/i6/210.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i6.210
胃癌(gastric cancer, GC)是一种临床常见的消化系统肿瘤, 在全世界仍然是一个相当大的健康负担[1]. 尽管, 我国GC的发病率已趋于平稳, 但总发病人数还在不断增加[2]. 目前, 以铂类药物为基础的化疗仍是GC中晚期患者常用的治疗手段, 但化疗药物的长期或不规范使用会产生耐药抵抗, 导致治疗效果不太理想[3]. 因此, 深入探讨GC发生发展的分子机制, 寻找有效提高肿瘤细胞对铂类化疗药物敏感性的方法具有重要意义. 越来越多的研究[4-6]显示, 长链非编码RNA(long non-coding RNA, lncRNA)可通过调控基因表达在GC发生发展和耐药形成过程中发挥着重要作用. lncRNA KCNQ1重叠转录物1(KCNQ1 overlapping transcript 1, KCNQ1OT1)定位于人11p15.5染色体上, 是KCNQ1的反义链转录物, 被报道与结直肠癌和卵巢癌等肿瘤恶性进展和顺铂耐药密切相关[7,8]. 有学者[9,10]指出, 在GC组织和细胞中KCNQ1OT1表达上调, 且高表达KCNQ1OT1与患者淋巴结转移和不良预后有关, 但其在GC中的作用并不清楚. 本研究通过观察下调KCNQ1OT1表达对HGC-27细胞增殖、侵袭、迁移和顺铂敏感性的影响, 旨在揭示KCNQ1OT1在GC发生发展中的作用, 以期为GC的治疗提供新线索.
HGC-27细胞(美国ATCC), 细胞计数试剂盒(cell counting kit-8, CCK-8)(北京百奥生物), RPMI-1640培养基(美国HyClone), 胎牛血清(杭州四季青), 细胞周期检测试剂盒和细胞凋亡检测试剂盒(江苏南京凯基), 顺铂(美国Sigma), 逆转录试剂盒、ECL发光液、BCA蛋白浓度测定试剂盒和SDS-PAGE配胶试剂盒(上海碧云天), 上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体和山羊抗兔或鼠HRP标记的IgG二抗(美国Santa Cruz), Trizol试剂和Lipofectamine 2000(美国Invitrogen), 靶向KCNQ1OT1的小干扰RNA KCNQ1OT1-siRNA(UGAGCGUAGCAUCGAGAGCGUACGUCGAUCGAC)及其阴性对照NC-siRNA(上海吉玛). Matrigel和FACSCalibur流式细胞仪(美国BD), Varioskan LUX多功能酶标仪(美国Thermo Fisher Scientific), Transwell小室(美国Corning), BB15二氧化碳细胞培养箱(美国Thermo), ProFlexTM聚合酶链式反应(polymerase chain reaction, PCR)仪(美国ABI), ChemiDoc MP凝胶成像分析系统(美国Bio-Rad).
1.2.1 细胞培养与处理: HGC-27细胞采用含10%胎牛血清的RPMI-1640培养基在37 ℃、5%二氧化碳细胞培养箱中常规培养. 将对数生长期的HGC-27细胞以每孔2×105个接种至6孔细胞板上后, 常规培养约至70%融合度时, 参照Lipofectamine 2000说明书步骤进行瞬时转染. 将转染KCNQ1OT1-siRNA的细胞作为KCNQ1OT1-siRNA组, 转染NC-siRNA的细胞作为NC-siRNA组, 以正常培养的细胞作为对照组. 转染5 h后更换新鲜培养基, 继续培养48 h后收集对照组、NC-siRNA组和KCNQ1OT1-siRNA组细胞并采用实时荧光定量PCR (real-time quantitative PCR, qRT-PCR)法检测各组细胞中KCNQ1OT1的表达水平以评价转染效果. 另外, 将转染KCNQ1OT1-siRNA后给予顺铂处理48 h的细胞, 通过CCK-8法检测细胞活力, 并计算细胞的半数抑制浓度(half- maximal inhibitory concentration, IC50)值[11].
1.2.2 qRT-PCR检测KCNQ1OT1表达: 采用Trizol法提取HGC-27细胞总RNA后, 参照逆转录试剂盒说明书步骤将RNA反转录合成cDNA. 以cDNA为模板, 在20 μL反应体系下根据设定的PCR反应条件(94 ℃预变性3 min, 94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸30 s, 循环40次)上PCR仪进行扩增. 以GAPDH为管家基因, 采用2-△△Ct法计算HGC-27细胞中KCNQ1OT1的表达水平. 其中, 由上海生工生物工程合成的PCR引物序列如下: KCNQ1OT1上游: 5'-CCTCCCTCACTGAGCTTTGG-3', 下游: 5'-GTGCGGACCCTATACGGAAG-3'; GAPDH上游: 5'-GCTGCTGAGTATGTCGTGGAGT-3', 下游: 5'-AGTCTTCTGGGTGGCAGTGAT-3'.
1.2.3 CCK-8法检测细胞增殖: 收集转染48 h后的NC-siRNA组、KCNQ1OT1-siRNA组和对照组HGC-27细胞, 按照每孔105个接种至96孔细胞板上, 其中每组设置3个复孔; 置于细胞培养箱中常规培养24 h、48 h、72 h和96 h后, 弃培养液, 每孔加入10 μL CCK-8试剂孵育2 h. 采用酶标仪检测HGC-27细胞在450 nm处的吸光度(optical density, OD)值, 实验重复3次.
1.2.4 Transwell小室实验检测细胞侵袭和迁移: (1)侵袭实验: 将50 μL Matrigel均匀地铺在(浓度为500 ng/μL)Transwell小室内面上, 置于细胞培养箱内孵育4 h使其凝固. 向24孔细胞板中每孔加入含血清培养基600 μL, 将Transwell小室放入24孔细胞板中, 并在小室上室中每孔加入200 μL细胞悬液(浓度为105个/mL); 放入培养箱内常规培养24 h后, 将小室取出. 以棉签小心拭去上室面残留的细胞后, 将小室放入4%多聚甲醛固定液中固定30 min; 再以0.1%结晶紫染色15 min后, 采用显微镜观察统计各组细胞的穿膜细胞数, 结果以随机选取的3个视野内细胞数的均值表示. 实验重复3次; (2)迁移实验: Transwell小室不需药使用Matrigel铺盖, 其余不同与侵袭实验相同.
1.2.5 流式细胞仪检测细胞周期: 收集转染48 h后的NC-siRNA组、KCNQ1OT1-siRNA组和对照组HGC-27细胞, 加入预冷的70%乙醇溶液在-20 ℃下孵育24 h. 弃上清后, 加入0.1 mL RNase(浓度5 μg/mL)和0.5 mL 碘化丙啶(propidium iodide, PI)(浓度50 μg/mL)于37 ℃下避光反应30 min. 采用流式细胞仪检测各组细胞周期分布情况.
1.2.6 免疫印迹法检测细胞中E-cadherin、N-cadherin、Vimentin、P-糖蛋白、多药耐药关联蛋白1蛋白表达: 将HGC-27细胞中加入细胞裂解液提取总蛋白后, 采用BCA法检测总蛋白的浓度与纯度. 将变性后的蛋白样品上样至SDS-PAGE凝胶中行电泳分离. 电泳结束后, 转PVDF膜. 以5%脱脂奶粉封膜2 h后, 加入E-cadherin(1:800)、N-cadherin(1:800)、Vimentin(1:1000)、P-gp(1:1000)、MRP1(1:1000)和GAPDH(1:1000)抗体于4 ℃下孵育24 h. 再以HRP标记的IgG二抗(1:5000)室温孵育2 h后, 加入ECL显影曝光. 以GAPDH为内参, 采用凝胶成像分析系统扫描分析HGC-27细胞中E-cadherin、N-cadherin和Vimentin蛋白的表达水平. 实验重复3次.
统计学处理 实验所得数据以mean±SD形式表示, 采用SPSS 22.0软件进行统计学分析, 多组间比较使用单因素方差分析, 组间多重比较采用SNK-q, 两组间比较采用独立样本t检验. P<0.05代表差异有统计学意义.
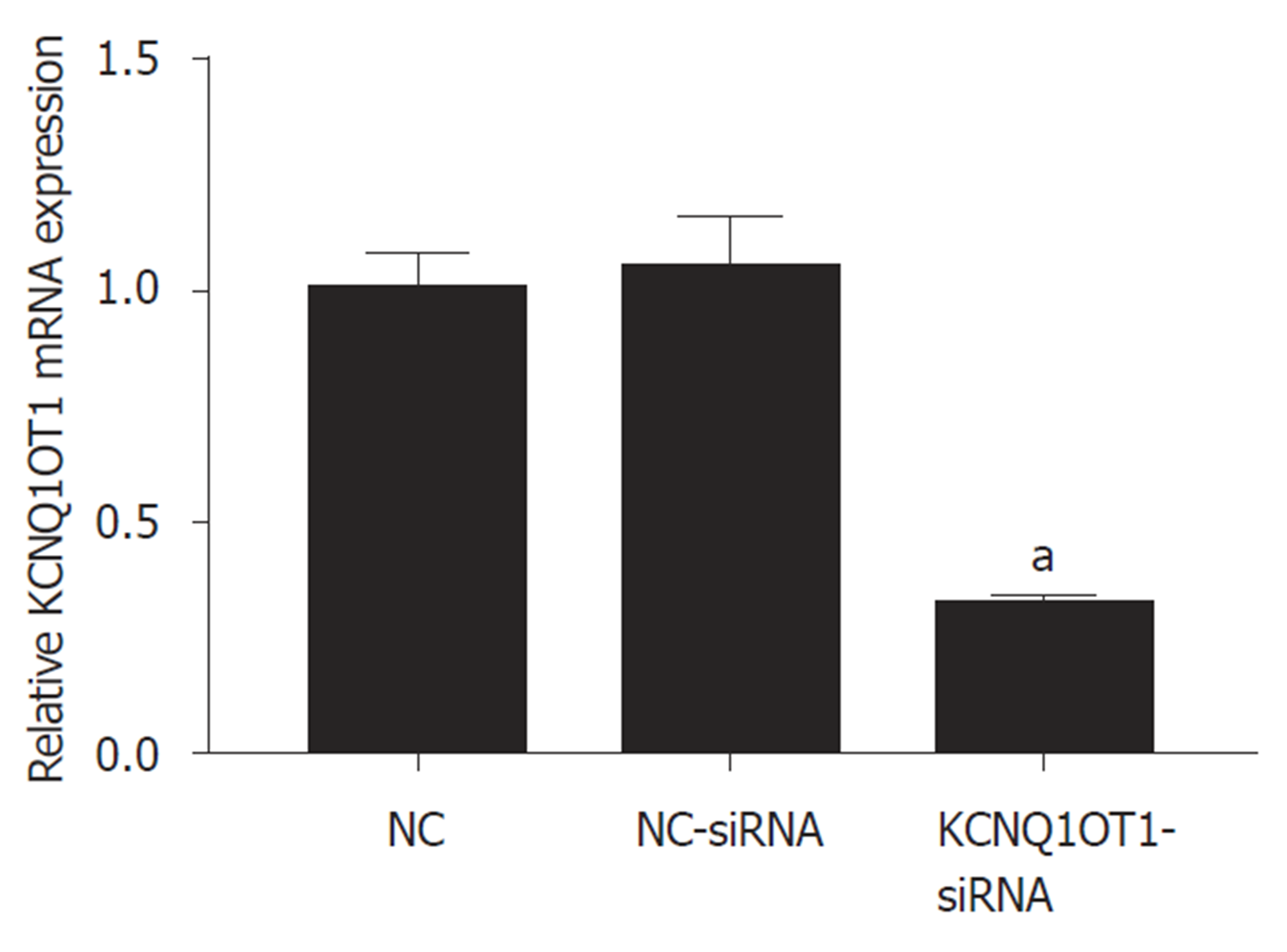
与对照组比较, NC-siRNA组细胞中KCNQ1OT1表达水平差异无统计学意义(P>0.05); 与NC-siRNA组或对照组比较, KCNQ1OT1-siRNA组细胞中KCNQ1OT1表达水平明显降低(P<0.05)(图1).
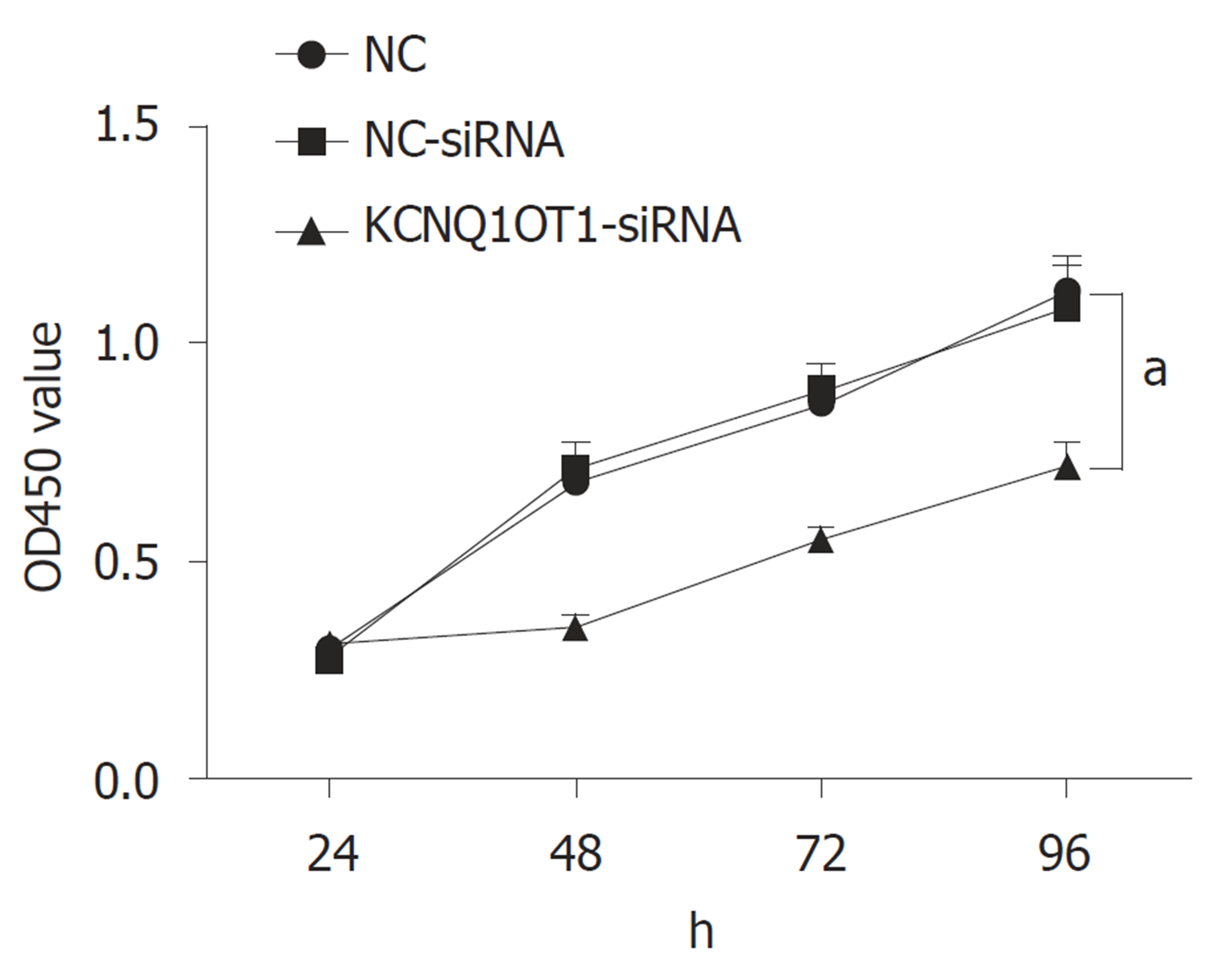
与对照组比较, NC-siRNA组细胞在转染后继续培养不同时间后增殖活力差异无统计学意义(P>0.05); 与对照组或NC-siRNA组比较, KCNQ1OT1-siRNA组细胞在转染后继续培养48 h、72 h和96 h后增殖活力明显降低(P<0.05)(图2).
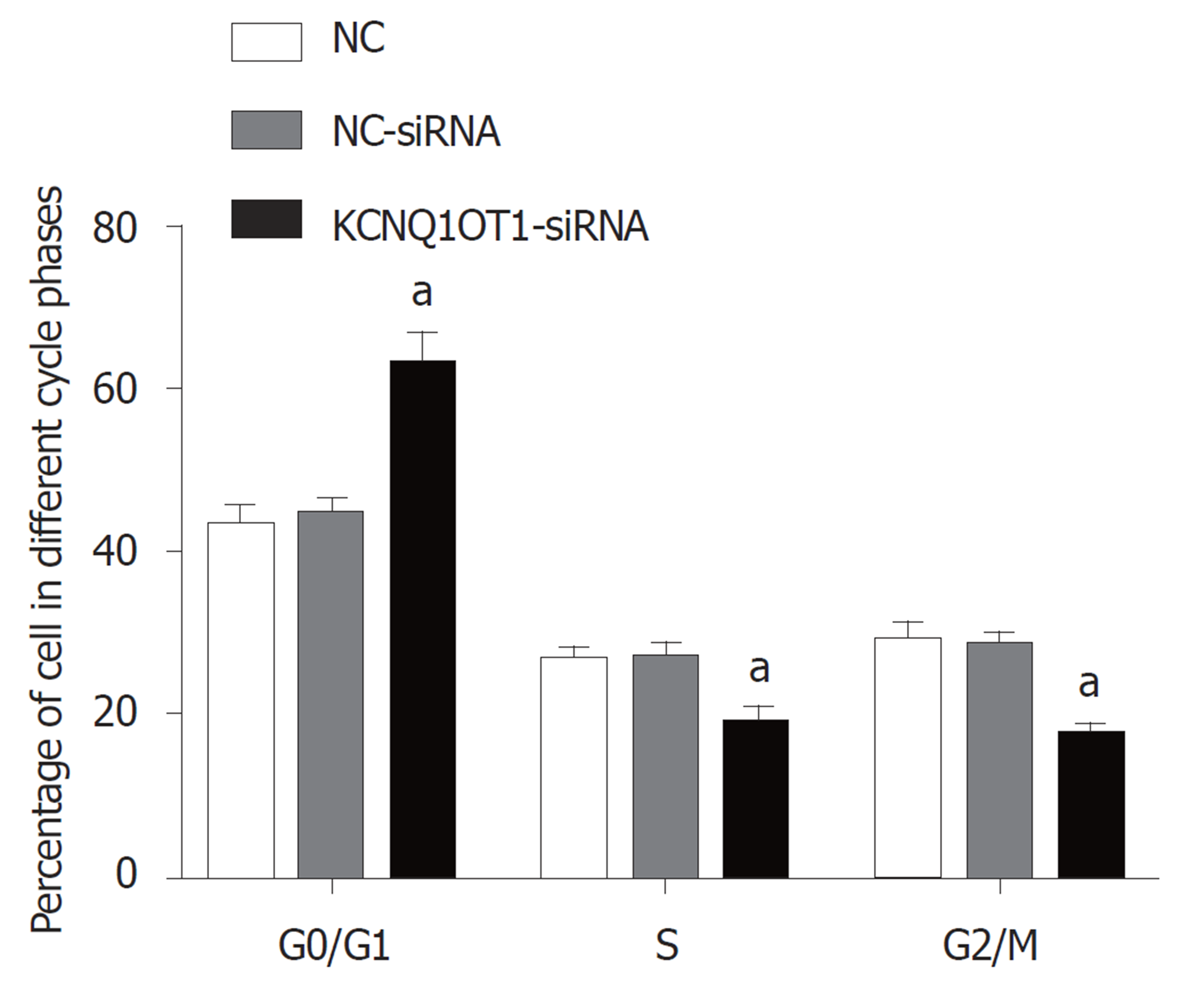
与对照组比较, NC-siRNA组细胞在G0/G1期、S期和G2/M期所占百分比差异均无统计学意义(P>0.05); 与对照组或NC-siRNA组比较, KCNQ1OT1-siRNA组细胞在G0/G1期所占百分比明显升高, 而在S期和G2/M期所占百分比明显降低(P<0.05)(图3).
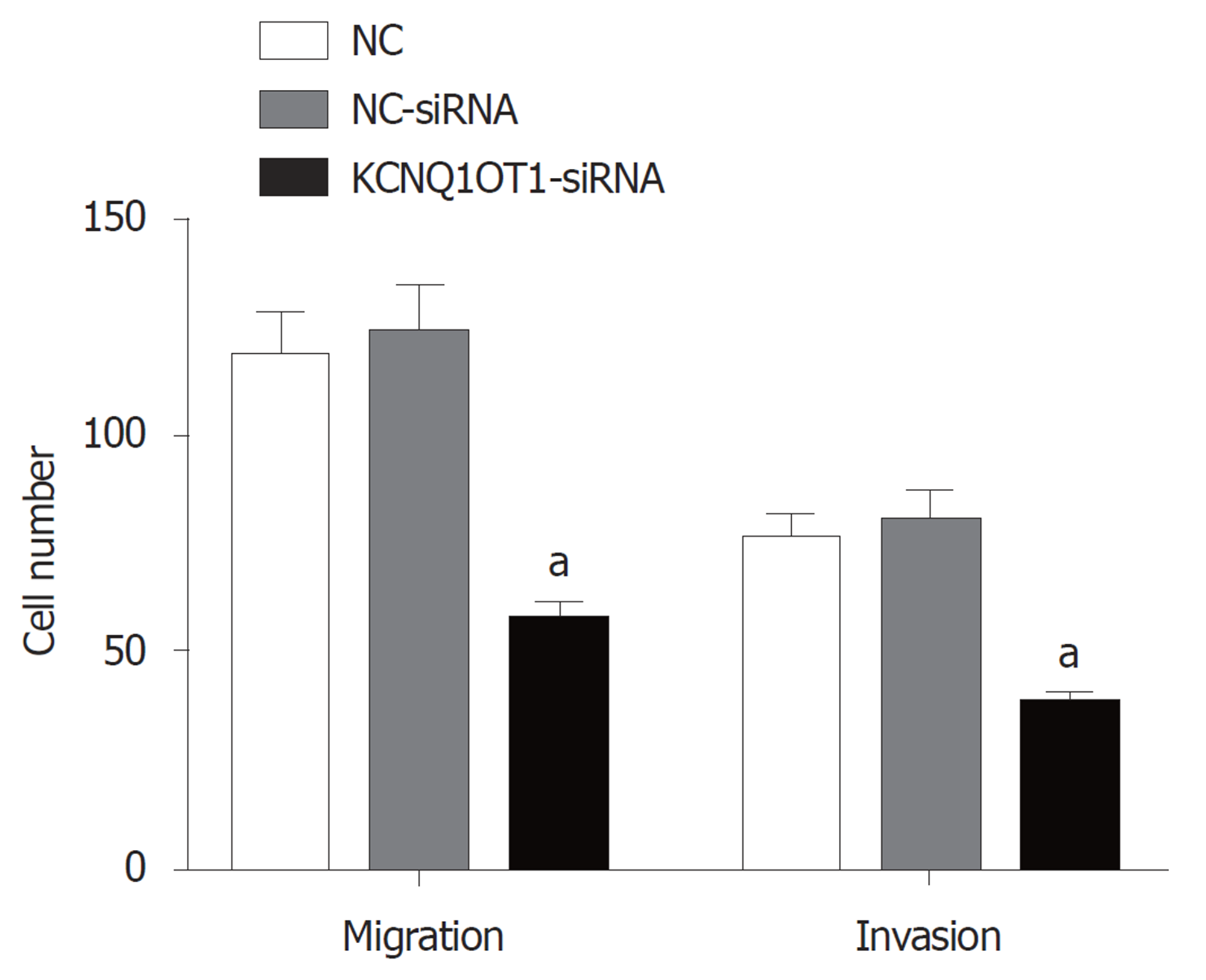
与对照组比较, NC-siRNA组细胞侵袭数目和迁移数目差异均无统计学意义(P>0.05); 与对照组或NC-siRNA组比较, KCNQ1OT1-siRNA组细胞侵袭数目和迁移数目均明显减少(P<0.05)(图4).
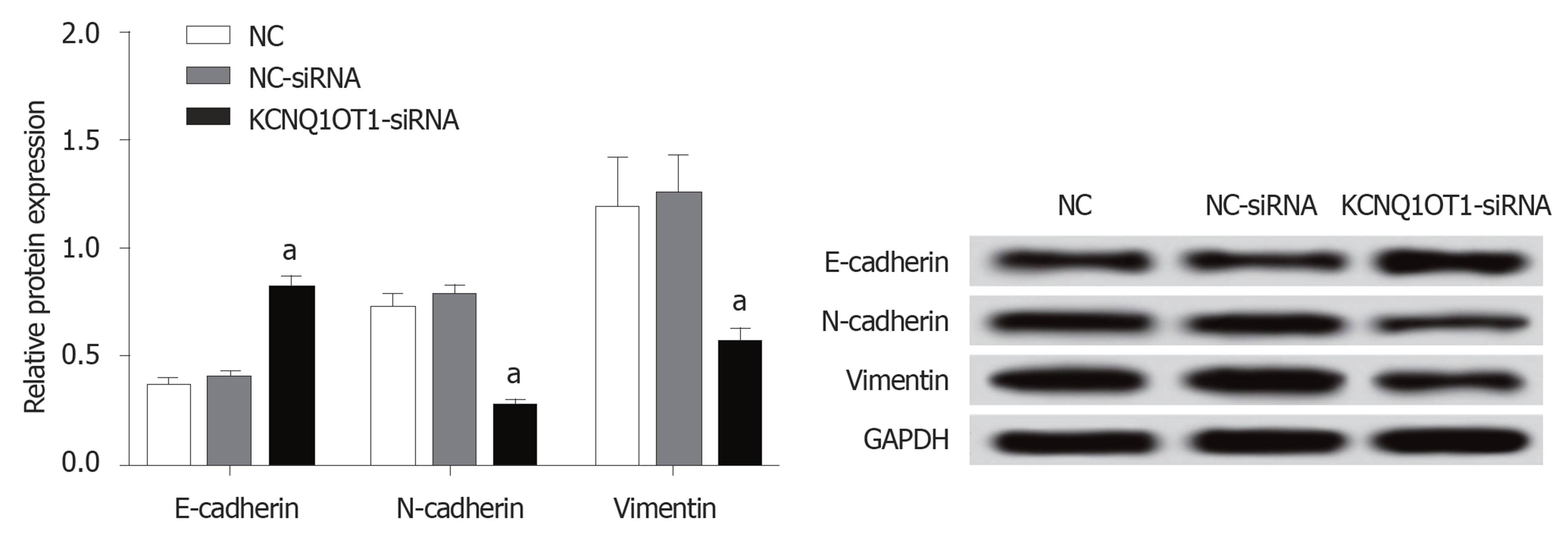
与对照组比较, NC-siRNA组细胞中上皮标志物E-cadherin和间质标志物N-cadherin、Vimentin蛋白的表达水平差异均无统计学意义(P>0.05); 与对照组或NC-siRNA组比较, KCNQ1OT1-siRNA组细胞中E-cadherin蛋白表达水平明显升高, 而N-cadherin、Vimentin蛋白表达水平明显降低(P<0.05)(图5).
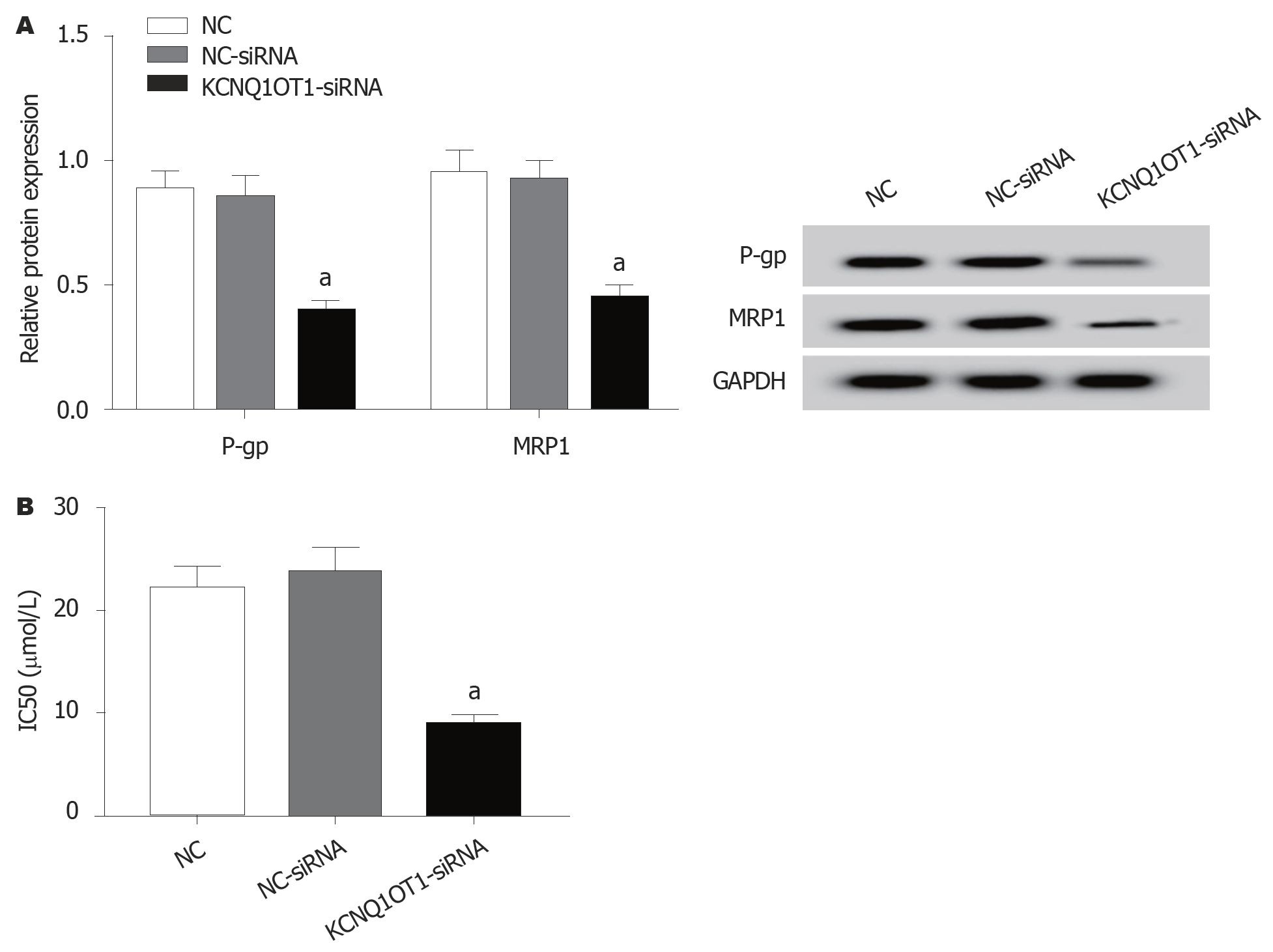
与NC-siRNA组比较, KCNQ1OT1-siRNA组P-gp蛋白水平显著降低(P<0.05), MRP1蛋白水平显著升高(P<0.05), IC50值明显降低(P<0.05)(图6).
lncRNA是一类可在表观遗传水平、转录和转录后水平调控基因表达的长链非编码RNA, 不具备编码蛋白的功能, 在维持基因稳定性和促进DNA修复等过程中发挥着重要作用[12]. 研究[13-15]显示, 在GC组织或细胞中存在异常表达的lncRNA, 并且这些lncRNA可通过调控细胞增殖、侵袭和凋亡等生物学行为参与GC的发生发展和耐药形成.
KCNQ1OT1是lncRNA成员, 其在肿瘤发生发展中的作用逐渐引起关注. KCNQ1OT1在结肠癌组织中表达上调, 且其表达水平与患者总生存期和无复发生存率缩短有关, 被认为是结肠癌独立预后指标[16]. 在膀胱癌中KCNQ1OT1发挥着原癌基因的作用, 敲低KCNQ1OT1表达可通过调控miR-145-5p/PCBP2轴抑制肿瘤细胞增殖、迁移并促进细胞凋亡[17]. 此外, KCNQ1OT1高表达还与肿瘤化疗耐药有关. 在抗奥沙利铂肝癌细胞KCNQ1OT1表达上调, 敲低KCNQ1OT1除了可通过调控miR-7-5p/ABCC1表达抑制肿瘤细胞增殖、侵袭和迁移外, 还可通过降低耐药基因MRP5、MDR1和LRP1表达降低肿瘤细胞对奥沙利铂的耐药抵抗[18]; KCNQ1OT1可通过靶向调控miR-211-5p表达促进舌鳞状细胞癌细胞增殖并抑制顺铂诱导的细胞凋亡, 而敲低其表达可挽救肿瘤细胞的顺铂抵抗, 被认为是舌鳞状细胞癌治疗的新靶点[19].
KCNQ1OT1在GC组织和细胞中呈现异常高表达, 且其表达水平的改变与患者不良预后密切相关, 但其在GC细胞生长和顺铂耐药抵抗中的作用并不清楚. GC的发生与发展是一个多因素、多阶段和多基因调控的复杂过程, 其中细胞周期失调导致的恶性增殖是GC发生发展的重要机制[20]. 本研究下调 KCNQ1OT1表达后发现, HGC-27细胞增殖能力明显减弱; 同时, HGC-27细胞在G0/G1期所占百分比明显升高, 在S期和G2/M期所占百分比明显减少. 结果表明, 下调KCNQ1OT1表达可通过诱导细胞周期阻滞于G0/G1期抑制GC细胞增殖. 此外, 侵袭转移是肿瘤发生发展的重要特征[21], 而上皮间质转化是上皮来源肿瘤细胞获得侵袭能力的重要环节, 与GC细胞浸润和转移密切相关[22-23]. 本研究发现, 下调 KCNQ1OT1表达还可使HGC-27细胞中上皮标志物E-cadherin蛋白表达升高, 而间质标志物N-cadherin和Vimentin蛋白表达降低, HGC-27细胞侵袭和迁移能力减弱. 结果表明, 下调KCNQ1OT1表达可通过抑制GC细胞上皮间质转化抑制癌细胞侵袭和迁移. 提示, KCNQ1OT1可通过调控细胞增殖、侵袭和迁移在GC发生发展过程中发挥着重要的促癌作用. 顺铂是GC化疗是常用药物之一, 但化疗过程中易产生耐药; 而靶向调控基因表达可增强顺铂对细胞的敏感性, 降低其耐药抵抗, 有望成为GC化疗的增敏剂[24-25]. 本研究以靶向干扰KCNQ1OT1表达后发现, 顺铂IC50值显著降低, P-gp蛋白水平降低, MRP1蛋白水平升高, 说明下调KCNQ1OT1表达可提高顺铂对GC细胞的敏感性. 提示, KCNQ1OT1在GC化疗耐药过程中发挥着重要作用, 而靶向干扰KCNQ1OT1表达可能是改善GC化疗耐药的重要策略.
综上所述, 下调KCNQ1OT1表达可抑制HGC-27细胞增殖、侵袭、迁移并增强细胞对顺铂的敏感性. 本研究初步揭示了KCNQ1OT1在GC中的作用, 其具体的作用机制还需进一步深入探讨.
胃癌(gastric cancer, GC)是临床常见的恶性肿瘤, 其发病率与死亡率逐年上升, 目前关于GC发生及转移的分子机制尚未阐明, 因而探寻转移相关基因对揭示GC发生及发展的分子机制具有重要意义.
临床主要采用手术结合放化疗的方式进行治疗, 但患者极易产生耐药性, 因而探究GC细胞耐药性机制有助于提高治疗效果及改善患者预后.
探讨下调长链非编码RNA KCNQ1重叠转录物1(KCNQ1 opposite strand/antisense transcript 1, KCNQ1OT1)表达对GC细胞增殖、迁移及侵袭的影响及分子机制, 并探讨细胞对顺铂的敏感性.
采用实时荧光定量聚合酶链式反应方法检测GC细胞中KCNQ1OT1的表达, MTT检测细胞增殖, Transwell小室实验检测细胞迁移及侵袭, Western blot法检测细胞增殖、迁移及侵袭相关蛋白表达. 检测IC50值及耐药相关蛋白表达从而探究KCNQ1OT1对细胞耐药性的影响及其作用机制.
KCNQ1OT1在GC细胞中呈高表达, 抑制KCNQ1OT1表达可显著抑制细胞增殖、迁移及侵袭, 还可诱导细胞周期阻滞, 同时抑制KCNQ1OT1表达可增强细胞敏感性.
抑制KCNQ1OT1表达可抑制GC细胞增殖、侵袭、迁移并增强细胞对顺铂的敏感性.
KCNQ1OT1可能作为GC诊断及治疗的潜在靶点, 还可能为GC敏感性药物研发奠定理论基础.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Charalampakis N, Economopoulou P, Kotsantis I, Tolia M, Schizas D, Liakakos T, Elimova E, Ajani JA, Psyrri A. Medical management of gastric cancer: a 2017 update. Cancer Med. 2018;7:123-133. [PubMed] [DOI] |
| 4. | Peng W, Wu J, Fan H, Lu J, Feng J. LncRNA EGOT Promotes Tumorigenesis Via Hedgehog Pathway in Gastric Cancer. Pathol Oncol Res. 2019;25:883-887. [PubMed] [DOI] |
| 5. | Wang CJ, Zhu CC, Xu J, Wang M, Zhao WY, Liu Q, Zhao G, Zhang ZZ. The lncRNA UCA1 promotes proliferation, migration, immune escape and inhibits apoptosis in gastric cancer by sponging anti-tumor miRNAs. Mol Cancer. 2019;18:115. [PubMed] [DOI] |
| 6. | Xu YD, Shang J, Li M, Zhang YY. LncRNA DANCR accelerates the development of multidrug resistance of gastric cancer. Eur Rev Med Pharmacol Sci. 2019;23:2794-2802. [PubMed] [DOI] |
| 7. | Xian D, Zhao Y. LncRNA KCNQ1OT1 enhanced the methotrexate resistance of colorectal cancer cells by regulating miR-760/PPP1R1B via the cAMP signalling pathway. J Cell Mol Med. 2019;23:3808-3823. [PubMed] [DOI] |
| 8. | 刘 正泰, 肖 方祥, 王 俊杰, 杨 超, 盖 李乐, 屈 家源, 袁 成福. LncRNA KCNQ1OT1在卵巢癌组织中的表达及对卵巢癌细胞顺铂耐药的作用. 肿瘤. 2019;39:57-66. |
| 9. | Feng L, Li H, Li F, Bei S, Zhang X. LncRNA KCNQ1OT1 regulates microRNA-9-LMX1A expression and inhibits gastric cancer cell progression. Aging (Albany NY). 2020;12:707-717. [PubMed] [DOI] |
| 10. | Sun X, Xin Y, Wang M, Li S, Miao S, Xuan Y, Wang Y, Lu T, Liu J, Jiao W. Overexpression of long non-coding RNA KCNQ1OT1 is related to good prognosis via inhibiting cell proliferation in non-small cell lung cancer. Thorac Cancer. 2018;9:523-531. [PubMed] [DOI] |
| 13. | Chen M, Wu X, Ma W, Zhou Q, Wang X, Zhang R, Wang J, Yang X. Decreased expression of lncRNA VPS9D1-AS1 in gastric cancer and its clinical significance. Cancer Biomark. 2017;21:23-28. [PubMed] [DOI] |
| 14. | Zhang H, Lu W. LncRNA SNHG12 regulates gastric cancer progression by acting as a molecular sponge of miR320. Mol Med Rep. 2018;17:2743-2749. [PubMed] [DOI] |
| 15. | Ding HX, Sun JF, Li RX, Wang GJ. Long non-coding RNA GACAT1 alleviates doxorubicin and vincristine resistance through a PTEN/AKT/mTOR/S6K1 regulatory pathway in gastric cancer. RSC advances. 2019;9:8048-8055. [DOI] |
| 16. | Zhang K, Yan J, Yi B, Rui Y, Hu H. High KCNQ1OT1 expression might independently predict shorter survival of colon adenocarcinoma. Future Oncol. 2019;15:1085-1095. [PubMed] [DOI] |
| 17. | Wang J, Zhang H, Situ J, Li M, Sun H. KCNQ1OT1 aggravates cell proliferation and migration in bladder cancer through modulating miR-145-5p/PCBP2 axis. Cancer Cell Int. 2019;19:325. [PubMed] [DOI] |
| 18. | Hu H, Yang L, Li L, Zeng C. Long non-coding RNA KCNQ1OT1 modulates oxaliplatin resistance in hepatocellular carcinoma through miR-7-5p/ ABCC1 axis. Biochem Biophys Res Commun. 2018;503:2400-2406. [PubMed] [DOI] |
| 19. | Zhang S, Ma H, Zhang D, Xie S, Wang W, Li Q, Lin Z, Wang Y. LncRNA KCNQ1OT1 regulates proliferation and cisplatin resistance in tongue cancer via miR-211-5p mediated Ezrin/Fak/Src signaling. Cell Death Dis. 2018;9:742. [PubMed] [DOI] |
| 22. | Kong F, Sun T, Kong X, Xie D, Li Z, Xie K. Krüppel-like Factor 4 Suppresses Serine/Threonine Kinase 33 Activation and Metastasis of Gastric Cancer through Reversing Epithelial-Mesenchymal Transition. Clin Cancer Res. 2018;24:2440-2451. [PubMed] [DOI] |
| 23. | Zhou LH, Yang YC, Zhang RY, Wang P, Pang MH, Liang LQ. CircRNA_0023642 promotes migration and invasion of gastric cancer cells by regulating EMT. Eur Rev Med Pharmacol Sci. 2018;22:2297-2303. [PubMed] [DOI] |
| 24. | Li M, Zhang YY, Shang J, Xu YD. LncRNA SNHG5 promotes cisplatin resistance in gastric cancer via inhibiting cell apoptosis. Eur Rev Med Pharmacol Sci. 2019;23:4185-4191. [PubMed] [DOI] |