修回日期: 2020-01-15
接受日期: 2020-02-25
在线出版日期: 2020-03-08
结直肠癌(colorectal carcinoma, CRC)是临床上常见的消化系统恶性肿瘤. 但其确切发病机制和预后独立因素仍未阐明. 本研究通过生物信息学方法分析了zeste基因增强子同源物2(enhancer of zeste homolog 2, EZH2)和血管内皮生长因子(vascular endothelial growth factor, VEGF)基因在CRC中的表达情况及其和患者预后的感谢. 并采用免疫组化检测了EZHE2和VEGF蛋白的表达情况及其与患者临床特征的关系.
探讨EZH2和VEGF在CRC中的表达、突变情况及其与患者临床病理特征和预后的关系.
首先在TCGA数据库中比较EZH2和VEGF基因mRNA在肠癌患者癌和癌旁组织中的表达, 同时分析EZH2和VEGF基因的突变情况; 采用STRING数据库建立EZH2和VEGF基因表达网络并筛选网络中的关键基因. 根据EZH2和VEGF在肿瘤组织中的表达分为高低表达组, Cox回归模型Log-rank检验比较高低表达组患者总生存和无疾病进展生存是否存在差异. 同时选取80例肠癌手术患者, 留取患者癌组织和癌旁组织, 采用免疫组织化学法检测上述组织中EZH2和VEGF蛋白表达水平.
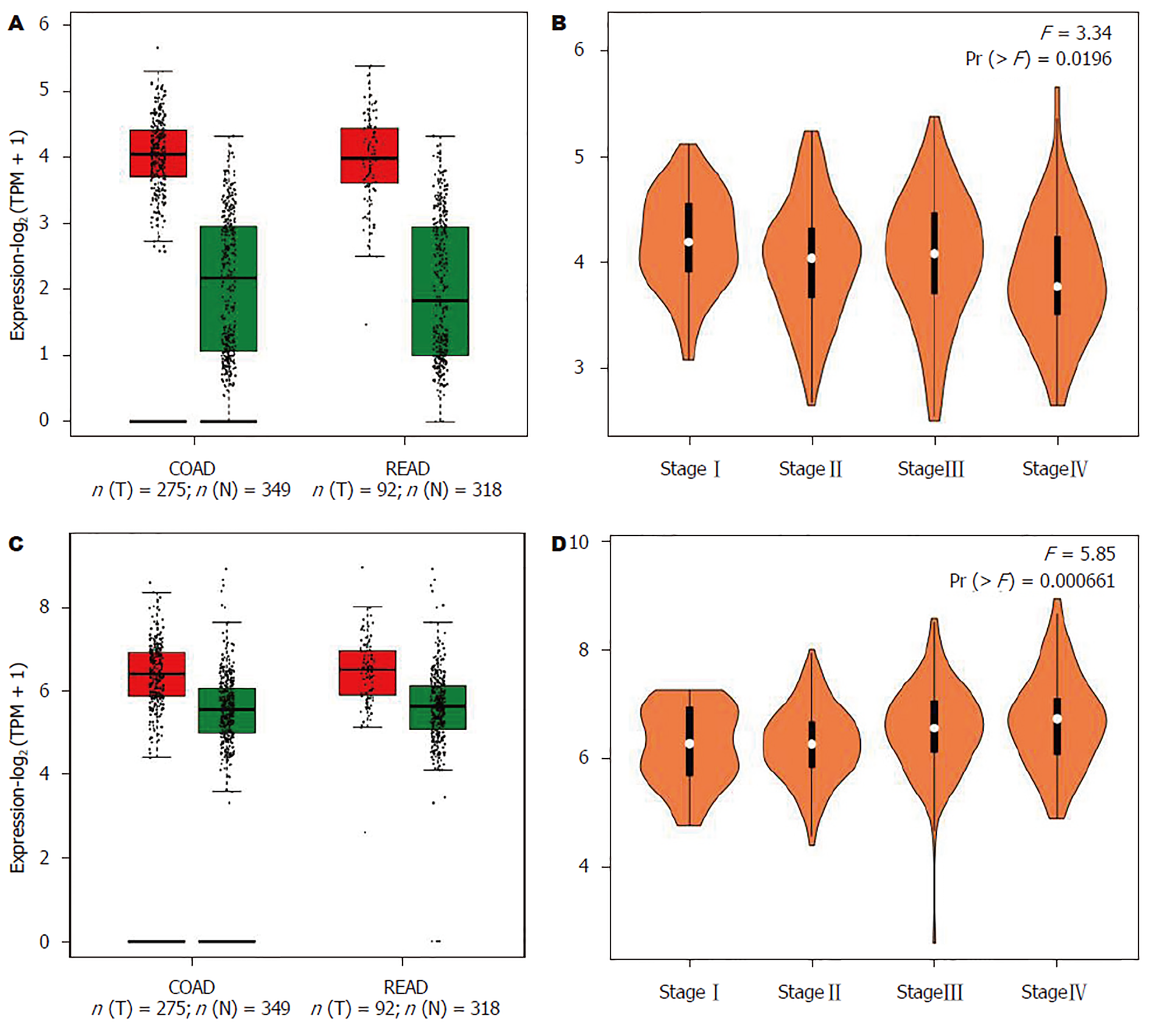
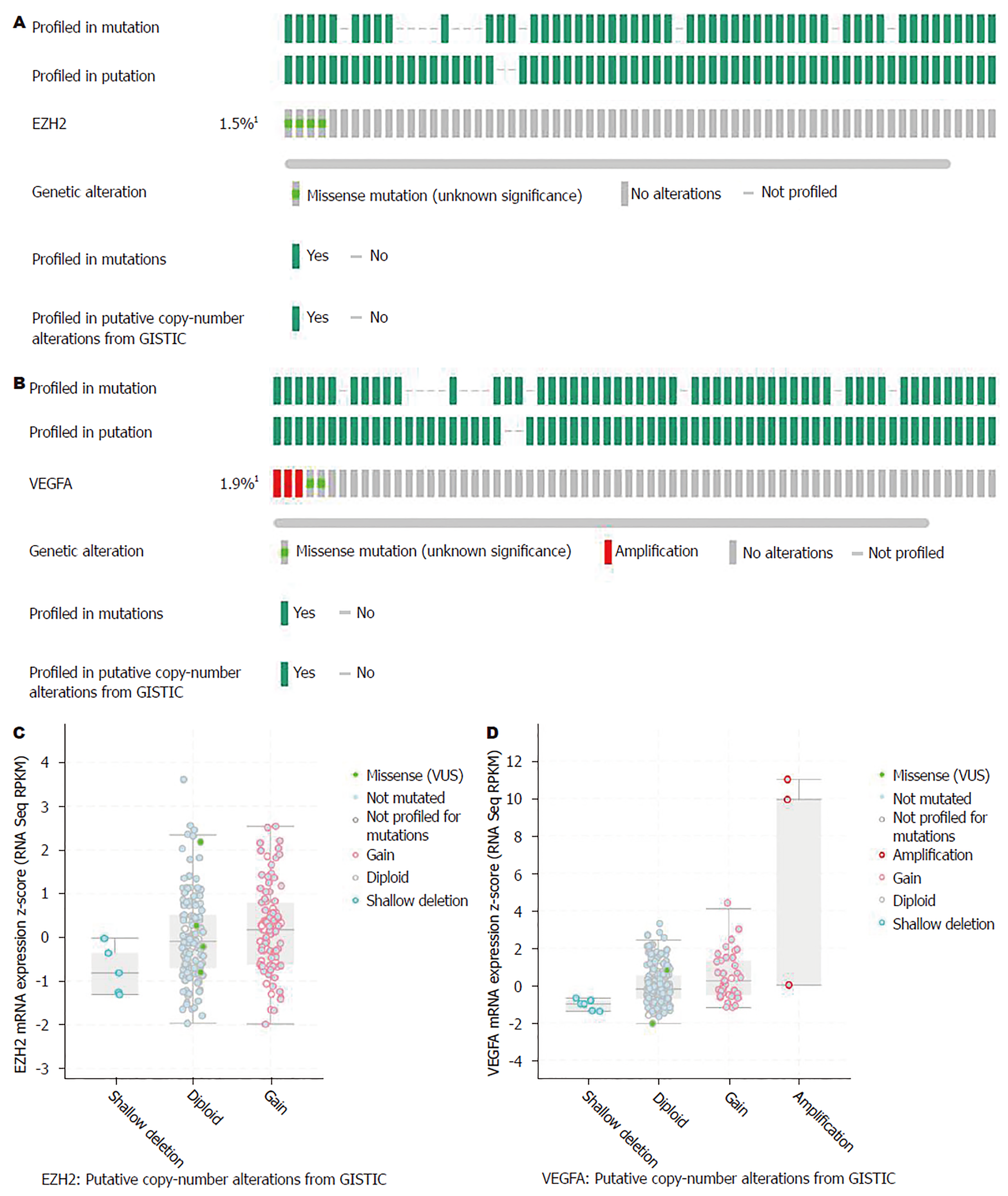
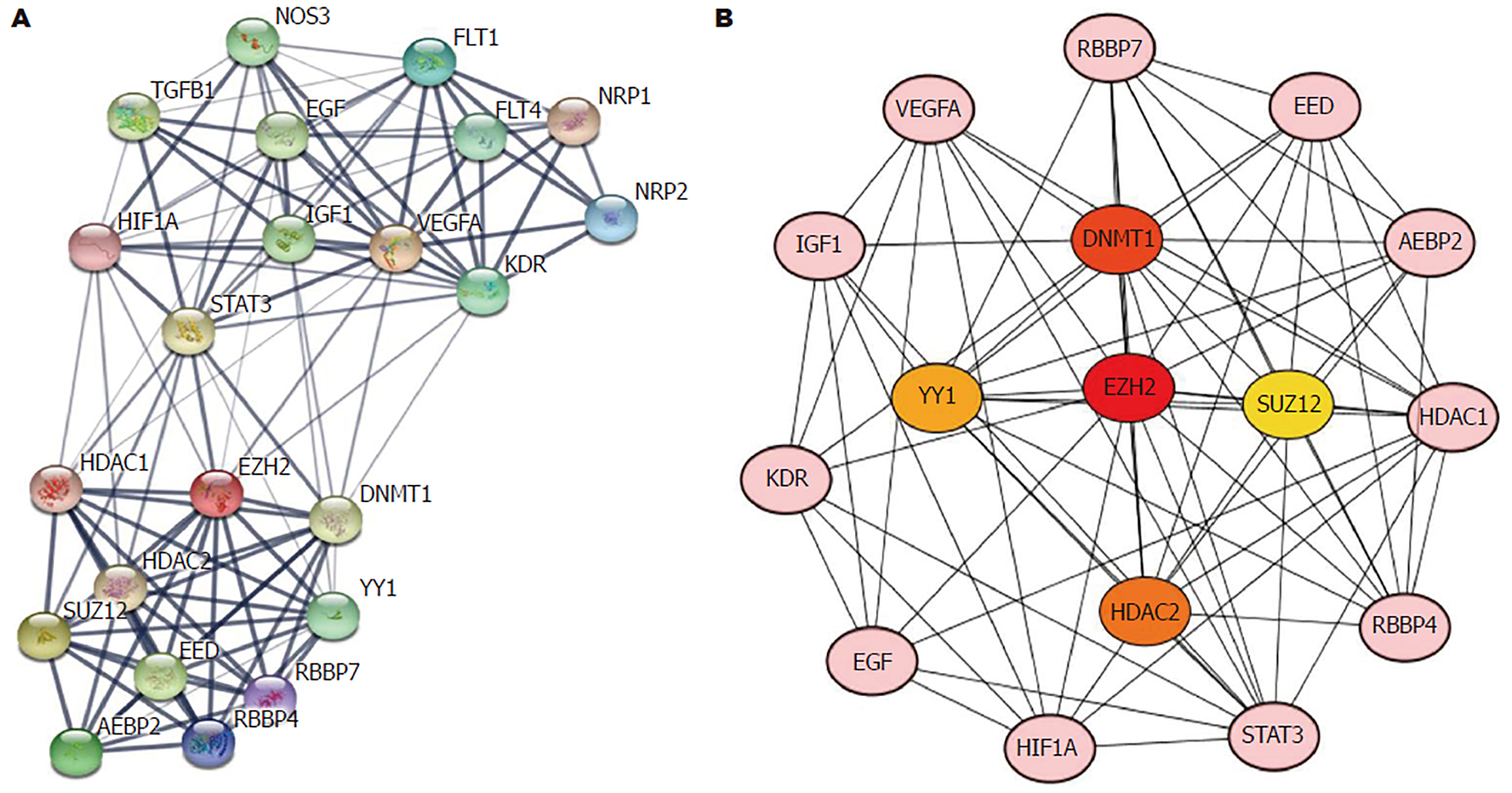
TCGA数据库显示EZH2和VEGF基因在CRC组织中的表达水平显著高于对应的正常肠上皮组织(P<0.05), 而与肠癌患者的临床分期并无明显相关性(P>0.05); EZH2和VEGF基因在人肠癌中的突变率分别为1.5%和1.9%, 且EZH2和VEGF不同突变组织中mRNA表达水平存在明显差异. 网络中共有22个蛋白, 各蛋白平均相互作用指数为10.5, 区域聚集指数为0.8, 各蛋白富集明显(P<0.01). Cytohubb软件筛选出EZH2, DNMT1, HDAC2, YY1和SUZ12为网络中的关键基因; EZH2和VEGF高低表达与患者总生存期均无相关性(P>0.05), 而VEGF高表达组患者无疾病进展生存期显著低于低表达组(HR = 1.8, P<0.05). 免疫组化显示, EZH2和VEGF在肠癌组织中的阳性表达率均显著高于癌旁组织 (P<0.01). EZH2阳性表达与肠癌肿瘤直径、分化程度和Duke分期有关(P<0.05). 而VEGF阳性表达与肠癌患者分化程度和Duke分期存在相关性(P<0.05).
EZH2和VEGF在肠癌组织中呈现明显上调表达和突变, 其高表达与肿瘤大小、分会程度和Duke分期有关, 并可作为肠癌预后的潜在分子标志物.
核心提要:zeste基因增强子同源物2(enhancer of zeste homolog 2, EZH2)和血管内皮生长因子(vascular endothelial growth factor, VEGF)基因mRNA在肠癌组织中的表达水平明显高于癌旁正常组织. EZH2蛋白阳性表达与肠癌肿瘤直径、分化程度和Duke分期有关(P<0.05). 而VEGF蛋白阳性表达与肠癌患者分化程度和Duke分期有关(P<0.05). EZH2和VEGF有望成为肠癌预后的潜在分子标志物.
引文著录: 于立刚, 陈素琴, 毛国良. EZH2和VEGF在结直肠癌中的表达其与患者预后关系生物信学分析及验证. 世界华人消化杂志 2020; 28(5): 155-166
Revised: January 15, 2020
Accepted: February 25, 2020
Published online: March 8, 2020
Colorectal cancer (CRC) is a common malignant tumor of the digestive system. However, its exact pathogenesis and independent prognostic factors are still unclear. In this study, we analyzed the expression of enhancer of zeste homolog 2 (EZH2) and vascular endothelial growth factor (VEGF) genes in CRC by using bioinformatics method and their relationship with prognosis. The expression of EZHE2 and VEGF proteins and their relationship with the patients' clinical characteristics were detected by immunohistochemistry.
To investigate the expression and mutation status of EZH2 and VEGF in CRC and their relationship with clinicopathological features and prognosis.
The expression of EZH2 and VEGF genes in CRC and tumor adjacent tissues was compared in the TCGA database, and the mutations of EZH2 and VEGF genes were analyzed. The expression network of EZH2 and VEGF genes was established with the STRING database and the key genes in the network were screened. According to the expression of EZH2 and VEGF in tumor tissues, the patients were divided into high and low expression groups. Cox regression model and log-rank test were used to compare the difference of total survival and disease-free survival between the high and low expression groups. In addition, 80 patients with CRC who underwent surgery were selected, and their cancer tissues and adjacent tissues were collected. The expression of EZH2 and VEGF proteins in the above tissues was detected by immunohistochemistry.
Analysis based on the TCGA database showed that the expression levels of EZH2 and VEGF genes in CRC tissues were significantly higher than those in matched normal intestinal epithelial tissues (P < 0.05), but they had no significant correlation with clinical stage of CRC (P > 0.05).The mutation rates of EZH2 and VEGF genes in human CRC were 1.5% and 1.9%, respectively, and there were significant differences in the expression levels of EZH2 and VEGF mRNA in tissues with different EZH2 and VEGF mutation statuses. There are 22 proteins in the network. The average interaction index of each protein is 10.5, the regional aggregation index is 0.8, and the protein enrichment was obvious (P < 0.01). EZH2, DNMT1, HDAC2, YY1, and SUZ12 were screened as the key genes in the network using Cytohubb software. There was no correlation between the expression of EZH2 and VEGF and the total survival time of patients (P > 0.05), but the disease-free survival time of patients with high expression of VEGF was significantly lower than that of patients with low expression of VEGF (HR = 1.8, P < 0.05). Immunohistochemistry showed that the positive rates of EZH2 and VEGF proteins in CRC tissues were significantly higher than those in adjacent tissues (P < 0.01). The positive expression of EZH2 was related to tumor diameter, differentiation, and Duke stage (P < 0.05). The positive expression of VEGF was correlated with degree of differentiation and Duke stage (P < 0.05).
EZH2 and VEGF are up-regulated and mutated in CRC tissues. The high expression of EZH2 and VEGF is related to tumor size, differentiation, and Duke stage, and can be used as potential molecular markers for the prognosis of CRC.
- Citation: Yu LG, Chen SQ, Mao GL. Relationship between EZH2 and VEGF expression and prognosis in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2020; 28(5): 155-166
- URL: https://www.wjgnet.com/1009-3079/full/v28/i5/155.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i5.155
肿瘤流行病学数据显示, 美国每年结直肠癌(colorectal carcinoma, CRC)发病人数为15万例左右, 死亡人数约为5万[1]. 我国尚无结直肠肿瘤确切的流行病学数据, 但各个地方的结直肠流行病学研究提示近年来其发病率呈现出上升趋势[2]. 早期行CRC根治术的患者预后较好, 而晚期患者预后较差[3,4]. 目前, 关于CRC预后的相关因素研究认为, 患者TNM分期是预后的独立因素. 同时, 近年来随着分子生物学技术的不断进步, 结直肠的恶性生物学行为调控机制逐渐明晰, 它是一个涉及多基因多步骤的分子生物调控过程[5], 在此过程中, 多种蛋白因子参与其中包括zeste基因增强子同源物2(enhancer of zeste homolog 2, EZH2)和血管内皮生长因子(vascular endothelial growth factor, VEGF)等[6]. EZH2基因是果蝇zeste基因增强子的人类同源物, 是PcG(Polycomb Group)基因家族的重要成员之一. EZH2能够促进细胞增殖、肿瘤细胞扩散, 在多种肿瘤组织中高表达, 与肿瘤恶性程度和患者预后密切相关. 而肿瘤的浸润和转移与血管生成密切相关. VEGF是肿瘤血管生成的重要因子, 其表达水平与肿瘤微血管生成有关. 在本研究中, 我们首先采用生物信息学方法, 分析EZH2和VEGF基因在肠癌中的表达和突变情况及其与患者预后的关系, 并采用免疫组化对上述生物信息结果进行验证.
1.1.1 EZH2和VEGF基因生物信息学分析: 首先在TCGA数据库中比较EZH2和VEGF基因mRNA在肠癌患者癌组和癌旁组织中的表达, 同时分析EZH2和VEGF基因的突变情况. STRING数据库(http://string-db.org/cgi/input.pl)[7]对EZH2和VEGF及相互作用基因进行网络分析, 物种选择人, 作用蛋白不少于20个, 相互作用关系置信度大于0.7. 根据EZH2和VEGF基因mRNA表达中位数将肠癌分为高低表达组, Cox回归模型Log-rank检验比较高低表达组肠癌患者总生存和无疾病进展生存是否存在差异, 并计算风险比(hazard ratio, HR).
1.1.2 EZH2和VEGF功能富集和蛋白-蛋白相互作用网络构建: 采用基因本体论(gene ontology, GO)对VEGF和EZH2基因和相关蛋白进行功能富集, 包括细胞组分, 分子功能和生物学过程3个层面[8]. 同时利用STRING数据库构建相互作用蛋白网络构建条件为置信度大于0.5[9].
1.1.3 EZH2和VEGF共表达分析: 在TCGA数据库中, 依据与EZH2和VEGF基因共表达关系, 对与EZH2和VEGF基因存在相关性的基因进行聚类. 同时选取正相关和负相关表达最为明显的2个基因进行分析, 计算spearman相关系数.
1.1.4 组织标本留取及仪器试剂: 回顾性研究我院2015-01/2019-06收治的80例CRC患者的蜡块癌和癌旁组织标本. 患者纳入标准: 患者病理明确诊断为CRC; 术前未接受新辅助治疗; 无合并其他系统恶性肿瘤; 患者组织标本获取经患者或家属同意并签订知情同意书. 排除标准: 患者CRC诊断不明确; 术前接受新辅助化疗或生物治疗; 合并其他系统恶性肿瘤; 临床病理自理不完整者. 本项目研究经天津市武清区人民医院医学伦理委员会批准. 采用免疫组织化学SP法检测EZH2和VEGF在癌组和癌旁组织中的表达水平及其与患者临床病理特征的关系. EZH2和VEGF单克隆抗体(鼠抗人, 一抗), 拟购自美国cell signaling公司; 鼠抗兔HRP(二抗)抗体, 购自美国sigma公司; PBS缓冲液, 购自武汉博士德生物工程有限公司.
EZH2和VEGF免疫组化检测: 组织标本处理及免疫组化操作: (1)脱蜡水化, 将组织切片置于二甲苯中浸泡10 min, 无水乙醇浸泡5 min, 95%, 80%和79%乙醇各浸泡5 min; (2)抗原修复, 水浴锅加入0.01 mol/L枸橼酸钠至95 ℃, 放入切片15 min; (3)免疫组织化学染色, 按操作指南逐步脱蜡水化、抗原修复、滴加一抗和二抗, 然后显色, 最终封片镜检.
统计学处理 采用SPSS 19.0软件进行统计学处理, 计数资料采用率表示, 组间比较采用χ2检验; 生存分析采用风险比例模型Log-rank检验, 多因素生存分析采用Cox回归模型, P<0.05表示差异有统计学意义.
TCGA数据库显示, EZH2和VEGF基因在CRC组织中的表达水平显著高于对应的正常肠上皮组织(P<0.05), 而EZH2和VEGF基因表达水平与肠癌患者的临床分期并无明显相关性(P>0.05)(图1).
EZH2和VEGF基因生物学过程、细胞成分和分子功能主要分别富集于细胞增殖调控、ESC/E(Z)复合体和血管内皮生长因子激活受体活性(表1).
| 基因功能 | 基因计数 | 背景基因 | P值 |
| 生物血过程 | |||
| 细胞增殖调控 | 18 | 1594 | 3.47E-13 |
| 细胞增殖的正调控 | 15 | 878 | 1.03E-12 |
| 基因表达的负调控, 表观遗传 | 9 | 117 | 5.19E-12 |
| 血管内皮生长因子信号通路 | 6 | 16 | 4.18E-11 |
| 基因表达调控, 表观遗传学 | 10 | 251 | 4.18E-11 |
| 内皮细胞迁移的正调控 | 8 | 96 | 5.73E-11 |
| 上皮细胞增殖的正调控 | 9 | 178 | 8.25E-11 |
| 基因表达的负调控 | 16 | 1670 | 1.14E-10 |
| 细胞过程的负调控 | 21 | 4454 | 1.51E-10 |
| 细胞成分 | |||
| ESC/E(Z)复合体 | 7 | 11 | 4.42E-15 |
| PCG蛋白复合物 | 8 | 33 | 5.02E-15 |
| 染色质 | 10 | 489 | 1.86E-09 |
| 核染色质 | 9 | 333 | 1.86E-09 |
| swi/snf超家族型配合物 | 6 | 67 | 3.98E-09 |
| 含蛋白质复合物 | 17 | 4792 | 3.34E-06 |
| Esc/E(Z)复合体 | 7 | 11 | 4.42E-15 |
| 分子功能 | |||
| 血管内皮生长因子激活受体活性 | 5 | 7 | 1.93E-10 |
| RNA聚合酶II近端启动子序列特异性DNA结合 | 9 | 457 | 9.52E-08 |
| 序列特异性DNA结合 | 11 | 1047 | 2.46E-07 |
| 蛋白酪氨酸激酶活性 | 6 | 180 | 9.92E-07 |
| 催化活性, 作用于蛋白质 | 13 | 2176 | 1.43E-06 |
| 组蛋白脱乙酰酶活性 | 4 | 39 | 2.35E-06 |
| 组蛋白脱乙酰酶结合 | 5 | 110 | 2.35E-06 |
| 启动子特异性染色质结合 | 4 | 43 | 2.42E-06 |
EZH2和VEGF基因在人肠癌中的突变率分别为1.5%和1.9%, 且EZH2和VEGF不同突变组织中期mRNA表达水平存在明显差异(图2).
EZH2和VEGF构建相互作用蛋白网络, 网络中共有22个蛋白, 各蛋白平均相互作用指数为10.5, 区域聚集指数为0.8, 各蛋白富集明显(P<0.01). Cytohubb软件筛选出EZH2, DNMT1, HDAC2, YY1和SUZ12为网络中的关键基因(图3).
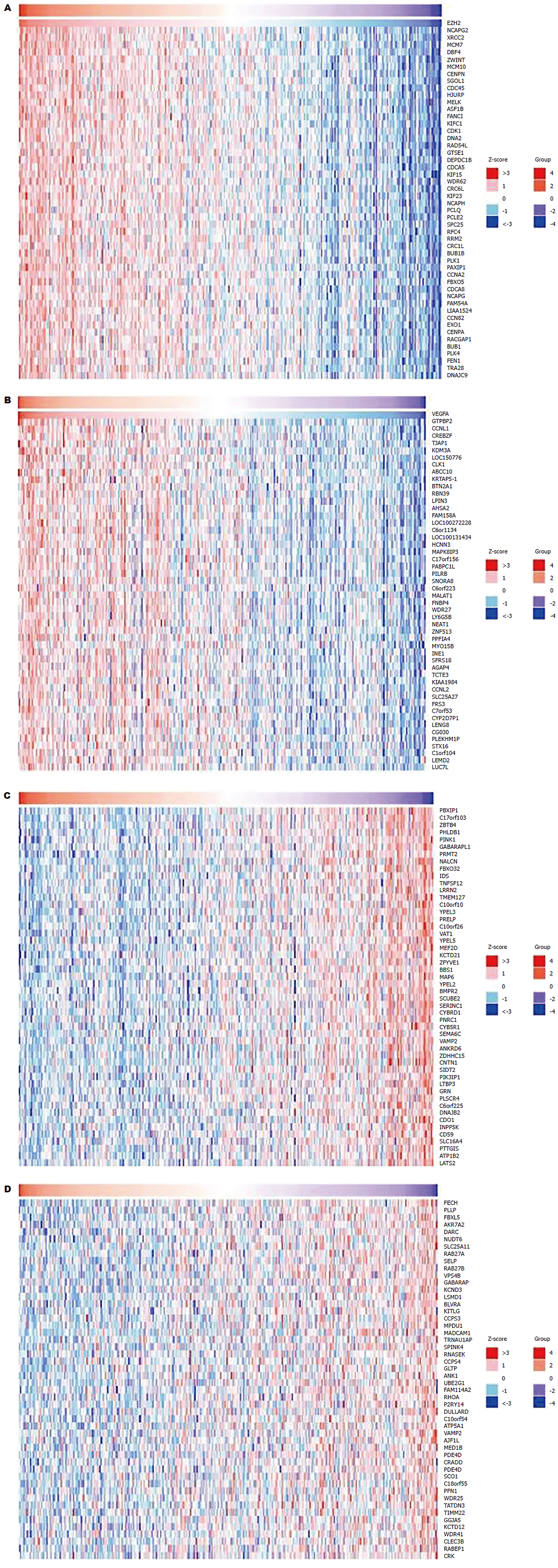
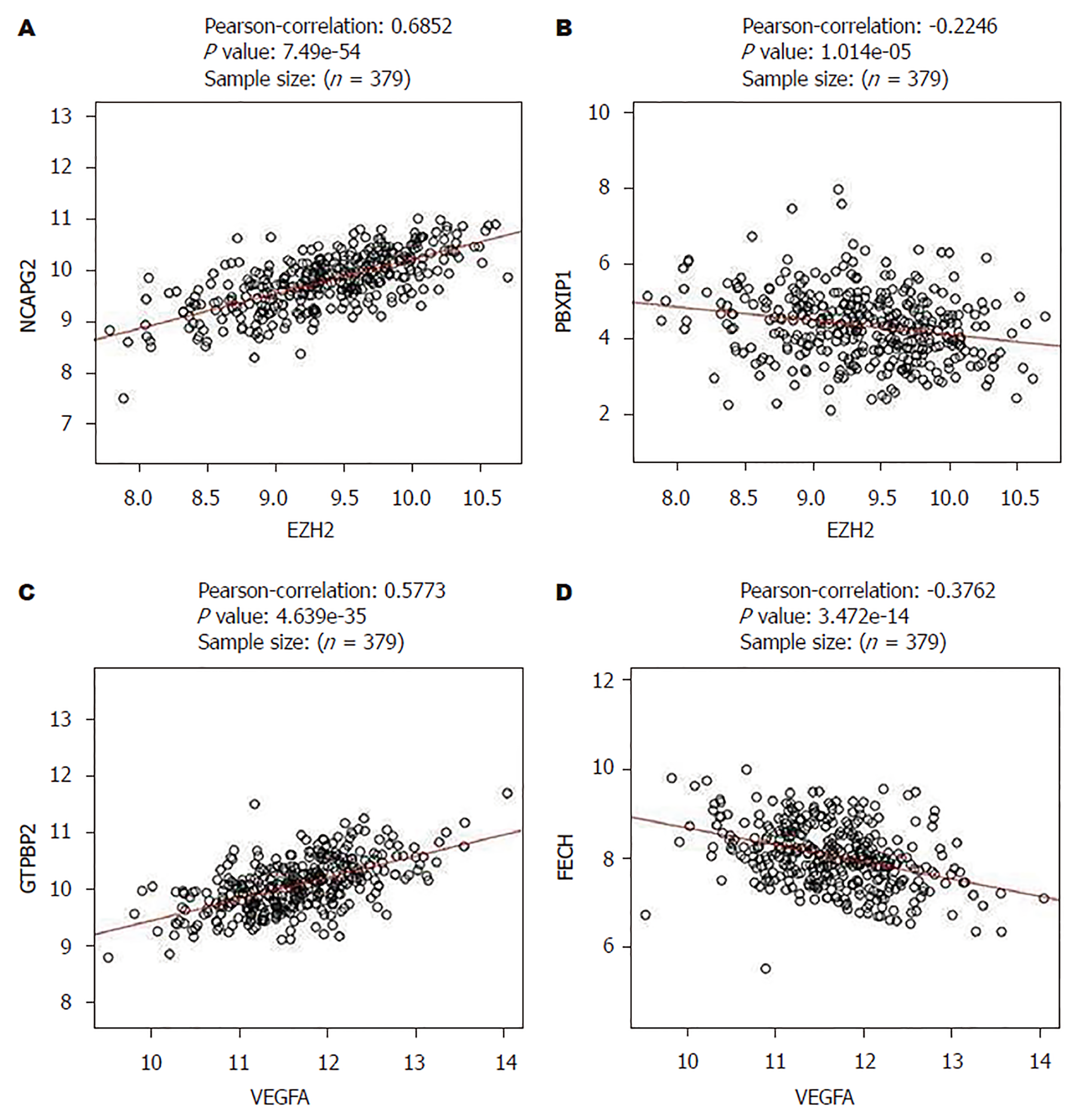
EZH2和VEGF基因正负相关表达的基因进行了聚类分析(图4), NCAPG2(r = 0.69, P<0.05)和PBXIP1基因(r = -0.22, P<0.05)分别于EZH2基因正负相关表达(图5A、B). 而GTPBP2(r = 0.598, P<0.05和PECH与VEGF(r = -0.38, P<0.05)分别于VEGF基因正负相关表达(图5C、D).
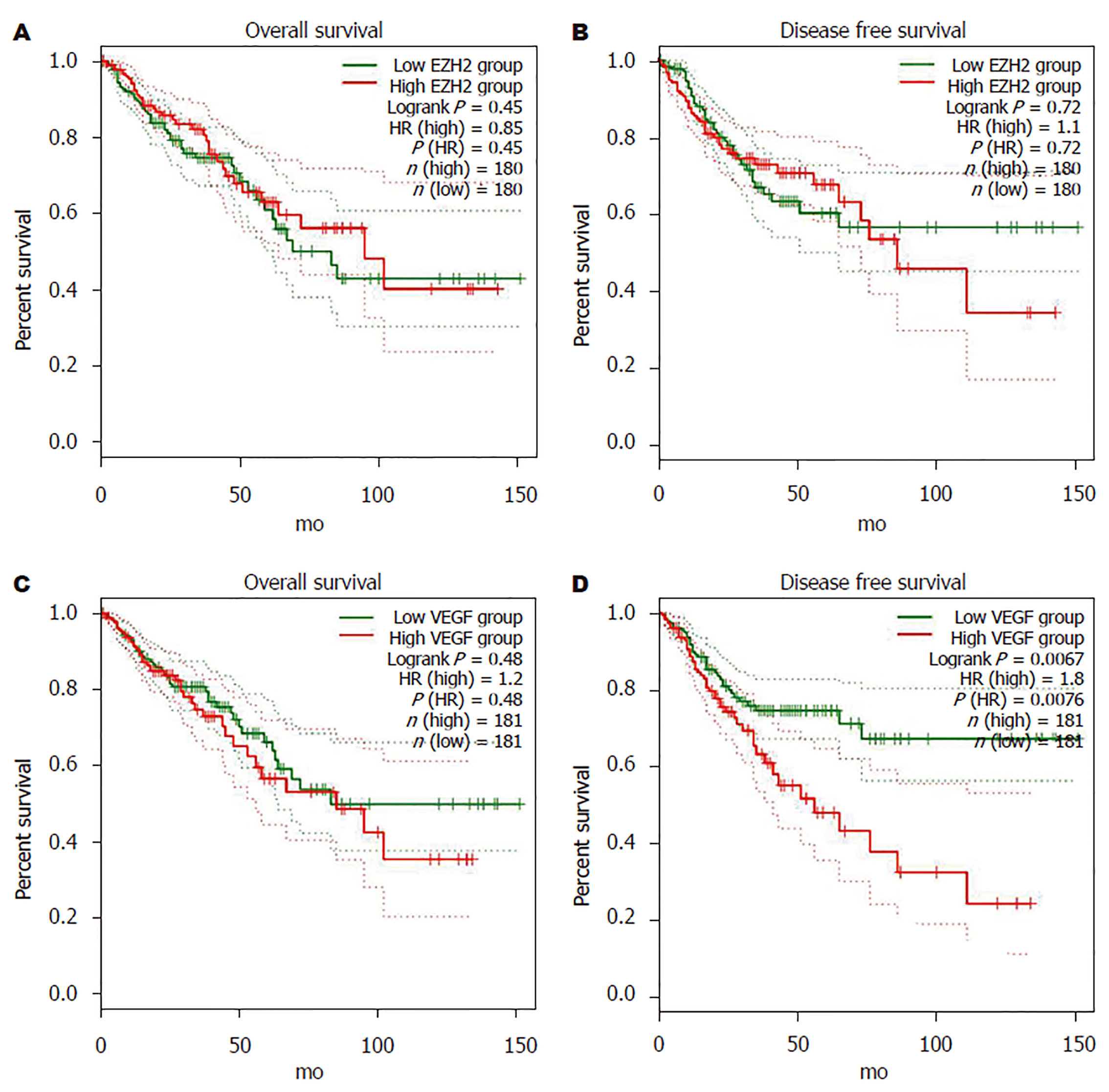
根据基因在肠癌组织中的表达水平分为高低表达组, 采用Cox回归模型绘制生存曲线, Log-rank检验显示EZH2和VEGF高低表达组与患者总生存期均无相关性(P>0.05), 而VEGF高表达组患者无疾病进展生存期显著低于低表达组(HR = 1.8, P<0.05)(图6).
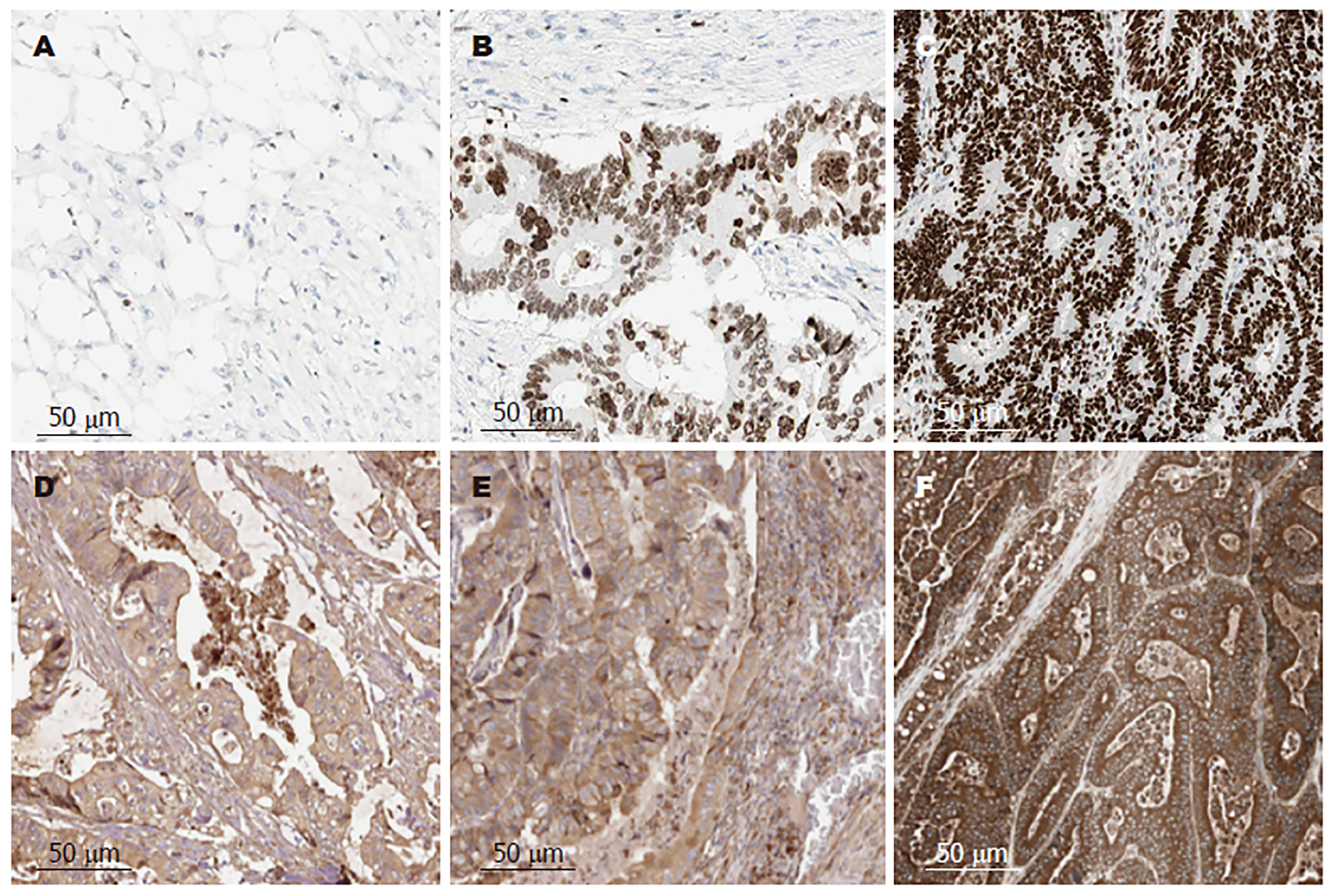
EZH2主要表达于肠癌细胞的细胞核, 呈现棕黄色颗粒状(图7). EZH2在肠癌组织中的阳性表达率为63.8%(51/80), 在癌旁组织中的阳性表达率为6.3%(5/80), 癌组织中EZH2阳性表达率显著高于正常肠组织(χ2 = 58.13, P<0.01). VEGF表达于细胞质表达, VEGF在肠癌患者肿瘤组织中的阳性表达率为60.0%(48/80), 高于癌旁组织26.5%(21/80), 差异有统计学意义(χ2 = 18.58, P<0.01). EZH2阳性表达与患者性别、年龄、肿瘤发生部和肿瘤直径无明显相关性(P>0.05), 而EZH2阳性表达与肿瘤分化程度和Duke分期有关(P<0.05). VEGF阳性表达与肠癌患者分化程度和Duke分期存在相关性(P<0.05), 而与其他病理特征无关(表2).
| 分组特征 | n = 80 | EZH2 | P值 | VEGF | P值 | ||
| 阳性(n = 51) | 阴性(n = 29) | 阳性(n = 48) | 阴性(n = 32) | ||||
| 性别 | 0.72 | 0.86 | |||||
| 男 | 49 | 32 | 17 | 30 | 20 | ||
| 女 | 31 | 19 | 12 | 18 | 13 | ||
| 年龄(岁) | 0.79 | 0.62 | |||||
| <50 | 25 | 16 | 9 | 14 | 11 | ||
| ≥50 | 55 | 35 | 20 | 34 | 21 | ||
| 肿瘤部位 | 0.29 | 0.17 | |||||
| 结肠 | 35 | 26 | 9 | 24 | 11 | ||
| 直肠 | 45 | 25 | 20 | 24 | 21 | ||
| 肿瘤直径(cm) | 0.01 | 0.23 | |||||
| >5 | 34 | 27 | 7 | 23 | 11 | ||
| ≤5 | 46 | 24 | 22 | 25 | 21 | ||
| 分化程度 | 0.03 | <0.001 | |||||
| 高/中分化 | 12 | 11 | 1 | 12 | 0 | ||
| 低/未分化 | 68 | 40 | 28 | 36 | 32 | ||
| Duke分期 | 0.04 | ||||||
| A/B期 | 45 | 20 | 25 | <0.001 | 22 | 23 | |
| C/D期 | 35 | 31 | 4 | 25 | 10 | ||
EZH2为果蝇zeste基因增强子同源物2, 在多种肿瘤的发生发展中起到重要作用. 该基因的异常表达可能与多种实体肿瘤的恶性表型有关[8]. EZH2是1996年初Hobert等采用酵母双杂交系统方法发现的一个新基因, 当时命名为ENX-1. 它在体内和体外都能和Vav相互作用, 是果蝇zeste基因增强子[E(z)]的人类同源物. 在人类EZH2基因定位于人7染色体3带5区, 为多梳蛋白复合体PcG(Polycomb group)家族重要成员之一. 既往研究发现, EzH2表达产物可以促进肿瘤细胞增殖及扩散, 在多种恶性肿瘤如前列腺癌、膀胱癌、乳腺癌、肝癌、胃癌等肿瘤中呈现异常表达[9-12]. 但关于EZH2与结肠癌的关系研究较少, 其与结肠癌发生、发展、侵袭转移等生物学行为之间的关系并不是十分清楚.
VEGF是1989年Ferrarra首先发现并报道的, VEGF分子量在34-45 KD之间, 研究显示它属于血小板衍生生长因子家族的一员,在人体和动物体内的各种组织均有广泛的分布, 不仅是生理组织, 在肿瘤等病理组织中, 也有大量的血管内皮生长因子分布[13,14]. VEGF是一种能产生多种生物学效应、功能强大的细胞因子, 对肿瘤发生发展影响最大的功能就是促进血管内皮细胞有丝分裂, 故将其命名成血管内皮细胞生长因子[15,16]. 目前发现的VEGF亚型有VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E、胎盘生长因子(placenta growth factor, PIGF). VEGF家族中, VEGF-A 是主要的血管生长因子, 对于血管内皮的生长起着主要作用, 所以对它的研究也最为成熟, 虽然如此, 对于VEGF-A的作用原理当前仍未研究透彻, 如今, 血管内皮生长因子已经成为研究肿瘤的重要分支, 关于VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E等因子的作用原理也成为当下研究的热点. 肿瘤新生血管的生长并不仅受VEGF的影响, 除此之外, 还有肿瘤转化因子、坏死因子等因素参与其中, 这些因子通过什么原理对肿瘤组织产生影响, 以及他们之间有没有联系, 这些都是医学界尚未解决和清楚的问题, 未来一段时间内, 影响肿瘤组织的细胞因子, 尤其是血管内皮细胞生长因子将会是研究的重点和热点问题[17,18]. VEGF蛋白表达与CRC患者的关系研究报道较少.
在本研究中, 我们首先采用生物信息学方法, 分析EZH2和VEGF基因在肠癌中的表达和突变情况及其与患者预后的关系. 并采用免疫组对上述生物信息结果进行验证. 生物信息分析结果显示, 肠癌组织中EZH2和VEGF表达水平均高于对应的正常肠黏膜上皮, 提示EZH2和VEGF基因在肠癌的发生发展中可能发挥了重要作用. 同时, 我们入组的80例肠癌患者免疫组化也显示肠癌组织中EZH2和VEGF蛋白阳性表达率显著高于正常肠黏膜, 与生物信息分析结果一致. TCGA数据库中, EZH2和VEGF基因均存在明显的突变, 且不同突变组中基因拷贝数存在差异, 说明EZH2和VEGF表达水平可能与突变类型存在一定的关联.
根据基因在肠癌组织中的表达水平分为高低表达组, 采用Cox回归模型绘制生存曲线, Log-rank检验显示EZH2和VEGF高低表达组与患者总生存期均无相关性(P>0.05), 而VEGF高表达组患者无疾病进展生存期显著低于低表达组(HR = 1.8, P<0.05). 说明VEGF高表达患者预后不良, 分析原因可能与VEGF高表达患者肿瘤微血管密度增高, 远处转移风险增加有关. 但其确切分子机制有待进一步评价.
EZH2和VEGF相互作用蛋白网络中, EZH2, DNMT1, HDAC2, YY1和SUZ12基因为关键基因, 上述基因大多参与肿瘤的分裂增殖和侵袭转移生物学过程. 进一步的生存分析认为, VEGF基因高表达患者无疾病进展生存期较短, 其高表达是肠癌患者预后不良的危险因素, 并有望成为肠癌预后的分子标志物.
文献报道EZH2和VEGF在多种实体肿瘤中高表达并与肿瘤的发生、发展及恶性生物学行为有关. EZH2和VEGF在结直肠癌(colorectal carcinoma, CRC)中的表达及其与患者临床病理特征及预后关系不明.
本研究通过生物信息学方法探讨EZH2和VEGF在CRC中低表达、相关信号通路及与患者预后的关系. 同时采用免疫组织化学法验证EZH2和VEGF蛋白表达水平与CRC患者临床病理特征的关系, 佐证生物信息分析结果.
探讨EZH2和VEGF在CRC中表达及与患者临床病理和预后的关系, 判断其作为CRC预后分子标志物的可行性.
在TCGA数据库中比较EZH2和VEGF基因mRNA在肠癌患者癌和癌旁组织中的表达.构建EZH2和VEGF基因表达网络并筛选网络中的关键基因.比较EZH2和VEGF高低表达组患者总生存和无疾病进展生存是否存在差异.采用免疫组织化学法检测上述组织中EZH2和VEGF蛋白表达水平及其与患者临床病理特征的关系.
EZH2和VEGF在CRC组织中的表达水平上调(P<0.05). VEGF高表达组患者无疾病进展生存期显著低于低表达组(HR = 1.8, P<0.05). EZH2和VEGF蛋白在肠癌组织中的阳性表达率均显著高于癌旁组织(P<0.01). EZH2阳性表达与肠癌肿瘤直径、分化程度和Duke分期有关(P<0.05). 而VEGF阳性表达与肠癌患者分化程度和Duke分期存在相关性(P<0.05).
EZH2和VEGF基因mRNA在肠癌组织中的表达水平明显高于癌旁正常组织, 且上述基因编码蛋白表达水平与患者的肿瘤直径、分化程度和Duke分期有关.
EZH2和VEGF有望成为肠癌预后的潜在分子标志物.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin. 2016;66:7-30. [PubMed] [DOI] |
| 2. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 4. | 宋 蒨, 石 红建, 任 景丽, 黄 优华, 徐 强, 孙 钟武, 张 中平. 散发性结直肠癌组织MMR蛋白表达变化及其与患者临床病理参数和预后的关系. 山东医药. 2018;58:73-75. [DOI] |
| 5. | Xiong Y, Wang Y, Tiruthani K. Tumor immune microenvironment and nano-immunotherapeutics in colorectal cancer. Nanomedicine. 2019;21:102034. [PubMed] [DOI] |
| 6. | Li S, Peppelenbosch MP, Smits R. Bacterial biofilms as a potential contributor to mucinous colorectal cancer formation. Biochim Biophys Acta Rev Cancer. 2019;1872:74-79. [PubMed] [DOI] |
| 7. | Hoffmann R, Valencia A. A gene network for navigating the literature. Nat Genet. 2004;36:664. [PubMed] [DOI] |
| 9. | Knudsen ES, Dervishaj O, Kleer CG, Pajak T, Schwartz GF, Witkiewicz AK. EZH2 and ALDH1 expression in ductal carcinoma in situ: complex association with recurrence and progression to invasive breast cancer. Cell Cycle. 2013;12:2042-2050. [PubMed] [DOI] |
| 10. | Yang YA, Yu J. EZH2, an epigenetic driver of prostate cancer. Protein Cell. 2013;4:331-341. [PubMed] [DOI] |
| 11. | Yoo KH, Hennighausen L. EZH2 methyltransferase and H3K27 methylation in breast cancer. Int J Biol Sci. 2012;8:59-65. [PubMed] [DOI] |
| 12. | Chase A, Cross NC. Aberrations of EZH2 in cancer. Clin Cancer Res. 2011;17:2613-2618. [PubMed] [DOI] |
| 13. | Penland SK, Goldberg RM. Combining anti-VEGF approaches with oxaliplatin in advanced colorectal cancer. Clin Colorectal Cancer. 2004;4 Suppl 2:S74-S80. [PubMed] [DOI] |
| 14. | Díaz-Rubio E, Schmoll HJ. Introduction. Critical role of anti-angiogenesis and VEGF inhibition in colorectal cancer. Oncology. 2005;69 Suppl 3:1-3. [PubMed] [DOI] |
| 15. | Carrato A, Gallego-Plazas J, Guillen-Ponce C. Anti-VEGF therapy: a new approach to colorectal cancer therapy. Expert Rev Anticancer Ther. 2006;6:1385-1396. [PubMed] [DOI] |
| 16. | Wilson RH. Novel therapeutic developments other than EGFR and VEGF inhibition in colorectal cancer. Oncologist. 2006;11:1018-1024. [PubMed] [DOI] |
| 17. | Martinelli E, Troiani T, Morgillo F, Orditura M, De Vita F, Belli G, Ciardiello F. Emerging VEGF-receptor inhibitors for colorectal cancer. Expert Opin Emerg Drugs. 2013;18:25-37. [PubMed] [DOI] |
| 18. | Hansen TF, Jakobsen A. Clinical implications of genetic variations in the VEGF system in relation to colorectal cancer. Pharmacogenomics. 2011;12:1681-1693. [PubMed] [DOI] |