修回日期: 2020-11-07
接受日期: 2020-11-24
在线出版日期: 2020-12-28
沃诺拉赞(vonoprazan, VPZ)作为一种新型抑酸剂, 已被日本广泛用于根除幽门螺旋杆菌、治疗胃食管反流性疾病以及消化性溃疡. 但和质子泵抑制剂(proton pump inhibitors, PPIs)相比, VPZ具有抑酸效果更稳定、时间更长的特点. 结合以往研究结果可推测: VPZ能比PPIs更有效预防胃内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)术后迟发性出血及促进人造溃疡愈合.
比较VPZ和PPIs在预防胃ESD术后迟发性出血和促进术后人造溃疡愈合方面的效果差异.
计算机检索国内外公开数据库: PubMed、EMBASE、The Cochrane Library、Google Scholar、CNKI数据库、万方数据库、维普数据库. 按照预设标准纳入文章及提取数据. 采用Cochrane 系统评价手册及Newcastle-Ottawa评分量表对纳入文献进行质量评价. 采用软件Revman 5.2 完成Meta分析. 采用统计软件Stata 14.0评估发表偏倚及绘制Begg漏斗图.
本次研究共纳入19篇文献. Meta分析结果表明, 在全体纳入患者中, VPZ与PPIs相比预防胃ESD术后迟发性出血的效果并无统计学差异[RR = 0.86, 95%CI (0.61, 1.21), P = 0.38]. 在抗栓人群亚组中, VPZ预防术后迟发性出血的效果与PPIs无统计学差异[RR = 1.35, 95%CI (0.52, 3.48), P = 0.54]; 在非抗栓人群亚组中, VPZ预防术后迟发性出血的效果与PPIs相比亦无统计学差异[RR = 0.68, 95%CI (0.41, 1.10), P = 0.12]. 在促进人造溃疡愈合方面, VPZ在术后4 wk内能比PPIs更显著加速人造溃疡愈合[RR = 1.37, 95%CI (1.06, 1.77), P = 0.02]; 而在术后8 wk内, VPZ与PPIs相比促进溃疡愈合的效果则无统计学差异[RR = 1.02, 95%CI (0.95, 1.09), P = 0.60]. 在敏感性分析中, 移除3个合并使用胃黏膜保护剂的研究后, 全体患者迟发性出血率、第4周人造溃疡愈合率、第8周人造溃疡愈合率的RR值分别为0.90(P = 0.56)、1.34(P = 0.04)及1.02(P = 0.60).
在胃ESD术后4 wk内, 服用VPZ能比PPIs促进人造溃疡更快愈合. 在术后服药第8周内, VPZ和PPIs促进溃疡愈合的效果则无明显差异. 无论在抗栓人群还是非抗栓人群中, 术后服用VPZ与服用PPIs相比在预防术后迟发性出血时均无显著效果差异.
核心提要: 胃内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)术后4 wk内服用沃诺拉赞(vonoprazan, VPZ)比服用质子泵抑制剂(proton pump inhibitors, PPIs)促进人造溃疡更快愈合. 无论在抗栓人群还是非抗栓人群中, 术后服用VPZ与服用PPIs相比在预防术后迟发性出血时均无显著效果差异.
引文著录: 陈旋, 徐梦婷, 文剑波. 新型抑酸剂沃诺拉赞与传统PPIs预防胃ESD术后迟发性出血和促进人造溃疡愈合比较的Meta分析: 2474例. 世界华人消化杂志 2020; 28(24): 1249-1260
Revised: November 7, 2020
Accepted: November 24, 2020
Published online: December 28, 2020
Vonoprazan (VPZ) is a novel potassium-competitive acid blocker that has been widely used in Japan for Helicobacter pylori eradication and for treatment of gastroeasophageal reflux disease and peptic ulcer. Compared with proton pump inhibitors (PPIs), VPZ can inhibit acid secretion more stably and effectively. Based on the results of previous studies, we speculated that compared with PPIs, VPZ is more effective in preventing delayed bleeding and facilitating ulcer healing after gastric endoscopic submucosal dissection (ESD).
To compare the efficacy of VPZ and PPIs in preventing delayed bleeding and facilitating ulcer healing after gastric ESD.
We collected randomized controlled trials (RCTs) or cohort studies on the effectiveness of VPZ and PPIs in ESD-induced ulcer and delayed bleeding from electronic datasets including PubMed, EMBASE, Cochrane Library, Google Scholar, CNKI database, Wanfang database, and VIP database. The Cochrane Risk of Bias Tool and Newcastle Ottawa Quality Assessment Scale were applied to evaluate the quality of the articles included. Meta-analysis was performed using software Revman 5.2. Publication bias was assessed and Begg's graphs were drawn using Stata 14.0. Trim and fill analysis was performed when the publication bias was significant.
Nineteen studies were included in this Meta-analysis. The overall risk ratio (RR) of VPZ relative to PPIs for delayed bleeding was 0. 86 (P = 0. 38; 95%CI: 0.61-1.21). The RR in the subgroup of antithrombotic patientes was 1.35 (P = 0.54; 95%CI: 0.52-3.48), while the RR in the subgroup of non-antithrombotic patients was 0.68 (P = 0.12; 95%CI: 0.41-1.10). The RR of VPZ relative to PPIs was 1.37 (P = 0.02; 95%CI: 1.06-1.77) at 4 wk and 1.02 (P = 0.60; 95%CI: 0.95-1.09) at 8 wk. After excluding three studies with combination treatment, the RRs for delayed bleeding, ulcer healing at 4 wk, and ulcer healing at 8 wk were 0.90 (P = 0.56), 1.34 (P = 0.04), and 1. 02 (P = 0.60), respectively.
During the first 4 wk after gastric ESD, VPZ promotes ulcer healing faster than PPIs. At the end of the 8th weeks after ESD, there is no significant difference between VPZ and PPIs for ulcer healing. In the postoperative population with or without using antithrombotic drugs, compared with PPIs, VPZ does not exhibit any superiority in preventing delayed bleeding.
- Citation: Chen X, Xu MT, Wen JB. Meta-analysis of vonoprazan and proton pump inhibitors in preventing delayed bleeding and facilitating ulcer healing after gastric endoscopic submucosal dissection. Shijie Huaren Xiaohua Zazhi 2020; 28(24): 1249-1260
- URL: https://www.wjgnet.com/1009-3079/full/v28/i24/1249.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i24.1249
作为一项内镜下微创手术技术, 内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)形成于20世纪90年代的日本, 近年来已发展成为早期胃癌、平滑肌瘤、间质瘤等胃部良恶性肿瘤的主要治疗手段之一[1]. 胃ESD手术和传统外科手术如胃癌根治术、胃大部切除术相比, 具有创伤小、恢复快、并发症少的优势[2]. 然而近年来随着胃ESD手术适应证的扩展和内镜诊疗水平的提高, ESD术后人造溃疡的面积和深度都有所增加, 这使得ESD相关并发症如术中穿孔、迟发性出血、医源性溃疡愈合不良的发生率也有所升高[3]. 目前, 我国国内胃ESD术后人造溃疡的管理方案仍旧以包括雷贝拉唑、艾司奥美拉唑在内的质子泵抑制剂(proton pump inhibitors, PPIs)和黏膜保护剂为主. 但是传统PPIs一直以来存在以下弱点: 半衰期短、在酸性环境中的易被破坏、仅抑制进餐后活化的质子泵、在达到完全抑酸效果疗程长, 以及与药物代谢酶CYP2C19基因多态性相关的临床变异性[4,5]. 因此, 应用更加稳定、强效、效果持久的新型抑酸剂无疑能使胃ESD术后的广大患者获益.
沃诺拉赞(vonoprazan, VPZ)是一种新型钾离子竞争性酸阻滞剂, 最早于2014-12在日本获批用于临床治疗[6]. 和包括艾司奥美拉唑、兰索拉唑在内的传统PPIs相比, VPZ直接与壁细胞管腔面上质子泵的钾离子结合位点相结合, 几乎不受CYP2C19多态性影响, 同时对质子泵的抑制作用无需酸的激活, 不受进餐影响, 因此拥有具有迅速、持续、稳定的胃酸分泌抑制作用[7]. 目前, 一些研究显示, VPZ在反流性食管炎、幽门螺旋杆菌根除、消化性溃疡治疗中的效果不亚于传统PPIs[8-10].
关于VPZ和传统PPIs相比在胃ESD术后人造溃疡管理中的作用, 近年来一些研究已经进行探索, 但是这些研究报道结果不一且至今仍存在争议. 尽管此前国外一些Meta分析已经发现VPZ在预防胃ESD术后迟发性出血及促进医源性溃疡愈合方面并不优于传统PPIs[11,12], 但是这些研究都只纳入少量相关文献, 在数据提取方面存在较大偏倚, 而且缺少对ESD术后出血高危人群如抗栓药物使用人群的进一步探讨. 另外, 随着VPZ逐步进入临床使用阶段, 在国内最新专家共识推荐胃ESD术后常规应用PPIs以预防迟发性出血、促进医源性溃疡尽快愈合的背景下[3], 研究VPZ与传统PPIs在胃ESD术后管理中的优劣既有利于指导VPZ的用药, 也有利于减轻新药滥用带来的医疗经济负担. 故本研究旨在先前研究基础上, 结合最新发表的研究, 对VPZ与PPIs相比在预防胃ESD术后迟发性出血和促进人造溃疡愈合中的疗效进行Meta分析, 以期为VPZ的临床应用提供循证证据.
1.1.1 检索关键词与数据库: 计算机检索国内外公开数据库, 检索时间范围为各数据库建库起至2020-07. 检索词主要为: "vonoprazan", "P-CAB", "potassium-competitive acid blocker", "TAK-438", "沃诺拉赞", "伏诺拉生", "PPIs", "proton pump inhibitors", "质子泵抑制剂", "ESD", "endoscopic submucosal dissection"以及"内镜黏膜下剥离术", 采用主题词与自由词相结合的检索方式. 检索人员为2人, 检索的外文数据库有: PubMed、EMBASE、The Cochrane Library和Google Scholar, 中文数据库包括: CNKI、维普、万方. 国外数据库检索语种限定为英文, 国内数据库检索语种限定为中文. 所得文献经多次筛选直至得出最佳文献.
1.1.2 纳入及排除标准: 纳入标准: (1)研究类型为随机对照研究或队列研究; (2)研究纳入患者为因胃良性肿瘤、早期胃癌或其他病变行ESD治疗的患者, 年龄大于或等于18岁; (3)纳入的患者术后接受PPIs、VPZ二者之一进行溃疡治疗, 加用或不加用胃黏膜保护剂; (4)受试者ESD术后服药及随访时间为2 wk或以上. 排除标准: (1)重复文献; (2)综述、Meta分析、病例报告等其他类型文献; (3)没有任何一项所需结局指标的随机对照研究或队列研究; (4)不符合纳入标准的其他文献.
1.2.1 干预方法: VPZ加用或不加用黏膜保护剂为试验组; PPIs加用或不加用黏膜保护剂为对照组; 两组患者在基线资料如年龄、性别等方面具有可比性.
1.2.2 结局指标: (1)迟发性出血: 术中止血确切而术后一段时间以后出现血红蛋白浓度下降达到或超过20 g/L或指向术后溃疡出血的其他临床证据, 如严重的呕血、黑便、失血性休克或内镜下溃疡出血; (2)根据Sakita-Miwa溃疡分期法[13], 若随访时内镜下人工溃疡进入红色瘢痕期或白色瘢痕期, 即S1或S2期, 则视为溃疡愈合.
1.2.3 相关文献评价: 随机对照研究以Cochrane系统评价员手册为文献评价工具[14], 具体包括随机方法是否正确; 是否分配隐藏; 是否采用盲法; 结果数据是否完整; 是否选择性报告研究结果; 是否存在其他偏倚来源; 各项均分为"低风险"、"高风险"、"不清楚". 对队列研究以Newcastle-Ottawa量表为文献评价工具[15], 评分0至3分为低质量研究, 评分4分及以上视为高质量研究. 2名研究者对检索所得文献进行筛选和评价并相互核对, 如产生分歧, 通过征求第三方的方式得出最终结论.
统计学处理 本研究应用软件RevMan 5.2完成Meta分析及森林图绘制. 效应值采用RR值及其95%置信区间描述, 采用χ2检验各研究之间异质性, 并用I2评价各研究异质性大小. 当I2<50%, P>0.1时, 则提示各研究之间无统计学异质性, 采用固定效应模型; 当I2>50%, P≤0.1时, 则提示存在统计学异质性, 此时采用随机效应模型. 采用亚组分析评价组间异质性及效应值. 对发表偏倚的评价本研究采用Stata14.0软件进行Begg's检验及Egger's检验, P<0.05提示有统计学差异. 对于有显著发表偏倚的指标应用非参数剪补法[16]进一步评估发表偏倚对Meta分析结果的影响大小.
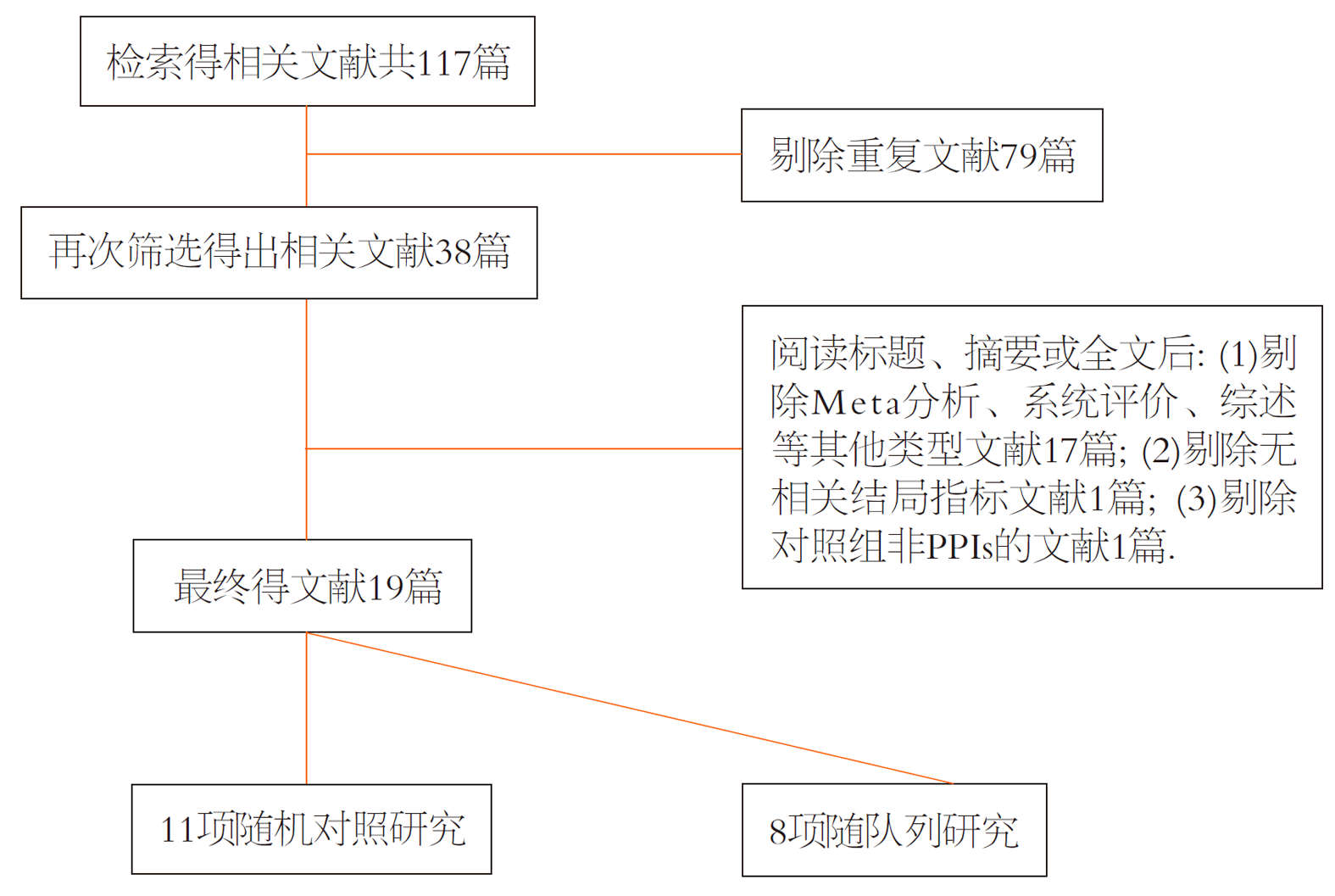
按照上述检索词分别搜索各个数据库, 总共得出候选文献117篇, 将79篇重复文献剔除得出相关文献38篇, 再通过阅读标题、摘要或全文剔除系统评价、Meta分析、综述等其他类型文献17篇、无相关结局指标文献1篇、对照组为非PPIs的文献1篇, 最终得出文献19篇[17-35]. 其中, 11篇文献的研究类型为随机对照试验, 其余8篇则为队列研究. 全部研究总共纳入患者2474例, 其中试验组纳入患者1170例, 对照组纳入患者1304例. 文献和纳入患者的基线资料(年龄、性别)如表1所示. 文献筛选流程如图1所示.
| 作者、年份 | 研究类型 | 对照设置(术后每日用药及剂量) | 服药疗程(wk) | 内镜随访时间点(wk) | 人数 | 平均年龄(岁) | 男性人数(%) | 溃疡瘢痕期人数 | 迟发性出血发生率 |
| Yamamoto等[17] 2020 | 队列研究 | A: VPZ 20 mg | 4 | 未内镜随访 | 50 | 78(54-87) | 33(66.0%) | NA | 8/50 |
| B: 艾司奥美拉唑 20 mg | 4 | 116 | 75(59-87) | 100(86.2%) | 14/116 | ||||
| Ishida等[18] 2020 | 队列研究 | A: VPZ 20 mg | 6 | 6 | 205 | 72(42-93) | 157(76.6%) | 140/205 | 8/205 |
| B: 标准剂量传统PPIs1 | 8 | 8 | 205 | 72(40-92) | 153(74.6%) | 153/205 | 9/205 | ||
| Ban等[19] 2019 | 随机对照研究 | A: VPZ 20 mg | 8 | 4、8 | 45 | NS | NS | 4 wk: 6/44; 8 wk: 42/45 | NA |
| B: 兰索拉唑 30 mg | 8 | 4、8 | 50 | 4 wk: 4/43; 8 wk: 41/47 | |||||
| Hamada等[20] 2019 | 随机对照研究 | A: VPZ 20 mg | 8 | 未内镜随访 | 69 | NS | NS | NA | 3/69 |
| B: 兰索拉唑 30 mg | 8 | 70 | 4/70 | ||||||
| Ichida等[21] 2019 | 随机对照研究 | A: VPZ 20 mg + 瑞巴派特 300 mg | 8 | 4、8 | 43 | 72.1 | NS | 4 wk: 9/43; 8 wk: 39/43 | 1/43 |
| B: 艾司奥美拉唑 20 mg + 瑞巴派特 300 mg | 8 | 4、8 | 39 | 87.2 | 4 wk: 6/39; 8 wk: 36/39 | 4/39 | |||
| Kakushima等[22] 2019 | 队列研究 | A: VPZ 20 mg | 8 | 未内镜随访 | 59 | 76±7 | 52 (88%) | NA | 17/59 |
| B: 艾司奥美拉唑 20 mg | 8 | 71 | 77±6 | 56 (79%) | 9/71 | ||||
| Komori等[23] 2019 | 随机对照研究 | A: VPZ 20 mg | 4 | 4 | 18 | 69±9.3 | 13 (72.2%) | 0/18 | 0/18 |
| B: 雷贝拉唑 10 mg | 4 | 4 | 15 | 70.9±8.8 | 11(73.3%) | 0/15 | 2/15 | ||
| Kusumoto等[24] 2018 | 随机对照研究 | A: VPZ 20 mg | 4 | 4 | 133 | NS | NS | 40/133 | NA |
| B: 雷贝拉唑10 mg | 4 | 4 | 89 | 15/89 | |||||
| Hirai等[25] 2018 | 随机对照研究 | A: VPZ 20 mg | 8 | 4、8 | 61 | 73.16±7.48 | NS | 4 wk: 10/61; 8 wk: 53/61 | 4/61 |
| B: 兰索拉唑 30 mg | 8 | 4、8 | 66 | 69.93±11.0 | 4 wk: 17/66; 8 wk: 60/66 | 4/66 | |||
| Horikawa等[26] 2018 | 队列研究 | A: VPZ 20 mg | 2 | 2 | 62 | 69.5(47.0-84.0) | 44(71.0%) | NA | 0/62 |
| B: 兰索拉唑 30 mg | 2 | 2 | 53 | 73.0(60.0-86.0) | 34(64.1%) | 0/53 | |||
| Ishii等[27] 2018 | 随机对照研究 | A: VPZ 20 mg + 瑞巴派特 300 mg | 8 | 4、8 | 27 | 70(65.3-75) | 23(85.2%) | 4 wk: 2/27; 8 wk: 24/27 | 0/27 |
| B: 艾司奥美拉唑20 mg + 瑞巴派特 300 mg | 8 | 4、8 | 26 | 70(66-75.3) | 22(84.6%) | 4 wk: 3/26; 8 wk: 22/26 | 0/26 | ||
| Yamasaki等[28] 2018 | 队列研究 | A: VPZ 20 mg | 4 | 4 | 77 | 71(39-87) | 54(70.1%) | 24/77 | 3/77 |
| B: 雷贝拉唑 20 mg | 4 | 4 | 90 | 70(42-90) | 66(73.3%) | 17/90 | 5/90 | ||
| Ishiguro等[29] 2018 | 随机对照研究 | A: VPZ 20 mg | 4 | 4 | 85 | NS | NS | 17/85 | 0/85 |
| B: 兰索拉唑 30 mg | 4 | 4 | 84 | 14/84 | 3/84 | ||||
| Ikeda等[30] 2017 | 队列研究 | A: VPZ 20 mg | 4 | 4 | 59 | NS | NS | NA | 4/59 |
| B: 标准剂量传统PPIs1 | 4 | 4 | 69 | 4/69 | |||||
| Maruoka等[31] 2017 | 队列研究 | A: VPZ 20 mg + 瑞巴派特 300 mg | 4 | 4 | 31 | 69.8±10.0 | 21(67.7%) | 10/31 | 0/31 |
| B: 艾司奥美拉唑20 mg + 瑞巴派特 300 mg | 4 | 4 | 31 | 71.4±9.2 | 19(61.3%) | 4/31 | 0/31 | ||
| Tsuchiya等[32] 2017 | 随机对照研究 | A: VPZ 20 mg | 8 | 8 | 39 | 73(67.5-80) | 27(69.2%) | 37/39 | 0/39 |
| B: 艾司奥美拉唑 20 mg | 8 | 8 | 41 | 74(71-80) | 30(73.2%) | 32/41 | 3/41 | ||
| Koimuzi等[33] 2017 | 随机对照研究 | A: VPZ 20 mg | 8 | 4、8 | 18 | 71.7 | 12(66.6%) | 4 wk: 0/18; 8 wk: 11/17 | 1/18 |
| B: 兰索拉唑 30 mg | 8 | 4、8 | 17 | 75.6 | 14(82.4%) | 4 wk: 0/17; 8 wk: 14/17 | 1/17 | ||
| Kagawa等[34] 2017 | 队列研究 | A: VPZ 20 mg | 5 | 5 | 75 | 72.3±8.4 | 52(69.3%) | NA | 1/75 |
| B: 雷贝拉唑 20 mg | 8 | 8 | 150 | 71.9±9.1 | 91(60.7%) | 15/150 | |||
| Takahashi等[35] 2017 | 随机对照研究 | A: VPZ 20 mg | 4 | 4 | 14 | 71.9 | 12(85.7%) | NA | 0/14 |
| B: 兰索拉唑 30 mg | 4 | 4 | 12 | 74.8 | 10(83.3%) | 0/12 |
随机对照研究的文献质量评价见表2: 其中, 1项研究未提及是否进行分配隐藏; 1项研究结局数据不完全可能导致失访偏倚; 1项研究未描述分配隐藏; 3项研究未采用研究者及受试者双盲, 8项研究未详细描述双盲的实施; 1项研究未使用结局评估者盲法, 8项研究未提及是否对结局评估者采用盲法; 所有研究均未发现选择性报道结果或其它偏倚来源. 队列研究的文献质量评价见表3: 在Newcastle-Ottawa量表评分中, 所有队列研究评价结果4分以上, 均可视为高质量研究.
| Refs. | 随机序列的产生 | 分配隐藏 | 实施者与参与者的双盲 | 结局评估中的盲法 | 结局数据不完全 | 选择性报道结局 | 其他偏倚来源 |
| Ban等[19] 2019 | 低风险 | 低风险 | 不清楚 | 不清楚 | 高风险 | 不清楚 | 低风险 |
| Hamada等[20] 2019 | 低风险 | 低风险 | 高风险 | 高风险 | 低风险 | 低风险 | 低风险 |
| Ichida等[21] 2019 | 低风险 | 不清楚 | 不清楚 | 不清楚 | 低风险 | 低风险 | 低风险 |
| Komori等[23] 2019 | 低风险 | 低风险 | 不清楚 | 不清楚 | 低风险 | 低风险 | 低风险 |
| Kusumoto等[24] 2018 | 低风险 | 低风险 | 不清楚 | 不清楚 | 低风险 | 低风险 | 低风险 |
| Hirai等[25] 2018 | 低风险 | 低风险 | 高风险 | 不清楚 | 低风险 | 低风险 | 低风险 |
| Ishii等[27] 2018 | 低风险 | 低风险 | 高风险 | 不清楚 | 低风险 | 低风险 | 低风险 |
| Ishiguro等[29] 2018 | 低风险 | 低风险 | 不清楚 | 不清楚 | 低风险 | 低风险 | 低风险 |
| Tsuchiya等[32] 2017 | 低风险 | 低风险 | 不清楚 | 低风险 | 低风险 | 低风险 | 低风险 |
| Koimuzi等[33] 2017 | 低风险 | 低风险 | 不清楚 | 低风险 | 低风险 | 低风险 | 低风险 |
| Takahashi等[35] 2017 | 低风险 | 低风险 | 不清楚 | 不清楚 | 低风险 | 低风险 | 低风险 |
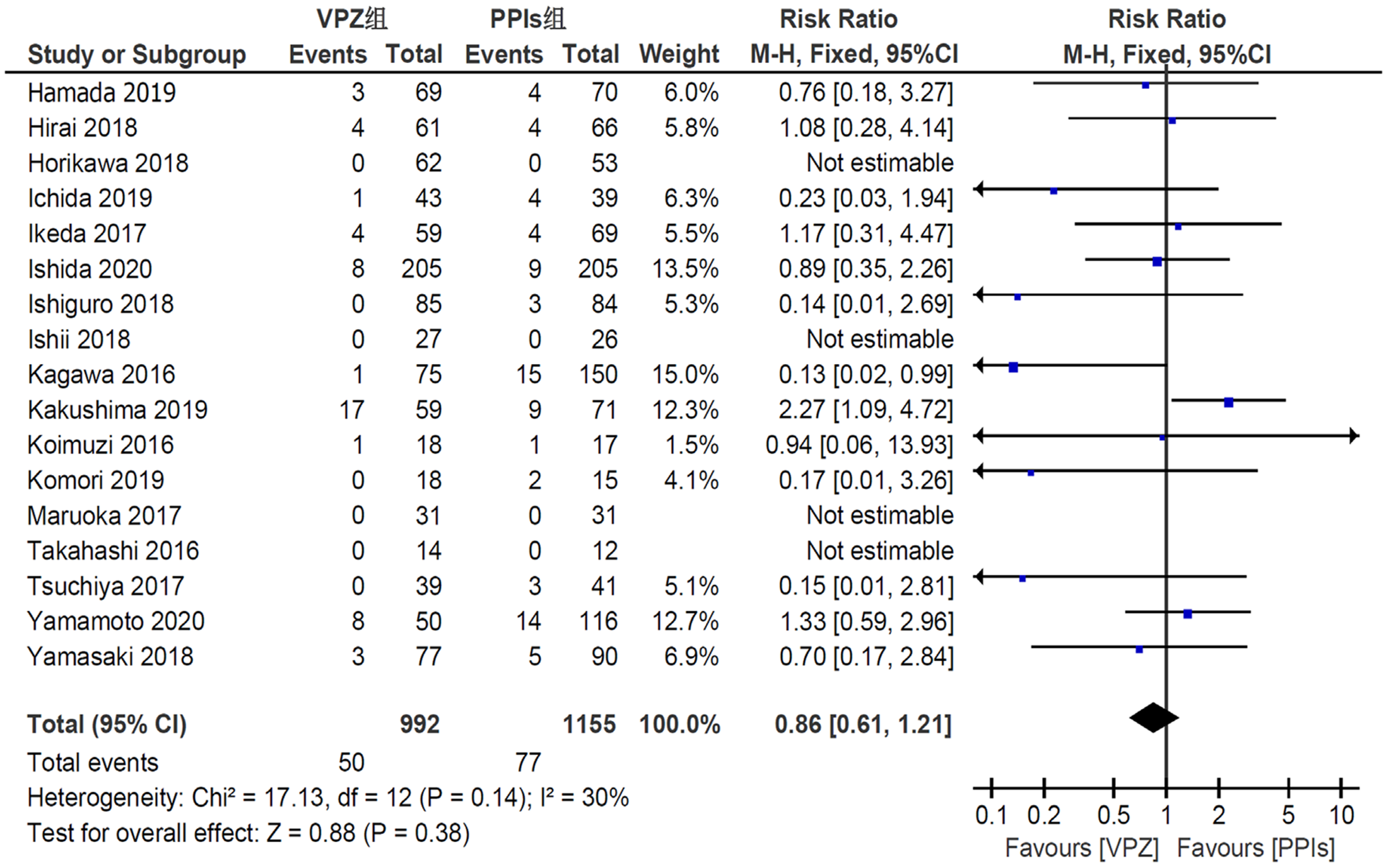
2.3.1 总人群的迟发性出血率: 19篇研究中共有17篇[17,18,20-23,25-35]报道ESD术后迟发性出血事件发生情况. Meta分析如图2所示, 各研究之间无统计学异质性(P = 0.14, I2 = 30%), 故进一步采用固定效应模型进行分析. 森林图显示, 纳入的所有研究中试验组与对照组之间总体迟发性出血率并无统计学差异[RR = 0.86, 95%CI(0.61, 1.21), P = 0.38].
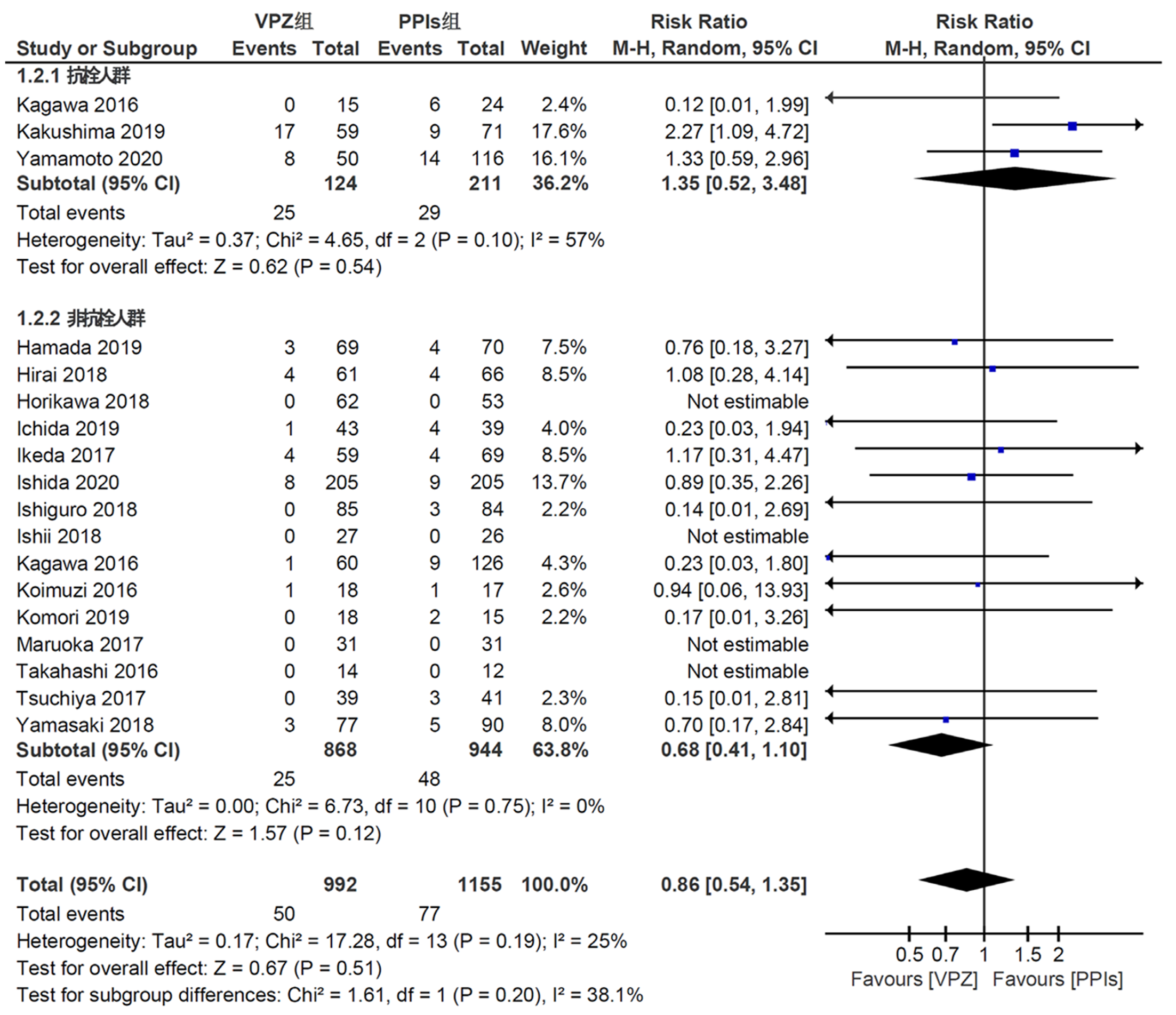
2.3.2 迟发性出血率的亚组分析: 在报道迟发性出血率的17项研究中, 2项研究[17,22]的纳入患者均长期使用包括抗血小板药物如阿司匹林或氯吡格雷、抗凝药物如华法林在内的抗栓药物. 另1项研究[34]纳入少部分长期使用抗栓药物人群. 根据是否为抗栓人群进行迟发性出血率的亚组分析, 如图3所示, 抗栓人群亚组内有统计学异质性(P = 0.10, I2 = 57%), 非抗栓人群亚组内无统计学异质性(P = 0.75, I2 = 0%), 而2个亚组间不存在明显的统计学异质性(P = 0.20, I2 = 38.1%), 故进一步采用随机效应模型进行分析. 在效应值方面: 抗栓人群亚组内, 试验组迟发性出血率与对照组无统计学差异[RR = 1.35, 95%CI(0.52, 3.48), P = 0.54], 同时, 在非抗栓人群亚组内, 试验组迟发性出血发生率与对照组亦无统计学差异[RR = 0.68, 95%CI(0.41, 1.10), P = 0.12].
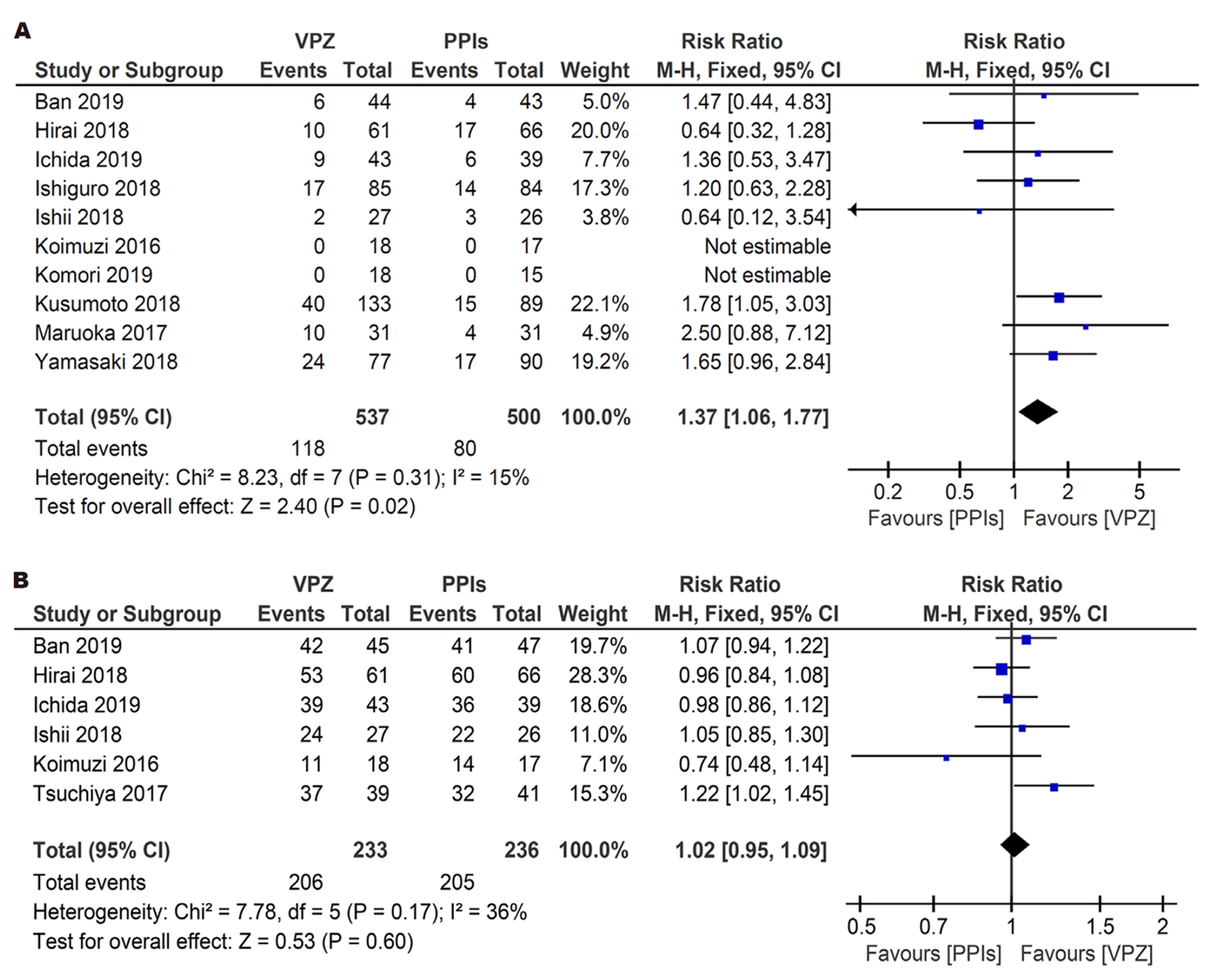
2.3.3 服药第4周人造溃疡愈合率: 19项研究中共有10项研究进行胃ESD术后服药第4周时人造溃疡愈合情况的内镜随访. 其中, 仅在Ban等[19]人的研究中, 试验组存在1人失访, 对照组存在7人失访; 其余研究均无患者失访. Meta分析结果如图4A所示, 纳入的10项研究之间不存在统计学异质性(P = 0.31, I2 = 15%), 故采用固定效应模型进行下一步分析. 在合并效应值方面, 术后服药第4周时试验组的人造溃疡愈合率明显高于对照组[RR = 1.37, 95%CI(1.06, 1.77), P = 0.02].
2.3.4 服药第8周人造溃疡愈合率: 19项研究中共有6项研究对胃ESD术后服药第8周时的人造溃疡愈合情况进行内镜随访. 其中, 仅在Ban等[19]人的研究中对照组存在3名患者失访; 其余研究随访数据均完整. Meta分析结果如图4B所示, 纳入的6项研究之间不存在统计学异质性(P = 0.17, I2 = 36%), 采用固定效应模型进行下一步分析. 在合并效应值方面, 术后服药第8周时试验组、对照组之间的人造溃疡愈合率不存在显著差异[RR = 1.02, 95%CI(0. 95, 1.09), P = 0.60].
2.3.5 敏感性分析: 上述Meta分析提示纳入研究整体异质性小. 为进一步进行敏感性分析, 3篇对照组、试验组均加用黏膜保护剂的研究[21,27,31]被移除以验证结果的稳定性. 移除上述研究后, 所有研究中试验组迟发性出血率仍与对照组无显著差异[RR = 0.90, 95%CI(0.64, 1.27), P = 0.56]. 术后服药第4周时试验组人造溃疡愈合率仍显著高于对照组[RR = 1.34, 95%CI(1.01, 1.78), P = 0.04]. 术后服药第8周时试验组人造溃疡愈合率与对照组相比仍无显著差别[RR = 1.02, 95%CI(0.94, 1.11), P = 0.60].
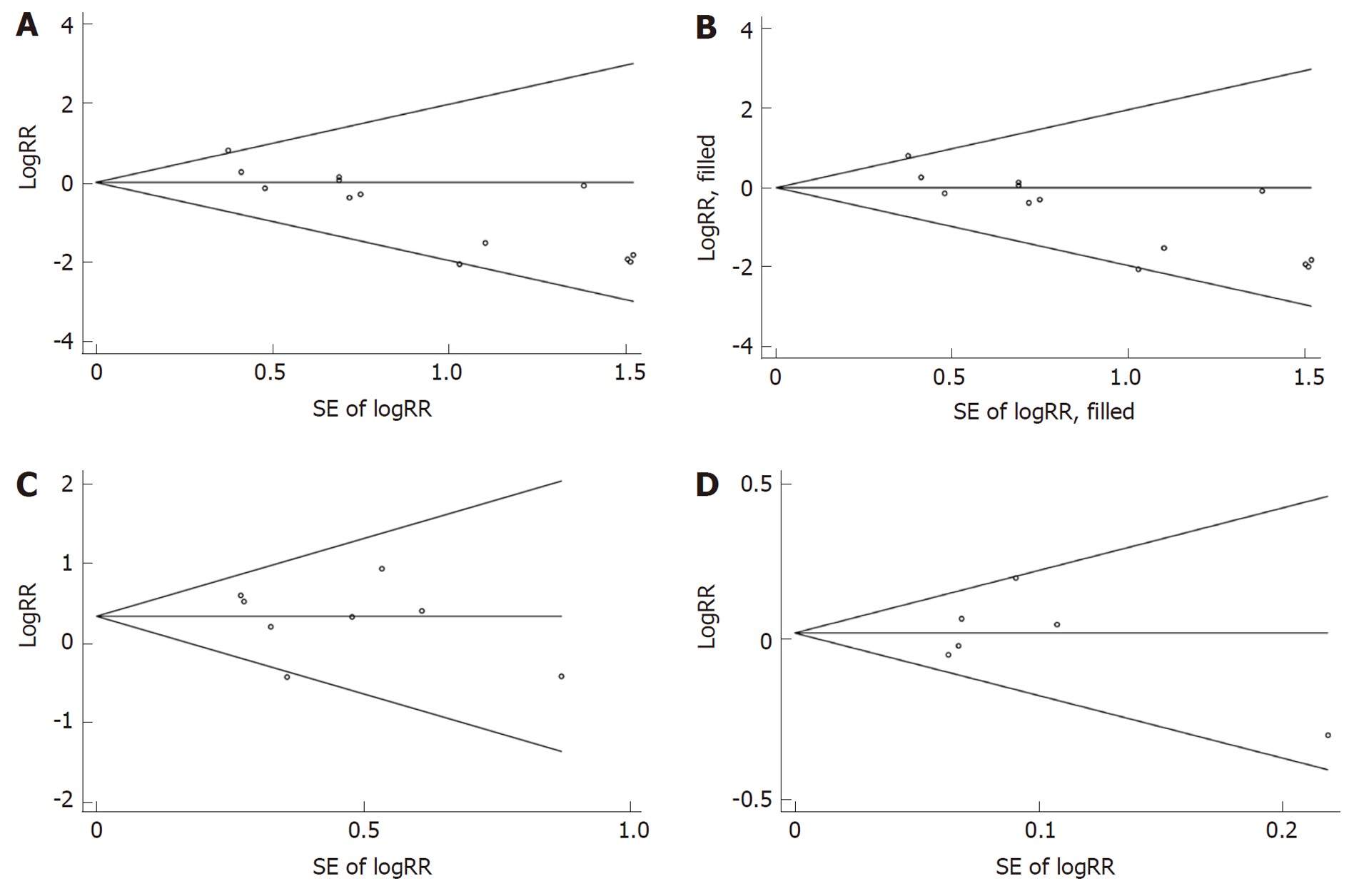
2.3.6 发表偏倚分析: 在全人群迟发性出血率方面, 如表4所示, Begg's检验校正后的P值为0.012, Egger's检验的P值为0.000, 两检验结果均提示存在发表偏倚可能性大, 故进一步用非参数剪补法分析发表偏倚对Meta分析结果的影响. 剪补法前后文献总数不变, 效应值完全一致, 剪补法前后的Begg's漏斗图如图5A、5B所示. 以术后服药第4周人造溃疡愈合率为指标, Begg's漏斗图如图5C所示. Begg's检验P值为0.536, Egger's检验P值为0.617. 以术后服药第8周人造溃疡愈合率为指标, Begg's漏斗图如图5D所示. Begg's检验P值为1.000, Egger's检验P值为0.761.
以迟发性出血率为结局指标, 本次Meta分析结果显示, 17篇文献合并后异质性小, 在纳入的所有患者中, 服用VPZ患者迟发性出血率与服用PPIs患者相比无显著差异. 对研究纳入人群进行亚组分析后显示, 无论在非抗栓人群还是在抗栓人群中, VPZ预防术后迟发性出血的效果与传统PPIs都无显著差异. 整个亚组分析组间异质性小且不具有统计学意义, 抗栓人群组内异质性均大且具有统计学意义, 提示抗栓人群研究很可能是重要异质性来源. 其次, 以术后服药第4周、第8周人造溃疡愈合率为指标, 分别对10项研究及6项研究进行合并. 术后服用VPZ患者在第4周时人造溃疡愈合率显著高于服用PPIs患者, 而术后服用VPZ或PPIs患者在第8周时人造溃疡愈合率并无显著差异, 2次合并异质性均小且无统计学意义. 另外, 本研究通过剔除3项合并使用黏膜保护剂瑞巴派特的研究进行敏感性分析, 3项结局指标的效应值均无明显改变或逆转, 提示Meta分析结果稳健. 最后, 针对全人群研究的迟发性出血率, Begg's检验及Egger's检验均有统计学意义, 提示存在发表偏倚可能性大. 进一步的非参数剪补法结果提示剪补前后研究数、效应值无变化, 说明发表偏倚对该结局指标影响小. 针对术后服药第4周、第8周的人造溃疡愈合率, Begg's检验和Egger's检验均无统计学意义, 提示上述2个指标存在发表偏倚可能性小, 结果稳健.
在胃壁缺损深度方面, ESD术后创面与消化性溃疡都可达黏膜下层甚至更深, 故一些文献把胃ESD术后创面称为广义上的"溃疡", 如医源性溃疡、人造溃疡或ESD术后溃疡. 然而两者在形成机制及病理学方面存在差异: 消化性溃疡则由于胃酸等侵袭因素和胃黏膜防御因素失衡所致, 而ESD术后人造溃疡由人工剥离造成; 消化性溃疡由于慢性炎症改变出现固有肌层纤维化、溃疡底部纤维性血管炎, 而ESD术后人造溃疡固有肌层保存相对完整. 这些差异导致ESD术后人造溃疡比消化性溃疡有更充足的血流, 因而愈合更快. 目前许多国外文献认为即使在目前各种内镜止血、钛夹封闭或钛夹联合尼龙绳缝合技术的辅助下, ESD术后仍应应用抑酸剂4-8 wk以尽可能减少迟发性出血或愈合不良情况的发生[28-32]. 此外, 国内最新ESD相关不良事件专家共识也明确建议胃ESD术后4-8 wk应常规应用PPIs以预防迟发性出血、促进医源性溃疡尽快愈合[3]. 在此背景下, 随着VPZ逐步进入我国临床应用, 对VPZ与PPIs在胃ESD术后溃疡管理中的效果进行循证比较无疑能指导VPZ的用药, 避免滥用新型抑酸剂, 也能为进一步临床研究提供参考.
与既往几项Meta分析研究结果相同, 本次研究发现在全人群中术后服用VPZ患者迟发性出血发生率与术后服用PPIs患者无明显差异. 与本次Meta分析相比, Gao等[36]人的研究为减少潜在偏倚及文献异质性只纳入随机对照研究而未纳入本次Meta分析中一些高质量的队列研究. Martin等[6]人的Meta分析尽管也纳入一些高质量队列研究, 但因VPZ组、PPIs组服药疗程不同故仍把Kagawa等[34]人的研究排除在外. 据统计[37], 绝大多数胃ESD术后迟发性出血发生于术后2 wk内, 而Kagawa等[34]人的队列研究中VPZ组与PPIs组服药时间均远超过2 wk, 对术后迟发性出血发生率的合并研究应具有纳入价值. 此外, 本研究还纳入2项针对抗栓人群药物使用人群的研究[17,22], 2项研究的结果及所有研究结果合并后均提示胃ESD术后服用VPZ或PPIs迟发性出血发生率无明显差异, 进一步说明两种药物在全人群中预防术后出血方面差别不显著.
本次Meta分析的新发现是: 无论在抗栓人群还是在非抗栓人群中, 胃ESD术后服用VPZ患者迟发性出血风险与服用PPIs患者相比均无明显差异. 长期口服包括阿司匹林、氯吡格雷、华法林在内的抗血小板药物或抗凝药物是公认的上消化道出血危险因素[38]. 抗血小板药物如氯吡格雷、阿司匹林可阻碍胃黏膜修复使溃疡或糜烂灶进一步发展, 抗凝药如华法林则可通过拮抗维生素K、降低相关凝血因子水平从而抑制凝血、促进出血. VPZ与PPIs相比在大部分研究中均未显示出预防术后迟发性出血的效果优越性, 这可能与目前胃ESD手术中医师广泛使用药物喷洒止血、电凝止血、钛夹夹闭等技术进行术中确切止血从而大幅度降低术后迟发性出血率有关, 最终使得2种抑酸剂的抑酸效果差别对迟发性出血发生率影响不大. 这一点在抗栓药物使用人群中更为明显, 因为他们往往更能引起术者对术后出血风险的警惕从而术毕时更加细致地止血. 考虑到VPZ具有迅速、强效抑酸的特点[39], VPZ在胃ESD术后抗栓人群中的使用仍需要更多大样本多中心随机对照研究进行验证.
此外, 本次Meta分析还发现, 胃ESD术后服用VPZ 4 wk能比PPIs更有效地促进人造溃疡愈合, 而术后服药8 wk时2种药物促进人造溃疡愈合的疗效则并无显著差异. 解释这一结论的理论基础是VPZ能比PPIs更快达到最大抑酸效果, 这使得VPZ组患者能比PPIs组患者在短期内更快达到人造溃疡愈合. 同时VPZ亦受CYP2C19基因多态性等因素影响小, 这种稳定抑酸状态也为术后人造溃疡愈合提供更有利条件. 此前Kang等[40]人的Meta分析与本研究同样认为VPZ促进术后4 wk内人造溃疡愈合的效果明显强于PPIs, 但不同之处则是该研究认为VPZ促进术后8 wk内人造溃疡愈合的效果明显弱于PPIs. 和Kang等[40]人的分析不同, 本Meta分析并未纳入Kagawa等[34]人的研究, 因为该研究中VPZ组服药疗程为5 wk, 而PPIs组服药疗程则长达8 wk. 纳入这项研究会不可避免地对第8周人造溃疡愈合率合并效应带来偏倚. 最近发表的Martin等[6]人的Meta分析认为, VPZ与PPIs相比在术后服药第4周或第8周均不能显著促进人造溃疡愈合. 该研究与本研究相比造成结论差异的原因可能有以下2点: (1)Martin等[6]人的Meta分析未纳入Ishiguro等[29]人、Koimuzi等[33]人的队列研究; (2)在规定人造溃疡愈合标准时, Martin等[6]人还把"内镜下人造溃疡面积收缩率≥90%"视也为人造溃疡愈合标准, 从而把Otsuka等[41]人的研究也纳入在内. 在实际内镜随访中, 由于不同单位内镜系统与测量工具的差异、内镜医师操作习惯的不同, 溃疡面积收缩率测量会存在一定误差, 故这一标准可能并不十分可靠.
本次研究存在如下局限性: (1)纳入的研究全部为日本人群的研究, 缺少对其他国家人群的相关研究; (2)在评估VPZ与PPIs对预防胃ESD术后抗栓人群迟发性出血的效果时, 目前纳入的研究仅有3篇且均为非随机对照研究, 可能存在偏倚; (3)本次纳入的部分研究为小样本研究, 这同样可能是偏倚的来源之一. 四是在迟发性出血率方面很可能存在一定的发表偏倚, 这可能是因为部分阴性结果的研究未发表在国际杂志上而发表在日本国内杂志上. 此外, 本次Meta分析仅检索所有已发表的文献, 这也可能造成部分发表偏倚.
综上所述, VPZ作为一种新型抑酸剂, 能在术后短期内比PPIs更有效地促进溃疡愈合. 然而无论患者是否使用抗栓药物, VPZ与PPIs预防术后迟发性出血的效果均无显著差异, 这仍需要更多大样本多中心临床试验进行验证比较.
内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)是目前治疗胃良恶性肿瘤的主要微创手段之一. 近年来随着胃ESD手术适应征的扩展, 术后人造溃疡的深度、面积都有所增加, 术后迟发性出血、溃疡延迟愈合等事件发生率也随之提高. 沃诺拉赞(vonoprazan, VPZ)是一种新型抑酸剂, 已被用于治疗多种胃酸相关疾病. 目前, VPZ与质子泵抑制剂(proton pump inhibitors, PPIs)在胃ESD术后溃疡管理中的疗效还存在争议. 本文就二者在胃ESD术后溃疡管理中的疗效进行Meta分析, 以期指导VPZ的临床应用.
本文就新型抑酸剂VPZ与传统PPIs在预防胃ESD术后迟发性出血及促进溃疡愈合方面进行Meta分析, 为探寻在胃ESD术后溃疡管理中应用哪种抑酸剂能使病人获益更多.
主要目标为解决: 新型抑酸剂VPZ与传统抑酸剂PPIs相比能否更有效预防胃ESD术后溃疡迟发性出血: 在全人群研究中, 二者谁优谁劣; 在抗栓药物使用人群中, 二者谁优谁劣. VPZ与PPIs相比, 能否促进术后溃疡更快达到愈合. 这为未来VPZ的临床使用提供更多证据, 也为ESD术后溃疡的管理提供全新选择.
本文通过多个电子数据库检索相关文献, 筛选评价文献并提取数据. 使用Revman 5.2软件对数据进行Meta分析, 制作森林图. 所有数据都用χ2检验异质性. 若存在统计学异质性, 采用随机效应模型分析; 若无统计学异质性, 采用固定效应模型分析. 敏感性分析采用剔除部分文献的方法进行. 发表偏倚的检测采用Stata 14.0软件进行Begg's检验及Egger's检验并绘制Begg's漏斗图. 有发表偏倚时采用非参数剪补法评估发表偏倚对结果的影响.
无论在非抗栓还是在抗栓人群中, 胃ESD术后患者服用VPZ与服用PPIs相比预防迟发性出血的效果均无显著差异. 在胃ESD术后连续服药第4周时, 服用VPZ的患者溃疡愈合率显著高于服用PPIs的患者; 在术后连续服药第8周时, 服用VPZ或PPIs不影响溃疡愈合率.
本次Meta分析发现, 与服用PPIs相比, 胃ESD术后服用VPZ并不能更有效预防迟发性出血的发生, 但能在短期内促进人造溃疡更快愈合.
本次Meta分析中, 针对抗栓药物使用人群的纳入研究数量少且均为非随机对照研究, 未来需要更多大样本多中心随机对照实验来比较两种抑酸剂在抗栓人群中的疗效.
学科分类: 胃肠病学和肝病学
手稿来源地: 江西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D, D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Abiko S, Yoshikawa A, Harada K, Kawagishi N, Sano I, Oda H, Miyagishima T. Combination of search, coagulation, clipping, and polyglycolic acid sheet to prevent delayed bleeding after gastric endoscopic submucosal dissection. Endoscopy. 2020;52:E344-E345. [PubMed] [DOI] |
| 4. | Shin JM, Inatomi N, Munson K, Strugatsky D, Tokhtaeva E, Vagin O, Sachs G. Characterization of a novel potassium-competitive acid blocker of the gastric H, K-ATPase, 1-[5-(2-fluorophenyl)-1-(pyridin-3-ylsulfonyl)-1H-pyrrol-3-yl]-N-methylmethanamine monofumarate (TAK-438). J Pharmacol Exp Ther. 2011;339:412-420. [PubMed] [DOI] |
| 5. | Cho H, Choi MK, Cho DY, Yeo CW, Jeong HE, Shon JH, Lee JY, Shin JS, Cho M, Kim DY, Shin JG. Effect of CYP2C19 genetic polymorphism on pharmacokinetics and pharmacodynamics of a new proton pump inhibitor, ilaprazole. J Clin Pharmacol. 2012;52:976-984. [PubMed] [DOI] |
| 6. | Martin, Zhou Y, Meng CX, Takagi T, Tian YS. Vonoprazan vs proton pump inhibitors in treating post-endoscopic submucosal dissection ulcers and preventing bleeding: A meta-analysis of randomized controlled trials and observational studies. Medicine (Baltimore). 2020;99:e19357. [PubMed] [DOI] |
| 7. | Kagami T, Sahara S, Ichikawa H, Uotani T, Yamade M, Sugimoto M, Hamaya Y, Iwaizumi M, Osawa S, Sugimoto K, Miyajima H, Furuta T. Potent acid inhibition by vonoprazan in comparison with esomeprazole, with reference to CYP2C19 genotype. Aliment Pharmacol Ther. 2016;43:1048-1059. [PubMed] [DOI] |
| 8. | Gotoh Y, Ishibashi E, Honda S, Nakaya T, Noguchi C, Kagawa K, Murakami K. Efficacy of vonoprazan for initial and maintenance therapy in reflux esophagitis, nonerosive esophagitis, and proton pump inhibitor-resistant gastroesophageal reflux disease. Medicine (Baltimore). 2020;99:e19520. [PubMed] [DOI] |
| 9. | Okubo H, Akiyama J, Kobayakawa M, Kawazoe M, Mishima S, Takasaki Y, Nagata N, Shimada T, Yokoi C, Komori S, Kimura K, Hisada Y, Iwata E, Watanabe K, Yanagisawa N, Shiroma S, Shimomura A, Okahara K, Cho H, Uemura N. Vonoprazan-based triple therapy is effective for Helicobacter pylori eradication irrespective of clarithromycin susceptibility. J Gastroenterol. 2020;55:1054-1061. [PubMed] [DOI] |
| 10. | Mizokami Y, Oda K, Funao N, Nishimura A, Soen S, Kawai T, Ashida K, Sugano K. Vonoprazan prevents ulcer recurrence during long-term NSAID therapy: randomised, lansoprazole-controlled non-inferiority and single-blind extension study. Gut. 2018;67:1042-1051. [PubMed] [DOI] |
| 11. | He HS, Li BY, Chen QT, Song CY, Shi J, Shi B. Comparison of the Use of Vonoprazan and Proton Pump Inhibitors for the Treatment of Peptic Ulcers Resulting from Endoscopic Submucosal Dissection: A Systematic Review and Meta-Analysis. Med Sci Monit. 2019;25:1169-1176. [PubMed] [DOI] |
| 12. | Kim EH, Park SW, Nam E, Lee JG, Park CH. Comparative efficacy of various anti-ulcer medications after gastric endoscopic submucosal dissection: a systematic review and network meta-analysis. Surg Endosc. 2019;33:1271-1283. [PubMed] [DOI] |
| 13. | Song KH, Lee YC, Fan DM, Ge ZZ, Ji F, Chen MH, Jung HC, Bo J, Lee SW, Kim JH. Healing effects of rebamipide and omeprazole in Helicobacter pylori-positive gastric ulcer patients after eradication therapy: a randomized double-blind, multinational, multi-institutional comparative study. Digestion. 2011;84:221-229. [PubMed] [DOI] |
| 14. | Cumpston M, Li T, Page MJ, Chandler J, Welch VA, Higgins JP, Thomas J. Updated guidance for trusted systematic reviews: a new edition of the Cochrane Handbook for Systematic Reviews of Interventions. Cochrane Database Syst Rev. 2019;10:ED000142. [PubMed] [DOI] |
| 15. | Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses. Eur J Epidemiol. 2010;25:603-605. [PubMed] [DOI] |
| 17. | Yamamoto S, Takayama H, Shimodate Y, Takezawa R, Nishimura N, Doi A, Mouri H, Matsueda K, Mizuno M, Okada H. Effect of Vonoprazan on Delayed Bleeding after Endoscopic Submucosal Dissection for Gastric Neoplasia among Antithrombotic Drug Users: A Single-Center, Single-Arm Prospective Observational Case Control Study. Acta Med Okayama. 2020;74:245-250. [PubMed] [DOI] |
| 18. | Ishida T, Dohi O, Yamada S, Yasuda T, Yamada N, Tomie A, Tsuji T, Horii Y, Majima A, Horie R, Fukui A, Zen K, Tomatsuri N, Yagi N, Naito Y, Itoh Y. Clinical Outcomes of Vonoprazan-Treated Patients after Endoscopic Submucosal Dissection for Gastric Neoplasms: A Prospective Multicenter Observation Study. Digestion. 2020;1-11. [PubMed] [DOI] |
| 19. | Ban H, Otsuka T, Sugimoto M, Andoh A. Effect of potassium-competitive acid blocker to healing of artificial ulcer after endoscopic submucosal dissection: Prospective randomized trial. United European Gastroenterology Journal. 2019;7:725. [DOI] |
| 20. | Hamada K, Uedo N, Tonai Y, Arao M, Suzuki S, Iwatsubo T, Kato M, Shichijo S, Yamasaki Y, Matsuura N, Nakahira H, Kanesaka T, Yamamoto S, Akasaka T, Hanaoka N, Takeuchi Y, Higashino K, Ishihara R, Okada H, Iishi H, Fukui K, Shimokawa T. Efficacy of vonoprazan in prevention of bleeding from endoscopic submucosal dissection-induced gastric ulcers: a prospective randomized phase II study. J Gastroenterol. 2019;54:122-130. [PubMed] [DOI] |
| 21. | Ichida T, Ueyama S, Eto T, Kusano F, Sakai Y. Randomized Controlled Trial Comparing the Effects of Vonoprazan Plus Rebamipide and Esomeprazole Plus Rebamipide on Gastric Ulcer Healing Induced by Endoscopic Submucosal Dissection. Intern Med. 2019;58:159-166. [PubMed] [DOI] |
| 22. | Kakushima N, Ono H, Takizawa K, Tanaka M, Kawata N, Yoshida M, Murai K, Yabuuchi Y, Kishida Y, Ito S, Imai K, Hotta K, Ishiwatari H, Matsubayashi H. Incidence of Delayed Bleeding among Patients Continuing Antithrombotics during Gastric Endoscopic Submucosal Dissection. Intern Med. 2019;58:2759-2766. [PubMed] [DOI] |
| 23. | Komori H, Ueyama H, Nagahara A, Akazawa Y, Takeda T, Matsumoto K, Matsumoto K, Asaoka D, Hojo M, Yao T, Watanabe S. A prospective randomized trial of a potassium competitive acid blocker vs proton pump inhibitors on the effect of ulcer healing after endoscopic submucosal dissection of gastric neoplasia. J Int Med Res. 2019;47:1441-1452. [PubMed] [DOI] |
| 24. | Kusumoto T, Yamada T, Nakanishi R, Nagahama S, Kimura E, Tanimoto T, Ohnishi K, Sueyoshi Y, Yamaguchi T, Matsumoto K, Hirao M, Hosui A, Hiramatsu N. Effect of vonoprazan on the treatment of post-endoscopic submucosal dissection artificial gastric ulcer. United European Gastroenterology Journal. 2018;6:A589. [DOI] |
| 25. | Hirai A, Takeuchi T, Takahashi Y, Kawaguchi S, Ota K, Harada S, Kojima Y, Tominaga K, Tokioka S, Higuchi K. Comparison of the Effects of Vonoprazan and Lansoprazole for Treating Endoscopic Submucosal Dissection-Induced Artificial Ulcers. Dig Dis Sci. 2018;63:974-981. [PubMed] [DOI] |
| 26. | Horikawa Y, Mizutamari H, Mimori N, Kato Y, Fushimi S, Sato S, Okubo S. Short-term efficacy of potassium-competitive acid blocker following gastric endoscopic submucosal dissection: a propensity score analysis. Scand J Gastroenterol. 2018;53:243-251. [PubMed] [DOI] |
| 27. | Ishii Y, Yamada H, Sato T, Sue S, Kaneko H, Irie K, Sasaki T, Tamura T, Ikeda R, Fukuchi T, Kobayashi R, Makazu M, Sato C, Hirasawa K, Kondo M, Shibata W, Maeda S. Effects of Vonoprazan Compared with Esomeprazole on the Healing of Artificial Postendoscopic Submucosal Dissection Ulcers: A Prospective, Multicenter, Two-Arm, Randomized Controlled Trial. Gastroenterol Res Pract. 2018;2018:1615092. [PubMed] [DOI] |
| 28. | Yamasaki A, Yoshio T, Muramatsu Y, Horiuchi Y, Ishiyama A, Hirasawa T, Tsuchida T, Sasaki Y, Fujisaki J. Vonoprazan is Superior to Rabeprazole for Healing Endoscopic Submucosal Dissection: Induced Ulcers. Digestion. 2018;97:170-176. [PubMed] [DOI] |
| 29. | Ishiguro M, Takenaka R, Kawai D, Takei K, Miura K, Takemoto K, Tsugeno H, Fujiki S. A prospective, randomized controlled trial of vonoprazan versus lansoprazole in the treatment of artificial gastric ulcers after endoscopic submucosal dissection. United European Gastroenterology Journal. 2018;6:A380. [DOI] |
| 30. | Ikeda G, Ueki N, Futagami S, Agawa S, Noda H, Higuchi K, Akimoto T, Maruki Y, Yamawaki H, Kodaka Y, Kawagoe T, Miyake K, Kaise M, Iwakiri K. The effect of vonoprazan for endoscopic submucosal dissection-induced ulceration and postoperative bleeding. United European Gastroenterology Journal. 2017;5:A439. [DOI] |
| 31. | Maruoka D, Arai M, Kasamatsu S, Ishigami H, Taida T, Okimoto K, Saito K, Matsumura T, Nakagawa T, Katsuno T, Yokosuka O. Vonoprazan is superior to proton pump inhibitors in healing artificial ulcers of the stomach post-endoscopic submucosal dissection: A propensity score-matching analysis. Dig Endosc. 2017;29:57-64. [PubMed] [DOI] |
| 32. | Tsuchiya I, Kato Y, Tanida E, Masui Y, Kato S, Nakajima A, Izumi M. Effect of vonoprazan on the treatment of artificial gastric ulcers after endoscopic submucosal dissection: Prospective randomized controlled trial. Dig Endosc. 2017;29:576-583. [PubMed] [DOI] |
| 33. | Koizumi A, Yamashita H, Okada A. Comparison of lansoprazole with vonoprazan for treating post-endoscopic submucosal dissection ulcers. United European Gastroenterology Journal. 2016;4:A387-A388. [DOI] |
| 34. | Kagawa T, Iwamuro M, Ishikawa S, Ishida M, Kuraoka S, Sasaki K, Sakakihara I, Izumikawa K, Yamamoto K, Takahashi S, Tanaka S, Matsuura M, Hasui T, Wato M, Inaba T. Vonoprazan prevents bleeding from endoscopic submucosal dissection-induced gastric ulcers. Aliment Pharmacol Ther. 2016;44:583-591. [PubMed] [DOI] |
| 35. | Takahashi K, Sato Y, Kohisa J, Watanabe J, Sato H, Mizuno K, Hashimoto S, Terai S. Vonoprazan 20 mg vs lansoprazole 30 mg for endoscopic submucosal dissection-induced gastric ulcers. World J Gastrointest Endosc. 2016;8:716-722. [PubMed] [DOI] |
| 36. | Gao H, Li L, Zhang C, Tu J, Geng X, Wang J, Zhou X, Jing J, Pan W. Comparison of efficacy of pharmacological therapies for gastric endoscopic submucosal dissection-induced ulcers: a systematic review and network meta-analysis. Expert Rev Gastroenterol Hepatol. 2020;14:207-220. [PubMed] [DOI] |
| 37. | Lee SH, Lee CK, Chung IK, Shim YS, Lee TH, Lee SH, Kim HS, Park SH, Kim SJ. Optimal duration of proton pump inhibitor in the treatment of endoscopic submucosal dissection-induced ulcers: a retrospective analysis and prospective validation study. Dig Dis Sci. 2012;57:429-434. [PubMed] [DOI] |
| 38. | Tsujita K, Deguchi H, Uda A, Sugano K. Upper gastrointestinal bleeding in Japanese patients with ischemic heart disease receiving vonoprazan or a proton pump inhibitor with multiple antithrombotic agents: A nationwide database study. J Cardiol. 2020;76:51-57. [PubMed] [DOI] |
| 39. | Hori Y, Matsukawa J, Takeuchi T, Nishida H, Kajino M, Inatomi N. A study comparing the antisecretory effect of TAK-438, a novel potassium-competitive acid blocker, with lansoprazole in animals. J Pharmacol Exp Ther. 2011;337:797-804. [PubMed] [DOI] |
| 40. | Kang H, Kim BJ, Choi G, Kim JG. Vonoprazan versus proton pump inhibitors for the management of gastric endoscopic submucosal dissection-induced artificial ulcer: A systematic review with meta-analysis. Medicine (Baltimore). 2019;98:e15860. [PubMed] [DOI] |
| 41. | Otsuka T, Sugimoto M, Ban H, Nakata T, Murata M, Nishida A, Inatomi O, Bamba S, Andoh A. Severity of gastric mucosal atrophy affects the healing speed of post-endoscopic submucosal dissection ulcers. World J Gastrointest Endosc. 2018;10:83-92. [PubMed] [DOI] |