修回日期: 2020-09-29
接受日期: 2020-11-10
在线出版日期: 2020-12-08
胃肠动力是消化道生理功能的重要组成部分, 其功能紊乱是引起多种胃肠动力障碍疾病的关键因素之一. 这些疾病严重影响人们的正常生活. 随着科研技术的发展, 人们对胃肠动力调节机制方面的研究越来越多, 其作用机制主要涉及对胃肠激素、肠道菌群、胃肠道神经递质、脑-肠肽、Cajal间质细胞和胃肠电活动的调节等. 除此之外, 很多研究发现苦味及其受体对胃肠运动有一定的调节作用. 该文章主要简述了几种调节胃肠动力的机制研究进展.
核心提要: 胃肠动力障碍是临床上常见的高发病症. 任何影响胃肠道节律性运动的因素都可能引发该疾病. 目前, 人们对胃肠动力调节机制的研究主要集中在中枢神经、肠神经、自主神经、Cajal间质细胞、脑肠肽及离子通道等方面. 近年来, 苦味受体在胃肠道中的功能性表达受到广泛关注. 激活苦味受体可直接或间接调控肠道平滑肌收缩, 进而影响胃肠动力.
引文著录: 于红珍, 付明海, 吉小平, 额尼荣贵. 简述胃肠动力调节机制的研究进展. 世界华人消化杂志 2020; 28(23): 1183-1191
Revised: September 29, 2020
Accepted: November 10, 2020
Published online: December 8, 2020
Gastrointestinal motility is an important part of the physiological function of the digestive tract, and its dysfunction is one of the key factors that cause different gastrointestinal motility disorders. These diseases seriously affect patients' normal life. With the development of scientific research and technology, well-designed research studies have been conducted on the regulatory mechanisms of gastrointestinal motility, which mainly include the regulation of gastrointestinal hormones, intestinal microflora, neurotransmitters, brain-gut peptides, interstitial cells of Cajal, and gastrointestinal electrical activities. In addition, current studies have proved that bitter taste receptors have certain regulatory effects on gastrointestinal motility. This paper primarily discusses the relevant pathways controlling gastrointestinal motility.
- Citation: Yu HZ, Fu MH, Ji XP, E-Ni RG. Progress in research of gastrointestinal motility regulation. Shijie Huaren Xiaohua Zazhi 2020; 28(23): 1183-1191
- URL: https://www.wjgnet.com/1009-3079/full/v28/i23/1183.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i23.1183
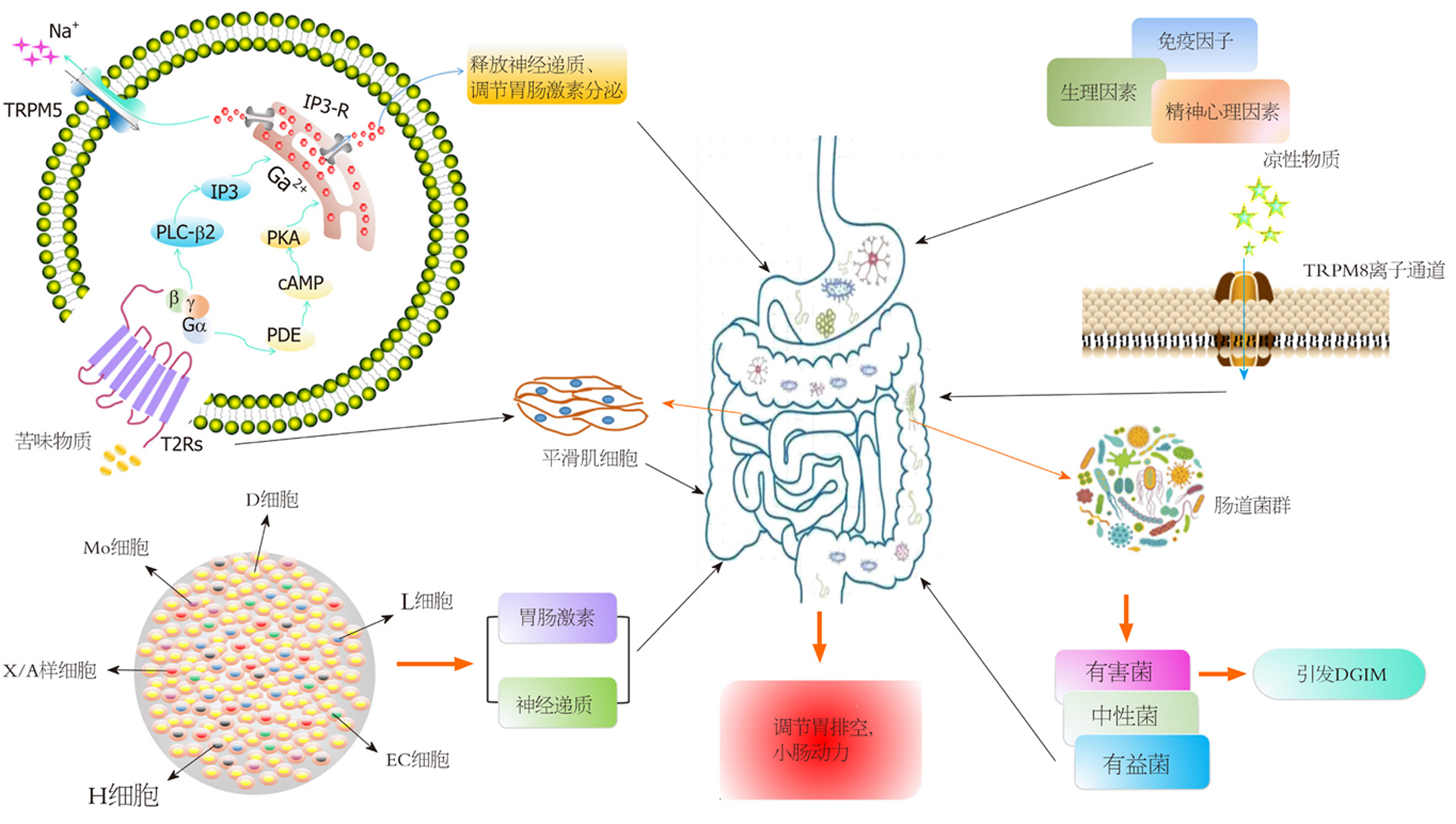
胃肠动力障碍疾病(disorder of gastrointestinal motility, DGIM)严重影响人类的生活质量, 是世界各地常见的公共健康问题, 其发病机制与胃肠动力紊乱和肠内分泌细胞分泌的胃肠激素水平失衡密切相关[1,2]. 众所周知, 便秘和消化不良是临床最常见的胃肠动力障碍疾病. 大量调查显示, 消化不良影响5%-10%的人, 而我国的功能性便秘的患病率约为3.1%-25.92%[3,4]. 胃肠动力是指胃肠道肌肉的收缩和蠕动能力, 包括胃肠道肌肉收缩的频率和力量, 是维持胃肠道正常生理功能的关键组成部分. 胃肠动力功能紊乱是导致DGIM的主要因素之一, 在胃肠病门诊患者中胃肠动力障碍患者占40%以上, 且影响了总人口的20%以上[5]. 目前, 在我国胃肠动力障碍性疾病的发病率非常高, 并且已成为消化内科的重点研究对象. 随着现代医学对DGIM的深入研究, 发现胃肠动力调节机制的复杂性(图1), 它是在中枢神经系统(central nervous system, CNS)的调节和控制下, 由自主神经系统、肠神经系统(enteric nervous system, ENS)和平滑肌细胞等相互调控来完成胃肠道的正常节律性运动[6]. ENS主要由肌间神经丛和黏膜下神经丛组成, 位于纵向平滑肌和横向平滑肌层之间的肌间神经丛, 并参与平滑肌收缩的启动和控制, 对胃肠运动的调节起着至关重要的作用[7]. 近年来许多研究表明, ENS、Cajal间质细胞(interstitial cells of Cajal, ICCs)、平滑肌细胞(smooth muscle cells, SMCs)构成一个网络体系, 参与胃肠动力的调节[8,9]. 本文主要综述了近年来调节胃肠动力的几种因素.
胃肠黏膜层内分布着40多种内分泌细胞, 约占胃肠道上皮细胞总数的1%, 它们分别以单个细胞的形式分布于整个肠道上皮[10]. 这些肠内分泌细胞主要分泌一些特殊化学物质, 如胃肠激素, 胃肠激素是肠内分泌细胞的主要产物. 目前已发现并鉴定的胃肠激素有20多种, 这些激素在感知肠内容物、调节胃肠运动、系统代谢、食物摄入、营养物质的消化和吸收等方面发挥重要作用[11]. 胃肠道激素不仅存在于胃肠道中, 而且又存在于脑组织中, 因此又被称为脑肠肽, 在消化系统疾病中扮演着非常重要的角色. 其主要功能包括兴奋或抑制胃肠道动力.
胃动素(motilin, MTL)是一种活性肽, 由22个氨基酸组成, 能兴奋胃肠平滑肌. 1966年被Brown[12]从狗十二指肠内发现的. MTL主要通过胃动素受体发挥作用. 此外, 它还能与中枢神经系统中G蛋白耦连受体结合, 促进磷酸肌醇酯生成, 增加细胞内Ca2+水平, 加强胃肠蠕动[13]; 还能促进胃蛋白酶的分泌, 加快平滑肌收缩, 提高胃排空率, 缩短食物在小肠内的时间[14,15]; 还能与迷走神经结合促进乙酰胆碱(acetylcholine, Ach)释放, 加快胃肠运动. MTL主要由Mo细胞分泌, 广泛分布在十二指肠、空肠、胃窦部等, 除胃肠黏膜外, 也存在于神经系统, 如大脑、外周神经和肠壁内神经. 此外, MTL的分泌与移行性复合运动(migrating motor complex, MMC)密切相关, 在MMCⅢ相时分泌可达到高峰值[16]. MTL在体内含量的高低直接影响患者的临床症状, MTL含量升高会使患者腹泻: 含量降低则有便秘的症状[17]. 目前研究表明, MTL与胃肠动力紊乱有关, 且有大量研究显示, 中药可以通过增加MTL表达, 促进胃排空率[18,19]. 综合上述, MTL与胃肠动力密切相关, 它是调节胃肠动力的重要机制之一.
胃饥饿素(Ghrelin)是由28个氨基酸组成的一种多功能胃肠激素, 1999年被Kojima等[20]首次从大鼠胃中提纯出来的一种兴奋性脑-肠肽. 由胃内分泌的X/A样细胞分泌[21], 分布在整个胃肠道中, 在胃底的含量最高. 能促进生长激素的释放, 是一种生长激素促分泌素受体(growth hormone secretagogue receptor, GHSR)的内源性配体. 可以促进胃肠动力, 调节小肠平滑肌收缩, 增加进食量, 调节能量代谢和胃酸分泌[22,23]. 潘小丽等[24]研究发现, 电针治疗可以提高体内ghrelin和GHSR-1a的表达, 从而调节胃肠动力, 促进胃排空, 加快消化达到改善功能性消化不良(functional dyspepsia, FD)的作用. 詹程胹等[25]利用半夏汤治疗腹泻型肠易激综合征(Diarrheal irritable bowel syndrome, D-IBS)发现, 半夏汤可能是通过调节ghrelin的释放, 改善胃肠动力紊乱, 从而缓解D-IBS的症状.
胃泌素(gastrin, GAS)是最早发现的多肽类激素之一, 又称促胃液素. 由十二指肠黏膜G细胞和胃窦分泌, 在胃底、十二指肠和空肠等部位分布广泛, 具有调节胃肠运动, 促进胃排空和刺激胃酸分泌的功能, 还可直接刺激胃肠平滑肌发生收缩作用[26,27]. 研究表明, GAS与MTL类似, 都能减少胃残留率, 也可直接作用于平滑肌细胞的特异性受体, 激发胃窦平滑肌的收缩反应, 二者分泌紊乱均可导致胃动力障碍疾病. 徐萌等[28]研究显示, 患有胃肠动力障碍小鼠血液中MTL和GAS表达水平明显低于正常对照组, 且GAS表达的变化比MTL更为显著, 提高MTL和GAS表达水平, 可改善胃肠动力障碍疾病的症状.
胰高血糖素样肽-1 (Glucagon like peptide, GLP-1)又称肠促胰岛素, 它是由29个氨基酸残基构成的一种胰高血糖素原的产物, 由胰腺α细胞, 小肠下层和结肠内分泌细胞L细胞分泌. GLP-1主要与GLP-1受体结合而发挥各项生理作用, 包括降血糖、改善胰岛素敏感性、调节脂代谢和肥胖、心血管保护、肾脏保护及胃肠运动调节等功能[29]. 研究表明, GLP-1对胃肠动力和胃排空率有一定的抑制作用[30], 并且与激活迷走神经有关, 认为GLP-1通过激活迷走神经传入的GLP-1受体发挥作用[31]. 另有研究发现, GLP-1与兴奋性胆碱能神经突触前GLP-1受体结合, 调节一氧化氮(nitric oxide, NO)释放而发挥作用[32].
胆囊收缩素(cholecystokinin, CCK)是由33个氨基酸组成的多肽激素, 是首个能给人产生厌食感觉的胃肠激素, 它的分泌是由消耗蛋白质、脂肪和碳水化合物等营养物质引起的, 主要由小肠黏膜L细胞分泌[33]. 研究发现, CCK及其受体广泛存在于胃肠道和中枢神经系统中, 主要受体是CKK1和CCK2受体, 并且每个受体的分布和功能都是不同的[34]. CCK1受体主要分布在胃肠道系统中, 而CCK2受体主要表达在中枢神经系统中. CCK作为胃肠激素和神经肽, 具有调节胃肠蠕动、促进胆囊和胃肠平滑肌收缩、抑制胃酸分泌、抑制餐后胃排空和抑制结肠转运的作用, 这些作用主要是通过CCK1受体完成[35]. 有研究报道, 内源性和外源性CCK均可抑制大鼠胃排空和肠转运[36].
除此之外, 生长抑素(somatostatin, SS)、瘦素(leptin, LEP)、胃肠激素肽(peptide YY, PYY)、神经降压素(neurotensin, NT)、降钙素基因相关肽(calcitonin generelated peptide, CGRP)、促肾上腺皮质激素释放激素(corticotropin releasing hormone, CRH)等多种胃肠激素均有调节胃肠道功能的作用. LEP广泛分布与胃肠道, 由脂肪细胞分泌, 具有抑制胃排空和食欲, 影响其他胃肠激素分泌的作用[37]. CRH由垂体分泌, 也是抑制性胃肠激素, 能抑制胃排空[38]. CGRP作为重要的脑肠肽, 能调节胃肠道平滑肌收缩, 在FD患者的胃肠道中表达量高, 推测可能参与FD的发病过程[39]. NT能减少胃肠蠕动, 保护胃肠黏膜, 在消化不良疾病中起到一定的作用[40]. 这些激素不同程度的影响胃肠运动, 并且与DGIM的发生有着密切的关系.
ENS是由大量神经元和神经胶质细胞组成, 能独立调节和控制胃肠道功能, 是机体的第二大脑, 又称肠脑. ENS富含兴奋和抑制性神经递质, 可直接作用于胃肠道平滑肌细胞[41], 以调节肠道的正常蠕动功能. Ach是兴奋胃肠动力最重要的神经递质之一, 由胆碱能神经释放, 在体内与胃肠平滑肌细胞上的M受体特异性结合, 使胞内环磷酸腺苷(cyclic adenosine monophosphate, cAMP)下降, 细胞膜去极化, 导致Ga2+通道开放, 细胞内Ga2+浓度增加, 从而调节胃肠蠕动, 促进胃肠道平滑肌收缩[42-44]. P物质(substance P, SP)是由11个氨基酸组成的兴奋性神经递质, 广泛存在于整个胃肠道, 能直接与肠道平滑肌细胞上相应的离子通道结合后收缩肠管[45,46]. 5-HT也是一种兴奋性神经递质, 由肠道EC细胞合成和分泌, 是调节胃肠道的必要因子, 可以调节胃肠动力, 收缩肠管, 促进胃肠蠕动[47,48]. 肠道内的5-HT受体是药物治疗胃肠动力障碍的重要靶点[49]. 血管活性肠肽和NO是由抑制性神经元释放的抑制性神经递质, 能抑制肌肉收缩, 舒张平滑肌[50,51]. NO由一氧化氮合成酶生成, 改变NO的生成会破坏正常的胃肠运动. 据报道, NO通过激活可溶性鸟苷酸环化酶产生cAMP, 使细胞内cAMP浓度升高, cAMP激活蛋白激酶G, 促进平滑肌舒张[52,53]. 此外, 还有很多调节胃肠道功能的神经递质, 这些神经元共同维持胃肠道的正常生理功能.
胃肠道内有大量的微生物群, 包括细菌、真菌、原虫、病毒, 其中细菌被称为人体第二大基因组-肠道菌群. 其数量繁多, 种类丰富, 不同菌群的微生物数量比人体内细胞数多100倍[43]. 一般将细菌分为3类, 有益菌, 中性菌和有害菌. 这些生活在胃肠道的菌群与人体内细胞相互作用一起调控机体的生理功能, 正常的肠道菌群能维持肠道内健康稳定的微生态环境. 肠道菌群对人体消化系统的功能至关重要, 它能促进消化系统对营养物质的消化和吸收, 同时调节胃肠动力、调节免疫系统的活性和促进大脑发育[54,55]. 高热量饮食是菌群失调的主要因素. Sheng等[56]对高热量饮食大鼠的菌群结构进行分析, 发现拟杆菌门和厚壁菌门比例明显下降, 导致肠道代谢紊乱. 越来越多的证据表明, 肠道菌群结构的变化与饮食结构的改变密切相关[57]. 近年来研究发现, 昼夜节律也调节肠道菌群[58]. 一旦肠道内环境改变, 菌群失衡, 则会导致一系列疾病的发生, 其中胃肠道疾病与其关系最为密切[59]. 研究发现, FD患者的胃液存在菌群失调的状况, 认为小肠内容物回流到胃内引起细菌改变, 并参与FD的病理生理过程, 然而用含有益生菌乳酸杆菌LG21酸奶干预后恢复胃液菌群平衡, 改善胃排空和FD症状[60]. 此外, 赵军海等[61]利用肠易激综合征患儿的粪便制成粪菌液灌胃小鼠后发现, 小鼠小肠推进率和MTL, GAS明显降低, 并且小肠和结肠中的酸敏感离子通道(acid sensitive ion channels, ASICs)表达显著增加, 认为肠道菌群调节胃肠动力可能与激活ASICs有关.
胃肠道的运动取决于肌电活动, 而肌电活动的起步电位是慢波, 它对平滑肌收缩非常关键, 也是胃肠动力的基础[62]. ICCs具有产生慢波并转导电活动的功能, 是胃肠道慢波活动的起搏和调节细胞[63,64]. 除此以外, 还能介导神经递质与SMCs之间的信号传递[65]. 1893年西班牙神经解剖学家Cajal首次在胃肠道中发现ICCs[66]. 后来发现它广泛分布在消化道的各个肌层, 如食管括约肌、胃、小肠、结肠等部位[67]. 其主要功能包括, 参与胃肠慢波活动的起搏和调节; 传播肌电活动, ICCs产生的慢波将肌电活动传递给胃肠平滑肌细胞, 从而调节胃肠道平滑肌的收缩, 舒张和蠕动; 介导胃肠道神经递质的作用; 调节胃肠激素分泌等[67,68]. 众所周知, 节律性蠕动对于消化系统功能至关重要, 而节律性运动离不开ICCs的参与和调控, 通过调节ICCs的表达可以改善胃肠动力[69,70]. 研究表明, 分布在食管中的ICCs能调节食管括约肌的张力, 并影响吞咽功能, 其机制是通过鸟苷酸环化酶介导的[71]. 在胃肠道中, ICCs作为慢波电活动的发起者和传播者, 在胃肠道平滑肌的收缩, 节律性运动等方面发挥重要的作用[72]. ICCs数目的减少、分布异常或网络结构的缺失都会直接导致一系列胃肠动力障碍疾病的发生. 研究显示, 超极化环核苷酸门控阳离子通道(hyperpolarized cyclic nucleotide, HCN1)是分布在ICCs上的离子通道蛋白, 是ICCs产生节律电活动的始发离子通道[73]. 林强等研究表明, 增加ICCs数目和上调HCN1离子蛋白能改善慢传输型便秘的症状[74]. 此外, 酪氨酸激酶膜受体蛋白(c-kit)、Anoamin1蛋白(Ano1)、重组干细胞因子(stem cell factor, SCF)、钠钾氯共同转运蛋白等因素都会影响ICCs数目、分布和功能导致胃肠动力功能异常[75]. 其中c-kit作为ICCs的特异性标志物, 与SCF结合构成c-kit/SCF信号通路, 调节ICCs的数目和功能, ICCs的数量随c-kit和SCF在细胞内的表达下降而减少[76]. 故可以通过改变影响ICCs表达的相关通道蛋白或细胞因子来改善胃肠运动功能.
除了ICCs和肠神经元调节胃肠动力外, 缝隙连接蛋白43 (Connexin 43, Cx43)作为缝隙连接的基本结构和功能单位, 在胃肠动力的形成和调节中发挥重要作用[77]. Cx43广泛存在于ICCs之间、ICCs和SMCs之间以及SMCs之间, 它是介导SMCs和ICCs舒缩功能的最重要的缝隙连接蛋白[78,79], 因此在胃肠运动的慢波电位转导和SMCs的收缩中起着连接作用[80]. 研究显示, Cx43与DGIM的发生有密切关系, 其表达下降, 缺失或结构受到破坏会直接抑制电信号的转导, 从而影响胃肠道的舒张或收缩功能, 导致一些DGIM[81,82]. 如先天性巨结肠大鼠的结肠狭窄段和移行段及糖尿病胃轻瘫大鼠的胃窦肌层的Cx43表达明显下降[81,82]. 此外, 张国山等[83]研究表明, FD大鼠胃肠组织中的Cx43蛋白的表达明显低于正常组. 故增加胃肠道肌层Cx43蛋白表达, 抑制Cx43蛋白表达的减少而调解慢波电位在SMCs间的转导, 将有效的治疗胃肠道舒缩障碍疾病, 可为现代医学治疗胃肠动力障碍提供新方向.
苦味感受作为一种防御机制, 是用来防止摄入食物中的有毒物质. 它是由G蛋白偶联受体(G-protein-coupled receptors, GPCR)家族中的第二类味觉受体家族, 苦味受体(bitter taste receptors, T2Rs)调节. 人们对T2Rs最早期的认知便是它能够识别苦味物质, 它和其他的GPCR一样都具有七次跨膜片段结构[84], 激活GPCR可将细胞外的刺激转化为细胞内的信号, 从而调控生物体的多种生理功能, 因此GPCR家族是非常重要的药物靶点[85]. 在味觉系统中, 苦味物质与T2Rs结合, 介导Gα和Gβγ两种通道, 第一种是Gα激活磷酸二酯酶, 导致细胞内cAMP的水平降低, 蛋白激酶A的活性减弱, 使Ca2+通道开放, Ca2+内流, 导致细胞膜去极化和神经递质释放[86]. 另一种是由Gβγ介导的通路, Gβγ激活磷脂酶Cβ2, 增加肌醇1,4,5 - 三磷酸的含量, 导致Ca2+通道开放, 释放胞内储存的Ca2+, 导致细胞内Ca2+浓度增加, 快速升高的Ca2+水平, 使TRPM5通道激活, 引起钠离子内流, 最终导致细胞膜去极化和神经递质释放[87]. 研究表明, 苦味化合物可通过位于舌头上的味蕾和肠内分泌细胞中的T2Rs来调节肠道激素的分泌和胃肠运动[88,89]. Kim等[90]通过细胞实验证实, 苦味物质苯甲地那铵激活T2Rs, 从而诱导肠内分泌细胞分泌GLP-1; 在动物实验中也发现DB增加了GLP-1的分泌, 抑制小鼠的胃排空率[91,92]. 苯甲地那铵对胃肠道的调节作用是通过调节GLP-1释放介导的, 也可能与调节胃动素的分泌有关, 或者直接刺激肠道平滑肌发挥作用[93]. 陈雪丽等[94]研究证实, 苦味成分能提高小鼠的小肠推进率, 同时也延缓胃排空, 能抑制离体空肠和回肠的自发性收缩, 但对十二指肠有双向调节作用, 低浓度时兴奋肠管, 而在高浓度下抑制肠管收缩[95].
瞬时受体电位通道(transient receptor potential, TRP)是位于细胞膜上的一种重要的阳离子通道家族, 对Ca2+, Mg2+或其他阳离子的通透性特别强, 主要通过影响阳离子对机体发挥各种生理功能. TRP有6个亚家族, 分别是TRPC、TRPM、TRPA、TRPP、TRPN和TRPV等. 它们在消化道, 呼吸道, 内脏等均有表达, 并在味觉、化学合成、机械感觉、疼痛感觉中起关键作用, 在胃肠道中调节胃肠动力, 胃肠吸收和分泌等[96]. 其中TRPM7与Cajal间质细胞一样参与肠道起搏活动, TRPC4能转导M胆碱受体激活平滑肌收缩[97]. TRPM8是一种温度感受器, 能被多种因素激活, 如冷环境、薄荷醇、冰片等凉性物质[98]. 研究表明, 薄荷醇激活TRPM8离子通道, 引起细胞内Ca2+浓度增加, 直接抑制了胃肠道平滑肌收缩的能力[99]. 此外, 一些离子通道, 如L型钙通道和超极化环核苷酸门控阳离子通道等在调节胃肠动力方面也有非常重要的作用[100,101].
胃肠道的正常蠕动功能主要受外周交感神经和副交感神经的支配和内在自主肠神经系统以及平滑肌收缩的影响[95]. 这些功能受神经递质, 胃肠激素和肠道菌群的调控. 此外, 一些免疫因子, 如白介素-2、白介素-4、白介素-6、白介素-8、肿瘤坏死因子等也能调节胃肠动力[102]. 张亚鹤等[103]临床研究表明, 降低炎症因子的表达水平, 可增强免疫功能, 并能改善腹泻型胃肠动力紊乱患者的症状. 王颖等[104]用香砂六君子汤治疗FD小鼠发现, 小鼠体内白介素-2、白介素-4、白介素-6等相关因子水平明显减少, 胃肠动力功能恢复明显. 除此之外, 一些生理因素, 如饮食和药物的食用不当, 精神心理因素或社会因素, 如焦虑、抑郁、失业等都会引起胃肠动力紊乱[105](表1).
| 调节形式 | 调节因素 | 细胞名称 | 分布 | 对胃肠道的作用 | Ref. |
| 胃肠激素 | MTL | Mo细胞 | 十二指肠, 空肠,胃窦等 | 增加平滑肌收缩、促进胃排空、增加胃蛋白酶的分泌、促进消化等 | [14,15] |
| GAS | 小肠G细胞、胃窦 | 胃底, 十二指肠,空肠等 | 促进胃排空、刺激胃酸分泌、高浓度抑制胃的运动等 | [26,27] | |
| Ghrelin | X/A样细胞 | 十二指肠, 空肠,直肠, 结肠等 | 调节小肠平滑肌收缩、增强食欲、促进食物摄取、促进生长素分泌、舒张血管等 | [22,23] | |
| GLP-1 | 胰腺α细胞、L细胞 | 回肠、结肠等 | 延缓胃排空、减少肠蠕动、调节脂代谢等 | [30] | |
| CCK | L细胞 | 十二指肠、空肠等 | 促进胃肠平滑肌收缩、调节胃肠蠕动、抑制胃酸分泌、抑制餐后胃排空等 | [35] | |
| SS | D细胞 | 胃窦、胃黏膜、胰岛内、肠神经系统 | 抑制胃肠运动、抑制胃肠激素分泌、胃粘膜保护作用等 | [15] | |
| 神经递质 | NO | 突触小泡 | 胃肠道 | 舒张消化道平滑肌, 减弱胃肠蠕动等 | [52] |
| VIP | D1、H细胞 | 结肠神经丛和平滑肌层 | 松弛胃肠平滑肌、延缓胃排空、抑制小肠运动等 | [51] | |
| 5-HT | EC细胞 | 胃肠道 | 兴奋胃肠平滑肌、促进胃肠运动和肠液分泌等 | [48] | |
| ACh | 胆碱能神经 | 中枢神经系统、胃肠道 | 收缩胃肠道平滑肌、促进胃排空, 加快小肠运动等 | [44] | |
| SP | EC1 | 整个胃肠道和肠神经系统 | 收缩胃肠平滑肌和括约肌、增加胃肠蠕动等 | [46] | |
| 肠道菌群 | - | - | 整个胃肠道组织 | 降解食物、调节胃肠运动等 | [54] |
| Cajal细胞 | - | - | 胃肠道肌层(食管括约肌、胃、小肠、结肠) | 胃肠慢波活动的起搏和调节细胞、传播肌电活动, 调节胃肠道蠕动、介导胃肠道神经递质、调节胃肠激素分泌 | [67,68] |
| Cx43蛋白 | - | - | ICCs之间、ICCs和SMCs之间以及SMCs之间 | 转导慢波电位, 调节平滑肌收缩, 影响胃肠动力 | [80] |
| 苦味 | CCK、GLP-1等 | 内分泌细胞、平滑肌细胞 | 整个胃肠道组织 | 提高小肠推进, 延缓胃排空、抑制离体空肠回肠的自发收缩、双向调节作用, 低浓度兴奋肠管, 高浓度抑制肠管收缩 | [94] |
| 其他 | 免疫因子,年龄, 饮食, 焦虑, 抑郁 | - | - | 影响胃肠动力 | [76,105] |
胃肠动力功能障碍疾病是临床上常见的疾病, 它的发病率高, 严重影响患者的生活质量. 治疗此类疾病的关键在于恢复正常的胃肠动力功能. 胃肠动力是一种非常复杂的神经肌肉活动, 它能维持人体正常消化功能, 任何影响胃肠道节律性运动的因素都会引起各种DGIM. 目前, 对胃肠动力调节机制方面的实验研究已经广泛开展. 肠神经系统作为机体的第二大脑, 在胃肠动力调节中起着重要的作用. 它能与中枢神经系统双向联系, 调控胃肠动力. 肠神经系统与肠内大部分细胞都有关系, 它能释放神经递质或胃肠激素调节Cajal间质细胞和平滑肌细胞的活性. 目前, 对于胃肠动力调节机制的研究大部分集中在CNS、ENS、自主神经、Cajal间质细胞及脑肠肽还有一些离子通道等方面. 近年来, 对苦味及其受体在消化道系统的研究也越来越多, 并且发现苦味能调节胃肠蠕动, 其机制可能是直接通过苦味受体发挥作用, 或通过调节胃肠激素和神经递质来影响胃肠动力. 这可能是一种新的治疗胃肠动力障碍疾病的靶点. 深入研究胃肠动力及其调节机制, 为治疗胃肠动力障碍疾病提供更有效的药物和方法, 这对促进人类健康有着重要的意义.
学科分类: 胃肠病学和肝病学
手稿来源地: 内蒙古自治区
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Russo F, Chimienti G, Clemente C, Riezzo G, D'Attoma B, Martulli M. Gastric Activity and Gut Peptides in Patients With Functional Dyspepsia: Postprandial Distress Syndrome Versus Epigastric Pain Syndrome. J Clin Gastroenterol. 2017;51:136-144. [PubMed] [DOI] |
| 2. | Vanheel H, Carbone F, Valvekens L, Simren M, Tornblom H, Vanuytsel T, Van Oudenhove L, Tack J. Pathophysiological Abnormalities in Functional Dyspepsia Subgroups According to the Rome III Criteria. Am J Gastroenterol. 2017;112:132-140. [PubMed] [DOI] |
| 3. | Ford AC, Moayyedi P, Black CJ, Yuan Y, Veettil SK, Mahadeva S, Kengkla K, Chaiyakunapruk N, Lee YY. Systematic review and network meta-analysis: efficacy of drugs for functional dyspepsia. Aliment Pharmacol Ther. 2020;. [PubMed] [DOI] |
| 5. | Chen JD, Yin J, Wei W. Electrical therapies for gastrointestinal motility disorders. Expert Rev Gastroenterol Hepatol. 2017;11:407-418. [PubMed] [DOI] |
| 7. | Rao M, Gershon MD. The bowel and beyond: the enteric nervous system in neurological disorders. Nat Rev Gastroenterol Hepatol. 2016;13:517-528. [PubMed] [DOI] |
| 8. | Huang ZP, Qiu H, Yang Y, Zhang L, Yang B, Lin MJ, Yu BP. The Role of Interstitial Cells of Cajal in Acute Cholecystitis in Guinea Pig Gallbladder. Cell Physiol Biochem. 2016;38:1775-1784. [PubMed] [DOI] |
| 9. | 文 钱, 曹 洋, 孙 冰, 姜 鹏, 娄 必丹, 钟 峰. 针刺对功能性便秘肠神经-Cajal间质细胞-平滑肌细胞网络影响的实验研究探讨. 针灸临床杂志. 2019;35:1-5. [DOI] |
| 10. | Worthington JJ, Reimann F, Gribble FM. Enteroendocrine cells-sensory sentinels of the intestinal environment and orchestrators of mucosal immunity. Mucosal Immunol. 2018;11:3-20. [PubMed] [DOI] |
| 11. | Prodam F, Bellone S, Ricotti R, Monzani A, Genoni G, Giglione E, Bona G. Hormones and Gastrointestinal Function of Newborns. Neonatology: A Practical Approach to Neonatal Diseases. Cham: Springer International Publishing 2017; 1-20. [DOI] |
| 12. | Brown JC. Presence of a gastric motor-stimulating property in duodenal extracts. Gastroenterology. 1967;52:225-229. [DOI] |
| 13. | Fang P, Dong L, Luo JY. Effects of motilin on intracellular free calcium in cultured smooth muscle cells from the antrum of neonatal rats. Acta Physiol (Oxf). 2010;199:53-61. [PubMed] [DOI] |
| 16. | Miyano Y, Sakata I, Kuroda K, Aizawa S, Tanaka T, Jogahara T, Kurotani R, Sakai T. The role of the vagus nerve in the migrating motor complex and ghrelin- and motilin-induced gastric contraction in suncus. PLoS One. 2013;8:e64777. [PubMed] [DOI] |
| 19. | 禄 保平, 陈 晓乐, 刘 湘花. 胃香乐方对功能性消化不良大鼠胃动素及胃窦Cajal间质细胞超微结构的影响. 中国中医药现代远程教育. 2020;18:118-120. [DOI] |
| 20. | Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 1999;402:656-660. [PubMed] [DOI] |
| 21. | Stengel A, Taché Y. Ghrelin - a pleiotropic hormone secreted from endocrine x/a-like cells of the stomach. Front Neurosci. 2012;6:24. [PubMed] [DOI] |
| 22. | Charoenthongtrakul S, Giuliana D, Longo KA, Govek EK, Nolan A, Gagne S, Morgan K, Hixon J, Flynn N, Murphy BJ, Hernández AS, Li J, Tino JA, Gordon DA, DiStefano PS, Geddes BJ. Enhanced gastrointestinal motility with orally active ghrelin receptor agonists. J Pharmacol Exp Ther. 2009;329:1178-1186. [PubMed] [DOI] |
| 29. | Cheang JY, Moyle PM. Glucagon-Like Peptide-1 (GLP-1)-Based Therapeutics: Current Status and Future Opportunities beyond Type 2 Diabetes. ChemMedChem. 2018;13:662-671. [PubMed] [DOI] |
| 31. | Ronveaux CC, de Lartigue G, Raybould HE. Ability of GLP-1 to decrease food intake is dependent on nutritional status. Physiol Behav. 2014;135:222-229. [PubMed] [DOI] |
| 32. | Amato A, Cinci L, Rotondo A, Serio R, Faussone-Pellegrini MS, Vannucchi MG, Mulè F. Peripheral motor action of glucagon-like peptide-1 through enteric neuronal receptors. Neurogastroenterol Motil. 2010;22:664-e203. [PubMed] [DOI] |
| 33. | Liddle RA, Goldfine ID, Rosen MS, Taplitz RA, Williams JA. Cholecystokinin bioactivity in human plasma. Molecular forms, responses to feeding, and relationship to gallbladder contraction. J Clin Invest. 1985;75:1144-1152. [PubMed] [DOI] |
| 34. | Wank SA, Harkins R, Jensen RT, Shapira H, de Weerth A, Slattery T. Purification, molecular cloning, and functional expression of the cholecystokinin receptor from rat pancreas. Proc Natl Acad Sci USA. 1992;89:3125-3129. [PubMed] [DOI] |
| 36. | Doong ML, Lu CC, Kau MM, Tsai SC, Chiao YC, Chen JJ, Yeh JY, Lin H, Huang SW, Chen TS, Chang FY, Wang PS. Inhibition of gastric emptying and intestinal transit by amphetamine through a mechanism involving an increased secretion of CCK in male rats. Br J Pharmacol. 1998;124:1123-1130. [PubMed] [DOI] |
| 37. | 王 韶轩. 脑肠肽与消化及神经系统基础与临床. 济南: 山东大学出版社 2010: 105-107 . |
| 38. | 郭 令飞, 徐 明兴, 葛 华, 王 灿. 香砂六君子汤合半夏泻心汤对老年功能性消化不良(脾虚气滞型)患者胃肠动力及血清IL-6、CGRP、NPSR1水平的影响. 中药材. 2019;42:2440-2444. |
| 39. | Schou WS, Ashina S, Amin FM, Goadsby PJ, Ashina M. Calcitonin gene-related peptide and pain: a systematic review. J Headache Pain. 2017;18:34. [PubMed] [DOI] |
| 41. | Mazzone A, Farrugia G. Evolving concepts in the cellular control of gastrointestinal motility: neurogastroenterology and enteric sciences. Gastroenterol Clin North Am. 2007;36:499-513, vii. [PubMed] [DOI] |
| 42. | Fagundes DS, Grasa L, Arruebo MP, Plaza MA, Murillo MD. Ca2+-activated K+ channels involved in duodenal dismotility induced by ethanol. Alcohol Alcohol. 2007;42:291-295. [PubMed] [DOI] |
| 45. | 孙 祥珍, 马 臻棋, 马 雪芹. 初探VIP、P物质与便秘的关系. 世界最新医学信息文摘. 2019;19:113-114. |
| 47. | Layunta E, Latorre E, Forcén R, Grasa L, Plaza MA, Arias M, Alcalde AI, Mesonero JE. NOD1 downregulates intestinal serotonin transporter and interacts with other pattern recognition receptors. J Cell Physiol. 2018;233:4183-4193. [PubMed] [DOI] |
| 49. | Swami T, Weber HC. Updates on the biology of serotonin and tryptophan hydroxylase. Curr Opin Endocrinol Diabetes Obes. 2018;25:12-21. [PubMed] [DOI] |
| 50. | 陆 之辉, 张 小平, 程 爱国. 肠神经系统概述. 中国煤炭工业医学杂志. 2008;1292-1294. |
| 51. | 刘 芳, 姚 树坤, 王 慧芬, 张 艳丽, 杜 时雨, 王 淼, 吴 晓敏. 急性胰腺炎患者胃肠动力紊乱与胃肠激素的关系分析. 现代消化及介入诊疗. 2016;21:426-428. [DOI] |
| 52. | Ignarro LJ. Nitric oxide is not just blowing in the wind. Br J Pharmacol. 2019;176:131-134. [PubMed] [DOI] |
| 53. | Guerra DD, Hurt KJ. Gasotransmitters in pregnancy: from conception to uterine involution. Biol Reprod. 2019;101:4-25. [PubMed] [DOI] |
| 54. | Sender R, Fuchs S, Milo R. Are We Really Vastly Outnumbered? Revisiting the Ratio of Bacterial to Host Cells in Humans. Cell. 2016;164:337-340. [PubMed] [DOI] |
| 55. | Hansen NW, Sams A. The Microbiotic Highway to Health-New Perspective on Food Structure, Gut Microbiota, and Host Inflammation. Nutrients. 2018;10. [PubMed] [DOI] |
| 56. | Sheng Y, Zheng SJ, Zhang CH, Zhao CH, He XY, Xu WT, Huang KL. Mulberry leaf tea alleviates diabetic nephropathy by inhibiting PKC signaling and modulating intestinal flora. J Funct Foods. 2018;46:118-127. [DOI] |
| 58. | Thaiss CA, Zeevi D, Levy M, Zilberman-Schapira G, Suez J, Tengeler AC, Abramson L, Katz MN, Korem T, Zmora N, Kuperman Y, Biton I, Gilad S, Harmelin A, Shapiro H, Halpern Z, Segal E, Elinav E. Transkingdom control of microbiota diurnal oscillations promotes metabolic homeostasis. Cell. 2014;159:514-529. [PubMed] [DOI] |
| 60. | Igarashi M, Nakae H, Matsuoka T, Takahashi S, Hisada T, Tomita J, Koga Y. Alteration in the gastric microbiota and its restoration by probiotics in patients with functional dyspepsia. BMJ Open Gastroenterol. 2017;4:e000144. [PubMed] [DOI] |
| 63. | Wang XY, Chen JH, Li K, Zhu YF, Wright GW, Huizinga JD. Discrepancies between c-Kit positive and Ano1 positive ICC-SMP in the W/Wv and wild-type mouse colon; relationships with motor patterns and calcium transients. Neurogastroenterol Motil. 2014;26:1298-1310. [PubMed] [DOI] |
| 65. | 刘 丽兵, 邓 秋林, 汤 国辉, 邢 佼涛, 范 超, 阳 瑶. 补气增液汤对慢传输型便秘大鼠肠道功能、肠神经递质及Cajal间质细胞的影响. 东南大学学报(医学版). 2019;3:433-438. |
| 66. | Sanders KM, Ward SM. Interstitial cells of Cajal: a new perspective on smooth muscle function. J Physiol. 2006;576:721-726. [PubMed] [DOI] |
| 68. | Huizinga JD, Chen JH. Interstitial cells of Cajal: update on basic and clinical science. Curr Gastroenterol Rep. 2014;16:363. [PubMed] [DOI] |
| 69. | Haki Yuksel O, Urkmez A, Verit A. The role of Cajal cells in chronic prostatitis. Arch Ital Urol Androl. 2016;88:133-135. [PubMed] [DOI] |
| 70. | 陈 峭, 谢 胜, 周 晓玲, 韦 金秀. "以俞调枢"法对胃肠动力障碍模型大鼠消化道内Cajal间质细胞超微结构表达的影响. 中华中医药学刊. 2019;37:2959-2962+3113-3114. |
| 71. | Groneberg D, Zizer E, Lies B, Seidler B, Saur D, Wagner M, Friebe A. Dominant role of interstitial cells of Cajal in nitrergic relaxation of murine lower oesophageal sphincter. J Physiol. 2015;593:403-414. [PubMed] [DOI] |
| 72. | Sanders KM. Spontaneous Electrical Activity and Rhythmicity in Gastrointestinal Smooth Muscles. Adv Exp Med Biol. 2019;1124:3-46. [PubMed] [DOI] |
| 78. | Sanders KM, Koh SD, Ro S, Ward SM. Regulation of gastrointestinal motility--insights from smooth muscle biology. Nat Rev Gastroenterol Hepatol. 2012;9:633-645. [PubMed] [DOI] |
| 79. | Maes M, Cogliati B, Crespo Yanguas S, Willebrords J, Vinken M. Roles of connexins and pannexins in digestive homeostasis. Cell Mol Life Sci. 2015;72:2809-2821. [PubMed] [DOI] |
| 80. | 郭 璇, 谭 华梁, 王 小娟, 周 恒, 徐 寅, 刘 芸, 颜 丽花, 李 田田. 舒胃汤对功能性消化不良大鼠Cx43蛋白的分布及Cajal间质细胞的修复与再生的影响. 中国中西医结合消化杂志. 2014;22:652-660. |
| 82. | Sun T, Li D, Hu S, Huang L, Sun H, Yang S, Wu B, Ji F, Zhou D. Aging-dependent decrease in the numbers of enteric neurons, interstitial cells of Cajal and expression of connexin43 in various regions of gastrointestinal tract. Aging (Albany NY). 2018;10:3851-3865. [PubMed] [DOI] |
| 83. | 张 国山. 从ICC超微结构及其细胞内、外Ca2+的变化研究电针足三里对FD大鼠胃肠动力障碍的调节机制. 湖南省: 湖南中医药大学, 2015. |
| 84. | 陈 倩, 王 婷. 苦味受体结构和信号转导通路的研究进展. 世界最新医学信息文摘. 2018;18:38-39. |
| 85. | Siryk-Bathgate A, Dabul S, Lymperopoulos A. Current and future G protein-coupled receptor signaling targets for heart failure therapy. Drug Des Devel Ther. 2013;7:1209-1222. [PubMed] [DOI] |
| 86. | Roper SD. Signal transduction and information processing in mammalian taste buds. Pflugers Arch. 2007;454:759-776. [PubMed] [DOI] |
| 87. | Cygankiewicz AI, Maslowska A, Krajewska WM. Molecular basis of taste sense: involvement of GPCR receptors. Crit Rev Food Sci Nutr. 2014;54:771-780. [PubMed] [DOI] |
| 88. | Janssen S, Laermans J, Verhulst PJ, Thijs T, Tack J, Depoortere I. Bitter taste receptors and α-gustducin regulate the secretion of ghrelin with functional effects on food intake and gastric emptying. Proc Natl Acad Sci USA. 2011;108:2094-2099. [PubMed] [DOI] |
| 89. | Daly K, Al-Rammahi M, Moran A, Marcello M, Ninomiya Y, Shirazi-Beechey SP. Sensing of amino acids by the gut-expressed taste receptor T1R1-T1R3 stimulates CCK secretion. Am J Physiol Gastrointest Liver Physiol. 2013;304:G271-G282. [PubMed] [DOI] |
| 90. | Kim KS, Egan JM, Jang HJ. Denatonium induces secretion of glucagon-like peptide-1 through activation of bitter taste receptor pathways. Diabetologia. 2014;57:2117-2125. [PubMed] [DOI] |
| 91. | van Avesaat M, Troost FJ, Ripken D, Peters J, Hendriks HF, Masclee AA. Intraduodenal infusion of a combination of tastants decreases food intake in humans. Am J Clin Nutr. 2015;102:729-735. [PubMed] [DOI] |
| 92. | Avau B, Rotondo A, Thijs T, Andrews CN, Janssen P, Tack J, Depoortere I. Targeting extra-oral bitter taste receptors modulates gastrointestinal motility with effects on satiation. Sci Rep. 2015;5:15985. [PubMed] [DOI] |
| 93. | Harada Y, Koseki J, Sekine H, Fujitsuka N, Kobayashi H. Role of Bitter Taste Receptors in Regulating Gastric Accommodation in Guinea Pigs. J Pharmacol Exp Ther. 2019;369:466-472. [PubMed] [DOI] |
| 95. | Yu HZ, A LS, Ji XP, Cho SB, Ba GN, Han PF, Fu MH. Bitter components related to alleviating intestinal obstruction in traditional Mongolian medicine. TMR Theory and Hypothesis. 2020;3:337-347. [DOI] |
| 96. | Holzer P. Transient receptor potential (TRP) channels as drug targets for diseases of the digestive system. Pharmacol Ther. 2011;131:142-170. [PubMed] [DOI] |
| 97. | Boesmans W, Owsianik G, Tack J, Voets T, Vanden Berghe P. TRP channels in neurogastroenterology: opportunities for therapeutic intervention. Br J Pharmacol. 2011;162:18-37. [PubMed] [DOI] |
| 99. | Amato A, Liotta R, Mulè F. Effects of menthol on circular smooth muscle of human colon: analysis of the mechanism of action. Eur J Pharmacol. 2014;740:295-301. [PubMed] [DOI] |
| 101. | 章 鹏宇. HCN1在调控胃肠运动机制中的作用. 陕西省: 第四军医大学, 2012 . |
| 102. | Valentin N, Acosta A, Camilleri M. Early investigational therapeutics for gastrointestinal motility disorders: from animal studies to Phase II trials. Expert Opin Investig Drugs. 2015;24:769-779. [PubMed] [DOI] |
| 105. | 宫 彩霞, 张 勤. 中药对胃肠动力紊乱治疗作用的研究进展. 中国中西医结合学会第八届虚证与老年医学专业委员会. 中国中西医结合学会第八届虚证与老年医学专业委员会、中国老年学和老年医学学会中西医结合分会、江苏省中医药学会老年医学专业委员会2019年学术年会论文集. 中国中西医结合学会第八届虚证与老年医学专业委员会: 中国中西医结合学会, 2019: 283-288 . |