修回日期: 2020-09-22
接受日期: 2020-10-16
在线出版日期: 2020-11-28
植物提取物具有抗胃癌的作用, 但关于其具体作用机制尚未阐明. 翠云草总黄酮具有抗炎、抗氧化及抗肿瘤的作用, 但翠云草总黄酮对胃癌细胞生物学行为的影响及其可能作用机制尚未阐明.
探讨翠云草总黄酮(TFS)对胃癌细胞增殖、凋亡、糖酵解水平的影响及其对环状RNA_0009910(circ_ 0009910)的调控作用.
体外培养人胃癌细胞AGS, 使用不同浓度的TFS处理细胞, 同时分别将pcDNA、pcDNA-circ_0009910转染至AGS细胞, 继而使用TFS处理细胞; 采用MTT法与平板克隆形成实验检测细胞增殖能力; 流式细胞术检测细胞凋亡率; 采用乳酸脱氢酶比色法检测乳酸含量, 以及检测葡萄糖消耗; 采用qRT-PCR法检测circ_0009910的表达量; Western blot法检测Bax、Bcl-2蛋白表达量.
TFS处理后可明显降低细胞活力与Bcl-2蛋白水平及葡萄糖消耗、乳酸水平(P<0.05), 减少克隆形成数(P<0.05), 提高凋亡率及Bax蛋白水平(P<0.05), 降低circ_0009910的表达水平(P<0.05), 且呈剂量依赖性; 与TFS-H+pcDNA组比较, TFS-H+pcDNA-circ_0009910组细胞活力、Bcl-2蛋白水平及葡萄糖消耗、乳酸水平显著升高(P<0.05), 克隆形成数显著增多(P<0.05), 凋亡率及Bax蛋白水平显著降低(P<0.05).
翠云草总黄酮可通过下调circ_0009910的表达从而促进胃癌细胞凋亡, 抑制细胞增殖, 以及降低糖酵解水平.
核心提要: 翠云草总黄酮治疗胃癌的分子机制尚未阐明, 本研究采用不同浓度的翠云草总黄酮处理胃癌细胞, 并观察其对细胞增殖、凋亡及糖酵解水平的影响, 旨在为阐释翠云草总黄酮抗胃癌的分子机制奠定实验基础, 并可为胃癌的治疗提供新方向.
引文著录: 张建海, 俞建洪. 翠云草总黄酮对胃癌细胞增殖、凋亡及糖酵解水平的影响. 世界华人消化杂志 2020; 28(22): 1121-1127
Revised: September 22, 2020
Accepted: October 16, 2020
Published online: November 28, 2020
Plant extracts have anti-gastric cancer effects, but the specific mechanisms of action have not yet been elucidated. Total flavones of Selaginella uncinata (Desv.) spring (TFS) have anti-inflammatory, antioxidant, and anti-tumor effects, but their effect on the biological behavior of gastric cancer cells and the underlying mechanism have not been elucidated.
To explore the effect of TFS on the proliferation, apoptosis, and glycolysis in gastric cancer cells and its regulatory effect on circ_0009910.
Human gastric cancer cell line AGS was cultured in vitro, and the cells were treated with different concentrations of TFS. pcDNA and pcDNA-circ_0009910 were transfected into AGS cells, respectively, and the cells were then treated with TFS Cell proliferation was detected by MTT method and plate clone formation assay. Flow cytometry was used to detect the apoptosis rate. The lactate dehydrogenase colorimetric method was used to detect lactic acid content and glucose consumption. The expression of circ_0009910 was detected by qRT-PCR method. Western blot method was used to detect the expression of Bax and Bcl-2 proteins.
TFS treatment significantly reduced cell viability, the protein level of Bcl-2, glucose consumption, the level of lactate (P < 0.05), and the number of formed clones (P < 0.05), and increased the apoptosis rate and the protein level of Bax (P < 0.05). The expression level of circ_0009910 was decreased (P < 0.05) in a dose-dependent manner. Compared with the TFS-H + pcDNA group, cell viability, the protein level of Bcl-2, glucose consumption, the lactate level, and the number of formed clones in the TFS-H + pcDNA-circ_0009910 group were increased significantly (P < 0.05), and the apoptosis rate and the protein level of Bax were significantly reduced (P < 0.05).
TFS can promote apoptosis, inhibit proliferation, and reduce glycolysis by down-regulating the expression of circ_0009910 in gastric cancer cells.
- Citation: Zhang JH, Yu JH. Effect of total flavones of Selaginella uncinata (Desv.) spring on proliferation, apoptosis, and glycolysis in gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2020; 28(22): 1121-1127
- URL: https://www.wjgnet.com/1009-3079/full/v28/i22/1121.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i22.1121
胃癌是我国常见的消化系统恶性肿瘤之一, 其发病率逐年上升, 已严重威胁人类生命安全, 由于胃癌发病初期较为隐匿导致大部分患者确诊时已处于癌症晚期, 失去最佳治疗时机, 随着不断深入研究以及研发新型治疗药物, 胃癌患者预后明显改善, 但患者的远期生存情况不佳, 而化疗药物具有较强的毒副作用从而限制其应用[1,2]. 因而研发治疗效果好且副作用小的药物具有重要意义. 天然中药的提取物成为治疗癌症的热点研究, 研究表明部分中药提取物具有抗胃癌的作用, 但关于其具体作用机制尚未阐明[3,4]. 翠云草属于卷柏科卷柏属植物, 其具有清热解毒、止血等作用, 其主要活性成分为黄铜, 研究表明翠云草总黄酮(total flavones of Selaginella uncinata (Desv.) spring, TFS)可抑制肺癌细胞增殖及诱导细胞周期阻滞[5]. 但翠云草总黄酮对胃癌的治疗效果及其可能作用机制尚未阐明. 环状RNA (circular RNA, circRNA)在肿瘤发生及发展过程中可能发挥癌基因或抑癌基因作用, 环状RNA_0009910(circular RNA_0009910, circ_0009910)在胃癌细胞中表达水平升高, 并可促进细胞增殖、迁移及侵袭[6]. 但翠云草总黄酮是否以circ_0009910为作用靶点而发挥作用尚未可知. 因此, 本研究主要探讨翠云草总黄酮对胃癌细胞增殖、凋亡及糖酵解水平的影响, 探究其对circ_0009910的调控作用.
翠云草购自三原天域生物制品有限公司; 胃癌细胞AGS购自美国ATCC细胞库; DMEM培养液、胎牛血清、胰蛋白酶购自美国Hyclone公司; Lipofectamine2000购自美国Thermo Fisher公司; Trizol试剂购自北京全式金生物技术有限公司; 荧光定量检测试剂盒购自北京天根生化科技有限公司; pcDNA3.1购自上海索宝生物科技有限公司; MTT购自北京鼎国昌盛生物技术有限责任公司; Annexin V-FITC/PI双染法细胞凋亡检测试剂盒购自美国Sigma公司; 乳酸水平检测试剂盒与葡萄糖消耗检测试剂盒购自美国Bivision公司; 兔抗人Bax、Bcl-2抗体购自美国CST公司; HRP标记的山羊抗兔二抗购自美国Abcam公司.
1.2.1 实验分组: 翠云草总黄酮制备: 精确称量1000 g翠云草, 研磨呈粉状, 使用60目筛过滤, 阿计入60%乙醇后加热处理20 min, 收集滤液, 减压, 蒸发, 烘干, 加入吸附树脂进行纯化, 加入70%乙醇洗脱, 浓缩干燥后获得翠云草提取物, 以芦丁为对照品, 翠云草提取物中加入甲醇进行溶解, 应用酶标仪进行扫描, 在波长510 nm处有最大吸收峰, 其吸收光谱与芦丁相似, 同时以芦丁为标准品绘制标准曲线, 根据回归方程计算翠云草提取物中的总黄酮含量(2.68 mg/g), 翠云草总黄酮加入DMSO进行溶解, 配置浓度为1 mg/mL的母液, 根据实验需要进行稀释液, 浓度分别为5 μg/mL、15 μg/mL、25 μg/mL[7].
胃癌细胞AGS接种于96孔板(1×104个/孔), 分别加入不同浓度(5 μg/mL、15 μg/mL、25 μg/mL)的翠云草总黄酮干预24 h, 分别记作TFS-L组、TFS-M组、TFS-H组. 同时将正常培养的细胞作为Con组. 参照Lipofectamine2000说明书分别将pcDNA、pcDNA-circ_0009910转染至AGS细胞, 加入含有浓度为25 μg/mL 翠云草总黄酮的培养液处理24 h, 分别记作TFS-H+pcDNA组、TFS-H+pcDNA-circ_0009910组.
1.2.2 MTT检测细胞增殖: 收集各组AGS细胞(3×104个/mL)接种于96孔板(100 μL/孔), 每孔加入20 μL MTT溶液, 置于培养箱内培养4 h, 弃上清, 分别加入150 μL DMSO, 室温孵育10 min, 应用酶标仪检测各孔在波长490 nm处的光密度值(OD值).
1.2.3 平板克隆形成实验: 收集各组AGS细胞种于细胞培养皿(200个/皿), 置于培养箱孵育24 h, 弃旧培养基, PBS洗涤, 加入消化液消化, 加入含有10%胎牛血清培养液制备细胞悬液, 接种于6孔板(200个/孔), 置于培养箱孵育, 每3 d更换一次培养液, 14 d后出现肉眼可见细胞克隆的形成, 移除培养液, 加入PBS洗涤, 加入0.1%结晶紫染色20 min, 清水洗涤, 观察细胞克隆形成数, 高于50个克隆数即为有效克隆.
1.2.4 流式细胞术检测细胞凋亡率: 收集各组AGS细胞, 预冷PBS洗涤, 细胞沉淀中加入500 μL结合缓冲液, 参照细胞凋亡检测试剂盒依次分别加入5 μL Annexin V-FITC与5 μL PI, 室温振荡孵育10 min, 应用FACS Calibur流式细胞仪及应用Cellauest软件检测各组细胞凋亡率.
1.2.5 检测细胞中葡萄糖消耗及乳酸水平: 采用乳酸脱氢酶比色法检测各组细胞培养基中的乳酸含量, 严格按照试剂盒说明书进行操作. 根据葡萄糖消耗检测试剂盒说明书检测各组细胞葡萄糖消耗, 严格按照试剂盒说明书进行操作.
1.2.6 实时荧光定量聚合酶链反应(qRT-PCR)检测circ_0009910的表达水平: 收集各组AGS细胞, 采用Trizol法提取细胞总RNA. 参照反转录试剂盒合成cDNA. circ_0009910正向引物5'-GCCAGCTGTGAGTGTT TCTT-3', 反向引物: 5'-CGCATCGATCAG CTACACG-3'; GAPDH正向引物5'-GGAGCGAGATCCCTC CAAAAT-3', 反向引物: 5'-GGCTGTTGTCATACTTCTCATGG-3, 引物由上海生工生物工程股份有限公司设计合成. 以cDNA为模板进行qRT-PCR扩增, 反应体系: 10×PCR Buffer 2.5 μL, MgSO4 2.5 μL, dNTPs 2.5 μL, 正反向引物各0.5 μL, cDNA 2 μL, RNase-Free ddH2O补足体系至25 μL; 反应条件: 95 ℃预变性2 min, 95 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸30 s, 共36次循环. circ_0009910以GAPDH为内参, 采用2-ΔΔCt法计算circ_0009910相对表达量.
1.2.7 蛋白免疫印迹(Western blot)检测Bax、Bcl-2蛋白表达: 收集各组AGS细胞, 加入蛋白裂解液提取细胞总蛋白, 采用BCA法测定蛋白浓度, 取50 μg变性蛋白进行SDS-PAGE), 转膜, 封闭, 分别加入一抗稀释液(1:1000), 4 ℃孵育24 h, TBST洗涤, 加入二抗稀释液(1:2000), 室温孵育1 h, TBST洗涤, 暗室内曝光显影, 应用ImageJ软件分析各条带灰度值.
统计学处理 采用SPSS 21.0统计学软件分析数据, 计量资料以mean±SD表示且均符合正态分布, 两组间比较采用独立样本t检验, 多组间比较采用单因素方差分析, 以P<0.05为差异具有统计学意义.
与Con组比较, TFS-L组、TFS-M组、TFS-H组细胞活力显著降低(P<0.05), 克隆形成数显著减少(P<0.05), 且TFS-L组、TFS-M组、TFS-H组各指标比较差异均具有统计学意义(P<0.05), 见表1.
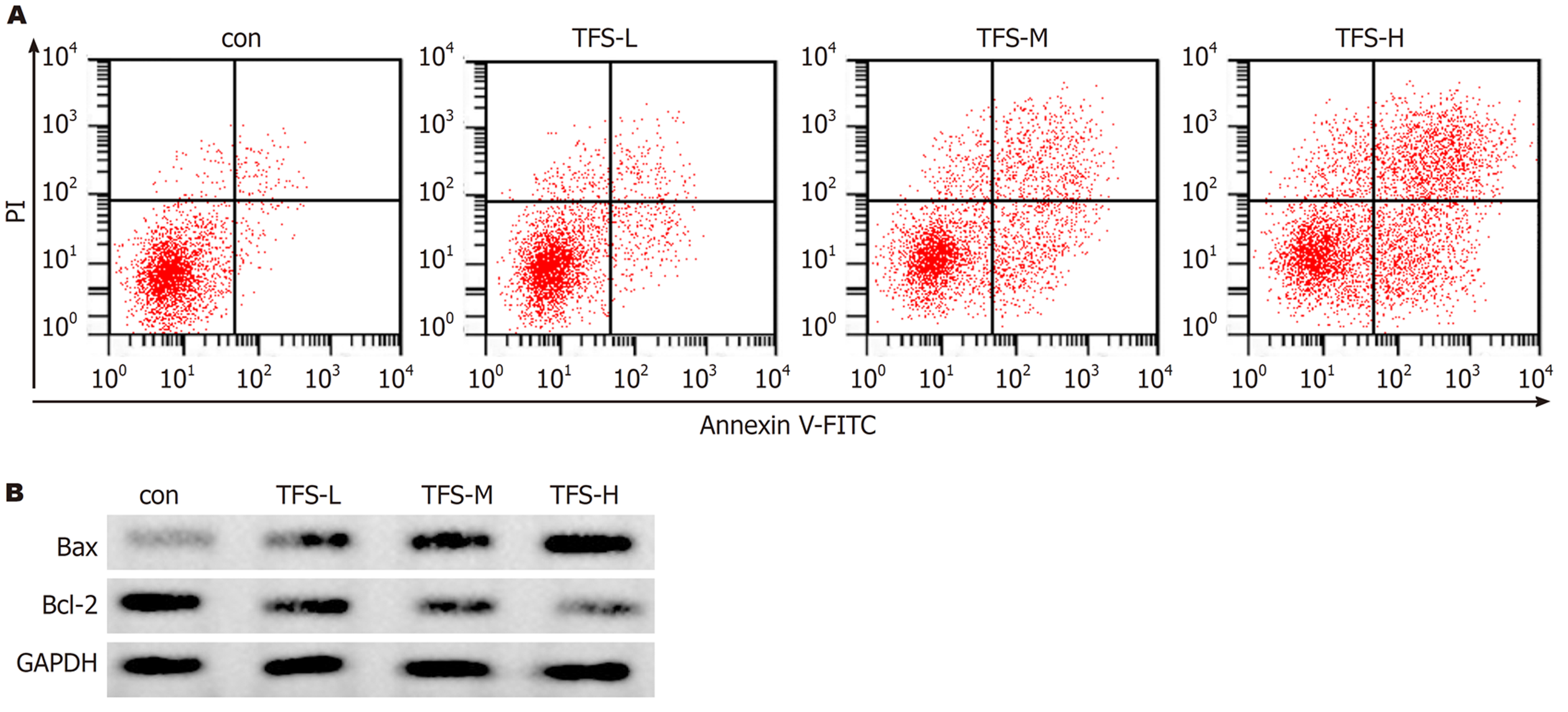
与Con组比较, TFS-L组、TFS-M组、TFS-H组凋亡率显著升高(P<0.05), Bax蛋白水平显著升高(P<0.05), Bcl-2蛋白水平显著降低(P<0.05), 且TFS-L组、TFS-M组、TFS-H组各指标比较差异均具有统计学意义(P<0.05), 见图1、表2.
与Con组比较, TFS-L组、TFS-M组、TFS-H组葡萄糖消耗、乳酸水平显著降低(P<0.05), 且TFS-L组、TFS-M组、TFS-H组各指标比较差异均具有统计学意义(P<0.05), 见表3.
与Con组比较, TFS-L组、TFS-M组、TFS-H组circ_0009910的表达水平显著降低(P<0.05), 且TFS-L组、TFS-M组、TFS-H组间circ_0009910的表达水平比较差异均具有统计学意义(P<0.05), 见表4.
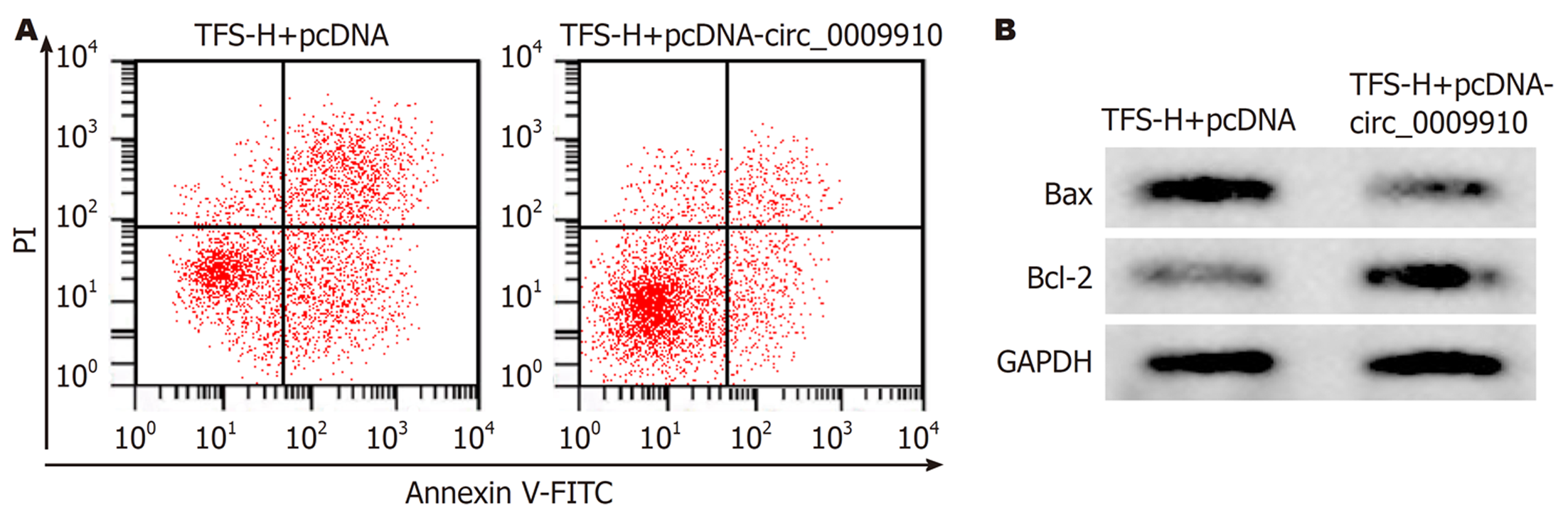
与TFS-H+pcDNA组比较, TFS-H+pcDNA-circ_0009910组细胞活力显著升高(P<0.05), 克隆形成数显著增多(P<0.05), 凋亡率显著降低(P<0.05), Bax蛋白水平显著降低(P<0.05), Bcl-2蛋白水平显著升高(P<0.05), 见图2、表5.
与TFS-H+pcDNA组比较, TFS-H+pcDNA-circ_0009910组葡萄糖消耗、乳酸水平显著升高(P<0.05), 见表6.
目前多数研究表明中药具有抗胃癌等作用, 并可能通过调控细胞增殖、迁移及侵袭等从而发挥作用, 但关于其作用机制尚未完全阐明[8,9]. circRNA在胃癌发生及发展过程中发挥重要调控作用, 并可能作为胃癌靶向治疗的潜在靶点[10]. 但circRNA是否可介导中药提取物对胃癌的治疗过程尚未阐明.
翠云草黄酮类化合物具有抗氧化、抗肿瘤等作用, 但其对胃癌的治疗效果及其可能作用机制尚未阐明[11-13]. 本研究结果显示不同浓度的翠云草总黄酮可降低胃癌细胞活力, 减少克隆形成数, 且呈剂量依赖性, 提示翠云草总黄酮可抑制胃癌细胞增殖. 细胞增殖与凋亡失衡是促进胃癌等肿瘤发生及发展的重要原因之一, 细胞凋亡过程中Bcl-2表达上调可抑制细胞凋亡, Bax表达上调可促进细胞凋亡[14]. 本研究结果显示不同浓度的翠云草总黄酮可提高细胞凋亡率, 促进Bax表达及抑制Bcl-2表达, 且呈剂量依赖性, 提示翠云草总黄酮可促进胃癌细胞凋亡. 糖酵解水平升高可促进胃癌等肿瘤增殖、细胞迁移及侵袭[15]. 本研究结果显示不同浓度的翠云草总黄酮可降低胃癌细胞中葡萄糖消耗、乳酸水平, 且随着药物剂量的升高而显著降低, 提示翠云草总黄酮可抑制糖酵解反应从而抑制胃癌细胞增殖.
circ_0009910表达上调可促进胃癌细胞增殖及转移[16]. 沉默circ_0009910可通过促进miR-20a-5p表达而抑制急性髓性白血病细胞的生长[17]. circ_0009910通过调控miR-335-5p/ROCK1分子轴促进肝癌细胞增殖及转移[18]. 本研究结果显示不同浓度的翠云草总黄酮处理后胃癌细胞中circ_0009910的表达水平明显降低, 而circ_0009910过表达后可明显减弱翠云草总黄酮对胃癌细胞增殖、凋亡及糖酵解的作用.
综上所述, 翠云草总黄酮可通过下调circ_0009910的表达从而抑制胃癌细胞增殖、糖酵解反应及促进细胞凋亡, 为进一步阐释翠云草总黄酮抗肿瘤作用奠定实验基础. 但关于circ_0009910如何调控下游基因表达及其可能作用机制仍需进一步探究.
胃癌发病机制尚未阐明, 由于胃癌早期临床症状不明显导致大部分患者确诊时已处于晚期, 失去最佳治疗时机, 化疗等药物对人体造成一定损害, 而天然植物提取物具有抗胃癌等作用, 但关于其具体作用机制尚未阐明.
翠云草总黄酮的主要活性成分为黄铜, 其具有抗炎、抗氧化与抗肿瘤等作用, 但翠云草总黄酮对胃癌的治疗效果尚未可知, 因而本研究采用体外细胞实验初步验证翠云草总黄酮对胃癌细胞增殖、凋亡及糖酵解水平的影响, 为胃癌的治疗提供新方向.
翠云草总黄酮具有抗胃癌的作用, 其作用机制可能通过调控circ_0009910的表达而实现.
采用MTT实验与平板克隆形成实验检测翠云草总黄酮对胃癌细胞增殖能力的影响; 采用流式细胞术检测翠云草总黄酮对胃癌细胞凋亡能力的影响; 根据试剂盒检测翠云草总黄酮对胃癌细胞糖酵解水平的影响; 采用qRT-PCR实验检测翠云草总黄酮对胃癌细胞中circ_0009910表达水平的影响; circ_0009910过表达载体转染入胃癌细胞后加入翠云草总黄酮培养, 采用上述方法检测细胞增殖、凋亡及糖酵解水平.
翠云草总黄酮可抑制胃癌细胞增殖及降低糖酵解水平, 并可诱导细胞凋亡; circ_0009910过表达可明显逆转翠云草总黄酮对胃癌细胞增殖、凋亡及糖酵解水平的作用.
翠云草总黄酮可抑制胃癌细胞增殖、糖酵解反应及促进细胞凋亡, 其作用机制可能与下调circ_0009910的表达有关.
circ_0009910可充当miRNA的海绵分子, 关于其如何调控下游miRNA表达而参与胃癌细胞增殖、凋亡及糖酵解反应过程尚需进一步探究.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑: 张砚梁
| 9. | 张 莹, 王 广, 左 天, 张 小海, 张 祚, 徐 燃, 张 绍鹏. 竹节参皂苷Ⅳ、Ⅳa和Ⅴ对胃癌SGC-7901细胞增殖、凋亡、迁移及侵袭的作用. 中药新药与临床药理. 2019;30:796-801. |
| 10. | Zhang Y, Liu H, Li WD, Yu J, Li J, Shen ZY, Ye GT, Qi XL, Li GX. CircRNA_100269 is downregulated in gastric cancer and suppresses tumor cell growth by targeting miR-630. Aging (Albany NY). 2017;9:1585-1594. [PubMed] [DOI] |
| 13. | Zou H, Xu PS, Liu R, Zou ZX, Li J, Zhong AG, Hu JZ, Xu KP, Tan GS. Selacyclicbiflavone A, an Unusual Macrocyclic Biflavone from Selaginella uncinata (Desv.) Spring. Tetrahedron Lett. 2016;57:892-894. [DOI] |
| 14. | Chen C, Maimaiti A, Zhang X, Qu H, Sun QL, He QS, Yu WB. Knockdown of RAI14 suppresses the progression of gastric cancer. Onco Targets Ther. 2018;11:6693-6703. [PubMed] [DOI] |
| 16. | Liu M, Liu KD, Zhang L, Cai J, Yao HW, Bai YK, Zhang ZT. Circ_0009910 Regulates Growth and Metastasis and Is Associated With Poor Prognosis in Gastric Cancer. Eur Rev Med Pharmacol Sci. 2018;22:8248-8256. [PubMed] [DOI] |
| 17. | Lei P, Chen JJ, Liao CS, Liu GH, Zhou M. Silencing of circ_0009910 inhibits acute myeloid leukemia cell growth through increasing miR-20a-5p. Blood Cells Mol Dis. 2019;75:41-47. [PubMed] [DOI] |
| 18. | Li HW, Liu J. Circ_0009910 promotes proliferation and metastasis of hepatocellular carcinoma cells through miR-335-5p/ROCK1 axis. Eur Rev Med. Pharmacol Sci. 2020;24:1725-1735. [PubMed] [DOI] |