修回日期: 2020-08-30
接受日期: 2020-09-28
在线出版日期: 2020-11-08
环磷酸鸟苷-腺苷酸合成酶(cyclic GMP - AMP synthase, cGAS)-干扰素刺激基因(stimulator of interferon gene, STING)信号通路是细胞质内重要的免疫应答通路, 通过识别胞质 DNA 调节天然免疫和适应性免疫应答, 是一种免疫系统检测应答病原体的重要机制; 在介导含DNA病原体的免疫及机体对肿瘤的内在免疫方面起关键作用, 近年来逐渐受到肿瘤干预的重视, 临床上有应用STING激活剂行肿瘤治疗的实例; cGAS作为肿瘤预后标志物的价值也受到重视. 目前cGAS及STING的相关激动剂在临床治疗结肠癌中已有使用, 但对于不同组织来源的肿瘤效果暂不明确, 其有效性与安全性有待进一步研究.
核心提要: 环磷酸鸟苷-腺苷酸合成酶-干扰素刺激基因信号通路是是一种免疫系统检测应答病原体的重要通路, 目前发现其对机体的肿瘤免疫起重要作用, 应用该通路激活剂行肿瘤治疗、作为肿瘤预后标志物成为现实. 本文将对其主要用途及应用进展、局限性等作一综述.
引文著录: 王斯炜, 苏文豪, 贾雪梅, 蒋昊天, 黄冰露, 董卫国. cGAS-STING信号通路在结肠癌中的作用机制研究. 世界华人消化杂志 2020; 28(21): 1084-1089
Revised: August 30, 2020
Accepted: September 28, 2020
Published online: November 8, 2020
The cyclic GMP-AMP synthase (cGAS)-stimulator of interferon gene (STING) signaling pathway is an important immune response pathway in the cytoplasm, and it is an important mechanism that regulates innate immune and adaptive immune responses. As an important mechanism that detects and responds to pathogens, the cGAS-STING signaling pathway plays a key role in mediating immunity against DNA pathogens and the body's internal immunity against tumors. Clinically, STING activators are often used for tumor treatment. Also, cGAS can act as a tumor prognostic marker. At present, related agonists of cGAS and STING have been used in clinical treatment of colon cancer, but their effects in tumors from other tissues are not clear yet. Thus, their effectiveness and safety are still needed to be further studied.
- Citation: Wang SW, Su WH, Jia XM, Jiang HT, Huang BL, Dong WG. Role of cGAS-STING signaling pathway in colon cancer. Shijie Huaren Xiaohua Zazhi 2020; 28(21): 1084-1089
- URL: https://www.wjgnet.com/1009-3079/full/v28/i21/1084.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i21.1084
结肠癌是一种常见的消化道恶性肿瘤, 好发于直肠和乙状结肠交界处. 目前其临床主要治疗原则是早期内镜下治疗, 中期和晚期主要行手术治疗, 佐以放化疗、免疫治疗等其余辅助治疗以缩小肿瘤体积, 获得手术机会, 减少复发可能, 提高生存率. 作为一种免疫源性肿瘤, 近年来人们开始关注对结直肠癌的免疫治疗. 除了已有的免疫检查点抑制剂、细胞因子、疫苗佐剂等, 一种具有辅助免疫治疗潜能的信号通路 - 环磷酸鸟苷-腺苷酸合成酶(cyclic GMP - AMP synthase, cGAS)-干扰素刺激基因(stimulator of interferon gene, STING)通路近年来进入人们视野. 该通路由于具有调控下游产生Ⅰ类干扰素[1]、通过其他通路交互作用、胞内自噬[2]调控炎症等方式干预结肠肿瘤周围炎症及结肠癌发生进展; 因此可通过特异性激动剂或抑制剂调控cGAS-STING通路改善肿瘤微环境, 完善机体肿瘤免疫, 以期抑制结肠癌的发生发展, 达到治疗目的. 本文将对cGAS-STING通路在结肠癌中的相关研究加以综述, 并分析该通路在临床中的应用及其利弊.
cGAS(环磷酸鸟苷-腺苷酸合成酶, cylic GMP-AMP synthase) 又称 C6ORF150 或 MB21D1, 是一种分子质量在 60 kDa 的蛋白质, 作为一种存在于胞浆中 DNA 感受器, 通过带正电荷的氨基酸残基与带负电荷的 DNA 磷酸主链相互作用. cGAS 与异常出现在胞质的 DNA 直接结合后, cGAS二聚体化并改变构象, 经过一系列的理化变化, 最终产生 2'3'-cGAMP[3].
STING又称ERIS/MYPS/MITA, 是一个由TMEM173基因编码的多功能接头蛋白[4,5], 包含4个跨膜结构域, 分别为二聚化结构域、环二核苷酸相互作用域, 以及与 TANK结合激酶1(TANK-binding kinase 1, TBK1)相互作用结构域. 在静息状态下, STING 呈现出自抑制失活状态. 在与 2'3'-cGAMP 结合后, STING发生二聚化反应改变构象, 从内质网通过高尔基体转运至核周微粒体. STING可激活TBK1并磷酸化下游转录因子IRF-3(诱导I型IFN反应)、信号传导和转录激活因子6(signal transduction and activator of transcription 6, STAT-6),诱导趋化因子如CCL2, CCL6, CCL20等[6]; 还可通过IκB激酶(IKK)的活性激活核因子κB(nuclear factor kappa-B, NF-κB)[6]等转录因子产生多种下游生物学效应.
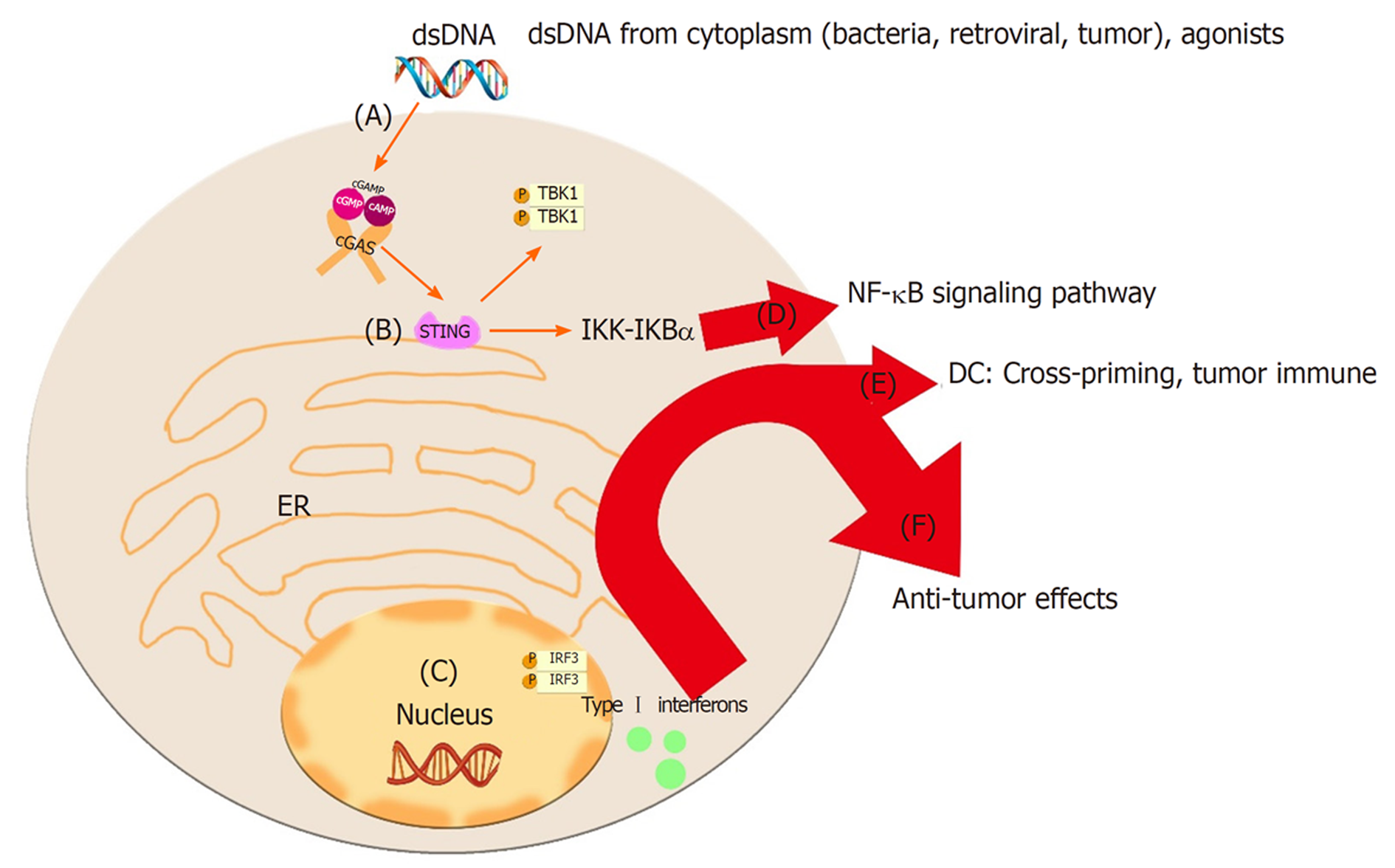
人们对cGAS-STING的研究逐渐深刻. cGAS-STING通路最早通过对病毒的固有免疫引起重视, 近年来, 针对STING泛素化、磷酸化, 调节自噬预防过度免疫反应方面的作用也逐渐在多种病理生理事件中进行考量. DNA病毒感染宿主细胞后和模式识别受体及MDA5产生相互作用, 激活下游的cGAS生成cGAMP, 后cGAMP与STING的二聚体结合, 激活TBK1-IRF3,NF-κB等信号通路, 最终产生Ⅰ型干扰素. 该机制被证明可通过多种病毒如HSV-1、KSHV、HIV-1中的DNA成分激活并作用于病毒免疫, 是构成固有免疫的重要组成部分. 针对这一点临床上已有使用KSHV及HSV-1行瘤内注射方式引入肿瘤组织, 引起肿瘤微环境中CD8阳性T细胞募集及Ⅰ型干扰素的产生, 减少宿主肿瘤负荷, 改善预后的实例, 如图1[7].
cGAS和STING对于抗肿瘤免疫(自然免疫或自发免疫), 对放疗[8]、CD47阻断剂[1]及免疫检查点治疗[9]改变肿瘤组织的免疫原性起重要作用, 是一些肿瘤的临床干预靶点, 也可作为某些肿瘤的预后的标志物. 其下游产生的Ⅰ型 IFN是连接固有免疫和适应性免疫发挥抗肿瘤免疫的重要桥梁, 因为肿瘤微环境中抗原提呈树突状细胞产生的Ⅰ型IFN, 不仅可以激活固有免疫, 同时促进T细胞的交叉浸润渗透, 且cGAMP并不受限于固有的细胞信号转导方式, 可以通过其他形式介导的信号转导产生更广泛的区域免疫应答, 因此IFN-I作为宿主对癌症的免疫应答的重要组成部分, 具有保护作用. 缺乏IFN-I信号传导的宿主表现出更高的肿瘤形成敏感度[10], 而IFN-I信号传导对于NK细胞抗肿瘤活性的强化[1]及引发肿瘤细胞的抗原交叉过程极其重要.
除了肿瘤本身, 肿瘤微环境[11]、相关调控因子[12]及机体特殊事件也是与肿瘤侵袭及扩散相关的重要环节. 在本文中主要说明肿瘤的相关调控因子及特殊事件. 近年有研究提示结肠癌中, 肿瘤微环境中存在的慢性炎症效应募集炎性细胞释放至肿瘤微环境中. 其中起重要作用的是巨噬细胞、肥大细胞、中性粒细胞、T细胞等[13]. 它们通过释放趋化因子、血管生长因子及基质降解酶等, 对肿瘤生长侵袭起到有利作用. 其中NF-κB, MMP(matrix metalloproteinase, 基质金属蛋白酶)较为重要. NF-κB在炎症、天然免疫、后天免疫过程中发挥枢纽作用. 另外, 肿瘤微环境中的免疫细胞通过产生活性氧和活性氮类化合物, 导致周围组织细胞DNA损伤, 诱发癌症.
结直肠癌是胃肠道中常见恶性肿瘤, 其发病率和病死率高, 本病发病原因至今未明, 相关因素包括结肠息肉、结肠慢性炎症刺激、饮食及遗传等. 结直肠癌可发生于结肠或直肠的任何部位, 但以直肠、乙状结肠最为多见, 可通过淋巴、血液循环及直接蔓延等途径,播散至体内其他组织脏器.
结直肠癌是一系列高度异质化的疾病, 患者个人的遗传因素及表观遗传存在差异. 众所周知, 肿瘤的发生发展与异常的细胞内和细胞间信号传导有关. 目前主要关注的结直肠癌相关信号通路包括Wnt/β-catenin、Notch、IL-6/JAK-STAT3、PI3K-Akt-mTOR、TGFβ-Smads等信号通路[14], 对cGAS-STING通路及下游效应参与结肠癌发展及介导肿瘤免疫方面报道甚少.
近年来人们对cGAS-STING通路的认识不断深刻. 关于其对肿瘤的作用也从最初的促进Ⅰ型干扰素产生作用于肿瘤免疫深化到了增加癌细胞衰老表型的表达及促进其老化、凋亡. 其中最经典为cGAS-STING-TBK1-IRF3-Ⅰ型干扰素通路: STING可能诱导Ⅰ型IFN的产生并进一步激活抗肿瘤CD8+T细胞. CRC组织中CD8+T细胞浸润的增加与更好的预后相关, CD8+T细胞启动需要肿瘤细胞本身[15,16], 例如CRC细胞; 也可能通过树突状细胞诱导I型IFN的产生[17]. 肿瘤微环境中, 树突状细胞(dendritic cell, DC)中的cGAS-STING通路十分重要, 其能够促进交叉呈递启动并启动肿瘤特异性CD8阳性T细胞, CD8阳性T细胞针对免疫原性肿瘤的启动涉及DC[16,18]产生Ⅰ型干扰素. 研究表明, 在结肠肿瘤微环境中, DC中的IFN-β表达是STING依赖性的.
在促进癌细胞衰老表型方面, cGAS-STING途径还可以通过响应氧化应激、辐射和癌基因表达等机制促癌细胞衰老. 有文献报道缺乏cGAS和STING的小鼠胚胎成纤维细胞[19,20]增殖加速, 衰老表型减弱. cGAS-STING途径通过介导Ⅰ型干扰素的产生和衰老相关的分泌表型因子促进衰老[20].
在cGAS-STING与STAT3中, 有文献报道[21]以斑马鱼为实验对象, 发现cGAMP介导的STING/STAT3轴的激活能够抑制肿瘤生长及侵袭, 这可能是通过cGAMP上调IL-2, TNF-α和IFN-γ及STING/STAT3轴介导Ⅰ型IFN和肿瘤浸润的NKT细胞的诱导来实现的. 这证实了cGAMP依赖的STING/STAT3轴激活在抑制肿瘤进展中起的关键作用. 有文献报道[22]在Sting-/-小鼠的结肠组织中, STAT3及IL-6的水平升高, 而STAT3是促成结肠肿瘤发生的IL-6R的下游效应子. 这些结果表明, STING通过减少结肠中的炎症来限制结肠肿瘤发生, STING可以抑制CRC的敏感性.
cGAS-STING与TGF-β通路多在放疗(radiotherapy, RT)与PD-L1抑制剂共同作用, 提高恶性肿瘤的客观应答率. 有文献报道[23]DNA损伤依赖性PD-L1表达通过ATM/ATR/Chk1激酶活性和cGAS/STING依赖性途径上调, 证明了DNA损伤信号在诱导PD-L1表达中的作用. 同样的, 该思路在临床上治疗结直肠癌中也有应用[24], 在放疗的同时通过放疗激活NBTXR3(一种氧化纳米颗粒), 诱导局部的细胞破坏和DNA损伤, 使cGAS-STING途径激活, 增强放疗效果.
STING激活炎性小体: 据相关文献报道, Sting-/-小鼠的结肠组织中观察到前胱天蛋白酶1成熟减少和IL-18表达[22], 表明STING上调了炎性体NLRP3及NLRP6的激活. 由此可见, STING可通过活化炎症小体抑制结肠肿瘤发生.
近年来, 调节STING活性的化合物开发已引起癌症治疗及疫苗佐剂筛选的重视[25]. 关于癌症治疗, 目前已完成的工作为模拟内源性STING配体cGAMP的修饰环二核苷酸的开发, 该成果已进入肿瘤患者的临床试验, 作为与免疫检查点抑制剂共同作用消退肿瘤的策略[26]. 有文献报道[27]一种小分子STING激动剂, 通过一种协同作用两个对称的酰胺基苯并咪唑(ABZI)基化合物的链接策略修饰, 创建了增强的STING结合和细胞功能的链接的ABZI(diABZIs). 向患结肠肿瘤的免疫功能正常的小鼠静脉内给予diABZI STING激动剂会引起强烈的抗肿瘤活性, 并使肿瘤消退.
值得注意的是, 该途径呈现出对多种组织来源肿瘤的抑制效果. 有文献[28]报道, 瘤内注射STING激动剂(包括黑色素瘤、结肠癌、乳腺癌等)可产生积极的治疗效果. 基于在肿瘤微环境下激活该途径行肿瘤治疗的药理学方法逐渐进入临床转化治疗的重要领域.
与之相应的, 缺失STING的宿主表现出结直肠组织的慢性炎症和异型增生概率增加. 有文献表明在Sting敲除小鼠大肠组织炎症细胞浸润增加, 异型增生增加[22]. 该文献还表明在CRC发育的不同阶段, 结肠组织和Sting-/-小鼠血清中的促炎因子(如IL-6和KC)水平升高. 此外, p-STAT3的水平在Sting-/-小鼠的结肠组织中上调, 后者是IL-6R的下游效应子, 有助于结肠肿瘤的发生[29], 表明STING可能通过减少结肠炎症来抑制结肠肿瘤发生.
如前文所介绍, cGAS-STING通路能够产生多种生物学效应, 不仅有通过产生干扰素抗肿瘤的作用, 还有提示肿瘤预后及进展的作用. 有文献报道[30]cGAS等胞质DNA感应和核酸酶相关基因在结肠肿瘤组织中高表达. 此外, 发现cGAS上调与早期结直肠癌有关. 对于非整倍体结肠癌细胞的研究指出了染色体不稳定能激活cGAS/STING信号传导, 抑制癌细胞侵袭[31].
结肠癌与模式识别受体引起的慢性炎症有关. cGAS为多种核酸感应模式识别受体中的一种[32]. 其基因相关变体, 如cGAS rs72960018, cGAS rs9352000, 和TMEM173突变累积使具有更多突变的等位基因携带者CRC风险成倍增加, 其与下游的相关干扰素基因及干扰素调节因子存在复杂的相互作用[33], 该相互作用的抑制可能导致相关细胞因子: 如最主要的Ⅰ型干扰素、IL-1β、IL-18[34]、IL-22[35]表达下调或缺失, 最终导致宿主患结肠癌风险增加. 在后续探究IL-18、IL-22及IL-22BP(IL-22结合蛋白)关系的实验中, 报道[36]STING诱导IL-18上调, 进一步上调IL-22BP的表达, IL-22BP负调节IL-22; 而IL-22被证明是促进结肠癌发生的启动子[35].
STING可以通过多种机制抑制结肠肿瘤的发生, 包括(但不限于)抑制炎症, 激活炎性小体和/或诱导Ⅰ型IFN. STING可能通过诱导Ⅰ型IFN的产生并进一步激活抗肿瘤CD8+T细胞. CRC组织中CD8+T细胞浸润的增加与更好的预后相关[15,16]. 此外, 有文献指出[37]在结肠癌发生时, STING信号会被多种机制抑制, 包括cGAS/STING启动子表观遗传沉默, STING错义突变等, 导致STING表达水平无法响应宿主DNA损伤相关事件, 不能产生相关细胞因子, 从而导致宿主免疫受损及癌细胞免疫逃逸. 这体现了cGAS及STING的水平对结肠癌的不同阶段及预后提示的独特作用.
cGAS-STING通路本质上是构成固有免疫的重要部分, 该通路的激动剂在应用于肿瘤治疗方面体现出普适性. 二甲基氧杂蒽基乙酸(DMXAA), 作为第一个靶向cGAS-STING途径的药物[38]虽能够在多个品系小鼠体内特异性增强IFN产生, 但在人体内DMXAA与STING作用微弱, 不能产生STING激动效应. 因此, 找到特异性人cGAS-STING激动剂成为临床上癌症治疗的重要策略.
关于高效特异性的STING激动剂, 有文献报道一种化合物[39]: 双螺二酮哌嗪(DSDP)能够以依赖功能性人STING而非小鼠STING的表达的方式诱导细胞因子应答, 其表现出了强大的抗病毒抗肿瘤作用. 除了cGAMP[40], ADU-S100[41]等小分子激动剂外, 前文中提到的[27]免疫修饰创建具有增强的STING结合力和细胞功能的链接的ABZI(酰胺基苯并咪唑)(diABZIs). 该化合物能够高效激活STING, 具有强烈的抗肿瘤活性. 这标志了通过特异性影响免疫过程的免疫修饰构建化合物介导肿瘤免疫取得新进展. CDNs是一种非常有效的STING激动剂, 其中值得注意的是将环状双鸟苷酸(c-di-GMP)与单核细胞增生性李斯特菌联合治疗表达肿瘤相关抗原MAGE-b[42], 它能够增强模型动物的抗癌能力, 且与5-氟尿嘧啶联用时减少其毒性. CDNs对体内多种肿瘤具有强大的抗肿瘤作用. 然而其临床安全性和可靠性还有待商榷.
cGAS- STING信号通路作为细胞质内重要的免疫应答通路, 是构成固有免疫的重要部分. cGAS作为一种模式识别受体, 识别胞质内出现肿瘤细胞DNA, 可通过cGAS-STING-TBK1-IRF3-IFN轴或STAT信号通路产生Ⅰ型IFN、产生炎性小体等方式参与肿瘤免疫, 减小肿瘤体积. 然而, cGAS引起的慢性炎症与结肠癌相关, 且在结肠癌中cGAS通路被多种机制抑制, 导致STING信号及后续干扰素、白介素等细胞因子分泌水平不足, 癌细胞免疫逃逸; 因此cGAS具有作为早期结肠癌发病的标志物的潜力. STING可通过激活炎性体和/或诱导I型IFN等途径抑制结肠肿瘤的发生, 且能够在肿瘤微环境进一步募集CD8+T细胞, 明显改善结肠癌患者预后. 正因如此, 在结肠肿瘤治疗方面, cGAS-STING通路的激动剂逐渐进入人们视野, 目前已经筛选出一些具有种属特异性的cGAS/STING激动剂, 甚至通过免疫修饰构建特异性影响免疫过程的化合物, 并且在不限于结肠癌的多类型肿瘤中具有抑制肿瘤发展的作用, 然而其安全性、可靠性, 以及对不同肿瘤的效果差异仍待研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 马亚娟 制作编辑:张砚梁
| 1. | Swann JB, Hayakawa Y, Zerafa N, Sheehan KC, Scott B, Schreiber RD, Hertzog P, Smyth MJ. Type I IFN contributes to NK cell homeostasis, activation, and antitumor function. J Immunol. 2007;178:7540-7549. [PubMed] [DOI] |
| 2. | Yang J, Tang X, Nandakumar KS, Cheng K. Autophagy induced by STING, an unnoticed and primordial function of cGAS. Cell Mol Immunol. 2019;16:683-684. [PubMed] [DOI] |
| 3. | Burdette DL, Monroe KM, Sotelo-Troha K, Iwig JS, Eckert B, Hyodo M, Hayakawa Y, Vance RE. STING is a direct innate immune sensor of cyclic di-GMP. Nature. 2011;478:515-518. [PubMed] [DOI] |
| 4. | Zhong B, Yang Y, Li S, Wang YY, Li Y, Diao F, Lei C, He X, Zhang L, Tien P, Shu HB. The adaptor protein MITA links virus-sensing receptors to IRF3 transcription factor activation. Immunity. 2008;29:538-550. [PubMed] [DOI] |
| 5. | Ishikawa H, Barber GN. STING is an endoplasmic reticulum adaptor that facilitates innate immune signalling. Nature. 2008;455:674-678. [PubMed] [DOI] |
| 6. | Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013;39:1-10. [PubMed] [DOI] |
| 7. | Li A, Yi M, Qin S, Song Y, Chu Q, Wu K. Activating cGAS-STING pathway for the optimal effect of cancer immunotherapy. J Hematol Oncol. 2019;12:35. [PubMed] [DOI] |
| 8. | Deng L, Liang H, Xu M, Yang X, Burnette B, Arina A, Li XD, Mauceri H, Beckett M, Darga T, Huang X, Gajewski TF, Chen ZJ, Fu YX, Weichselbaum RR. STING-Dependent Cytosolic DNA Sensing Promotes Radiation-Induced Type I Interferon-Dependent Antitumor Immunity in Immunogenic Tumors. Immunity. 2014;41:843-852. [PubMed] [DOI] |
| 9. | Wang H, Hu S, Chen X, Shi H, Chen C, Sun L, Chen ZJ. cGAS is essential for the antitumor effect of immune checkpoint blockade. Proc Natl Acad Sci USA. 2017;114:1637-1642. [PubMed] [DOI] |
| 10. | Dunn GP, Bruce AT, Sheehan KC, Shankaran V, Uppaluri R, Bui JD, Diamond MS, Koebel CM, Arthur C, White JM, Schreiber RD. A critical function for type I interferons in cancer immunoediting. Nat Immunol. 2005;6:722-729. [PubMed] [DOI] |
| 11. | Estrella V, Chen T, Lloyd M, Wojtkowiak J, Cornnell HH, Ibrahim-Hashim A, Bailey K, Balagurunathan Y, Rothberg JM, Sloane BF, Johnson J, Gatenby RA, Gillies RJ. Acidity generated by the tumor microenvironment drives local invasion. Cancer Res. 2013;73:1524-1535. [PubMed] [DOI] |
| 12. | Woo SR, Corrales L, Gajewski TF. The STING pathway and the T cell-inflamed tumor microenvironment. Trends Immunol. 2015;36:250-256. [PubMed] [DOI] |
| 13. | Farhood B, Najafi M, Mortezaee K. CD8+ cytotoxic T lymphocytes in cancer immunotherapy: A review. J Cell Physiol. 2019;234:8509-8521. [PubMed] [DOI] |
| 14. | Bertrand FE, Angus CW, Partis WJ, Sigounas G. Developmental pathways in colon cancer: crosstalk between WNT, BMP, Hedgehog and Notch. Cell Cycle. 2012;11:4344-4351. [PubMed] [DOI] |
| 15. | Naito Y, Saito K, Shiiba K, Ohuchi A, Saigenji K, Nagura H, Ohtani H. CD8+ T cells infiltrated within cancer cell nests as a prognostic factor in human colorectal cancer. Cancer Res. 1998;58:3491-3494. [PubMed] |
| 16. | Fuertes MB, Kacha AK, Kline J, Woo SR, Kranz DM, Murphy KM, Gajewski TF. Host type I IFN signals are required for antitumor CD8+ T cell responses through CD8{alpha}+ dendritic cells. J Exp Med. 2011;208:2005-2016. [PubMed] [DOI] |
| 17. | Andzinski L, Spanier J, Kasnitz N, Kröger A, Jin L, Brinkmann MM, Kalinke U, Weiss S, Jablonska J, Lienenklaus S. Growing tumors induce a local STING dependent Type I IFN response in dendritic cells. Int J Cancer. 2016;139:1350-1357. [PubMed] [DOI] |
| 18. | Diamond MS, Kinder M, Matsushita H, Mashayekhi M, Dunn GP, Archambault JM, Lee H, Arthur CD, White JM, Kalinke U, Murphy KM, Schreiber RD. Type I interferon is selectively required by dendritic cells for immune rejection of tumors. J Exp Med. 2011;208:1989-2003. [PubMed] [DOI] |
| 19. | Yang H, Wang H, Ren J, Chen Q, Chen ZJ. cGAS is essential for cellular senescence. Proc Natl Acad Sci USA. 2017;114:E4612-E4620. [PubMed] [DOI] |
| 20. | Glück S, Guey B, Gulen MF, Wolter K, Kang TW, Schmacke NA, Bridgeman A, Rehwinkel J, Zender L, Ablasser A. Innate immune sensing of cytosolic chromatin fragments through cGAS promotes senescence. Nat Cell Biol. 2017;19:1061-1070. [PubMed] [DOI] |
| 21. | Jiang X, Liu G, Hu Z, Chen G, Chen J, Lv Z. cGAMP inhibits tumor growth in colorectal cancer metastasis through the STING/STAT3 axis in a zebrafish xenograft model. Fish Shellfish Immunol. 2019;95:220-226. [PubMed] [DOI] |
| 22. | Zhu Q, Man SM, Gurung P, Liu Z, Vogel P, Lamkanfi M, Kanneganti TD. Cutting edge: STING mediates protection against colorectal tumorigenesis by governing the magnitude of intestinal inflammation. J Immunol. 2014;193:4779-4782. [PubMed] [DOI] |
| 23. | Shevtsov M, Sato H, Multhoff G, Shibata A. Novel Approaches to Improve the Efficacy of Immuno-Radiotherapy. Front Oncol. 2019;9:156. [PubMed] [DOI] |
| 24. | Marill J, Mohamed Anesary N, Paris S. DNA damage enhancement by radiotherapy-activated hafnium oxide nanoparticles improves cGAS-STING pathway activation in human colorectal cancer cells. Radiother Oncol. 2019;141:262-266. [PubMed] [DOI] |
| 25. | Li T, Chen ZJ. The cGAS-cGAMP-STING pathway connects DNA damage to inflammation, senescence, and cancer. J Exp Med. 2018;215:1287-1299. [PubMed] [DOI] |
| 26. | Mullard A. Can innate immune system targets turn up the heat on 'cold' tumours? Nat Rev Drug Discov. 2018;17:3-5. [PubMed] [DOI] |
| 27. | Ramanjulu JM, Pesiridis GS, Yang J, Concha N, Singhaus R, Zhang SY, Tran JL, Moore P, Lehmann S, Eberl HC, Muelbaier M, Schneck JL, Clemens J, Adam M, Mehlmann J, Romano J, Morales A, Kang J, Leister L, Graybill TL, Charnley AK, Ye G, Nevins N, Behnia K, Wolf AI, Kasparcova V, Nurse K, Wang L, Puhl AC, Li Y, Klein M, Hopson CB, Guss J, Bantscheff M, Bergamini G, Reilly MA, Lian Y, Duffy KJ, Adams J, Foley KP, Gough PJ, Marquis RW, Smothers J, Hoos A, Bertin J. Design of amidobenzimidazole STING receptor agonists with systemic activity. Nature. 2018;564:439-443. [PubMed] [DOI] |
| 28. | Corrales L, Gajewski TF. Molecular Pathways: Targeting the Stimulator of Interferon Genes (STING) in the Immunotherapy of Cancer. Clin Cancer Res. 2015;21:4774-4779. [PubMed] [DOI] |
| 29. | Corvinus FM, Orth C, Moriggl R, Tsareva SA, Wagner S, Pfitzner EB, Baus D, Kaufmann R, Huber LA, Zatloukal K, Beug H, Ohlschläger P, Schütz A, Halbhuber KJ, Friedrich K. Persistent STAT3 activation in colon cancer is associated with enhanced cell proliferation and tumor growth. Neoplasia. 2005;7:545-555. [PubMed] [DOI] |
| 30. | Yang CA, Huang HY, Chang YS, Lin CL, Lai IL, Chang JG. DNA-Sensing and Nuclease Gene Expressions as Markers for Colorectal Cancer Progression. Oncology. 2017;92:115-124. [PubMed] [DOI] |
| 31. | Vasudevan A, Baruah PS, Smith JC, Wang Z, Sayles NM, Andrews P, Kendall J, Leu J, Chunduri NK, Levy D, Wigler M, Storchová Z, Sheltzer JM. Single-Chromosomal Gains Can Function as Metastasis Suppressors and Promoters in Colon Cancer. Dev Cell. 2020;52:413-428.e6. [PubMed] [DOI] |
| 32. | He L, Chen Y, Wu Y, Xu Y, Zhang Z, Liu Z. Nucleic acid sensing pattern recognition receptors in the development of colorectal cancer and colitis. Cell Mol Life Sci. 2017;74:2395-2411. [PubMed] [DOI] |
| 33. | Catalano C, da Silva Filho MI, Frank C, Lu S, Jiraskova K, Vymetalkova V, Levy M, Liska V, Vycital O, Naccarati A, Vodickova L, Hemminki K, Vodicka P, Weber ANR, Försti A. Epistatic effect of TLR3 and cGAS-STING-IKKε-TBK1-IFN signaling variants on colorectal cancer risk. Cancer Med. 2020;9:1473-1484. [PubMed] [DOI] |
| 34. | Elinav E, Nowarski R, Thaiss CA, Hu B, Jin C, Flavell RA. Inflammation-induced cancer: crosstalk between tumours, immune cells and microorganisms. Nat Rev Cancer. 2013;13:759-771. [PubMed] [DOI] |
| 35. | Huber S, Gagliani N, Zenewicz LA, Huber FJ, Bosurgi L, Hu B, Hedl M, Zhang W, O'Connor W, Murphy AJ, Valenzuela DM, Yancopoulos GD, Booth CJ, Cho JH, Ouyang W, Abraham C, Flavell RA. IL-22BP is regulated by the inflammasome and modulates tumorigenesis in the intestine. Nature. 2012;491:259-263. [PubMed] [DOI] |
| 36. | Ahn J, Konno H, Barber GN. Diverse roles of STING-dependent signaling on the development of cancer. Oncogene. 2015;34:5302-5308. [PubMed] [DOI] |
| 37. | Konno H, Yamauchi S, Berglund A, Putney RM, Mulé JJ, Barber GN. Suppression of STING signaling through epigenetic silencing and missense mutation impedes DNA damage mediated cytokine production. Oncogene. 2018;37:2037-2051. [PubMed] [DOI] |
| 38. | Conlon J, Burdette DL, Sharma S, Bhat N, Thompson M, Jiang Z, Rathinam VA, Monks B, Jin T, Xiao TS, Vogel SN, Vance RE, Fitzgerald KA. Mouse, but not human STING, binds and signals in response to the vascular disrupting agent 5,6-dimethylxanthenone-4-acetic acid. J Immunol. 2013;190:5216-5225. [PubMed] [DOI] |
| 39. | Liu B, Tang L, Zhang X, Ma J, Sehgal M, Cheng J, Zhang X, Zhou Y, Du Y, Kulp J, Guo JT, Chang J. A cell-based high throughput screening assay for the discovery of cGAS-STING pathway agonists. Antiviral Res. 2017;147:37-46. [PubMed] [DOI] |
| 40. | Eaglesham JB, Kranzusch PJ. Conserved strategies for pathogen evasion of cGAS-STING immunity. Curr Opin Immunol. 2020;66:27-34. [PubMed] [DOI] |
| 41. | Sivick KE, Desbien AL, Glickman LH, Reiner GL, Corrales L, Surh NH, Hudson TE, Vu UT, Francica BJ, Banda T, Katibah GE, Kanne DB, Leong JJ, Metchette K, Bruml JR, Ndubaku CO, McKenna JM, Feng Y, Zheng L, Bender SL, Cho CY, Leong ML, van Elsas A, Dubensky TW, McWhirter SM. Magnitude of Therapeutic STING Activation Determines CD8+ T Cell-Mediated Anti-tumor Immunity. Cell Rep. 2018;25:3074-3085.e5. [PubMed] [DOI] |
| 42. | Chandra D, Quispe-Tintaya W, Jahangir A, Asafu-Adjei D, Ramos I, Sintim HO, Zhou J, Hayakawa Y, Karaolis DK, Gravekamp C. STING ligand c-di-GMP improves cancer vaccination against metastatic breast cancer. Cancer Immunol Res. 2014;2:901-910. [PubMed] [DOI] |