修回日期: 2020-08-27
接受日期: 2020-09-21
在线出版日期: 2020-11-08
近些年, 全球爆发了多起新发传染病事件, 包括重症急性呼吸综合征、埃博拉病毒病、中东呼吸综合征和新型冠状病毒肺炎. 经验表明, 新发传染病的检测和研究在应对疫情过程中发挥着至关重要的作用, 这也给生物安全实验室带来巨大的挑战. 面对未知的生物危险因子, 不规范的生物安全防护措施对实验室人员的生命健康以及传染病的研究造成严重影响, 这足以表明生物安全实验室重视安全防护的必要性. 本文将针对新发传染病事件中, 国内外生物安全实验室在安全防护措施方面的管理以及展望进行简要述评.
核心提要: 面对新发传染病事件, 生物安全实验室在检测和研究未知新型生物危险因子时, 要吸取以往经验教训, 开发创新性途径, 积极采取措施, 避免生物安全防护不足而导致的实验室感染.
引文著录: 贾延芳, 郑健, 高英堂. 针对新发传染病生物安全实验室的管理与展望. 世界华人消化杂志 2020; 28(21): 1059-1067
Revised: August 27, 2020
Accepted: September 21, 2020
Published online: November 8, 2020
In recent years, there have been several outbreaks of infectious diseases around the world, including severe acute respiratory syndrome, Ebola virus disease, Middle East respiratory syndrome, and corona virus disease 2019. Experience suggests that the detection and research of emergent infectious diseases play a crucial role in the process of responding to the epidemic, which also brings great challenges to biosafety laboratories. In the face of unknown biological risk factors, the non-standard biosafety protection measures have a serious impact on the life safety of laboratory staff and the research of infectious diseases, which stresses the necessity of safety protection in biosafety laboratories. This article will briefly review the current status and future prospect of management of biosafety laboratories both in China and other countries in terms of safety protection measures during new sudden infectious disease incidents.
- Citation: Jia YF, Jian Z, Gao YT. Current status and future prospect of management of biosafety laboratories for emerging infectious diseases. Shijie Huaren Xiaohua Zazhi 2020; 28(21): 1059-1067
- URL: https://www.wjgnet.com/1009-3079/full/v28/i21/1059.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i21.1059
近些年全球爆发了多起大规模的新发传染病: 2002-11/2003年春夏之交, 在我国爆发严重急性呼吸系统综合征(severe acute respiratory syndrome, SARS)[1]; 2009年爆发甲型H1N1流感[2]; 始于2012年的中东呼吸综合征(middle east respiratory syndrome, MERS)[3,4]; 2014年, 西非多国爆发的埃博拉出血热(ebola virus disease, EVD)[5]; 2019年出现的COVID-19[6,7]. 以COVID-19为例, 2019年底在中国武汉首次发现, 目前已涉及全球绝大多数国家[8,9]. 报道显示, 尽管新冠疫情在我国、韩国等少数国家得到有效控制, 但在欧美等国家仍呈上升趋势. 新发传染病传播速度之迅猛、死亡率之高以及波及范围之广给全世界各个国家的公共卫生防疫工作带来巨大挑战. 研究表明, 预防或延缓新发传染病大流行的有效措施, 在一定程度上取决于准确的预测及诊断筛查能力[10]. 因此, 面对新型未知生物危险因子, 生物安全实验室管理和检测能力的高效性和准确性, 在应对突发性公共卫生事件中发挥着至关重要的作用. 然而就目前现状而言, 对于新型未知生物危险因子的感染方式、传播途径、致病剂量以及对生物安全实验室的要求都处于探索阶段. 在此期间, 生物安全实验室工作人员的安全防护对于避免发生实验室获得性感染起到关键性作用.
近几年连续爆发的全球性新发传染病, 促使实验室生物安全成为全社会关注的焦点, 这也是目前全球面临的重大公共卫生问题之一. 实验室各相关工作人员要基于以往生物安全实验室在应对新发传染病时的经验, 充分完善、不断创新安全防护措施. 本文就相关领域的主要研究进展进行简要述评.
世界卫生组织(world health organization, WHO)《实验室生物安全手册(第三版)》表述: "实验室生物安全"一词用于描述为防止无意暴露于病原体和毒素或其意外释放而实施的遏制原则、技术和做法[11]. 换言之, "实验室生物安全"是指旨在防止病原体和毒素丢失、被盗、误用、转移或故意释放的机构和个人的安全措施[11]. 其主要目的是保护工作人员避免感染危险生物因子, 保护公众健康和生存环境不受污染, 并且不改变试验对象原有性质[12].
美国疾病控制与预防中心(chinese center for disease control and prevention, CDC)《微生物和生物医学实验室的生物安全(第五版)》将生物安全实验室分为四级, 即Biological Safety Level-1-4 (BSL-1-4). 国内病原微生物实验室依据其承担的检测工作在生物安全方面具有不同的规范要求, 在实验室选址、设计建造、安全设备、个人防护和环境保护等方面均有明确的指南或准则. 参考我国国家卫生和计划生育委员会《病原微生物实验室生物安全通用准则》(WS 233-2017)及相关文献[12-15], 总结BSL-1-4实验室的简要特征见表1.
| 实验室等级 | 适用范围 | 安全设备和个人防护 | 特殊要求 |
| 一级生物安全实验室(BSL-1) | 在通常情况下不会引起人类或者动物疾病的微生物 | 实验台面应防水, 并能耐受中等程度的热、有机溶剂、酸碱等化学剂; 操作中穿工作服 | 洗手池宜设置在靠近出口处; 若涉及使用有毒 、刺激性、挥发性物质, 应配备适当的排风柜(罩), 30 m内设洗眼装置 |
| 二级生物安全实验室(BSL-2) | 能够引起人类或者动物疾病,但一般情况下对人、动物或者环境不构成严重危害, 传播风险有限, 具备有效治疗和预防措施的微生物 | 符合BSL-1的要求; 设置Ⅱ级生物安全柜; 安全柜外处理感染性材料必须使用面部保护装置(护目镜、面罩等) | 主入口的门应有进入控制措施; 应包含缓冲间和核心工作间; 消毒、灭菌设备应以风险评估为依据; 核心工作间内送风口和排风口的布置应符合定向气流的原则; 核心工作间气压相对于相邻区域应为负压, 压差宜不低于10 Pa |
| 三级生物安全实验室(BSL-3) | 能够引起人类或者动物严重疾病, 比较容易直接或者间接在人与人、动物与人、动物与动物间传播的微生物 | 符合BSL-2的要求; 必须安装Ⅱ级或Ⅱ级以上生物安全柜; 所有操作应在生物安全柜中进行; 在缓冲间更换防护服; 实验室配备应急药品 | 应在建筑物中自成隔离区或为独立建筑物; 明确区分辅助工作区和防护区; 设置自控、监视与报警系统、通讯系统以及门禁管理系统; 送风应经过初效、中效过滤器和HEPA过滤器过滤, 在生物安全柜操作面或其他有气溶胶发生地点的上方不得设送风口; 安装独立送排风系统,气流由低向高风险区流动, HEPA过滤后排出; 防护区下水系统, 应与建筑物的下水系统完全隔离 |
| 四级生物安全实验室(BSL-4) | 能够引起人类或者动物非常严重疾病的微生物, 我国尚未发现或者已经宣布消灭的微生物 | 符合 BSL-3的要求; BSL-4分为正压服型实验室和安全柜型实验室; 所有操作均在Ⅲ级生物安全柜中进行; 进入实验室必须换上全套防护服, 离开前均须在更衣室脱下; 在正压服型实验室中, 工作人员必须穿着特殊的正压服式保护服装 | 应在建筑物中自成隔离区或为独立建筑物; 防护区应至少包括核心工作间、缓冲间、外防护服更换间; 辅助工作区应包括监控室、清洁衣物更换间等; 设置化学淋浴消毒装置; 防护区内所有区域的室内气压应为负压; 实验室的排风应经过两级HEPA过滤器处理后排放; 应具备与安全隔离装置配套的物品传递设备以及生物安全型压力蒸汽灭菌器 |
规范的生物安全管理是实现实验室安全运行的重要保障. 我国国家卫生和计划生育委员会《临床实验室生物安全指南》(WS/T 442-2014)指出, 实验室生物安全管理包括实验室硬件(设施设备)、软件(管理体系)和工作人员的管理.
2004年以来, 我国先后颁布《病原微生物实验室生物安全管理条例》(国务院令第424号)、《实验室生物安全通用要求》(GB 19489-2004)等一系列法律法规及标准规范, 推动生物安全实验室相关防护意识和水平的提高[16,17]. 通过公布病原微生物分类和实验室生物安全等级规范, 进一步完善实验室生物安全管理标准化, 并规定实验室人员职业暴露以及生物危险因子泄露时的应急报告和控制时限[17]. 自此以后, 我国实验室生物安全在管理规范化、队伍建设、人员培训、技术研发和应急管理等方面取得了阶段性的进步, 为新发传染病的防控提供了可靠的支持[17].
如今, 随着现代科技的发展, 生物安全管理中信息技术的应用日益增多, 提高了生物安全实验室信息化管理水平和备案时效, 使得实验室管理更加便捷、规范和高效, 一定程度上减少了由于管理者失误造成的实验室生物安全事故隐患[18]. 例如, 国内一些专家利用信息技术将电子芯片RFID技术与GPS、ZigBee等技术相结合, 研发出生物安全实验室实时监测管理系统, 实现菌(毒)种的安全保存、实时定位和防窃等功能, 使相关管理部门可以及时监测、准确掌握菌(毒)种的动态信息, 更高效地对实验室生物安全进行管理[12].
尽管生物安全管理在制定规范和监督检查等方面取得长足进步, 但实验室在相关规范具体落实和人员培训等诸多方面仍有欠缺[19]. 近几年, 多次爆发的新发传染病暴露出实验室生物安全管理的不足之处, 特别是广泛分布于医疗机构的BSL-2实验室.
2.2.1 管理体系、组织制度不完善, 生物安全自查工作不规范: 就国内而言, 生物安全实验室的各项管理规定大多属于纲领性的文件, 对操作规范只作宏观指导, 具体操作性的要求较少, 而且监督管理制度不完善[20]. 大多数医疗机构实验室的生物安全管理主要依赖于医院院内的感染管理制度, 但后者难以有效预防、控制实验室感染, 总之, 医院院内感染管理制度不能代替实验室生物安全管理制度[21]. 此外, 部分医疗机构实验室没有设置生物安全实验室检查和生物安全柜等设施的检测记录[21]. 但近些年, 这种情况在国内三甲医院得到一定程度的改善, 现阶段更需要注意的是自查工作在不同医疗机构重视程度的差异.
2.2.2 实验室的硬件设施达不到管理要求: 一些低资源地区的医疗卫生机构, 由于经济落后, 对实验室生物安全管理的重视程度不够, 实验室硬件设施距离实际需求及国际标准还有一定差距, 在一定程度上降低了实验室生物安全的保障系数[22,23].
2.2.3 实验室工作人员缺乏安全意识、应急处理能力不足: 实验室工作人员的生物安全素质是实验室生物安全的基本保障, 然而生物安全实验室中仍然存在漠视生物安全、不按照规范操作的问题, 为生物安全事故埋下了隐患. 有研究表明, 若实验室工作人员不熟悉本实验室的意外事件应急处理程序, 出现意外事件时就不能迅速准确应对, 甚至发生因处理不及时或处理不当导致事件进一步恶化[24]. 这与实验室工作人员面对实验室生物安全防护主观意识不强、缺乏底线思维以及实验室管理者对工作人员意外事故应急培训与演练的不足有直接关系[25].
2.2.4 样本存储与处理、危险废弃物处置不当: 调查发现, 个别医疗机构的实验室存在样本、试剂混放现象, 且未对冰箱设置防护[2]. 实验室生物废弃物往往含有致病性危险生物因子, 有些实验室存在对其处置不当的现象, 易造成环境污染, 甚至导致实验室工作人员发生实验室获得性感染, 进而造成致病性危险生物因子的传播[26].
2.2.5 实验室备案不足: 经调查显示, 实验室中的各项生物安全设施与《人间传染的病原微生物名录》中的相关规定存在一定差距, 并且部分实验设施未符合《实验室生物安全通用要求》以及《生物实验室建筑技术》的要求[21]. 实验室因各种原因不能向卫生主管部门主动备案, 导致相关部门不能及时对实验室实施审查和规范, 为发生实验室感染等事件埋下隐患.
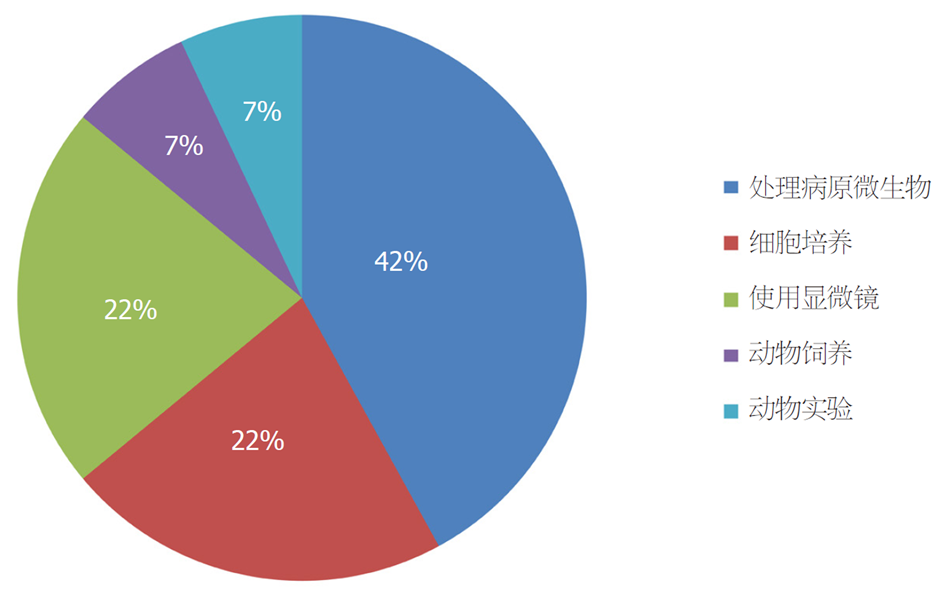
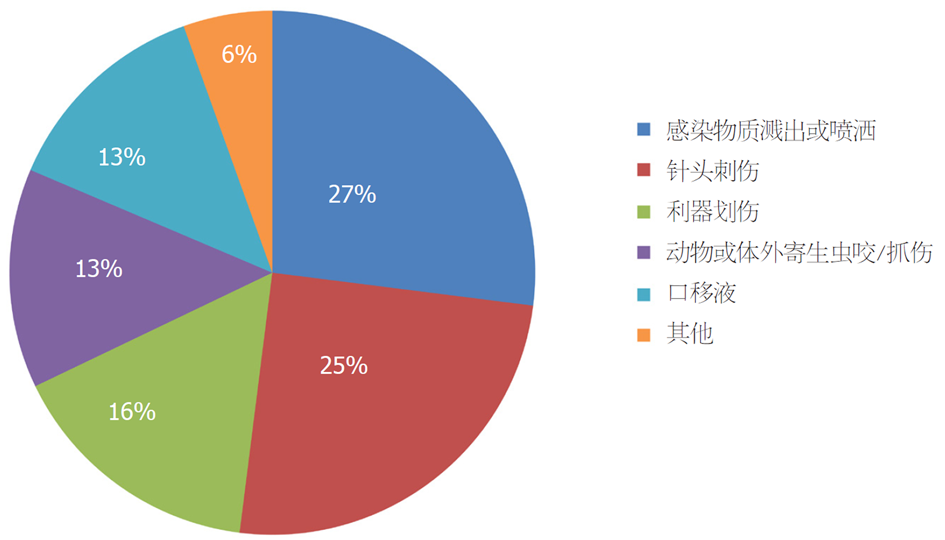
忽视实验室生物安全管理, 可能会造成实验人员或社会人群感染危险致病因子甚至死亡的严重后果. 由于生物感染往往具有隐蔽性, 感染后不易觉察等特点, 因此易造成群体性感染事故[26]. 实验室感染存在多个途径, 如图1所示, 处理病原微生物和细胞培养占比超过六成[26-28]. 实验室处理病原体样本的现代诊断方法通常是从病人的血液、拭子或其他组织、体液中提取核酸或蛋白, 进行核酸检测和血清抗体检测[29]. 在操作过程中, 如果不遵守实验室生物安全的严格规定, 可能造成实验室获得性感染. 调查分析显示, 人为失误占实验室获得性感染的比例非常高[13,28,30], 图2列出了常见的实验室获得性感染事故类型, 其中半数以上事故由感染性物质溅出或喷洒以及针头刺伤引起. 研究人员未能规范使用个人防护设备是导致感染的关键因素[31]. 然而, 并非所有接触病原体都必然导致感染和疾病. 感染是否发生取决于以下几个因素: 特定病原体、病原体暴露量、剂量-反应关系和传播途径等[27,32]. 因此, 首先要确定所考虑的特定病原体是否可以在人与人之间传播; 其次, 对于可传播的病原体, 评估可能导致的暴发规模和范围[32]. 值得注意的是, 人类并不是生物危害的唯一潜在受害者. 2007年, 英国爆发了口蹄疫, 后来怀疑是由于附近两个研究这种病毒的实验室管道破裂所致[28].
考虑到对人类的致病作用和对环境的潜在危害, 应采取并遵循最大限度的遏制措施和程序, 以减少这类风险的发生[27]. 实验室降低风险的常规预防措施包括: 出入控制、防护装备、生物安全柜、定向气流、净化程序和设备、人员培训、紧急事故响应和报告系统、安全、密封的环境等[32].
新型病原体的出现和流行病的演变对各级公共卫生系统提出了复杂的新挑战[33]. 对于新出现或重新出现的病毒, 如SARS-CoV, 实验室操作常常伴随着高病毒载量和高毒力[31]. 新发传染病流行的早期阶段, 通常对这些病原体的传播动力学以及微生物特性知之甚少[34]. 实验室工作人员接触病原体的强度和深度、以及所遇到的病原体浓度和受侵袭概率比在常规环境中要高[31]. 经验表明, 在识别和分离一种新的病原体时, 往往会导致由该新分离物引起的实验室获得性感染[13]. 临床实验室处于检测新发传染病的前沿, 这些实验室应对疫情的能力对于感染控制和预防至关重要[27,33]. 正因为如此, 实验室需要制定适当的生物安全防护措施, 以保护实验室工作人员免受感染, 降低实验室获得性感染发生率[27]. 建议实验室内安装监控摄像头, 实验室管理人员可以实时监控, 并实现实验室工作人员安全便捷的交流[35]. 此外, 有专家建议在常规基础上进行健康检测和实验性疫苗接种, 以及做好疫苗接种后的不良反应和相关症状检查[27]. BSL-4实验室处理的大多数病毒在亚洲、南美和非洲的发展中国家引起过暴发, 这些国家利用流动实验室提供早期诊断, 从而避免了样品在运输过程中发生生物危险因子泄露事件[35]. 2014-09, 中国派出一个移动生物安全三级实验室(MBSL-3实验室)和一个训练有素的诊断小组前往塞拉利昂[36]. 新型冠状肺炎时期, 中国疾病预防控制中心也紧急出动MBSL-3实验室驰援湖北武汉. 因此, 确定适宜的生物安全管理措施在应对紧急公共卫生事件时将会发挥重要作用.
2003年SARS的流行体现了核酸检测在数周内识别、分离和鉴定一种未知病毒病原体的能力[37,38]. 疫情初期, 鉴于该病毒有可能通过飞沫感染和污染物传播, 加上其较高的病死率(10%-20%), 专家建议, 针对该未知病毒的生物安全措施从SARS爆发初期就开始实施, 涉及SARS-CoV复制的任何程序都要在BSL-3实验室进行[38,39]. 在处理疑似或潜在的SARS-CoV标本时, 要确保最严格的防护措施[38]. 对于要保留的病原体样本, 根据样本类别, 储存在BSL-3实验室或带有门禁系统的BSL-2实验室[39]. 除此之外, 建立数据库, 维护和更新这些样本的信息, 只允许指定的工作人员访问数据库, 以确保数据库信息的安全[39]. SARS爆发期间, 世界卫生组织SARS反应小组负责人表示: "每个政府都应该充分了解其国家所有的生物安全实验室, 以确保他们有适当的设施; 要完全阻断动物与人之间的传播仍然很困难, 但我们应该遵循适当的程序, 避免SARS的实验室传播"[40]. 对于在BSL-3实验室工作的人来说, 要实施更为严格的生物安全培训[39]. 此次SARS的流行在一定程度上改善了生物安全实验室的管理防护措施[38].
2012年, 一种新型SARS样冠状病毒在中东的出现引起了国际社会对可能发生的传染病大流行的担忧[3,41]. MERS的爆发比预期更严重, 医院和公众之间在感染控制和预防方面面临很多困难[33]. 2015年, 韩国疫情初期, 为了应对MERS爆发造成的实验室生物安全威胁, 尽管临床实验室配备了二级生物安全柜, 但是尚不具备诸如负压痰液收集和预处理室等高端设施[33]. 公共卫生机构要及时规范用于检测、研究MERS-CoV的生物安全实验室设施配备标准. 临床实验室主要负责测试样本以支持临床决策, 通常拥有可快速检测的病原体样本, 因此, 面对新发传染病, 临床实验室更要重视实验室生物安全相关事项[33].
2013-12/2016-03, 西非爆发了迄今为止最大规模的EVD[42,43]. EVD是由埃博拉病毒引起的一种出血热, 此种病毒具有高度传染性, 可通过感染性体液或分泌物传播[5,44-46]. 风险评估是制定埃博拉病毒实验计划的关键要素[47]. 疫情爆发期间, 没有针对人类的疫苗、有效的治疗方法和暴露后预防. 因此, 埃博拉病毒的培养和检测必须在BSL-4实验室进行[44,45]. 实验室始终是高度接触BSL-4病毒病原体的潜在场所, 尽管保护标准很高, 但实验室工作人员感染埃博拉病毒的风险依然很高[45,48]. 实验室人员在指定用于埃博拉病毒检测的空间内进行常规技能训练和相关系统运行的测试控制, 以培养肌肉记忆[47]. 针对新型病原体实施新的诊断方法时, 要进行专门培训[49]. 除此之外, 还要在实验室设备方面进行相应的建设, 并长期致力于有效监督和质量改进[49]. 在疫情结束时, 欧洲实验室对埃博病毒疫情进行了评估, 包括针对实验室的诊断、生物安全管理等方面, 其回顾性评估有助于查明当前操作程序中的瓶颈, 并改进生物安全实验室应对措施[42].
新型冠状病毒是一种人畜共患的病毒, 主要通过呼吸道飞沫和接触传播, 引起人发热、乏力、干咳, 甚至急性呼吸窘迫等症状的肺炎, 该病于2019-12在中国武汉地区爆发, 世界卫生组织将其命名为COVID-19[50-52]. 在COVID-19大流行期间, 采用严格的实验室规范和准则对于建立和维持安全的工作环境至关重要[9]. 实验室严格遵守世界卫生组织的《实验室生物安全手册》和国家相关部门制定的实验室生物安全规范等[53]. 通过评估病原体毒力、感染后果、流行潜力、感染所需剂量、感染途径或传播方式、宿主谱和病原体在实验室环境中的生存能力, 以采取适当的实验室安全管理措施[13].
报道显示, COVID-19患者的咽拭子、下呼吸道分泌物、肺泡灌洗液、血浆或粪便等标本携带病毒核酸, 具有传染性, 而疫情前期, 实验室工作人员无法评估这些样本是否来源于SARS-CoV-2潜伏期或无症状感染者, 故对工作人员自身安全具有潜在威胁[51]. 为了解决这些与病原体有关的重要问题, 研究人员将新型冠状病毒的基因组序列与SARS-CoV和MERS-CoV进行了比较, 以探索它们之间的关联性[54]. 在此期间, 任何处理、加工和测试潜在SARS-CoV-2感染样本的实验室操作都需要由具备资质的技术人员在符合要求的BSL-2或BSL-3实验室进行[53].
在中国, 样本采集人员为疑似或确诊COVID-19患者采集样本前, 必须经过生物安全培训且具备相应的操作技能, 个人防护标准按三级生物安全执行[51]. 在包装疑似或确诊为COVID-19患者样本时, 将已贴好患者信息条码的样本装入密封袋, 由专人运送[51]. 样本接收与处理采用与临床一体化的、无纸化办公信息系统[51]. 国家卫生健康委办公厅《新型冠状病毒实验室生物安全指南(第二版)》(<2020>70号)规定: 病毒培养以及动物感染实验应当在生物安全三级实验室操作; 未经培养的感染性材料的操作, 在生物安全二级实验室进行, 同时采用生物安全三级实验室的个人防护; 灭活材料的操作可以在生物安全一级实验室进行. 当生物安全柜的操作台面被SARS-CoV-2或其他潜在感染性材料污染时使用新鲜配制的有效氯含量为0.55%消毒液进行消毒. 当含病毒的器皿碎裂或倾覆造成实验室污染时应保持实验室空间密闭, 避免污染物扩散, 使用0.55%有效氯消毒液的毛巾覆盖污染区; 清理污染物严格遵循活病毒生物安全操作要求, 采用压力蒸汽灭菌处理, 并进行实验室换气等, 防止次生危害, 疫情期间的微生物平皿和样本均当日销毁[51]. 在疫情期间, 做好实验室工作人员的安全防护培训, 充分利用实验室现有的防护设备, 保障实验室人员自身的安全.
在意大利, COVID-19患者的血液样本在BLS-2实验室处理, 该实验室配备有二级生物安全柜(BSC), 任何可能被污染的生物材料都会被丢弃[53]. 所有实验室工作人员必须穿戴个人防护装备, 以防止液滴扩散引发的实验室获得性感染或无症状感染时的传播[53]. 在进行实验操作时, 实验室的门都必须是关闭的, 实验室内人员之间保持至少1 m的距离, 避免让两个实验人员同时使用相同的仪器[53]. 此外, 意大利研究机构为检测SARS-CoV-2感染患者的组织学和细胞学样本制定了一个内部方案, 目的是确保经过培训的实验室人员安全, 以确保生物安全实验室风险控制措施实施到位[9].
在经历了几次全球新发传染病以后, 各国公共卫生机构都应该积极完善实验室生物安全管理体系, 对此可将以下几个环节落实、监管到位: (1)借鉴先进的生物安全管理经验, 根据生物安全实验室的实际工作情况, 制定相应的实验室生物安全管理体系, 强化防护综合措施[12,26], 可以保护实验室工作人员不受实验对象的伤害, 保护样品不交叉传染及不污染周围环境; (2)实验室管理人员和技术人员必须定期接受生物安全知识培训, 加强应急演练, 一旦出现意外事件时能快速准确地做出反应[12,26]. 实验室的管理负责人在员工培训和监督管理方面采取合理措施[55]. 最直接接触危险生物因子的实验室人员所佩戴的防护用具, 可以利用新型材料研制, 降低防护成本, 有利于实验室生物安全防护用具的普及, 提高利用率; (3)安全措施的选择取决于感知到的风险, 风险分析基于病原体的危险等级和在特定实验室进行的详细操作[56]. 执行风险评估时, 首先最重要的是, 必须确定与实验室及其活动相关的风险, 以及其可能造成的潜在的人类健康威胁或不利于环境的影响[32]. 当风险已经被定义和评估时, 可以采取适当的措施将其最小化[32]. 一个适当执行的风险评估是确保每个相关人员和公众得到充分保护的关键步骤, 实验室的工作才能以安全可靠的方式进行[32,55]; (4)实验室网络在促进实验室科学交流、培训和信息资源共享方面体现着独有的价值. 实验室响应网络旨在确保实验室对公共卫生威胁作出高度优先的有效反应, 实验室响应网络参与新出现的传染病的反应程度取决于公共卫生威胁的规模和后果[57]. 如今, 随着生物信息技术的发展和大数据时代的到来, 5G通讯工程、远程操控以及人工智能等为生物安全实验室安全防护措施的发展提供了新颖的途径, 可以大大降低实验室人员暴露在未知病原体下的风险; (5)前线医院以及生物安全实验室在疫情应对中发挥着关键作用, 应将实验室、临床和公共卫生相互结合起来[58]. 《全球卫生安全议程》呼吁结束孤立思维, 鼓励采用综合卫生安全方法[19]. 需要在全球范围内, 特别是在低资源环境下, 建立创新的实验室能力, 并确保生物材料的安全处理[19].
面对新发传染病的检测和研究, 保护实验室工作人员的安全、避免危险生物因子泄漏导致的实验室获得性感染和环境污染、获得准确的研究结果是实验室生物安全管理的最重要目标. 随着人类活动对野生动物生存环境的破坏以及生物危险因子的不断变异, 未来也许依然会有新发传染病的爆发, 实验室生物安全仍然面临着诸多挑战, 各国政府和卫生行政部门应该高度重视生物安全问题, 不断更新和完善生物安全实验室标准化管理体系, 使生物安全管理更加规范化. 而对于病原体的泄露最重要的还是人为因素, 要增强实验人员的安全意识、规范实验人员的行为, 以逐步实现实验室生物安全防护水平的提升. 此外, 要充分利用新型科技手段, 不断创新实验室设施设备, 利用科学技术促进实验室生物安全防护的发展. 公共卫生机构应该积极开展管理指标体系的研究以及生物安全信息化管理的创新型设计, 应用新技术、新手段积极探索. 这些将在新发传染病爆发时, 为生物安全管理带来崭新的工作模式, 有效促进实验室生物安全防护的发展.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Jernigan JA, Low DE, Hefland RF. Combining clinical and epidemiologic features for early recognition of SARS. Emerg Infect Dis. 2004;10:327-333. [PubMed] [DOI] |
| 2. | De Serres G, Rouleau I, Hamelin ME, Quach C, Skowronski D, Flamand L, Boulianne N, Li Y, Carbonneau J, Bourgault A, Couillard M, Charest H, Boivin G. Contagious period for pandemic (H1N1) 2009. Emerg Infect Dis. 2010;16:783-788. [PubMed] [DOI] |
| 3. | Saeed AA, Abedi GR, Alzahrani AG, Salameh I, Abdirizak F, Alhakeem R, Algarni H, El Nil OA, Mohammed M, Assiri AM, Alabdely HM, Watson JT, Gerber SI. Surveillance and Testing for Middle East Respiratory Syndrome Coronavirus, Saudi Arabia, April 2015-February 2016. Emerg Infect Dis. 2017;23:682-685. [PubMed] [DOI] |
| 4. | Harvey R, Mattiuzzo G, Hassall M, Sieberg A, Müller MA, Drosten C, Rigsby P, Oxenford CJ; study participants. Comparison of Serologic Assays for Middle East Respiratory Syndrome Coronavirus. Emerg Infect Dis. 2019;25:1878-1883. [PubMed] [DOI] |
| 5. | Ka D, Fall G, Diallo VC, Faye O, Fortes LD, Faye O, Bah EI, Diallo KM, Balique F, Ndour CT, Seydi M, Sall AA. Ebola Virus Imported from Guinea to Senegal, 2014. Emerg Infect Dis. 2017;23:1026-1028. [PubMed] [DOI] |
| 6. | Ayukekbong JA, Ntemgwa ML, Ayukekbong SA, Ashu EE, Agbor TA. COVID-19 compared to other epidemic coronavirus diseases and the flu. World J Clin Infect Dis. 2020;10:1-13. [DOI] |
| 8. | Osman EEA, Toogood PL, Neamati N. COVID-19: Living through Another Pandemic. ACS Infect Dis. 2020;. [PubMed] [DOI] |
| 9. | Rossi ED, Fadda G, Mule A, Zannoni GF, Rindi G. Cytologic and histologic samples from patients infected by the novel coronavirus 2019 SARS-CoV-2: An italian institutional experience focusing on biosafety procedures. Cancer Cytopathol. 2020;. [PubMed] [DOI] |
| 10. | Lipsitch M. Why Do Exceptionally Dangerous Gain-of-Function Experiments in Influenza? Methods Mol Biol. 2018;1836:589-608. [PubMed] [DOI] |
| 11. | Pastorino B, de Lamballerie X, Charrel R. Biosafety and Biosecurity in European Containment Level 3 Laboratories: Focus on French Recent Progress and Essential Requirements. Front Public Health. 2017;5:121. [PubMed] [DOI] |
| 13. | Sewell DL. Laboratory-associated infections and biosafety. Clin Microbiol Rev. 1995;8:389-405. [PubMed] |
| 14. | Ta L, Gosa L, Nathanson DA. Biosafety and Biohazards: Understanding Biosafety Levels and Meeting Safety Requirements of a Biobank. Methods Mol Biol. 2019;1897:213-225. [PubMed] [DOI] |
| 15. | Byrum R, Keith L, Bartos C, St Claire M, Lackemeyer MG, Holbrook MR, Janosko K, Barr J, Pusl D, Bollinger L, Wada J, Coe L, Hensley LE, Jahrling PB, Kuhn JH, Lentz MR. Safety Precautions and Operating Procedures in an (A)BSL-4 Laboratory: 4. Medical Imaging Procedures. J Vis Exp. 2016;116:53601. [PubMed] [DOI] |
| 17. | Zhang EM, Wang JQ, Gao LD, Zhan ZF, Zhang H, Hu YH, Wei JC, Liang XD, Wan KL, Wei Q. Emergency Response for a Laboratory Biosafety Incident. Biomed Environ Sci. 2019;32:231-233. [PubMed] [DOI] |
| 19. | Dickmann P, Sheeley H, Lightfoot N. Biosafety and Biosecurity: A Relative Risk-Based Framework for Safer, More Secure, and Sustainable Laboratory Capacity Building. Front Public Health. 2015;3:241. [PubMed] [DOI] |
| 25. | Chamberlain AT, Burnett LC, King JP, Whitney ES, Kaufman SG, Berkelman RL. Biosafety Training and Incident-reporting Practices in the United States: A 2008 Survey of Biosafety Professionals. Appl Biosaf. 2009;14:135-143. [PubMed] [DOI] |
| 27. | Peng H, Bilal M, Iqbal HMN. Improved Biosafety and Biosecurity Measures and/or Strategies to Tackle Laboratory-Acquired Infections and Related Risks. Int J Environ Res Public Health. 2018;15. [PubMed] [DOI] |
| 28. | Wurtz N, Papa A, Hukic M, Di Caro A, Leparc-Goffart, Leroy E, Landini MP, Sekeyova Z, Dumler JS, Bădescu D, Busquets N, Calistri A, Parolin C, Palù G, Christova I, Maurin M, La Scola B, Raoult D. Survey of laboratory-acquired infections around the world in biosafety level 3 and 4 laboratories. Eur J Clin Microbiol Infect Dis. 2016;35:1247-58. [PubMed] [DOI] |
| 29. | Weidmann M, Avsic-Zupanc T, Bino S, Bouloy M, Burt F, Chinikar S, Christova I, Dedushaj I, El-Sanousi A, Elaldi N, Hewson R, Hufert FT, Humolli I, Jansen van Vuren P, Koçak Tufan Z, Korukluoglu G, Lyssen P, Mirazimi A, Neyts J, Niedrig M, Ozkul A, Papa A, Paweska J, Sall AA, Schmaljohn CS, Swanepoel R, Uyar Y, Weber F, Zeller H. Biosafety standards for working with Crimean-Congo hemorrhagic fever virus. J Gen Virol. 2016;97:2799-2808. [PubMed] [DOI] |
| 30. | Muriithi B, Bundi M, Galata A, Miringu G, Wandera E, Kathiiko C, Odoyo E, Kamemba M, Amukoye E, Huqa S, Shah M, Inoue S, Ichinose Y. Biosafety and biosecurity capacity building: insights from implementation of the NUITM-KEMRI biosafety training model. Trop Med Health. 2018;46:30. [PubMed] [DOI] |
| 31. | Pedrosa PB, Cardoso TA. Viral infections in workers in hospital and research laboratory settings: a comparative review of infection modes and respective biosafety aspects. Int J Infect Dis. 2011;15:e366-76. [PubMed] [DOI] |
| 32. | Patterson A, Fennington K, Bayha R, Wax D, Hirschberg R, Boyd N, Kurilla M. Biocontainment laboratory risk assessment: perspectives and considerations. Pathog Dis. 2014;71:102-108. [PubMed] [DOI] |
| 33. | Lee MK, Kim S, Kim MN, Kweon OJ, Lim YK, Ki CS4, Kim JS, Seong MW, Sung H4, Yong D, Lee H, Choi JR, Kim JH; MERS-CoV Laboratory Response Task Force of The Korean Society for Laboratory Medicine. Survey of Clinical Laboratory Practices for 2015 Middle East Respiratory Syndrome Coronavirus Outbreak in the Republic of Korea. Ann Lab Med. 2016;36:154-161. [PubMed] [DOI] |
| 34. | Yarbrough ML, Kwon JH, Wallace MA, Hink T, Shupe A, Fraser VJ, Dubberke ER, Burnham CA. Frequency of Instrument, Environment, and Laboratory Technologist Contamination during Routine Diagnostic Testing of Infectious Specimens. J Clin Microbiol. 2018;56. [PubMed] [DOI] |
| 35. | Nisii C, Castilletti C, Raoul H, Hewson R, Brown D, Gopal R, Eickmann M, Gunther S, Mirazimi A, Koivula T, Feldmann H, Di Caro A, Capobianchi MR, Ippolito G. Biosafety Level-4 laboratories in Europe: opportunities for public health, diagnostics, and research. PLoS Pathog. 2013;9:e1003105. [PubMed] [DOI] |
| 36. | Zhang Y, Gong Y, Wang C, Liu W, Wang Z, Xia Z, Bu Z, Lu H, Sun Y, Zhang X, Cao Y, Yang F, Su H, Hu Y, Deng Y, Zhou B, Zhao Z, Fu Y, Kargbo D, Dafae F, Kargbo B, Kanu A, Liu L, Qian J, Guo Z. Rapid deployment of a mobile biosafety level-3 laboratory in Sierra Leone during the 2014 Ebola virus epidemic. PLoS Negl Trop Dis. 2017;11:e0005622. [PubMed] [DOI] |
| 37. | Bell DM, World Health Organization Working Group on International and Community Transmission of SARS. Public health interventions and SARS spread, 2003. Emerg Infect Dis. 2004;10:1900-1906. [PubMed] [DOI] |
| 38. | Richardson SE, Tellier R, Mahony J. The laboratory diagnosis of severe acute respiratory syndrome: emerging laboratory tests for an emerging pathogen. Clin Biochem Rev. 2004;25:133-141. [PubMed] |
| 39. | Lim W, Ng KC, Tsang DN. Laboratory containment of SARS virus. Ann Acad Med Singapore. 2006;35:354-360. [PubMed] |
| 40. | Orellana C. Laboratory-acquired SARS raises worries on biosafety. Lancet Infect Dis. 2004;4:64. [PubMed] [DOI] |
| 41. | Kumar M, Mazur S, Ork BL, Postnikova E, Hensley LE, Jahrling PB, Johnson R, Holbrook MR. Inactivation and safety testing of Middle East Respiratory Syndrome Coronavirus. J Virol Methods. 2015;223:13-18. [PubMed] [DOI] |
| 42. | Reusken CB, Mögling R, Smit PW, Grunow R, Ippolito G, Di Caro A, Koopmans M. Status, quality and specific needs of Ebola virus diagnostic capacity and capability in laboratories of the two European preparedness laboratory networks EMERGE and EVD-LabNet. Euro Surveill. 2018;23. [PubMed] [DOI] |
| 43. | Rico A, Brody D, Coronado F, Rondy M, Fiebig L, Carcelen A, Deyde VM, Mesfin S, Retzer KD, Bilivogui P, Keita S, Dahl BA. Epidemiology of Epidemic Ebola Virus Disease in Conakry and Surrounding Prefectures, Guinea, 2014-2015. Emerg Infect Dis. 2016;22:178-83. [PubMed] [DOI] |
| 44. | Huang Q, Fu WL, You JP, Mao Q. Laboratory diagnosis of Ebola virus disease and corresponding biosafety considerations in the China Ebola Treatment Center. Crit Rev Clin Lab Sci. 2016;53:326-340. [PubMed] [DOI] |
| 45. | Günther S, Feldmann H, Geisbert TW, Hensley LE, Rollin PE, Nichol ST, Ströher U, Artsob H, Peters CJ, Ksiazek TG, Becker S, ter Meulen J, Olschläger S, Schmidt-Chanasit J, Sudeck H, Burchard GD, Schmiedel S. Management of accidental exposure to Ebola virus in the biosafety level 4 laboratory, Hamburg, Germany. J Infect Dis. 2011;204:S785-790. [PubMed] [DOI] |
| 46. | Alimonti J, Leung A, Jones S, Gren J, Qiu X, Fernando L, Balcewich B, Wong G, Ströher U, Grolla A, Strong J, Kobinger G. Evaluation of transmission risks associated with in vivo replication of several high containment pathogens in a biosafety level 4 laboratory. Sci Rep. 2014;4:5824. [PubMed] [DOI] |
| 47. | Beam EL, Schwedhelm MM, Boulter KC, Vasa AM, Larson L, Cieslak TJ, Lowe JJ, Herstein JJ, Kratochvil CJ, Hewlett AL. Ebola Virus Disease: Clinical Challenges, Recognition, and Management. Nurs Clin North Am. 2019;54:169-180. [PubMed] [DOI] |
| 48. | Kortepeter MG, Martin JW, Rusnak JM, Cieslak TJ, Warfield KL, Anderson EL, Ranadive MV. Managing potential laboratory exposure to ebola virus by using a patient biocontainment care unit. Emerg Infect Dis. 2008;14:881-887. [PubMed] [DOI] |
| 49. | VanSteelandt A, Aho J, Franklin K, Likofata J, Kamgang JB, Keita S, Koivogui L, Magassouba N, Martel LD, Dahourou AG. Operational evaluation of rapid diagnostic testing for Ebola Virus Disease in Guinean laboratories. PLoS One. 2017;12:e0188047. [PubMed] [DOI] |
| 50. | Tu H, Tu S, Gao S, Shao A, Sheng J. Current epidemiological and clinical features of COVID-19; a global perspective from China. J Infect. 2020;81:1-9. [PubMed] [DOI] |
| 51. | 龚 雅利, 石 云龙, 罗 小强, 张 成, 刘 美希, 陈 渝, 彭 毅志. 新型冠状病毒肺炎疫情下临床微生物实验室的工作流程. 中华烧伤杂志. 2020;36. [PubMed] [DOI] |
| 52. | Tan SS, Yan B, Saw S, Lee CK, Chong AT, Jureen R, Sethi S. Practical laboratory considerations amidst the COVID-19 outbreak: early experience from Singapore. J Clin Pathol. 2020;. [PubMed] [DOI] |
| 53. | Cossarizza A, Gibellini L, De Biasi S, Lo Tartaro D, Mattioli M, Paolini A, Fidanza L, Bellinazzi C, Borella R, Castaniere I, Meschiari M, Sita M, Manco G, Clini E, Gelmini R, Girardis M, Guaraldi G, Mussini C. Handling and Processing of Blood Specimens from Patients with COVID-19 for Safe Studies on Cell Phenotype and Cytokine Storm. Cytometry A. 2020;. [PubMed] [DOI] |
| 54. | Xu X, Chen P, Wang J, Feng J, Zhou H, Li X, Zhong W, Hao P. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission. Sci China Life Sci. 2020;63:457-460. [PubMed] [DOI] |
| 55. | Munson E, Bowles EJ, Dern R, Beck E, Podzorski RP, Bateman AC, Block TK, Kropp JL, Radke T, Siebers K, Simmons B, Smith MA, Spray-Larson F, Warshauer DM. Laboratory Focus on Improving the Culture of Biosafety: Statewide Risk Assessment of Clinical Laboratories That Process Specimens for Microbiologic Analysis. J Clin Microbiol. 2017;56. [PubMed] [DOI] |
| 56. | Barkham TM. Laboratory safety aspects of SARS at Biosafety Level 2. Ann Acad Med Singapore. 2004;33:252-256. [PubMed] |
| 57. | Villanueva J, Schweitzer B, Odle M, Aden T. Detecting Emerging Infectious Diseases: An Overview of the Laboratory Response Network for Biological Threats. Public Health Rep. 2019;134:16S-21S. [PubMed] [DOI] |
| 58. | Bartolini B, Gruber CE, Koopmans M, Avšič T, Bino S, Christova I, Grunow R, Hewson R, Korukluoglu G, Lemos CM, Mirazimi A, Papa A, Sanchez-Seco MP, Sauer AV, Zeller H, Nisii C, Capobianchi MR, Ippolito G, Reusken CB, Di Caro A. Laboratory management of Crimean-Congo haemorrhagic fever virus infections: perspectives from two European networks. Euro Surveill. 2019;24. [PubMed] [DOI] |