修回日期: 2020-09-11
接受日期: 2020-09-21
在线出版日期: 2020-10-28
胃底腺息肉(fundic gland polyps, FGPs)系胃底胃体黏膜形成的多发性广基息肉状隆起, 是胃息肉最常见的类型, 一般倾向于良性. 有研究表明, FGPs患者发生结直肠肿瘤(腺瘤和癌)的风险较一般人群高, 但也存在争议. 本文旨在结合国内外研究现状, 对FGPs及其与结直肠肿瘤之间的相关性予以综述.
核心提要: 胃底腺息肉(fundic gland polyps, FGPs)是最常见的胃息肉类型, 随着对其研究的逐渐深入, 有学者发现FGPs发生结直肠肿瘤的风险高. 本文综述了FGPs的临床特征, 探讨其与结直肠肿瘤的相关性及可能机制, 旨在为临床FGPs患者的诊治的提供参考.
引文著录: 杨雪梅, 徐红. 胃底腺息肉的临床特征及其与结直肠肿瘤相关性的研究进展. 世界华人消化杂志 2020; 28(20): 1036-1041
Revised: September 11, 2020
Accepted: September 21, 2020
Published online: October 28, 2020
Fundic gland polyps (FGPs) are multiple, sessile polypoid bumps formed by the gastric mucosa of the fundus and body, which are the most common type of gastric polyps and generally tend to be benign. Studies have shown that patients with FGPs have a higher risk of developing colorectal tumors (adenoma and cancer) than the general population, but their correlation is still controversial. This article is aimed to review the clinical features of FGPs and their correlation with colorectal tumors.
- Citation: Yang XM, Xu H. Clinical features of fundic gland polyps and their correlation with colorectal tumors. Shijie Huaren Xiaohua Zazhi 2020; 28(20): 1036-1041
- URL: https://www.wjgnet.com/1009-3079/full/v28/i20/1036.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i20.1036
结直肠癌是消化系统最常见的恶性肿瘤, 其发病率位居全球恶性肿瘤的第3位, 死亡率居全球第2位, 且我国近10年的发病率和死亡率总体呈现上升趋势[1]. 研究表明, 结直肠病变遵循公认的息肉-腺瘤-癌的发展规律, 结直肠腺瘤为结直肠癌的癌前病变, 内镜下早期治疗, 可有效的预防结直肠癌的发生. 我国目前结肠肿瘤的检出率较前明显提高, 但仍较低. 加之其具有潜伏周期长, 无明显特异性症状及表现等特点, 临床诊断也更加困难.
随着消化内镜的逐渐普及, 胃息肉的检出率较前大大提高, 最常见的息肉类型也由增生性息肉逐渐转变为胃底腺息肉(fundic gland polyps, FGPs)[2]. 由于其发病机制尚不明确, FGPs逐渐成为当今临床研究的重点及难点. 有多项临床研究称FGPs与结直肠肿瘤的发生风险密切相关[3-10], 并有研究提出对内镜下发现FGPs的患者应尽早行结肠镜检查排除结直肠肿瘤, 但也有学者认为两者并无相关性[11,12]. 目前对于两者相关的机制尚无明确解释, 本文就FGPs的临床特征及与结直肠肿瘤的相关性及可能机制予以综述, 旨在为FGPs和结直肠肿瘤的诊治提供更多的思路.
胃息肉是指突出于胃黏膜表面的良性隆起型病变, 较小可无症状, 常于行胃镜检查时偶然发现[13]. 其中FGPs是最常见的类型, 我国学者通过对2004-2013年行胃镜检查的157902例患者回顾性分析, 发现FGPs占所有胃息肉类型的77%[2]. 与传统分类的增生性息肉和腺瘤性息肉不同, FGPs为胃底腺的腺上皮增生所致, 本质是被覆单层腺窝上皮, 内含有壁细胞、主细胞与黏液颈细胞的囊肿, 故又名Elster氏囊肿[5].
FGPs可分为散发性和家族性腺瘤性息肉综合征(familial adenomatous polyposis, FAP)相关的FGPs[13]. 散发性FGPs多见于40-60岁女性, FAP为常染色体显性遗传病, 常见于30-40岁人群, 男女发生率无显著差异[14]. 散发性FGPs恶性潜能很低,异型增生的发生率小于1%, 而FAP 相关的FGPs异型增生的比例可达40% 以上[15]. 目前内镜下尚无法确切的区分FAP相关的和散发性FGPs, 对年龄<40岁、多发FGP(通常>20个)、伴异型增生及十二指肠腺瘤者, 建议行结肠镜检查排除FAP[13].
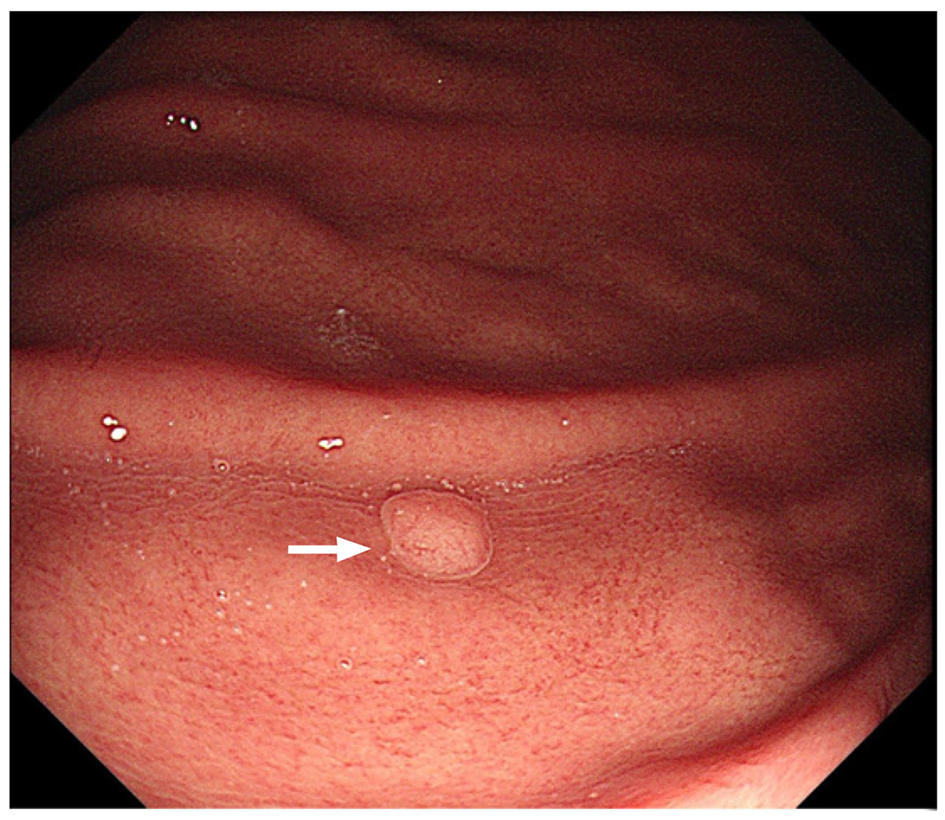
据文献报道FGPs通常发生在正常的、非萎缩的胃黏膜[16]. 多见于胃底或胃体、以山田Ⅰ型和Ⅱ型为主、可为单发或多发、体积较小, 一般直径<5 mm, 内镜下常表现为光滑、充血、半透明的广基息肉, 常合并有反流性食管炎、消化性溃疡、胆汁反流及胃黏膜异位等[5,6,15,17,18], 见图1.
关于FGPs的发病机制尚不清楚, 研究发现FAP相关的FGPs与APC基因突变有关, 散发性FGPs与βcatenin激活有关[15]. 目前临床研究表明散发性FGPs的发生与质子泵抑制剂(proton pump inhibitor, PPI)的长期应用(≥12 mo)及幽门螺旋杆菌(Helicobacter pylori, H.pylori)感染率低相关[19,20]. 在此基础上有研究进一步发现, 随着H.pylori感染, FGPs开始消退[21]. PPI相关的FGPs停用PPI后, FGPs可明显缩小, 甚至消失[22].
2010年世卫组织在消化系统肿瘤分类中, 将FGPs归于肿瘤性息肉, 但既往研究认为不伴有FAP的FGPs几乎不会发生癌变, 近年也出现关于FGPs癌变的病例报道. Jeong等[23]报道1例多发FGP的患者, 其中1枚表面发红伴糜烂的FGP诊断为印戒细胞癌. Togo等[24]报道了2例发生癌变(高分化腺癌)的FGP病例, 这2例息肉在普通胃镜和放大色素内镜(magnifying endoscopy with narrow band imaging, ME-NBI)下均呈发红外观. Nawata等[25]报道了1例15 mm表面发红的胃腺癌, 被认为起源于FGP. 提示表面发红及伴糜烂需警惕FGP癌变的可能. 目前虽无其发生癌变的危险因素的相关研究报道, 但我们仍要充分地认识该疾病, 及时发现癌前病变, 以减少胃腺癌的发生.
我国尚无FGPs相关的诊治指南, 2015 年美国消化内镜学会指南建议[26]: (1)所有单发息肉均应进行活检或切除; (2)切除≥1 cm FGPs; (3)对于多发息肉, 建议活检或切除最大者, 并从其他息肉中选取有代表性的取活检; (4)对FAP患者进行活检, 并在可行的情况下切除较大息肉, 确认组织学类型和评估异型增生. 2019年英国胃肠病学会指南建议[13]: (1)具有典型FGPs外观无需内镜下活检; (2)散发性FGPs无需切除; (3)对于>1 cm、胃窦部、伴溃疡或外观异常者应切除, 而未经内镜下切除需再次行靶向活检; (4)长期接受PPI治疗的患者需重新评估PPI使用的适应症、剂量及寻求替代治疗. 根据英美国家相关指南[13,26]建议, 对FGPs患者无需随访. 考虑到西方国家的指南推荐并不能完全适用于我国国情. 何金龙等[17]指出: 强烈建议对>60岁男性患者行息肉活检. 由于内镜下活检产生额外费用会加重患者的经济负担, 覃姝媚等[27]指出对于具有典型FGPs外观及有长期PPI使用史的小息肉, 可不必活检. 因此临床中是否有必要对所有FGPs进行活检或切除治疗, 应结合内镜下FGPs具体的表现及临床特征和患者的意愿综合判断.
虽然大量研究结果表明FGPs倾向于良性, 极少发生恶变, 但随着人们对FGPs研究的逐渐深入, 有学者发现FGPs患者伴发结直肠肿瘤的风险高于一般人群, 部分学者还提出可通过对FGPs患者行结肠镜检查来提高结直肠肿瘤的检出率. 目前关于两者之间相关性的争论颇多, 且临床上对FGPs患者是否需行结肠镜检查, 也存在争议.
一些学者认为FGPs合并结直肠肿瘤的风险高, 应接受结肠镜检查. 2002年, Jung等[3]在一项前瞻性研究纳入了64例FGPs患者, 发现FGPs有29例(45.3%)合并结直肠肿瘤, 而64例无FGPs的患者中有6例(9.3%)合并结直肠肿瘤. 2008年, Teichmann等[4]对500例患者进行回顾性分析, 结果发现250例FGPs患者中有39例(15.5%)发现结直肠肿瘤, 对照组250例中有23例(9.2%)发现结直肠肿瘤. 由此作者认为FGPs的患者发生结直肠肿瘤的风险较高, 应接受诊断性结肠镜检查.
2009年, Genta等[5]在此基础上进行了一项大型队列研究, 纳入6081例FGPs患者, 发现女性FGPs患者发生结直肠腺瘤的风险高于无FGPs女性(OR = 1.43; 95%CI: 1.26-1.63; P<0.001), 而男性FGPs患者未见类似结果. 我国的黄尔炯等[6]和郝月茗等[8]及丁敏等[10]的三项病例对照研究结果均表明FGPs患者无论男女结直肠肿瘤的检出率均高于对照组, 但女性FGPs患者结直肠肿瘤检出率的差异具有统计学意义(P<0.05). 因此, 作者认为FGPs患者尤其是女性, 应接受结肠镜检查. 但目前对FGPs患者发生结直肠肿瘤在性别上表现出的差异尚没有合理的机制解释.
流行病学调查显示, 与世界其他国家相同, 中国结直肠癌发病率和死亡率在50岁以后增长迅速, 且其发病率随年龄的增加而上升[28]. 我国指南推荐对50-75岁的低风险人群行结肠癌的筛查, 那么对于FGPs患者是否需降低结肠镜开始筛查的年龄也是临床研究的重点. 2016年, 韩国的一项回顾性研究, Lee等[7]纳入了128例FGPs患者, 研究发现年龄>50岁的FGPs患者发生结直肠癌的风险是对照组的4.1倍(OR = 4.10; 95%CI: 1.16-14.45; P = 0.04). 随后我国的两项回顾性研究证实了Lee的结论[8,10]. Lee等[7]的研究还发现男性(OR = 4.83; 95%CI: 1.23-18.94; P = 0.02)和年龄>50岁(OR = 9.90; 95%CI: 1.21-81.08; P = 0.03)是FGPs组发生进展期结直肠肿瘤的危险因素. 最近我国的一项多中心前瞻性横断面研究纳入1546名患者, 发现年龄>40岁胃息肉组患者结直肠肿瘤的检出率高于无胃息肉的患者[9]. 作者建议对胃息肉患者最早在40岁开始进行结肠镜检查, 特别是在FGPs患者中. 但在黄尔炯等[6]的研究中我们发现, 年龄<50岁及≥50岁FGPs患者其结直肠肿瘤的检出率虽高于对照组, 但年龄≥50岁组的差异无统计学意义, 结合上述研究推测可能与该研究纳入样本量(65例FGPs)有限有关(表1).
虽有文献报道FGPs与结直肠肿瘤的发生呈正相关, 但仍有少数学者认为FGPs与结直肠肿瘤的发生相关性不大. 韩国学者[11]的一项回顾性研究纳入158例FGPs患者, 发现FGPs与结直肠肿瘤的相关性无统计学意义, 但该研究纳入的样本均来自于健康促进中心, 存在选择偏倚, 导致其结果可能存在一定的局限性. Cimmino等[12]在研究中也发现FGPs与结直肠肿瘤的发生无关. 目前发表的关于FGPs与结直肠肿瘤不相关的研究均为回顾性病例对照研究, 虽有严格的纳入排除标准, 但不可避免地存在一些混杂因素的影响. 同时我们认为导致两者无相关性的原因还可能与纳入的样本量、地域差异以及结肠镜的普及率等有关(表2).
有关FGPs合并结直肠肿瘤的发病机制尚不清楚, 有假说认为两者之间的关联机制可能与基因和(或)环境因素有关. 目前文献报道的可能性机制如下:
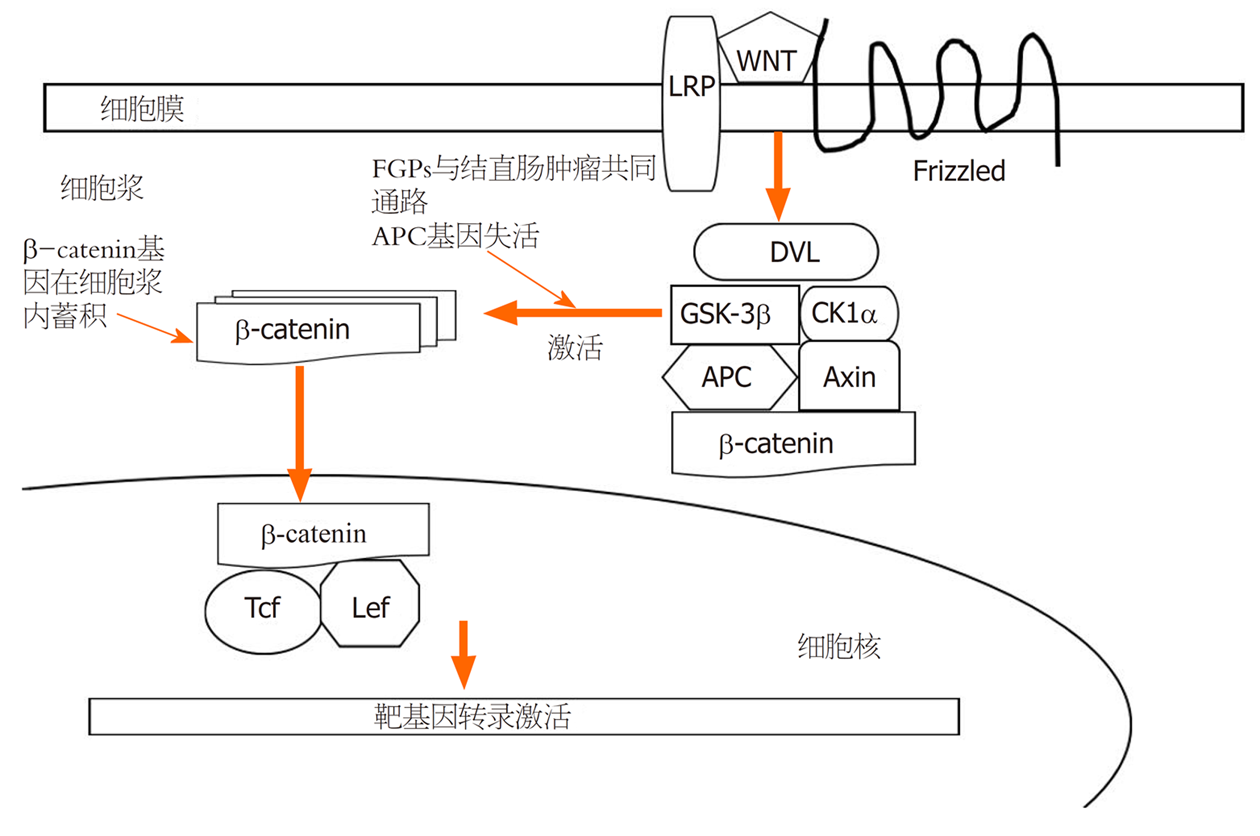
(1)Wnt/β-catenin是 Wnt信号通路中的经典信号途径, 参与细胞的增殖、分化、凋亡. β-catenin是该信号通路的关键蛋白, 存在于正常结直肠细胞膜, 在胞浆和胞核内少见. 且β-catenin基因突变在结直肠肿瘤发生中的作用已证实[29]. Mcduffie等[30]研究发现FGPs与结肠息肉均有β-catenin、ki67、p53表达增加. 由于共同通路的存在, β-catenin 在胞质内积聚, 并进入细胞核内与 Tcf/Lef结合引起靶基因的转录, 引起细胞异常增生、组织结构异常, 导致患结直肠肿瘤风险增加[6,31]; (2)APC基因编码的氨基酸序列与β-catenin一样, 同属于Wnt信号通路的关键蛋白. APC基因突变所编码的蛋白在Wnt信号通路中起负调控作用, 也参与到细胞迁移、粘附、转录激活和凋亡中. APC基因失活性突变导致β-catenin 在胞质内积聚, 并进入细胞核内参与结直肠肿瘤的发生[31]. APC基因缺陷导致FAP, 通常易发生癌变, 文献报道有30%-88%的FAP患者伴有FGPs[14]. 尽管上述临床研究已排除FAP, 但部分FAP患者可能已有FGPs却未表现出结直肠多发息肉, 从而导致FAP漏诊[6]. 对这部分患者可行APC基因检测明确; (3)环氧化酶(cyclooxygenase, COX)又称前列腺素内氧化酶还原酶, 是催化花生四烯酸转化为前列腺素的关键酶, 包括COX-1和COX-2. COX-2是一种膜结合蛋白, 在人体正常组织中低表达. 而在炎症、肿瘤等病理状态下受炎性刺激物、损伤和致癌物质等促炎介质诱导后, 呈表达增高趋势, 进而参与多种病理生理过程. 既往研究证明COX-2在结直肠肿瘤中异常高表达[32], 且结直肠癌中β-catenin异常表达与COX-2表达之间呈正相关. 曹海龙等[18]研究发现FGPs患者中COX-2染色阳性率很高(9/12). 因此COX-2是否在FGPs合并结直肠肿瘤的发生中起作用, 目前国内外对此均无报道, 这无疑对FGPs的研究与认识提供了新思路, 有待于我们进一步的临床研究(图2).
综上所诉, FGPs与结直肠肿瘤的相关性的研究受到学者们的广泛关注, 虽然研究结果存在差异, 但多数研究支持FGPs与结直肠肿瘤发生具有相关性的结论. 然而目前关于两者并发的机制并不明确, 仍需要进一步的临床及分子生物学研究探讨. 我国指南建议对低风险人群50岁开始结肠癌筛查, 但根据我国的国情及结肠镜的普及率, 效果并不理想. 因此笔者建议对胃镜检查发现FGPs的患者(特别是≥50岁及女性)需行结肠镜检查, 提高结直肠肿瘤的检出率. 但我们仍有必要进行相关的临床研究, 进一步分析FGPs发生结直肠肿瘤的危险因素, 旨在精细化管理FGPs患者. 我国对于FGPs的诊治缺乏相应指南, 可参考西方国家的指南, 但又应符合我国国情, 做到个体化.
学科分类: 胃肠病学和肝病学
手稿来源地: 吉林省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 2. | Fan NN, Yang J, Sun G, Lu ZS, Ling Hu EQ, Wang XD, Yang YS. Changes in the spectrum of gastric polyps in the Chinese population. World J Gastroenterol. 2015;21:9758-9764. [PubMed] [DOI] |
| 3. | Jung A, Vieth M, Maier O, Stolte M. Fundic gland polyps (Elster's cysts) of the gastric mucosa. A marker for colorectal epithelial neoplasia? Pathol Res Pract. 2002;198:731-734. [PubMed] [DOI] |
| 4. | Teichmann J, Weickert U, Riemann JF. Gastric fundic gland polyps and colonic polyps - is there a link, really? Eur J Med Res. 2008;13:192-195. [PubMed] |
| 5. | Genta RM, Schuler CM, Robiou CI, Lash RH. No association between gastric fundic gland polyps and gastrointestinal neoplasia in a study of over 100,000 patients. Clin Gastroenterol Hepatol. 2009;7:849-854. [PubMed] [DOI] |
| 7. | Lee HS, Choi Y, Jung JY, Sung YJ, Ahn DW, Jeong JB, Kim BG, Lee KL, Koh SJ, Kim JW. Do we need colonoscopy verification in patients with fundic gland polyp? Intest Res. 2016;14:172-177. [PubMed] [DOI] |
| 8. | Hao YM, Li J, Liu WQ, Meng XW. Correlation between fundic gland polyps and colorectal neoplasms. Shijie Huaren Xiaohua Zazhi. 2017;25. [DOI] |
| 9. | Zhang S, Zheng D, Yang Z, Hong L, Ng SC, Li M, Huang S, Wang S, Li L, Li M, Zhang H, Lin J, Zhong B, Cui Y, Chen M. Patients with Gastric Polyps need Colonoscopy Screening at Younger Age: A Large Prospective Cross-Sectional Study in China. J Cancer. 2019;10:4623-4632. [PubMed] [DOI] |
| 11. | Hwang SM, Kim BW, Chae HS, Lee BI, Choi H, Ji JS, Choi KY, Chung IS, Maeng LS. Gastric fundic gland polyps and their relationship to colorectal neoplasia in Koreans: a 16-year retrospective study. Korean J Gastroenterol. 2011;58:20-24. [PubMed] [DOI] |
| 12. | Cimmino DG, Mella JM, Luna P, González R, Pereyra L, Fischer C, Mohaidle A, Vizcaino B, Medrano MA, Hadad A, Pedreira S, Boerr L. Risk of colorectal polyps in patients with sporadic gastric polyps: A case-control study. World J Gastrointest Endosc. 2013;5:240-245. [PubMed] [DOI] |
| 13. | Banks M, Graham D, Jansen M, Gotoda T, Coda S, di Pietro M, Uedo N, Bhandari P, Pritchard DM, Kuipers EJ, Rodriguez-Justo M, Novelli MR, Ragunath K, Shepherd N, Dinis-Ribeiro M. British Society of Gastroenterology guidelines on the diagnosis and management of patients at risk of gastric adenocarcinoma. Gut. 2019;68:1545-1575. [PubMed] [DOI] |
| 14. | Dinarvand P, Davaro EP, Doan JV, Ising ME, Evans NR, Phillips NJ, Lai J, Guzman MA. Familial Adenomatous Polyposis Syndrome: An Update and Review of Extraintestinal Manifestations. Arch Pathol Lab Med. 2019;143:1382-1398. [PubMed] [DOI] |
| 15. | Group of Digistive Diseases of Chinese Society of Pathology. Consensus on pathological diagnosis of gastrointestinal adenoma and benign epithelial polyps. Zhonghua Bing Li Xue Za Zhi. 2020;49:3-11. [PubMed] [DOI] |
| 16. | Jeong CY, Kim N, Lee HS, Yoon H, Shin CM, Park YS, Kim JW, Lee DH. Risk Factors of Multiple Gastric Polyps according to the Histologic Classification: Prospective Observational Cohort Study. Korean J Gastroenterol. 2019;74:17-29. [PubMed] [DOI] |
| 19. | Huang CZ, Lai RX, Mai L, Zhou HL, Chen HJ, Guo HX. Relative risk factors associated with the development of fundic gland polyps. Eur J Gastroenterol Hepatol. 2014;26:1217-1221. [PubMed] [DOI] |
| 20. | Zhang R. Clinical features of fundic gland polyps and relationship between fundic gland polyps andHelicobacter pyloriinfection. Shijie Huaren Xiaohua Zazhi. 2014;22:1127-1130. [DOI] |
| 21. | Samarasam I, Roberts-Thomson J, Brockwell D. Gastric fundic gland polyps: a clinico-pathological study from North West Tasmania. ANZ J Surg. 2009;79:467-470. [PubMed] [DOI] |
| 22. | Hamada K, Takeuchi Y, Akasaka T, Iishi H. Fundic Gland Polyposis Associated with Proton-Pump Inhibitor Use. Eur J Case Rep Intern Med. 2017;4:000607. [PubMed] [DOI] |
| 23. | Jeong YS, Kim SE, Kwon MJ, Seo JY, Lim H, Park JW, Kang HS, Moon SH, Kim JH, Park CK. Signet-ring cell carcinoma arising from a fundic gland polyp in the stomach. World J Gastroenterol. 2014;20:18044-18047. [PubMed] [DOI] |
| 24. | Togo K, Ueo T, Yonemasu H, Honda H, Ishida T, Tanabe H, Yao K, Iwashita A, Murakami K. Two cases of adenocarcinoma occurring in sporadic fundic gland polyps observed by magnifying endoscopy with narrow band imaging. World J Gastroenterol. 2016;22:9028-9034. [PubMed] [DOI] |
| 25. | Nawata Y, Ichihara S, Hirasawa D, Tanaka I, Unno S, Igarashi K, Matsuda T. A case of gastric adenocarcinoma considered to originate from a sporadic fundic gland polyp in a Helicobacter pylori-uninfected stomach. Clin J Gastroenterol. 2020;. [PubMed] [DOI] |
| 26. | ASGE Standards of Practice Committee. Evans JA, Chandrasekhara V, Chathadi KV, Decker GA, Early DS, Fisher DA, Foley K, Hwang JH, Jue TL, Lightdale JR, Pasha SF, Sharaf R, Shergill AK, Cash BD, DeWitt JM. The role of endoscopy in the management of premalignant and malignant conditions of the stomach. Gastrointest Endosc. 2015;82:1-8. [PubMed] [DOI] |
| 27. | Qin S, Xu Y. Progress in clinical diagnosis and treatment for gastric polyps. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2020;45:74-78. [PubMed] [DOI] |
| 28. | 吴 春晓, 顾 凯, 龚 杨明, 郑 荣寿, 王 少明, 陈 茹, 张 思维, 施 燕, 魏 文强, 付 晨, 赫 捷. 2015年中国结直肠癌发病和死亡情况分析. 中国癌症杂志. 2020;30:241-245. [DOI] |
| 29. | Kim S, Jeong S. Mutation Hotspots in the β-Catenin Gene: Lessons from the Human Cancer Genome Databases. Mol Cells. 2019;42:8-16. [PubMed] [DOI] |
| 30. | McDuffie LA, Sabesan A, Allgäeuer M, Xin L, Koh C, Heller T, Davis JL, Raffeld M, Miettienen M, Quezado M, Rudloff U. β-Catenin activation in fundic gland polyps, gastric cancer and colonic polyps in families afflicted by 'gastric adenocarcinoma and proximal polyposis of the stomach' (GAPPS). J Clin Pathol. 2016;69:826-833. [PubMed] [DOI] |
| 31. | Valenta T, Hausmann G, Basler K. The many faces and functions of β-catenin. EMBO J. 2012;31:2714-2736. [PubMed] [DOI] |
| 32. | Negi RR, Rana SV, Gupta V, Gupta R, Chadha VD, Prasad KK, Dhawan DK. Over-Expression of Cyclooxygenase-2 in Colorectal Cancer Patients. Asian Pac J Cancer Prev. 2019;20:1675-1681. [PubMed] [DOI] |
| 33. | Lei WY, Wang JH, Yi CH, Liu TT, Hung JS, Wong MW, Bair MJ, Vaezi MF, Orr WC, Chen CL. Association between use of proton pump inhibitors and colorectal cancer: A nationwide population-based study. Clin Res Hepatol Gastroenterol. 2020;. [PubMed] [DOI] |
| 34. | Sonnenberg A, Turner KO, Genta RM. Associations between gastric histopathology and the occurrence of colonic polyps. Colorectal Dis. 2020;22:814-817. [PubMed] [DOI] |