修回日期: 2020-08-18
接受日期: 2020-09-21
在线出版日期: 2020-10-28
内质网应激(endoplasmic reticulum stress, ERS) -自噬是肝癌细胞一种自我保护性机制. 内质网(endoplasmic reticulum, ER)应激诱导剂二硫苏糖醇(dithiothreitol, DTT)能诱导肝癌细胞ERS-自噬. 课题组前期研究证实金刚藤具有抑制肝癌细胞的作用, 那么肝癌细胞ERS-自噬是否影响金刚藤抑制肝癌细胞的作用尚不清楚.
探讨ERS-自噬肝癌SMMC-7721细胞模型的复制及金刚藤的干预.
ERS-自噬肝癌SMMC-7721细胞模型的复制: 采用不同剂量的DTT(50、200、500 μmol/L)处理SMMC-7721细胞24 h, 设DTT 0 μmol/L组为control组, 透射电镜观察各模型组细胞自噬小体, 运用western blot法测定各组细胞微管相关蛋白1轻链3-Ⅱ(microtubule-associated protein 1 light chain 3-Ⅱ, LC3-Ⅱ)蛋白的表达. 金刚藤对ERS-自噬肝癌SMMC-7721细胞存活率的影响: 将SMM C-7721细胞分为空白组(control组)、金刚藤组(JGT组)、DTT+JGT组, control、JGT组分别给予空白血清、金刚藤含药血清处理, DTT+JGT组予DTT构建的ERS模型后给予金刚藤含药血清处理, 采用CCK-8法检测细胞的存活率.
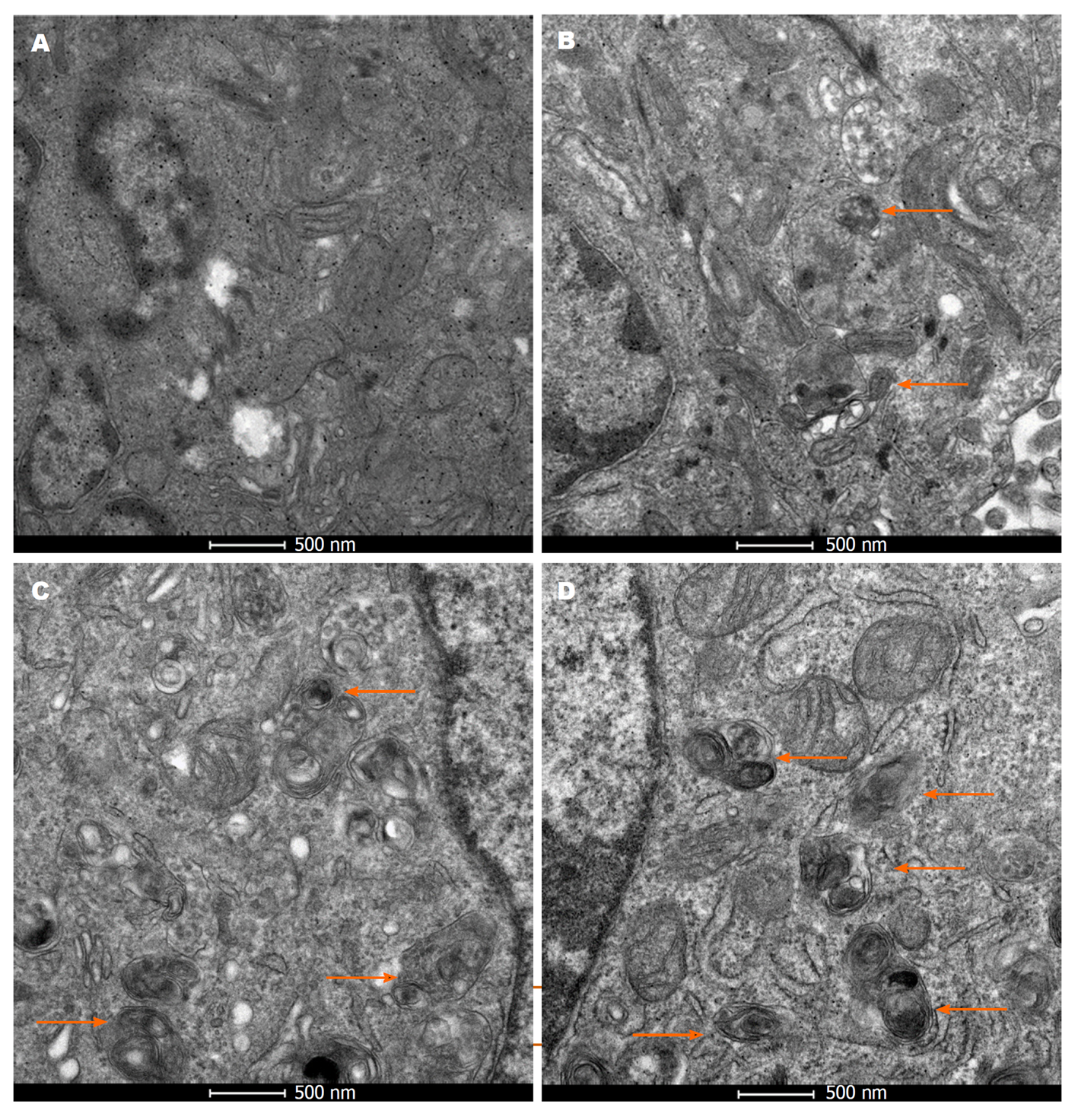
DTT(50、200、500 μmol/L)组细胞的细胞质内均可见自噬小体, 随着DTT浓度的增加, 自噬小体数量逐渐增加, DTT 500 μmol/L组可见大量自噬小体; 各模型组细胞LC3-Ⅱ蛋白的表达: 与control组比较, DTT(50、200、500 μmol/L)组细胞中自噬相关蛋白LC3-Ⅱ的表达均显著升高(P均<0.05); 与DTT 200 μmol/L组比较, 500 μmol/L组LC3-Ⅱ蛋白的表达显著升高(P<0.05). 金刚藤对ERS-自噬肝癌细胞模型存活率的影响: JGT、DTT+JGT组细胞存活率均显著低于control组(P均<0.05); JGT组细胞存活率显著低于DTT+JGT组(P<0.05).
DTT可诱导肝癌SMMC-7721细胞ERS-自噬; 金刚藤可抑制SMMC-7721细胞的存活率, DTT诱导的ERS-自噬可抵抗金刚藤抑制SMMC-7721细胞的存活率.
核心提要: 本研究证实了二硫苏糖醇(dithiothreitol, DTT)能够诱导肝癌细胞内质网应激(endoplasmic reticulum stress, ERS)-自噬; DTT诱导的ERS-自噬可抵抗金刚藤抑制SMMC-7721细胞的存活率.
引文著录: 凌江红, 文一惠, 周芬敏, 陈珺明, 郭锦荣. 内质网应激-自噬肝癌SMMC-7721细胞模型的复制及金刚藤的干预. 世界华人消化杂志 2020; 28(20): 1009-1015
Revised: August 18, 2020
Accepted: September 21, 2020
Published online: October 28, 2020
Endoplasmic reticulum stress induced autophagy is a self-protective mechanism of liver cancer cells. The endoplasmic reticulum stress inducer dithiothreitol (DTT) can induce autophagy in liver cancer cells. Previous studies have confirmed that Smilax China L has the effect of inhibiting liver cancer cells, but it is not clear whether the endoplasmic reticulum stress induced autophagy of liver cancer cells affects the role of Smilax China L in inhibiting liver cancer cells.
To reproduce a SMMC-7721 liver cancer cell model of endoplasmic reticulum stress induced autophagy and to explore the impact of endoplasmic reticulum stress induced autophagy on the interventional effect of Smilax China L.
Different doses of dithiothreitol (DTT; 0, 50, 200, and 500 μmol/L) were used to treat SMMC-7721 cells for 24 h. Cells were then observed for autophagosomes by transmission electron microscopy. The expression of microtubule-associated protein 1 light chain 3-Ⅱ (LC3-Ⅱ) protein in each group was determined by Western blot. The effect of smilax China L on the survival rate of model SMMC-7721 cells was observed by divividing SMM C-7721 cells into the following groups: Control, smilax China L (JGT) alone, and DTT + JGT groups. The control and JGT groups were given blank serum and smilax China L containing serum, respectively. The DTT + JGT group was treated with DTT and smilax China L medicated serum. The CCK-8 method was used to detect the cell survival rate.
Autophagosomes can be seen in the cytoplasm of DTT (50, 200, and 500 μmol/L) treated cells. As the concentration of DTT increased, the number of autophagosomes gradually increased, with a large number of auto-phagosomes visible in the DTT 500 μmol/L group. Compared with the control group, the expression of autophagy-related protein LC3-Ⅱ in DTT (50, 200, and 500 μmol/L) treated cells was significantly increased (P < 0.05 for all). Compared with the DTT 200 μmol/L group, the expression of LC3-Ⅱ protein in the DTT 500 μmol/L group was significantly increased (P < 0.05). The cell survival rates in the JGT and DTT + JGT groups were significantly lower than that of the control group (P < 0.05). The cell survival rate of the JGT group was significantly lower than that of the DTT + JGT group (P < 0.05).
DTT can induce autophagy in SMMC-7721 hepatocellular carcinoma cells. Smilax China L can inhibit the survival rate of SMMC-7721 cells, but DTT-induced autophagy can resist the inhibitory effect of Smilax China L on SMMC-7721 cell survival rate.
- Citation: Ling JH, Wen YH, Zhou FM, Chen JM, Guo JR. Reproduction of an SMMC-7721 hepatocellular carcinoma cell model of endoplasmic reticulum stress induced autophagy: Impact on interventional effect of Smilax China L. Shijie Huaren Xiaohua Zazhi 2020; 28(20): 1009-1015
- URL: https://www.wjgnet.com/1009-3079/full/v28/i20/1009.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i20.1009
内质网(endoplasmic reticulum, ER)是一个真核生物维持细胞生存的重要的呈网状结构的细胞器. 在某些生理及病理情况下, ER功能紊乱, 细胞为维持自身稳态, 发生内质网应激(endoplasmic reticulum stress, ERS)[1], 进而激活自噬[2]. ERS-自噬是一种重要的细胞自我保护机制, 维持细胞内环境的稳态, 能够促进细胞的生存, 增加肿瘤细胞对抗肿瘤药物的耐药性[3-5]. 研究表明[6], 肝癌细胞内存在ERS的活化. 金刚藤具有利湿去浊、祛风除痹、解毒散瘀的功效. 金刚藤对多种实体肿瘤具有一定疗效[7,8], 课题组前期研究发现金刚藤具有良好的抗肝癌作用[9]. 本研究运用ERS诱导剂二硫苏糖醇(dithiothreitol, DTT)诱导人肝癌SMMC-772细胞ERS-自噬, 并观察金刚藤对DTT诱导的ERS-自噬SMMC-7721细胞增殖的影响, 旨在深入探讨金刚藤抗肝癌的作用.
SPF级SD大鼠购自上海杰思捷实验动物有限公司, 许可证编号为SCXK(沪)2018-0004, 雌雄不限, 鼠龄8-10 wk, 共8只. 大鼠适应性喂养7 d后用于实验, 喂养期间大鼠自由进食、水. 人肝癌SMMC-7721细胞株由上海中科院细胞库提供. 将SMMC-7721细胞按1×106个/板接种于含10%胎牛血清、1%青霉素-链霉素双抗的DMEM培养基, 于37 ℃、5%CO2、恒温恒湿条件的细胞培养箱中培养, 1-2 d换液传代1次. 待细胞进入对数生长期后进行实验. 中药金刚藤购自广西民族医药研究所, 产地广西, 批号为161201, 由桂林鼎康中药饮片有限公司生产. DMEM培养基、青霉素-链霉素双抗混合液、胎牛血清购自美国GIBCO公司. DTT购自中国Solarbio公司. Apoptosis Detection Kit购自上海翊圣生物科技有限公司. 细胞微管相关蛋白1轻链3-Ⅱ(microtubule-associated protein 1 light chain 3-Ⅱ, LC3-Ⅱ)抗体购自英国Abcam公司.
1.2.1 细胞培养: 复苏存活下来的SMMC-7721细胞培养于10 cm细胞培养皿中, 细胞接种106个/板. 培养基为DMEM+10%FBS+1%双抗, 37 ℃、5%CO2恒温恒湿的细胞培养箱中培养. 1-2 d换液传代备用.
1.2.2 ERS-自噬模型的建立: 实验分组及处理方法: 取生长状态良好的SMMC-7721细胞按DTT不同浓度分为50、200、500 μmol/L组, 同时设DTT 0 μmol/L为control组, 将细胞按80%的汇合度接种到6孔板, 每孔2 mL, 细胞数量为2 × 105个/孔, 培养基为DMEM+10%FBS+1%PS, 每组3个复孔. 置于37 ℃、5%的CO2培养箱中培养过夜, 次日分别更换不同浓度(0、50、200、500 μmol/L)培养基稀释的DTT, 置于37 ℃、5%的CO2培养箱中继续培养24 h.
Western blot法检测各组细胞LC3-Ⅱ蛋白表达: 将上述细胞去除培养基, PBS清洗两遍, 去除PBS后, 加入100 μl含PMSF的裂解液, 4 ℃裂解30 min. 裂解完后, 12000 r/min、4 ℃离心10 min, 取上清, 用BCA法测定蛋白浓度. 以20 μg总蛋白上样, 行聚丙烯酰胺凝胶电泳, 电泳结束后转移蛋白至PVDF膜, 用含5%脱脂奶粉封闭1 h. 置于1×TBST缓冲液中, 于摇床上缓慢洗涤3次, 5 min/次. 然后移入一抗β-actin (1:5000)、LC3-Ⅱ(1:1000), 置于4 ℃孵育过夜. 次日洗膜后加入二抗(羊抗兔1:50000)中, 室温摇床孵育2 h. PBST洗3次, 每次5 min, 显色. 用Image软件对每个条带灰度值进行分析.
1.2.3 透射电镜观察自噬小体: 将细胞离心弃上清, 加入电镜固定液固定, 50%、70%、80%、90%乙醇梯度脱水, 丙酮置换, 浸渍、包埋、切片, 用醋酸双氧铀染色10 min后清洗, 用透射电镜检测.
1.2.4 金刚藤对ERS-自噬肝癌细胞模型增殖能力的影响: 金刚藤水煎液及含药血清的制备: (1)金刚藤水煎液的制备: 200 g金刚藤饮片, 加水至高出药物表面2 cm处, 浸泡2 h武火煮沸后改用文火煎煮30 min, 冷却, 过滤取汁(滤液1), 滤渣如上法再煎2次, 得到滤液2, 滤液3, 混合3次得到的药液, 浓缩至100 mL, 得到2 g/mL的药液, 4 ℃保存备用; (2)含药血清的制备: SPF级SD大鼠8只, 随机分为空白组(control组)、金刚藤组(JGT组)、每组4只; JGT组以2 g/mL的金刚藤水煎液灌胃4 mL, control组给予等体积生理盐水灌胃, 每天灌胃2次、间隔12 h, 连续给药3 d; 末次给药1 h后以CO2窒息法处死小鼠, 心脏取血, 静置后离心15 min取血清, 合并同组血清, 过滤、灭活除菌后得到含药血清, -80 ℃冻存备用.
实验分组及给药方法: 取对数生长期SMMC-7721细胞分为control组、JGT-L组、DTT+JGT组, 用DMEM培养液调整细胞浓度为1×105个/mL, 加入96孔培养板、每孔0.1 mL, 在37 ℃、5%CO2培养箱中过夜, 待细胞贴壁70%-80%时, 弃去细胞培养液. Control、JGT组分别加入空白含药血清和金刚藤含药血清分别培养12 h. DTT+JGT组则予DTT 500 μmol/L孵育24 h后更换金刚藤含药血清继续培养12 h.
CCK-8法检测各组细胞的存活率: 每组重复6个副孔, 每孔分别加入10 μL的CCK-8, 继续置于37 ℃、5%CO2培养箱中孵育3 h. 用酶标仪测定450 nm波长处各孔的光密度值(OD值), 计算细胞的存活率, 存活率 = (实验组OD值/对照组OD值)×100%.
统计学处理 统计学方法采用SPSS21.0统计软件. 计量资料以mean ± SD表示, 多组间比较采用单因素方差分析, P<0.05为差异有统计学意义.
2.1.1 各组SMMC-7721细胞LC3-Ⅱ蛋白的表达: 与contorl组比较, 各浓度处理组细胞中自噬相关蛋白LC3-Ⅱ的表达均显著升高(P均<0.05). 与200 μmol/L组比较, 500 μmol/L组LC3-Ⅱ蛋白的表达显著升高(P<0.05, 表1, 图1).
2.1.2 各组细胞自噬小体的检测: DTT干预各组细胞内均可见自噬小体(如箭头所示), 并且随着DTT浓度的增加, 自噬小体数量逐渐增加, DTT 500 μmol/L组可见大量自噬小体(图2).
ER是存在于真核生物细胞内的网状结构, 具有调控细胞生理功能和维持细胞生存的作用, 是细胞对蛋白质合成后进行正确折叠和翻译后修饰的重要细胞器, 维持着细胞生存及功能, 在某些情况下, 如钙稳态失衡、氧化应激、感染等导致ER功能紊乱, 致未折叠或错误折叠的蛋白堆积, 则引发ERS[10]. 研究表明, 在多种实体肿瘤中, 肿瘤细胞快速增殖, 使得肿瘤细胞在生长的过程中, 普遍存在缺血、缺氧的情况[11]; 此外, 肿瘤细胞的快速增殖, 需要合成大量蛋白质, 这便可能有部分蛋白质折叠错误或者未折叠产生并堆积[12]. 有研究发现, 肝癌患者肝癌细胞ERS是被激活的[6]. DTT是一种ERS诱导剂, 可阻止蛋白质中的半胱氨酸残基的氧化, 干扰蛋白二硫键异构酶(protein disulfide isomerase, PDI)在蛋白质二硫键形成中的催化作用, 导致错误折叠的蛋白大量堆集, 从而诱发ERS[13]. Cheng等[14]成功利用DTT复制癌细胞ERS模型. 严冬梅等[15]等运用DTT诱导SMMC-7721细胞ERS, 并观察了SMMC-7721细胞ERS状态下组蛋白的表达.
自噬系统是真核生物细胞蛋白质降解系统之一[16]. ERS可诱导自噬的发生[2,17]. 本研究发现, 不同浓度DTT(50、200、500 μmol/L)处理SMMC-7721细胞24 h后, 细胞中的自噬小体增多, 以DTT 500 μmol/L组更为明显. 微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3, LC3), 参与了自噬体的形成. 自噬时,微管相关蛋白1轻链3-Ⅰ(microtubule-associated protein 1 light chain 3-Ⅰ, LC3-Ⅰ)转变为LC3-Ⅱ, LC3-Ⅱ附着在自噬体膜上, 是自噬体结构蛋白, 蛋白活性与细胞自噬水平呈正相关, 是自噬发生的标志[18]. 本研究运用不同浓度DTT 处理SMMC-7721细胞24 h, 观察到DTT可显著上调SMMC-7721细胞中自LC3-Ⅱ蛋白的表达, 随着DTT浓度的增加, LC3-Ⅱ蛋白的表达增加, DTT 500 μmol/L组LC3-Ⅱ蛋白的表达最高, 与Control组比较, 差异具有统计学意义. 由此可见, DTT可诱导SMMC-7721细胞ERS-自噬的发生.
无限增殖是恶性肿瘤细胞的重要特征之一, 许多抗癌药物都是通过抑制肿瘤细胞增殖来发挥抗肿瘤作用. 课题组前期用MMT法检测10种壮药含药血清对SMMC-7721细胞生长的抑制情况, 观察到金刚藤、藤梨根、叶下珠、半枝莲的含药血清具有较好的抑制肝癌细胞生长及增殖的作用, 其中金刚藤对SMMC-7721细胞抑制作用最强[9], 课题组另一项研究表明金刚藤能够诱导肝癌细胞凋亡, 将其阻滞于S期, 机制可能与下调癌基因POLD1的表达有关[19]. 本研究选用CCK-8法检测金刚藤对SMMC-7721细胞增殖的影响, 观察到金刚藤可以抑制SMMC-7721细胞增殖, 与课题组前期研究结果相一致. 有研究表明[5], ERS-自噬对细胞的保护作用是肿瘤细胞化疗药物耐药的重要原因之一. ERS-自噬可抑制化疗药物顺铂抗人肝癌HepG2细胞的作用[20]. 本研究结果显示, DTT+JGT组对SMMC-7721细胞抑制作用较Control组强(P<0.05), 但较JGT组弱(P<0.05), 提示DTT诱导的ERS-自噬, 增加了SMMC-7721细胞对金刚藤的抵抗性, 使SMMC-7721细胞在金刚藤的干预下细胞存活率的抑制作用减弱.
综上所述, DTT可诱导肝癌SMMC-7721细胞ERS-自噬, 金刚藤可抑制SMMC-7721细胞的存活率, DTT诱导的ERS-自噬可抵抗金刚藤抑制SMMC-7721细胞的存活率. 由此推测, 抑制ERS-自噬在化疗药物耐药方面可能具有潜在的应用价值.
肝癌是常见的消化道恶性肿瘤, 死亡率位居世界第2位. 金刚藤具有抑制肝癌细胞的作用, 而内质网应激(endoplasmic reticulum stress, ERS)-自噬的保护作用能够促进肝癌细胞生存, 因而探寻肝癌细胞ERS-自噬对金刚藤抑制肝癌细胞作用的影响具有重要意义.
临床治疗肝癌主要采用手术及化疗的方法, 但大部分确诊患者已失去手术机会, 而化疗存在副作用大且易产生耐药性. 中医药治疗肝癌具有疗效稳定且副作用小的特点, 因而探寻金刚藤抗肝癌细胞的深层机制对于其临床运用及新的研究方向具有重要指导意义.
探讨二硫苏糖醇(Dithiothreitol, DTT)诱导SMMC-7721细胞ERS-自噬及金刚藤的干预。
ERS-自噬模型的复制: DTT处理SMMC-7721细胞, 采用透射电镜观察自噬小体和Western blot法检测微管相关蛋白1轻链3-Ⅱ(microtubule-associated protein 1 light chain 3-Ⅱ, LC3-Ⅱ)蛋白的表达. 金刚藤的干预: 运用金刚藤干预ERS-自噬肝癌SMMC-7721细胞模型, 采用CCK-8法检测细胞的存活率.
DTT能够诱导肝癌SMMC-7721细胞ERS-自噬; DTT诱导肝癌SMMC-7721细胞的ERS-自噬可抵抗金刚藤抑制SMMC-7721细胞的存活率.
DTT可诱导肝癌SMMC-7721细胞ERS-自噬, 且DTT诱导肝癌细胞的ERS-自噬可抵抗金刚藤抑制SMMC-7721细胞的存活率.
抑制ERS-自噬在化疗药物耐药方面可能具有潜在的应用价值.
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D, D
E级 (差): E
科学编辑: 张晗 制作编辑:张砚梁
| 1. | Liu MQ, Chen Z, Chen LX. Endoplasmic reticulum stress: a novel mechanism and therapeutic target for cardiovascular diseases. Acta Pharmacol Sin. 2016;37:425-443. [PubMed] [DOI] |
| 2. | Yin XM, Ding WX, Gao WT. Autophagy in the liver. Hepatology. 2008;47:1773-1785. [PubMed] [DOI] |
| 3. | Sun WL, Chen J, Wang YP, Zheng H. Autophagy protects breast cancer cells from epirubicin-induced apoptosis and facilitates epirubicin-resistance development. 2011;1035-1044. [PubMed] [DOI] |
| 4. | Song B, Bian Q, Shao CH, Li G, Liu AA, Jing W, Liu R, Zhang YJ, Zhou YQ, Hu XG, Jin G. Ulinastatin reduces the resistance of liver cancer cells to epirubicin by inhibiting autophagy. PLoS One. 2015;10:e0120694. [PubMed] [DOI] |
| 5. | TTavernier Q, Legras A, Didelot A, Normand C, Gibault L, Badoual C, Le Pimpec-Barthes F, Puig PL, Blons H, Pallet N. High expression of spliced X-Box Binding Protein 1 in lung tumors is associated with cancer aggressiveness and epithelial-to-mesenchymal transition. Sci Rep. 2020;10:10188. [PubMed] [DOI] |
| 6. | Luo C, Xiong H, Chen L, Liu X, Zou S, Guan J, Wang K. GRP78 Promotes Hepatocellular Carcinoma proliferation by increasing FAT10 expression through the NF-κB pathway. Exp Cell Res. 2018;365:1-11. [PubMed] [DOI] |
| 10. | Nagelkerke A, Bussink J, Sweep FC, Span PN. The unfolded protein response as a target for cancer therapy. Biochim Biophys Acta. 2014;1846:277-284. [PubMed] [DOI] |
| 11. | Ruan K, Song G, Ouyang G. Role of hypoxia in the hallmarks of human cancer. J Cell Biochem. 2009;107:1053-1062. [PubMed] [DOI] |
| 12. | Feldman DE, Chauhan V, Koong AC. The unfolded protein response: a novel component of the hypoxic stress response in tumors. Mol Cancer Res. 2005;3:597-605. [PubMed] [DOI] |
| 13. | Wilkinson B, Gilbert HF. Protein disulfide isomerase. Biochim. Biophys Acta. 2004;1699:35-44. [PubMed] [DOI] |
| 14. | Cheng Z, Rendleman J, Vogel C. Time-course proteomics dataset monitoring HeLa cells subjected to DTT induced endoplasmic reticulum stress. Data in Brief. 2016;8:1168-1172. [PubMed] [DOI] |
| 17. | Ni Z, Gong Y, Dai X, Ding W, Wang B, Gong H, Qin L, Cheng P, Li S, Lian J, He F. AU4S: a novel synthetic peptide to measure the activity of ATG4 in living cells. Autophagy. 2015;11:403-415. [PubMed] [DOI] |
| 18. | Yu L, McPhee CK, Zheng L, Mardones GA, Rong Y, Peng J, Mi N, Zhao Y, Liu Z, Wan F, Hailey DW, Oorschot V, Klumperman J, Baehrecke EH, Lenardo MJ. Termination of autophagy and reformation of lysosomes regulated by mTOR. Nature. 2010;465:942-946. [PubMed] [DOI] |
| 19. | Cao B, Zhang Z, Zhang Y, Li J, Liang G, Ling J. Effect of Smilax china L.-containing serum on the expression of POLD1 mRNA in human hepatocarcinoma SMMC-7721 cells. Exp Ther Med. 2013;6:1070-1076. [PubMed] [DOI] |
| 20. | Zhang LJ, Li ZQ, Yang YP, Li XW, Ji JF. Tunicamycin suppresses cisplatin-induced HepG2 cell apoptosis via enhancing p53 protein nuclear export. Mol Cell Biochem. 2009;327:171-182. [PubMed] [DOI] |