修回日期: 2020-07-18
接受日期: 2020-08-14
在线出版日期: 2020-10-08
肠神经胶质细胞是肠道神经系统的重要组成成分, 不仅具有营养和支持肠神经元的作用, 还能参与多种肠道功能的调控. 异常活化的肠神经胶质细胞还可能是炎症性肠病、感染性肠炎、结肠癌等肠道疾病的重要致病因素之一. 目前, 肠神经胶质细胞在消化系统疾病中所发挥的作用尚不完全清楚, 本文就这一方面的研究进展进行综述.
核心提要: 肠神经胶质细胞(enteric glial cells, EGC)是肠道神经系统的重要组成成分, 能以直接接触或间接释放介质的方式对肠道功能产生有利或有害的影响. EGC对肠道稳态所起的保护作用是毋庸置疑的, 但在特定条件下其对肠道的保护作用也可能转变为损伤作用.
引文著录: 王亚梅, 贾漪涛, 李中信. 肠神经胶质细胞在肠道功能与肠道疾病中的作用. 世界华人消化杂志 2020; 28(19): 979-985
Revised: July 18, 2020
Accepted: August 14, 2020
Published online: October 8, 2020
Enteric glial cells, as a key component of the intestinal nervous system, not only have the function of nutrition and supporting intestinal neurons, but also participate in the regulation of various intestinal functions. Abnormal activation of enteric glial cells may also be one of the important pathogenic factors for inflammatory bowel disease, intestinal infection, intestinal obstruction, colon cancer, and other intestinal diseases. At present, the role of enteric glial cells in the occurrence and development of digestive system diseases remains to be elucidated. This paper reviews the research progress in this area.
- Citation: Wang YM, Jia YT, Li ZX. Role of enteric glial cells in intestinal function and intestinal diseases. Shijie Huaren Xiaohua Zazhi 2020; 28(19): 979-985
- URL: https://www.wjgnet.com/1009-3079/full/v28/i19/979.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i19.979
肠神经胶质细胞(enteric glial cells, EGC)作为肠道神经系统(enteric nervous system, ENS)的重要组成成分, 其形态与功能均类似于中枢神经系统中的星形胶质细胞, 并能表达与星形胶质细胞相同的标记物[1]. EGC既在调节肠道屏障功能、肠道免疫、胃肠动力等方面具有重要的作用, 又能参与多种肠道疾病的发生发展[2,3]. 有研究表明, EGC缺失会导致肠黏膜屏障的完整性丧失、肠道出血和坏死等病理改变[4,5]. 目前, EGC在肠道疾病中的作用正在引起人们越来越多的关注, 本文将对EGC在肠道功能和肠道疾病中的作用及研究进展做一综述.
ENS是由肠壁内大量的神经元和EGC相互连接组成的神经系统, 横跨整个肠道, 其作为外周独立的神经系统, 可单独或协同其他神经元(副交感神经/交感神经)参与维持肠道的正常功能. 因此, ENS被形象地称作人类的"第二大脑". 肠神经元细胞和EGC均来源于神经外胚层. EGC的数量是肠神经元数量的4-10倍[6,7], 主要分布于黏膜下神经丛和肌间神经丛的神经节, 并伸出突触与周围细胞相互作用. 从分子学角度看, 成熟的EGC能表达与星形胶质细胞相似的分子标记物如中间丝胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)[8]、S100β[9]、SOX8/9/10[10]、43半通道蛋白(connexin-43, Cx43)[11]等. 虽然EGC被发现已超过一个世纪, 但长久以来人们对它的功能了解甚少[12]. 既往研究结果提示EGC主要有支持、营养、保护神经元和参与肠道内神经活动整合的功能. 近年来研究发现, EGC还是维持肠道内稳态的关键调节因子[13,14], 既能参与多种肠道生理功能的调节, 又能在某些肠道疾病如炎症性肠病[15]、感染性肠炎[16]、肠道肿瘤[17]等的发生发展过程中发挥重要作用.
肠黏膜屏障由机械屏障、化学屏障、生物屏障和免疫屏障组成. 肠黏膜屏障的维护受多种因素的调控, 其中ENS扮演着重要的角色. 肠上皮细胞也能通过表达三种连接复合物来维持肠黏膜屏障的完整性, 它们分别是紧密连接、黏着连接和桥粒[18]. 其中, 细胞间紧密连接由闭锁蛋白、胞质紧密连接蛋白(ZO-1, ZO-2和ZO-3)和紧密连接蛋白等组成[19]. 当肠黏膜屏障破坏时, 肠道微生物群可跨越肠黏膜屏障, 破坏肠道菌群与人体之间的动态平衡, 导致一系列疾病的发生发展.
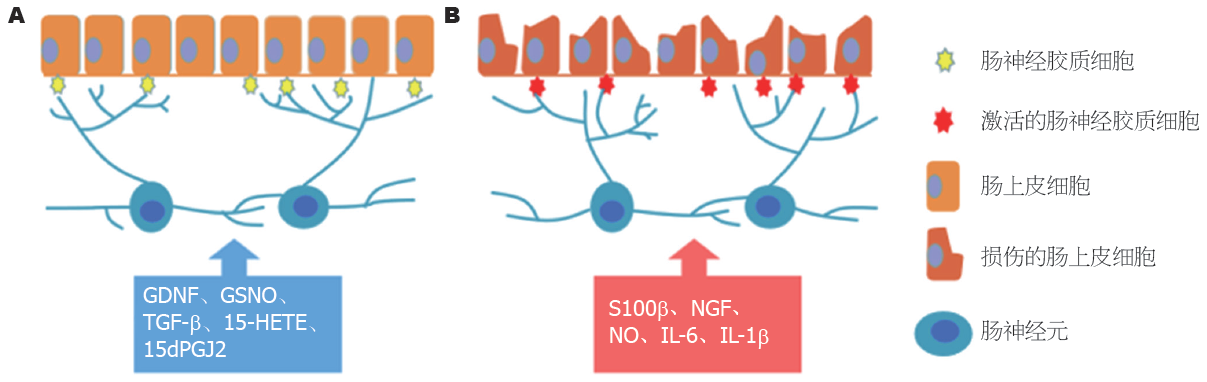
研究表明, EGC作为ENS的重要组成部分, 不仅能将突触直接延伸至肠道黏膜层, 与肠上皮细胞相连接, 形成所谓的"神经元-胶质-上皮单元"[13,20]; 还能够与周围环境相互作用, 接收和处理来自神经元和其他非神经元细胞的信息, 通过产生和释放多种神经营养因子、炎性因子和不饱和脂肪酸代谢产物等参与肠上皮细胞的增殖、分化、成熟以及肠黏膜损伤与修复的过程[21]. 在生理状态下, EGC可以分泌多种神经营养因子或脂质代谢产物如胶质源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF)、亚硝基谷胱甘肽(S-nitrosog lutathione, GSNO)、转化生长因子-β (transforming growth factor, TGF-β)、15-羟基膦酸(15-hydroxyeicosatetraenoic acid, 15-HETE)和15-脱氧前列腺素-J2 (15-deoxyprostaglandin-J2, 15dPGJ2)等维护肠道的稳态. 研究证实, 多种EGC缺失的小鼠模型均会出现肠道血管和肠黏膜屏障通透性增加的现象. GFAP相关基因敲除的小鼠, 与正常小鼠相比, 其髓过氧化物酶(myeloperoxidase, MPO)活性增加、肌层神经元中度变性、管腔内出血和肠黏膜屏障完整性破坏, 严重时甚至可出现致命性的空肠回肠炎[22,23]. 在病理情况下, EGC能够被激活并释放S100β、神经生长因子(nerve growth factor, NGF)、一氧化氮(nitric oxide, NO)、白细胞介素(interleukin, IL) -6和IL-1β等改变肠黏膜屏障的功能(图1). 有研究表明, 在炎症或感染条件下, EGC可过度释放S100β, 促进NO的合成与释放, 导致肠黏膜屏障破坏[24]. 目前, 病理状态下的EGC在维护肠黏膜屏障功能方面所发挥的作用尚存在争议[9].
在肠道微环境中, EGC被看作是肠道免疫系统中的重要调节因子. 在炎症性肠病患者体内, EGC衍生的S100β能与RAGE相互作用, 促进诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)的表达和NO的释放, 影响外周血和肠道黏膜免疫细胞的应答[25,26]. Ibiza等[27]人发现, EGC可诱导3型固有淋巴细胞合成和分泌IL-22, 进而促进肠上皮细胞产生抗菌肽, 参与肠黏膜屏障的固有免疫. 促炎因子可上调EGC中IL-7 mRNA和蛋白的表达水平, 影响肠道免疫和防御功能[28]. 在炎症因子刺激下, EGC可分泌多种细胞因子和趋化因子, 募集免疫细胞如巨噬细胞、中性粒细胞和肥大细胞等参与黏膜屏障的先天免疫反应[15,29]. EGC不仅能够募集多种免疫细胞, 还可以通过表达不同的Toll样受体来区分病原体与益生菌, 并驱动促炎通路, 保护肠道免受病原菌侵害, 此过程与上调S100β的表达密切相关[30]. 在生理条件下, EGC仅能表达组织相容性复合体(major histocompatibility complex, MHC) Ⅰ类分子, 而不能表达MHCII. 但在炎性刺激下, EGC能够表达MHCⅡ和ICAM-1, 从而使其具有抗原提呈的能力[31]. 此外, EGC存在明显的异质性, 不仅可以通过抗原提呈激活T细胞, 还具有一定的免疫抑制作用. Kermarrec等[32]将从克罗恩病(Crohn's disease, CD)患者体内分离出的EGC与活化的T细胞共培养, 发现其能够抑制T细胞的增殖. 对于炎症性肠病患者而言, 这种免疫抑制能力在维持肠道局部免疫稳态中起着重要的作用.
EGC与肠神经元、Cajal间质细胞(interstritial cell of cajal, ICC)及平滑肌细胞相毗邻. 肠神经-ICC-平滑肌细胞网络作为胃肠道运动功能的基本单位, 对调节肠道运动起着关键性的作用[33,34]. EGC对肠神经元的保护作用保证了肠神经-ICC-平滑肌细胞网络的完整性, 因此EGC在肠道运动的调控中也起着重要作用. 研究人员在上世纪90年代已发现, 用6-氨基烟酰胺治疗后的小鼠不仅出现中枢及外周神经胶质细胞的破坏, 同时还出现严重的腹泻, 此实验首次揭示了EGC可参与胃肠动力的调控[35]. Nasser等[36]人也发现敲除了EGC的小鼠肠道排空延迟、传输速率减慢.
EGC数目或性状的异常均会导致肠道动力障碍, 导致肠道排空及运输减慢. 先天性巨结肠患者的肠神经节中FABP7与S100β的比值显著增加, 提示肠神经节中存在较多未成熟的EGC[37]. 此类未成熟的EGC可促进神经元凋亡, 造成肠道运动障碍. 慢传输性便秘和假性肠梗阻患者肠道内EGC细胞的大量丢失, 可加重肠道起搏信号的损害, 使得胃肠运动减弱. Stoffels等[38]人发现, IL-1R特异性地存在于肠道肌间神经丛的EGC上, 并通过IL-1R/MyD88信号通路导致IL-6及单核细胞趋化蛋白1的表达上调, 这可能是造成术后肠梗阻的重要机制.
EGC能够通过表达多种神经递质受体如腺苷、谷氨酸、5-羟色胺、肾上腺素等的受体, 对肠神经元来源的信号做出应答, 进而反馈性调节肠道运动. 例如ADP可与EGC上的P2Y1受体结合, 触发胞内Ca2+信号, 并通过Cx43释放ATP[39], 最终增强肠道运动. 近期研究证实, EGC可表达M3和M5型毒蕈碱受体, 这表明EGC还可以接受胆碱能神经元的调控, 其中M3型受体激活可驱动胞质内Ca2+信号活化[40].
炎症性肠病包括溃疡性结肠炎(ulcearative colitis, UC)和CD, 是一种慢性非特异性肠道炎症性疾病. 众所周知, EGC的缺失或功能障碍可造成肠道黏膜屏障和肠道微环境的破坏, 提示EGC的异常可能与炎症性肠病的发生发展存在着一定的联系[15,25].
由EGC分泌的神经生长因子GDNF是肠上皮细胞与EGC相互作用的重要介质[41]. 在用5%右旋糖酐硫酸钠(DSS)诱导的结肠炎小鼠模型中, GDNF可以通过PI3K/AKT信号通路减少炎性细胞因子TNF-α和IL-1β的产生、降低MPO的活性, 进而降低炎症性肠病小鼠的疾病活动指数, 缓解肠道炎症[42]. EGC分泌的GDNF能够以旁分泌的方式作用于邻近肠上皮细胞的GFR-α2受体上, 抑制肠上皮细胞凋亡, 上调ZO-1的表达, 从而降低肠道黏膜屏障通透性[43]. 此外在CD患者的肠道黏膜中存在一个反馈性的GDNF自分泌环, 通过自分泌的方式有效防止EGC凋亡, 从而起到维护肠道黏膜屏障完整性、抑制炎症反应的作用[43]. 目前研究表明, GDNF无论是自分泌还是旁分泌, 其均依赖于cAMP/PKA或p38 MAPK信号通路挥抗细胞凋亡的作用[41,44]. GDNF还能够通过抑制肥大细胞中的JNK信号通路, 减少其脱颗粒及促炎因子的释放, 从而减轻实验小鼠结肠炎的严重程度[45].
特别是EGC可以通过释放GSNO来调控肠道屏障的功能[46]. Savidge等[47]人发现, GFAP敲基因小鼠体内EGC的数量减少, 肠道黏膜屏障通透性增加; 在补充外源性的GSNO后, 敲基因小鼠的肠道黏膜屏障损伤可明显修复. 另有研究表明, GSNO可通过改变Occludin、ZO-1和磷酸化肌球蛋白轻链的表达, 维持炎症期间肠道黏膜屏障的完整性. GSNO可还能够通过抑制NF-κB炎性通路, 减少炎性因子如IL-1β、IL-6和 TNF-α的产生, 对肠道黏膜屏障起到保护作用, 但其具体作用靶点仍有待确定[48].
肠道炎症中的大部分NO来自于EGC, 其与肠道黏膜屏障损伤之间的联系, 已在多种小鼠结肠炎模型中得到了证实[49,50]. 脂多糖(lipopolysaccharide, LPS)可增加EGC胞内的iNOS活性和NO的含量, 导致肠道黏膜屏障功能受损[23]. MacEachern等[49]人发现, EGC中iNOS的表达增加可以导致结肠炎小鼠肠道离子转运失调, 破坏肠道黏膜屏障功能并增加细菌移位. 同时, 研究人员还发现无论是抑制NO的产生, 还是阻断胶质细胞的代谢, 均可改善结肠炎小鼠肠道的离子转运功能, 维持肠道黏膜屏障的完整性. NO还可引起肠上皮细胞间紧密连接相关蛋白ZO-1、ZO-2、ZO-3和Occludin的表达异常, 导致肠道黏膜屏障的渗透性增加. 另外, 在UC患者中, EGC能够通过S100β相关通路, 激活下游NF-κB通路, 促进黏膜NO的产生和释放, 加重肠道炎症反应[51].
在CD患者的EGC中, 多种不饱和脂肪酸代谢物的产生减少, 包括18-羟基异戊酸、15-HETE、15dPGJ2及11-β-前列腺素F2α等[52]. 其中, 15-HETE与11-β-前列腺素F2α对肠黏膜屏障的保护作用早已得到证实. 与正常肠道组织相比, CD患者EGC中15-HETE的产生减少, 不能稳定肠上皮细胞的屏障功能; 加入外源性15-HETE后, 可通过抑制腺苷一磷酸活化蛋白激酶的活性和增加ZO-1的表达维护肠道黏膜屏障功能[53].
随着研究的逐步深入, 人们认为EGC除了在生理状态下对肠道稳态的调节起着重要作用, 还在炎症性肠病的发生发展中发挥着关键作用. 进一步研究EGC的功能及作用机制, 有助于明确EGC在炎症性肠病不同阶段所发挥的作用, 或许将来能通过调控EGC而对炎症性肠病进行治疗.
感染性肠炎是由病原菌感染引起的肠道疾病, 具有发病率高、流行范围广的特点, 是全球公共卫生问题之一. 弗氏志贺菌是导致肠道黏膜屏障破坏和肠道炎症反应的主要侵袭性病原体. EGC分泌的GSNO可使肠上皮细胞中Cdc42和phospho-PAK的表达显著降低、ZO-1的表达增加, 维持肠道黏膜屏障的完整性[12], 从而增强机体对弗氏志贺菌感染的抵抗力. 肠道黏膜屏障通透性的增加是轮状病毒引起腹泻的重要机制. 在轮状病毒感染性腹泻期间, GSNO能够增加ZO-1的表达[54]. 这些研究表明EGC在预防及治疗肠道疾病, 特别在感染性疾病中扮演着重要角色.
目前关于EGC与结肠癌的相关研究较少. Neunlist等[17]人发现, EGC可通过释放TGF-β1抑制结肠癌细胞Caco-2、HT-29和T84的增殖. 研究表明, EGC合成与释放的脂质代谢产物15dPGJ2能使肠上皮细胞上的PPARγ发生核移位, 抑制细胞的增殖、促进细胞的分化成熟, 改变肠黏膜屏障的特性, 最终抑制结肠癌的发生[55]. 此外, 神经胶质前列腺素D合酶活性的变化可改变肠道黏膜屏障的功能, 参与癌症、炎症性肠病等疾病的发生发展[56]. 最新研究发现,被肿瘤细胞劫持的EGC可转变为促进肿瘤发生的表型, 即EGC一旦被肿瘤激活后, 就可以通过PGE2/EP4/EGFR信号途径刺激结肠癌干细胞, 从而驱动结肠癌的发生[57].
EGC不仅仅是一个简单的肠道"粘合剂", 同时还与多种肠道疾病如炎症性肠病、感染性肠炎、结肠癌和术后肠梗阻等的发生发展密切相关. 研究证实, EGC能以直接接触或间接释放介质的方式对肠道功能产生有利或有害的影响. 这种异质性可使其对肠道的保护作用转变为损害作用. 但EGC对肠道稳态所起的保护作用也是不容忽视的. 在临床上, 靶向EGC来改善肠道功能、治疗肠道疾病仍面着临许多挑战. 因此, 我们需要对EGC进一步深入的认识和研究, 明确其在不同肠道疾病和疾病的不同时期中所发挥的作用, 且寻找靶向不同疾病状态下EGC的特异性药物.
学科分类: 胃肠病学和肝病学
手稿来源地: 河北省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Wang Z, Ocadiz-Ruiz R, Sundaresan S, Ding L, Hayes M, Sahoo N, Xu H, Merchant JL. Isolation of Enteric Glial Cells from the Submucosa and Lamina Propria of the Adult Mouse. J Vis Exp. 2018;57629. [PubMed] [DOI] |
| 2. | McMenamin CA, Clyburn C, Browning KN. High-Fat Diet During the Perinatal Period Induces Loss of Myenteric Nitrergic Neurons and Increases Enteric Glial Density, Prior to the Development of Obesity. Neuroscience. 2018;393:369-380. [PubMed] [DOI] |
| 3. | Meir M, Burkard N, Ungewiß H, Diefenbacher M, Flemming S, Kannapin F, Germer CT, Schweinlin M, Metzger M, Waschke J, Schlegel N. Neurotrophic factor GDNF regulates intestinal barrier function in inflammatory bowel disease. J Clin Invest. 2019;129:2824-2840. [PubMed] [DOI] |
| 4. | Pochard C, Coquenlorge S, Freyssinet M, Naveilhan P, Bourreille A, Neunlist M, Rolli-Derkinderen M. The multiple faces of inflammatory enteric glial cells: is Crohn's disease a gliopathy? Am J Physiol Gastrointest Liver Physiol. 2018;315:G1-G11. [PubMed] [DOI] |
| 5. | Reinshagen M, Rohm H, Steinkamp M, Lieb K, Geerling I, Von Herbay A, Flämig G, Eysselein VE, Adler G. Protective role of neurotrophins in experimental inflammation of the rat gut. Gastroenterology. 2000;119:368-376. [PubMed] [DOI] |
| 7. | Esposito G, Sarnelli G, Capoccia E, Cirillo C, Pesce M, Lu J, Calì G, Cuomo R, Steardo L. Autologous transplantation of intestine-isolated glia cells improves neuropathology and restores cognitive deficits in β amyloid-induced neurodegeneration. Sci Rep. 2016;6:22605. [PubMed] [DOI] |
| 8. | Coelho-Aguiar Jde M, Bon-Frauches AC, Gomes AL, Veríssimo CP, Aguiar DP, Matias D, Thomasi BB, Gomes AS, Brito GA, Moura-Neto V. The enteric glia: identity and functions. Glia. 2015;63:921-935. [PubMed] [DOI] |
| 9. | Bishop AE, Carlei F, Lee V, Trojanowski J, Marangos PJ, Dahl D, Polak JM. Combined immunostaining of neurofilaments, neuron specific enolase, GFAP and S-100. A possible means for assessing the morphological and functional status of the enteric nervous system. Histochemistry. 1985;82:93-97. [PubMed] [DOI] |
| 11. | McClain J, Grubišić V, Fried D, Gomez-Suarez RA, Leinninger GM, Sévigny J, Parpura V, Gulbransen BD. Ca2+ responses in enteric glia are mediated by connexin-43 hemichannels and modulate colonic transit in mice. Gastroenterology. 2014;146:497-507.e1. [PubMed] [DOI] |
| 12. | Neunlist M, Van Landeghem L, Mahé MM, Derkinderen P, des Varannes SB, Rolli-Derkinderen M. The digestive neuronal-glial-epithelial unit: a new actor in gut health and disease. Nat Rev Gastroenterol Hepatol. 2013;10:90-100. [PubMed] [DOI] |
| 13. | Vergnolle N, Cirillo C. Neurons and Glia in the Enteric Nervous System and Epithelial Barrier Function. Physiology (Bethesda). 2018;33:269-280. [PubMed] [DOI] |
| 14. | Ochoa-Cortes F, Turco F, Linan-Rico A, Soghomonyan S, Whitaker E, Wehner S, Cuomo R, Christofi FL. Enteric Glial Cells: A New Frontier in Neurogastroenterology and Clinical Target for Inflammatory Bowel Diseases. Inflamm Bowel Dis. 2016;22:433-449. [PubMed] [DOI] |
| 15. | Li H, Fan C, Lu H, Feng C, He P, Yang X, Xiang C, Zuo J, Tang W. Protective role of berberine on ulcerative colitis through modulating enteric glial cells-intestinal epithelial cells-immune cells interactions. Acta Pharm Sin B. 2020;10:447-461. [PubMed] [DOI] |
| 16. | Flamant M, Aubert P, Rolli-Derkinderen M, Bourreille A, Neunlist MR, Mahé MM, Meurette G, Marteyn B, Savidge T, Galmiche JP, Sansonetti PJ, Neunlist M. Enteric glia protect against Shigella flexneri invasion in intestinal epithelial cells: a role for S-nitrosoglutathione. Gut. 2011;60:473-484. [PubMed] [DOI] |
| 17. | Neunlist M, Aubert P, Bonnaud S, Van Landeghem L, Coron E, Wedel T, Naveilhan P, Ruhl A, Lardeux B, Savidge T, Paris F, Galmiche JP. Enteric glia inhibit intestinal epithelial cell proliferation partly through a TGF-beta1-dependent pathway. Am J Physiol Gastrointest Liver Physiol. 2007;292:G231-41. [PubMed] [DOI] |
| 18. | Walsh KT, Zemper AE. The Enteric Nervous System for Epithelial Researchers: Basic Anatomy, Techniques, and Interactions With the Epithelium. Cell Mol Gastroenterol Hepatol. 2019;8:369-378. [PubMed] [DOI] |
| 19. | Fang Y, Wu C, Wang Q, Tang J. Farnesol contributes to intestinal epithelial barrier function by enhancing tight junctions via the JAK/STAT3 signaling pathway in differentiated Caco-2 cells. J Bioenerg Biomembr. 2019;51:403-412. [PubMed] [DOI] |
| 20. | Rao M, Rastelli D, Dong L, Chiu S, Setlik W, Gershon MD, Corfas G. Enteric Glia Regulate Gastrointestinal Motility but Are Not Required for Maintenance of the Epithelium in Mice. Gastroenterology. 2017;153:1068-1081.e7. [PubMed] [DOI] |
| 21. | D'Antongiovanni V, Benvenuti L, Fornai M, Pellegrini C, van den Wijngaard R, Cerantola S, Giron MC, Caputi V, Colucci R, Haskó G, Németh ZH, Blandizzi C, Antonioli L. Glial A2B Adenosine Receptors Modulate Abnormal Tachykininergic Responses and Prevent Enteric Inflammation Associated with High Fat Diet-Induced Obesity. Cells. 2020;9:1245. [PubMed] [DOI] |
| 22. | Cornet A, Savidge TC, Cabarrocas J, Deng WL, Colombel JF, Lassmann H, Desreumaux P, Liblau RS. Enterocolitis induced by autoimmune targeting of enteric glial cells: a possible mechanism in Crohn's disease? Proc Natl Acad Sci USA. 2001;98:13306-13311. [PubMed] [DOI] |
| 23. | Langness S, Kojima M, Coimbra R, Eliceiri BP, Costantini TW. Enteric glia cells are critical to limiting the intestinal inflammatory response after injury. Am J Physiol Gastrointest Liver Physiol. 2017;312:G274-G282. [PubMed] [DOI] |
| 24. | Xiao WD, Chen W, Sun LH, Wang WS, Zhou SW, Yang H. The protective effect of enteric glial cells on intestinal epithelial barrier function is enhanced by inhibiting inducible nitric oxide synthase activity under lipopolysaccharide stimulation. Mol Cell Neurosci. 2011;46:527-534. [PubMed] [DOI] |
| 25. | Cirillo C, Sarnelli G, Esposito G, Grosso M, Petruzzelli R, Izzo P, Calì G, D'Armiento FP, Rocco A, Nardone G, Iuvone T, Steardo L, Cuomo R. Increased mucosal nitric oxide production in ulcerative colitis is mediated in part by the enteroglial-derived S100B protein. Neurogastroenterol Motil. 2009;21:1209-e112. [PubMed] [DOI] |
| 26. | Cirillo C, Sarnelli G, Esposito G, Turco F, Steardo L, Cuomo R. S100B protein in the gut: the evidence for enteroglial-sustained intestinal inflammation. World J Gastroenterol. 2011;17:1261-1266. [PubMed] [DOI] |
| 27. | Ibiza S, García-Cassani B, Ribeiro H, Carvalho T, Almeida L, Marques R, Misic AM, Bartow-McKenney C, Larson DM, Pavan WJ, Eberl G, Grice EA, Veiga-Fernandes H. Glial-cell-derived neuroregulators control type 3 innate lymphoid cells and gut defence. Nature. 2016;535:440-443. [PubMed] [DOI] |
| 28. | Kermarrec L, Durand T, Gonzales J, Pabois J, Hulin P, Neunlist M, Neveu I, Naveilhan P. Rat enteric glial cells express novel isoforms of Interleukine-7 regulated during inflammation. Neurogastroenterol Motil. 2019;31:e13467. [PubMed] [DOI] |
| 29. | Capoccia E, Cirillo C, Gigli S, Pesce M, D'Alessandro A, Cuomo R, Sarnelli G, Steardo L, Esposito G. Enteric glia: A new player in inflammatory bowel diseases. Int J Immunopathol Pharmacol. 2015;28:443-451. [PubMed] [DOI] |
| 30. | Turco F, Sarnelli G, Cirillo C, Palumbo I, De Giorgi F, D'Alessandro A, Cammarota M, Giuliano M, Cuomo R. Enteroglial-derived S100B protein integrates bacteria-induced Toll-like receptor signalling in human enteric glial cells. Gut. 2014;63:105-115. [PubMed] [DOI] |
| 31. | da Silveira AB, de Oliveira EC, Neto SG, Luquetti AO, Fujiwara RT, Oliveira RC, Brehmer A. Enteroglial cells act as antigen-presenting cells in chagasic megacolon. Hum Pathol. 2011;42:522-532. [PubMed] [DOI] |
| 32. | Kermarrec L, Durand T, Neunlist M, Naveilhan P, Neveu I. Enteric glial cells have specific immunosuppressive properties. J Neuroimmunol. 2016;295-296:79-83. [PubMed] [DOI] |
| 33. | Lee SE, Wi JS, Min YI, Jung C, Ahn KY, Bae CS, Kim BY, Park SS, Oh CS, Weninger WJ, Nam KI. Distribution and three-dimensional appearance of the interstitial cells of Cajal in the rat stomach and duodenum. Microsc Res Tech. 2009;72:951-956. [PubMed] [DOI] |
| 34. | Aubé AC, Cabarrocas J, Bauer J, Philippe D, Aubert P, Doulay F, Liblau R, Galmiche JP, Neunlist M. Changes in enteric neurone phenotype and intestinal functions in a transgenic mouse model of enteric glia disruption. Gut. 2006;55:630-637. [PubMed] [DOI] |
| 35. | Aikawa H, Suzuki K. Lesions in the skin, intestine, and central nervous system induced by an antimetabolite of niacin. Am J Pathol. 1986;122:335-342. [PubMed] |
| 36. | Nasser Y, Fernandez E, Keenan CM, Ho W, Oland LD, Tibbles LA, Schemann M, MacNaughton WK, Rühl A, Sharkey KA. Role of enteric glia in intestinal physiology: effects of the gliotoxin fluorocitrate on motor and secretory function. Am J Physiol Gastrointest Liver Physiol. 2006;291:G912-G927. [PubMed] [DOI] |
| 37. | Tani G, Tomuschat C, O'Donnell AM, Coyle D, Puri P. Increased population of immature enteric glial cells in the resected proximal ganglionic bowel of Hirschsprung's disease patients. J Surg Res. 2017;218:150-155. [PubMed] [DOI] |
| 38. | Stoffels B, Hupa KJ, Snoek SA, van Bree S, Stein K, Schwandt T, Vilz TO, Lysson M, Veer CV, Kummer MP, Hornung V, Kalff JC, de Jonge WJ, Wehner S. Postoperative ileus involves interleukin-1 receptor signaling in enteric glia. Gastroenterology. 2014;146:176-87.e1. [PubMed] [DOI] |
| 39. | Cerantola S, Caputi V, Marsilio I, Ridolfi M, Faggin S, Bistoletti M, Giaroni C, Giron MC. Involvement of Enteric Glia in Small Intestine Neuromuscular Dysfunction of Toll-Like Receptor 4-Deficient Mice. Cells. 2020;9:838. [PubMed] [DOI] |
| 40. | Delvalle NM, Fried DE, Rivera-Lopez G, Gaudette L, Gulbransen BD. Cholinergic activation of enteric glia is a physiological mechanism that contributes to the regulation of gastrointestinal motility. Am J Physiol Gastrointest Liver Physiol. 2018;315:G473-G483. [PubMed] [DOI] |
| 41. | Meir M, Flemming S, Burkard N, Bergauer L, Metzger M, Germer CT, Schlegel N. Glial cell line-derived neurotrophic factor promotes barrier maturation and wound healing in intestinal epithelial cells in vitro. Am J Physiol Gastrointest Liver Physiol. 2015;309:G613-G624. [PubMed] [DOI] |
| 42. | Liu GX, Yang YX, Yan J, Zhang T, Zou YP, Huang XL, Gan HT. Glial-derived neurotrophic factor reduces inflammation and improves delayed colonic transit in rat models of dextran sulfate sodium-induced colitis. Int Immunopharmacol. 2014;19:145-152. [PubMed] [DOI] |
| 43. | Duarte Azevedo M, Sander S, Tenenbaum L. GDNF, A Neuron-Derived Factor Upregulated in Glial Cells during Disease. J Clin Med. 2020;9:456. [PubMed] [DOI] |
| 44. | Steinkamp M, Geerling I, Seufferlein T, von Boyen G, Egger B, Grossmann J, Ludwig L, Adler G, Reinshagen M. Glial-derived neurotrophic factor regulates apoptosis in colonic epithelial cells. Gastroenterology. 2003;124:1748-1757. [PubMed] [DOI] |
| 45. | Xie Q, Chen X, Meng ZM, Huang XL, Zhang Q, Zhou JQ, Zhang L, He FQ, Zou YP, Gan HT. Glial-derived neurotrophic factor regulates enteric mast cells and ameliorates dextran sulfate sodium-induced experimental colitis. Int Immunopharmacol. 2020;85:106638. [PubMed] [DOI] |
| 46. | Li Z, Zhang X, Zhou H, Liu W, Li J. Exogenous S-nitrosoglutathione attenuates inflammatory response and intestinal epithelial barrier injury in endotoxemic rats. J Trauma Acute Care Surg. 2016;80:977-984. [PubMed] [DOI] |
| 47. | Savidge TC, Newman P, Pothoulakis C, Ruhl A, Neunlist M, Bourreille A, Hurst R, Sofroniew MV. Enteric glia regulate intestinal barrier function and inflammation via release of S-nitrosoglutathione. Gastroenterology. 2007;132:1344-1358. [PubMed] [DOI] |
| 48. | Cheadle GA, Costantini TW, Bansal V, Eliceiri BP, Coimbra R. Cholinergic signaling in the gut: a novel mechanism of barrier protection through activation of enteric glia cells. Surg Infect (Larchmt). 2014;15:387-393. [PubMed] [DOI] |
| 49. | MacEachern SJ, Patel BA, Keenan CM, Dicay M, Chapman K, McCafferty DM, Savidge TC, Beck PL, MacNaughton WK, Sharkey KA. Inhibiting Inducible Nitric Oxide Synthase in Enteric Glia Restores Electrogenic Ion Transport in Mice With Colitis. Gastroenterology. 2015;149:445-55.e3. [PubMed] [DOI] |
| 50. | Cochran KE, Lamson NG, Whitehead KA. Expanding the utility of the dextran sulfate sodium (DSS) mouse model to induce a clinically relevant loss of intestinal barrier function. PeerJ. 2020;8:e8681. [PubMed] [DOI] |
| 51. | Esposito G, Capoccia E, Turco F, Palumbo I, Lu J, Steardo A, Cuomo R, Sarnelli G, Steardo L. Palmitoylethanolamide improves colon inflammation through an enteric glia/toll like receptor 4-dependent PPAR-α activation. Gut. 2014;63:1300-1312. [PubMed] [DOI] |
| 52. | Coquenlorge S, Van Landeghem L, Jaulin J, Cenac N, Vergnolle N, Duchalais E, Neunlist M, Rolli-Derkinderen M. The arachidonic acid metabolite 11β-ProstaglandinF2α controls intestinal epithelial healing: deficiency in patients with Crohn's disease. Sci Rep. 2016;6:25203. [PubMed] [DOI] |
| 53. | Pochard C, Coquenlorge S, Jaulin J, Cenac N, Vergnolle N, Meurette G, Freyssinet M, Neunlist M, Rolli-Derkinderen M. Defects in 15-HETE Production and Control of Epithelial Permeability by Human Enteric Glial Cells From Patients With Crohn's Disease. Gastroenterology. 2016;150:168-180. [PubMed] [DOI] |
| 54. | Hagbom M, De Faria FM, Winberg ME, Westerberg S, Nordgren J, Sharma S, Keita ÅV, Loitto V, Magnusson KE, Svensson L. Neurotrophic Factors Protect the Intestinal Barrier from Rotavirus Insult in Mice. mBio. 2020;11:e02834-19. [PubMed] [DOI] |
| 55. | Ponferrada A, Caso JR, Alou L, Colón A, Sevillano D, Moro MA, Lizasoain I, Menchén P, Gómez-Lus ML, Lorenzo P, Cos E, Leza JC, Menchén L. The role of PPARgamma on restoration of colonic homeostasis after experimental stress-induced inflammation and dysfunction. Gastroenterology. 2007;132:1791-1803. [PubMed] [DOI] |
| 56. | Bach-Ngohou K, Mahé MM, Aubert P, Abdo H, Boni S, Bourreille A, Denis MG, Lardeux B, Neunlist M, Masson D. Enteric glia modulate epithelial cell proliferation and differentiation through 15-deoxy-12,14-prostaglandin J2. J Physiol. 2010;588:2533-2544. [PubMed] [DOI] |
| 57. | Valès S, Bacola G, Biraud M, Touvron M, Bessard A, Geraldo F, Dougherty KA, Lashani S, Bossard C, Flamant M, Duchalais E, Marionneau-Lambot S, Oullier T, Oliver L, Neunlist M, Vallette FM, Van Landeghem L. Tumor cells hijack enteric glia to activate colon cancer stem cells and stimulate tumorigenesis. EBioMedicine. 2019;49:172-188. [PubMed] [DOI] |