修回日期: 2020-08-02
接受日期: 2020-08-14
在线出版日期: 2020-09-28
炎症性肠病(inflammatory bowel disease, IBD)是一种病因不明、异常免疫介导的肠道慢性及复发性炎症性疾病. 肠道黏膜岩藻糖基化是在岩藻糖基转移酶的调控下, 将岩藻糖转移到肠道黏膜蛋白质侧链上形成岩藻糖苷键的过程. 肠道黏膜岩藻糖基化在IBD中的作用机制尚未完全探明, 本文就肠道黏膜岩藻糖基化与IBD研究进展作一综述.
核心提要: 炎症性肠病(inflammatory bowel disease, IBD), 包括溃疡性结肠炎和克罗恩病, 是肠道菌群失衡等因素作用于遗传易感者后, 肠道黏膜发生的慢性炎症反应. 我国的IBD发病率呈逐年上升趋势. 肠道黏膜岩藻糖基化, 即在岩藻糖基转移酶(fucosyltransferases, FUTs)的调控下, 将岩藻糖以活化的单体形式(鸟苷二磷酸-岩藻糖)转移到肠道蛋白质上形成聚糖链的过程, 参与选择素介导的白细胞外渗及归巢、宿主微生物相互作用及炎症因子表达, 并与肿瘤增殖、侵袭、转移、免疫逃逸有关. 目前发现有两类FUTs被发现与IBD密切相关, 第一类为FUT2和FUT3, 特异催化人类组织血型抗原的形成; 第二类为FUT8, 能将岩藻单糖连接到蛋白质天冬酰胺的NH2自由基上, 这一过程被称为"核心岩藻糖基化". 本文就肠道黏膜岩藻糖基化与IBD研究进展作一综述.
引文著录: 陈鑫, 李国熊, 方家恒, 徐思楠, 高宇飞, 孙倚天. 肠道黏膜岩藻糖基化与炎症性肠病研究进展. 世界华人消化杂志 2020; 28(18): 920-924
Revised: August 2, 2020
Accepted: August 14, 2020
Published online: September 28, 2020
Inflammatory bowel disease (IBD) is an unexplained, abnormal immune mediated chronic and recurrent inflammatory disorder of the intestine. Fucosylation in the intestinal mucosal is the process of transferring fucose to intestinal mucosal protein side chains under the control of fucosyltransferases to form fucosyl bonds. The mechanism of fucosylation in the intestinal mucosa in IBD has not been fully proved. In this paper, we will review the progress in understanding the relationship between fucosylation in the intestinal mucosa and IBD.
- Citation: Chen X, Li GX, Fang JH, Xu SN, Gao YF, Sun YT. Fucosylation in the intestinal mucosa and inflammatory bowel disease. Shijie Huaren Xiaohua Zazhi 2020; 28(18): 920-924
- URL: https://www.wjgnet.com/1009-3079/full/v28/i18/920.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i18.920
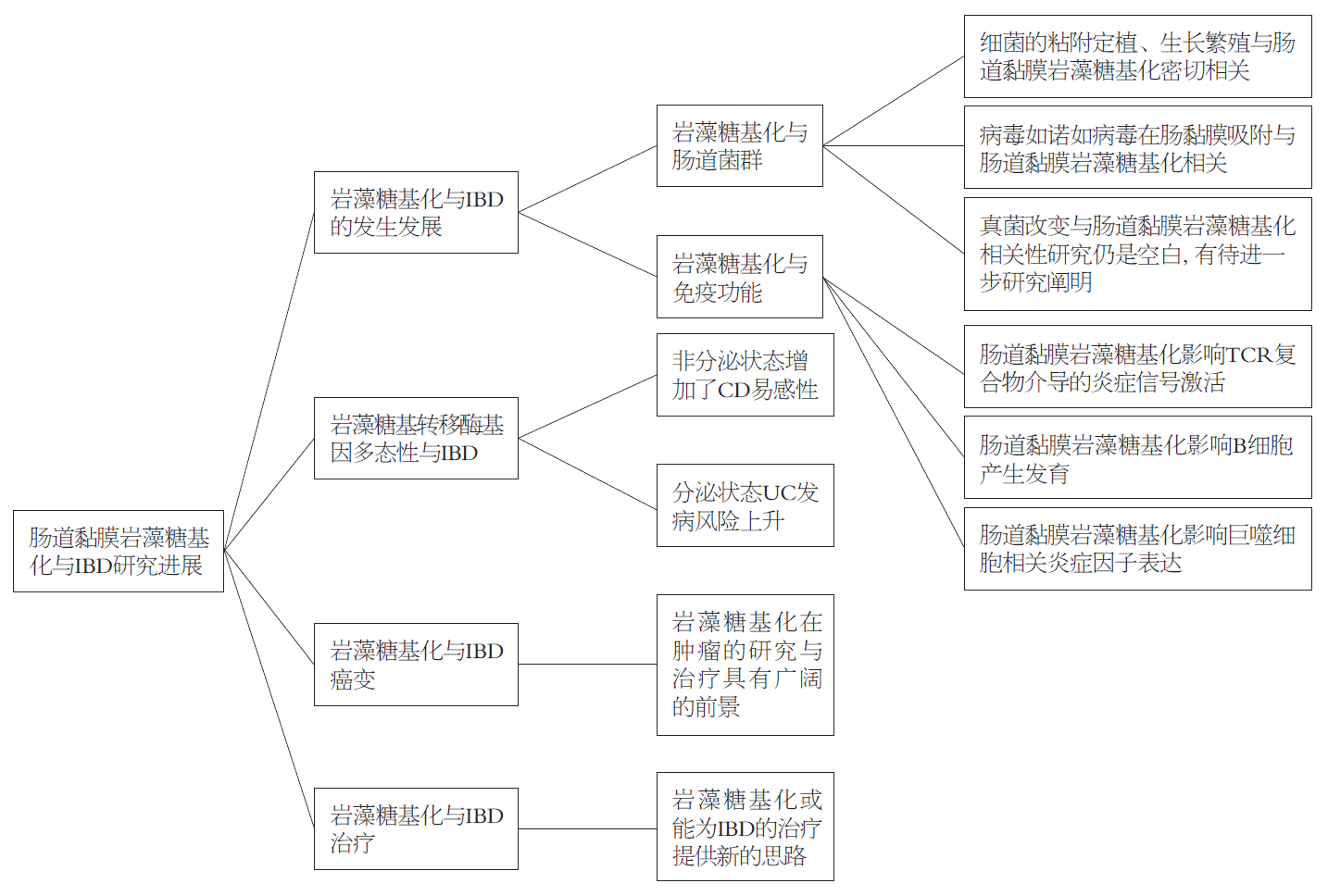
炎症性肠病(inflammatory bowel disease, IBD), 包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD), 是肠道菌群失衡等因素作用于遗传易感者后, 肠道黏膜发生的慢性炎症反应. 我国的IBD发病率呈逐年上升趋势[1]. 肠道黏膜岩藻糖基化, 即在岩藻糖基转移酶(fucosyltransferases, FUTs)的调控下, 将岩藻糖以活化的单体形式(鸟苷二磷酸-岩藻糖)转移到肠道蛋白质上形成聚糖链的过程. 肠道黏膜岩藻糖基化被发现能影响蛋白质的生物学功能, 并参与宿主微生物相互作用、受体激活、信号转导等诸多重要生命进程. 目前发现有两类FUTs被发现与IBD密切相关, 第一类为FUT2和FUT3, 特异催化人类组织血型抗原(histo-blood group antigens, HBGA)的形成; 第二类为FUT8, 能将岩藻单糖连接到蛋白质天冬酰胺的NH2自由基上, 这一过程被称为"核心岩藻糖基化". 本文就肠道黏膜岩藻糖基化与IBD研究进展作一综述(图1).
目前医学界普遍认为, IBD是针对自身肠道菌群的异常免疫反应性疾病. 肠道菌群改变、炎症信号异常激活及持续的异常免疫反应与IBD的发生发展密切相关. 岩藻糖基化作为蛋白质翻译后修饰的一种形式, 在近年来逐渐成为研究的热点, 它的研究进展给阐释IBD的发生发展提供了新的思路.
肠道微生态环境中生存着100万亿微生物, 包括细菌、真菌、病毒等, 这些微生物统称为肠道菌群. 肠道菌群分布于在肠道黏液外层, 内黏液层将肠道菌群与肠道黏膜分隔开, 使肠道菌群不与肠道上皮细胞直接接触. 肠道上皮细胞蛋白质岩藻糖基化异常可使肠道菌群及其产物的代谢发生改变, 导致上皮细胞功能损伤, 使正常或已发生紊乱的黏膜免疫系统过度暴露于肠道微生物中, 促进黏膜异常免疫反应, 在IBD发生发展中扮演着重要作用. 头孢曲松治疗72 d后的雄性Wistar大鼠(140-160 g)肠道黏膜岩藻糖基化水平较治疗前降低3.1倍, 沙门氏菌、弯曲杆菌、侵袭性大肠杆菌等致病菌感染率升高[2]. 肠道黏膜的岩藻糖基不仅可作为肠道菌群与肠壁的结合位点, 更能为某些菌群的生长繁殖提供碳源, 其能维持肠道菌群稳态, 为肠道功能的正常运转奠定基础. 研究发现, 非产肠毒素脆弱类杆菌群可将肠道黏蛋白侧链的岩藻糖基作为碳源进行新陈代谢, 更好地适应肠道环境; 空肠弯曲杆菌、绿脓杆菌、大肠杆菌可与肠道上皮细胞蛋白质侧链的岩藻糖基特异性结合, 将其限制在肠道黏液外层, 避免异位感染; 多形拟杆菌可利用肠道黏蛋白侧链的岩藻糖基合成细胞壁, 促进其生长及增殖[3,4]. 肠道黏膜岩藻糖基化可促进白细胞介素-22 (interleukin-22, IL-22)的表达. IL-22过表达可进一步诱导幼龄生物肠道组织发育成熟及抗菌肽的产生. 这两者可抑制有害菌侵染及繁殖. 如在肠道相关淋巴组织的派伊尔氏结中, 遏制产碱菌全身性传播及分节丝状菌的生长增殖, 避免肠道炎症反应的产生[5]. Pham等[6]通过对FUT2缺陷型(Fut2-/-)及同窝(Fut2+/+)小鼠的粪便进行微生物群落分析后, 发现FUT2缺陷型(Fut2-/-)小鼠粪便中大肠杆菌、梭状芽孢杆菌和类杆菌数量明显增加, 而双歧杆菌、乳酸菌数量显著减少.
许多研究表明, 肠道菌群改变与IBD发生发展密切相关. 有学者将IBD患者粪便样本与健康对照组粪便样本进行对比发现, IBD患者粪便标本中沙门氏菌、弯曲杆菌、侵袭性大肠杆菌、艰难梭菌等致病菌感染率较健康对照组显著增加, 其中艰难梭菌感染的IBD患者疾病进展更迅速且预后更差[7,8]. 尽管肠道内真菌及病毒数量仅占肠道菌群的很小一部分, 研究发现真菌改变及病毒感染与IBD发生发展有关. Li等[9]对19名活动性CD患者和7名健康人的肠道黏膜真菌微生物群进行统计分析后, 发现活动性CD患者肠道炎症黏膜的真菌丰富度及多样性明显高于非炎症黏膜, 真菌成分发生了显著改变, 念珠菌、交链孢菌和新生隐球菌比例明显增加. 近年来, IBD合并巨细胞病毒(cytomegalovirus, CMV)感染病例逐渐增多, 大量研究显示病毒感染尤其是CMV感染的IBD患者较未感染者病情进展更迅速且预后不良[10]. 肠道黏膜岩藻糖基化能促进人诺如病毒的吸附及繁殖, 在人诺如病毒在人群中的流行起重要促进作用[11]. 血清a-L-岩藻糖苷酶(α-L-Fucosidase, AFU)对乙型肝炎病毒的感染同样起促进作用. 但真菌改变与肠道黏膜岩藻糖基化相关性研究仍是空白, 有待进一步研究阐明.
核心岩藻糖基化作为岩藻糖基化的一种重要类型, 由FUT8特异催化, 可通过调节T细胞、B细胞、巨噬细胞等免疫细胞功能在肠道免疫耐受的维持发挥着重要作用. Shinzaki等[12]对FUT8基因缺陷小鼠的分析表明, FUT8缺陷小鼠较FUT8正常小鼠的结肠炎症得到明显改善, 进一步研究发现FUT8基因缺陷小鼠肠道黏膜T细胞受体(T cell receptor, TCR)缺乏核心岩藻糖基化, 导致TCR复合物在细胞膜脂质中的运输受阻, TCR介导的炎症信号无法激活. Fujii等[13,14]通过三硝基苯酚(trinitrophenol, TNP)及脂多糖(lipopolysaccharide, LPS)诱导FUT8缺陷型(Fut8-/-)小鼠和同窝(Fut8+/+)小鼠产生结肠炎的实验, 发现FUT8缺陷型(Fut8-/-)小鼠较同窝(Fut8+/+)小鼠炎症程度明显减轻. 他们认为这是FUT8缺陷型(Fut8-/-)小鼠的Toll样受体4 (toll-like receptor 4, TLR4)缺乏核心岩藻糖基化, TLR4介导的炎症信号传导受到抑制, 巨噬细胞相关炎症因子如诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、白细胞介素1β (interleukin-1β, IL-1β)和肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)表达减少导致. 所以FUT8缺陷可导致TCR介导的信号转导减弱, 炎症因子表达减少, 避免了肠道炎症的进展. 核心岩藻糖基化对B细胞同样有重要的调节作用. 前B细胞抗原受体的形成发育需要以N46糖基核心岩藻糖基化为前提, 当FUT8缺失, N46糖基核心岩藻糖基化修饰障碍, 前B抗原细胞受体无法形成, 其介导的信号通路传导受阻, 前B细胞增殖发育异常, B细胞克隆能力明显下降. 研究发现FUT3功能障碍时, 路易斯寡糖A (sialyl lewis A, SLe A)表达增加, 多形核白细胞(polymorphonuclear leukocyte, PMN)跨肠上皮迁移失调, PMN在肠道黏膜隐窝中聚集, 对IBD的发生发展起促进作用[15]. 肠道免疫细胞可称为肠道黏膜的监视系统, 对肠道菌群及抗原进行识别并作出不同的反应. 肠上皮细胞的岩藻糖基化可通过调节Ⅲ型先天淋巴细胞(innate lymphoid cells 3, ILC3)产生IL-22, 介导肠粘膜免疫屏障功能和抗微生物宿主防御机制, 限制辅助性T细胞17 (helper T cells 17, TH17)介导的结肠炎[4]. 综上所述, 肠道黏膜岩藻糖基化能通过对机体信号通路、免疫系统产生影响, 引发、维持或者缓解肠道炎症.
在大约20%的人群中, HBGA无法在肠道黏膜上皮细胞及分泌液中检测到, 这组人群被称为非分泌者. 非分泌者不分泌岩藻糖阳性抗原, 且缺乏岩藻糖基化, 其肠道菌群结构不同于分泌者. 非分泌型者粪便中双歧杆菌的多样性和丰度显著降, 放线菌也明显减少, 菌群结构更接近CD患者. FUT2编码基因位于人染色体19q13.3, 由两个外显子组成, 第二个外显子处发生的两个单核苷酸多态性(single nucleotide polymorphisms, SNP)是导致非分泌状态的主要原因. 国际炎症性肠病遗传学联盟(international inflammatory bowel disease genetics consortium, IIBDGC)对896例白种人CD患者和3204例健康对照者进行全基因组关联研究(genome-wide association studies, GWAS)后, 发现FUT2位点失活突变导致的非分泌者对于CD易感性明显增加[16]. 刘进等[17]对3682例IBD患者(UC1852例, CD1830例)进行FUT2基因多态性与IBD易感性Meta分析, 发现亚洲人群中FUT2基因多态性与CD易感性密切相关, FUT2基因A385T位点及G428A位点纯合突变导致的非分泌状态增加了CD易感性. 日本学者的研究也支持这一结果: 即缺乏HBGA表达的非分泌者CD患病率明显高于分泌者, 认为HBGA异常表达可能为CD发生所必须且独立的影响因素[18]. 一项对中国汉族和维吾尔族的小样本研究发现FUT2基因中有三个单核苷酸位点多态性(rs281377、rs1047781和rs601338)与UC易感性相关[19]. 芬兰人群研究报告也显示: 芬兰人群中HBGA表达正常的分泌者UC发病风险较非分泌者高[20].
IBD患者病情反复发作, 肠壁破坏与修复交替进行, 其病变肠道癌变率较常人明显增加, 其中以结直肠癌(colorectal cancer, CRC)发病率增加最为显著. 研究发现UC患者10年、20年、30年癌变率分别为2%、8%、18%, CD患者癌变率也较普通人群高2-3倍[21]. Wang等[22]研究发现岩藻糖基化缺乏导致的转录抑制因子HES1缺失与CRC的发生相关. 长链非编码RNA (long noncoding RNA, LncRNA) HOTAIR可通过调节CD44的α1, 3-岩藻糖基化触发PI3K/AKT/mTOR通路, 从而介导CRC的发生和肝转移[23]. 核心岩藻糖基化可通过调节寡糖加工及E-钙粘蛋白更新为癌细胞粘附提供一定帮助. FUT8高度表达的CRC患者核心岩藻糖基化表达水平显著升高, 其生存率较低度或无表达者要低[24]. 大部分CRC患者肿瘤细胞中都存在岩藻糖基化异常, 因此岩藻糖基化在肿瘤研究及治疗具有广阔的前景, 或能成为预测性生物标记物和潜在治疗靶点.
越来越多的研究提示肠道黏膜岩藻糖基化异常导致的免疫功能障碍及肠道菌群失衡在IBD患者的肠道中普遍存在, 对于疾病的发生发展有着潜在的影响, 这给IBD的治疗提供了新的思路. 皮质类固醇、钙调神经磷酸酶抑制剂、硫嘌呤等免疫调节剂和抗肿瘤坏死因子抗体等免疫抑制剂可缓解IBD的许多临床症状. 抗肿瘤坏死因子抗体Fc区通过影响巨噬细胞极化而具有免疫抑制特性. 研究发现抗肿瘤坏死因子Fc区域的核心岩藻糖能增加与Fcγ受体之间的相互作用, 形成更多的CD206+巨噬细胞, 降低T细胞增殖水平, 使抗肿瘤坏死因子抗体在降低结肠炎严重程度方面更有效[25]. 在葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导小鼠结肠炎模型中, 移植Fut8-/-骨髓细胞小鼠较移植Fut8+/+骨髓细胞小鼠, 具有更强的抗炎能力[20]. IBD患者肠组织T细胞受体上的核心岩藻糖基化水平与IBD的病情严重程度和病程明显相关, 通过调节核心岩藻糖基化水平可以改变T细胞的功能, 这可能作为一种治疗IBD策略[9]. 目前肠道微生态制剂已经被写入IBD治疗的临床指南, 但是诸如粪便移植等仍然存在争议. 通过调节岩藻糖基化改善肠道菌群结构的相关研究也较少, 或能成为以后新的研究方向.
肠道黏膜岩藻糖基化参与了SLe A介导的白细胞外渗、宿主微生物相互作用、免疫调节及炎症因子表达, 并与肿瘤细胞增殖、侵袭、转移及免疫逃逸有关. FUT2和FUT3功能障碍导致的非分泌状态会增加CD的易感性, 而UC却恰恰相反, 分泌状态增加了UC易感性. FUT8的过度表达会促进B细胞产生发育、TCR复合物介导的炎症信号激活、巨噬细胞相关炎症因子表达, 导致IBD过度炎症反应. 肠道黏膜岩藻糖基化给阐明IBD发病机制, 寻找敏感度、特异度更高的诊疗标志物提供了新的方向, 针对岩藻糖基化来治疗IBD 将成为可能. 我们寄希望将有更多的研究能够从分子、细胞、组织、个体等多个层次深入分析研究岩藻糖基化在IBD发生发展过程中的作用, 使众多的IBD患者受益.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Li X, Song P, Li J, Tao Y, Li G, Li X, Yu Z. The Disease Burden and Clinical Characteristics of Inflammatory Bowel Disease in the Chinese Population: A Systematic Review and Meta-Analysis. Int J Environ Res Public Health. 2017;14. [PubMed] [DOI] |
| 2. | Holota YV, Olefir YA, Dovbynchuk TV, Tolstanova GM. Carbohydrate composition of rat intestine surface mucus layer after ceftriaxone treatment. Ukr Biochem J. 2016;88:35-44. [PubMed] [DOI] |
| 3. | Day CJ, Tiralongo J, Hartnell RD, Logue CA, Wilson JC, von Itzstein M, Korolik V. Differential carbohydrate recognition by Campylobacter jejuni strain 11168: influences of temperature and growth conditions. PLoS One. 2009;4:e4927. [PubMed] [DOI] |
| 5. | Goto Y, Kurashima Y, Kiyono H. [Roles of the gut mucosal immune system in symbiosis and immunity]. Rinsho Ketsueki. 2015;56:2205-2212. [PubMed] [DOI] |
| 6. | Pham TA, Clare S, Goulding D, Arasteh JM, Stares MD, Browne HP, Keane JA, Page AJ, Kumasaka N, Kane L, Mottram L, Harcourt K, Hale C, Arends MJ, Gaffney DJ; Sanger Mouse Genetics Project, Dougan G, Lawley TD. Epithelial IL-22RA1-mediated fucosylation promotes intestinal colonization resistance to an opportunistic pathogen. Cell Host Microbe. 2014;16:504-516. [PubMed] [DOI] |
| 7. | Lobatón T, Domènech E. Bacterial Intestinal Superinfections in Inflammatory Bowel Diseases Beyond Clostridum difficile. Inflamm Bowel Dis. 2016;22:1755-1762. [PubMed] [DOI] |
| 9. | Li Q, Wang C, Tang C, He Q, Li N, Li J. Dysbiosis of gut fungal microbiota is associated with mucosal inflammation in Crohn's disease. J Clin Gastroenterol. 2014;48:513-523. [PubMed] [DOI] |
| 10. | McCurdy JD, Enders FT, Khanna S, Bruining DH, Jones A, Killian JM, Tariq R, Smyrk TC, Loftus EV. Increased Rates of Clostridium difficile Infection and Poor Outcomes in Patients with IBD with Cytomegalovirus. Inflamm Bowel Dis. 2016;22:2688-2693. [PubMed] [DOI] |
| 12. | Shinzaki S, Iijima H, Fujii H, Kamada Y, Naka T, Takehara T, Miyoshi E. A novel pathogenesis of inflammatory bowel disease from the perspective of glyco-immunology. J Biochem. 2017;161:409-415. [PubMed] [DOI] |
| 13. | Fujii H, Shinzaki S, Iijima H, Wakamatsu K, Iwamoto C, Sobajima T, Kuwahara R, Hiyama S, Hayashi Y, Takamatsu S, Uozumi N, Kamada Y, Tsujii M, Taniguchi N, Takehara T, Miyoshi E. Core Fucosylation on T Cells, Required for Activation of T-Cell Receptor Signaling and Induction of Colitis in Mice, Is Increased in Patients With Inflammatory Bowel Disease. Gastroenterology. 2016;150:1620-1632. [PubMed] [DOI] |
| 14. | Nakayama K, Wakamatsu K, Fujii H, Shinzaki S, Takamatsu S, Kitazume S, Kamada Y, Takehara T, Taniguchi N, Miyoshi E. Core fucose is essential glycosylation for CD14-dependent Toll-like receptor 4 and Toll-like receptor 2 signalling in macrophages. J Biochem. 2019;165:227-237. [PubMed] [DOI] |
| 15. | Brazil JC, Liu R, Sumagin R, Kolegraff KN, Nusrat A, Cummings RD, Parkos CA, Louis NA. α3/4 Fucosyltransferase 3-dependent synthesis of Sialyl Lewis A on CD44 variant containing exon 6 mediates polymorphonuclear leukocyte detachment from intestinal epithelium during transepithelial migration. J Immunol. 2013;191:4804-4817. [PubMed] [DOI] |
| 16. | McGovern DP, Jones MR, Taylor KD, Marciante K, Yan X, Dubinsky M, Ippoliti A, Vasiliauskas E, Berel D, Derkowski C, Dutridge D, Fleshner P, Shih DQ, Melmed G, Mengesha E, King L, Pressman S, Haritunians T, Guo X, Targan SR, Rotter JI; International IBD Genetics Consortium. Fucosyltransferase 2 (FUT2) non-secretor status is associated with Crohn's disease. Hum Mol Genet. 2010;19:3468-3476. [PubMed] [DOI] |
| 18. | Miyoshi J, Yajima T, Okamoto S, Matsuoka K, Inoue N, Hisamatsu T, Shimamura K, Nakazawa A, Kanai T, Ogata H, Iwao Y, Mukai M, Hibi T. Ectopic expression of blood type antigens in inflamed mucosa with higher incidence of FUT2 secretor status in colonic Crohn's disease. J Gastroenterol. 2011;46:1056-1063. [PubMed] [DOI] |
| 19. | Aheman A, Luo HS, Gao F. Association of fucosyltransferase 2 gene variants with ulcerative colitis in Han and Uyghur patients in China. World J Gastroenterol. 2012;18:4758-4764. [PubMed] [DOI] |
| 20. | Parmar AS, Alakulppi N, Paavola-Sakki P, Kurppa K, Halme L, Färkkilä M, Turunen U, Lappalainen M, Kontula K, Kaukinen K, Mäki M, Lindfors K, Partanen J, Sistonen P, Mättö J, Wacklin P, Saavalainen P, Einarsdottir E. Association study of FUT2 (rs601338) with celiac disease and inflammatory bowel disease in the Finnish population. Tissue Antigens. 2012;80:488-493. [PubMed] [DOI] |
| 21. | Chang M, Chang L, Chang HM, Chang F. Intestinal and Extraintestinal Cancers Associated With Inflammatory Bowel Disease. Clin Colorectal Cancer. 2018;17:e29-e37. [PubMed] [DOI] |
| 22. | Wang Y, Huang D, Chen KY, Cui M, Wang W, Huang X, Awadellah A, Li Q, Friedman A, Xin WW, Di Martino L, Cominelli F, Miron A, Chan R, Fox JG, Xu Y, Shen X, Kalady MF, Markowitz S, Maillard I, Lowe JB, Xin W, Zhou L. Fucosylation Deficiency in Mice Leads to Colitis and Adenocarcinoma. Gastroenterology. 2017;152:193-205.e10. [PubMed] [DOI] |
| 23. | Pan S, Liu Y, Liu Q, Xiao Y, Liu B, Ren X, Qi X, Zhou H, Zeng C, Jia L. HOTAIR/miR-326/FUT6 axis facilitates colorectal cancer progression through regulating fucosylation of CD44 via PI3K/AKT/mTOR pathway. Biochim Biophys Acta Mol Cell Res. 2019;1866:750-760. [PubMed] [DOI] |
| 24. | Noda M, Okayama H, Kofunato Y, Chida S, Saito K, Tada T, Ashizawa M, Nakajima T, Aoto K, Kikuchi T, Sakamoto W, Endo H, Fujita S, Saito M, Momma T, Ohki S, Kono K. Prognostic role of FUT8 expression in relation to p53 status in stage II and III colorectal cancer. PLoS One. 2018;13:e0200315. [PubMed] [DOI] |
| 25. | Bloemendaal FM, Levin AD, Wildenberg ME, Koelink PJ, McRae BL, Salfeld J, Lum J, van der Neut Kolfschoten M, Claassens JW, Visser R, Bentlage A, D'Haens GRAM, Verbeek JS, Vidarsson G, van den Brink GR. Anti-Tumor Necrosis Factor With a Glyco-Engineered Fc-Region Has Increased Efficacy in Mice With Colitis. Gastroenterology. 2017;153:1351-1362.e4. [PubMed] [DOI] |