修回日期: 2020-07-01
接受日期: 2020-07-15
在线出版日期: 2020-08-28
肿瘤的发生发展与其微循环血供、高迁移率族蛋白B1(high mobility group box protein 1, HMGB1)表达水平等因素关系密切. 术前准确预测原发性肝细胞癌(hepatocellular carcinoma, HCC)的微血管侵犯(microvascular invasion, MVI)情况有着重要临床意义.
运用超声造影定量分析HCC的血流量特征, 探讨其与血清HMGB1及MVI的相关性.
选取在我院行手术切除的78例HCC患者作为研究对象. 根据术后病理结果分为: 微血管侵犯组(45例)和无微血管侵犯组(33例). 所有患者均在术前3 d内行超声造影检查, 运用时间-强度曲线测定HCC增强强度(enhancement intensity, EI)、曲线下面积(area under the curve, AUC). 采用酶联免疫吸附法测定患者血清HMGB1水平及血管内皮生长因子 (vascular endothelial growth factor, VEGF)水平. 术后测定组织标本的微血管密度(microvessel density, MVD). 分析EI、AUC与血清HMGB1水平的相关性.
微血管侵犯组EI、AUC均明显高于无微血管侵犯组, 差异有统计学意义(P<0.05); 微血管侵犯组血清HMGB1水平、VEGF水平以及MVD明显高于无微血管侵犯组, 差异有统计学意义(P<0.05); EI、AUC分别与血清HMGB1水平呈正相关(r = 0.729, r = 0.759, P<0.05).
超声造影能定量分析HCC血流量状态, 其血流量参数与血清HMGB1水平相关性良好, 可为临床术前无创性评估HCC微血管侵犯提供有价值的参考.
核心提要: 超声造影是一种能实时动态反映肿瘤微循环血流状态的超声新技术. 运用超声造影定量分析原发性肝细胞癌(hepatocellular carcinoma, HCC)血流动力学特征, 结合血清高迁移率族蛋白B1表达水平, 以期为临床无创性评估HCC微血管侵犯情况提供参考.
引文著录: 黄晓昳, 李浩. 原发性肝细胞癌血流量与血清高迁移率族蛋白B1及微血管侵犯相关性的初步研究. 世界华人消化杂志 2020; 28(16): 807-812
Revised: July 1, 2020
Accepted: July 15, 2020
Published online: August 28, 2020
The occurrence and development of tumors are closely related to microcirculation and high mobility group box protein 1 (HMGB1) expression levels. It is very important to predict the microvascular invasion (MVI) of hepatocellular carcinoma (HCC) before operation.
To quantitatively analyze the blood flow characteristics of HCC by contrast-enhanced ultrasound (CEUS), and to explore the correlation of the blood flow with HMGB1 and MVI.
Seventy-eight patients with HCC who underwent surgical resection were included. According to the postoperative pathological results, the patients were divided into either an MVI group (45 cases) or a non-MVI group (33 cases). All patients underwent CEUS 3 d before operation. The enhancement intensity (EI) and area under the curve (AUC) in HCC were measured by time-intensity curve analysis. Serum HMGB1 and vascular endothelial growth factor (VEGF) were measured by enzyme-linked immunosorbent assay. Microvessel density was measured after operation. The correlation between EI, AUC, and serum HMGB1 was analyzed.
EI and AUC in the MVI group were significantly higher than those in the non-MVI group (P < 0.05). Serum HMGB1 and VEGF were significantly higher than those of the non-MVI group (P < 0.05). EI and AUC were positively correlated with serum HMGB1 (r = 0.729 and 0.759, P < 0.05).
CEUS can quantitatively analyze the blood flow in HCC, and its blood flow parameters have a good correlation with serum HMGB1, which can provide reference for noninvasive assessment of MVI before operation.
- Citation: Huang XY, Li H. Correlation of blood flow in hepatocellular carcinoma with serum high mobility group box protein 1 and microvascular invasion: A preliminary study. Shijie Huaren Xiaohua Zazhi 2020; 28(16): 807-812
- URL: https://www.wjgnet.com/1009-3079/full/v28/i16/807.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i16.807
原发性肝细胞癌(hepatocellular carcinoma, HCC)在我国有着较高发病率及病死率, 其起病隐匿, 早期症状不明显, 症状出现时往往处于晚期, 病情进展恶化迅速[1]. 早期评估其微血管侵犯(microvascular invasion, MVI)状态, 有助于制定合适治疗方案及改善预后[2]. 近年研究显示高迁移率族蛋白B1 (high mobility group box protein 1, HMGB1)与肿瘤的发生、发展密切相关[3]. 本研究运用超声造影定量分析HCC血流量特征, 并探讨其与血清HMGB1水平的相关性, 以期为临床术前无创性评估HCC微血管侵犯提供有价值的参考.
1.1.1 一般资料: 选择2019-02/2020-03期间, 在我院行手术切除治疗的78例HCC患者作为研究对象. 其中男61例, 女17例, 年龄 32-68岁, 平均51.65岁±10.69岁. 共计78个肿瘤, 最大直径1.65-7.64 cm, 平均4.29 cm±1.16 cm.
1.1.2 纳入标准: (1)均经病理证实为HCC; (2)均为单一肿瘤病灶; (3)首次行手术切除治疗.
1.1.3 排除标准: (1)影像学检查明确胆管、肝静脉、门静脉存在侵犯者; (2)肝外转移者; (3)术前曾行HCC干预治疗者. 根据术后病理结果分为: 微血管侵犯组(45例)和无微血管侵犯组(33例).
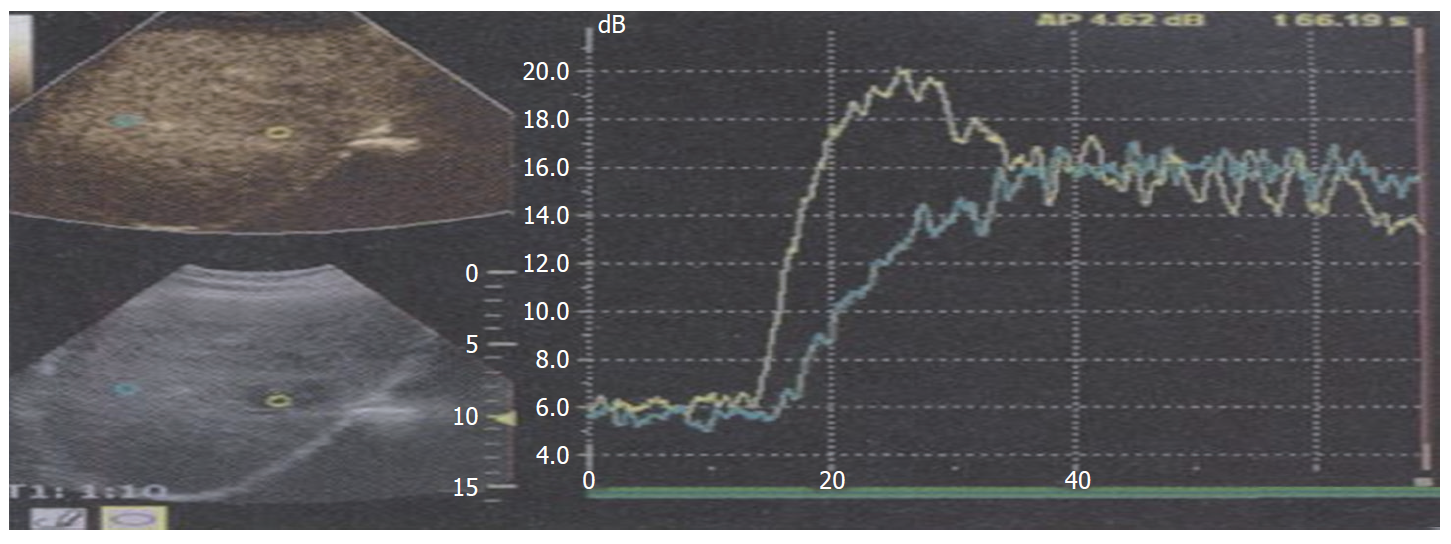
1.2.1 超声造影检查: 用Acuson S2000彩色超声诊断仪, 4C1探头, 频率4.0 MHz, 对比脉冲系列成像技术. 采用声诺维作为超声造影剂, 按说明书制备成混悬液备用. 首先行常规肝脏超声扫查, 观察病灶位置、大小、边界、内部回声、血流等情况. 在清楚显示病灶切面下, 启动超声造影模式, 经肘部浅静脉以团注法推注超声造影剂2.4 mL, 同步计时, 观察超声造影全过程并存储图像资料. 选取病灶作为感兴趣区, 系统自动绘制时间-强度曲线, 测量并记录血流量参数: 增强强度(enhancement intensity, EI)、曲线下面积(area under the curve, AUC). 超声造影由1名经验丰富的超声科副主任医师分析诊断. 见图1.
1.2.2 血清HMGB1、血管内皮生长因子以及病理学微血管密度测定: 术前, 清晨空腹状态, 抽取外周静脉血5 mL, 以 3000 r/min离心分离血清, 低温冰箱保存待测. 严格按照酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)检测血清HMGB1水平及血管内皮生长因子(vascular endothelial growth factor, VEGF)水平. 术后组织标本行甲醛固定、常规石蜡包埋、病理切片, 采用ElivisionTM二步法免疫组化染色, 按照Weidner等[4]的方法测定微血管密度(microvessel density, MVD).
统计学处理 采用SPSS 20.0统计学软件处理数据, 计量资料表示为mean±SD, 两组间比较采用独立样本t检验, 多组间比较采用方差分析. 两变量间相关性采用Pearson相关分析. 以病理结果作为金标准, 运用受试者工作特征曲线(receiver operating characteristic, ROC)分析超声造影参数判定HCC微血管侵犯的诊断效能. P<0.05为差异有统计学意义.
微血管侵犯组EI、AUC均明显高于无微血管侵犯组, 差异有统计学意义(P<0.05). 见表1.
| 组别 | EI (dB) | AUC |
| 微血管侵犯组 | 26.59±4.15 | 1370.04±245.58 |
| 无微血管侵犯组 | 20.85±3.80 | 914.09±172.37 |
| t/P值 | 6.252/0.000 | 9.135/0.000 |
微血管侵犯组血清HMGB1水平明显高于无微血管侵犯组, 差异有统计学意义(P<0.05); 微血管侵犯组血清VEGF水平明显高于无微血管侵犯组, 差异有统计学意义(P<0.05); 微血管侵犯组微MVD明显高于无微血管侵犯组, 差异有统计学意义(P<0.05). 见表2.
| 组别 | HMGB1 (ng/mL) | VEGF (pg/mL) | MVD (条/200倍视野) |
| 微血管侵犯组 | 122.89±32.23 | 370.50±77.74 | 91.72±21.49 |
| 无微血管侵犯组 | 89.88±23.07 | 212.56±58.94 | 65.27±18.11 |
| t/P值 | 5.013/0.000 | 9.783/0.000 | 5.731/0.000 |
随着HCC病理分化程度下降, 其EI、AUC, 血清HMGB1, VEGF水平升高, 即高分化HCC的EI、AUC, 血清HMGB1水平, 血清VEGF水平<中分化HCC<低分化HCC, 各组间比较差异均有统计学意义(P<0.05). 见表3.
| 病理分级 | 例 | EI (dB) | AUC | HMGB1 (ng/mL) | VEGF (pg/mL) |
| 高分化 | 24 | 18.86±1.59 | 848.75±148.87 | 77.34±10.91 | 192.01±43.70 |
| 中分化 | 18 | 23.43±1.70 | 1060.83±158.86 | 105.01±13.27 | 281.76±42.29 |
| 低分化 | 36 | 28.07±3.95 | 1454.22±199.87 | 131.94±32.63 | 389.08±76.93 |
| F/P值 | 75.642/0.000 | 106.688/0.000 | 40.398/0.000 | 76.010/0.000 |
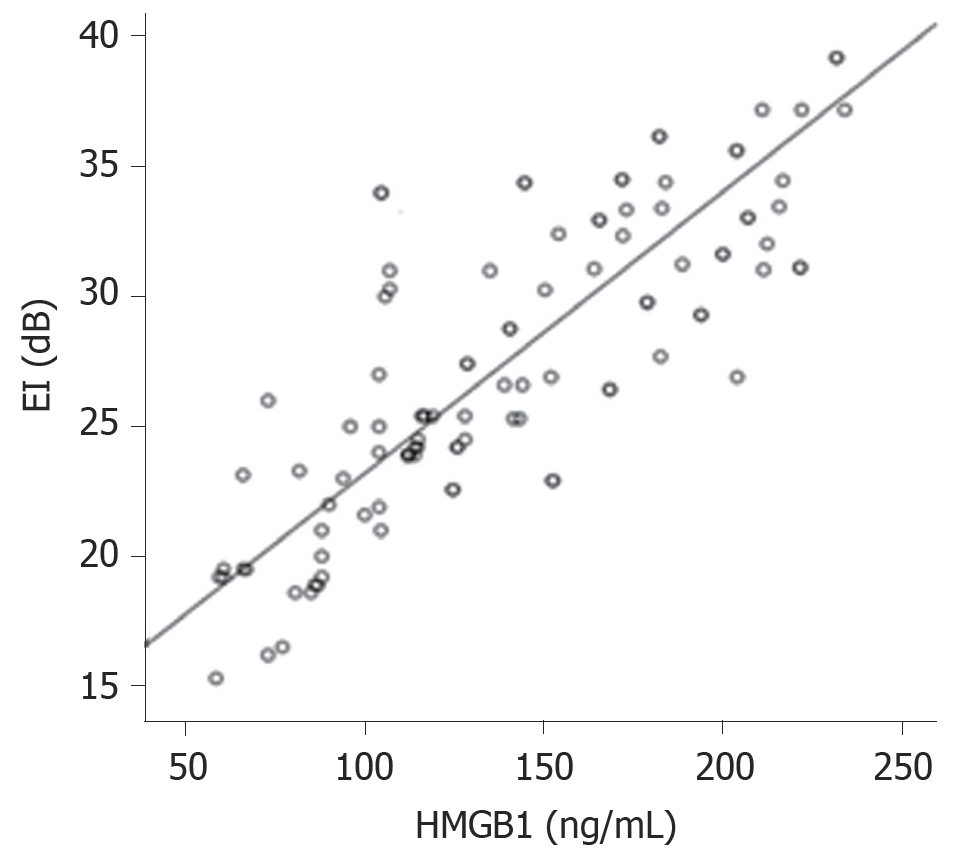
EI与血清HMGB1水平呈正相关(r = 0.729, P<0.05); AUC与血清HMGB1水平呈正相关(r = 0.759, P<0.05). 见图2、3. EI, AUC 分别与血清VEGF水平呈正相关(r = 0.801, r = 0.833, P<0.05), 血清HMGB1水平与血清VEGF水平呈正相关(r = 0.706, P<0.05).
EI判定HCC微血管侵犯的ROC AUC为0.784, 临界值为23.75 (dB), 灵敏度为80.23%, 特异度为76.80%, 95%CI为0.735-0.833. AUC判定HCC微血管侵犯的ROC AUC为0.738, 临界值为1184.58, 灵敏度为81.30%, 特异度为72.00%, 95%CI为0.685-0.791.
HCC是一种富血供肝脏恶性肿瘤, 其恶性生物学行为以血管新生作为基础, 血管新生是其发生、发展以及转移的关键因素[5]. 大量研究表明VEGF在HCC血管生成中发挥着十分重要的作用, 致使其病理组织中微血管密度增高[6]. 本研究结果显示, 微血管侵犯组血清VEGF水平以及MVD明显高于无微血管侵犯组(P<0.05). 证实了VEGF表达与HCC血管生成密切相关. HCC异常表达VEGF, 促使病灶组织微小血管大量生成, 流经病灶组织的血流量增多, 反映了其转移侵袭能力的增强. 超声造影作为一种全新的无创性微循环血流监测手段, 可动态实时观察肿瘤组织血流灌注状态并对其作定量分析[7]. 本研究结果显示, 微血管侵犯组EI、AUC均明显高于无微血管侵犯组(P<0.05), 进一步提示HCC的转移侵袭能力与其血流供应量关系密切. 随着HCC血流量的增加, 有效保证了其发展转移所需的营养物质, 加速了其向周围组织血管转移侵袭的发生.
HMGB1是一种相对分子质量约为25×103的核蛋白, 包含着215个氨基酸残基[8]. HMGB1在肺癌、膀胱癌、乳腺癌、胃癌等肿瘤中呈高表达状态, 与肿瘤的发生发展密切相关. 孟玉娟等[9]研究发现肝癌患者的HMGB1表达水平明显高于肝脏良性病变患者和正常人. 周宝勇等[10]研究发现肝癌组织中HMGB1表达水平异常增高, 并与肿瘤的VEGF分泌和微血管生成过程密切相关. 本研究结果显示, 微血管侵犯组血清HMGB1水平明显高于无微血管侵犯组(P<0.05). 提示HMGB1表达水平与HCC微血管侵犯状态关系密切, 即HMGB1表达水平增加, HCC更容易发生微血管侵犯. HMGB1作为一种细胞凋亡抑制蛋白, 肝癌细胞通过主动分泌大量的HMGB1, 抑制肿瘤细胞凋亡, 促进肿瘤细胞发生发展, 而且HMGB1可通过调节基因组转录水平, 调控细胞基因表达, 促进肿瘤细胞发生迁移[11].
相关性分析结果显示, EI、AUC分别与血清HMGB1水平呈正相关(r = 0.729, r = 0.759, P<0.05). 提示HCC血流量增加, 其HMGB1表达水平随之上升, 肿瘤细胞更易发生转移侵袭. HCC逐步发生发展过程中, 在多种因子作用下肿瘤组织的血管结构、血流动力学不断发生变化, 即门静脉血供逐渐减少, 动脉血供逐渐增加, 同时血管新生形成大量微小血管网, 肿瘤侵蚀血管壁形成大量动静脉瘘, 致使肿瘤内血流量增加, 血流速度加快, 加速了肿瘤细胞向周围组织血管发生转移侵袭的进程.
总之, 超声造影能定量分析HCC血流量状态, 其血流量参数与血清HMGB1水平相关性良好, 可为临床术前无创性评估HCC微血管侵犯提供有价值的参考.
术前无创性评估原发性肝细胞癌(hepatocellular carcinoma, HCC)微血管侵犯情况, 有助于临床治疗和预后评估.
运用超声造影定量分析HCC血流量状态, 探讨其与血清高迁移率族蛋白B1 (high mobility group box protein 1, HMGB1)水平相关性, 间接评估HCC微血管侵犯情况.
本篇论文研究的主要目标是探讨HCC血流量状态与血清HMGB1水平、微血管侵犯的相关性. 结果显示超声造影能评估HCC血流量情况, 其血流量参数与血清HMGB1水平相关性良好, 能有效评估HCC微血管侵犯状态.
本篇论文为了达到目标采用了超声造影定量评估HCC血流量状态. 超声造影能定量分析病灶的微循环血供情况, 客观反映其血管新生状态.
本篇论文研究达到了实验目标, 研究结果显示微血管侵犯组增强强度(enhancement intensity, EI)、曲线下面积(area under the curve, AUC)、血清HMGB1水平、血管内皮生长因子(vascular endothelial growth factor, VEGF)水平以及微血管密度(microvessel density, MVD)明显高于无微血管侵犯组(P<0.05); EI、AUC分别与血清HMGB1水平呈正相关. 本研究结果说明超声造影能客观反映HCC血流量状态, 间接反映血清HMGB1水平, 可为临床术前无创性评估HCC微血管侵犯提供一种新方法.
HCC微血管侵犯与其血流量密切相关. 超声造影能为HCC的鉴别诊断提供参考, 同时能定量分析其血流量状态. 本研究采用超声造影测定HCC血流量状态, 分析其与血清HMGB1水平相关性, 间接评估HCC微血管侵犯状态. 本研究发现, 微血管侵犯组EI、AUC、血清HMGB1水平、血清VEGF水平以及MVD明显高于无微血管侵犯组; EI、AUC分别与血清HMGB1水平呈正相关, 提示超声造影可为临床术前无创性评估HCC微血管侵犯提供一种新方法.
肺部气体、肠道气体可对超声造影检查造成影响而导致结果发生偏差. 未来研究的方向为超声评估HCC微血管侵犯的临床应用价值, 最佳方法是采用超声造影判定HCC微血管侵犯.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | 雷 海科, 李 小升, 赵 玉兰, 何 美, 张 维, 周 宏, 吴 永忠. 原发性肝癌患者生存预后及影响因素分析(附3106例报告). 中华消化外科杂志. 2020;19:179-184. [DOI] |
| 3. | 陈 建安, 陈 思玉, 刘 丽文, 朱 威威, 陈 晓龙, 余 炎, 何 玉婷, 孙 冉冉, 任 志刚, 李 娟, 崔 光莹, 余 祖江. 高迁移率族蛋白1在肝癌组织中的表达及对肝癌细胞生物学活性的影响. 郑州大学学报:医学版. 2019;54:14-20. [DOI] |
| 4. | Weidner N. Angiogenesis in breast cancer. Cancer Treat Res. 1996;83:265-301. [PubMed] [DOI] |
| 5. | Couri T, Pillai A. Goals and targets for personalized therapy for HCC. Hepatol Int. 2019;13:125-137. [PubMed] [DOI] |
| 6. | Godin C, Bodeau S, Saidak Z, Louandre C, François C, Barbare JC, Coriat R, Galmiche A, Sauzay C. Early decrease in serum amphiregulin or vascular endothelial growth factor levels predicts sorafenib efficacy in hepatocellular carcinoma. Oncol Rep. 2019;41:2041-2050. [PubMed] [DOI] |
| 7. | Lee SM, Kim JH, Yang HK, Kang HJ, Han JK. Usefulness of contrast-enhanced ultrasound using perfluorobutanecontaining microbubbles as a planning for percutaneous biopsies of focal hepatic lesions: a prospective feasibility study. Med Ultrason. 2019;21:109-116. [PubMed] [DOI] |
| 8. | Khambu B, Huda N, Chen X, Antoine DJ, Li Y, Dai G, Köhler UA, Zong WX, Waguri S, Werner S, Oury TD, Dong Z, Yin XM. HMGB1 promotes ductular reaction and tumorigenesis in autophagy-deficient livers. J Clin Invest. 2018;128:2419-2435. [PubMed] [DOI] |
| 9. | 孟 玉娟, 张 国强, 费 睿成, 王 静, 亓 民. 研究肝细胞肝癌(HCC)患者血清高迁移率族蛋白B1(HMGB1)水平变化及临床意义. 中外医疗. 2016;33:67-68. [DOI] |
| 11. | Kang R, Chen R, Zhang Q, Hou W, Wu S, Cao L, Huang J, Yu Y, Fan XG, Yan Z, Sun X, Wang H, Wang Q, Tsung A, Billiar TR, Zeh HJ, Lotze MT, Tang D. HMGB1 in health and disease. Mol Aspects Med. 2014;40:1-116. [PubMed] [DOI] |