修回日期: 2020-07-13
接受日期: 2020-07-15
在线出版日期: 2020-08-28
肠易激综合征(irritable bowel syndrome, IBS)为功能性胃肠病, 目前机制不清. 新近研究表明低度炎症在其发生发展中起重要作用, 然而IBS确切炎症标志物是什么, 非特异性炎症标志物超敏C反应蛋白(hypersensitive C-reactive protein, hs-CRP)与IBS的诊断和分型之间有何关联均不清楚.
探讨罗马IV标准下非特异性炎症标志物hs-CRP在不同亚型IBS中的表达及其与炎症因子的关联.
选取2017-01/2019-01期间在扬州大学附属医院及江苏省苏北人民医院就诊的IBS患者177例及同时期体检的正常对照174例作为研究对象, 分别采用免疫透射比浊法和酶联免疫吸附法对其血清hs-CRP和肿瘤坏死因子α (tumor necrosis factor-alpha, TNFα)的表达进行检测.
与健康对照相比, IBS患者血清TNFα、hs-CRP水平均显著增高(P<0.001); 在5种不同的IBS亚型中, 感染后IBS (postinfectious irritable bowel syndrome, PI-IBS)和腹泻型IBS (diarrhea-predominant irritable bowel syndrome, IBS-D) 组血清TNFα和hs-CRP水平较其他三种亚型显著增高(P<0.001); 并且IBS-D组(P<0.001)和PI-IBS组(P<0.05)血清hs-CRP水平与TNFα水平呈显著正相关, 相关系数分别为0.814和0.432.
Hs-CRP可能可以作为潜在的炎症标志物用于IBS-D和PI-IBS的辅助诊断和治疗.
核心提要: 本研究通过探讨罗马IV诊断标准下非特异性炎症标志物超敏C反应蛋白(hypersensitive C-reactive protein, hs-CRP)在5种不同亚型肠易激综合征(irritable bowel syndrome, IBS)中的表达及其与炎症因子的关联, 提示hs-CRP可能可以作为潜在的炎症标志物用于腹泻型IBS和感染后IBS的辅助诊断和治疗.
引文著录: 张瑜, 张露, 李双, 吴夏鑫, 毕雅昕, 胡旭, 陈雨晴, 袁媛. 超敏C反应蛋白在不同亚型肠易激综合征的表达及其与炎症因子的相关性. 世界华人消化杂志 2020; 28(16): 782-788
Revised: July 13, 2020
Accepted: July 15, 2020
Published online: August 28, 2020
Irritable bowel syndrome (IBS) is a functional gastrointestinal disorder, and the pathogenetic mechanism is still not clear at present. Recent studies have shown that low-grade inflammation plays important roles in the occurrence and progression of IBS. However, the exact inflammatory markers of IBS and the relationship between the non-specific inflammatory marker hypersensitive C-reactive protein (hs-CRP) and the diagnosis and classification of IBS are not clear.
To investigate the serum levels of hs-CRP, a non-specific inflammatory marker, and tumor necrosis factor-alpha (TNF-α) in different subtypes of IBS and their correlation under Rome IV criteria.
One hundred and seventy-seven IBS patients who were treated at the Affiliated Hospital of Yangzhou University and Subei People's Hospital and 174 normal controls who received physical examinations at the same hospitals from January 2017 to January 2019 were selected as subjects in this study. The levels of hs-CRP and TNF-α in serum of the subjects were detected by transmittance turbidity method and enzyme-linked immunosorbent assay, respectively.
The serum levels of TNF-α and hs-CRP in IBS patients were significantly higher than those in healthy controls (P < 0.001). Among five different IBS subtypes, the levels of TNF-α and hs-CRP in the postinfectious irritable bowel syndrome (PI-IBS) and diarrhea-predominant irritable bowel syndrome (IBS-D) groups were significantly higher than those in the other three subtypes (P < 0.001). Hs-CRP levels were positively correlated with the levels of TNF-α in the IBS-D (P < 0.001) and PI-IBS groups (P < 0.05), and the correlation coefficients were 0.814 and 0.432, respectively.
Hs-CRP may be used as a potential inflammatory marker for the diagnosis and treatment of IBS-D and PI-IBS.
- Citation: Zhang Y, Zhang L, Li S, Wu XX, Bi YX, Hu X, Chen YQ, Yuan Y. Serum levels of high sensitive C-reactive protein and tumor necrosis factor-alpha in different subtypes of irritable bowel syndrome and their correlation. Shijie Huaren Xiaohua Zazhi 2020; 28(16): 782-788
- URL: https://www.wjgnet.com/1009-3079/full/v28/i16/782.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i16.782
肠易激综合征(irritable bowel syndrome, IBS)被认为是一种以慢性腹痛、腹胀和肠道习惯改变为特征的功能性胃肠道疾病[1-3]. 亚洲和西方国家报告的IBS发病率均越来越高[4-6]. 根据罗马Ⅳ诊断标准[7], 将IBS划分为腹泻为主型(diarrhea-predominant IBS, IBS-D), 便秘为主型(constipation-predominant IBS, IBS-C)、混合型(mixed IBS, IBS-M)以及不确定型(unclassifiable IBS, IBS-U), 还有感染后的IBS (postinfectious IBS, PI-IBS). 尽管传统上认为IBS存在一些可能的机制, 例如遗传易感性、下丘脑-垂体-肾上腺轴异常、肠动力异常、神经内分泌和内脏高敏感性发生改变, 但这种综合征的确切机制仍不十分清楚[8,9]. 近年来, 越来越多的证据表明, 低度炎症在IBS的发生、发展中起着重要作用[10]. 但IBS的确切炎症标志物是什么, 这些炎症标志物与IBS的诊断和分型之间有何关联均不清楚. 本研究旨在了解IBS血清炎症标志物肿瘤坏死因子(tumor necrosis factor-alpha, TNFα)、超敏C反应蛋白(hypersensitive C-reactive protein, hs-CRP)的表达情况及其与IBS亚型的关联, 以期为不同亚型IBS患者开展针对性治疗和护理打下基础.
1.1.1 一般资料: 收集2017-01/2019-01期间在扬州大学附属医院及江苏省苏北人民医院两家三甲医院就诊的IBS患者177例(女性123例, 男性54例), 年龄均大于18岁, 所有患者均经血尿粪常规检查及结肠镜检查排除器质性疾病. 健康对照选自上述医院的健康体检者174例(女性124例, 男性50例), 性别、年龄与病例组相匹配.
1.1.2 纳入标准: 病例组需符合诊断标准并自愿加入本研究, 同时签定"知情同意书"; 对照组年龄、性别等一般资料与病例组相匹配, 具有可比性, 大便习惯正常, 无胃肠道症状和胃肠疾病, 无腹部手术史, 无免疫性疾病、感染病史, 无近期服用药物史, 结肠镜检查肠黏膜无异常.
1.1.3 排除标准: 病例组和对照组均排除以下情况: 如孕妇或哺乳期女性, 手术或其他应激情况下的患者, 合并严重肝、肾功能损害、严重心脑血管疾病、内分泌疾病、各种急性感染性疾病患者; 所有精神病患者.
IBS的诊断和分型采用罗马Ⅳ标准[7]: 反复发作的腹痛, 在过去3 mo内每周发作至少1 d, 伴有以下两项或两项以上: (1)与排便有关; (2)发作伴随排便频率的改变: (3)发作伴随大便性状的改变. 在诊断之前症状出现至少6 mo, 且近3 mo症状必须符合诊断标准.
1.2.1 研究方法: (1)标本采集及酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)检测: 采集患者及正常对照者空腹静脉血5 mL, 置于EDTA抗凝管中, 3000 r/min离心15 min, 离心半径为11 cm, 收集上清液, 购买武汉基因美科技有限公司的人TNFα ELISA试剂盒, 根据说明书步骤采用ELISA技术检测血清TNFα浓度, 购买上海麦瑞生物技术公司的hs-CRP检测试剂盒, 利用免疫透射比浊法检测血清hs-CRP的浓度; (2)心理评估: 采用焦虑自评量表(self-rating anxiety scale, SAS)和抑郁自评量表(self-rating depression scale, SDS)对病例组和对照组的焦虑、抑郁状况进行评估[11-13].
统计学处理 所有数据采用SPSS 22.0软件进行处理, 病例组和对照组人口学资料的分析用χ2检验, 病例组和对照组血清TNFα、hs-CRP表达水平的差异分析用t检验, hs-CRP与TNFα的相关性分析用Pearson相关分析.
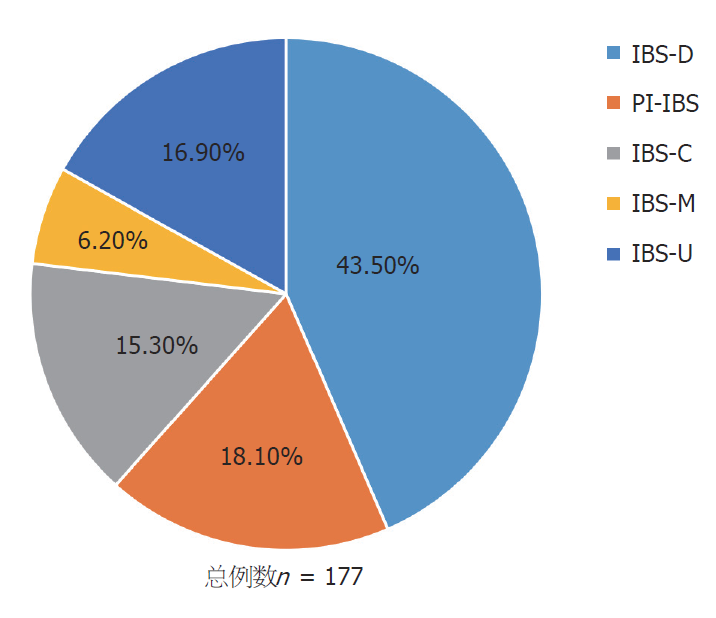
本研究共招募了375人, 其中IBS患者191人, 正常对照184人, 但由于资料收集不全、TNFα或hs-CRP检测明显错误以及中途有人退出, 最后纳入分析的IBS患者共177人, 正常对照174人. 从表1的结果来看, IBS组和正常对照组性别、年龄、体重指数等一般资料相匹配; IBS组与正常对照组相比较, 受教育程度较高(P = 0.037, 表1)但家庭收入较低(P = 0.042, 表1); 通过心理状态的评估, 发现IBS组较正常对照组焦虑、抑郁的比例均显著增高, 差异有统计学意义(P<0.001). 在177例IBS患者中, 共分为五种亚型, 分别为IBS-D (n = 77, 43.5%)、IBS-C (n = 27, 15.3%)、IBS-M (n = 11, 6.2%)、IBS-U (n = 30, 16.9%)以及PI-IBS (n = 32, 18.1%), 如图1所示.
| IBS (n = 177) | HC (n = 174) | P value1 | |
| 特征 | |||
| 性别-女性, n (%) | 123 (69.5) | 124 (71.4) | NS |
| 年龄(mean±SD) (岁) | 39.12±15.23 | 40.56±14.28 | NS |
| 体重指数(mean±SD) (kg/m2) | 23.24±2.15 | 24.16±2.92 | NS |
| 教育-低于高中, n (%) | 66 (37.35) | 84 (48.3) | 0.037 |
| 家庭收入-<7000$/年, n (%) | 82 (46.32) | 62 (35.71) | 0.042 |
| 心理状态 | |||
| 焦虑, n (%) | 48 (27.81) | 12 (6.98) | 0.000 |
| 抑郁, n (%) | 16 (8.91) | 1 (0.56) | 0.000 |
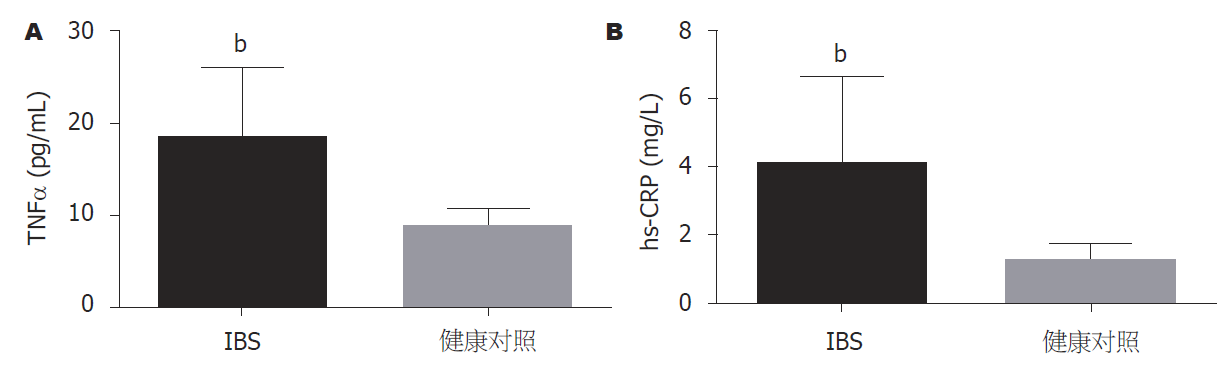
本研究发现, 与健康对照组相比, IBS患者血清非特异性炎症标志物hs-CRP表达水平及促炎因子TNFα的水平均显著增高, 差异有显著统计学意义(P<0.001, 见表2和图2).
| IBS患者(mean±SD) | 健康对照(mean±SD) | P值 | |
| TNFα (pg/mL) | 18.35±7.61 | 8.79±2.00 | <0.001 |
| hs-CRP (mg/L) | 4.06±2.56 | 1.26±0.50 | <0.001 |
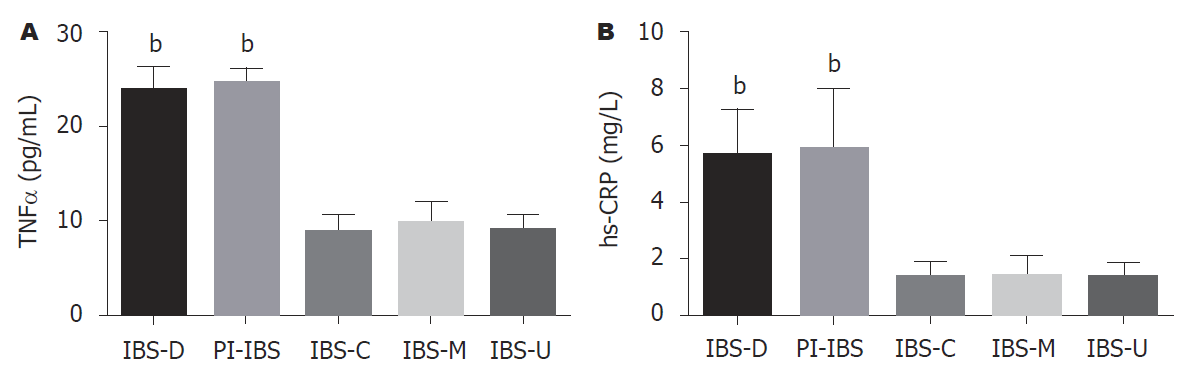
为进一步了解在新的罗马Ⅳ诊断标准下, 两种炎症标记物在5种不同IBS亚型中的表达差异, 我们对5种IBS亚型血清TNFα和hs-CRP水平进行了F检验, 发现PI-IBS和IBS-D组血清TNFα和hs-CRP水平较其他三种亚型显著增高, 差异有统计学意义(P<0.001, 见表3和图3).
| TNFα (pg/mL, mean±SD) | F | P值 | hs-CRP (mg/L, mean±SD) | F | P值 | |
| IBS-D | 23.92±2.29 | 5.66±1.62 | ||||
| PI-IBS | 24.65±1.52 | 5.92±2.08 | ||||
| IBS-C | 8.89±1.70 | 1.34±0.58 | ||||
| IBS-M | 9.78±2.17 | 1.43±0.70 | ||||
| IBS-U | 8.98±1.61 | 611.9 | <0.001 | 1.38±0.48 | 97.31 | <0.001 |
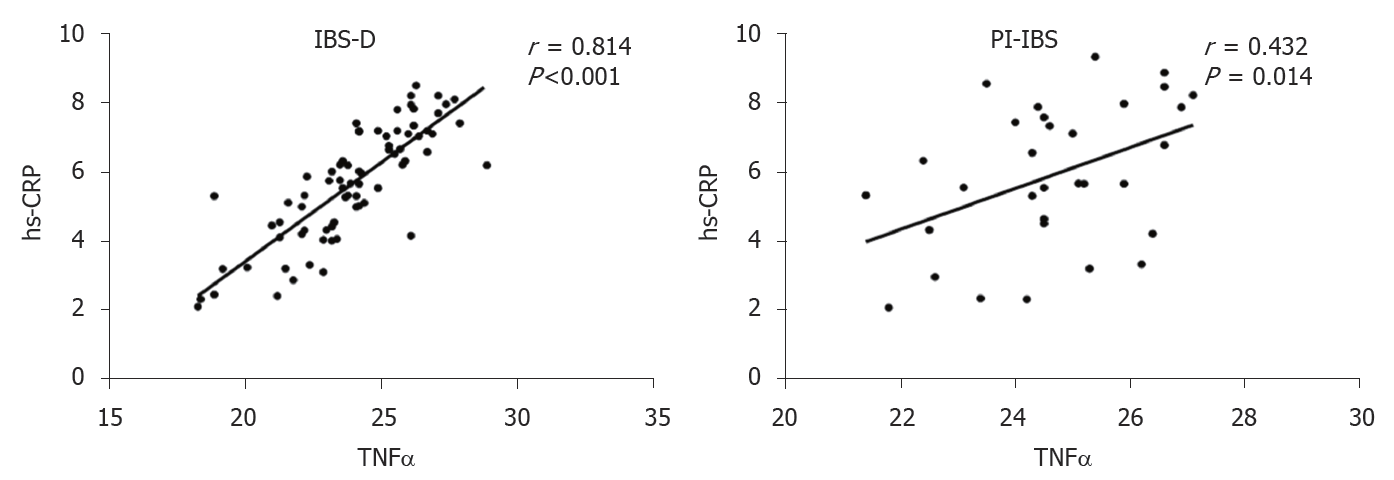
根据结果2.3的提示, IBS-D组和PI-IBS组为与炎症密切相关的亚型, 为进一步了解这两种炎症相关亚型中炎症非特异性标志物hs-CRP与促炎因子TNFα的表达相关性, 我们将两者进行了Pearson相关分析, 发现IBS-D组血清hs-CRP的水平与TNFα的水平呈显著正相关(P<0.001), 相关系数为0.814, PI-IBS组血清hs-CRP的水平与TNFα的水平呈显著正相关(P<0.05), 相关系数为0.432 (见图4).
本研究发现, 在新的罗马Ⅳ诊断标准下, IBS患者血清非特异性炎症标志物hs-CRP的表达水平显著高于正常对照组, 并且在五种不同类型的IBS亚型中, IBS-D和PI-IBS亚型患者血清TNFα、hs-CRP的表达水平高于IBS-C、IBS-M及IBS-U亚型. 在IBS-D和PI-IBS亚型中, 血清hs-CRP的表达水平与促炎细胞因子TNFα呈正相关.
在新的罗马Ⅳ诊断标准下, 扬州地区诊断的177例IBS患者中, 绝大多数为IBS-D和PI-IBS, 分别占43.5%和18.1%, 这与前期的一些研究相一致[14-17]. 从一般资料来看, IBS患者与正常对照相比, 高中以下水平的占比反而降低, 说明学历层次高可能是IBS的一个危险因素, 但在低收入范围内, IBS占比较正常对照高, 说明收入低可能也是IBS的一个危险因素, 当然这都是单因素分析的结果, 需要多元回归进一步确证. 而在新的诊断标准下, IBS患者焦虑、抑郁水平远远高于正常对照, 这也与以往的多项研究相一致.
此外, 我们的研究发现, IBS患者血清炎症标志物TNFα、hs-CRP的表达水平显著高于正常对照组, 这与以往的研究结果是一致的[18,19], 进一步说明先天免疫系统功能障碍和低度炎症可能在IBS的发生发展中起着重要作用[9]. 从我们的研究结果来看, 在五种不同类型的IBS亚型中, IBS-D和PI-IBS亚型患者血清hs-CRP的表达水平高于IBS-C、IBS-M及IBS-U亚型. 虽然以往的研究中也有研究者发现IBS-D血清TNFα[18]或者hs-CRP[19]的表达水平高于正常对照组和IBS-C组, 这可能可以用炎症反应是IBS-D的突出的病理生理学特征来解释[20], 但未有研究纳入PI-IBS亚型与其他亚型的比较, 也很少有研究系统的对比五种不同亚型IBS炎症因子的表达异同. 我们的研究证实, 在所有亚型的IBS患者中, 只有IBS-D和PI-IBS患者炎症标志物的表达明显升高, 高于正常对照和其他三种亚型, 充分说明IBS-D和PI-IBS亚型与慢性和持续性肠道炎症密切相关. 前期有学者也通过其他炎症因子证明了IBS-D或PI-IBS与肠道慢性炎症的关系. 例如, Yang等[21]发现在PI-IBS小鼠模型中干扰素γ (interferon-γ, IFN-γ), 白细胞介素 (interleukin, IL) -1β, IL-17和IL-12的表达水平较正常组小鼠均显著增高, 而IL-10和IL-4的水平显著降低; Chen等[14]发现PI-IBS患者肠道粘膜IFN-γ的水平增高而IL-10水平降低, 这表明感染可能影响Th1/Th2平衡, 而免疫反应的失调可能是IBS的一个重要原因. Hod等[19]研究发现hs-CRP水平与IBS-D患者症状的严重程度密切, 但该研究只纳入了IBS-D和IBS-C两种亚型. HsCRP是一种非特异性的炎症标志物, 虽然有研究发现其与IBS相关, 但在IBS-D和PI-IBS两种亚型中其是否与公认的促炎因子TNFα相关联尚未有报道. 我们的研究发现, 在炎症相关的这两种亚型中, hs-CRP和TNFα呈显著正相关, 说明非特异性的炎症标志物hs-CRP能很好的反映这两种亚型患者的炎症状态.
综上所述, 在新的罗马Ⅳ诊断标准下, 扬州地区IBS患者存在明显的低度炎症反应, 并且在五种亚型中, PI-IBS和IBS-D亚型的炎症状态更明显, 提示临床根据不同亚型给予积极有效的抗炎治疗.
当然本研究还存在一定的局限性, 比如我们只观察了外周血炎症因子的表达, 有时不能代表肠道炎症局部的表现, 未来研究中最好通过肠道组织样本的收集来丰富今天的结果. 另外一个局限性为本次研究总样本量不大, 导致某些亚型的病例数只有十几例, 可能在某种程度上会造成部分研究结果存在偏倚. 期待未来进一步扩大样本量加以确证.
肠易激综合征(irritable bowel syndrome, IBS)是一种以慢性腹痛、腹胀和肠道习惯改变为特征的功能性胃肠道疾病, 但其确切的发病机制仍不十分清楚. 近年来, 越来越多的证据表明, 低度炎症在IBS的发生发展中起着重要作用. 但IBS的确切炎症标志物是什么, 这些炎症标志物与IBS的诊断和分型之间有何关联均不清楚.
明确肿瘤坏死因子(tumor necrosis factor-alpha, TNFα)和超敏C反应蛋白(hypersensitive C-reactive protein, hs-CRP)是否可以成为IBS诊断和分型的潜在生物标记物.
本研究旨在了解IBS血清炎症标志物TNFα、hs-CRP的表达情况及其与IBS亚型的关联, 以期为不同亚型IBS患者开展针对性治疗和护理提供实验基础.
本研究采用酶联免疫吸附法检测血清TNFα浓度, 利用免疫透射比浊法检测血清hs-CRP的浓度; 采用焦虑自评量表和抑郁自评量表对病例组和对照组的焦虑、抑郁状况进行评估. 在此基础上采用χ2检验、t检验及相关分析创新性的研究非特异性炎症标志物hs-CRP与IBS诊断和分型之间的关联.
本研究达到预期的研究目标并发现, 在新的罗马IV诊断标准下, IBS血清炎症标志物TNFα、hs-CRP的高表达与腹泻型IBS (diarrhea-predominant irritable bowel syndrome, IBS-D)和感染后IBS (postinfectious irritable bowel syndrome, PI-IBS)亚型密切相关. 在IBS-D和PI-IBS亚型中, 血清hs-CRP的表达水平与促炎细胞因子TNFα呈正相关.
本研究通过实验证实hs-CRP可能可以作为潜在的炎症标志物用于IBS-D和PI-IBS的辅助诊断和治疗. 在新的罗马Ⅳ诊断标准下, 扬州地区IBS患者存在明显的低度炎症反应, 并且在五种亚型中, PI-IBS和IBS-D亚型的炎症状态更明显, 提示临床根据不同亚型给予积极有效的抗炎治疗.
本研究只观察了外周血炎症因子的表达, 有时不能代表肠道炎症局部的表现, 在未来研究中将通过肠道组织样本的收集和实验来丰富今天的结果. 另外本次研究总样本量不大, 导致某些亚型的病例数只有十几例, 可能在某种程度上会造成部分研究结果存在偏倚, 未来将进一步扩大样本量加以明确.
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC. Functional bowel disorders. Gastroenterology. 2006;130:1480-1491. [PubMed] [DOI] |
| 2. | Chey WD, Kurlander J, Eswaran S. Irritable bowel syndrome: a clinical review. JAMA. 2015;313:949-958. [PubMed] [DOI] |
| 3. | Keshteli AH, Madsen KL, Mandal R, Boeckxstaens GE, Bercik P, De Palma G, Reed DE, Wishart D, Vanner S, Dieleman LA. Comparison of the metabolomic profiles of irritable bowel syndrome patients with ulcerative colitis patients and healthy controls: new insights into pathophysiology and potential biomarkers. Aliment Pharmacol Ther. 2019;49:723-732. [PubMed] [DOI] |
| 4. | Lee OY. Prevalence and risk factors of irritable bowel syndrome in Asia. J Neurogastroenterol Motil. 2010;16:5-7. [PubMed] [DOI] |
| 5. | Chang L, Lembo A, Sultan S. American Gastroenterological Association Institute Technical Review on the pharmacological management of irritable bowel syndrome. Gastroenterology. 2014;147:1149-72.e2. [PubMed] [DOI] |
| 6. | Lovell RM, Ford AC. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clin Gastroenterol Hepatol. 2012;10:712-721.e4. [PubMed] [DOI] |
| 7. | Palsson OS, Whitehead WE, van Tilburg MA, Chang L, Chey W, Crowell MD, Keefer L, Lembo AJ, Parkman HP, Rao SS, Sperber A, Spiegel B, Tack J, Vanner S, Walker LS, Whorwell P, Yang Y. Rome IV Diagnostic Questionnaires and Tables for Investigators and Clinicians. Gastroenterology. 2016;. [PubMed] [DOI] |
| 8. | Lucak S, Chang L, Halpert A, Harris LA. Current and emergent pharmacologic treatments for irritable bowel syndrome with diarrhea: evidence-based treatment in practice. Therap Adv Gastroenterol. 2017;10:253-275. [PubMed] [DOI] |
| 9. | Holtmann GJ, Ford AC, Talley NJ. Pathophysiology of irritable bowel syndrome. Lancet Gastroenterol Hepatol. 2016;1:133-146. [PubMed] [DOI] |
| 10. | Lazaridis N, Germanidis G. Current insights into the innate immune system dysfunction in irritable bowel syndrome. Ann Gastroenterol. 2018;31:171-187. [PubMed] [DOI] |
| 11. | Jegede RO. Psychometric attributes of the Self-Rating Anxiety Scale. Psychol Rep. 1977;40:303-306. [PubMed] [DOI] |
| 12. | Liao J, Zhu S, Li X. Anxiety and depression in paradoxical insomnia: a case-control study. Neuropsychiatr Dis Treat. 2018;14:231-238. [PubMed] [DOI] |
| 13. | Zung WW. A rating instrument for anxiety disorders. Psychosomatics. 1971;12:371-379. [PubMed] [DOI] |
| 14. | Chen J, Zhang Y, Deng Z. Imbalanced shift of cytokine expression between T helper 1 and T helper 2 (Th1/Th2) in intestinal mucosa of patients with post-infectious irritable bowel syndrome. BMC Gastroenterol. 2012;12:91. [PubMed] [DOI] |
| 15. | De Silva AP, Nandasiri SD, Hewavisenthi J, Manamperi A, Ariyasinghe MP, Dassanayake AS, Jewell DP, de Silva HJ. Subclinical mucosal inflammation in diarrhea-predominant irritable bowel syndrome (IBS) in a tropical setting. Scand J Gastroenterol. 2012;47:619-624. [PubMed] [DOI] |
| 16. | Gwee KA, Collins SM, Read NW, Rajnakova A, Deng Y, Graham JC, McKendrick MW, Moochhala SM. Increased rectal mucosal expression of interleukin 1beta in recently acquired post-infectious irritable bowel syndrome. Gut. 2003;52:523-526. [PubMed] [DOI] |
| 17. | Wang LH, Fang XC, Pan GZ. Bacillary dysentery as a causative factor of irritable bowel syndrome and its pathogenesis. Gut. 2004;53:1096-1101. [PubMed] [DOI] |
| 18. | Choghakhori R, Abbasnezhad A, Hasanvand A, Amani R. Inflammatory cytokines and oxidative stress biomarkers in irritable bowel syndrome: Association with digestive symptoms and quality of life. Cytokine. 2017;93:34-43. [PubMed] [DOI] |
| 19. | Hod K, Ringel-Kulka T, Martin CF, Maharshak N, Ringel Y. High-sensitive C-Reactive Protein as a Marker for Inflammation in Irritable Bowel Syndrome. J Clin Gastroenterol. 2016;50:227-232. [PubMed] [DOI] |
| 20. | Sinagra E, Morreale GC, Mohammadian G, Fusco G, Guarnotta V, Tomasello G, Cappello F, Rossi F, Amvrosiadis G, Raimondo D. New therapeutic perspectives in irritable bowel syndrome: Targeting low-grade inflammation, immuno-neuroendocrine axis, motility, secretion and beyond. World J Gastroenterol. 2017;23:6593-6627. [PubMed] [DOI] |
| 21. | Yang B, Zhou X, Lan C. Changes of cytokine levels in a mouse model of post-infectious irritable bowel syndrome. BMC Gastroenterol. 2015;15:43. [PubMed] [DOI] |