修回日期: 2020-06-24
接受日期: 2020-07-05
在线出版日期: 2020-08-08
多种长链非编码RNA (long non-coding RNA, lncRNAs)在胃癌(gastric cancer, GC)进展中被证实发挥抑癌或促癌作用. 但lncRNAs数量众多, 仍有多种lncRNAs在GC进展中的作用并不明确. 因此, 筛选具有影响GC细胞增殖、迁移和侵袭的lncRNAs对GC防治十分必要.
探讨LncRNA ASB16-AS1调控miR-670-3p/ATXN7L3轴对GC细胞增殖、迁移和侵袭的影响.
实时荧光定量PCR (real-time quantitative PCR, RT-qPCR)和western blot检测人胃黏膜细胞GES-1、GC细胞HGC-27、AGS、NUGC-4中ASB16-AS1、miR-670-3p和ATXN7L3的表达水平. 将HGC-27细胞分为si-NC、si-ASB16-AS1、miR-NC、miR-670-3p、si-ATXN7L3、si-ASB16-AS1+anti-miR-NC、si-ASB16-AS1+anti-miR-670-3p、si-ASB16-AS1+pcDNA-NC、si-ASB16-AS1+pcDNA-ATXN7L3组. 采用细胞计数试剂盒、transwell实验分别测定细胞活力、迁移侵袭能力; 双荧光素酶报告实验、RT-qPCR、western blot确定ASB16-AS1与miR-670-3p、miR-670-3p与ATXN7L3之间的相互作用.
GC细胞中ASB16-AS1、ATXN7L3呈高表达, miR-670-3p呈低表达(P<0.05). 抑制ASB16-AS1表达, 或过表达miR-670-3p, 或抑制ATXN7L3表达后, HGC-27细胞增殖活力、迁移和侵袭能力均显著降低(P<0.05). ASB16-AS1靶向负调控miR-670-3p表达. miR-670-3p靶向负调控ATXN7L3表达. 抑制miR-670-3p表达部分逆转抑制ASB16-AS1对HGC-27细胞增殖、迁移和侵袭的影响(P<0.05). 过表达ATXN7L3部分逆转抑制ASB16-AS1对HGC-27细胞增殖、迁移和侵袭的影响(P<0.05).
抑制ASB16-AS1通过调控miR-670-3p/ATXN7L3轴抑制GC细胞增殖、迁移和侵袭.
核心提要: ASB16-AS1在胃癌细胞中高表达. 抑制ASB16-AS1通过调控miR-670-3p/ATXN7L3轴抑制HGC-27细胞的增殖、迁移和侵袭.
引文著录: 罗俊, 张晓苹, 郑园园, 马阿火. 长链非编码RNA ASB16-AS1调控miR-670-3p/ATXN7L3轴影响胃癌细胞增殖、迁移和侵袭. 世界华人消化杂志 2020; 28(15): 673-682
Revised: June 24, 2020
Accepted: July 5, 2020
Published online: August 8, 2020
Many long non-coding RNAs (lncRNAs) have been shown to play a role in suppressing or promoting the progression of gastric cancer (GC). However, there are still a large number of lncRNAs whose roles in the progression of GC are still unclear. Therefore, it is still necessary to identify lncRNAs that affect the proliferation, migration, and invasion of GC cells to provide potential targets for the prevention and treatment of GC.
To investigate the effect of lncRNA ASB16-AS1 on the proliferation, migration, and invasion of GC cells and the underlying mechanism.
The expression levels of ASB16-AS1, miR-670-3p, and ATXN7L3 in human gastric mucosal cell line GES-1 and GC cell lines HGC-27, AGS, and NUGC-4 were detected by real-time fluorescent quantitative PCR (RT-qPCR) and Western blot. HGC-27 cells were divided into si-NC, si-ASB16-AS1, miR-NC, miR-670-3p, si-ATXN7L3, si-ASB16-AS1 + anti-miR-NC, si-ASB16 -AS1 + anti-miR-670-3p, si-ASB16-AS1 + pcDNA-NC, and si-ASB16-AS1 + pcDNA-ATXN7L3 groups. Cell counting kit-8 and transwell assay were used to detect cell viability and migration invasion , respectively. Dual luciferase reportor assay, RT-qPCR, and Western blot were used to determine the interaction between ASB16-AS1 and miR-670-3p and between miR-670-3p and ATXN7L3.
ASB16-AS1 and ATXN7L3 were highly expressed in GC cells, while miR-670-3p was lowly expressed (P < 0.05). After inhibiting the expression of ASB16-AS1, overexpressing miR-670-3p, or inhibiting the expression of ATXN7L3, the proliferation, migration, and invasion of HGC-27 cells were significantly reduced (P < 0.05). ASB16-AS1 targets and negatively regulates miR-670-3p expression. MiR-670-3p targets and negatively regulates ATXN7L3 expression. Inhibiting miR-670-3p partially reversed the effects of inhibiting ASB16-AS1 on the proliferation, migration, and invasion of HGC-27 cells (P < 0.05). Overexpressing ATXN7L3 partially reversed the effect of inhibiting ASB16-AS1 on the proliferation, migration, and invasion of HGC-27 cells (P < 0.05).
Inhibiting ASB16-AS1 inhibits the proliferation, migration, and invasion of GC cells by regulating the miR-670-3p/ATXN7L3 axis.
- Citation: Luo J, Zhang XP, Zheng YY, Ma AH. Long non-coding RNA ASB16-AS1 inhibits proliferation, migration, and invasion of gastric cancer cells by regulating miR-670-3p/ATXN7L3 axis. Shijie Huaren Xiaohua Zazhi 2020; 28(15): 673-682
- URL: https://www.wjgnet.com/1009-3079/full/v28/i15/673.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i15.673
胃癌(gastric cancer, GC)是最常见的消化系统恶性肿瘤之一, 是全球癌症相关死亡的第三大原因, 已给全球共卫生带来巨大负担[1]. 近几十年来, 虽然GC诊疗取得迅速进展, 但由于癌细胞的局部扩散和临床转移, GC患者5年生存率仍然较低[2]. 因此, 了解GC发展的调控机制, 对寻找有效的治疗靶点、提高患者生存能力意义重大. 长链非编码RNA (long non-coding RNA, lncRNA)是一类新型的长度超过200个核苷酸但缺乏蛋白编码能力的RNA, 其通过表观遗传修饰、转录或转录后调节和mRNA加工参与了多种癌症的发生发展[3,4]. ASB16-AS1位于染色体17q21.31区域, 由10745个核苷酸和4个外显子组成, 大量研究证实ASB16-AS1在人类癌症中的具有致癌基因作用. 例如ASB16-AS1高表达促进非小细胞肺癌细胞增殖, 抑制细胞凋亡[5]. ASB16-AS1高表达促进胶质瘤细胞的增殖、迁移和侵袭[6]. 然而ASB16-AS1在GC中的作用和潜在机制仍有待阐明. 本研究通过分析GC中ASB16-AS1表达水平, 揭示ASB16-AS1在GC中生物学作用和潜在机制, 以期为临床GC防治开辟新的途径.
人胃黏膜细胞GES-1、人GC细胞HGC-27、AGS、NUGC-4购自中国科学院上海细胞库; 胎牛血清、青链霉素双抗溶液、DMEM培养基、F12K培养基、RPMI-1640培养基购自美国Gibco公司; TRIzol、Lipofectamine 2000购自美国Invitrogen公司; miScript SYBR green PCR试剂盒、miScript逆转录试剂盒购自北京天根生化科技公司; PrimeScript逆转录试剂盒、SYBR Premix Ex Taq购自大连Takara生物技术公司; ASB16-AS1小干扰RNA (si-ASB16-AS1)及其阴性对照(si-NC)、si-ATXN7L3、miR-670-3p模拟物(miR-670-3p mimics)及其阴性对照(miR-NC)、ATXN7L3过表达质粒(pcDNA-ATXN7L3)及其阴性对照(pcDNA-NC)由上海吉玛制药公司提供; 细胞计数试剂盒(cell counting kit, CCK-8)试剂盒、放射免疫沉淀测定(radioimmunoprecipitation assay, RIPA)裂解液、二喹啉甲酸(bicinchoninic acid, BCA)试剂盒购于上海碧云天生物公司; transwell小室购自美国BD公司; 兔源ATXN7L3、CyclinD1、MMP2、MMP9、β-actin抗体以及山羊抗兔二抗购自美国Abcam公司.
1.2.1 细胞培养: GES-1、HGC-27、AGS、NUGC-4分别采用采用补充10%北美优质胎牛血清、1%青链霉素双抗溶液的DMEM培养基、DMEM高糖培养基、F12K培养基、RPMI-1640培养基于含95%空气、5%CO2、70%湿度、37 ℃恒温培养箱中培养. 当细胞密度达80%-90%时, 按照1:2比例进行传代培养.
1.2.2 RT-qPCR检测ASB16-AS1、miR-670-3p和ATXN7L3 mRNA表达: 用TRIzol试剂分别提取GES-1、HGC-27、AGS和NUGC-4细胞的总RNA, 用紫外分光光度计进行定量. 为检测miR-670-3p表达, 利用miScript逆转录试剂盒合成cDNA, 以U6为内参, miScript SYBR green PCR试剂盒进行qPCR分析miR-670-3p表达. 为检测ASB16-AS1、ATXN7L3 mRNA表达, 利用PrimeScript逆转录试剂盒合成cDNA, 以β-actin为内参, 使用SYBR Premix Ex Taq进行qPCR. 2-△△Ct法分析ASB16-AS1、miR-670-3p和ATXN7L3 mRNA的相对表达水平. GAPDH上游引物5'-GCCTGCTTCACCACCTTCT-3', 下游引物5'-GAACGGGAAGCTCACTGG-3'; ASB16-AS1上游引物5'-CGGCCCTGAGGCAAACATAC-3', 下游引物5'-TGAAACACTGCGCCAACTTC-3'; ATXN7L3上游引物5'-CAGGCACTTCTCCAGATGGG-3', 下游引物5'-CGGGCTTGGACATCTTTGGA-3'; U6上游引物5'-GACAGATTCGGTCTGTGGCAC-3', 下游引物5'-GATTACCCGTCGGCCATCGATC-3'; miR-670-3p上游引物5'-CTGATCGTGAGGAGAGTGT-3', 下游引物5'-GGTCTTCGACATCGGGGCGG-3'.
1.2.3 细胞转染和实验分组: 取2×105个对数期HGC-27细胞接种到6孔板, 当细胞密度达到60%时, 按照Lipofectamine 2000使用说明书将si-NC、si-ASB16-AS1、miR-NC、miR-670-3p、si-ATXN7L3、si-ASB16-AS1+anti-miR-NC、si-ASB16-AS1+anti-miR-670-3p、si-ASB16-AS1+pcDNA-NC、si-ASB16-AS1+pcDNA-ATXN7L3分别转染HGC-27细胞, 依次记为si-NC组、si-ASB16-AS1组、miR-NC组、miR-670-3p组、si-ATXN7L3组、si-ASB16-AS1+anti-miR-NC组、si-ASB16-AS1+anti-miR-670-3p组、si-ASB16-AS1+pcDNA-NC组、si-ASB16-AS1+pcDNA-ATXN7L3组, 6 h后更换为新鲜细胞培养液, 转染48 h时, 收集细胞按照RT-qPCR、western blot步骤检测转染效果, 合格后进行细胞活力、迁移侵袭能力检测.
1.2.4 CCK-8法检测细胞增殖活力: 按照每孔2×103个HGC-27转染细胞接种96孔板, 培养48 h后, 取20 µL的CCK-8溶液加入到平板各孔中, 48 h后, 以空白孔调零, 酶标仪测定450 nm处各孔的光密度值.
1.2.5 Transwell实验检测细胞迁移和侵袭: 采用transwell小室测定细胞的侵袭和迁移能力. 将包被(侵袭实验)或未包被(迁移实验)基质胶的transwell小室放到24孔板中. 采用无血清培养基调整细胞浓度, 取200 µL细胞数约为2×105的细胞悬液加入到transwell上室, 取500 μL含20%胎牛血清的培养基加入到24孔板下室. 培养箱孵育24 h, 用1%甲醛固定transwell小室底部侵袭和迁移的细胞, 并进行结晶紫染色. 倒置显微镜观察细胞侵袭、迁移情况, 随机选取5个视野进行计数, 拍照, 以其均值表示细胞侵袭、迁移数量.
1.2.6 Western blot检测ATXN7L3、CyclinD1、MMP2和MMP9蛋白表达水平: 使用RIPA裂解液从HGC-27细胞分离总蛋白, 用BCA试剂盒测定其浓度. 取适量细胞蛋白与上样缓冲液混合, 按照每泳道30 μg蛋白样品进行聚丙烯酰胺凝胶电泳分离蛋白, 并转移至PVDF膜. 用含5%脱脂牛奶的封闭液4 ℃孵育膜过夜; 用含稀释的ATXN7L3 (1:2000)、CyclinD1 (1:1000)、MMP2 (1:500)和MMP9 (1:1000)一抗溶液室温下孵育膜2 h; IgG二抗室温孵育膜2 h. 增强型化学发光试剂盒暗室显色后, 以β-actin为内参, 用凝胶成像系统分析目的条带灰度值.
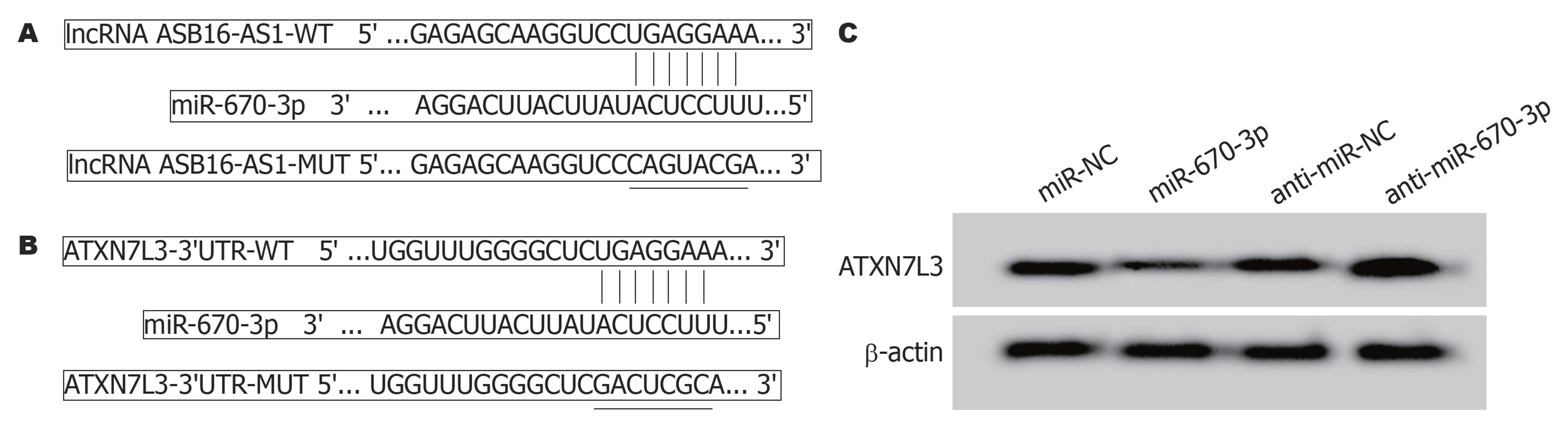
1.2.7 双荧光素酶报告基因实验: 将含有miR-670-3p结合位点的野生型(wild type, WT)或突变型(mutant type, MUT) ASB16-AS1序列或ATXN7L3-3'-UTR序列插入pmirGLO质粒, 构建成WT-ASB16-AS1、MUT-ASB16-AS1、WT-ATXN7L3、MUT-ATXN7L3报告基因, 该步骤由上海吉玛制药公司完成. 将报告基因分别与miR-NC、miR-670-3p mimics共转染到HGC-27细胞, 48 h后, 使用双荧光素酶报告基因测定系统测量HGC-27细胞荧光素酶活性. 为确定ASB16-AS1对miR-670-3p调控作用, 将pcDNA-NC、pcDNA-ASB16-AS1、si-NC、si-ASB16-AS1分别转染HGC-27细胞, 48 h后采用RT-qPCR检测miR-670-3p表达. 为确定miR-670-3p对ATXN7L3的调控作用, 将miR-NC、miR-670-3p、anti-miR-NC、anti-miR-670-3p分别转染HGC-27细胞, 8 h后采用western blot检测ATXN7L3蛋白表达.
统计学处理 统计分析采用SPSS 20.0软件进行. 每组设置3个平行实验, 重复3次, 计量资料以mean±SD表示. 采用学生t检验分析两组间差异; 采用单因素方差分析分析多组间差异, 进一步两两比较采用SNK-q检验. P<0.05为差异有统计学意义.
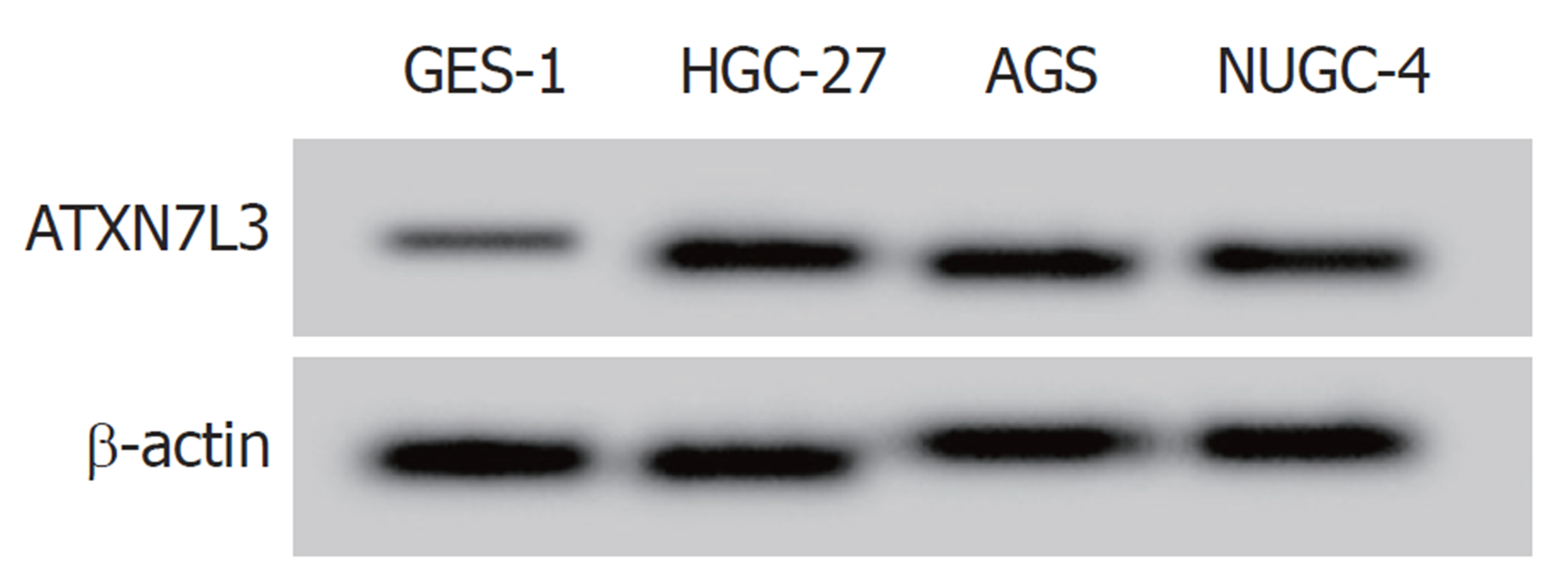
与人胃黏膜细胞GES-1比较, GC细胞HGC-27、AGS、NUGC-4中ASB16-AS1、ATXN7L3 mRNA和ATXN7L3蛋白的表达水平显著升高, miR-670-3p的表达水平显著降低(P<0.05), 见表1和图1. 选择ASB16-AS1和ATXN7L3表达最高、miR-670-3p表达最低的HGC-27细胞进行后续实验.
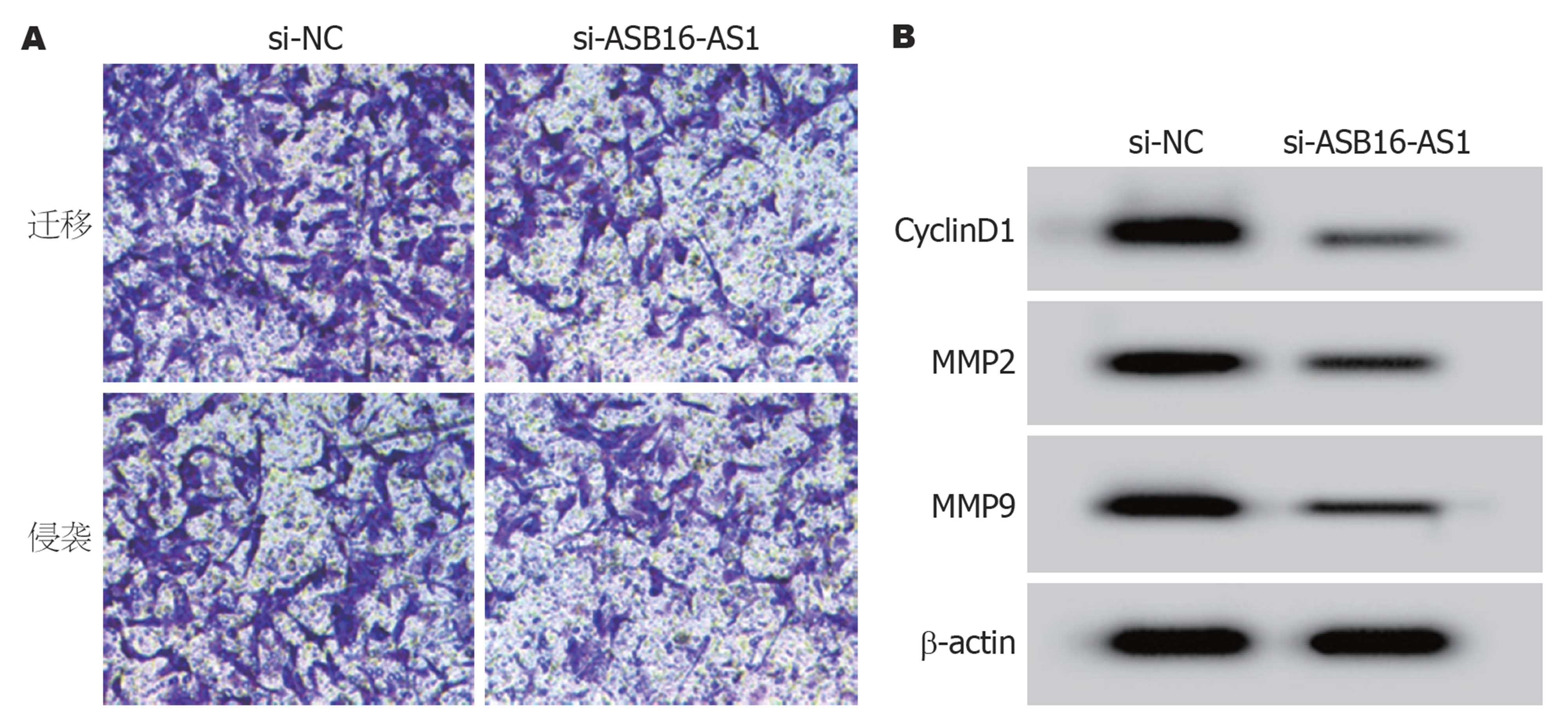
ASB16-AS1表达对GC细胞HGC-27增殖、迁移和侵袭的影响 与si-NC组比较, si-ASB16-AS1组HGC-27细胞ASB16-AS1的表达水平显著降低(P<0.05), 提示HGC-27细胞中ASB16-AS1表达受到抑制. 抑制ASB16-AS1表达后HGC-27细胞CyclinD1、MMP2和MMP9蛋白表达显著降低, 细胞活力、细胞迁移和侵袭数量显著降低(P<0.05), 见表2和图2.
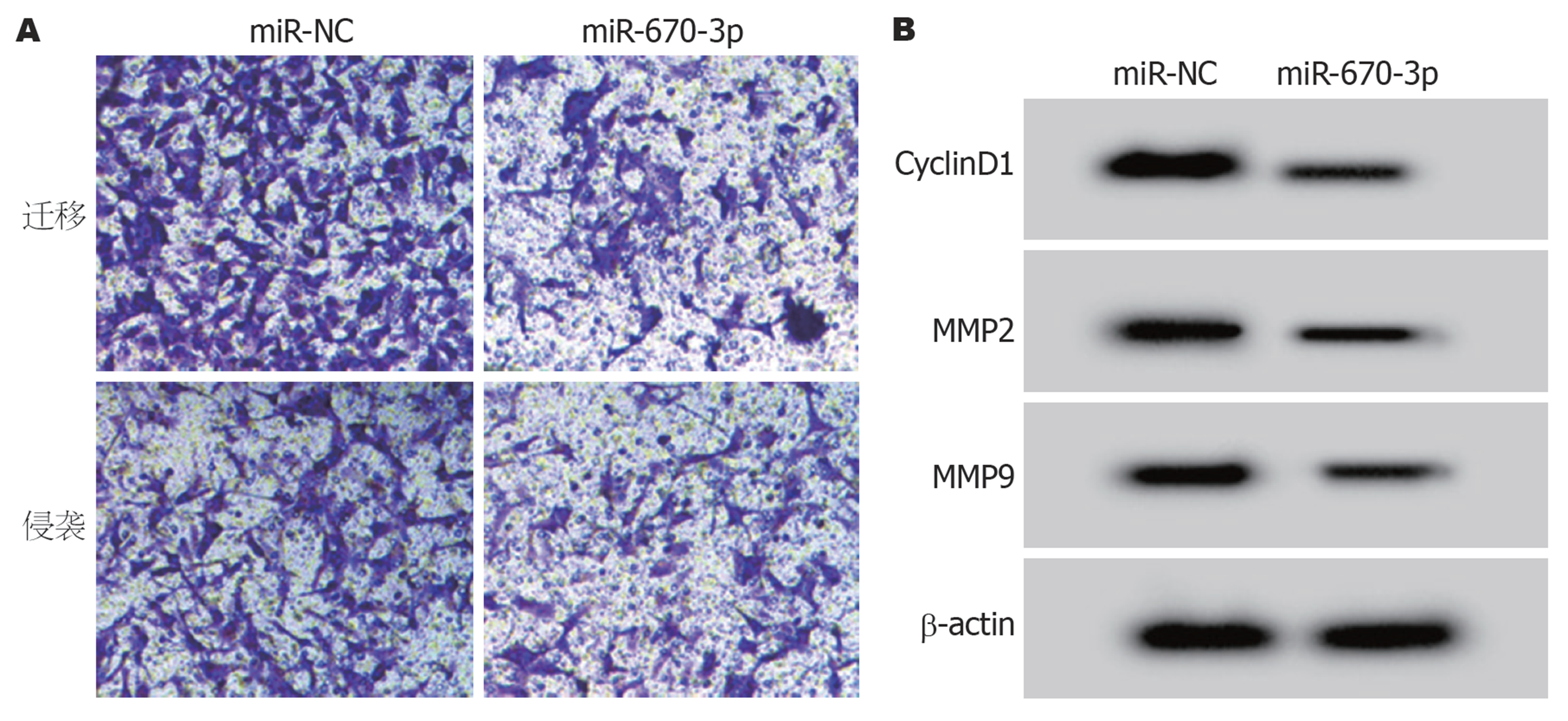
与miR-NC组比较, miR-670-3p组HGC-27细胞miR-670-3p的表达水平显著升高(P<0.05), 提示HGC-27细胞miR-670-3p的表达得到上调. 过表达miR-670-3p后HGC-27细胞CyclinD1、MMP2和MMP9蛋白表达显著降低, 细胞活力、细胞迁移和侵袭数量显著降低(P<0.05), 见表3和图3.
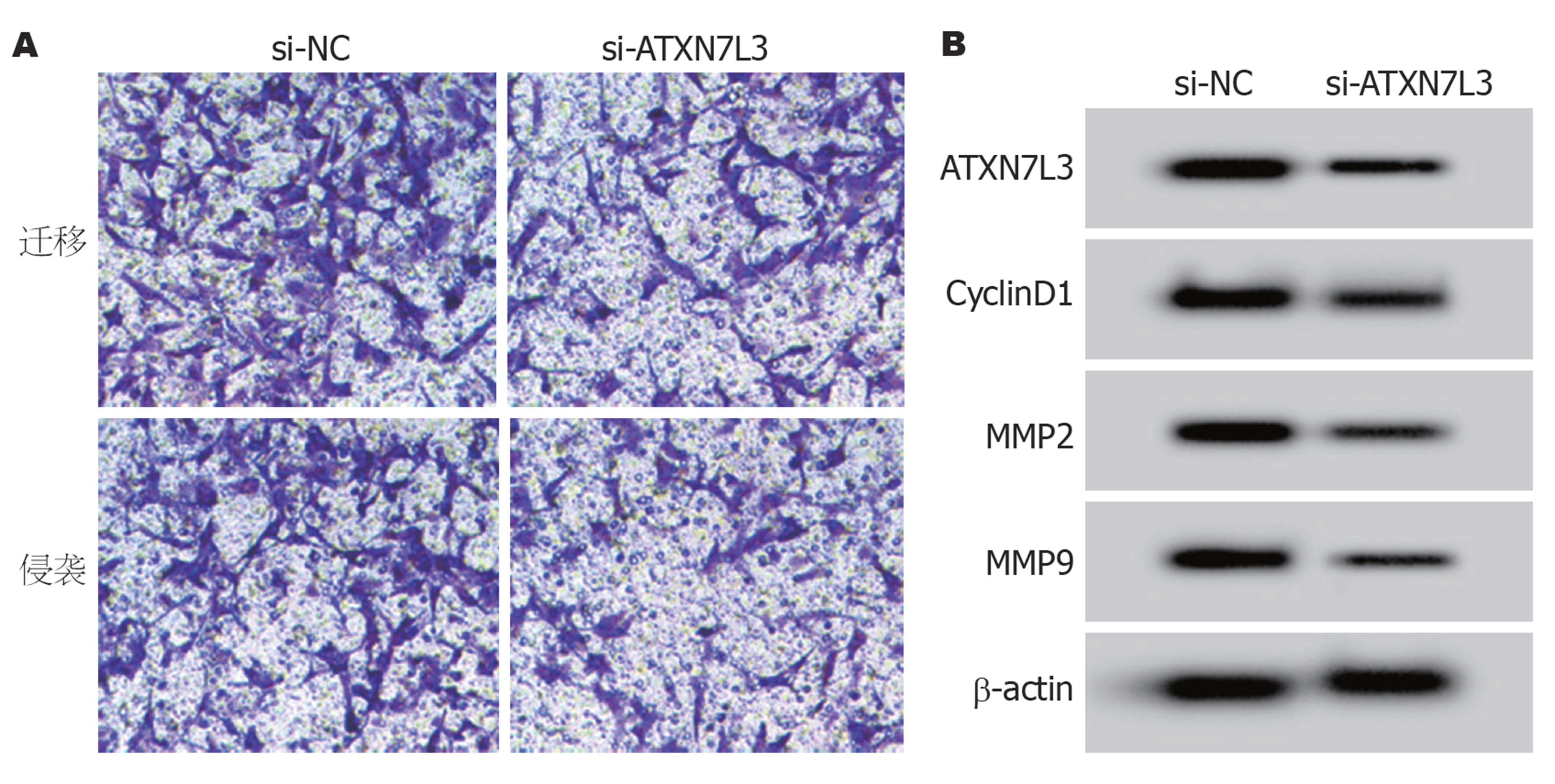
与si-NC组比较, si-ATXN7L3组HGC-27细胞ATXN7L3的表达显著降低(P<0.05), 提示HGC-27细胞ATXN7L3的表达受到抑制. 抑制ATXN7L3表达后HGC-27细胞CyclinD1、MMP2和MMP9蛋白表达显著降低, 细胞活力、细胞迁移和侵袭数量显著降低(P<0.05), 见表4和图4.
Starbase预测显示, miR-670-3p与ASB16-AS1、ATXN7L3-3'-UTR区域存在部分连续结合的核苷酸序列, 见图5A和B. 双荧光素酶报告基因实验显示, miR-670-3p mimics和WT-ASB16-AS1(或WT-ATXN7L3)共转染组HGC-27细胞的荧光素酶活性较miR-NC和WT-ASB16-AS1(或WT-ATXN7L3)共转染组显著降低(P<0.05); 而miR-670-3p mimics和MUT-ASB16-AS1 (或MUT-ASB16-AS1)共转染组HGC-27细胞的荧光素酶活性与miR-NC和MUT-ASB16-AS1 (或MUT-ASB16-AS1)共转染组比较无显著变化, 见表5和表6. RT-qPCR检测显示, pcDNA-ASB16-AS1组HGC-27细胞miR-670-3p的表达较pcDNA-NC组显著降低; 而si-ASB16-AS1组HGC-27细胞miR-670-3p的表达较si-NC组显著升高(P<0.05), 见表7. Western blot检测显示, miR-670-3p组HGC-27细胞ATXN7L3蛋白表达较miR-NC组显著降低; 而anti-miR-670-3p组HGC-27细胞ATXN7L3蛋白表达较anti-miR-NC组显著升高, 见表8和图5C.
| 组别 | 荧光素酶活性 | |
| WT-ASB16-AS1 | MUT-ASB16-AS1 | |
| miR-NC | 1.00±0.12 | 1.04±0.13 |
| miR-670-3p | 0.45±0.04b | 1.01±0.11 |
| t | 13.044 | 0.528 |
| P值 | 0.000 | 0.604 |
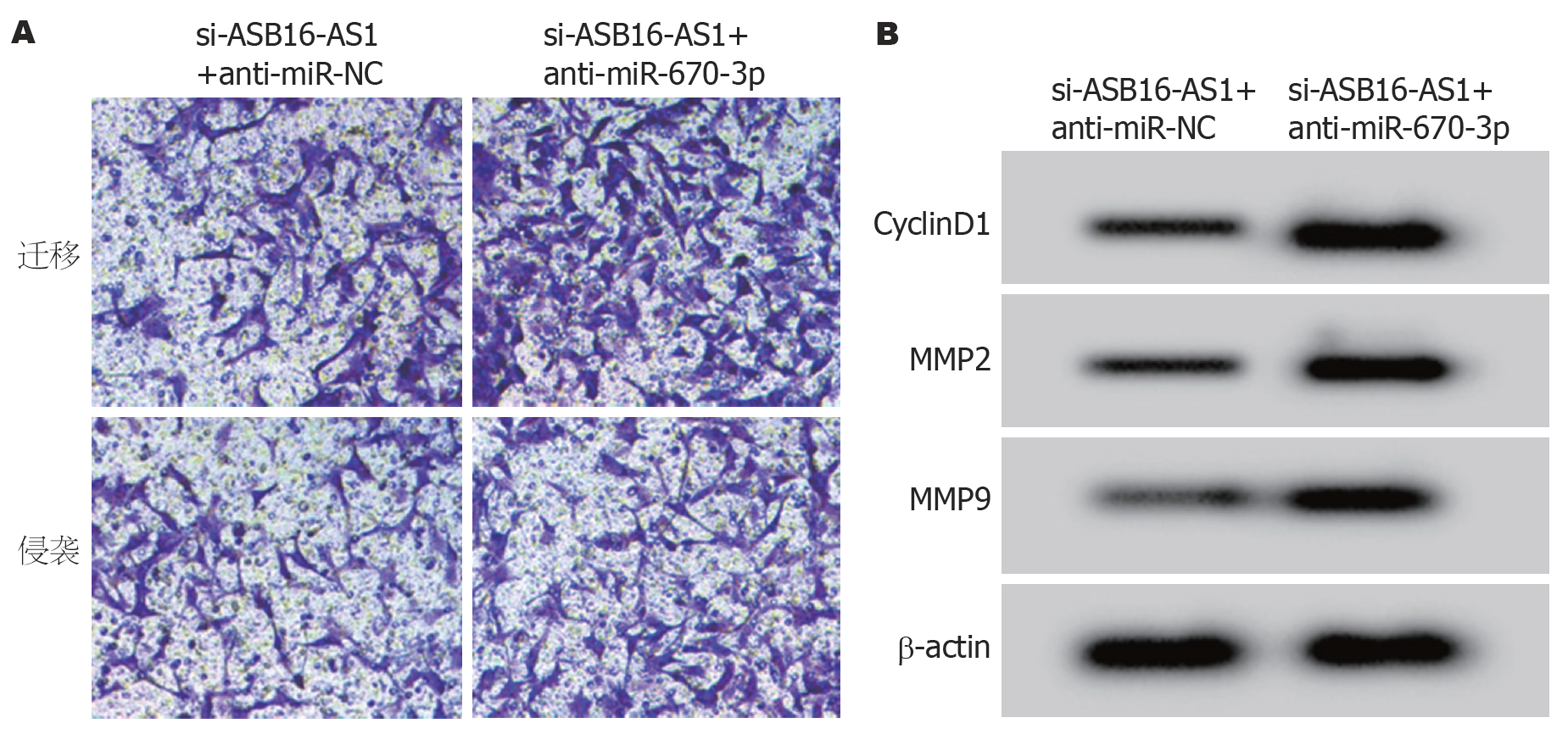
与si-ASB16-AS1+anti-miR-NC组比较, si-ASB16-AS1+anti-miR-670-3p组HGC-27细胞miR-670-3p的表达显著降低, CyclinD1、MMP2和MMP9蛋白表达显著升高, 细胞活力、细胞迁移和侵袭数量显著升高(P<0.05), 见表9和图6.
| 组别 | miR-670-3p | CyclinD1 | MMP2 | MMP9 | OD450 nm | 细胞迁移数量 | 细胞侵袭数量 |
| si-ASB16-AS1+anti-miR-NC | 1.00±0.08 | 0.40±0.04 | 0.35±0.03 | 0.30±0.04 | 0.397±0.05 | 82.04±8.22 | 62.11±6.05 |
| si-ASB16-AS1+anti-miR-670-3p | 0.46±0.04b | 0.90±0.10b | 0.73±0.06b | 0.65±0.07b | 0.689±0.07b | 162.43±16.07b | 123.59±12.08b |
| t | 18.112 | 13.927 | 16.994 | 13.024 | 10.079 | 13.361 | -13.652 |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
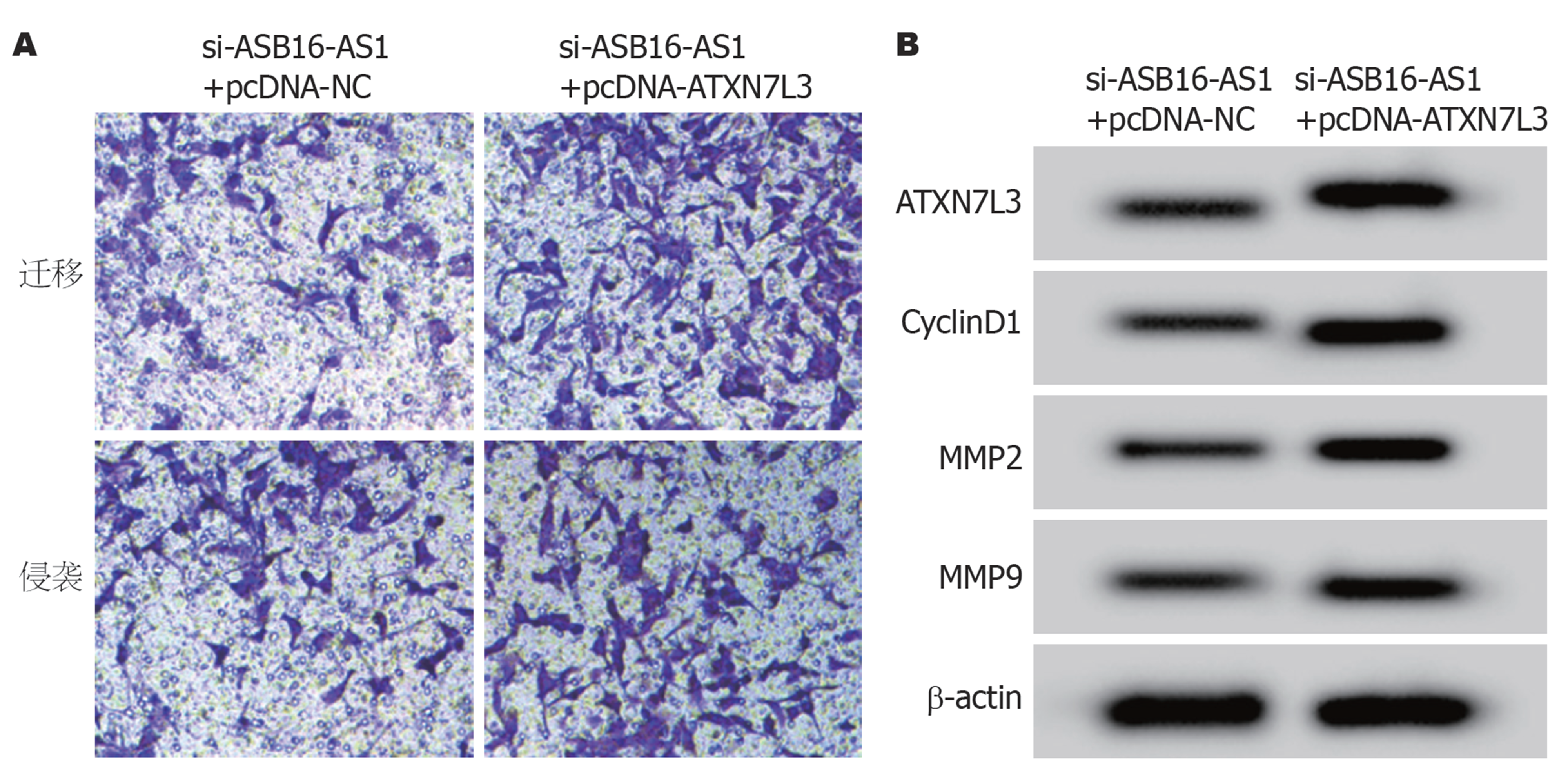
与si-ASB16-AS1+pcDNA-NC组比较, si-ASB16-AS1+pcDNA-ATXN7L3组HGC-27细胞ATXN7L3、CyclinD1、MMP2和MMP9蛋白表达显著升高, 细胞活力、细胞迁移和侵袭数量显著升高(P<0.05), 见表10和图7.
| 组别 | ATXN7L3 | CyclinD1 | MMP2 | MMP9 | OD450 nm | 细胞迁移数量 | 细胞侵袭数量 |
| si-ASB16-AS1+pcDNA-NC | 0.46±0.04 | 0.39±0.03 | 0.33±0.04 | 0.31±0.02 | 0.406±0.08 | 80.77±8.05 | 65.81±6.08 |
| si-ASB16-AS1+pcDNA-ATXN7L3 | 0.82±0.08b | 0.80±0.08b | 0.70±0.07b | 0.62±0.06b | 0.734±0.09b | 151.36±15.10b | 117.24±11.22b |
| t | 12.075 | 14.396 | 13.768 | 14.705 | 8.172 | 12.376 | 12.090 |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
GC是最常见的威胁生命的恶性肿瘤之一, 其局部或全身转移是导致GC患者预后不良的重要原因[7]. 因此, 深入了解GC发生、转移的分子机制开辟新的GC治疗方法至关重要.
ASB16-AS1是近年发现的抑癌基因, 骨肉瘤组织和细胞系中ASB16-AS1表达上调, ASB16-AS1表达升高与患者肿瘤大小、肿瘤淋巴结转移分期、远处转移有关, ASB16-AS1通过与miR-760相互作用上调肝癌衍生生长因子表达促进骨肉瘤的恶性表型[8]. 宫颈癌中ASB16-AS1亦呈高表达, 敲减ASB16-AS1能够降低宫颈癌细胞的增殖、迁移和侵袭能力[9]. 在肝癌中ASB16-AS1通过与miR-1827相互作用促进卷曲蛋白4基因表达最终激活Wnt/β-catenin通路促进肝癌的生长和转移[10]. 与上述恶性肿瘤研究结果一致, 本研究发现3种GC细胞中ASB16-AS1的表达显著升高. 选择HGC-27细胞进行功能分析发现, 抑制ASB16-AS1表达可降低HGC-27细胞增殖活力、迁移和侵袭能力. 此外, 抑制ASB16-AS1表达还可降低促增殖蛋白CyclinD1、促迁移侵袭蛋白MMP2和MMP9的表达水平. 以上结果表明ASB16-AS1在GC中发挥抑癌基因作用, 抑制ASB16-AS1表达可有效抑制GC细胞的增殖和侵袭转移.
大量研究证实, lncrna通过与微小RNA竞争性结合, 作为竞争性内源RNA调控肿瘤相关基因表达参与多种恶性肿瘤发生发展[11,12]. 为探讨ASB16-AS1在GC中的调控机制, 采用生物信息学数据库Starbase在线预测发现ASB16-AS1与miR-670-3p之间存在相互作用. 既往研究显示, 肝癌中miR-670-3p表达下调可促进肝癌的细胞增殖和侵袭[13]. 本研究发现3种GC细胞中miR-670-3p表达显著降低, 过表达miR-670-3p可降低HGC-27细胞增殖活力、迁移和侵袭能力, 并影响增殖、迁移和侵袭蛋白表达水平. 此外, ASB16-AS1对miR-670-3p具有靶向负调控作用, 且抑制miR-670-3p表达能够部分逆转抑制ASB16-AS1对GC细胞增殖、迁移和侵袭的影响. 以上研究表明, ASB16-AS1通过调控miR-670-3p在GC中发挥致癌基因作用.
为探讨miR-670-3p在GC中的作用机制, 通过Starbase在线分析发现miR-670-3p与ATXN7L3直接作用. 已有研究表明ATXN7L3和ENY2介导多种去泛素化酶的活性在细胞增殖和肿瘤生长中起关键作用[14]. let-7b和let-7c通过靶向ATXN7L3促进组蛋白2B泛素化可抑制癌细胞的迁移能力[15]. 此外, DSCAM-AS1靶向miR-877-5p上调ATXN7L3表达参与宫颈癌的发生[16]. 本研究发现3种GC细胞中ATXN7L3的表达显著升高, 抑制ATXN7L3表达可降低HGC-27细胞增殖活力、迁移和侵袭能力, 并影响增殖、迁移和侵袭蛋白表达水平. 同时, 双荧光素酶报告基因实验、westsern blot证实miR-670-3p对ATXN7L3表达具有靶向负调控作用. 此外, 过表达ATXN7L3还能够逆转抑制miR-670-3p对HGC-27细胞增殖、迁移和侵袭的影响. 基于以上结果, 本研究推测ASB16-AS1通过发挥miR-877-5p竞争性内源RNA作用上调ATXN7L3表达进而影响GC细胞的生物学行为.
综上, lncRNA ASB16-AS1在GC中具有致癌作用, 抑制ASB16-AS1可抑制GC细胞的增殖、迁移和侵袭, 其机制与调控miR-670-3p/ATXN7L3轴有关. 因此, ASB16-AS1有望成为GC的潜在治疗靶点.
我国胃癌(gastric cancer, GC)发病率呈逐年升高趋势. 长链非编码RNA (long non-coding RNA, lncRNAs)在胃癌的发生发展中具有重要作用, 筛选影响GC进展的lncRNAs, 有助于为临床开发新的GC诊疗方法提供线索.
ASB16-AS1在胶质瘤中高表达, 且ASB16-AS1高表达促进胶质瘤细胞的增殖、迁移和侵袭, 但ASB16-AS1对GC细胞增殖、迁移和侵袭的影响尚不清楚.
本研究旨在检测GC细胞中ASB16-AS1表达水平, 探讨ASB16-AS1为GC细胞增殖、迁移和侵袭的影响, 并分析其潜在分子机制.
采用实时荧光定量PCR检测ASB16-AS1在GC细胞中的表达. 用细胞计数试剂盒和transwell实验评估抑制ASB16-AS1表达对GC细胞增殖、迁移和侵袭的影响. 预测ASB16-AS1靶微小RNA (microRNA, miRNA)以及miRNA下游靶mRNA, 并验证. 最后, 检测ASB16-AS1是否通过调控miRNA/mRNA轴发挥作用.
ASB16-AS1在GC细胞中高表达. 抑制ASB16-AS1表达通过靶向调控miR-670-3p/ATXN7L3轴对GC细胞的增殖、迁移和侵袭具有抑制作用.
抑制ASB16-AS1表达通过靶向调控miR-670-3p/ATXN7L3轴可抑制GC细胞的增殖、迁移和侵袭.
本研究为GC的治疗提供了参考靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Nasrollahzadeh-Khakiani M, Emadi-Baygi M, Schulz WA, Nikpour P. Long noncoding RNAs in gastric cancer carcinogenesis and metastasis. Brief Funct Genomics. 2017;16:129-145. [PubMed] [DOI] |
| 2. | Youn GJ, Chung WC. [Micrometastasis in Gastric Cancer]. Korean J Gastroenterol. 2017;69:270-277. [PubMed] [DOI] |
| 4. | Wang G, Wang X, Jin Y. LINC01410/miR-3619-5p/FOXM1 Feedback Loop Regulates Papillary Thyroid Carcinoma Cell Proliferation and Apoptosis. Cancer Biother Radiopharm. 2019;34:572-580. [PubMed] [DOI] |
| 5. | Tan LJ, Liu JT, Yang M, Ju T, Zhang YS. LncRNA ASB16-AS1 promotes proliferation and inhibits apoptosis of non small cell lung cancer cells by activating the Wnt/β catenin signaling pathway. Eur Rev Med Pharmacol Sci. 2020;24:1870-1876. [PubMed] [DOI] |
| 6. | Zhang D, Zhou H, Liu J, Mao J. Long Noncoding RNA ASB16-AS1 Promotes Proliferation, Migration, and Invasion in Glioma Cells. Biomed Res Int. 2019;2019:5437531. [PubMed] [DOI] |
| 7. | Lin MT, Song HJ, Ding XY. Long non-coding RNAs involved in metastasis of gastric cancer. World J Gastroenterol. 2018;24:3724-3737. [PubMed] [DOI] |
| 8. | Yin R, Liu J, Zhao D, Wang F. Long Non-Coding RNA ASB16-AS1 Functions as a miR-760 Sponge to Facilitate the Malignant Phenotype of Osteosarcoma by Increasing HDGF Expression. Onco Targets Ther. 2020;13:2261-2274. [PubMed] [DOI] |
| 9. | Liu W, Zhuang R, Feng S, Bai X, Jia Z, Kapora E, Tan W. Long non-coding RNA ASB16-AS1 enhances cell proliferation, migration and invasion via functioning as a ceRNA through miR-1305/Wnt/β-catenin axis in cervical cancer. Biomed Pharmacother. 2020;125:109965. [PubMed] [DOI] |
| 10. | Yao X, You G, Zhou C, Zhang D. LncRNA ASB16-AS1 Promotes Growth And Invasion Of Hepatocellular Carcinoma Through Regulating miR-1827/FZD4 Axis And Activating Wnt/β-Catenin Pathway. Cancer Manag Res. 2019;11:9371-9378. [PubMed] [DOI] |
| 11. | Dong D, Mu Z, Wei N, Sun M, Wang W, Xin N, Shao Y, Zhao C. Long non-coding RNA ZFAS1 promotes proliferation and metastasis of clear cell renal cell carcinoma via targeting miR-10a/SKA1 pathway. Biomed Pharmacother. 2019;111:917-925. [PubMed] [DOI] |
| 12. | Zhong Y, Li Y, Song T, Zhang D. MiR-718 mediates the indirect interaction between lncRNA SEMA3B-AS1 and PTEN to regulate the proliferation of hepatocellular carcinoma cells. Physiol Genomics. 2019;51:500-505. [PubMed] [DOI] |
| 13. | Fu Y, Cai L, Lei X, Wang D. Circular RNA ABCB10 promotes hepatocellular carcinoma progression by increasing HMG20A expression by sponging miR-670-3p. Cancer Cell Int. 2019;19:338. [PubMed] [DOI] |
| 14. | Atanassov BS, Mohan RD, Lan X, Kuang X, Lu Y, Lin K, McIvor E, Li W, Zhang Y, Florens L, Byrum SD, Mackintosh SG, Calhoun-Davis T, Koutelou E, Wang L, Tang DG, Tackett AJ, Washburn MP, Workman JL, Dent SY. ATXN7L3 and ENY2 Coordinate Activity of Multiple H2B Deubiquitinases Important for Cellular Proliferation and Tumor Growth. Mol Cell. 2016;62:558-571. [PubMed] [DOI] |
| 15. | Spolverini A, Fuchs G, Bublik DR, Oren M. let-7b and let-7c microRNAs promote histone H2B ubiquitylation and inhibit cell migration by targeting multiple components of the H2B deubiquitylation machinery. Oncogene. 2017;36:5819-5828. [PubMed] [DOI] |
| 16. | Liang J, Zhang S, Wang W, Xu Y, Kawuli A, Lu J, Xiu X. Long non-coding RNA DSCAM-AS1 contributes to the tumorigenesis of cervical cancer by targeting miR-877-5p/ATXN7L3 axis. Biosci Rep. 2020;40:BSR20192061. [PubMed] [DOI] |