修回日期: 2020-06-16
接受日期: 2020-06-18
在线出版日期: 2020-07-28
应激是机体在生存竞争中的一种本能的防御机制; 但长期、慢性应激则会引起全身多系统多部位病理表现. 肠道疾病与机体受到的应激关系密切. 本文重点就心理应激引起肠道疾病发生的下丘脑-垂体-肾上腺轴、自主神经系统和肠道自身介导发生机制进行综述.
核心提要: 应激与肠道疾病的关系越来越受到重视. 本文对应激引起肠道疾病发生的下丘脑-垂体-肾上腺轴、自主神经及肠神经和肠道系统介导三个方面的发生机制进行综述, 为肠道疾病的发生机制及未来新的治疗方向提出线索.
引文著录: 李佳佳, 任文静, 尹海燕, 赵亚飞, 唐勇. 应激与肠道疾病发生机制. 世界华人消化杂志 2020; 28(14): 617-627
Revised: June 16, 2020
Accepted: June 18, 2020
Published online: July 28, 2020
Stress is an instinctive defense mechanism of the body in the competition for survival, but long-term or chronic stress will lead to systemic pathological manifestations. Intestinal diseases are closely related to pathological stress. This paper reviews the pathogenesis of intestinal diseases arising from stress.
- Citation: Li JJ, Ren WJ, Yin HY, Zhao YF, Tang Y. Underlying mechanisms for intestinal diseases arising from stress. Shijie Huaren Xiaohua Zazhi 2020; 28(14): 617-627
- URL: https://www.wjgnet.com/1009-3079/full/v28/i14/617.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i14.617
应激概念由加拿大病理生理学家学者Hans Selye于1936年提出. 最早应激被分为"良性应激"和"恶性应激", 后来被定义为机体稳定的内环境受到外来的一些非特异性的刺激而导致的一种不协调状态[1]. 70年代心理学家介入了应激的研究, Mason认为应激应该首先是心理学的概念, 生理上有害的动因造成肾上腺皮质激素分泌上的变化, 是心理影响的结果, 表现为抑郁、焦虑、恐惧、心率加快、血压升高等一系列反应. 这些反应可能主要是机体暴露于应激源后, 下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)轴和自主神经系统(autonomic nervous system, ANS)等被激活, 皮质醇水平释放增加, 从而导致机体对内外环境刺激的一种适应性反应[1,2]. 生理性的应激有助于保持机体内部环境稳定, 确保生物体的生存率; 而病理性的频繁、长期的慢性应激则会增加疾病的易感性或者加重疾病[3]. 随着时代的发展和社会节奏的加快, 心理因素成为机体应激的重要成分; 剧烈或者持久的心理应激成为神经、精神、免疫、心血管、血液、消化、泌尿、生殖等系统疾病发生的重要因素[4-9]. 特别是消化系统疾病, 无论是肠道肿瘤还是炎症性肠病(inflammatory bowel disease, IBD)、肠易激综合征(irritable bowel syndrome, IBS)以及其他功能性胃肠疾病, 都与心理应激密切相关[10-14]. 因此, 本文将重点从HPA轴、自主神经系统和肠道自身介导心理应激与肠道疾病的发生机制进行综述.
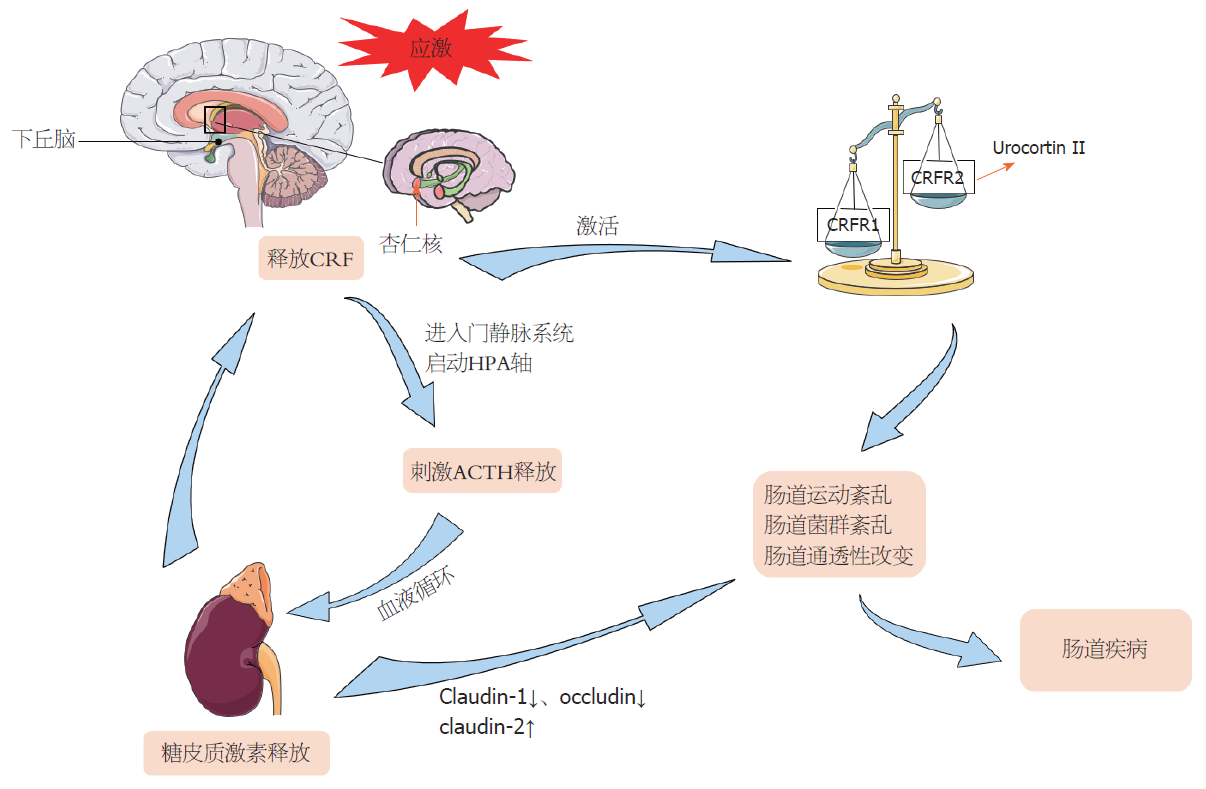
肠道疾病的一个重要特征就是暴露于不同程度的应激及相关的心理反应, 是生理与心理共病的结果[10-12,15-17]. 特别是脑-肠双向交互作用的改变被认为是肠易激综合征和相关功能性胃肠疾病的病理生理学基础[18,19]. 其中产生应激反应的大脑神经网络称为中枢应激回路, 包括下丘脑室旁核(paraventricular nucleus, PVN)、杏仁核和中脑导水管周围灰质. 它接收来自外周躯体和内脏传入通路的输入, 也接收来自中枢内脏运动皮层(内侧前额叶皮层、前扣带皮层和岛叶皮层)的输入[20]. 促肾上腺皮质激素释放因子(corticotropinreleasing factor, CRF)是一种由41个氨基酸组成的神经肽, 因其具有促进垂体分泌促肾上腺皮质激素的作用而被命名, 通过激活CRFR1和CRFR2两种受体参与到应激反应中[21], 是中枢应激反应的重要调节因子, 存在于PVN、杏仁核和蓝斑中[22,23]. PVN中的CRF神经元作为协调神经内分泌、自主神经和行为应激反应的一部分, 通过将CRF释放到门静脉系统中来启动下丘脑-垂体-肾上腺轴功能活动, 通过垂体皮质激素刺激促肾上腺皮质激素(Adrenocorticotropic hormone, ACTH)释放, 同时ACTH通过血液循环, 促使肾上腺糖皮质激素的合成和分泌, 从而为机体应对应激事件做好准备[24,25](图1). 反之糖皮质激素生成障碍也会影响应激诱导大鼠肾上腺髓质和大脑中CRF家族的成员尿皮质激素2基因表达的变化[26].
肠道疾病的发生与暴露于社会心理应激相关, 其中在对炎症性及功能性肠道疾病的临床研究中发现疾病的活动期与社会心理应激相关, 并且针对肠易激综合征的治疗中, 包括心理治疗以及抗抑郁药物的治疗, 这种治疗方式可以改善疾病症状和生活质量[27]. 并且在针对405名溃疡性结肠炎或克罗恩病患者为期两年的前瞻性研究中发现, 疾病活动期患者焦虑与抑郁评分量表异常, 并且疾病活动期的发生与疾病静止期量表异常相关, 这说明炎症性肠病的疾病活动和心理应激具有双向影响, 这就要求临床上应监测炎症性肠病患者的心理健康[28]. 早期母婴分离作为一种早期生活应激模型, 实验动物在生命早期接受母婴分离, 成年后容易诱发肠易激综合征, 故早期母婴分离也是常用的肠易激综合征动物模型[29,30], 这种模型动物下丘脑室旁核的CRF mRNA的表达显著增加[24].
CRF作为中枢应激反应的重要调节因子, 应激导致CRF释放, CRF通过与CRF1或CRF2两种不同受体结合参与到肠蠕动、肠分泌和粘膜屏障功能中, 在功能性肠道疾病如肠易激综合征、功能性消化不良以及炎症性肠病中发挥重要作用. CRFR1广泛表达于哺乳动物大脑和脑垂体, 是HPA轴激活的关键环节[25]. 两种CRF受体可能同时被激活, CRF1和CRF2的信号平衡可能决定了应激诱导的胃肠道功能变化, CRF信号平衡可能会异常地向CRF1转移, 从而导致IBS的结肠运动和内脏痛敏增加[31]. 尿皮素(Urocortin)为CRF类似物, Urocortin Ⅱ通过CRFR2α受体对人肠细胞具有促炎作用, 并且可能在人结肠炎的病理生理中起重要作用[32](图1). 脑室注射CRF以及CRF受体激动剂UrocortinⅠ会通过激活CRFR1诱导结肠转运加快[33]. 中枢apelin可通过APJ受体刺激CRF的释放, 急性应激和慢性异型应激后, 微透析液中下丘脑apelin和CRF水平的升高会减慢胃排空, 加速结肠转运[34]. 通过侧脑室给药NPY Y1受体的拮抗剂可导致慢性应激后中枢CRF mRNA的表达以及外周血清中CRF的浓度升高, 且可以导致结肠运动的失调[35]. 除此之外, PVN中的CRFR1阳性神经元在暴露于慢性应激状态下被激活, 分泌CRFR1, 通过正反馈系统调节肾上腺皮质释放糖皮质激素[36]. 糖皮质激素受体是调节许多生理事件以应对急性和慢性应激反应的主要角色之一并促进人体肠道发育, 加速肠道屏障的发育, 在早期母婴分离模型中, 肠道内糖皮质激素的高反应性会导致肠上皮完整性的破坏, 增加肠道通透性[37]. 慢性应激后糖皮质激素受体下调, 导致糖皮质激素受体介导的紧密连接蛋白claudin-1和occludin减少, claudin-2增加, 导致肠道通透性的增加, 以及内脏痛觉过敏[38]. 并且糖皮质激素在肠道水平的变化具有区域特异性, 应激大鼠结肠中糖皮质激素受体和紧密连接蛋白水平显著下降, 空肠中则无明显下降[39]. 在结肠炎模型中, 肾上腺素和皮质酮的使用可将背根神经节神经元中阿片类受体的信号转为兴奋性, 从而防止在治疗结肠炎过程中对于阿片类药物的大量使用[10].
自主神经系统(autonomic nervous system, ANS)由交感和副交感神经系统组成, 在胃肠道与肠神经系统紧密相连, 共同控制着肠道内的分泌、运动、肠道免疫以及内脏痛觉[40](图2).
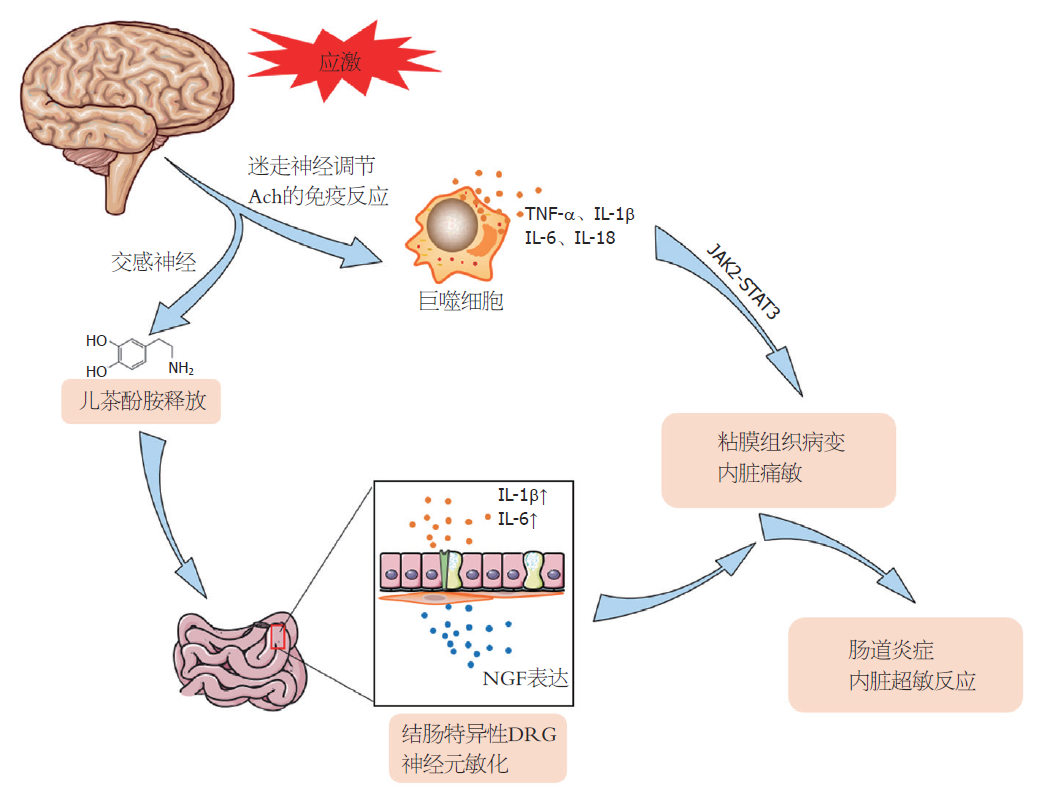
应激导致肠道炎症的产生通过激活交感神经系统, 导致肾上腺髓质激素儿茶酚胺(如: 肾上腺素、去甲肾上腺素)的产生. 儿茶酚胺介导中枢和外周炎症细胞因子的增 加, 儿茶酚胺的释放是应激诱导促炎细胞因子IL-1β与IL-6增加的重要原因[41]. 此外, 内脏痛敏与慢性应激导致的血液中的去甲肾上腺素及肾上腺素相关, 应激状态下, 血液中的去甲肾上腺素及肾上腺素升高, 导致内脏痛敏[42]. 外周血液中儿茶酚胺的浓度也与炎症性肠病的发生发展密切相关, 外源性控制儿茶酚胺血清浓度有助于减少炎性肠病症状, 防止疾病的进一步进展[43]. 此外相关临床研究也发现, 患有肠易激综合征妇女的尿液中儿茶酚胺及皮质醇的含量明显增加[44]. 为期9 d的异型慢性应激显着升高去甲肾上腺素的血浆浓度[45]. 去甲肾上腺素通过增加结肠壁肌肉组织和粘膜及粘膜下层中神经生长因子(nerve growth factor, NGF)的表达, 使结肠特异性背根神经节神经元敏化, 诱导内脏对结肠直肠扩张的超敏反应, 而芬妥拉明联合普萘洛尔进行腹腔注射则阻断了应激诱导的结肠壁的NGF升高[46]. 通过以剂量依赖的方式全身性使用β-肾上腺素能受体拮抗剂普萘洛尔可减轻异型间歇性应激诱导的内脏超敏反应, 但不能通过α-肾上腺素能受体拮抗剂苯妥拉明来减弱. 使用特定的β-肾上腺素受体拮抗剂, β2肾上腺素受体拮抗剂可缓解异型间歇性应激引起的内脏超敏反应, 而β1-或β3肾上腺素受体拮抗剂不能缓解[47]. 多巴胺β-羟化酶是调节儿茶酚胺合成的限速酶, 在束缚应激的小鼠结肠组织中被诱导表达, 表明儿茶酚胺合成与心理应激有关, 使用a2-肾上腺素受体拮抗剂RX821002进行的预处理减弱了心理应激诱导的结肠炎的炎症反应[48]. 因此, α、β-肾上腺素受体通路在交感神经介导肠道炎症的发病机制中具有关键作用, 并且通过调节心理压力以及α、β-肾上腺素受体通路也在肠道炎症的治疗中具有潜在作用.
迷走神经代表副交感神经系统的主要组成部分, 该神经系统负责监督各种重要的身体功能, 包括情绪控制、免疫反应、消化等. 迷走神经在抗炎反应中起重要作用. 它的神经传入受到细菌LPS或其他应激源的刺激, 诱导HPA轴的激活[49]. 有研究表明, Ach是副交感神经抗炎途径的主要因子, 可作为神经免疫细胞因子. 迷走神经可调节Ach的免疫反应, 减少巨噬细胞通过烟碱Ach受体释放的促炎细胞因子(TNF-α、IL-1β、IL-6、IL-18)[50]. 单次急性注射脂多糖(LPS, 10 mg/kg)制作的应激研究中, 通过激活迷走神经或通过外围施用α7烟碱样受体激动剂PHA543613, 激活调节外周免疫反应的神经回路, 阻断前额叶皮质突触抑制的IL-6依赖性降低[51]. 在克罗恩病患者中, 炎症会失去生理稳定性, 降低迷走神经张力, 从而促进TNF-α的过度表达, 而通过刺激迷走神经在这些疾病的治疗中或有一定的作用[52]. 通过对结肠炎模型大鼠的研究发现, 迷走神经刺激可改善模型大鼠体重, 结肠粘膜组织病变以及降低TNF-α和IL-1β mRNA水平[53]. 而自主神经刺激也被用于治疗炎症性肠病[54]. 对7例克罗恩病患者进行迷走神经刺激治疗后进行了6 mo的随访, 其中5例临床症状逐渐缓解, 生物学和内窥镜检查指标恢复, 并伴有迷走神经张力[55]. 此外, 作为副交感神经组成部分的迷走神经在应激状态下活性被抑制, 而刺激迷走神经可通过激活肠道巨噬细胞中的JAK2-STAT3信号通路来改善肠道炎症[56]. 自主神经通过交感及副交感神经传入纤维从肠道传递感觉、化学、机械刺激及伤害性信息, 感觉信息通过脊髓传入中枢神经系统, 通过HPA轴反馈再次作用于肠道, 在此过程中肠神经系统发挥了重要作用.
肠神经系统(enteric nervous system, ENS)由神经细胞、肠神经节、以及神经节之间的神经连接和神经纤维组成, 广泛分布在肠道内, 独立于中枢神经系统, 与肠道的免疫和内分泌系统相互作用从而自主调节肠道功能[57].
研究显示肠易激综合征患者的肠上皮产生并释放活性蛋白酶, 即胰蛋白酶-3能够向粘膜下神经元、初级传入神经传递信号并诱导内脏超敏反应[57]. 并且在慢性应激导致的腹泻型肠易激综合征大鼠模型中发现回肠神经节及神经元数量明显增加, 且与应激相关的腹泻症状及粘膜屏障受损程度可能与粘膜下神经丛分泌运动神经元的增加相关[58].
在雌性早期断奶应激猪模型中观察到肥大细胞数量增加以及与神经元神经节的共定位增强[59]. 感觉神经节中的大麻素受体1控制内脏感觉, 并且在慢性应激条件下, 通过表观遗传过程修饰编码CB1的基因转录. 这些过程可能将应激与腹痛联系在一起. 大麻素系统还集中参与应激的表现, 并且内源性大麻素信号传导通过特定大脑区域(尤其是前额叶皮层, 杏仁核和下丘脑)的作用降低下丘脑-垂体-肾上腺途径的活性. 加深对大麻素系统的了解并可能成为胃肠道疾病的新疗法[60]. 早期母婴分离大鼠的结肠粘膜神经纤维密度在第12周增加, 突触发生在第4周增加, 提前使用抗神经生长因子抗体治疗可减少神经突触的形成[61].
肠神经系统作为引起肠道疾病的关键环节之一, 在应激介导的肠道疾病中发挥着重要作用. 同样, 应激影响外周胃肠道的病变. 粘膜损伤和保护机制均响应应激而激活, 机体接收到应激源刺激后, 血流从内脏区域重新分配至重要器官, 引起的粘膜循环减少可能是胃粘膜损伤的机制, 粘膜灌注不足可导致粘膜缺血、自由基形成和胃动力不足[62].
除此之外, 肠道自身的免疫细胞在参与应激介导肠道疾病中也扮演着重要角色.
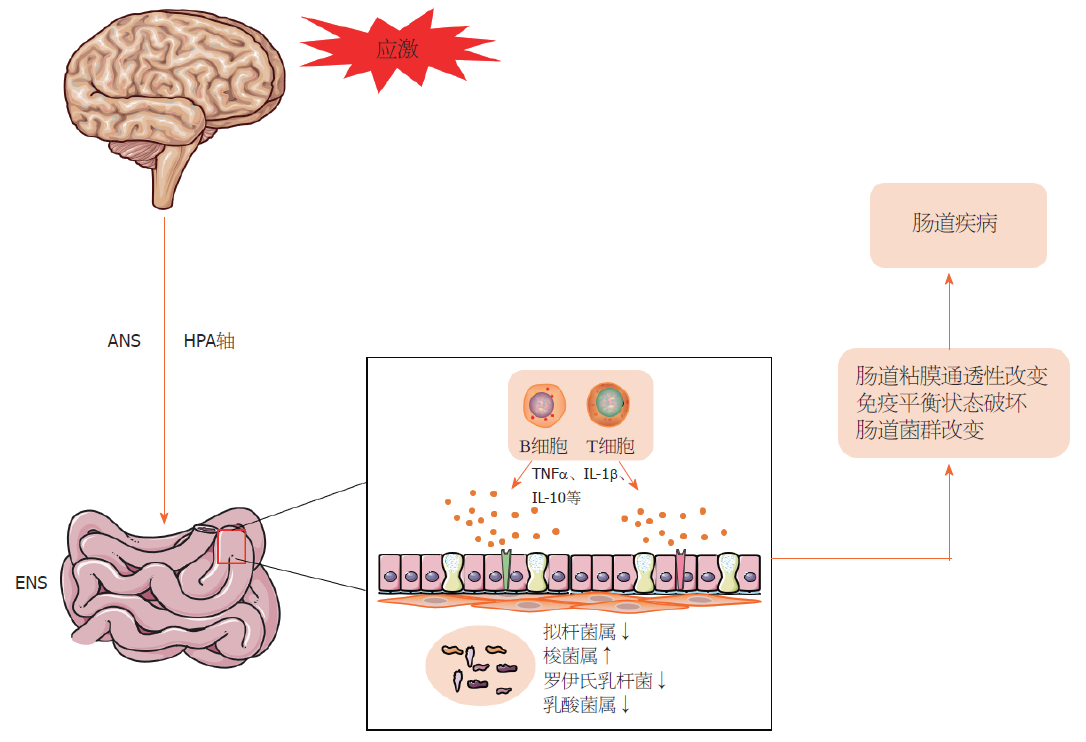
肠道具有重要的屏障和免疫功能, 可与腔内微生物群相互作用, 并能抵抗潜在的病原体和抗原性物质(图3). 这些重要的功能有赖于广泛分布在肠道的T细胞、B细胞、中性粒细胞以及巨噬细胞等免疫细胞维持肠道内环境的平衡. 同时肠道菌群与宿主相互作用, 维持肠道的正常功能和健康状态.
肠道内环境的平衡依赖于自身的先天免疫和适应性免疫, 其中先天免疫及适应性免疫细胞, 如B细胞、T细胞、中性粒细胞以及巨噬细胞、肥大细胞等在炎症性肠病的发生发展中具有重要作用[63]. 研究显示消化系统中免疫原结构的细胞组成变化在应激后早期(第1周)最为显著, 被动行为大鼠在极度暴露后, 小肠中B细胞和T细胞依赖性区域的细胞结构变化显著[64]. 49例腹泻型肠易激综合症患者的单次粘膜空肠活检显示, 腹泻型肠易激综合症患者黏膜B淋巴细胞和浆细胞数量和活化表现更多[65]. 同时, 慢性应激会导致小鼠对硫酸葡聚糖钠诱导结肠炎的敏感性, 增加结肠固有层B细胞、中性粒细胞和巨噬细胞的浸润[66]. 其中有研究显示炎症性肠道疾病模型小鼠的肠道淋巴组织中B细胞的亚群CD1d表达上调, 产生IL-10且CD1d的上调通过抑制IL-1的上调以及STAT3的激活来抑制肠道炎症的发展[67]. 将脂联素敲除并给予口服葡聚糖硫酸钠7天的小鼠表现出严重的结肠炎、更严重的炎性细胞浸润和活化B细胞的增加, 脂联素通过与其受体AdipoR1的相互作用和调节适应性免疫力, 维持肠道的稳态并预防鼠类结肠炎[68].
应激可介导肠内T细胞转化为IL-17+Foxp3+T细胞, 使TNFα释放增加, 从而导致肠道炎症[69]. 此外对组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor, HDAC)敲除小鼠研究表明, HDAC6可能通过抑制T细胞功能, 在IBD炎症进展中发挥重要的促炎症作用[70]. 一部分克罗恩病患者中, 多药耐药蛋白1 (multidrug resistance protein 1, MDR1)减轻了暴露于共轭胆汁酸的回肠中的粘膜CD4 + T效应细胞的氧化应激并增强了体内稳态[71]. 应激可能诱导MICA和MICB的表达和被具有可变区Vdelta1γδT细胞受体的T细胞的识别, 并调节肠道上皮中的Vdelta1γδT细胞的保护反应[72]. 另外有研究证明, 应激通过抑制细胞凋亡对猪肠粘膜系统的免疫功能产生负面影响. 在持续10 d, 每天4 h暴露于39 ℃下的猪慢性热应激模型条件下, 小肠中CD3 + T细胞的数量均急剧增加, 揭示了慢性热应激使免疫功能的平衡状态被破坏[73].
除B细胞及T细胞外, 中性粒细胞、巨噬细胞及肥大细胞在肠道疾病的发生发展中也具有重要作用. 在炎症性肠道疾病中, 中性粒细胞的浸润会导致肠上皮屏障功能受损, 分泌促炎细胞因子[74]. 而应激会导致结肠组织中的中性粒细胞增多、中性粒细胞浸润, 并且中性粒细胞的改变与结肠的损伤密切相关, 且使用抑制应激反应的相关药物可减少循环中的中性粒细胞数量, 抑制中性粒细胞向结肠组织的浸润, 减轻慢性应激引起的结肠组织损伤[75]. 巨噬细胞的自噬对于控制响应代谢或外源性应激的炎症小体活化很重要, 而巨噬细胞的自噬不足可能会导致与脂质损伤和结肠炎相关的代谢综合征的发展[76]. 并且外源性活化巨噬细胞也可显著降低二硝基苯磺酸诱导的结肠炎的严重程度[77]. 肠道通透性增加是功能性和器质性胃肠道疾病的显著特点, 肥大细胞和CRF在调节结肠粘膜屏障中发挥重要作用[78-80]. 有研究显示慢性应激可诱导结肠远端肥大细胞增生, 使肥大细胞广泛活化, 从而介导肠道粘膜通透性增加[81]. CRF还通过肥大细胞释放肿瘤坏死因子(tumor necrosis factor, TNF) -α和蛋白酶来增加肠道通透性通过选择性拮抗剂靶向CRF受体以抑制肥大细胞活化可成为因应激而加剧的慢性炎性疾病的治疗选择[82]. 从以上所有研究中我们可以得知肠道免疫细胞在介导应激导致的肠道疾病的发生发展中同样发挥了重要的作用.
肠道菌群在健康和疾病活跃状态下的结构和功能均有不同, 与炎症性肠病的发生发展及预后息息相关, 其通过代谢交换和底物协同代谢与宿主相互作用, 维持肠道的正常功能和健康状态[83,84]. 在这一基础上也提出了微生物-肠-脑轴的概念[85]. 而导致肠道菌群改变的炎症改变也会增强肠内病原体在肠道中的定植能力, 增加疾病易感性[86]. 肠道功能和微生物群受到应激的影响, 应激前后肠道菌群组成和粪便中与肠道菌群相关的代谢物浓度的变化与肠道通透性增加有关[87]. 应激可能通过粘膜免疫激活而引起肠道菌群活性和组成改变的重要因素, 特别是在某些特定的微生物种类中, 如毛螺菌科[88]. 避水胁迫应激模型小鼠有明显的抑郁行为, 其大脑神经活性增强, 肠道免疫激活, 出现低度炎症浸润, 同时肠道菌群亦发生改变[89]. 暴露于社会破坏应激源的成年小鼠显示出菌群的稳定性的改变, 导致细菌移位, 其中应激源暴露降低了拟杆菌属细菌的相对丰度, 而增加了梭菌属细菌的相对丰度[90]. 此外这种应激会导致罗伊氏乳杆菌的数量减少, 促进了促炎基因表达和单核细胞分化, 增加了与炎症相关疾病的风险[91,92].
慢性产前压应激的大鼠模型中, 从胚胎的第14天到第20天, 怀孕大鼠受到反复的约束应激刺激, 并在4 mo大时评估了它们的雄性后代, 其子代肠道菌群会发生改变, 例如乳酸菌属的细菌数量会出现明显减少[93]. 研究表明, 出生后产前和产后应激均可影响微生物定植[94]. 并且, 在出生后的4-13 d开始对雄性幼鼠施用万古霉素, 显着改变了微生物群, 肠道微生物群在早期生命中的暂时破坏会导致雄性大鼠内脏敏感性发生非常特定且持久的变化, 这是应激相关的脑肠轴功能障碍(如肠易激疾病)的表现[95]. 说明生命早期所接受的应激会对肠道微生物产生长期的影响.
应激在引起肠道微生物群改变的同时, 对肠道微生物群的调节又会反过来改变应激反应, 这进一步强调了脑-肠轴的双向性. 例如, 在社会应激下, 局部使用抗生素后显示出类似于益生菌的缓解社会压力的作用, 并且也改变了社会压力对前额叶及前扣带皮层的影响[96]. 研究显示, 益生菌疗法或可减少避水胁迫应激诱发的肠炎小鼠的肠道炎症[89]. 褪黑激素能通过断奶小鼠模型中的肠道菌群缓解断奶应激. 在断奶小鼠中补充褪黑激素(在饮用水中以0.2 mg/mL的剂量提供2 wk)可显着改善体重情况及肠道形态, 通过离体增殖测定和结肠环增殖测定证实褪黑素可增加肠道菌群的丰富指数并影响肠道菌群的组成, 也可显着降低大肠杆菌感染的断奶小鼠的细菌负荷[97].
3.4.1 CRF: CRF主要在结肠的远端表达, 在粘膜下和肌肉层表达水平最高, 外周注射CRF或CRF1激动剂可模拟急性应激对结肠的影响[98,99]. 在肠道局部表达的外周CRF信号对胃肠道应激反应同样起到重要的作用[98,100]. 由空间束缚产生的应激也会导致大鼠结肠CRF mRNA水平的升高[101]. 在大鼠避水应激实验中也发现外周CRF2和中枢多巴胺D2受体降低应激诱导的内脏痛敏反应, 且这一过程与传统镇痛物质阿片受体无关[102]. 同时, 外周CRF的释放会介导应激诱导的肠道屏障功能的受损, CRF配体会增加肠道的通透性, 且依赖于CRF1的激活[31,82,98]. CRF引起的肠道通透性的改变与内脏超敏反应相一致[103]. 而使用CRF的拮抗剂也可以改善胃肠道运动、内脏超敏反应以及肠道刺激引起的负面[98]. 因此肠道内源性CRF在应激引起的结肠运动和分泌功能的改变中也发挥了关键作用.
3.4.2 P物质: P物质(Substance P, SP)通过激活其受体神经激肽(neurokinin, NK)受体NK1、NK2、NK3来调节机体的免疫活动. SP也参与到应激诱导的炎症性肠道疾病模型中. 目前的研究发现, 慢性避水应激诱导的SP表达升高, 并且参与内脏痛觉过敏的维持[104,105]. 应激可诱导炎症的发展. 在三硝基苯磺酸结肠炎模型中, 结肠粘膜SP表达升高, 慢性束缚应激影响下, 粘膜中SP增加更明显, 表明应激导致肠道炎症加剧可能由粘膜中SP介导[106]. 并且有研究显示SP的释放与TRPA1的激活相关, 在避水应激实验中, 激活TRPA1, 导致SP的释放, 对诱导和加重应激后大鼠十二指肠损伤起重要作用[107]. 此外, 在避水应激实验中还发现, TRPV1和SP相关基因在结肠表达升高, 而在使用中药方剂疏肝汤后, 内脏痛敏减轻, 且TRPV1和SP相关基因表达减少[108]. 可知SP也可作为治疗肠道疾病的靶点.
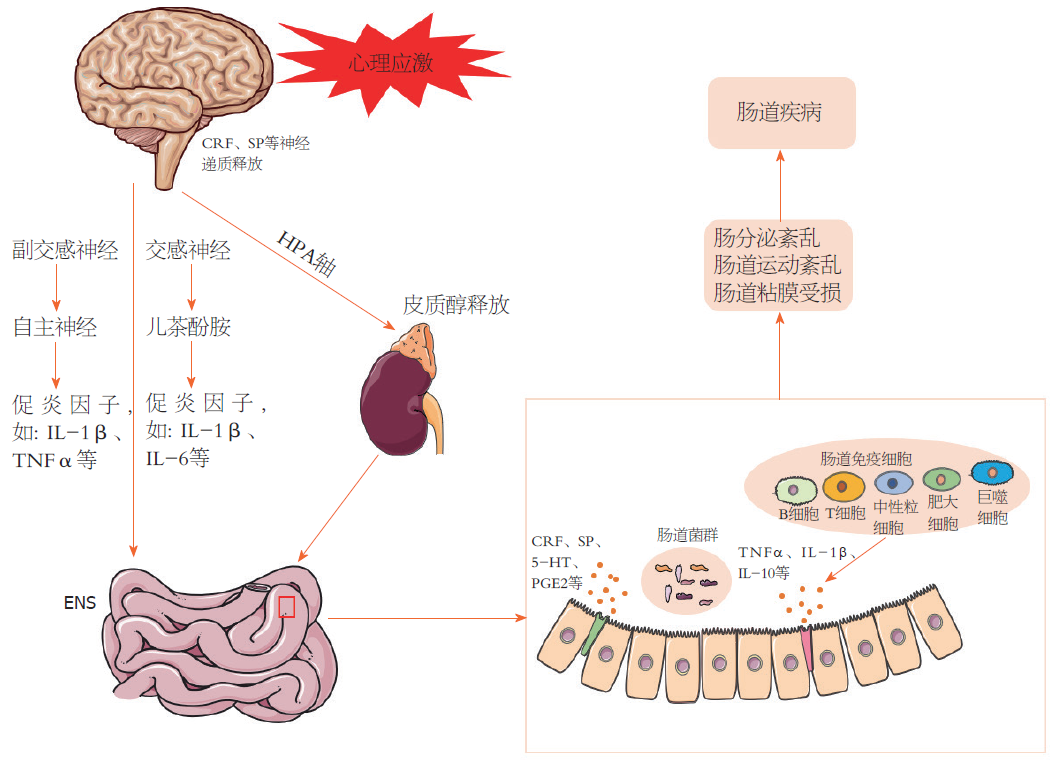
应激参与了众多肠道疾病的发生及发展, 暴露于应激状况下是肠道疾病的危险因素. 应激与肠道疾病的发生涉及以下多个环节(图4). 接收应激信号传入的中枢应激通路释放CRF进入门静脉系统启动HPA轴功能, 通过垂体皮质激素刺激ACTH释放, 通过血液循环, 促使肾上腺糖皮质激素的合成和分泌, 从而为机体应对应激事件做好准备. 此过程中, CRFR1和CRFR2的信号平衡可能决定了应激诱导的胃肠道功能变化; 机体接受应激刺激后激活交感神经系统, 促进儿茶酚胺释放, 诱导促炎因子增加及结肠特异性背根神经节神经元敏化, 从而诱导内脏痛敏. 同时, 迷走神经可调节Ach的免疫反应, 减少巨噬细胞通过Ach受体释放的促炎细胞因子. 而感觉、化学、机械刺激及伤害性信息的传递及HPA轴反馈作用于肠道的过程中, 肠神经系统发挥了重要作用; 应激可致肠内B细胞及T细胞增加或转化, 释放相关的致炎及抗炎因子参与肠道疾病的发生发展. 而微生物-肠-脑轴概念的提出也为探索应激参与肠道疾病的发生机制提供新的途径. 应激或通过粘膜免疫激活影响肠道微生物群, 引起肠道菌群活性和组成改变, 导致肠道疾病的发生.
未来肠道疾病的治疗, 如果考虑应激因素, 可能平衡CRF1及CRF2受体信号是其中一个选择; α、β-肾上腺素受体通路也可能是肠道炎症潜在的治疗靶点. 对迷走神经的调节, 以及采用不同方式(如电刺激等)对自主神经、肠神经及脊髓进行刺激, 可能是减少药物干预胃肠道副作用的新兴方式, 如电针通过多巴胺介导免疫系统的迷走调节产生抗炎作用[109]; 以及刺激外周神经缓解肠道疾病[110]等. 另外, 以肠道菌群为靶点的疗法, 关注应激对微生物-肠-脑轴调控系统的影响或也将成为肠道疾病未来治疗的重要方向.
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 马亚娟 制作编辑:刘继红
| 1. | Chrousos GP, Gold PW. The concepts of stress and stress system disorders. Overview of physical and behavioral homeostasis. JAMA. 1992;267:1244-1252. [PubMed] [DOI] |
| 2. | Chrousos GP. Stress and disorders of the stress system. Nat Rev Endocrinol. 2009;5:374-381. [PubMed] [DOI] |
| 3. | Bhatia V, Tandon RK. Stress and the gastrointestinal tract. J Gastroenterol Hepatol. 2005;20:332-339. [PubMed] [DOI] |
| 4. | Butterfield DA, Halliwell B. Oxidative stress, dysfunctional glucose metabolism and Alzheimer disease. Nat Rev Neurosci. 2019;20:148-160. [PubMed] [DOI] |
| 5. | McCormick C, Khaperskyy DA. Translation inhibition and stress granules in the antiviral immune response. Nat Rev Immunol. 2017;17:647-660. [PubMed] [DOI] |
| 6. | Liu Q, Körner H, Wu H, Wei W. Endoplasmic reticulum stress in autoimmune diseases. Immunobiology. 2020;225:151881. [PubMed] [DOI] |
| 7. | Burroughs Peña MS, Mbassa RS, Slopen NB, Williams DR, Buring JE, Albert MA. Cumulative Psychosocial Stress and Ideal Cardiovascular Health in Older Women. Circulation. 2019;139:2012-2021. [PubMed] [DOI] |
| 8. | Chang HH, Hsu SP, Chien CT. Intrarenal Transplantation of Hypoxic Preconditioned Mesenchymal Stem Cells Improves Glomerulonephritis through Anti-Oxidation, Anti-ER Stress, Anti-Inflammation, Anti-Apoptosis, and Anti-Autophagy. Antioxidants (Basel). 2019;9. [PubMed] [DOI] |
| 9. | Zhao JL, Baltimore D. Regulation of stress-induced hematopoiesis. Curr Opin Hematol. 2015;22:286-292. [PubMed] [DOI] |
| 10. | Guerrero-Alba R, Valdez-Morales EE, Jimenez-Vargas NN, Lopez-Lopez C, Jaramillo-Polanco J, Okamoto T, Nasser Y, Bunnett NW, Lomax AE, Vanner SJ. Stress activates pronociceptive endogenous opioid signalling in DRG neurons during chronic colitis. Gut. 2017;66:2121-2131. [PubMed] [DOI] |
| 11. | Lackner JM, Ma CX, Keefer L, Brenner DM, Gudleski GD, Satchidanand N, Firth R, Sitrin MD, Katz L, Krasner SS, Ballou SK, Naliboff BD, Mayer EA. Type, rather than number, of mental and physical comorbidities increases the severity of symptoms in patients with irritable bowel syndrome. Clin Gastroenterol Hepatol. 2013;11:1147-1157. [PubMed] [DOI] |
| 12. | Henningsen P, Zimmermann T, Sattel H. Medically unexplained physical symptoms, anxiety, and depression: a meta-analytic review. Psychosom Med. 2003;65:528-533. [PubMed] [DOI] |
| 13. | Whitehead WE, Palsson O, Jones KR. Systematic review of the comorbidity of irritable bowel syndrome with other disorders: what are the causes and implications? Gastroenterology. 2002;122:1140-1156. [PubMed] [DOI] |
| 14. | Gagnière J, Raisch J, Veziant J, Barnich N, Bonnet R, Buc E, Bringer MA, Pezet D, Bonnet M. Gut microbiota imbalance and colorectal cancer. World J Gastroenterol. 2016;22:501-518. [PubMed] [DOI] |
| 15. | Gracie DJ, Ford AC. IBS-like symptoms in patients with ulcerative colitis. Clin Exp Gastroenterol. 2015;8:101-109. [PubMed] [DOI] |
| 16. | Matsuki N, Fujita T, Watanabe N, Sugahara A, Watanabe A, Ishida T, Morita Y, Yoshida M, Kutsumi H, Hayakumo T, Mukai H, Azuma T. Lifestyle factors associated with gastroesophageal reflux disease in the Japanese population. J Gastroenterol. 2013;48:340-349. [PubMed] [DOI] |
| 17. | Mawdsley JE, Rampton DS. Psychological stress in IBD: new insights into pathogenic and therapeutic implications. Gut. 2005;54:1481-1491. [PubMed] [DOI] |
| 18. | Rhee SH, Pothoulakis C, Mayer EA. Principles and clinical implications of the brain-gut-enteric microbiota axis. Nat Rev Gastroenterol Hepatol. 2009;6:306-314. [PubMed] [DOI] |
| 19. | Mayer EA. Gut feelings: the emerging biology of gut-brain communication. Nat Rev Neurosci. 2011;12:453-466. [PubMed] [DOI] |
| 20. | Sawchenko PE, Li HY, Ericsson A. Circuits and mechanisms governing hypothalamic responses to stress: a tale of two paradigms. Prog Brain Res. 2000;122:61-78. [PubMed] [DOI] |
| 21. | Vale W, Spiess J, Rivier C, Rivier J. Characterization of a 41-residue ovine hypothalamic peptide that stimulates secretion of corticotropin and beta-endorphin. Science. 1981;213:1394-1397. [PubMed] [DOI] |
| 22. | Heinrichs SC, Menzaghi F, Merlo Pich E, Britton KT, Koob GF. The role of CRF in behavioral aspects of stress. Ann N Y Acad Sci. 1995;771:92-104. [PubMed] [DOI] |
| 23. | Koob GF, Heinrichs SC. A role for corticotropin releasing factor and urocortin in behavioral responses to stressors. Brain Res. 1999;848:141-152. [PubMed] [DOI] |
| 24. | Bosch OJ, Pohl TT, Neumann ID, Young LJ. Abandoned prairie vole mothers show normal maternal care but altered emotionality: Potential influence of the brain corticotropin-releasing factor system. Behav Brain Res. 2018;341:114-121. [PubMed] [DOI] |
| 25. | Henckens MJ, Deussing JM, Chen A. Region-specific roles of the corticotropin-releasing factor-urocortin system in stress. Nat Rev Neurosci. 2016;17:636-651. [PubMed] [DOI] |
| 26. | Tillinger A, Horváthová Ľ, Nostramo R, Serova LI, Kvetňanský R, Sabban EL, Mravec B. Glucocorticoid withdrawal affects stress-induced changes of urocortin 2 gene expression in rat adrenal medulla and brain. J Neuroendocrinol. 2018;e12595. [PubMed] [DOI] |
| 27. | Gracie DJ, Hamlin PJ, Ford AC. The influence of the brain-gut axis in inflammatory bowel disease and possible implications for treatment. Lancet Gastroenterol Hepatol. 2019;4:632-642. [PubMed] [DOI] |
| 28. | Gracie DJ, Guthrie EA, Hamlin PJ, Ford AC. Bi-directionality of Brain-Gut Interactions in Patients With Inflammatory Bowel Disease. Gastroenterology. 2018;154:1635-1646.e3. [PubMed] [DOI] |
| 29. | O'Mahony SM, Hyland NP, Dinan TG, Cryan JF. Maternal separation as a model of brain-gut axis dysfunction. Psychopharmacology. 2011;214:71-88. |
| 30. | Barreau F, Ferrier L, Fioramonti J, Bueno L. New insights in the etiology and pathophysiology of irritable bowel syndrome: contribution of neonatal stress models. Pediatric research. 2007;62:240-245. |
| 31. | Nozu T, Okumura T. Corticotropin-releasing factor receptor type 1 and type 2 interaction in irritable bowel syndrome. J Gastroenterol. 2015;50:819-830. [PubMed] [DOI] |
| 32. | Moss AC, Anton P, Savidge T, Newman P, Cheifetz AS, Gay J, Paraschos S, Winter MW, Moyer MP, Karalis K, Kokkotou E, Pothoulakis C. Urocortin II mediates pro-inflammatory effects in human colonocytes via corticotropin-releasing hormone receptor 2alpha. Gut. 2007;56:1210-1217. [PubMed] [DOI] |
| 33. | Martínez V, Wang L, Rivier J, Grigoriadis D, Taché Y. Central CRF, urocortins and stress increase colonic transit via CRF1 receptors while activation of CRF2 receptors delays gastric transit in mice. J Physiol. 2004;556:221-234. [PubMed] [DOI] |
| 34. | Bülbül M, İzgüt-Uysal VN, Sinen O, Birsen İ, Tanrıöver G. Central apelin mediates stress-induced gastrointestinal motor dysfunction in rats. Am J Physiol Gastrointest Liver Physiol. 2016;310:G249-G261. [PubMed] [DOI] |
| 35. | Yang Y, Babygirija R, Zheng J, Shi B, Sun W, Zheng X, Zhang F, Cao Y. Central Neuropeptide Y Plays an Important Role in Mediating the Adaptation Mechanism Against Chronic Stress in Male Rats. Endocrinology. 2018;159:1525-1536. [PubMed] [DOI] |
| 36. | Ramot A, Jiang Z, Tian JB, Nahum T, Kuperman Y, Justice N, Chen A. Hypothalamic CRFR1 is essential for HPA axis regulation following chronic stress. Nat Neurosci. 2017;20:385-388. [PubMed] [DOI] |
| 37. | Moussaoui N, Braniste V, Ait-Belgnaoui A, Gabanou M, Sekkal S, Olier M, Théodorou V, Martin PG, Houdeau E. Changes in intestinal glucocorticoid sensitivity in early life shape the risk of epithelial barrier defect in maternal-deprived rats. PLoS One. 2014;9:e88382. [PubMed] [DOI] |
| 38. | Zong Y, Zhu S, Zhang S, Zheng G, Wiley JW, Hong S. Chronic stress and intestinal permeability: Lubiprostone regulates glucocorticoid receptor-mediated changes in colon epithelial tight junction proteins, barrier function, and visceral pain in the rodent and human. Neurogastroenterol Motil. 2019;31:e13477. [PubMed] [DOI] |
| 39. | Zheng G, Wu SP, Hu Y, Smith DE, Wiley JW, Hong S. Corticosterone mediates stress-related increased intestinal permeability in a region-specific manner. Neurogastroenterol Motil. 2013;25:e127-e139. [PubMed] [DOI] |
| 40. | Million M, Larauche M. Stress, sex, and the enteric nervous system. Neurogastroenterol Motil. 2016;28:1283-1289. [PubMed] [DOI] |
| 41. | Johnson JD, Campisi J, Sharkey CM, Kennedy SL, Nickerson M, Greenwood BN, Fleshner M. Catecholamines mediate stress-induced increases in peripheral and central inflammatory cytokines. Neuroscience. 2005;135:1295-1307. [PubMed] [DOI] |
| 42. | Posserud I, Agerforz P, Ekman R, Björnsson ES, Abrahamsson H, Simrén M. Altered visceral perceptual and neuroendocrine response in patients with irritable bowel syndrome during mental stress. Gut. 2004;53:1102-1108. [PubMed] [DOI] |
| 43. | Mittal R, Debs LH, Patel AP, Nguyen D, Patel K, O'Connor G, Grati M, Mittal J, Yan D, Eshraghi AA, Deo SK, Daunert S, Liu XZ. Neurotransmitters: The Critical Modulators Regulating Gut-Brain Axis. J Cell Physiol. 2017;232:2359-2372. [PubMed] [DOI] |
| 44. | Heitkemper M, Jarrett M, Cain K, Shaver J, Bond E, Woods NF, Walker E. Increased urine catecholamines and cortisol in women with irritable bowel syndrome. Am J Gastroenterol. 1996;91:906-913. [PubMed] |
| 45. | Choudhury BK, Shi XZ, Sarna SK. Norepinephrine mediates the transcriptional effects of heterotypic chronic stress on colonic motor function. Am J Physiol Gastrointest Liver Physiol. 2009;296:G1238-G1247. [PubMed] [DOI] |
| 46. | Winston JH, Xu GY, Sarna SK. Adrenergic stimulation mediates visceral hypersensitivity to colorectal distension following heterotypic chronic stress. Gastroenterology. 2010;138:294-304.e3. [PubMed] [DOI] |
| 47. | Zhang C, Rui YY, Zhou YY, Ju Z, Zhang HH, Hu CY, Xiao Y, Xu GY. Adrenergic β2-receptors mediates visceral hypersensitivity induced by heterotypic intermittent stress in rats. PLoS One. 2014;9:e94726. [PubMed] [DOI] |
| 48. | Bai A, Chen J, Liao W, Lu N, Guo Y. Catecholamine Mediates Psychological Stress-Induced Colitis Through a2-Adrenoreceptor. J Interferon Cytokine Res. 2015;35:580-584. [PubMed] [DOI] |
| 49. | Sgambato D, Miranda A, Ranaldo R, Federico A, Romano M. The Role of Stress in Inflammatory Bowel Diseases. Curr Pharm Des. 2017;23:3997-4002. [PubMed] [DOI] |
| 50. | Borovikova LV, Ivanova S, Zhang M, Yang H, Botchkina GI, Watkins LR, Wang H, Abumrad N, Eaton JW, Tracey KJ. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin. Nature. 2000;405:458-462. [PubMed] [DOI] |
| 51. | Garcia-Oscos F, Peña D, Housini M, Cheng D, Lopez D, Borland MS, Salgado-Delgado R, Salgado H, D'Mello S, Kilgard MP, Rose-John S, Atzori M. Vagal nerve stimulation blocks interleukin 6-dependent synaptic hyperexcitability induced by lipopolysaccharide-induced acute stress in the rodent prefrontal cortex. Brain Behav Immun. 2015;43:149-158. [PubMed] [DOI] |
| 52. | Pellissier S, Dantzer C, Mondillon L, Trocme C, Gauchez AS, Ducros V, Mathieu N, Toussaint B, Fournier A, Canini F, Bonaz B. Relationship between vagal tone, cortisol, TNF-alpha, epinephrine and negative affects in Crohn's disease and irritable bowel syndrome. PLoS One. 2014;9:e105328. [PubMed] [DOI] |
| 53. | Meregnani J, Clarençon D, Vivier M, Peinnequin A, Mouret C, Sinniger V, Picq C, Job A, Canini F, Jacquier-Sarlin M, Bonaz B. Anti-inflammatory effect of vagus nerve stimulation in a rat model of inflammatory bowel disease. Auton Neurosci. 2011;160:82-89. [PubMed] [DOI] |
| 54. | Cheng J, Shen H, Chowdhury R, Abdi T, Selaru F, Chen JDZ. Potential of Electrical Neuromodulation for Inflammatory Bowel Disease. Inflamm Bowel Dis. 2019;. [PubMed] [DOI] |
| 55. | Bonaz B, Sinniger V, Hoffmann D, Clarençon D, Mathieu N, Dantzer C, Vercueil L, Picq C, Trocmé C, Faure P, Cracowski JL, Pellissier S. Chronic vagus nerve stimulation in Crohn's disease: a 6-month follow-up pilot study. Neurogastroenterol Motil. 2016;28:948-953. [PubMed] [DOI] |
| 56. | de Jonge WJ, van der Zanden EP, The FO, Bijlsma MF, van Westerloo DJ, Bennink RJ, Berthoud HR, Uematsu S, Akira S, van den Wijngaard RM, Boeckxstaens GE. Stimulation of the vagus nerve attenuates macrophage activation by activating the Jak2-STAT3 signaling pathway. Nat Immunol. 2005;6:844-851. [PubMed] [DOI] |
| 57. | Rolland-Fourcade C, Denadai-Souza A, Cirillo C, Lopez C, Jaramillo JO, Desormeaux C, Cenac N, Motta JP, Larauche M, Taché Y, Vanden Berghe P, Neunlist M, Coron E, Kirzin S, Portier G, Bonnet D, Alric L, Vanner S, Deraison C, Vergnolle N. Epithelial expression and function of trypsin-3 in irritable bowel syndrome. Gut. 2017;66:1767-1778. [PubMed] [DOI] |
| 58. | Li S, Fei G, Fang X, Yang X, Sun X, Qian J, Wood JD, Ke M. Changes in Enteric Neurons of Small Intestine in a Rat Model of Irritable Bowel Syndrome with Diarrhea. J Neurogastroenterol Motil. 2016;22:310-320. [PubMed] [DOI] |
| 59. | Pohl CS, Medland JE, Mackey E, Edwards LL, Bagley KD, DeWilde MP, Williams KJ, Moeser AJ. Early weaning stress induces chronic functional diarrhea, intestinal barrier defects, and increased mast cell activity in a porcine model of early life adversity. Neurogastroenterol Motil. 2017;29. [PubMed] [DOI] |
| 60. | Sharkey KA, Wiley JW. The Role of the Endocannabinoid System in the Brain-Gut Axis. Gastroenterology. 2016;151:252-266. [PubMed] [DOI] |
| 61. | Barreau F, Salvador-Cartier C, Houdeau E, Bueno L, Fioramonti J. Long-term alterations of colonic nerve-mast cell interactions induced by neonatal maternal deprivation in rats. Gut. 2008;57:582-590. [PubMed] [DOI] |
| 62. | Gyires K, Feher A. Stress, Neuropeptides and Gastric Mucosa. Curr Pharm Des. 2017;23:3928-3940. [PubMed] [DOI] |
| 63. | Sun M, He C, Cong Y, Liu Z. Regulatory immune cells in regulation of intestinal inflammatory response to microbiota. Mucosal Immunol. 2015;8:969-978. [PubMed] [DOI] |
| 64. | Koplik EV, Ivanova EA, Pertsov SS. Cellular Composition of the B- and T-Cell-Dependent Areas in the Small Intestine during the Post-Stress Period (Experimental Study). Bull Exp Biol Med. 2018;164:413-419. [PubMed] [DOI] |
| 65. | Vicario M, González-Castro AM, Martínez C, Lobo B, Pigrau M, Guilarte M, de Torres I, Mosquera JL, Fortea M, Sevillano-Aguilera C, Salvo-Romero E, Alonso C, Rodiño-Janeiro BK, Söderholm JD, Azpiroz F, Santos J. Increased humoral immunity in the jejunum of diarrhoea-predominant irritable bowel syndrome associated with clinical manifestations. Gut. 2015;64:1379-1388. [PubMed] [DOI] |
| 66. | Gao X, Cao Q, Cheng Y, Zhao D, Wang Z, Yang H, Wu Q, You L, Wang Y, Lin Y, Li X, Wang Y, Bian JS, Sun D, Kong L, Birnbaumer L, Yang Y. Chronic stress promotes colitis by disturbing the gut microbiota and triggering immune system response. Proc Natl Acad Sci U S A. 2018;115:E2960-E2969. [PubMed] [DOI] |
| 67. | Mizoguchi A, Mizoguchi E, Takedatsu H, Blumberg RS, Bhan AK. Chronic intestinal inflammatory condition generates IL-10-producing regulatory B cell subset characterized by CD1d upregulation. Immunity. 2002;16:219-230. [PubMed] [DOI] |
| 68. | Obeid S, Wankell M, Charrez B, Sternberg J, Kreuter R, Esmaili S, Ramezani-Moghadam M, Devine C, Read S, Bhathal P, Lopata A, Ahlensteil G, Qiao L, George J, Hebbard L. Adiponectin confers protection from acute colitis and restricts a B cell immune response. J Biol Chem. 2017;292:6569-6582. [PubMed] [DOI] |
| 69. | Wu W, Sun M, Zhang HP, Chen T, Wu R, Liu C, Yang G, Geng XR, Feng BS, Liu Z, Liu Z, Yang PC. Prolactin mediates psychological stress-induced dysfunction of regulatory T cells to facilitate intestinal inflammation. Gut. 2014;63:1883-1892. [PubMed] [DOI] |
| 70. | de Zoeten EF, Wang L, Butler K, Beier UH, Akimova T, Sai H, Bradner JE, Mazitschek R, Kozikowski AP, Matthias P, Hancock WW. Histone deacetylase 6 and heat shock protein 90 control the functions of Foxp3(+) T-regulatory cells. Mol Cell Biol. 2011;31:2066-2078. [PubMed] [DOI] |
| 71. | Cao W, Kayama H, Chen ML, Delmas A, Sun A, Kim SY, Rangarajan ES, McKevitt K, Beck AP, Jackson CB, Crynen G, Oikonomopoulos A, Lacey PN, Martinez GJ, Izard T, Lorenz RG, Rodriguez-Palacios A, Cominelli F, Abreu MT, Hommes DW, Koralov SB, Takeda K, Sundrud MS. The Xenobiotic Transporter Mdr1 Enforces T Cell Homeostasis in the Presence of Intestinal Bile Acids. Immunity. 2017;47:1182-1196.e10. [PubMed] [DOI] |
| 72. | Groh V, Steinle A, Bauer S, Spies T. Recognition of stress-induced MHC molecules by intestinal epithelial gammadelta T cells. Science. 1998;279:1737-1740. [PubMed] [DOI] |
| 73. | Huo C, Xiao C, She R, Liu T, Tian J, Dong H, Tian H, Hu Y. Chronic heat stress negatively affects the immune functions of both spleens and intestinal mucosal system in pigs through the inhibition of apoptosis. Microb Pathog. 2019;136:103672. [PubMed] [DOI] |
| 74. | Brazil JC, Louis NA, Parkos CA. The role of polymorphonuclear leukocyte trafficking in the perpetuation of inflammation during inflammatory bowel disease. Inflamm Bowel Dis. 2013;19:1556-1565. [PubMed] [DOI] |
| 75. | Deng Q, Chen H, Liu Y, Xiao F, Guo L, Liu D, Cheng X, Zhao M, Wang X, Xie S, Qi S, Yin Z, Gao J, Chen X, Wang J, Guo N, Ma Y, Shi M. Psychological stress promotes neutrophil infiltration in colon tissue through adrenergic signaling in DSS-induced colitis model. Brain Behav Immun. 2016;57:243-254. [PubMed] [DOI] |
| 76. | Lee HY, Kim J, Quan W, Lee JC, Kim MS, Kim SH, Bae JW, Hur KY, Lee MS. Autophagy deficiency in myeloid cells increases susceptibility to obesity-induced diabetes and experimental colitis. Autophagy. 2016;12:1390-1403. [PubMed] [DOI] |
| 77. | Hunter MM, Wang A, Parhar KS, Johnston MJ, Van Rooijen N, Beck PL, McKay DM. In vitro-derived alternatively activated macrophages reduce colonic inflammation in mice. Gastroenterology. 2010;138:1395-1405. [PubMed] [DOI] |
| 78. | Wallon C, Persborn M, Jönsson M, Wang A, Phan V, Lampinen M, Vicario M, Santos J, Sherman PM, Carlson M, Ericson AC, McKay DM, Söderholm JD. Eosinophils express muscarinic receptors and corticotropin-releasing factor to disrupt the mucosal barrier in ulcerative colitis. Gastroenterology. 2011;140:1597-1607. [PubMed] [DOI] |
| 79. | Camilleri M, Madsen K, Spiller R, Greenwood-Van Meerveld B, Verne GN. Intestinal barrier function in health and gastrointestinal disease. Neurogastroenterol Motil. 2012;24:503-512. [PubMed] [DOI] |
| 80. | Salim SY, Söderholm JD. Importance of disrupted intestinal barrier in inflammatory bowel diseases. Inflamm Bowel Dis. 2011;17:362-381. [PubMed] [DOI] |
| 81. | Vicario M, Guilarte M, Alonso C, Yang P, Martínez C, Ramos L, Lobo B, González A, Guilà M, Pigrau M, Saperas E, Azpiroz F, Santos J. Chronological assessment of mast cell-mediated gut dysfunction and mucosal inflammation in a rat model of chronic psychosocial stress. Brain Behav Immun. 2010;24:1166-1175. [PubMed] [DOI] |
| 82. | Overman EL, Rivier JE, Moeser AJ. CRF induces intestinal epithelial barrier injury via the release of mast cell proteases and TNF-α. PLoS One. 2012;7:e39935. [PubMed] [DOI] |
| 83. | Lemon KP, Armitage GC, Relman DA, Fischbach MA. Microbiota-targeted therapies: an ecological perspective. Sci Transl Med. 2012;4:137rv5. [PubMed] [DOI] |
| 84. | Rooks MG, Veiga P, Wardwell-Scott LH, Tickle T, Segata N, Michaud M, Gallini CA, Beal C, van Hylckama-Vlieg JE, Ballal SA, Morgan XC, Glickman JN, Gevers D, Huttenhower C, Garrett WS. Gut microbiome composition and function in experimental colitis during active disease and treatment-induced remission. ISME J. 2014;8:1403-1417. [PubMed] [DOI] |
| 85. | Kennedy PJ, Cryan JF, Dinan TG, Clarke G. Kynurenine pathway metabolism and the microbiota-gut-brain axis. Neuropharmacology. 2017;112:399-412. [PubMed] [DOI] |
| 86. | Bailey MT, Dowd SE, Parry NM, Galley JD, Schauer DB, Lyte M. Stressor exposure disrupts commensal microbial populations in the intestines and leads to increased colonization by Citrobacter rodentium. Infect Immun. 2010;78:1509-1519. [PubMed] [DOI] |
| 87. | Karl JP, Margolis LM, Madslien EH, Murphy NE, Castellani JW, Gundersen Y, Hoke AV, Levangie MW, Kumar R, Chakraborty N, Gautam A, Hammamieh R, Martini S, Montain SJ, Pasiakos SM. Changes in intestinal microbiota composition and metabolism coincide with increased intestinal permeability in young adults under prolonged physiological stress. Am J Physiol Gastrointest Liver Physiol. 2017;312:G559-G571. [PubMed] [DOI] |
| 88. | Li S, Wang Z, Yang Y, Yang S, Yao C, Liu K, Cui S, Zou Q, Sun H, Guo G. Lachnospiraceae shift in the microbial community of mice faecal sample effects on water immersion restraint stress. AMB Express. 2017;7:82. [PubMed] [DOI] |
| 89. | Sun Y, Zhang M, Chen CC, Gillilland M, Sun X, El-Zaatari M, Huffnagle GB, Young VB, Zhang J, Hong SC, Chang YM, Gumucio DL, Owyang C, Kao JY. Stress-induced corticotropin-releasing hormone-mediated NLRP6 inflammasome inhibition and transmissible enteritis in mice. Gastroenterology. 2013;144:1478-1487, 1487.e1-1487.e8. [PubMed] [DOI] |
| 90. | Bailey MT, Dowd SE, Galley JD, Hufnagle AR, Allen RG, Lyte M. Exposure to a social stressor alters the structure of the intestinal microbiota: implications for stressor-induced immunomodulation. Brain Behav Immun. 2011;25:397-407. [PubMed] [DOI] |
| 91. | De Palma G, Collins SM, Bercik P, Verdu EF. The microbiota-gut-brain axis in gastrointestinal disorders: stressed bugs, stressed brain or both? J Physiol. 2014;592:2989-2997. [PubMed] [DOI] |
| 92. | Powell ND, Sloan EK, Bailey MT, Arevalo JM, Miller GE, Chen E, Kobor MS, Reader BF, Sheridan JF, Cole SW. Social stress up-regulates inflammatory gene expression in the leukocyte transcriptome via β-adrenergic induction of myelopoiesis. Proc Natl Acad Sci USA. 2013;110:16574-16579. [PubMed] [DOI] |
| 93. | Golubeva AV, Crampton S, Desbonnet L, Edge D, O'Sullivan O, Lomasney KW, Zhdanov AV, Crispie F, Moloney RD, Borre YE, Cotter PD, Hyland NP, O'Halloran KD, Dinan TG, O'Keeffe GW, Cryan JF. Prenatal stress-induced alterations in major physiological systems correlate with gut microbiota composition in adulthood. Psychoneuroendocrinology. 2015;60:58-74. [PubMed] [DOI] |
| 94. | O'Mahony SM, Clarke G, Dinan TG, Cryan JF. Early-life adversity and brain development: Is the microbiome a missing piece of the puzzle? Neuroscience. 2017;342:37-54. [PubMed] [DOI] |
| 95. | O'Mahony SM, Felice VD, Nally K, Savignac HM, Claesson MJ, Scully P, Woznicki J, Hyland NP, Shanahan F, Quigley EM, Marchesi JR, O'Toole PW, Dinan TG, Cryan JF. Disturbance of the gut microbiota in early-life selectively affects visceral pain in adulthood without impacting cognitive or anxiety-related behaviors in male rats. Neuroscience. 2014;277:885-901. [PubMed] [DOI] |
| 96. | Wang H, Braun C, Enck P. Effects of Rifaximin on Central Responses to Social Stress-a Pilot Experiment. Neurotherapeutics. 2018;15:807-818. [PubMed] [DOI] |
| 97. | Ren W, Wang P, Yan J, Liu G, Zeng B, Hussain T, Peng C, Yin J, Li T, Wei H, Zhu G, Reiter RJ, Tan B, Yin Y. Melatonin alleviates weanling stress in mice: Involvement of intestinal microbiota. J Pineal Res. 2018;64. [PubMed] [DOI] |
| 98. | Taché Y, Perdue MH. Role of peripheral CRF signalling pathways in stress-related alterations of gut motility and mucosal function. Neurogastroenterol Motil. 2004;16 Suppl 1:137-142. [PubMed] [DOI] |
| 99. | Yuan PQ, Wu SV, Wang L, Taché Y. Corticotropin releasing factor in the rat colon: expression, localization and upregulation by endotoxin. Peptides. 2010;31:322-331. [PubMed] [DOI] |
| 100. | Larauche M, Gourcerol G, Wang L, Pambukchian K, Brunnhuber S, Adelson DW, Rivier J, Million M, Taché Y. Cortagine, a CRF1 agonist, induces stresslike alterations of colonic function and visceral hypersensitivity in rodents primarily through peripheral pathways. Am J Physiol Gastrointest Liver Physiol. 2009;297:G215-G227. [PubMed] [DOI] |
| 101. | Liu S, Chang J, Long N, Beckwith K, Talhouarne G, Brooks JJ, Qu MH, Ren W, Wood JD, Cooper S, Bhargava A. Endogenous CRF in rat large intestine mediates motor and secretory responses to stress. Neurogastroenterol Motil. 2016;28:281-291. [PubMed] [DOI] |
| 102. | Nozu T, Miyagishi S, Nozu R, Takakusaki K, Okumura T. Water avoidance stress induces visceral hyposensitivity through peripheral corticotropin releasing factor receptor type 2 and central dopamine D2 receptor in rats. Neurogastroenterol Motil. 2016;28:522-531. [PubMed] [DOI] |
| 103. | Nozu T, Takakusaki K, Okumura T. A balance theory of peripheral corticotropin-releasing factor receptor type 1 and type 2 signaling to induce colonic contractions and visceral hyperalgesia in rats. Endocrinology. 2014;155:4655-4664. [PubMed] [DOI] |
| 104. | Bradesi S, Kokkotou E, Simeonidis S, Patierno S, Ennes HS, Mittal Y, McRoberts JA, Ohning G, McLean P, Marvizon JC, Sternini C, Pothoulakis C, Mayer EA. The role of neurokinin 1 receptors in the maintenance of visceral hyperalgesia induced by repeated stress in rats. Gastroenterology. 2006;130:1729-1742. [PubMed] [DOI] |
| 105. | Liang C, Luo H, Liu Y, Cao J, Xia H. Plasma hormones facilitated the hypermotility of the colon in a chronic stress rat model. PLoS One. 2012;7:e31774. [PubMed] [DOI] |
| 106. | Israeli E, Hershcovici T, Berenshtein E, Zannineli G, Wengrower D, Weiss O, Chevion M, Goldin E. The effect of restraint stress on the normal colon and on intestinal inflammation in a model of experimental colitis. Dig Dis Sci. 2008;53:88-94. [PubMed] [DOI] |
| 107. | Xu Y, Huang C, Deng H, Jia J, Wu Y, Yang J, Tu W. TRPA1 and substance P mediate stress induced duodenal lesions in water immersion restraint stress rat model. Turk J Gastroenterol. 2018;29:692-700. [PubMed] [DOI] |
| 108. | Shang JJ, Yuan JY, Xu H, Tang RZ, Dong YB, Xie JQ. Shugan-decoction relieves visceral hyperalgesia and reduces TRPV1 and SP colon expression. World J Gastroenterol. 2013;19:8071-8077. [PubMed] [DOI] |
| 109. | Torres-Rosas R, Yehia G, Peña G, Mishra P, del Rocio Thompson-Bonilla M, Moreno-Eutimio MA, Arriaga-Pizano LA, Isibasi A, Ulloa L. Dopamine mediates vagal modulation of the immune system by electroacupuncture. Nat Med. 2014;20:291-295. [PubMed] [DOI] |
| 110. | Waltz E. A spark at the periphery. Nat Biotechnol. 2016;34:904-908. [PubMed] [DOI] |