修回日期: 2020-06-30
接受日期: 2020-07-04
在线出版日期: 2020-07-28
随着新药的不断问世, 药物性肝损伤(drug-induced liver injury, DILI)的发病率也相应增加, 但由于DILI诊断缺乏特异性, 容易造成漏诊及误诊. 青海地处高原, 低氧是主要环境特征, 本文对我院近6年DILI的诊治情况进行总结分析, 拟发现低氧条件下DILI的临床特点.
探讨低氧条件下DILI的临床特征及预后的影响因素.
回顾性分析青海地区近6年收治的247例DILI病例的年龄、性别、民族、饮酒史、可疑肝损伤药物、临床表现、实验室检查等内容.
青海地区引起DILI男女比例为1:1.2, 年龄集中在40-59岁(125例, 50.61%), 前三位药物分别是中药、感冒药及藏药, 245例(99.19%)有临床症状, 以乏力为主, 247例患者中肝细胞损伤型146例(59.11%), 胆汁淤积型51例(20.65%), 混合型50例(20.24%). 247例患者好转出院232例(93.93%), 死亡15例(6.07%). 预后的危险因素为年龄(OR = 0.39, P = 0.05)、民族(OR = 3.13, P = 0.01)、初始白蛋白水平(OR = 1.01, P = 0.01)、凝血酶原时间[prothrombin time, PT (OR = 1.51, P = 0.01)].
引起DILI的药物种类繁多, 临床表现缺乏特异性, 年龄大、白蛋白水平低、PT高的患者预后不良的风险增加.
核心提要: 青海地区引起肝损伤的常见药物有中药、感冒药及藏药, 其中藏药所致肝损伤在其他地区报道较为少见, 需引起临床医生重视.
引文著录: 袁玲, 杨永耿. 低氧条件下药物性肝损伤的临床特征及预后分析. 世界华人消化杂志 2020; 28(14): 587-593
Revised: June 30, 2020
Accepted: July 4, 2020
Published online: July 28, 2020
With the advent of new drugs, the incidence of drug-induced liver injury (DILI) has increased. However, due to the lack of specificity in DILI diagnosis, it is easy to cause missed diagnosis and misdiagnosis. Qinghai is located in the Qinghai-Tibet plateau plateau, and hypoxia is the main environmental characteristic. This paper summarized and analyzed the diagnosis and treatment of DILI at our hospital in the past 6 years, with an aim to identify the clinical characteristics of DILI under hypoxia conditions.
To investigate the clinical features and prognostic factors of DILI under hypoxia conditions.
The data including age, gender, ethnicity, drinking history, suspected liver injury drugs, clinical manifestation, and laboratory findings of 247 cases of DILI admitted to Qinghai Provincial People's Hospital in recent 6 years were analyzed retrospectively.
The male-to-female ratio was 1:1.2, and the age group of 40-59 years (125 cases, 50.61%) was most commonly affected. The top three drugs were traditional Chinese medicine, cold medicine, and Tibetan medicine. A total of 245 (99.19%) patients had clinical symptoms, with fatigue being the most common. Of 247 patients included, 146 (59.11%) had hepatocellular injury type, 51 (20.65%) had cholestasis type, and 50 (20.24%) had mixed type; 232 (93.9%) improved and were discharged from hospital and 15 (6.07%) died. The prognostic risk factors were age (OR = 0.39, P = 0.05), ethnicity (OR = 3.13, P = 0.01), initial albumin level (OR = 1.01, P = 0.01), and prothrombin time [PT (OR = 1.51, P = 0.01)].
There are many kinds of drugs causing DILI, and the clinical manifestations are not specific. Patients with old age, low albumin level, and high PT have an increased risk of poor prognosis.
- Citation: Yuan L, Yang YG. Clinical features and prognosis of drug-induced liver injury under hypoxia conditions. Shijie Huaren Xiaohua Zazhi 2020; 28(14): 587-593
- URL: https://www.wjgnet.com/1009-3079/full/v28/i14/587.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i14.587
药物性肝损伤(drug-induced liver injury, DILI)是指由各类处方或非处方的化学药物、生物制剂、传统中药、天然药、保健品、膳食补充剂及其代谢产物乃至辅料等所诱发的肝损伤. DILI可以分为固有型和特异质型, 前者由药物或其代谢产物直接导致损伤, 且多与剂量相关, 绝大多数损伤的发生是可预测, 其中最常见药物为对乙酰氨基酚[1,2], 而后者通常与剂量无关, 个体差异显著, 具有不可预测性. 临床上特异质反应引起的肝损伤大多较为严重、进展快, 且易发展至急性肝衰竭. 随着新药的不断出现, 保健品滥用等, DILI的发病率逐年升高. 青海地处高原, 低压低氧、低温、干旱是其重要的环境特征, 低氧改变药物的药代动力学特征, 从而影响药物的吸收、分布、代谢和排泄, 本研究旨在, 通过回顾性分析我院近年来DILI住院患者的可疑药物、临床表现等总结低氧条件下DILI的临床特征及预后情况, 以引起临床医师重视、提高诊断率.
1.1.1 研究对象: 收集我院2013-01/2018-12出院患者中诊断为DILI的247份病历, 进行回顾性调查, 记录患者一般情况、可疑用药史、临床表现、实验室检查、治疗方案及预后.
1.1.2 可疑药物的因果关系评估: 247例患者均采用Roussel Uclaf因果关系评估法(roussel uclaf method of causality assessment, RUCAM)量表来对药物与肝损伤的因果关系进行综合评估.
1.1.3 DILI的临床分型: 临床分型是参照由国际医学组织理事会建立、修订的判断标准: (1)肝细胞损伤型: 谷丙转氨酶(glutamic-pyruvic transaminase, ALT) ≥3正常值上限(upper limit of normal, ULN), 且R≥5; (2)胆汁淤积型: 碱性磷酸酶(alkaline phosphatase, ALP) ≥2ULN, 且R≤2; (3)混合型: ALT≥3ULN, ALP≥2ULN, 且2<R<5. R = (ALT实测值/ALT ULN)/(ALP实测值/ALP ULN)[3,4].
1.1.4 DILI预后标准: 预后判断[5]: (1)治愈, 临床表现消失或者明显的改善, ALT、谷草转氨酶、ALP、总胆红素(total bilirubin, TBil)等肝脏生化指标完全下降到正常范围; (2)好转, 临床表现好转, 肝脏生化指标下降, 并<2×ULN; (3)未愈, 临床表现无好转, 肝脏生化指标下降不明显, 或者病情加重(包括因病情严重自行离院者); (4)死亡, 治疗中死亡.
采用回顾性研究的方法, 记录患者一般资料、可疑药物、临床表现、实验室检查、治疗以及预后等资料, 所有患者均进行RUCAM量表评分.
统计学处理 计量资料采用mean±SD进行表示, 计数资料采用频数、百分比进行表示, 符合正态分布的计量资料组间均数比较采用t检验或方差分析. 计数资料的组间比较使用χ2检验, 多因素分析采用非条件Logistic回归分析, P<0.05差异有统计学意义.
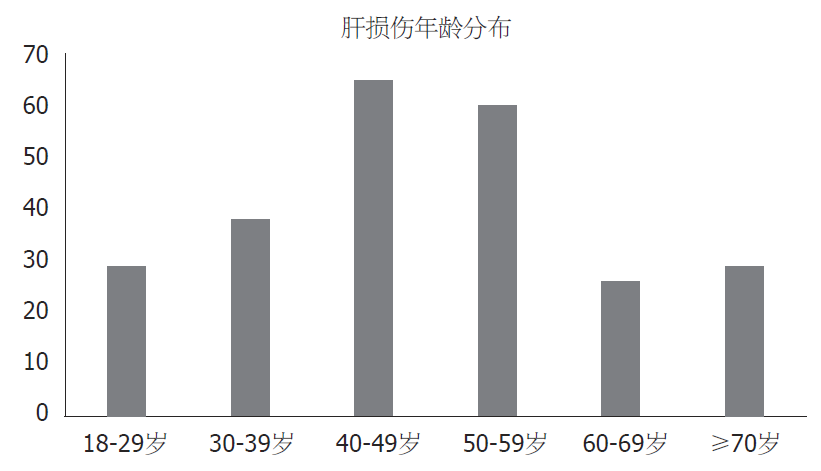
我院2013-01/2018-12出院患者中诊断为DILI的共有247份病历, 所有患者均应用RUCAM量表进行可疑药物因果关系评估, 结果显示评分均大于等于3分, 极可能92例(37.25%), 很可能140例(56.68%), 可能15例(6.07%). 247例患者中男性111例(44.94%), 女性136例(55.06%), 男女比例为1:1.2, 年龄18-86岁, 平均年龄为48.82岁±15.21岁, 主要发病年龄集中在40-59岁(125例, 50.61%), 年龄分布见图1. 247例患者中汉族158例(63.97%), 回族36例(14.57%), 藏族32例(12.96%), 蒙古族9例(3.64%), 土族9例(3.64%), 撒拉族2例(0.81%), 满族1例(0.40%). 有饮酒史10例(4.05%), 有伴随用药36例(14.57%), 有其他肝损害疾病44例(17.81%), 其中脂肪肝17例、乙肝15例、自身免疫性肝病6例、其他肝病6例. 合并有其他慢性疾病患者93例, 其中以高血压、糖尿病最为常见, 其中4例患者有肿瘤病史. 不同类型肝损伤的特点见表1.
| 年龄(岁) | 初始ALT (U/L) | 初始ALP (U/L) | TBil (mmol/L) | |
| 所有患者 | 48.8±15.2 | 603.4±642.7 | 195.9±166.5 | 133.9±140.4 |
| 肝细胞损伤型n = 146 (59.1%) | 48.2±14.9 | 888.9±691.1 | 161.0±61.3 | 145.6±143.2 |
| 胆汁淤积型n = 51 (20.6%) | 49.2±15.0 | 93.5±61.0 | 263.5±298.9 | 137.1±151.7 |
| 混合型n = 50 (20.2%) | 50.1±16.0 | 290.2±201.3 | 228.6±159.8 | 96.6±108.9 |
青海地区引起DILI的药物有中药(包括三七粉、治疗关节炎、骨质疏松、脱发、前列腺增生等中成药及汤剂)、感冒药(包括速效伤风胶囊、康泰克、感康、VC银翘片、双黄连、感冒颗粒等)、藏药(包括用于治疗类风湿性关节炎、便秘、湿疹、痛风等疾病的药物)、保健品、抗结核药(包括利福平、吡嗪酰胺、异烟肼、乙胺丁醇等)、非甾体抗炎药(包括阿司匹林、吲哚美辛、双氯芬酸等)、混合药物及其他(包括降糖药、激素、蒙药、抗抑郁药、甲状腺疾病药物、化疗药、降脂药等), 其中排名前三的药物是中药、感冒药及藏药. 肝损伤可疑药物与初始ALT水平有相关性, 其中藏药所致肝损害更容易出现初始ALT升高, 同时可疑药物与合并症具有相关性(表2), 即患者合并有其他系统基础疾病时更容易引起肝损害.
| 可疑药物 | χ2/F | P值 | ||||||||
| 保健品(n = 19) | 藏药(n = 20) | 非甾体抗炎药(n = 9) | 感冒药(n = 74) | 混合药 物(n = 7) | 抗结核药(n = 11) | 中药(n = 90) | 其他(n = 17) | |||
| 初始ALT (U/L) | 536.93±442.08 | 806.13±853.78 | 797.05±962.26 | 478.56±325.69 | 398.09±361.06 | 274.81±142.45 | 506.85±466.91 | 265.75±224.41 | 2.70 | 0.01 |
| 合并症 | ||||||||||
| 有 | 8 (8.51%) | 9 (9.57%) | 4 (4.26%) | 20 (21.28%) | 4 (4.3%) | 9 (9.57%) | 26 (27.7%) | 14 (14.89%) | 19.70 | 0.00 |
| 无 | 11 (7.19%) | 11 (7.19%) | 5 (3.26%) | 54 (35.29) | 3 (2.0%) | 2 (1.31%) | 64 (41.8%) | 3 (1.96%) | ||
DILI的平均病程为15.1 d±6.4 d, 247例患者中245 (99.0%)例有临床症状, 且主要表现为乏力94例(38.06%)、黄疸70例(28.3%)、腹痛45例(18.2%)、恶心呕吐36例(14.5%), 仅有2例无症状, 在体检过程中发现.
247例患者诊断DILI后均立即停用可疑药物, 其中189例患者给予静脉应用保肝药物, 常用保肝药物有异甘草酸镁、多烯磷脂酰胆碱、甘草酸苷、还原型谷胱甘肽、促肝细胞生长素等, 应用1种保肝药物治疗的45例(18.2%), 2种联合111例(44.9%), 3种联合30例(12.1%), 4种联合3例(1.2%), 药物联合应用与预后之间无关系(表3).
| 药物联合应用 | 预后 | χ2 | P值 | |
| 好转 | 死亡 | |||
| 1种 | 60 | 2 | 7.02 | 0.07 |
| 2种 | 123 | 7 | ||
| 2种 | 43 | 4 | ||
| 4种 | 6 | 2 | ||
247例患者住院天数最短为1 d, 最长38 d, 平均15.05 d±6.43 d. 好转出院232例(93.9%), 死亡5例(2.0%), 因病情危重自动出院10例(4.0%), 由于自动出院病例均在院外死亡, 故总体死亡15例(6.1%). 其中肝细胞型患者死亡占6.2%, 胆汁淤积型患者死亡占9.8%, 混合型死亡占2.0%. 患者入院时转氨酶与胆红素水平是否同时异常与预后具有相关性, 即同时异常时预后更差. 年龄、初始TBil、白蛋白、凝血酶原时间(prothrombin time, PT)、PT%均与DILI的预后具有相关性, 即年龄越大其预后越差, 初始TBil越高预后越差, 白蛋白水平越低预后越差、PT越高预后越差, PT%越低预后越差(表4).
| 预后 | χ2/t | P值 | ||
| 好转(n = 232) | 死亡(n = 15) | |||
| ALT与TBil同时异常 | ||||
| 是 | 112 (48.28%) | 11 (73.3%) | 3.54 | 0.04 |
| 否 | 120 (51.7%) | 4 (26.7%) | ||
| 年龄 | ||||
| <55岁 | 165 (71.1%) | 7 (46.7%) | 3.99 | 0.04 |
| ≥55岁 | 67 (28.9%) | 8 (53.3%) | ||
| 初始TBil | 126.24±136.66 | 252.66±149.25 | 3.45 | 0.01 |
| 白蛋白 | 36.84±5.76 | 30.97±6.11 | 3.81 | <0.01 |
| PT | 13.25±2.34 | 24.60±14.86 | 10.08 | <0.01 |
| PT% | 76.88±20.97 | 42.37±27.76 | 6.05 | <0.01 |
对年龄、性别、民族、临床分型、可疑药物、合并其他肝损疾病、饮酒进行以及实验室检查危险因素分析, 结果提示年龄、民族、初始白蛋白水平、PT是预后的危险因素, 详见表5.
| 分组 | B | 标准误差 | 瓦尔德 | 自由度 | 显著性 | EXP (B) | EXP (B)的95%CI | |
| 下限 | 上限 | |||||||
| 年龄 | -0.95 | 1.68 | 0.32 | 1 | 0.05 | 0.39 | 0.01 | 0.96 |
| 民族 | 1.14 | 1.81 | 0.40 | 1 | 0.01 | 3.13 | 1.89 | 105.51 |
| 性别 | -0.02 | 1.50 | 0.00 | 1 | 0.99 | 0.98 | 0.05 | 22.60 |
| 临床分型 | 0.00 | 1.39 | 0.00 | 1 | 1.00 | 1.00 | 0.07 | 15.17 |
| 可疑药物 | 0.01 | 0.39 | 0.00 | 1 | 0.99 | 1.01 | 0.38 | 3.82 |
| 其他肝损疾病 | 0.93 | 2.04 | 0.21 | 1 | 0.65 | 2.54 | 0.04 | 282.84 |
| 饮酒 | 1.27 | 7.74 | 0.03 | 1 | 0.87 | 3.55 | 0.00 | 5163378.71 |
| 常量 | -27.03 | 21.88 | 1.53 | 1 | 0.22 | 0.00 | ||
| 初始白蛋白 | 0.01 | 0.00 | 7.65 | 1 | 0.01 | 1.01 | 1.00 | 1.01 |
| PT | 0.41 | 0.17 | 6.00 | 1 | 0.01 | 1.51 | 1.09 | 2.10 |
| 初始ALT | 0.00 | 0.00 | 0.35 | 1 | 0.55 | 1.00 | 1.00 | 1.00 |
| 初始ALP | -0.00 | 0.00 | 0.10 | 1 | 0.76 | 1.00 | 0.99 | 1.01 |
| 初始TBil | -0.09 | 0.07 | 1.36 | 1 | 0.24 | 0.92 | 0.80 | 1.06 |
| 常量 | -7.34 | 5.20 | 2.00 | 1 | 0.16 | 0.00 | ||
DILI的发病率逐年上升[6], 研究显示, DILI在中国的发病率约23.8/10万[7], DILI是美国及欧洲引起急性肝衰竭的最常见原因[8]. 引起DILI的药物种类繁多, 据统计, 全球范围内大约有1100多种上市药物有潜在肝毒性[9], 常见的引起DILI的药物有中草药、抗感染药物(包括抗结核药)、抗肿瘤药、膳食补充剂、非甾体抗炎药、糖皮质激素等, 在欧美国家, 以对乙酰氨基酚所致的DILI最为常见, 而在亚洲国家, 膳食补充剂是最常见原因[10]. 在本研究中, 引起DILI的常见药物位列前五的是中药、感冒药、藏药、保健品以及抗结核药物, 而非低氧环境下报道DILI前五位分别是中药、抗生素、解热镇痛药、抗结核药以及心血管药物, 藏药所致肝损伤报道较为少见[8,11], 而本研究显示青海地区引起肝损伤药物中藏药位列第三, 这与丁月荷[12]等报道的藏族人群更容易发生DILI结果一致, 其原因尚不明确, 考虑可能与青海藏族等少数民族人群较多有关. 中草药导致肝损伤可能是因为这类药物比较容易得到, 并且人们普遍认为传统中药更为安全. DILI发生与年龄有一定相关性, 研究显示, 非低氧条件下年龄大于55岁时更容易发生DILI[13]. 本研究结果显示低氧条件下年龄大于45岁时发病率更高, 可能与低氧条件下药物代谢缓慢有关, 药物半衰期延长后更容易发生肝损伤, DILI多见于中年考虑与中年患者注重保健, 膳食补充剂摄入较多有关. 年轻患者多发生肝细胞型肝损伤, 而高龄患者更容易发生胆汁淤积型肝损伤[14], 而本研究结果在DILI损伤类型上无明显相关性.
DILI临床表现与其他肝损害疾病相比无特异性, 常见的有纳差、恶心呕吐、乏力、黄疸等, 也有部分轻症患者无任何临床表现, 往往在体检中发现, 本研究中患者多以乏力为主诉就诊, 这与非低氧条件下DILI的报道结果无差异[15], 临床表现均无特异性.
DILI的治疗原则[16]是及时停用可疑药物, 根据DILI类型选择适当的药物, 重症者考虑肝移植, 本研究中247例患者诊断DILI后均停用可疑药物, 并给予保肝治疗, 大多数患者应用两种或两种以上保肝药物治疗, 结果显示两种或两种以上保肝药物并没有对DILI更好的治疗效果, 可能存在一定过度治疗的情况. 绝大多数DILI可以得到临床症状及生化指标的完全恢复, 少数并发急性肝衰竭患者可能导致死亡, 或成为慢性肝病. 研究显示, 大约有10%药物诱导的黄疸患者并发急性肝衰竭需要肝移植或死亡[3,17]. 本研究结果提示胆汁淤积型肝损伤患者与不良预后有更高的相关性, 这与美国报道的肝细胞损伤型与不良预后有关有所不同[18].
青海为高海拔地区, 缺氧是其主要特点, 而大多数药物在高海拔缺氧时代谢缓慢, 平均停留时间、半衰期增加清除减少. 药物代谢酶活性和表达的变化与某些酶底物在高海拔缺氧环境下的药代动力学变化一致[19]. 通过与国内报道非低氧条件下DILI临床特点的对比, 发现青海地区DILI发病年龄更趋于年轻, 引起肝损伤药物中藏药所致DILI需引起重视, 预后的危险因素有年龄、民族、初始白蛋白水平、PT, 而临床表现及损伤类型无特异性, 因此, 青海地区DILI肝损伤药物、临床表现及其特点有其特殊性, 通过相关报道引起临床医师重视, 从而达到早诊断、早治疗的目的.
近年来, 随着新药的不断出现、临床用药种类的不断增加、中草药的广泛应用, 药物性肝损伤(drug-induced liver injury, DILI)的发病率也随之增多, 发病率仅次于病毒性肝炎、脂肪性肝病, 据世界卫生组织统计, DILI已成为全球死亡原因的第5位. DILI约占所有药物不良反应的3.0%-9.0%, 占肝炎患者的10%. 本研究回顾性分析我院近6年DILI病例, 拟总结青海地区DILI的发病特点.
本篇文章主要通过回顾性分析我院收治的DILI患者的临床资料, 寻找其发病特点及临床规律, 拟探讨低氧条件对DILI发病特点的影响, 以引起临床医师重视, 为防治DILI提供依据.
本篇文章研究的主要目标是总结青海地区常见的引起肝损伤药物、发病年龄, 临床表现、肝损伤类型、实验室检查特点、治疗方案及疾病转归情况, 并通过与非低氧地区DILI发病特点的对比总结低氧条件对DILI发病的可能影响因素.
本文对出院患者临床资料进行回顾性数据分析以得出结论.
本篇论文的研究达到了试验目标, 通过回顾性分析得出, 青海地区DILI主要发病年龄在40-59岁, 与非低氧地区相比, 年龄更趋于年轻化. 排在前三位引起肝损伤的药物是中药、感冒药及藏药, 藏药引起的肝损伤在其他地区报道较为少见. 临床表现无特异性, 总体预后好, 年龄、民族、初始白蛋白水平、凝血酶原时间是预后的危险因素.
本研究发现, 藏药所致肝损伤在青海地区常见, 40-59岁中年人更易发生DILI. 提出低氧条件可能影响DILI的发病特点的新理论. 本研究结果显示中药、感冒药仍然是引起DILI最常见药物、临床表现无特异性、治疗方面多种保肝药物联合应用并不能改善预后. 对现有的DILI内容提出藏药引起肝损伤不容忽视, 提出低氧条件对DILI的影响的假说, 并通过数据分析及对比证实.
本研究尚有不足之处, 未能纳入多家医院资料进行分析研究, 未来研究的方向可以从基础试验进行对比分析, 并尝试探讨低氧对DILI发病的影响机制.
学科分类: 胃肠病学和肝病学
手稿来源地: 青海省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Yan M, Huo Y, Yin S, Hu H. Mechanisms of acetaminophen-induced liver injury and its implications for therapeutic interventions. Redox Biol. 2018;17:274-283. [PubMed] [DOI] |
| 2. | Chalasani NP, Hayashi PH, Bonkovsky HL, Navarro VJ, Lee WM, Fontana RJ, Practice Parameters Committee of the American College of Gastroenterology. ACG Clinical Guideline: the diagnosis and management of idiosyncratic drug-induced liver injury. Am J Gastroenterol. 2014;109:950-966; quiz 967. [PubMed] [DOI] |
| 3. | Robles-Diaz M, Lucena MI, Kaplowitz N, Stephens C, Medina-Cáliz I, González-Jimenez A, Ulzurrun E, Gonzalez AF, Fernandez MC, Romero-Gómez M, Jimenez-Perez M, Bruguera M, Prieto M, Bessone F, Hernandez N, Arrese M, Andrade RJ; Spanish DILI Registry; SLatin DILI Network; Safer and Faster Evidence-based Translation Consortium. Use of Hy's law and a new composite algorithm to predict acute liver failure in patients with drug-induced liver injury. Gastroenterology. 2014;147:109-118.e5. [PubMed] [DOI] |
| 4. | Alex S, Adenew AB, Arundel C, Maron DD, Kerns JC. Medication Errors Despite Using Electronic Health Records: The Value of a Clinical Pharmacist Service in Reducing Discharge-Related Medication Errors. Qual Manag Health Care. 2016;25:32-37. [PubMed] [DOI] |
| 5. | Yu YC, Mao YM, Chen CW, Chen JJ, Chen J, Cong WM, Ding Y, Duan ZP, Fu QC, Guo XY, Hu P, Hu XQ, Jia JD, Lai RT, Li DL, Liu YX, Lu LG, Ma SW, Ma X, Nan YM, Ren H, Shen T, Wang H, Wang JY, Wang TL, Wang XJ, Wei L, Xie Q, Xie W, Yang CQ, Yang DL, Yu YY, Zeng MD, Zhang L, Zhao XY, Zhuang H; Drug-induced Liver Injury (DILI) Study Group; Chinese Society of Hepatology (CSH); Chinese Medical Association (CMA). CSH guidelines for the diagnosis and treatment of drug-induced liver injury. Hepatol Int. 2017;11:221-241. [PubMed] [DOI] |
| 6. | Shen T, Liu Y, Shang J, Xie Q, Li J, Yan M, Xu J, Niu J, Liu J, Watkins PB, Aithal GP, Andrade RJ, Dou X, Yao L, Lv F, Wang Q, Li Y, Zhou X, Zhang Y, Zong P, Wan B, Zou Z, Yang D, Nie Y, Li D, Wang Y, Han X, Zhuang H, Mao Y, Chen C. Incidence and Etiology of Drug-Induced Liver Injury in Mainland China. Gastroenterology. 2019;156:2230-2241.e11. [PubMed] [DOI] |
| 7. | Lee WM. Drug-induced acute liver failure. Clin Liver Dis. 2013;17:575-586, viii. [PubMed] [DOI] |
| 9. | Wai CT, Tan BH, Chan CL, Sutedja DS, Lee YM, Khor C, Lim SG. Drug-induced liver injury at an Asian center: a prospective study. Liver Int. 2007;27:465-474. [PubMed] [DOI] |
| 10. | 滕 光菊, 孙 颖, 常 彬霞, 张 伟, 赵 军, 田 辉, 梁 庆升, 尚 丽丹, 邹 正升, 李 保森. 418例药物性肝损害临床特征及预后分析. 肝脏. 2013;18:11-14. [DOI] |
| 11. | Danan G, Benichou C. Causality assessment of adverse reactions to drugs--I. A novel method based on the conclusions of international consensus meetings: application to drug-induced liver injuries. J Clin Epidemiol. 1993;46:1323-1330. [PubMed] [DOI] |
| 13. | Hunt CM, Yuen NA, Stirnadel-Farrant HA, Suzuki A. Age-related differences in reporting of drug-associated liver injury: data-mining of WHO Safety Report Database. Regul Toxicol Pharmacol. 2014;70:519-526. [PubMed] [DOI] |
| 16. | Mumoli N, Cei M, Cosimi A. Drug-related hepatotoxicity. N Engl J Med. 2006;354:2191-3; author reply 2191-3. [PubMed] [DOI] |
| 17. | Fontana RJ, Hayashi PH, Gu J, Reddy KR, Barnhart H, Watkins PB, Serrano J, Lee WM, Chalasani N, Stolz A, Davern T, Talwakar JA; DILIN Network. Idiosyncratic drug-induced liver injury is associated with substantial morbidity and mortality within 6 months from onset. Gastroenterology. 2014;147:96-108.e4. [PubMed] [DOI] |
| 18. | Chalasani N, Bonkovsky HL, Fontana R, Lee W, Stolz A, Talwalkar J, Reddy KR, Watkins PB, Navarro V, Barnhart H, Gu J, Serrano J; United States Drug Induced Liver Injury Network. Features and Outcomes of 899 Patients With Drug-Induced Liver Injury: The DILIN Prospective Study. Gastroenterology. 2015;148:1340-52.e7. [PubMed] [DOI] |
| 19. | Zhou X, Nian Y, Qiao Y, Yang M, Xin Y, Li X. Hypoxia Plays a Key Role in the Pharmacokinetic Changes of Drugs at High Altitude. Curr Drug Metab. 2018;19:960-969. [PubMed] [DOI] |