修回日期: 2020-06-07
接受日期: 2020-06-12
在线出版日期: 2020-07-28
微小RNA是一类具有调控蛋白翻译功能的细胞内源性非编码RNA分子, 对生物的生长、发育、衰老, 以及细胞的增殖、分化、凋亡, 甚至癌症等疾病的发生起到重要的调控作用. miR-302b可参与多种基因的表达调控, 在恶性肿瘤的发生发展侵袭转移等过程中发挥抑癌基因功能. 本文就miR-302b在恶性肿瘤中的表达形式、所发挥的生物学功能及其分子机制进行述评.
核心提要: miR-302b作为一种新型的微小RNA, 其生物学特征赋予了其独特的功能, 本文阐述了miR-302b作为抑癌基因, 通过不同的分子机制, 介导肿瘤细胞的增值、侵袭迁移、药敏、肿瘤相关炎症和自噬, 揭示了miR-302b与肿瘤的关系, 为肿瘤的治疗提供了一个新的方向.
引文著录: 李敏娜, 路宁, 王艺璇, 张晓庆, 周莹, 张明鑫. 抑癌基因miR-302b在恶性肿瘤中的调控机制. 世界华人消化杂志 2020; 28(14): 570-580
Revised: June 7, 2020
Accepted: June 12, 2020
Published online: July 28, 2020
MicroRNAs are a class of endogenous non-coding RNA molecules that regulate the translation of proteins. They play important regulatory roles in the growth, development, and aging of organisms, as well as cell proliferation, differentiation, apoptosis, and even cancer. miR-302b can participate in the regulation of the expression of a variety of genes, and functions as a tumor suppressor gene in the occurrence, development, invasion, and metastasis of malignant tumors. This article discusses the expression of miR-302b in malignant tumors and its biological functions and molecular mechanism.
- Citation: Li MN, Lu N, Wang YX, Zhang XQ, Zhou Y, Zhang MX. Regulatory mechanism of tumor suppressor gene miR-302b in malignant tumors. Shijie Huaren Xiaohua Zazhi 2020; 28(14): 570-580
- URL: https://www.wjgnet.com/1009-3079/full/v28/i14/570.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i14.570
肿瘤是世界范围内导致患者死亡的重要原因之一, 也是一个全球性的重大公共健康问题, 2018年全球约有1819万肿瘤新增病例以及960万肿瘤死亡病例[1]. 在我国. 肺癌(lung cancer, LC)、乳腺癌(breast cancer, BC)、胃癌(gastric cancer, GC)、食管癌(esophageal cancer, EC)、肝癌是最常见的恶性肿瘤[2], 死亡前5位的是LC、GC、肝癌、EC及结肠癌(colon cancer, CC), 占全国所有癌症死亡的69.1%[3]. 因此, 肿瘤是包括中国在内的大多数国家的主要公共卫生问题.
非编码RNA是由基因组转录产生的一类不同于信使RNA (messenger RNA, mRNA)的遗传信息分子, 深入研究非编码RNA及其调节靶基因网络, 发现由非编码RNA介导的基因表达调控通路和网络, 对于深层次揭示生命活动与疾病的本质和规律具有重要意义[4]. 微小RNA (microRNAs, miRNAs)是一类具有调控蛋白翻译功能的细胞内源性非编码RNA分子, 其长度为18-25个核苷酸. 1993年Lee在线虫中发现了第一个miRNAs, 自此之后, 大量miRNAs相继在人类、动植物、病毒等生物中被发现[5,6]. 相关研究表明[7], miRNAs主要通过完全互补或不完全互补的方式与靶基因mRNAs的3´非编码区(3´-UTR)结合而抑制蛋白的合成, 或通过降解其靶基因mRNAs沉默基因表达, 从而对生物的生长、发育、衰老, 以及细胞的增殖、分化、凋亡, 甚至癌症等疾病的发生起到重要的调控作用. 先前的报道表明, miRNAs可能在人类的癌变过程中发挥重要作用, 并且发现特定miRNAs的异常表达与多种癌症的发生和/或发展有关[8]. 近年来, 人们越来越重视miRNAs在肿瘤的早期诊断、治疗和复发预测中的作用, miRNAs在调节血管生成、上皮间质转化(epithelial-mesenchymal transition, EMT)、癌症-干细胞生物学、转移和耐药性相关的分子途径中起着重要作用[9,10]. 也有研究表明, 在人类及一些动物的血清和血浆中, miRNAs均能逃避核糖核酸酶的降解, 稳定的存在[11], 相对体液中丰度较低的DNA[12], 可通过寻找恶性肿瘤患者血液中存在差异表达的miRNAs, 将miRNAs视为恶性肿瘤的临床诊断潜在标志物[13].
近年来miRNAs的研究越来越多, 其中miR-302b逐渐吸引了人们的关注. miR-302b属于miR-302基因簇, 位于4q25染色体区[14], 由四个转录为非编码RNA簇的同源miRNA组成, 在人和小鼠胚胎干细胞中特异表达[15], 并且具有脊椎动物特异性和高度保守性[14]. miR-302基因簇共有5个成员, 分别为miR-367、miR-302a、miR-302b、miR-302c、和miR-302d[16], 并且miR-302-367簇主要通过抑制靶基因蛋白质的翻译, 通过促进间质上皮化、调控细胞分化等方式诱导体细胞转化为多能干细胞, 在维持干细胞干性中发挥重要作用[17]. 越来越多的证据表明, miR-302b通过调控与肿瘤发生有关的基因和信号通路在癌症发病中发挥作用, 本文就miR-302b在恶性肿瘤中的表达形式、所发挥的生物学功能及其分子机制进行综述.
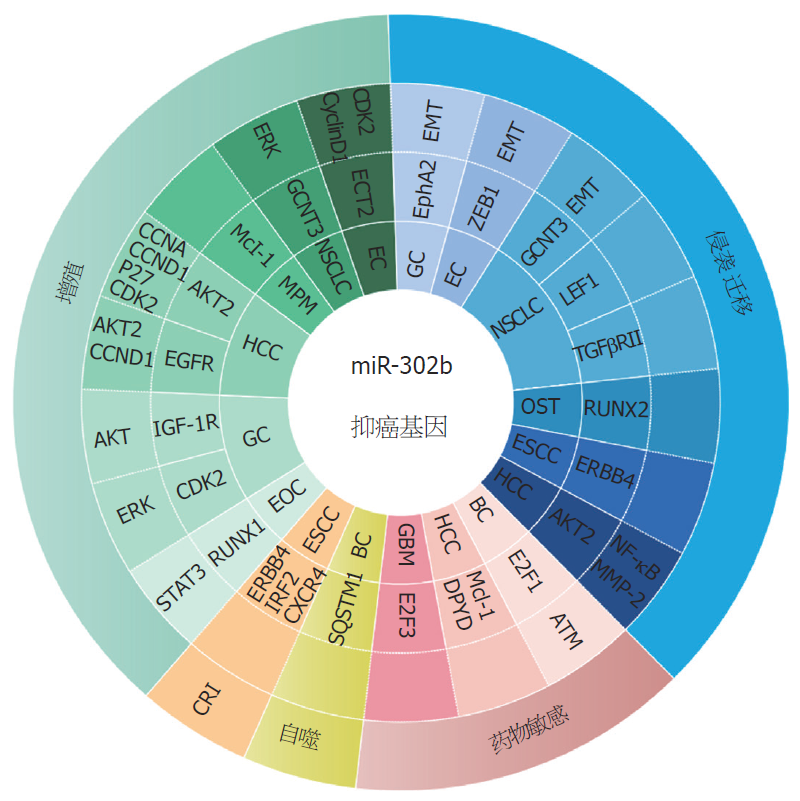
自从20世纪90年代miR-302b被发现以来, 人们对miR-302b的研究不断深入,现已经有大量的报道证实了miR-302b与舌癌(tongue cancer, TC)、口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)、食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)、GC、BC等肿瘤密切相关, 此外, miR-302b作为潜在的抑癌基因, 它的异常表达与肿瘤的侵袭、转移、分期分型等临床特征密切相关(表1).
口腔恶性肿瘤是世界第6大常见癌症[18,19], 在我国呈上升趋势[20]. TC是口腔颌面部常见的恶性肿瘤, 其恶性程度高, 预后差, 且治疗棘手[21]. Yang等[22]发现, miR-302b的过表达使人TC细胞增殖率、迁移能力和侵袭能力降低, 表明miR-302b作为一种抑癌基因, 能够抑制人TC细胞的增殖、迁移和侵袭能力. OSCC是常见的恶性肿瘤之一, 其发病总量约占到口腔癌的90%[23]. Liu等[24]研究发现, 过表达的miR-302b在体外能够显著降低OSCC的侵袭与迁移能力, 体内实验结果表明, miR-302b能够降低肿瘤相关的局部淋巴管形成、颈部及腋下淋巴结转移和肺转移率.
EC仍然是癌症相关死亡率的主要原因之一[1]. EC通常以腺癌或鳞状细胞癌的形式出现, 后者在东亚占主导地位, 占中国所有EC病例的95%[25], 尽管其在手术、放化疗等治疗方面已取得一些进展, 但其预后仍不理想, 5年生存率低于20%[26,27], 因此, 越来越多的学者对EC发生和发展的分子机制进行了研究. Tabrizi等[28]利用RT-qPCR方法研究发现, miR-302b的表达水平无论是在癌和癌旁间还是不同恶性程度间, 都未显示其表达差异. 本团队前期研究发现[29], miR-302b在ESCC组织中低表达, 另外, 临床病理特征分析表明, miR-302b的低表达与肿瘤分化程度和淋巴结转移有显著相关性, 但与年龄、性别、吸烟、饮酒和TNM分期无关, 且miR-302b低表达是ESCC患者预后不良的独立因素.
LC是所有预后差的癌症中发病率和死亡率最高的一种[30]. 根据病理类型不同可以将LC分为小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung cancer, NSCLC), 其中NSCLC较为常见, 主要包括鳞癌、腺癌、大细胞癌等. 2015年本团队[31]研究发现, miR-302b在NSCLC组织内的表达明显下调, 显著低于癌旁组织, 且进一步研究发现, 其与淋巴转移及分化密切相关, 表明miR-302b在NSCLC的发展过程中可能发挥抑癌基因功能.
BC是女性最常见的恶性肿瘤之一, 根据世界卫生组织国际癌症研究中心发布的统计数据显示, 2012年全球新诊断BC病例170万例, 占女性恶性肿瘤发病的25%, 死亡病例52.2万例, 是女性恶性肿瘤死亡最常见的原因[18]. Ma等[32]研究发现, miR-302b在BC细胞中低表达, 并且进一步证实, miR-302b的低表达与淋巴结转移和TNM分期相关, miR-302b表达较低的患者的生存时间比miR-302b表达较高的患者的生存时间更短, 此外, miR-302b表达和TNM分期被证明是BC的独立预后因素, 表明miR-302b的下调可能是BC患者生存不良的重要预后因素.
GC是常见的消化道肿瘤之一, 它的发生是一个涉及多基因、多步骤的过程, 尽管近几年胃癌手术治疗和化疗取得了很大的进展, 但由于GC在早期缺乏特异性症状与体征, 导致大部分GC患者在诊断时已是晚期[33], 晚期GC患者的5年生存率<10%[34], 因此, 早期诊断和治疗对降低GC的发病率和死亡率具有重要意义. Tang等[35]研究发现, miR-302b作为胚胎干细胞(embryonic stem cells, ESC)中含量最丰富的miRNA, 在胃腺癌中的表达水平显著降低, 且ESC特异性转录因子(OCT4、SOX2、Nanog、Rex-1)在miR-302b启动子上具有结合位点, 以上研究表明, miR-302b作为抑癌基因, 可能通过调节ESC对肿瘤的发生和发展起着重要的作用. Liu等[36]检测发现, 与正常胃组织相比, miR-302b在GC组织中的表达水平显着降低, 有淋巴结转移的GC患者中的miR-302b表达水平显着低于无淋巴结转移的GC患者, 远处转移距离为M1的患者的表达水平显着低于转移距离为M0的患者, TNM III-IV患者的表达水平显着低于TNM I-II患者, 提示miR-302b在胃组织肿瘤发生中的潜在抑癌作用, 并且miR-302b的低表达可能是一个不良的预后因素, 可以作为胃癌早期诊断和预测预后的指标. 有研究发现, GC组织中miR-302b低表达, miR-302b表达下降的GC患者可能会出现癌症的侵袭性和进展性, 且低表达miR-302b是GC患者独立预后指标[37].
早在2017年, 本团队[38]通过应用qRT-PCR法检测CC组织、癌旁组织、腺瘤性息肉组织中miR-302b的表达变化, 同时分析miR-302b的表达变化与CC患者的分化程度、淋巴转移、性别等临床病理参数的关系, 结果显示, miR-302b在腺瘤性息肉中的表达显著低于癌旁组织, 而CC组织中的表达则显著低于癌旁组织和腺瘤性息肉, 从而证实了miR-302b的表达水平随着组织异性程度的加重, 呈进行性的下调, 提示miR-302b的低表达可能与CC的发生发展密切相关, 且进一步研究发现, miR-302b的表达水平越低, 肿瘤分化程度越差, 存在淋巴结和远处转移可能性越大, 提示miR-302b的低表达促进了肿瘤的转移和侵袭, 在此研究中, miR-302b作为肿瘤抑制因子, 在CC可能发挥抑癌基因功能和抑制CC的转移和侵袭.
膀胱癌是中国最常见的泌尿系生殖系统恶性肿瘤, 早期诊断新发和复发性膀胱癌, 予以及时治疗, 将有效降低其死亡率[39]. Li等[40]发现, 相比癌旁组织, miR-302b在膀胱尿路上皮癌(bladder urothelial carcinoma, BUC)组织中的表达明显下调, 进一步研究发现, miR-302b抑制了BUC细胞的迁移和增殖, 且诱导癌凋亡. 大约75%的膀胱癌患者是非肌源性膀胱癌, 60%-70%的非肌源性膀胱癌患者会复发[41,42], 分子数据表明, 大多数复发与最终治疗失败有关[43], 因此, 寻找用于膀胱癌早期诊断、治疗和复发预测的分子生物标志物具有重要的意义. Li等人通过单因素和多因素分析发现miR-302b低表达的患者有较高的复发风险, 从而得出, miR-302b是预测BUC复发的潜在生物标志物.
随着对miR-302b研究的深入, 已经有越来越多证据表明, miR-302b可通过调控不同的靶基因在肿瘤的增值、凋亡、侵袭、迁移、肿瘤相关性炎症等扮演重要的角色(图1).
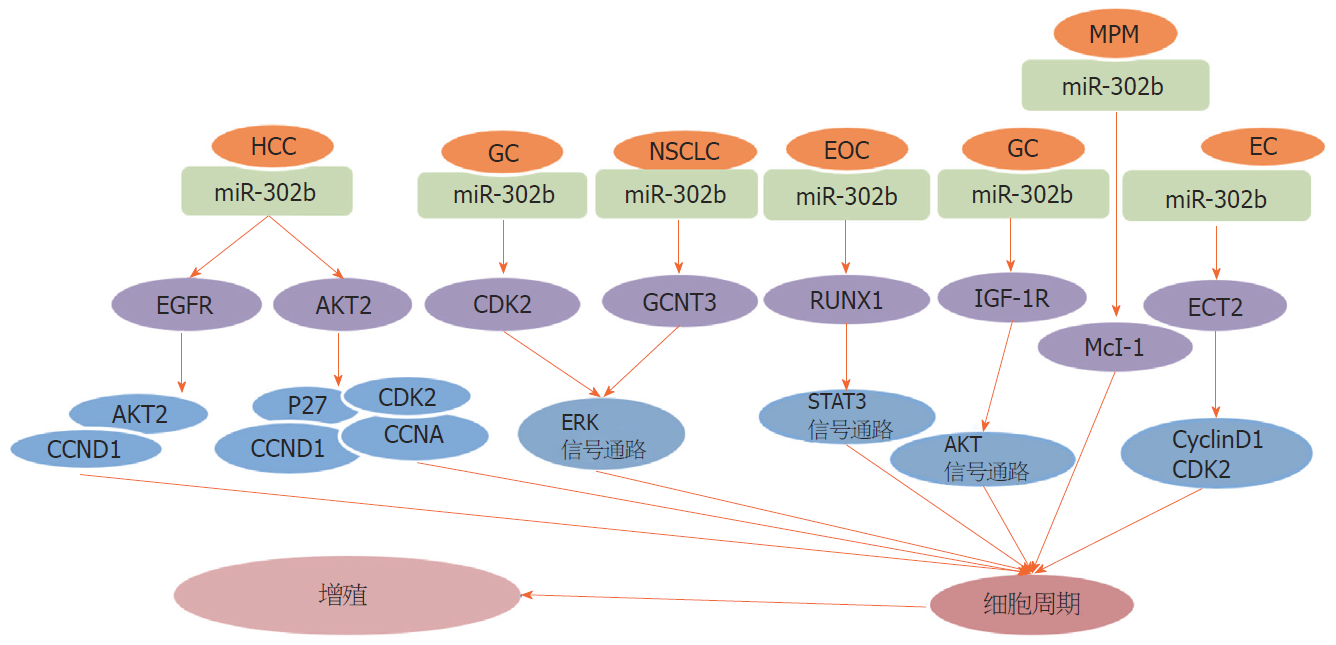
细胞增殖调控是一个复杂而精确的过程, 由多种信号驱动, 这些信号通过调节细胞周期使细胞分裂和生长. 许多研究表明, miR-302b在调控肿瘤增殖方面发挥重要作用(图2). Ge等[46]通过检测38例上皮性卵巢癌(epithelial ovarian cancer, EOC)组织和16例正常卵巢组织中miR-302b和Runt相关转录因子(Runt related transcription factor, RUNX) 1的表达发现, EOC组织中miR-302b水平显著低于正常卵巢组织, 进一步研究发现, miR-302b靶向RUNX1诱导G0/G1期细胞周期阻滞和促进细胞凋亡, 抑制EOC细胞的生长和集落形成能力, 并证明miR-302b通过其靶基因RUNX1调节STAT3通路的活性, 因此, miR-302b通过靶向RUNX1调节STAT3通路, 影响EOC细胞的增殖周期, 发挥抑癌基因的功能. 有学者称, CDK2是一种在G1/S转变期和S期发挥重要作用的细胞周期蛋白激酶, 其激活导致恶性细胞增殖[35], 而细胞外调节蛋白激酶ERK信号通路参与多种细胞增殖和分化过程, 并与多种肿瘤的侵袭和转移机制有关[36], Liu等[36]人研究发现, miR-302b作为一种在GC组织显著下调的miRNAs, 可以靶向和负性调节CDK2的表达, 抑制ERK信号通路, 从而抑制GC组织细胞增殖、阻滞细胞周期, 因此, 这为GC细胞调控和增殖研究提供了新的思路, 为GC的治疗提供了新的靶点. 同样有研究发现, 在NSCLC细胞中发现了miR-302b-3p的低表达, 并且负向靶标GCNT3, 抑制ERK信号通路影响肿瘤细胞周期, 从而抑制NSCLC细胞的增值[47]. Wang等[48,49]先后做过两次关于miR-302b影响肝细胞癌(hepatocellular carcinoma, HCC)增殖的研究, 2013年的研究证实[47], miR-302b在肝癌细胞中不仅低表达, 而且通过靶向表皮生长因子受体EGFR使得细胞周期相关蛋白AKT2、CCND1下调, 抑制人肝癌细胞增殖. 2014年研究[49]发现, 在临床HCC标本中以及在HCC细胞系中, miR-302b的表达水平显着降低, 并且miR-302b通过直接靶向AKT2, 调节细胞周期来抑制HCC细胞的增殖调控因子CCNA、CCND1、P27和CDK2, 抑制了HCC细胞增殖.
Khodayari等[50]研究发现, Mcl-1作为一种抗凋亡蛋白, 被发现在大多数恶性胸膜间皮瘤(malignant pleural mesothelioma, MPM)组织中过度表达, miR-302b可通过靶向Mcl-1的3'-UTR下调恶性间皮瘤细胞中Mcl-1的mRNA和蛋白表达, 来抑制恶性间皮瘤细胞的增殖和瘤球形成, 因此, miR-302b在恶性间皮瘤中通过调节Mcl-1介导细胞增殖/肿瘤球生长的速率, 从而起到抑制MPM的发展, 并且可能是一个针对MPM有希望的新治疗策略的候选者. Guo等[51]研究发现, miR-302b-3p是一种新型的肿瘤抑制因子, 可通过靶向类胰岛素生长因子1型受体(insulin-like growth factor 1 receptor, IGF-1R)阻止AKT信号传导途径影响细胞周期G1-S过渡抑制增值, 从而阻止GC细胞的生长. 在EC细胞中, miR-302b-3p通过靶向ECT2, 下调CyclinD1和CDK2表达诱导细胞周期阻滞于G0/G1[52].
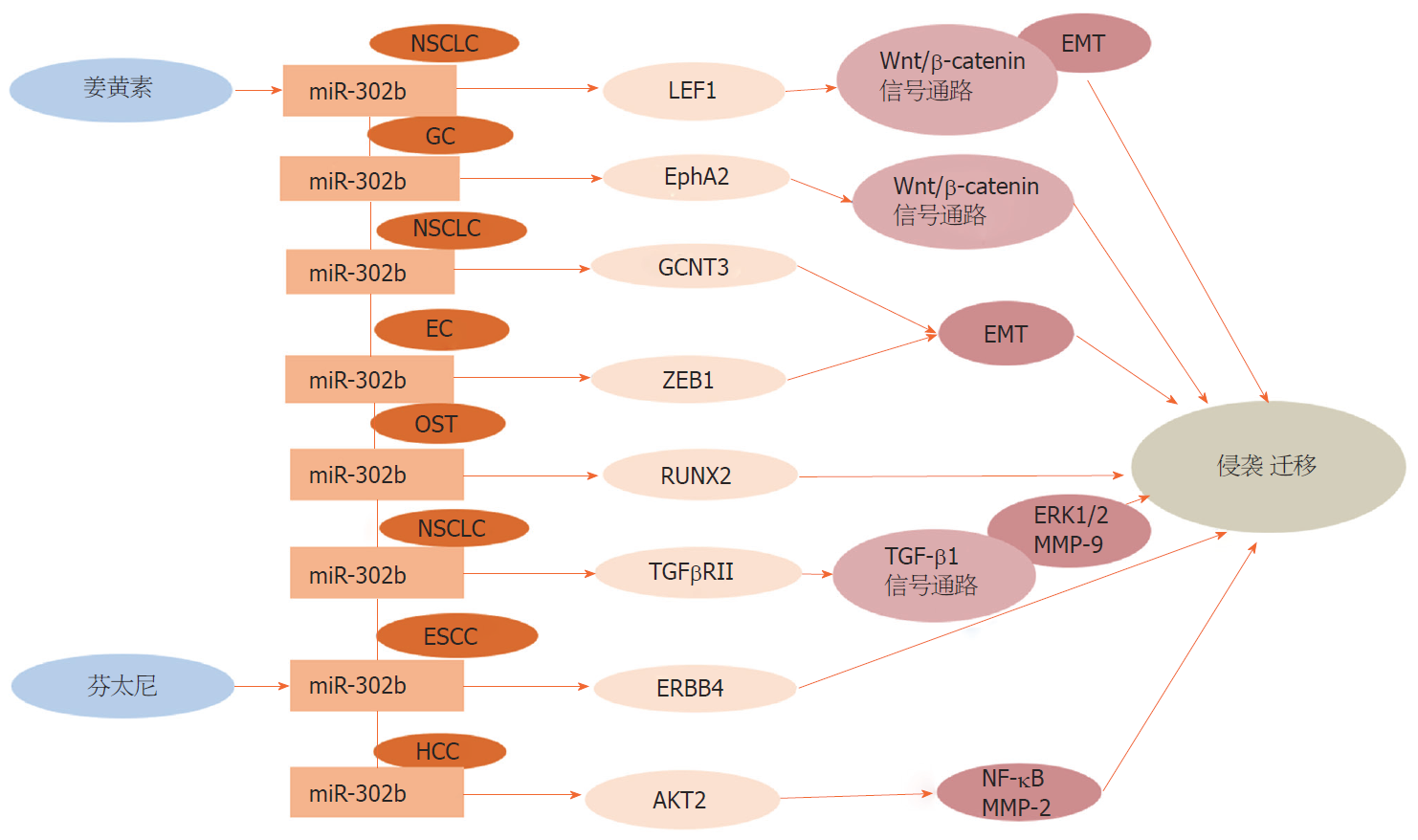
肿瘤细胞的侵袭和迁移是导致大部分恶性肿瘤患者死亡的主要原因. 这种侵袭和迁移的能力, 使肿瘤细胞离开组织内的原发位置, 进入淋巴管和血管, 随血液循环到远处器官定植. 因此, 阐明恶性肿瘤侵袭和迁移的分子机制, 特别是导致癌细胞无控制转移的基因改变和信号传导途径, 有望改善恶性肿瘤的治疗. 许多具有上皮表型肿瘤细胞的转移、运动和入侵能力在接受刺激信号后增强这一过程称EMT[53]. EMT使肿瘤细胞失去上皮特性, 包括上皮极性和细胞-细胞的接触结构, 取而代之的是获得了较高的转移与侵袭、抗凋亡和降解细胞外基质的能力等间质表型, 从而使得它们侵袭并转移到邻近周围组织[54], 因此, EMT赋予肿瘤细胞离开原发肿瘤和侵入局部组织转移扩散的能力[55]. 在EMT过程中, 上皮细胞经历了细胞骨架的重塑, 可能会失去促进细胞间质接触的蛋白质, 如E-cadherin和Ƴ-catenin, 而获得间质标记物, 如波形蛋白、纤维连接蛋白、N-cadherin、MMP-2、MMP-9, 导致细胞迁移和侵袭的增强[54]. 例如: 在NSCLC中, Tian等[47]研究发现, GCNT3作为miR-302b-3p的直接靶标, 可通过影响E-cadherin、N-cadherin和波形蛋白, 抑制NSCLC侵袭和转移, 间接揭示了GCNT3和miR-302b-3p可通过EMT影响NSCLC侵袭和转移. 在EC中, Li等[56]研究称, 锌指蛋白E-盒结合同源异形盒-1作为E-cadherin的转录抑制剂, 可直接被miR-302b-3p负向靶标抑制EMT的进程, 影响子宫内膜癌细胞的侵袭和转移. Wnt/β-连环蛋白(Wnt/β-catenin)信号通路在肿瘤进展过程中对EMT有重要影响, 细胞膜上的Wnt受体受信号刺激后, 促进β-catenin向细胞核的转移可能导致E-cadherin的丢失和EMT的诱导[57-59]. Huang等[60]研究表明, miR-302b可靶向生促红素人肝细胞受体酪氨酸激酶受体A2, 进而调控Wnt/β-catenin信号通路抑制了EMT, 影响了GC细胞侵袭和迁移. Jiao等[61]通过研究姜黄素在NSCLC转移中的抑制机制, 发现姜黄素作为癌症的保护因子, 可靶向且负向调控miR-302b-3p, miR-302b-3p又可负向靶标LEF1, 影响Wnt/β-catenin信号传导, 从而抑制NSCLC细胞的进展.
转化生长因子-β1 (transforming growth factor beta-1, TGF-β1)信号通路在细胞生长、分化和迁移的调节中发挥着重要作用, 已被认为是肿瘤进展的关键途径. Li等[62]研究发现, TGFβRII作为一种众所周知的跨膜受体, 与TGF-β1结合可启动TGF-β1信号通路, 此信号通路的启动上调了磷酸化ERK1/2和MMP-9的表达, 然而, TGFβRII作为肺癌细胞miR-302b的直接靶点, 抑制了TGF-β1信号通路, 因此, miR-302b通过直接靶向TGFβRII抑制TGF-β1诱导的TGF-β1/ERK途径, 从而抑制了肺癌细胞的侵袭和迁移. RUNX2是参与骨髓间质干细胞成骨分化、骨发育等过程的重要转录因子[63], 被发现在人OST细胞系中显著过表达[64], Xie等[45]研究发现, 上调或下调miR-302b的表达均会导致RUNX2水平的反向变化, 并且miR-302b可靶向RUNX2在OST的侵袭和迁移活动中发挥肿瘤抑制作用. 芬太尼作为一种强麻醉镇痛药, 广泛应用于外科手术, 有研究称芬太尼能够抑制肿瘤的进展, 包括增殖、细胞周期、凋亡、侵袭和化疗敏感性[65-68], Wang等[69]研究发现, 芬太尼通过刺激miR-302b的表达而抑制了ESCC细胞的侵袭, 但下调了erb-b2受体酪氨酸激酶4 (Erb-b2 receptor tyrosine kinase 4, ERBB4), 因此, 芬太尼可能通过miR-302b/ERBB4途径抑制ESCC细胞的侵袭. 在HCC中, Wang等[70]研究发现, miR-302b通过靶向AKT2调节NF-κB和MMP-2的表达, 抑制HCC细胞的侵袭和转移, 提示AKT2是肝癌转移和侵袭的关键信号整合因子(图3).
有研究称, 肿瘤相关性炎症(cancer related inflammation, CRI)是长期炎性刺激(炎性因子或炎性细胞)所致细胞内的信号通路异常, 而异常的信号通路又发挥多种促肿瘤作用: 如促进细胞的增殖和存活、促进血管的新生和转移、减弱获得性免疫反应以及改变机体对化疗药物和激素的反应[71], 因此, CRI在肿瘤发生及进展中具有非常重要的作用. 本团队自2015年开始, 一直致力于探索miR-302b在肿瘤中的作用, 就miR-302b与肿瘤相关炎症关系的研究做过深入的分析, 首先明确了miR-302b在ESCC中的表达水平低于永生化食管上皮细胞, 且48 h的炎症刺激降低了ESCC中miR-302b的表达, 但对永生化食管上皮细胞没有影响, 说明miR-302b的表达水平与食管癌CRI有关[71]. 进一步研究发现, miR-302b减少了CRI的关键转录因子(NF-κB、STAT3和HIF-1α)及其下游细胞因子(IL-6、IL-23和TNF-β), 并且ESCC组织中的miR-302b与潜在的靶基因蛋白表达ERBB4, 干扰素调控因子IRF2和趋化因子受体CXCR4之间呈负相关, 这些研究表明, miR-302b可能是一种调节CRI的新型miRNA, 可通过靶向ERBB4, IRF2和CXCR4抑制CRI的关键途径和下游细胞因子的表达, 从而导致肿瘤生长减少[72].
miR-302b不仅可通过调控不同的靶基因在肿瘤的增值、凋亡、侵袭和迁移等方面具有重要作用, 在恢复耐药的肿瘤细胞对化疗药物的敏感性及增加药敏上亦发挥着不可忽视的作用. 肿瘤细胞产生耐药是导致患者治疗效果不理想的重要原因, 产生耐药的途径和机制多种多样, 因此, 鉴定与建立耐药表型有关的分子机制, 是制定预防或克服抗肿瘤治疗的癌症耐药新策略的迫切需要.
BC是导致女性癌症相关死亡的主要原因, BC患者通常对顺铂(cisplatin, DDP)为主的化疗有良好的初始反应, 但耐药性是治疗失败的主要原因之一, 尤其是转移性疾病患者[73,74]. Cataldo等[75]研究发现, miR-302b过表达增强了BC细胞系对DDP的敏感性, 降低了细胞存活率和对治疗的反应, 还鉴定了G1/S转换的主调节因子E2F1作为miR-302b的直接靶基因, E2F1转录激活了DNA损伤的主要细胞传感器ATM, miR-302b通过对E2F1的负调控间接影响ATM的表达, 阻断DDP治疗后细胞周期的进展. 此外, miR-302b降低了BC细胞修复受损DNA的能力, 增强了DDP治疗后细胞凋亡的激活. 因此, miR-302b通过调节E2F1/ATM轴在BC细胞对DDP的反应中发挥了相关作用, 是克服化疗耐药的有效治疗手段(图1).
肝癌是我国最常见的癌症类型之一, 也是我国死亡率最高的癌症之一[76]. 在治疗肝癌的100多种药物中, 5-氟尿嘧啶(5-fluorouracil, 5-FU)是目前最理想的药物, 应用广泛. 但是, 由于5-FU耐药的迅速发展, 单用5-FU治疗晚期肝癌的疗效并不理想. 因此, 许多人致力于寻找影响5-FU在肿瘤细胞中敏感性的基因, 或5-FU诱导的细胞凋亡. Cai等[77]证明了miR-302b可以增强肝癌细胞中5-FU的化疗敏感性, 诱导肝癌细胞的凋亡, 通过靶向Mcl-1和二氢嘧啶脱氢酶完成(图1), 由于其在肝癌细胞中的低表达水平, 因此, miR-302b在开发更好的基因递送系统后, 将成为潜在的候选分子, 可提高晚期肝癌患者的化疗效率.
有学者证实[78], 全反式维甲酸(all trans retinoic acid, ATRA)是维甲酸的衍生物, 作为诱导分化剂, 对多种肿瘤细胞具有诱导分化、抑制增殖并促进凋亡的作用. Chen等[79]研究发现, 因为, ATRA可通过线粒体功能紊乱、内质网应激和活性氧生成诱导胶质母细胞瘤细胞死亡, 且ATRA通过维甲酸受体a介导的途径以剂量和时间依赖的方式上调miR-302b的表达, 所以, miR-302b的过表达增强了ATRA介导的多形性胶质母细胞瘤(glioblastoma multiforme, GBM)细胞死亡, 进一步研究发现, E2F3作为miR-302b的直接靶基因(图1), miR-302b降低的E2F3水平与ATRA介导的胶质瘤细胞死亡有关, 因此, MiR-302b抑制的E2F3表达参与ATRA介导的细胞死亡途径, 且miR-302b及其直接靶基因可能成为未来疾病治疗的重要靶点.
自噬是一种与凋亡、坏死并列的细胞程序性死亡方式, 又被称作是II型程序性细胞死亡. 近年来的研究发现自噬信号通路异常跟肿瘤的发生和发展密切相关, 适度的自噬可使细胞适应不利因素从而利于肿瘤细胞的存活, 但过度的自噬会损伤细胞器, 从而导致细胞发生自噬性死亡[80]. 因此以自噬为靶点, 探索miR-302b-3p调控肿瘤的自噬, 寻找肿瘤等疾病的新治疗方式, 也成为了研究的热点. Chen等[81]研究发现, SQSTM1作为多聚体泛素化合物和自噬体之间的桥梁起着作用, miR-302b-3p靶向SQSTM1的3'UTR的584-590的位置, 并会导致SQSTM1的低表达, 从而使细胞自噬相关蛋白LC3-II/LC3-I和Beclin1的表达明显上升, 最终抑制BC细胞的自噬.
综上所述, miR-302b在以上恶性肿瘤中作为一个潜在的抑癌基因, 靶向或控制多个信号通路基因的表达, 影响肿瘤细胞的增殖、迁移、侵袭、肿瘤相关炎症、自噬和耐药等恶性过程, 并且miR-302b在肿瘤组织中的低表达水平与临床病理特征相关. miR-302b具有广阔的临床应用前景, 其有望成为恶性肿瘤分子靶向治疗的关键靶点, 研究miR-302b在恶性肿瘤中的潜在调控机制, 对多种恶性肿瘤的诊断、治疗及疾病预后具有重要意义.
虽然近几年miR-302b的研究越发火热, 但仍存在一些问题有待进一步探究: (1)大量研究显示, miR-302b在恶性肿瘤中作为抑癌基因存在, 但也有研究发现, miR-302b在恶性生殖细胞肿瘤中的表达高于正常性腺和良性生殖细胞肿瘤[82], miR-302b-3p在睾丸生殖细胞肿瘤(testicular germ cell tumor, TGCT)中不仅高表达, 而且可能通过诱导SPRY4的表达和激活MAPK/ERK途径而成为TGCT癌基因[83], 因此, 继续完善miR-302b的功能并深入研究其作用机制, 将对肿瘤患者的诊断和治疗等有着重要意义; (2)目前, miRNA在体液中被发现, 如血清、脑脊液、尿液、精液、唾液等, 这些循环miRNA表现出非凡的稳定性和抗降解能力, 对RNA酶和极端的理化因素的处理不敏感, 这使得循环miRNA作为理想的疾病标记物, 对多种肿瘤具有诊断和预后的价值[84], 有研究发现, miR-302b-3p在OSCC患者的唾液细胞外囊泡中表达, 且具有作为生物标志物的潜力[85], 但有关循环miR-302b表达的研究少之甚少, 大部分研究的实验样本来源于组织, 因此, 循环miR-302b的表达, 且对恶性肿瘤的诊断、预后和治疗等的价值, 也是值得深入研究的; (3)miR-302b作为miR-302家族中的一员, 是否与miR-302家族存在一些功能上的交叉, 亦或是存在一定的关联, 助于明确miR-302b的作用, 这都是有待进一步的实验论证的; (4)上下游靶向调控机制的明确, 有助于丰富恶性肿瘤发生发展的分子机制, 为未来靶向治疗药物的开发提供新的思路, 有研究表明, 长链非编码RNA可以作为miR-302b的上游调控基因, 影响肿瘤的发生、发展[86], 同样有研究发现, 环状RNA可通过调节miR-302b-3p/IGF-1R轴, 影响喉鳞状细胞癌(laryngeal squamous cell carcinoma, LSCC)的进程[87], 但关于miR-302b上游调控机制的研究有限, 因此, 在现有研究的基础上, 更进一步的研究miR-302b的上游调控机制也是很有必要的.
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 2. | Chen W, Zheng R, Zhang S, Zeng H, Xia C, Zuo T, Yang Z, Zou X, He J. Cancer incidence and mortality in China, 2013. Cancer Lett. 2017;401:63-71. [PubMed] [DOI] |
| 3. | 王 宁, 刘 硕, 杨 雷, 张 希, 袁 延楠, 李 慧超, 季 加孚. 2018全球癌症统计报告解读. 肿瘤综合治疗电子杂志. 2019;5:87-97. [DOI] |
| 6. | Pfeffer S, Zavolan M, Grässer FA, Chien M, Russo JJ, Ju J, John B, Enright AJ, Marks D, Sander C, Tuschl T. Identification of virus-encoded microRNAs. Science. 2004;304:734-736. [PubMed] [DOI] |
| 7. | Kröger H, Donner I, Skiello G. Influence of a new virostatic compound on the induction of enzymes in rat liver. Arzneimittelforschung. 1975;25:1426-1429. [PubMed] [DOI] |
| 8. | Hummel R, Hussey DJ, Haier J. MicroRNAs: predictors and modifiers of chemo- and radiotherapy in different tumour types. Eur J Cancer. 2010;46:298-311. [PubMed] [DOI] |
| 9. | Kong YW, Ferland-McCollough D, Jackson TJ, Bushell M. microRNAs in cancer management. Lancet Oncol. 2012;13:e249-e258. [PubMed] [DOI] |
| 10. | Bonfrate L, Altomare DF, Di Lena M, Travaglio E, Rotelli MT, De Luca A, Portincasa P. MicroRNA in colorectal cancer: new perspectives for diagnosis, prognosis and treatment. J Gastrointestin Liver Dis. 2013;22:311-320. [PubMed] |
| 11. | Chen X, Ba Y, Ma L, Cai X, Yin Y, Wang K, Guo J, Zhang Y, Chen J, Guo X, Li Q, Li X, Wang W, Zhang Y, Wang J, Jiang X, Xiang Y, Xu C, Zheng P, Zhang J, Li R, Zhang H, Shang X, Gong T, Ning G, Wang J, Zen K, Zhang J, Zhang CY. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res. 2008;18:997-1006. [PubMed] [DOI] |
| 12. | Wu L, Qu X. Cancer biomarker detection: recent achievements and challenges. Chem Soc Rev. 2015;44:2963-2997. [PubMed] [DOI] |
| 13. | Yu S, Liu Y, Wang J, Guo Z, Zhang Q, Yu F, Zhang Y, Huang K, Li Y, Song E, Zheng XL, Xiao H. Circulating microRNA profiles as potential biomarkers for diagnosis of papillary thyroid carcinoma. J Clin Endocrinol Metab. 2012;97:2084-2092. [PubMed] [DOI] |
| 14. | Gao Z, Zhu X, Dou Y. The miR-302/367 cluster: a comprehensive update on its evolution and functions. Open Biol. 2015;5:150138. [PubMed] [DOI] |
| 15. | Yan GJ, Yu F, Wang B, Zhou HJ, Ge QY, Su J, Hu YL, Sun HX, Ding LJ. MicroRNA miR-302 inhibits the tumorigenicity of endometrial cancer cells by suppression of Cyclin D1 and CDK1. Cancer Lett. 2014;345:39-47. [PubMed] [DOI] |
| 16. | Cao YP, Pan M, Song YL, Zhang HL, Sui HT, Shan BC, Piao HX. MiR-302 a/b/c suppresses tumor angiogenesis in hepatocellular carcinoma by targeting MACC1. Eur Rev Med Pharmacol Sci. 2019;23:7863-7873. [PubMed] [DOI] |
| 17. | Rosa A, Brivanlou AH. A regulatory circuitry comprised of miR-302 and the transcription factors OCT4 and NR2F2 regulates human embryonic stem cell differentiation. EMBO J. 2011;30:237-248. [PubMed] [DOI] |
| 18. | Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136:E359-E386. [PubMed] [DOI] |
| 19. | Warnakulasuriya S. Living with oral cancer: epidemiology with particular reference to prevalence and life-style changes that influence survival. Oral Oncol. 2010;46:407-410. [PubMed] [DOI] |
| 20. | 韩 晟. 口腔颌面部恶性肿瘤流行病学与卫生经济学风险因素的研究. 博士论文, 第四军医大学 2010. Available from: https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode. |
| 21. | 刘 爱芹, 李 莎莎, 周 旋, 王 旭东, 张 仑. 信号传导及转录激活因子调控微RNA-21影响人舌鳞状细胞癌细胞侵袭能力的体外研究. 中华口腔医学杂志. 2013;48:539-544. [DOI] |
| 23. | Ramos-García P, González-Moles MÁ, González-Ruiz L, Ruiz-Ávila I, Ayén Á, Gil-Montoya JA. Prognostic and clinicopathological significance of cyclin D1 expression in oral squamous cell carcinoma: A systematic review and meta-analysis. Oral Oncol. 2018;83:96-106. [PubMed] [DOI] |
| 24. | 刘 佳佳, 曾 昕, 陈 谦明, 李 敬. MicroRNA-302b通过靶向FZD6抑制口腔鳞状细胞癌的侵袭迁移. 2018年中华口腔医学会第十次全国口腔黏膜病学术大会暨第八次全国口腔中西医结合学术大会论文集; 2018-08-09; 中国上海. 2018;256-258. |
| 25. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 26. | van Hagen P, Hulshof MC, van Lanschot JJ, Steyerberg EW, van Berge Henegouwen MI, Wijnhoven BP, Richel DJ, Nieuwenhuijzen GA, Hospers GA, Bonenkamp JJ, Cuesta MA, Blaisse RJ, Busch OR, ten Kate FJ, Creemers GJ, Punt CJ, Plukker JT, Verheul HM, Spillenaar Bilgen EJ, van Dekken H, van der Sangen MJ, Rozema T, Biermann K, Beukema JC, Piet AH, van Rij CM, Reinders JG, Tilanus HW, van der Gaast A; CROSS Group. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med. 2012;366:2074-2084. [PubMed] [DOI] |
| 27. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 28. | Kong YW, Ferland-McCollough D, Jackson TJ, Bushell M. microRNAs in cancer management. Lancet Oncol. 2012;13:e249-e258. [PubMed] [DOI] |
| 29. | Zhang M, Yang Q, Zhang L, Zhou S, Ye W, Yao Q, Li Z, Huang C, Wen Q, Wang J. miR-302b is a potential molecular marker of esophageal squamous cell carcinoma and functions as a tumor suppressor by targeting ErbB4. J Exp Clin Cancer Res. 2014;33:10. [PubMed] [DOI] |
| 30. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 32. | Ma J, Zhou Z. Downregulation of miR-302b is associated with poor prognosis and tumor progression of breast cancer. Breast Cancer. 2020;27:291-298. [PubMed] [DOI] |
| 33. | Lansdorp-Vogelaar I, Kuipers EJ. Screening for gastric cancer in Western countries. Gut. 2016;65:543-544. [PubMed] [DOI] |
| 34. | Blake SM, Klepp KI, Pechacek TF, Folsom AR, Luepker RV, Jacobs DR, Mittelmark MB. Differences in smoking cessation strategies between men and women. Addict Behav. 1989;14:409-418. [PubMed] [DOI] |
| 35. | Tang L, Hu H, He Y, Mcleod HL, Xiao D, Chen P, Shen L, Zeng S, Yin X, Ge J, Li L, Ma J, Chen Z, Huang J. The relationship between miR-302b and EphA2 and their clinical significance in gastric cancer. J Cancer. 2018;9:3109-3116. [PubMed] [DOI] |
| 36. | Liu FY, Wang LP, Wang Q, Han P, Zhuang WP, Li MJ, Yuan H. miR-302b regulates cell cycles by targeting CDK2 via ERK signaling pathway in gastric cancer. Cancer Med. 2016;5:2302-2313. [PubMed] [DOI] |
| 37. | Ma G, Li Q, Dai W, Yang X, Sang A. Prognostic Implications of miR-302a/b/c/d in Human Gastric Cancer. Pathol Oncol Res. 2017;23:899-905. [PubMed] [DOI] |
| 39. | Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin. 2017;67:7-30. [PubMed] [DOI] |
| 40. | Li Z, Zhou L, Lin C, Pan X, Xie J, Zhao L, Quan J, Xu J, Guan X, Xu W, Li H, Chen Y, Lai Y. MiR-302b regulates cell functions and acts as a potential biomarker to predict recurrence in bladder cancer. Life Sci. 2018;209:15-23. [PubMed] [DOI] |
| 41. | Kamat AM, Hahn NM, Efstathiou JA, Lerner SP, Malmström PU, Choi W, Guo CC, Lotan Y, Kassouf W. Bladder cancer. Lancet. 2016;388:2796-2810. [PubMed] [DOI] |
| 43. | Grossman HB. Bladder cancer: neoadjuvant is new again. Lancet Oncol. 2011;12:830-831. [PubMed] [DOI] |
| 44. | Zhang Y, Hu H, Song L, Cai L, Wei R, Jin W. Epirubicin-mediated expression of miR-302b is involved in osteosarcoma apoptosis and cell cycle regulation. Toxicol Lett. 2013;222:1-9. [PubMed] [DOI] |
| 45. | Xie Y, Sun W, Deng Z, Zhu X, Hu C, Cai L. MiR-302b Suppresses Osteosarcoma Cell Migration and Invasion by Targeting Runx2. Sci Rep. 2017;7:13388. [PubMed] [DOI] |
| 46. | Ge T, Yin M, Yang M, Liu T, Lou G. MicroRNA-302b suppresses human epithelial ovarian cancer cell growth by targeting RUNX1. Cell Physiol Biochem. 2014;34:2209-2220. [PubMed] [DOI] |
| 47. | Li Q, Ran P, Zhang X, Guo X, Yuan Y, Dong T, Zhu B, Zheng S, Xiao C. Downregulation of N-Acetylglucosaminyltransferase GCNT3 by miR-302b-3p Decreases Non-Small Cell Lung Cancer (NSCLC) Cell Proliferation, Migration and Invasion. Cell Physiol Biochem. 2018;50:987-1004. [PubMed] [DOI] |
| 48. | Wang L, Yao J, Shi X, Hu L, Li Z, Song T, Huang C. MicroRNA-302b suppresses cell proliferation by targeting EGFR in human hepatocellular carcinoma SMMC-7721 cells. BMC Cancer. 2013;13:448. [PubMed] [DOI] |
| 49. | Wang L, Yao J, Zhang X, Guo B, Le X, Cubberly M, Li Z, Nan K, Song T, Huang C. miRNA-302b suppresses human hepatocellular carcinoma by targeting AKT2. Mol Cancer Res. 2014;12:190-202. [PubMed] [DOI] |
| 50. | Khodayari N, Mohammed KA, Lee H, Kaye F, Nasreen N. MicroRNA-302b targets Mcl-1 and inhibits cell proliferation and induces apoptosis in malignant pleural mesothelioma cells. Am J Cancer Res. 2016;6:1996-2009. [PubMed] |
| 51. | Guo B, Zhao Z, Wang Z, Li Q, Wang X, Wang W, Song T, Huang C. MicroRNA-302b-3p Suppresses Cell Proliferation Through AKT Pathway by Targeting IGF-1R in Human Gastric Cancer. Cell Physiol Biochem. 2017;42:1701-1711. [PubMed] [DOI] |
| 52. | 刘 翼, 祝 琳, 康 敏. miR-302b-3p对食管癌EC-109细胞增殖和凋亡的影响及其机制. 吉林大学学报(医学版). 2019;45:1346-1352. [DOI] |
| 53. | Savagner P. Epithelial-mesenchymal transitions: from cell plasticity to concept elasticity. Curr Top Dev Biol. 2015;112:273-300. [PubMed] [DOI] |
| 54. | 郑 舒丹, 程 诗萌, 董 亚兵, 李 其富, 朱 宁文. RACK1与肿瘤细胞的侵袭和转移相关性研究进展. 中国美容整形外科杂志. 2019;30:500-503, 511. |
| 55. | Antoon JW, Nitzchke AM, Martin EC, Rhodes LV, Nam S, Wadsworth S, Salvo VA, Elliott S, Collins-Burow B, Nephew KP, Burow ME. Inhibition of p38 mitogen-activated protein kinase alters microRNA expression and reverses epithelial-to-mesenchymal transition. Int J Oncol. 2013;42:1139-1150. [PubMed] [DOI] |
| 56. | Li Y, Huo J, Pan X, Wang C, Ma X. MicroRNA 302b-3p/302c-3p/302d-3p inhibits epithelial-mesenchymal transition and promotes apoptosis in human endometrial carcinoma cells. Onco Targets Ther. 2018;11:1275-1284. [PubMed] [DOI] |
| 57. | Song S, Mazurek N, Liu C, Sun Y, Ding QQ, Liu K, Hung MC, Bresalier RS. Galectin-3 mediates nuclear beta-catenin accumulation and Wnt signaling in human colon cancer cells by regulation of glycogen synthase kinase-3beta activity. Cancer Res. 2009;69:1343-1349. [PubMed] [DOI] |
| 58. | Heuberger J, Birchmeier W. Interplay of cadherin-mediated cell adhesion and canonical Wnt signaling. Cold Spring Harb Perspect Biol. 2010;2:a002915. [PubMed] [DOI] |
| 59. | Su YJ, Chang YW, Lin WH, Liang CL, Lee JL. An aberrant nuclear localization of E-cadherin is a potent inhibitor of Wnt/β-catenin-elicited promotion of the cancer stem cell phenotype. Oncogenesis. 2015;4:e157. [PubMed] [DOI] |
| 60. | Huang J, He Y, Mcleod HL, Xie Y, Xiao D, Hu H, Chen P, Shen L, Zeng S, Yin X, Ge J, Li L, Tang L, Ma J, Chen Z. miR-302b inhibits tumorigenesis by targeting EphA2 via Wnt/ β-catenin/EMT signaling cascade in gastric cancer. BMC Cancer. 2017;17:886. [PubMed] [DOI] |
| 61. | Jiao DM, Yan L, Wang LS, Hu HZ, Tang XL, Chen J, Wang J, Li Y, Chen QY. Exploration of inhibitory mechanisms of curcumin in lung cancer metastasis using a miRNA- transcription factor-target gene network. PLoS One. 2017;12:e0172470. [PubMed] [DOI] |
| 62. | Li J, Yu J, Zhang H, Wang B, Guo H, Bai J, Wang J, Dong Y, Zhao Y, Wang Y. Exosomes-Derived MiR-302b Suppresses Lung Cancer Cell Proliferation and Migration via TGFβRII Inhibition. Cell Physiol Biochem. 2016;38:1715-1726. [PubMed] [DOI] |
| 63. | Chu Q, Gao Y, Gao X, Dong Z, Song W, Xu Z, Xiang L, Wang Y, Zhang L, Li M, Gao Y. Ablation of Runx2 in Ameloblasts Suppresses Enamel Maturation in Tooth Development. Sci Rep. 2018;8:9594. [PubMed] [DOI] |
| 64. | Sadikovic B, Thorner P, Chilton-Macneill S, Martin JW, Cervigne NK, Squire J, Zielenska M. Expression analysis of genes associated with human osteosarcoma tumors shows correlation of RUNX2 overexpression with poor response to chemotherapy. BMC Cancer. 2010;10:202. [PubMed] [DOI] |
| 65. | Qin Y, Li L, Chen J, Tang X, Liao C, Xie Y, Xiao Q. Fentanyl inhibits progression of human gastric cancer MGC-803 cells by NF-kappaB downregulation and PTEN upregulation in vitro. Oncol Res. 2012;20:61-69. [PubMed] [DOI] |
| 66. | Zong L, Abe M, Seto Y, Ji J. The challenge of screening for early gastric cancer in China. Lancet. 2016;388:2606. [PubMed] [DOI] |
| 67. | Ling H, Samarasinghe S, Kulasiri D. Computational experiments reveal the efficacy of targeting CDK2 and CKIs for significantly lowering cellular senescence bar for potential cancer treatment. Biosystems. 2013;111:71-82. [PubMed] [DOI] |
| 68. | Neuzillet C, Hammel P, Tijeras-Raballand A, Couvelard A, Raymond E. Targeting the Ras-ERK pathway in pancreatic adenocarcinoma. Cancer Metastasis Rev. 2013;32:147-162. [PubMed] [DOI] |
| 69. | Wang N, Zhang Z, Lv J. Fentanyl inhibits proliferation and invasion via enhancing miR-302b expression in esophageal squamous cell carcinoma. Oncol Lett. 2018;16:459-466. [PubMed] [DOI] |
| 70. | Wang L, Yao J, Sun H, Sun R, Chang S, Yang Y, Song T, Huang C. miR-302b suppresses cell invasion and metastasis by directly targeting AKT2 in human hepatocellular carcinoma cells. Tumour Biol. 2016;37:847-855. [PubMed] [DOI] |
| 72. | Zhang M, Zhang L, Cui M, Ye W, Zhang P, Zhou S, Wang J. miR-302b inhibits cancer-related inflammation by targeting ERBB4, IRF2 and CXCR4 in esophageal cancer. Oncotarget. 2017;8:49053-49063. [PubMed] [DOI] |
| 73. | Roy V, Pockaj BA, Allred JB, Apsey H, Northfelt DW, Nikcevich D, Mattar B, Perez EA. A Phase II trial of docetaxel and carboplatin administered every 2 weeks as preoperative therapy for stage II or III breast cancer: NCCTG study N0338. Am J Clin Oncol. 2013;36:540-544. [PubMed] [DOI] |
| 74. | Mayer IA, Abramson VG, Lehmann BD, Pietenpol JA. New strategies for triple-negative breast cancer--deciphering the heterogeneity. Clin Cancer Res. 2014;20:782-790. [PubMed] [DOI] |
| 75. | Combe B. [The immunology of rheumatoid arthritis. Influence of basic treatment]. Rev Rhum Mal Osteoartic. 1989;56:30-33. [PubMed] [DOI] |
| 76. | Chen W, Zheng R, Zeng H, Zhang S, He J. Annual report on status of cancer in China, 2011. Chin J Cancer Res. 2015;27:2-12. [PubMed] [DOI] |
| 77. | Cai D, He K, Chang S, Tong D, Huang C. MicroRNA-302b Enhances the Sensitivity of Hepatocellular Carcinoma Cell Lines to 5-FU via Targeting Mcl-1 and DPYD. Int J Mol Sci. 2015;16:23668-23682. [PubMed] [DOI] |
| 79. | Chen PH, Shih CM, Chang WC, Cheng CH, Lin CW, Ho KH, Su PC, Chen KC. MicroRNA-302b-inhibited E2F3 transcription factor is related to all trans retinoic acid-induced glioma cell apoptosis. J Neurochem. 2014;131:731-742. [PubMed] [DOI] |
| 82. | Murray MJ, Saini HK, van Dongen S, Palmer RD, Muralidhar B, Pett MR, Piipari M, Thornton CM, Nicholson JC, Enright AJ, Coleman N. The two most common histological subtypes of malignant germ cell tumour are distinguished by global microRNA profiles, associated with differential transcription factor expression. Mol Cancer. 2010;9:290. [PubMed] [DOI] |
| 83. | Das MK, Evensen HSF, Furu K, Haugen TB. miRNA-302s may act as oncogenes in human testicular germ cell tumours. Sci Rep. 2019;9:9189. [PubMed] [DOI] |
| 85. | Gai C, Camussi F, Broccoletti R, Gambino A, Cabras M, Molinaro L, Carossa S, Camussi G, Arduino PG. Salivary extracellular vesicle-associated miRNAs as potential biomarkers in oral squamous cell carcinoma. BMC Cancer. 2018;18:439. [PubMed] [DOI] |
| 86. | Sun L, Guo Y, He P, Xu X, Zhang X, Wang H, Tang T, Zhou W, Xu P, Xie P. Genome-wide profiling of long noncoding RNA expression patterns and CeRNA analysis in mouse cortical neurons infected with different strains of borna disease virus. Genes Dis. 2019;6:147-158. [PubMed] [DOI] |
| 87. | Tian L, Cao J, Jiao H, Zhang J, Ren X, Liu X, Liu M, Sun Y. CircRASSF2 promotes laryngeal squamous cell carcinoma progression by regulating the miR-302b-3p/IGF-1R axis. Clin Sci (Lond). 2019;133:1053-1066. [PubMed] [DOI] |