修回日期: 2020-06-01
接受日期: 2020-06-12
在线出版日期: 2020-07-08
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是由于肝脏脂质蓄积诱发的一系列炎症、氧化应激和内质网应激反应导致的的一种慢性肝损伤疾病. 银杏内酯B (ginkgolide B, GB)具有抗炎、抗氧化应激和维持脂代谢稳态的作用, 提示其可能具有治疗NAFLD的作用.
探究GB是否对NAFLD具有治疗作用并分析其机制.
C57BL/6J小鼠分为正常对照(normal control, NC)组、NC+8 mg/kg GB组、高脂饮食(high fat diet, HFD)组、HFD+2 mg/kg GB组、HFD+4 mg/kg GB组和HFD+8 mg/kg GB组. 通过HFD诱导法建立NAFLD小鼠模型. 收集各组小鼠血液和肝组织并分别进行生化、病理学和Western blot检测.
病理学结果显示, GB改善HFD导致的肝脏脂肪变性, 减少炎症和肝细胞中脂质蓄积. 生化结果显示, GB降低HFD喂养的小鼠的血清中谷丙转氨酶、谷草转氨酶、甘油三酯和总胆固醇的水平和肝组织中白介素-6、白介素-1β、肿瘤坏死因子-α的水平. Western blot结果显示, GB抑制HFD诱导的肝组织中真核翻译起始因子2α亚基的磷酸化水平和脂肪酸合酶与活化转录因子表达.
GB对HFD诱导的NAFLD小鼠具有肝保护作用, 且保护作用与其减轻HFD引起的肝损伤、脂肪变性和减弱内质网应激相关.
核心提要: 银杏内酯B (ginkgolide B, GB)能改善高脂饮食诱导的非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)小鼠的肝损伤、肝细胞脂肪变性和脂质蓄积, 并减弱肝脏炎症和内质网应激反应, 提示GB是抗NAFLD的潜在药物.
引文著录: 龙思琴, 喻秀峰, 葛宇黎, 刘炉香. 银杏内酯B改善高脂饮食诱导的小鼠肝脏脂肪变性和炎症. 世界华人消化杂志 2020; 28(13): 519-525
Revised: June 1, 2020
Accepted: June 12, 2020
Published online: July 8, 2020
Nonalcoholic fatty liver disease (NAFLD) is a chronic liver injury caused by a series of inflammation, oxidative stress, and endoplasmic reticulum stress responses induced by lipid accumulation in the liver. Ginkgolide B (GB) has the functions of anti-inflammation, antioxidant stress, and maintenance of lipid metabolism homeostasis, and therefore may have a therapeutic effect on NAFLD.
To explore whether GB has a therapeutic effect on NAFLD and analyze its mechanism.
C57BL/6J mice were divided into a normal control group (NC), 8 mg/kg GB group, high fat diet (HFD) group, HFD + 2 mg/kg GB group, HFD + 4 mg/kg GB group, and HFD + 8 mg/kg GB group. NAFLD was induced in mice by HFD feeding. Blood and liver tissues were collected for biochemical, pathological, and Western blot analyses.
Pathological results showed that GB improved hepatic steatosis and reduced inflammatory response and lipid accumulation in liver cells caused by HFD feeding. Biochemical results showed that GB reduced the levels of alanine aminotransferase, aspartate aminotransferase, triglyceride, and total cholesterol in serum as well as the levels of interleukin-6, interleukin-1β, and tumor necrosis factor-α in live tissues in HFD-fed mice. Western blot results showed that GB inhibited the phosphorylation level of eukaryotic translation initiation factor-2α, and the expression of fatty acid synthase and activating transcription factor 4 in liver tissues induced by HFD feeding.
GB has a protective effect on the liver of mice with NAFLD induced by HFD feeding, and the protective effect is related to the reduction of liver damage, steatosis, and endoplasmic reticulum stress.
- Citation: Long SQ, Yu XF, Ge YL, Liu LX. Ginkgolide B ameliorates high-fat diet-induced hepatic steatosis and inflammation in mice. Shijie Huaren Xiaohua Zazhi 2020; 28(13): 519-525
- URL: https://www.wjgnet.com/1009-3079/full/v28/i13/519.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i13.519
脂肪肝分为酒精性脂肪性肝病和非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD)两种类型[1]. 其中NAFLD与肥胖、胰岛素抵抗、高血压和血脂异常等代谢性疾病密切相关, 因此NAFLD属于慢性代谢异常性肝脏类疾病[2]. NAFLD的突出特征在于病程的持续性病理改变, 从最初(排除明确的损肝因素)机体代谢紊乱所致的肝细胞脂肪变性发展为非酒精性脂肪性肝炎, 随后发生肝纤维化和肝硬化, 甚至最终可能导致肝细胞肝癌发生, 因此, NAFLD是原发性肝细胞癌发生的潜在因素[3]. 且, NAFLD约影响全球范围内30%的成年人的身体健康[4]. 故, NAFLD已成为一个与我们生活密切相关的公共卫生问题. 尽管已开展了许多用于NAFLD治疗策略, 但目前尚无特异性针对NAFLD的治疗药物[5].
银杏内酯B(Ginkgolide B, GB)是从银杏叶中提取的一种药理活性最高的二萜内酯类活性单体. GB具有包含抗氧化应激、抗炎、扩血管和维持脂代谢稳态等多种药理作用[6,7]. 在肝病领域方面的研究显示, GB能改善CCl4诱导大鼠的肝脏的炎症与纤维化[8]. 基于NAFLD为肝细胞脂代谢紊乱导致的应激性和炎症性肝损伤[2,3],以及GB的药理作用[6-8], 推测GB可能具有抗NAFLD的作用, 而GB对NAFLD的影响和机制尚未见报道. 因此, 本研究主要探究GB是否在NAFLD中具有肝保护作用以及其机制.
36只SPF级8周龄雄性C57BL/6J小鼠购自浙江维通利华实验动物技术有限公司[SCXK(浙)2019-0001], 饲养于SPF级动物房(无病原体条件; 12 h光/暗循环; 室温维持在23-25 ℃; 湿度维持在55%-65%), 在给予特殊饮食之前, 小鼠随意饮食和水. 银杏内酯B (货号: B21581, 纯度≥98%)购于上海源叶生物科技有限公司; 油红O染液(货号: D027)购于上海雅吉生物公司; 白介素6 (interleukin 6, IL-6) ELISA试剂盒(货号: GRS13-515)购于上海广锐生物科技有限公司; 白介素1β (interleukin 1β, IL-1β) ELISA试剂盒(货号: H002)、肿瘤坏死因子α (tumor necrosis factor α, TNF-α) ELISA试剂盒(货号: H052)、甘油三酯(triglyceride, TG)比色法试剂盒(货号: F001-1-1)和总胆固醇(total cholesterol, TC)比色法试剂盒(货号: F002-1-1)购于南京建成生物公司; RIPA缓冲液(货号: P0013C)、BCA蛋白定量试剂盒(货号: P0010S)、β-actin抗体(货号: AF5001)和HRP缀合的二抗(货号: A0208)购于上海碧云天生物科技有限公司; 真核翻译起始因子2α亚基(phospho-eukaryotic translation initiation factor-2α, eIF2α, 货号: #9722S)和磷酸化真核翻译起始因子2α亚基(eukaryotic translation initiation factor-2α, p-eIF2α, 货号: #3398T)抗体购于美国Cell Signaling Technology公司; 脂肪酸合酶(fatty acid synthase, FAS, 货号: sc-8009)和活化转录因子4 (activating transcription factor 4, ATF-4, 货号: sc-390063)抗体购于美国Santa Cruz公司.
1.2.1 非酒精性脂肪肝小鼠建模: 通过高脂饮食(high fat diet, HFD)诱导法建立NAFLD小鼠模型[9]. 将小鼠随机分为正常对照组(normal control, NC)、NC+8 mg/kg GB组、HFD组、HFD+2 mg/kg GB组、HFD+4 mg/kg GB组和HFD+8 mg/kg GB组, 每组6只. NC组和NC+8 mg/kg GB组小鼠采用普通饲料喂养10 wk; HFD组、HFD+2 mg/kg GB组、HFD+4 mg/kg GB组和HFD+8 mg/kg GB组采用HFD饲料(60%普通饲料、35%脂肪和5%胆固醇)喂养10 wk. NC+8 mg/kg GB组、HFD+2 mg/kg GB组、HFD+4 mg/kg GB组和HFD+8 mg/kg GB组小鼠在喂养第7-10周每天分别腹腔注射8 mg/kg、2 mg/kg、4 mg/kg和8 mg/kg GB, NC组和HFD组在同时间段给予腹腔注射等体积的生理盐水. 在第10周末, 称重后, 麻醉小鼠后处死, 断头取血, 解剖取肝脏并称重.
1.2.2 血生化检测: 将血液样本置于真空抗凝管中静置10 min, 在室温下以3000 r/min离心20 min以收集血清, 然后用全自动生化仪分析血清中谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、TG和TC水平.
1.2.3 HE染色: 将肝脏组织在4%甲醛溶液中浸泡过夜, 然后包埋固定于石蜡, 并制作5 μm后肝切片. 肝切片经常规脱蜡复水后, 行HE染色, 显微镜下观察肝组织病理学的变化并拍照.
1.2.4 油红O染色: 将肝组织制成10 μm厚的切片, 蒸馏水洗涤后将切片用60%异丙醇中漂洗20-30 s, 滴加油红O染液并室温孵育10 min后, 用60%异丙醇稍洗去多余染液, 再用蒸馏水洗除异丙醇, 苏木素染核, 并用1%盐酸酒精分化. 最后用水漂洗10 min, 室温晾干, 显微镜下观察肝组织脂质蓄积情况并拍照.
1.2.5 ELISA检测: 取肝组织经RIPA匀浆后, 收取匀浆液并用BCA法进行蛋白定量. 取肝组织匀浆液, 并根据试剂盒说明书的步骤, 进行ELISA检测, 反应显色后用96孔板式分光光度计(DLB-96C型, 石家庄点晶电子科技有限公司)在波长450 nm处测量吸光度值, 并根据标准品绘制标准曲线, 计算出单位mg蛋白中IL-6、IL-1β和TNF-α的含量.
1.2.6 比色法检测: 取经BCA法蛋白定量后的肝组织匀浆液样品, 按照试剂盒说明书的步骤, 进行反应, 反应完成后用分光光度计在波长505 nm处测量吸光度值, 并根据标准品绘制标准曲线, 计算出单位mg蛋白中TG和TC的含量.
1.2.7 Western blot检测: 取经BCA法蛋白定量后的肝组织匀浆液样品, 并取等量(30 mg)蛋白进行SDS-聚丙烯酰胺凝胶电泳分离并转移到PVDF膜上. 封闭膜后, 4 ℃孵育1:1000稀释比例的一抗(eIF2α、p-eIF2α、ATF-4、FAS和β-actin)过夜, 用TBST洗膜3次, 将膜与1:3000稀释比例的HRP缀合的二抗孵育1 h. 化学发光法显影后, 利用Image J软件进行灰度值分析, 以β-actin灰度值对目的条带灰度值进行标准归一化处理.
统计学处理 数据表示为mean±SD, 并利用SPSS 17.0软件进行统计学分析. 数据间的两两比较采用单因素方差分事后的Bonferroni-t检验. P<0.05时被认为具有统计学差异.
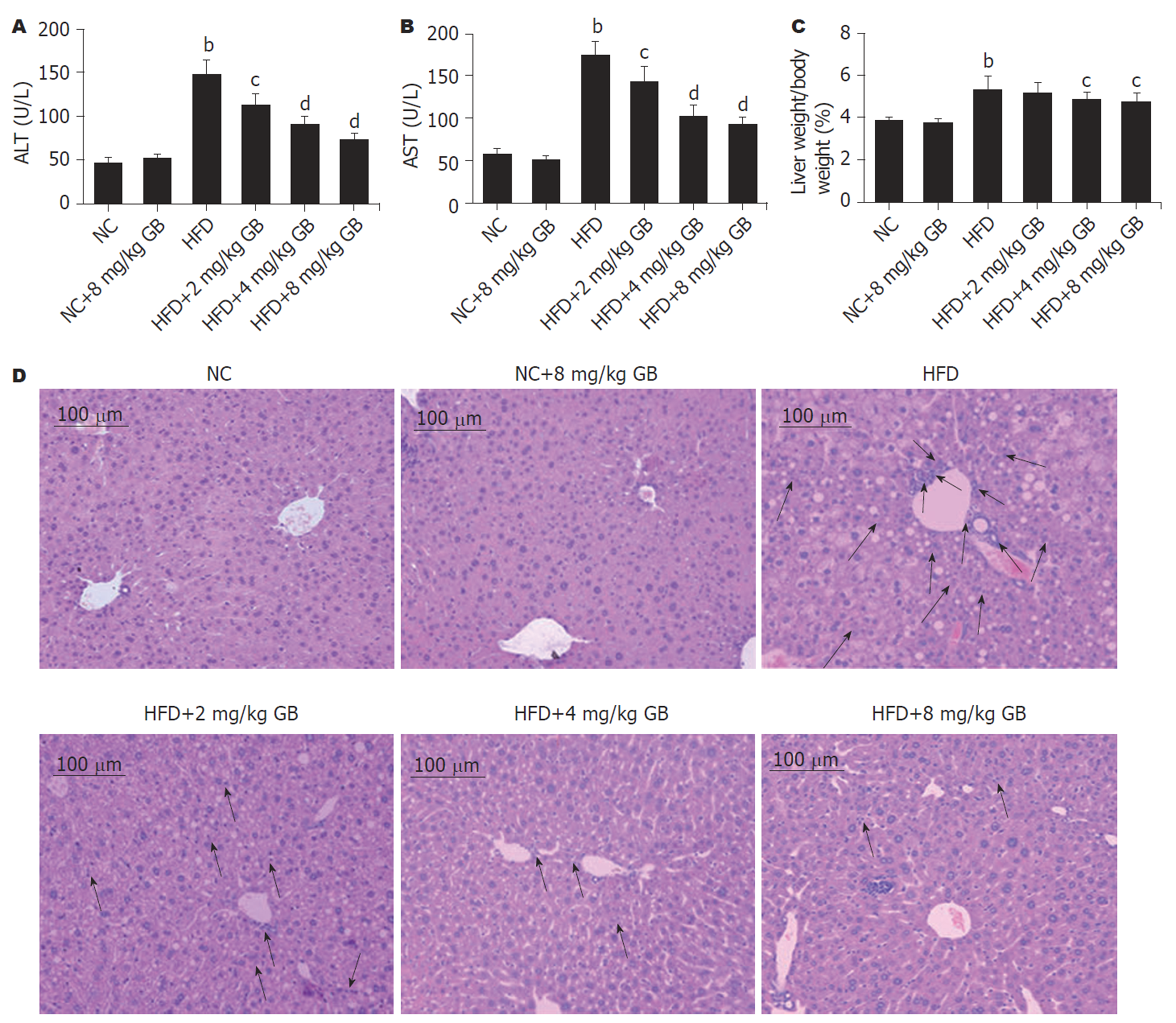
全自动生化仪检测血清中ALT和AST活性用于评估肝损伤, 结果(图1A和B)显示, HFD组血清中ALT和AST活性明显升高(P<0.01), 而GB治疗能明显抑制HFD诱导的ALT和AST活性升高(P<0.05或P<0.01), 提示GB能抑制HFD诱导的肝损伤. 进一步计算了肝体比, 结果(图1C)显示, 与NC组比较, HFD组肝体比明显增加(P<0.01); 与HFD组比较, HFD+4 mg/kg GB组和HFD+8 mg/kg GB组肝体比明显降低(P<0.05). 通过HE染色直接的观察肝组织病理学改变, 结果(图1D)显示, HFD组肝组织出现大量肝细胞空泡样改变, 且伴有炎性细胞侵润(箭头); 而在GB治疗组中HFD导致的肝病理学改变明显减轻.
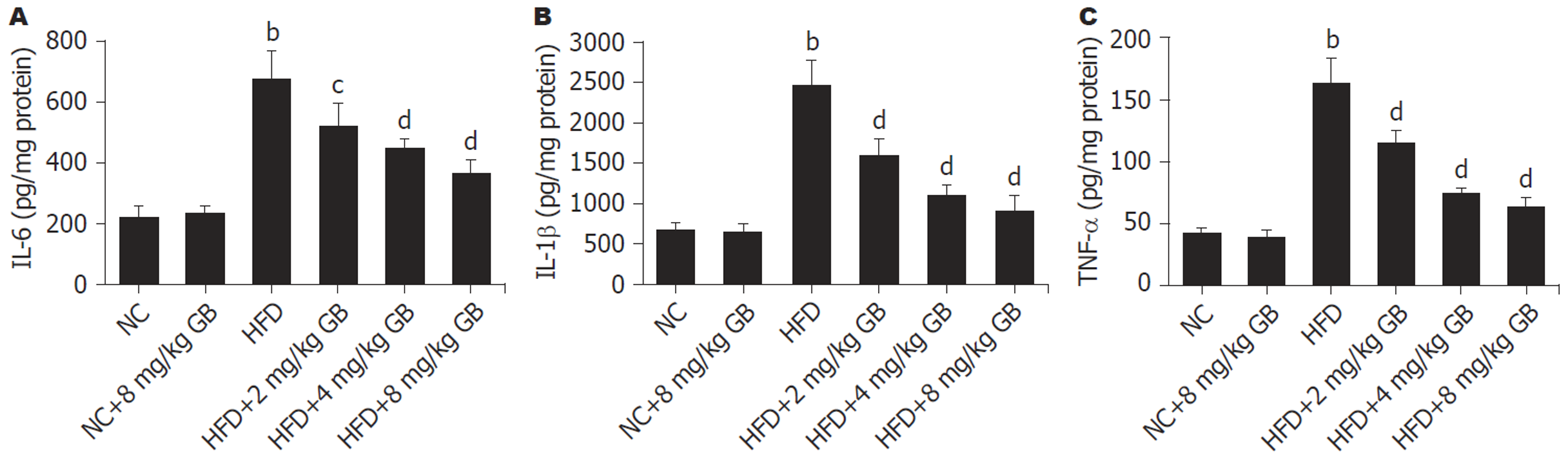
通过ELISA检测IL-6、IL-1β和TNF-α以评估肝组织中炎性反应, 结果(图2A-C)显示, 与NC组比较, HFD组肝组织中IL-6、IL-1β和TNF-α水平明显升高(P<0.01); 与HFD组比较, GB能以剂量依赖性降低HFD诱导的IL-6、IL-1β和TNF-α水平(P<0.05或P<0.01).
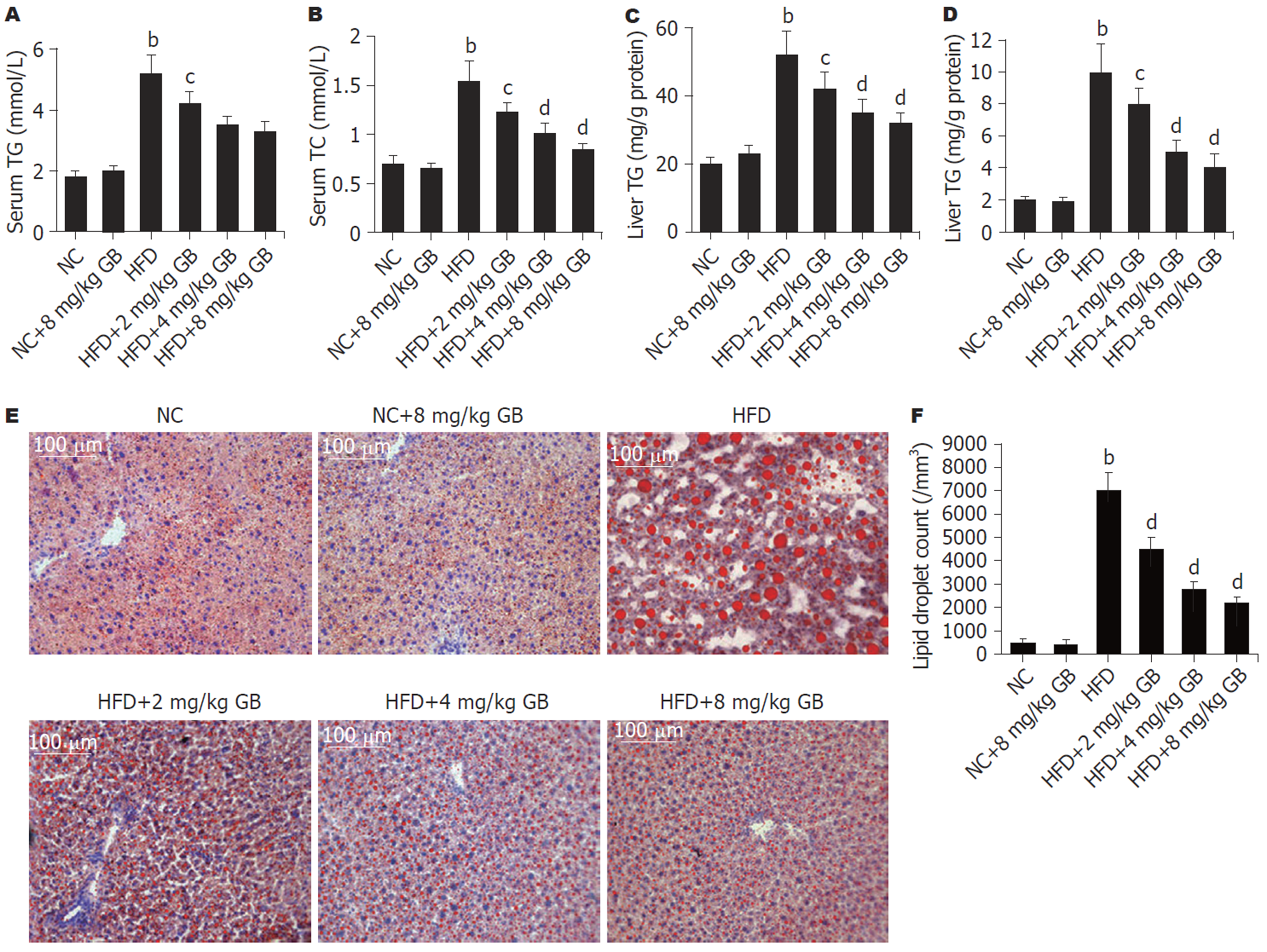
结果(图3A和B)显示, HFD组血清中TG和TC含量明显升高(P<0.01), 而GB治疗能明显抑制HFD诱导的TG和TC含量升高; 这一现象同样在肝组织中呈现(图3C和D). 用油红O染色观察结果(图3E)显示, 在HFD组因肝组织大量空泡脂肪样变性, 脂滴汇合成大的脂滴(红色), 大量积聚于肝细胞; GB治疗能明显改善HFD诱导的肝组织的肝细胞中脂质蓄积; 对脂滴计数, 结果(图3F)显示, HFD组肝组织脂滴数明显增加(P<0.01), 而GB治疗能浓度依赖性减少HFD诱导的肝组织细胞中脂滴积聚(P<0.01).
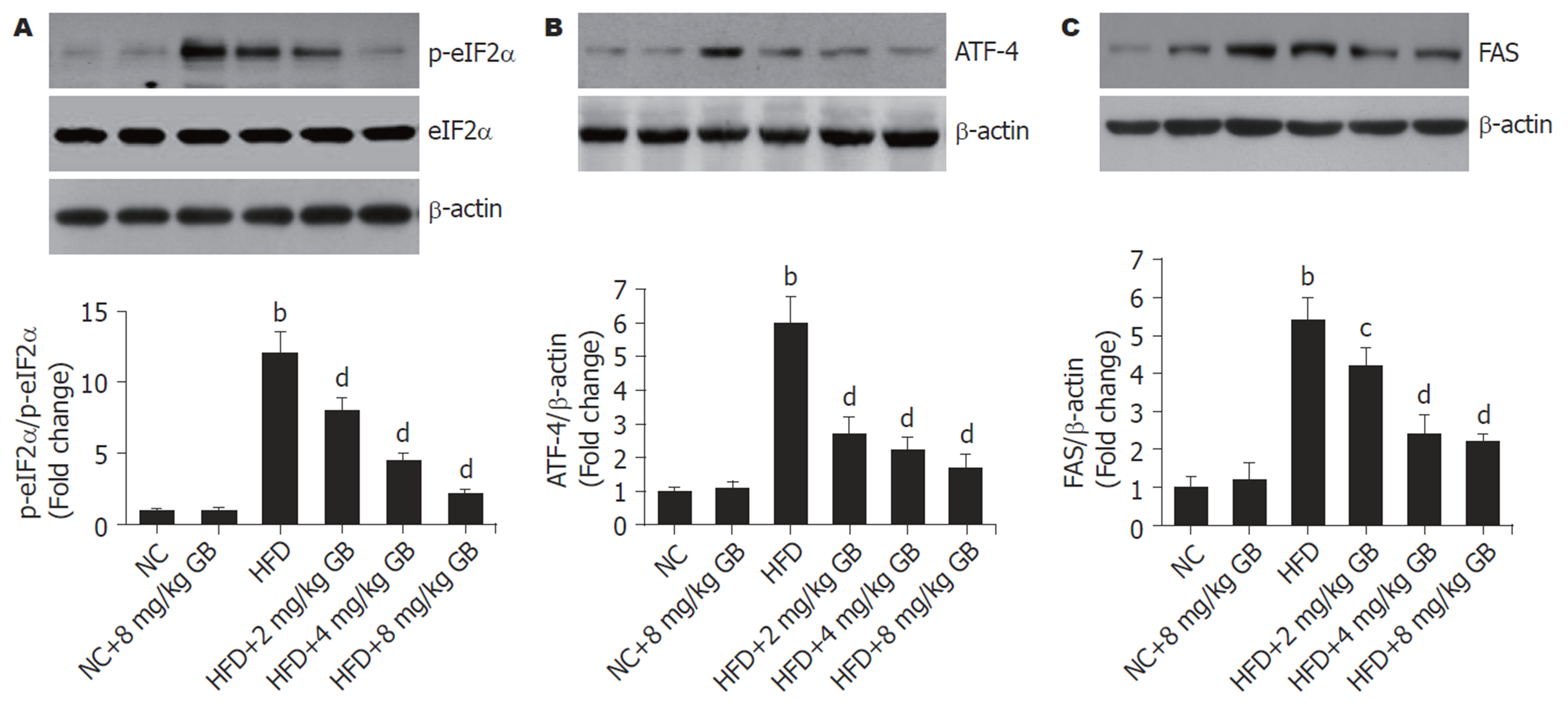
Western blot结果(图4)显示, 与NC组比较, HFD组肝组织中p-eIF2α、ATF-4和FAS表达水平明显升高(P<0.01); 与HFD组比较, GB治疗能抑制HFD诱导的肝组织中p-eIF2α、ATF-4和FAS高表达(P<0.01).
肝脏中肝细胞脂肪变性与脂质积聚为NAFLD的关键性病理变化, 也是触发后续肝功能减退与肝损伤的关键因素[3]. 文献表明[10,11], HFD诱发的代谢紊乱可使得TC与TG水平的异常升高, 特别是TC与TG异常沉积于肝脏,能促使肝细胞脂肪性变性, 并且TC与TG的持续积累能促使肝脏对炎症敏感, 促进NAFLD的进展. 本研究显示, GB能降低HFD诱导小鼠血清和肝组织中TC与TG含量, 并减少HFD导致的肝组织中肝细胞脂肪变性和肝细胞中脂质蓄积. 脂质沉积造成的肝损伤和肝功能减退是NAFLD进展的驱动因素. 血清ALT和AST是NAFLD生化检查用于评估肝损伤和肝功能的重要指标[12], 长期HFD会引起肝损伤和肝功能减退并升高ALT和AST的水平[13]. 本研究结果显示, GB可显著降低HFD诱导的小鼠血清中ALT和AST水平, 提示GB可减轻HFD诱导的肝损伤. 另有, 研究[14]报道, HFD诱导的肝脏脂肪变性与慢性肝脏炎症密切相关, 肝脏脂肪变性增加了肝脏细胞对促炎性因子介导的损伤的敏感性, 并且持续的慢性炎症进一步加剧了NAFLD进展. 因此, 本研究进一步观察GB是否对NAFLD小鼠肝内肝细胞炎症反应起保护作用,结果显示, GB能改善HFD引起的小鼠肝组织内炎性侵润的病理变化, 并降低肝组织中促炎因子IL-6、IL-1β和TNF-α的分泌, 表明GB可有效抑制HFD导致的肝脏炎症反应.
内质网应激(endoplasmic reticulum stress, ERS)反应是导致NAFLD肝损伤的主要毒性事件之一[15]. 低氧、脂质过度负荷、炎症等病理因素可打破内质网稳态, 引发肝细胞中ERS[15,16], 其中, eIF2α在ERS中发挥重要作用. 有研究[17]发现激活eIF2α/ATF-4信号能通过上调FAS的表达促进乳腺上皮细胞的脂源性分化和细胞内脂质合成. Oyadomari等[18]在动物实验中观察到ERS激动剂诱导的小鼠表现为脂肪肝, 而eIF2α去磷酸化后, 小鼠的脂肪肝明显改善. 另外, p-eIF2α可以上调ATF-4的表达, 进而激活核内的固醇调节元件结合蛋白-1c、乙酰辅酶A羧化酶2和FAS等脂质合成相关基因的表达[19], ATF-4基因敲除小鼠能抵抗HFD诱导的肥胖、高甘油三脂血症和NAFLD[20]. 以上证据表明了eIF2α/ATF-4在NAFLD肝细胞脂质合成和代谢中的作用. 本研究结果也显示, 在HFD诱导的NAFLD小鼠肝组织中p-eIF2α、ATF-4和FAS高表达, 而GB能抑制HFD诱导的小鼠肝组织中的高水平p-eIF2α、ATF-4和FAS, 说明GB可通过减弱ERS进而减轻HFD诱导的NAFLD.
综上所述, HFD诱导的NAFLD小鼠表现为肝细胞弥漫大泡性脂肪变性和过量脂质异常沉积于脂肪变性的肝细胞且伴随肝损伤、肝脏炎症和肝ERS反应; 而GB能改善HFD导致的肝组织中肝细胞脂肪变性和肝细胞中脂质蓄积并减少肝脏炎症和减弱肝ERS反应, 提示GB可作为抗NAFLD的潜在药物.
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)发病率呈逐年增加趋势, 其不仅危害患者的身体健康, 且其还具体诱发肝癌的风险. 而目前尚无特异性治疗NAFLD的药物, 因此, 继续研究或筛选NAFLD的潜在治疗剂是目前一项刻不容缓的科研任务.
银杏内酯B (ginkgolide B, GB)具有抗炎、抗氧化和维持脂代谢稳态的作用, 提示GB可能具有改善NAFLD的作用.
探讨GB对NAFLD小鼠肝损伤和脂肪变性的影响, 并分析其中的机制.
用高脂饮食(high fat diet, HFD)诱导法建立NAFLD小鼠模型, 并给予低、中和高剂量的GB治疗. 收集小鼠血液样品, 生化法检测血清中谷丙转氨酶、谷草转氨酶、甘油三酯(triglyceride, TG)和总胆固醇(total cholesterol, TC)的水平. 收集小鼠肝组织样品, HE染色观察病理形态学改变; 油红O染色观察脂质蓄积情况; ELISA法检测白介素-6、白介素-1β和肿瘤坏死因子-α的水平; 比色法检测TG和TC的水平; Western blot检测内质网应激关键蛋白表达.
GB改善了HFD导致的肝脏脂肪变性, 降低了肝损伤和炎症反应, 并维持了肝细胞中脂代谢稳态. 另外, GB减弱了HFD导致的内质网应激反应.
GB能通过减轻肝损伤、脂肪变性和减弱内质网应激来改善HFD诱导的小鼠NAFLD.
GB具有改善HFD导致的小鼠肝细胞脂肪变性和脂质异常蓄积并减弱肝脏炎症和内质网应激反应的作用, 提示GB可作为潜在的抗NAFLD的药物.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Sookoian S, Pirola CJ. Systems biology elucidates common pathogenic mechanisms between nonalcoholic and alcoholic-fatty liver disease. PLoS One. 2013;8:e58895. [PubMed] [DOI] |
| 3. | Lonardo A, Nascimbeni F, Maurantonio M, Marrazzo A, Rinaldi L, Adinolfi LE. Nonalcoholic fatty liver disease: Evolving paradigms. World J Gastroenterol. 2017;23:6571-6592. [PubMed] [DOI] |
| 4. | Perumpail BJ, Khan MA, Yoo ER, Cholankeril G, Kim D, Ahmed A. Clinical epidemiology and disease burden of nonalcoholic fatty liver disease. World J Gastroenterol. 2017;23:8263-8276. [PubMed] [DOI] |
| 6. | Wang G, Liu Z, Li M, Li Y, Alvi SS, Ansari IA, Khan MS. Ginkgolide B Mediated Alleviation of Inflammatory Cascades and Altered Lipid Metabolism in HUVECs via Targeting PCSK-9 Expression and Functionality. Biomed Res Int. 2019;2019:7284767. [PubMed] [DOI] |
| 7. | Feng Z, Yang X, Zhang L, Ansari IA, Khan MS, Han S, Feng Y. Ginkgolide B ameliorates oxidized low-density lipoprotein-induced endothelial dysfunction via modulating Lectin-like ox-LDL-receptor-1 and NADPH oxidase 4 expression and inflammatory cascades. Phytother Res. 2018;32:2417-2427. [PubMed] [DOI] |
| 10. | Kim MJ, Lee KJ. Analysis of the dietary factors associated with suspected pediatric nonalcoholic fatty liver disease and potential liver fibrosis: Korean National Health and Nutrition Examination Survey 2014-2017. BMC Pediatr. 2020;20:121. [PubMed] [DOI] |
| 11. | Marra F, Svegliati-Baroni G. Lipotoxicity and the gut-liver axis in NASH pathogenesis. J Hepatol. 2018;68:280-295. [PubMed] [DOI] |
| 12. | Suzuki A, Lindor K, St Saver J, Lymp J, Mendes F, Muto A, Okada T, Angulo P. Effect of changes on body weight and lifestyle in nonalcoholic fatty liver disease. J Hepatol. 2005;43:1060-1066. [PubMed] [DOI] |
| 13. | Kwo PY, Cohen SM, Lim JK. ACG Clinical Guideline: Evaluation of Abnormal Liver Chemistries. Am J Gastroenterol. 2017;112:18-35. [PubMed] [DOI] |
| 14. | Manne V, Handa P, Kowdley KV. Pathophysiology of Nonalcoholic Fatty Liver Disease/Nonalcoholic Steatohepatitis. Clin Liver Dis. 2018;22:23-37. [PubMed] [DOI] |
| 15. | Lebeaupin C, Vallée D, Hazari Y, Hetz C, Chevet E, Bailly-Maitre B. Endoplasmic reticulum stress signalling and the pathogenesis of non-alcoholic fatty liver disease. J Hepatol. 2018;69:927-947. [PubMed] [DOI] |
| 16. | Sharma RS, Harrison DJ, Kisielewski D, Cassidy DM, McNeilly AD, Gallagher JR, Walsh SV, Honda T, McCrimmon RJ, Dinkova-Kostova AT, Ashford MLJ, Dillon JF, Hayes JD. Experimental Nonalcoholic Steatohepatitis and Liver Fibrosis Are Ameliorated by Pharmacologic Activation of Nrf2 (NF-E2 p45-Related Factor 2). Cell Mol Gastroenterol Hepatol. 2018;5:367-398. [PubMed] [DOI] |
| 17. | Hazari YM, Habib M, Bashir S, Bashir A, Hilal N, Irfan S, Ul Haq E, Fazili KM. Natural osmolytes alleviate GRP78 and ATF-4 levels: Corroboration for potential modulators of unfolded protein response. Life Sci. 2016;146:148-153. [PubMed] [DOI] |
| 18. | Oyadomari S, Harding HP, Zhang Y, Oyadomari M, Ron D. Dephosphorylation of translation initiation factor 2alpha enhances glucose tolerance and attenuates hepatosteatosis in mice. Cell Metab. 2008;7:520-532. [PubMed] [DOI] |
| 19. | Enos RT, Velázquez KT, Carson MS, McClellan JL, Nagarkatti P, Nagarkatti M, Davis JM, Murphy EA. A Low Dose of Dietary Quercetin Fails to Protect against the Development of an Obese Phenotype in Mice. PLoS One. 2016;11:e0167979. [PubMed] [DOI] |
| 20. | Cho EJ, Yoon JH, Kwak MS, Jang ES, Lee JH, Yu SJ, Kim YJ, Kim CY, Lee HS. Tauroursodeoxycholic acid attenuates progression of steatohepatitis in mice fed a methionine-choline-deficient diet. Dig Dis Sci. 2014;59:1461-1474. [PubMed] [DOI] |