修回日期: 2020-05-19
接受日期: 2020-05-28
在线出版日期: 2020-06-28
肝癌是危害人类健康的主要恶性肿瘤之一, 而肝细胞癌(hepatocellular carcinoma, HCC)是肝癌这种异质性恶性疾病中最常见的组织学分型. 肿瘤微环境(tumor microenvironment, TME)是一个由肿瘤细胞及肿瘤相关基质共同构成的动态系统. HCC可以通过多种血管生成模式形成肿瘤相关血管, 已有研究表明TME各组分通过多种方式介导HCC的血管生成, 使其临床抗血管生成治疗面临严峻挑战. 本文就HCC的血管生成模式、TME对HCC血管形成调控的研究进展予以综述, 供肝癌基础与临床研究参考.
核心提要: 肝细胞癌(hepatocellular carcinoma, HCC)是一种高度血管化的异质性恶性肿瘤, 肿瘤微环境(tumor microenvironment, TME)各成分通过多种方式介导HCC血管生成, 迄今TME与HCC研究取得许多新进展. 本文综述TME对HCC血管形成调控新进展, 对肝癌基础与临床研究具有重要参考价值.
引文著录: 覃小珊, 张彩灵, 黄赞松. 肿瘤微环境对肝细胞癌血管生成的影响. 世界华人消化杂志 2020; 28(12): 493-500
Revised: May 19, 2020
Accepted: May 28, 2020
Published online: June 28, 2020
Liver cancer is one of the main malignant tumors that endanger human health, and hepatocellular carcinoma (HCC) is the most common histological type of this heterogeneous cancer. The tumor microenvironment (TME) is a dynamic system composed of tumor cells and tumor-related stroma. HCC can form tumor-related blood vessels through a variety of angiogenesis modes. Previous studies have shown that various components of TME mediate HCC angiogenesis in multiple ways, which brings big challenges to clinical anti-angiogenesis therapy. This article reviews the research progress of HCC angiogenesis model and the role of TME in the regulation of HCC angiogenesis, with an aim to provide a reference for basic and clinical research of liver cancer.
- Citation: Qin XS, Zhang CL, Huang ZS. Influence of tumor microenvironment on angiogenesis in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2020; 28(12): 493-500
- URL: https://www.wjgnet.com/1009-3079/full/v28/i12/493.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i12.493
原发性肝癌素有"癌中之王"的称号, 病程短、手术率低、治疗棘手[1], 是我国主要的常见恶性肿瘤[2]. 2018年全球癌症统计数据显示, 肝癌在恶性肿瘤致死病因中位居第3位, 这其中75%-85%的病例来源于肝细胞癌(hepatocellular carcinoma, HCC), 严重威胁着人类的生命健康[3]. HCC是一种高度血管化且血管高度异质性的肿瘤, 其中增殖性HCC通常分化差, 而新发现的增殖性HCC亚型(巨梁团块型HCC)更与血管生成激活有关[4]. 肿瘤血管的形成不仅为肿瘤生长提供必须的氧气和营养, 还为远处转移提供途径. 大量研究[5-10]发现HCC的血管生成是一种模式多样, 并受到多种因素调节的复杂过程. 肿瘤微环境(tumor microenvironment, TME)是由肿瘤细胞、多种基质细胞和非细胞成分构成, 这些成分通过不同机制所形成的复杂理化网络促进肿瘤发生发展[11]. 研究表明, TME中的各个成分可通过多种方式促进HCC血管形成. 本文就HCC的血管生成模式、TME对HCC血管形成调控的研究进展予以综述.
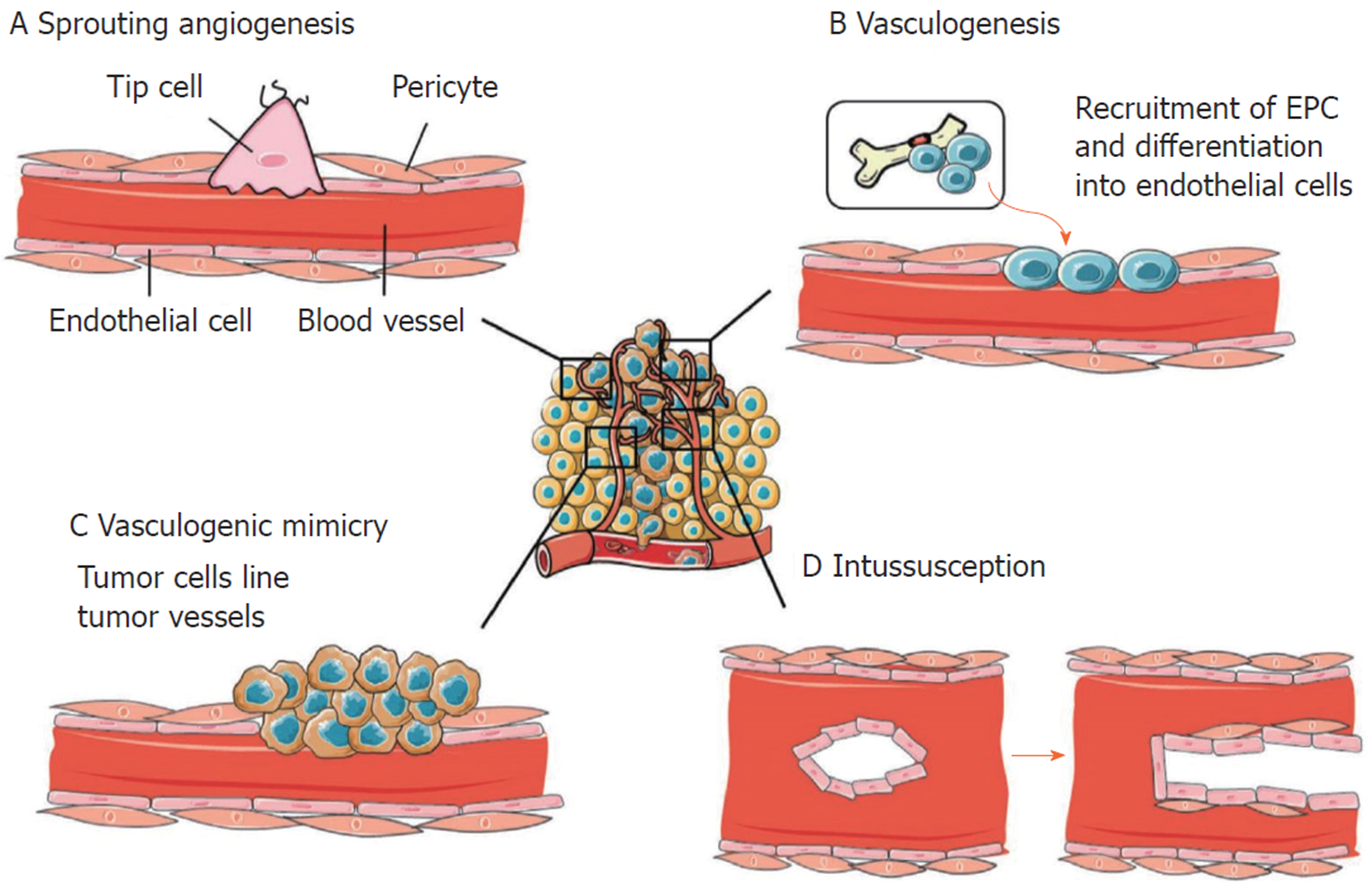
在正常组织中, 大多数血管常处于静止状态. 血管生成模式主要包括: 出芽式血管生成、分裂式血管生成和循环血管生成. 肿瘤的血管生成过程主要是肿瘤本身引发的复杂过程(图1), 这其中还包含血管共选择、套叠式微血管生长、血管生成拟态、成血管细胞募集、肾小球样血管生长等模式[12]. HCC的血管生成也涉及多种血管生成模式.
出芽式血管生成(sprouting angiogenesis, SA)是指先前存在的宿主毛细血管内皮细胞(endothelial cells, ECs)以出芽的方式形成新的肿瘤毛细血管. 它是由多种因素共同参与的有序复杂过程, 在促血管生成信号刺激下血管ECs历经增殖、分化、迁移及管状血管结构形成[13]. 当然这种模式也在HCC血管生成中广泛存在, 参与其中的肿瘤相关血管ECs因其独特的细胞表型而促进肿瘤进展. 例如趋化因子受体CXCR4可以在多种细胞中表达, 而CXCR4+的肿瘤相关血管ECs具有尖端细胞特征并有助于血管发芽[5].
血管共选择是肿瘤细胞利用周围非恶性组织现存的脉管系统来支持肿瘤存活、生长及转移的非血管新生模式. 这一模式普遍存在黑色素瘤、神经胶质瘤、乳腺癌等多种体内外肿瘤模型中[14]. Kuczynski等[6]研究发现, 在原位人类HCC模型经过索拉非尼治疗出现耐药迹象后, 肿瘤细胞表现出高度侵袭性, 却未见新血管生成, 耐药组中血管共选择达到肿瘤所有血管的75%±10.9%, 远高于未经治疗的对照组. 但在停止治疗后肿瘤细胞侵袭表现减少转而依赖血管生成. HCC中血管共选择的存在也说明了HCC抗血管治疗的复杂性. 临床抗血管生成治疗主要针对的是肿瘤新生血管, 而血管共选择有可能是部分HCC患者临床治疗耐药的原因.
套叠式微血管形成(intussusceptive microvascular growth, IMG)是依靠ECs重塑形成的间质柱状结构分裂原有存在的血管腔, 同时募集周细胞、成纤维细胞等覆盖间隙壁, 最终形成两个独立血管的过程. 这种模式最初在肺血管的研究中被发现, 但随后的多项研究表明IMG支持肿瘤血管形成[15]. 蔡靓羽等[7]应用mTOR抑制剂西罗莫司处理荷肝癌大鼠后发现其肿瘤组织的血管主要以IMG的方式生长, 而血管出芽生长被抑制. 由此, 我们可以认为HCC的血管生成模式可以多种形式同时存在, 肿瘤能选择有利模式促进血管生成以适应环境变化.
血管生成拟态(vasculogenic mimicry, VM)是一种有别于传统血管生成的新模式, 极具侵袭性的肿瘤细胞可以模拟ECs形成功能性血管通道为肿瘤提供血液供给. 主要分为管状型VM和基质型VM 2种类型, 前者是由模拟正常ECs形成血供通道的肿瘤细胞组成, 后者是由富含纤维连接蛋白、胶原蛋白、层粘连蛋白的基底膜包绕肿瘤细胞构成[16]. 越来越多的证据表明HCC组织中有VM的存在, 而且以上2种类型都可以在HCC中出现[8,17]. 不同的VM类型可能促使HCC获得不同的生物学行为, 这就需要更深的研究来论证.
肿瘤血管的ECs主要有3个来源: 邻近已有血管的ECs; VM中的肿瘤细胞; 骨髓源性的内皮祖细胞(endothelial progenitor cells, EPCs)[18]. 肿瘤组织分泌相关促血管生成因子诱导骨髓源性的EPCs迁移至肿瘤组织分化为ECs参与血管形成的过程即为成血管细胞募集[19]. Wang等[9]和Sun等[20]在不同的肝癌模型中证实EPCs可以迁移到HCC组织中促进血管生成.
包裹肿瘤簇的血管(vessels encapsulating tumor clusters, VETC)是在HCC细胞来源的血管生成素2诱导下由CD34+ECs、壁细胞、基底膜所形成的血管, 血管内皮可以完全包裹肿瘤簇并形成蜘蛛网状网络. 它是由Fang等[10]在HCC临床样品和小鼠异种移植模型的研究中首次发现. 他们的研究也明确了VETC模式是HCC血源性转移的新机制, 而且这个机制是不依赖上皮-间质转换(epithelial-mesenchymal transition, EMT)进行的. 同时, Renne等[21]进行的一项多机构队列研究发现VETC不但与HCC多种临床及病理学表征相关, 而且影响着HCC的生物学行为.
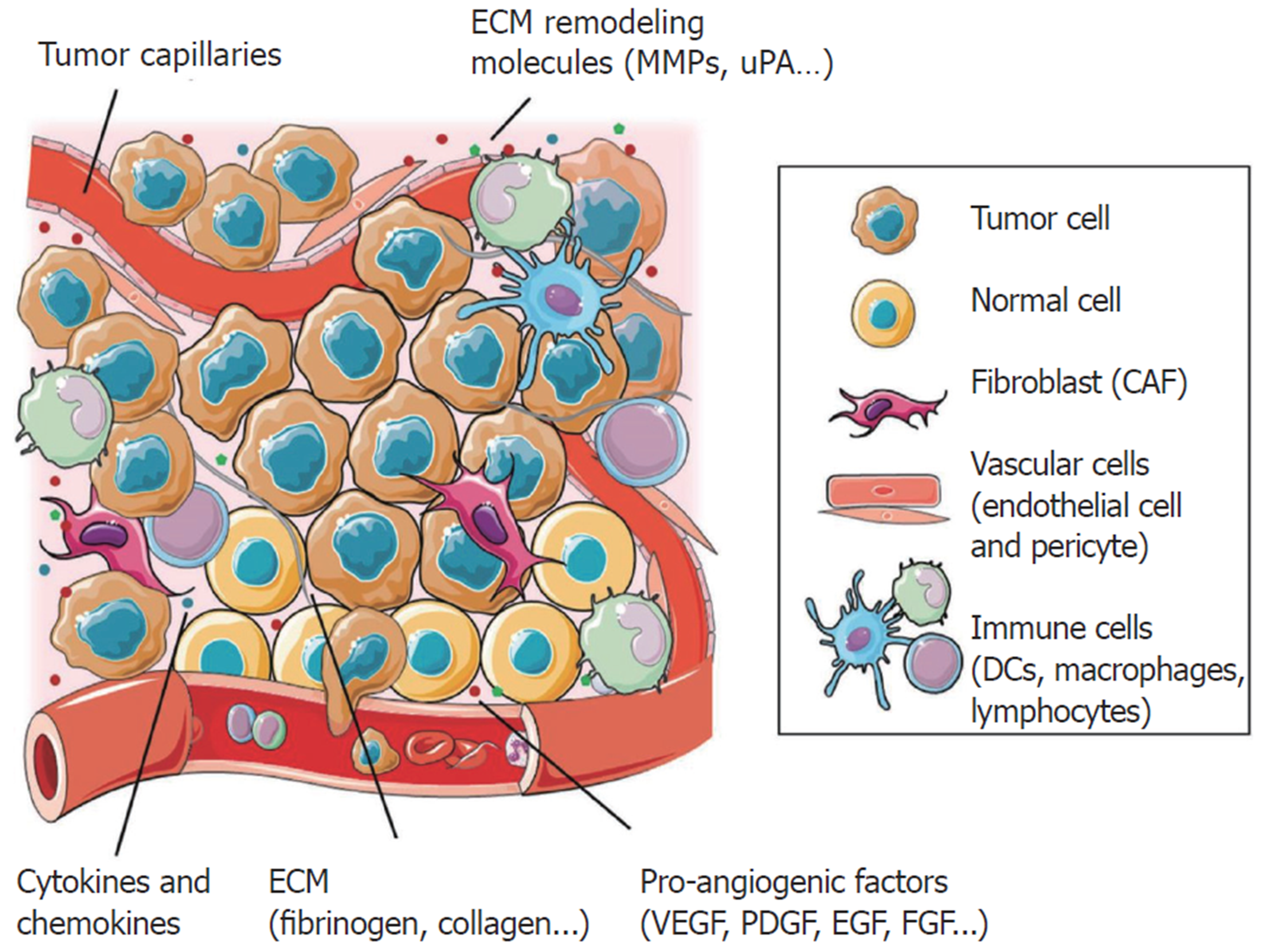
肿瘤血管生成始终贯穿肿瘤发生发展整个过程. 大量证据表明肿瘤血管生成是一个由肿瘤细胞与多种肿瘤相关基质细胞及其生物活性产物共同参与的过程(图2)[22]. 肿瘤血管生成有赖于肿瘤血管生成促进因子与抑制因子之间的不平衡, 而且HCC的血管生成不是以单一的特定模式进行, 由此, 许多学者从各个角度研究TME对HCC血管生成的影响.
2.1.1 缺氧: 缺氧不仅是TME的一个特征, 也是肿瘤发生发展的一个适应性机制, 缺氧会促使不同癌细胞和各种基质成分之间出现复杂反应[23]. 肿瘤组织的生长会导致微环境越来越缺氧, 那么就更依赖血管生成来增强血供, 所以, 它也是影响血管生成的关键因素之一. 缺氧可直接调节各种非编码RNA的表达、外泌体的释放等来影响血管形成. 在缺氧条件下, 源自HCC细胞内含高水平miR-155的外泌体增强人脐静脉内皮细胞(HUVEC)的血管形成能力[24]. 缺氧诱导因子(hypoxia inducible factor, HIF)是由HIF-1α或HIF-2α和HIF-1β/ARNT亚基组成的异二聚体转录因子, HIF激活是肿瘤细胞在缺氧条件下调控肿瘤生物学行为的关键步骤[25,26]. Wang等[27]发现HIF-1α上调HCC细胞中LOXL2的表达, 并诱导EMT和管型VM出现. 在缺氧条件下, HIF调控的下游基因大多参与肿瘤细胞迁移及侵袭、组织血管生成等过程. Wen等[28]研究表明HIF-1α活化能激活VEGFA、TGF-β、EPO等下游血管生成相关基因表达上调, 促进HCC细胞条件培养基所培养的HUVEC形成毛细血管. 但在裸鼠原位植入的HCC模型中, 肿瘤组织中HIF-1α、SDF-1和VEGF表达上调可能导致EPCs向HCC的定向归巢, 进而增强肿瘤血管生成[29].
2.1.2 低pH: 低pH是TME的另一个显著特征. 肿瘤生长可以伴随产生大量酸性代谢产物, 通过瓦伯格效应或有氧糖酵解的新陈代谢程序而形成典型的酸性微环境, 同时酸性微环境也更有助于肿瘤细胞生长[30,31]. 许多体内实验发现肿瘤酸性微环境碱化可以缓解细胞缺氧进而遏制肿瘤血运. 在兔肝癌模型中给予经动脉化学栓塞术(transcatheter arterial chemoembolization, TACE)治疗的区域HIF-1α、糖酵解的组织病理学标志物GLUT-1、慢性酸中毒指标LAMP-2表达降低[32]. 另外, 在临床一项非随机对照研究中, Chao等[33]发现碳酸氢盐可显著增强TACE的抗癌活性.
2.1.3 细胞外基质重塑: 细胞外基质(extracellular matrix, ECM)是TME主要的结构成分, 由纤维蛋白、糖蛋白、蛋白多糖、多糖等不同要素组成. 失衡的ECM重塑促进不可逆的蛋白水解和交联使肿瘤组织变得更坚硬. ECM降解诱发大量细胞因子及生长因子的释放导致细胞信号传导异常、微环境特征改变、血管生成紊乱等[34]. 胶原蛋白是ECM中最丰富的成分, LOXL2作为赖氨酰氧化酶(LOX)家族的一员, 主要作用是催化ECM中胶原蛋白和弹性蛋白的共价交联, HCC中的LOXL2过表达可促进VM的形成[27]. 另外, Shuai等[35]研究发现高密度的ECM能够诱导HCC细胞(Bel7402细胞)的VM形成. 透明质酸(hyaluronan, HA)作为ECM中一种重要多糖, 主要是提供松散基质而利于癌细胞迁移及粘附. Ghose等[36]研究证实HA介导细胞骨架重组, 经HA处理的小鼠肝脏ECs中促血管生成因子表达升高, 并出现更多数量的血管芽. 综上, HCC进展过程中不同刚性的基质变化、细胞信号的传导异常可以促使不同的血管生成方式出现.
2.2.1 肿瘤相关成纤维细胞: 肿瘤相关成纤维细胞(cancer-associated fibroblasts, CAFs)是TME中比重最大的基质细胞, 可能来源于正常成纤维细胞、ECs、肝星状细胞(hepatic stellate cells, HSCs)、骨髓来源的间充质干细胞等, 有着独特的细胞表型, 不仅分泌TGF-β、FGF、VEGF、PDGF、IL等多种因子, 还能衍生ECM相关蛋白质、ECM相关酶等[37]. 但是, 目前CAFs参与血管生成的确切机制仍不完全清楚. Zhou等[38]研究发现来源HCC细胞外泌体的miRNA-21通过激活PDK1/AKT信号通路将HSCs转化为CAFs, CAFs分泌VEGF、MMP2、MMP9、bFGF、TGF-β增加促进血管生成. VASH 1介导血管内皮的负反馈, 而CAFs可以通过分泌VEGF调节EZH2/VASH1途径促进HCC的血管生成[39]. 另外, 有临床数据[40]表明CAFs的富集度与人HCC样品中的肿瘤大小呈正相关. 那么, 在HCC的发展进程中, CAFs对肿瘤血管生成的作用可能会随着肿瘤体积的增大而增强.
2.2.2 ECs: ECs是血管生成的核心参与者, 可在血管发芽期间从静止状态快速转变为高度迁移和增殖状态. 在肿瘤组织中, ECs通常处于激活状态, 细胞表型会随细胞的不同分子水平而改变, 其分泌的多种因子不仅利于血管形成, 而且也促进肿瘤生长[41]. VEGF是参与ECs依赖性肿瘤血管生成的主要活化因子, 但当以ECs为导向的SA方式减弱时, HCC则利用更少依赖ECs的血管套叠生长模式[7]. 另一方面, 应用抑制肿瘤血管形成和破坏现存肿瘤相关血管的抗血管生成疗法能够促进肿瘤相关ECs的自噬, 但其释放富含VEGF的外泌体反而促进肿瘤组织VM形成[42]. Géraud等[43]在分析小鼠肝癌AST模型和人类HCC样品的肝窦内皮细胞特异标记物中发现, HCC在不同发展时期会由于ECs的转分化而选择不同血管生成方式, 早期倾向于血管共选择和IMG, 而后期似乎以SA为主. 由此可见, HCC在不同时期不同阶段可以转换相对利于自身生长的血管生成方式来改善肿瘤供血, 那么临床上抗肝癌血管生成治疗方案应该动态改变, 但具体治疗时机的调整仍需进一步深究.
2.2.3 HSCs: HSCs是位于肝窦和门脉区域的肝特异性间充质细胞, HSCs参与多种细胞因子、生长因子、MMP等的产生, 活化的HSC (aHSC)是ECM中胶原蛋白和蛋白多糖的主要来源. 通过与HCC细胞、其他基质细胞之间相互串扰影响HCC的发展[44]. 血管生成素Ang-1是除VEGF及其受体外重要的血管生成因子. Lin等[45]研究表明aHSC通过分泌Ang-1促进HCC血管生成. 而且在小鼠原位肝癌模型(小鼠肝癌细胞H22与BALB/c小鼠肝脏中分离得到的HSC共移植)中能检测出密度更高的CD31+血管[46]. 当然, HSCs在许多信号通路中也有着重要作用. Hh-Gli信号通路是关键的致癌路径, Li等[47]研究发现旁分泌Hh信号诱导的HSC激活分泌VEGF、Ang-1不仅促进血管生成, 还有助于VM增强.
2.3.1 肝巨噬细胞: 肝脏是人体最大的免疫器官, 肝巨噬细胞是由常驻肝脏的库普弗细胞(kupffer cells, KCs)和不同部位募集到肝脏的巨噬细胞构成. 起源于骨髓循环单核细胞的肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)也属于肝巨噬细胞范畴. 肝巨噬细胞虽有不同的细胞标记, 但大量研究发现它们除了可以分泌VEGF、PDGF、肿瘤坏死因子TNF-α、IL等因子, 还通过细胞间接接触及修剪原始血管等方式参与HCC血管生成[48]. 目前研究发现, 不同的巨噬细胞子集通过不同机制参与HCC的血管形成, 并且导致不同子集间的细胞表型改变. Miura等[49]研究发现高脂饮食增加肝细胞特异性磷酸酶和张力蛋白同源(Pten)缺陷[hepatocyte-specific phosphatase and tensin homolog (Pten)-deficient, Pten△hep]小鼠HCC发生, Pten△hep小鼠肿瘤区域CD31+ECs增多, 双重免疫荧光染色结果显示KCs是高脂饮食下VEGF的主要来源. Notch和Wnt信号通路的相互调节参与血细胞生长等多个发育过程, 有研究结果[50]表明Notch-Wnt信号支配着表现KCs样特性的TAMs在HCC中增殖.
2.3.2 骨髓来源抑制细胞: 骨髓来源抑制细胞(myeloid-derived suppressor cells, MDSCs)是未成熟髓样细胞的异质群体, 在不同的条件下分化为巨噬细胞、中性粒细胞、树突状细胞等, 目前MDSCs的细胞表型仍难确定. 它们参与肿瘤血管新生的方式有直接分泌生长因子(如VEGF、bFGF、Bv8、PDGF)来促进新血管生成, 分泌MMPs重塑细胞外环境, 激活其他末端分化细胞为肿瘤促进表型(如Tregs、Tie2+TAMs、TANs)进而分泌能够促进血管生成的细胞生长因子等[51]. 有研究[52]证实CD11b+Ly6G+MDSCs亚群[粒细胞-MDSC(granulocyte-MDSC, G-MDSCs)]在肝损伤后的再生肝脏中富集, G-MDSCs主要通过VEGF、IL-6、IL-10等信号传导参与血管生成和肝细胞增殖. 同时, MDSCs通过不同机制募集到肿瘤组织促进血管生成, 使得HCC治疗变得更加棘手. Lin等[53]发现在小鼠原位HCC模型中, 肿瘤细胞分泌的粒细胞-巨噬细胞集落刺激因子(GM-CSF)和肿瘤相关ECs分泌的IL-6诱导MDSCs和TAMs在肿瘤中的浸润来促进肿瘤血管生成. 组织缺氧是基质细胞募集的关键因素, Chiu等[54]研究表明缺氧通过HIF/趋化因子(CC基序)配体26诱导表达趋化因子(C-X3-C基序)受体1的MDSC募集到HCC中.
2.3.3 肿瘤相关中性粒细胞: 肿瘤相关中性粒细胞(tumor-associated neutrophils, TANs)主要通过细胞因子和趋化因子作用而进入TME影响肿瘤发生发展. 根据功能不同可将TANs分为抗肿瘤型(N1型)和促肿瘤型(N2型), 在TGF-β等作用下出现细胞表型极化[55]. MYC原癌基因是一种重要的转录因子, 在多种人类癌症中过表达, 有研究[56]表明Myc诱导肿瘤发生过程中增强中性粒细胞在肝脏中浸润, 表现为肿瘤中炎症相关基因(如TNF-α、IL-1b、MMP9等)的表达上调, 但应用血管生成抑制剂后中性粒细胞浸润被抑制. Huo等[57]在Kras诱导的斑马鱼肝癌发生模型中分离出TANs, 并对不同组别的TANs进行转录组学分析, 发现所有组别的VEGFA、IL-1b、MMP14、MMP9等促血管生成基因都明显上调. 在多种HCC动物模型中, TANs表现强烈的促血管生成作用, 这也和一些临床HCC样本的研究结果基本一致. Gao等[58]研究发现240例临床HCC组织中微血管密度(microvessel density, MVD)与肿瘤浸润的CD66b+中性粒细胞数呈正相关, 而CD66b+中性粒细胞与CXCR6相关. 当CXCR6在小鼠HCC模型中表达下调时, 肿瘤炎性浸润及血管生成均被抑制. MVD被认为是评估肿瘤血管生成的金标准, 这表明肿瘤中的TANs数量有可能成为衡量HCC血管生成程度的指标之一.
2.3.4 肿瘤浸润淋巴细胞: 肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TILs)主要包括T细胞(如细胞毒性T细胞、Tregs、Th1细胞、Th2细胞、Th17细胞、γδ T细胞等)、B细胞、NK细胞、NKT细胞等. 在TME中除了发挥调节免疫应答的作用, 部分TILs还能够通过各种途径介导肿瘤血管生成[59]. 有研究[60]表明IL-17A可以刺激肝癌细胞分泌血管生成的CXC趋化因子, 可能将CXCR2依赖性的ECs募集到肿瘤中. Th17细胞、γδ T细胞、NK细胞、CD8+T细胞等TILs都可以分泌IL-17A[61], 那么当这些细胞分泌IL-17A增多时, HCC可能更多选择依赖ECs的血管生成模式形成肿瘤相关血管. 而组织缺氧可以诱导基质细胞趋化, Ren等[62]研究发现HCC通过上调趋化因子(CC基序)配体28表达来募集Tregs以在缺氧条件下促进血管生成.
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 3. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 4. | Calderaro J, Ziol M, Paradis V, Zucman-Rossi J. Molecular and histological correlations in liver cancer. J Hepatol. 2019;71:616-630. [PubMed] [DOI] |
| 5. | Xu J, Liang J, Meng YM, Yan J, Yu XJ, Liu CQ, Xu L, Zhuang SM, Zheng L. Vascular CXCR4 Expression Promotes Vessel Sprouting and Sensitivity to Sorafenib Treatment in Hepatocellular Carcinoma. Clin Cancer Res. 2017;23:4482-4492. [PubMed] [DOI] |
| 6. | Kuczynski EA, Yin M, Bar-Zion A, Lee CR, Butz H, Man S, Daley F, Vermeulen PB, Yousef GM, Foster FS, Reynolds AR, Kerbel RS. Co-option of Liver Vessels and Not Sprouting Angiogenesis Drives Acquired Sorafenib Resistance in Hepatocellular Carcinoma. J Natl Cancer Inst. 2016;108:djw030. [PubMed] [DOI] |
| 9. | Wang Y, Yu H, Shan Y, Tao C, Wu F, Yu Z, Guo P, Huang J, Li J, Zhu Q, Yu F, Song Q, Shi H, Zhou M, Chen G. EphA1 activation promotes the homing of endothelial progenitor cells to hepatocellular carcinoma for tumor neovascularization through the SDF-1/CXCR4 signaling pathway. J Exp Clin Cancer Res. 2016;35:65. [PubMed] [DOI] |
| 10. | Fang JH, Zhou HC, Zhang C, Shang LR, Zhang L, Xu J, Zheng L, Yuan Y, Guo RP, Jia WH, Yun JP, Chen MS, Zhang Y, Zhuang SM. A novel vascular pattern promotes metastasis of hepatocellular carcinoma in an epithelial-mesenchymal transition-independent manner. Hepatology. 2015;62:452-465. [PubMed] [DOI] |
| 11. | Balkwill FR, Capasso M, Hagemann T. The tumor microenvironment at a glance. J Cell Sci. 2012;125:5591-5596. [PubMed] [DOI] |
| 12. | Teleanu RI, Chircov C, Grumezescu AM, Teleanu DM. Tumor Angiogenesis and Anti-Angiogenic Strategies for Cancer Treatment. J Clin Med. 2019;9:84. [PubMed] [DOI] |
| 13. | Zuazo-Gaztelu I, Casanovas O. Unraveling the Role of Angiogenesis in Cancer Ecosystems. Front Oncol. 2018;8:248. [PubMed] [DOI] |
| 14. | Zhang Y, Wang S, Dudley AC. Models and molecular mechanisms of blood vessel co-option by cancer cells. Angiogenesis. 2020;23:17-25. [PubMed] [DOI] |
| 15. | Ribatti D, Djonov V. Intussusceptive microvascular growth in tumors. Cancer Lett. 2012;316:126-131. [PubMed] [DOI] |
| 16. | Zhang X, Zhang J, Zhou H, Fan G, Li Q. Molecular Mechanisms and Anticancer Therapeutic Strategies in Vasculogenic Mimicry. J Cancer. 2019;10:6327-6340. [PubMed] [DOI] |
| 17. | Guzman G, Cotler SJ, Lin AY, Maniotis AJ, Folberg R. A pilot study of vasculogenic mimicry immunohistochemical expression in hepatocellular carcinoma. Arch Pathol Lab Med. 2007;131:1776-1781. [PubMed] [DOI] |
| 18. | Krishna Priya S, Nagare RP, Sneha VS, Sidhanth C, Bindhya S, Manasa P, Ganesan TS. Tumour angiogenesis-Origin of blood vessels. Int J Cancer. 2016;139:729-735. [PubMed] [DOI] |
| 19. | Hillen F, Griffioen AW. Tumour vascularization: sprouting angiogenesis and beyond. Cancer Metastasis Rev. 2007;26:489-502. [PubMed] [DOI] |
| 20. | Sun XT, Yuan XW, Zhu HT, Deng ZM, Yu DC, Zhou X, Ding YT. Endothelial precursor cells promote angiogenesis in hepatocellular carcinoma. World J Gastroenterol. 2012;18:4925-4933. [PubMed] [DOI] |
| 21. | Renne SL, Woo HY, Allegra S, Rudini N, Yano H, Donadon M, Viganò L, Akiba J, Lee HS, Rhee H, Park YN, Roncalli M, Di Tommaso L. Vessels Encapsulating Tumor Clusters (VETC) Is a Powerful Predictor of Aggressive Hepatocellular Carcinoma. Hepatology. 2020;71:183-195. [PubMed] [DOI] |
| 22. | De Palma M, Biziato D, Petrova TV. Microenvironmental regulation of tumour angiogenesis. Nat Rev Cancer. 2017;17:457-474. [PubMed] [DOI] |
| 23. | Casazza A, Di Conza G, Wenes M, Finisguerra V, Deschoemaeker S, Mazzone M. Tumor stroma: a complexity dictated by the hypoxic tumor microenvironment. Oncogene. 2014;33:1743-1754. [PubMed] [DOI] |
| 24. | Matsuura Y, Wada H, Eguchi H, Gotoh K, Kobayashi S, Kinoshita M, Kubo M, Hayashi K, Iwagami Y, Yamada D, Asaoka T, Noda T, Kawamoto K, Takeda Y, Tanemura M, Umeshita K, Doki Y, Mori M. Exosomal miR-155 Derived from Hepatocellular Carcinoma Cells Under Hypoxia Promotes Angiogenesis in Endothelial Cells. Dig Dis Sci. 2019;64:792-802. [PubMed] [DOI] |
| 25. | Choudhry H, Harris AL. Advances in Hypoxia-Inducible Factor Biology. Cell Metab. 2018;27:281-298. [PubMed] [DOI] |
| 26. | Semenza GL. Hypoxia-inducible factors in physiology and medicine. Cell. 2012;148:399-408. [PubMed] [DOI] |
| 27. | Wang M, Zhao X, Zhu D, Liu T, Liang X, Liu F, Zhang Y, Dong X, Sun B. HIF-1α promoted vasculogenic mimicry formation in hepatocellular carcinoma through LOXL2 up-regulation in hypoxic tumor microenvironment. J Exp Clin Cancer Res. 2017;36:60. [PubMed] [DOI] |
| 28. | Wen Y, Zhou X, Lu M, He M, Tian Y, Liu L, Wang M, Tan W, Deng Y, Yang X, Mayer MP, Zou F, Chen X. Bclaf1 promotes angiogenesis by regulating HIF-1α transcription in hepatocellular carcinoma. Oncogene. 2019;38:1845-1859. [PubMed] [DOI] |
| 29. | Zhu Z, Chen G, Li X, Yin Q, Yang Z, Yi J. Endothelial progenitor cells homing to the orthotopic implanted liver tumor of nude mice. J Huazhong Univ Sci Technolog Med Sci. 2012;32:675-679. [PubMed] [DOI] |
| 30. | Webb BA, Chimenti M, Jacobson MP, Barber DL. Dysregulated pH: a perfect storm for cancer progression. Nat Rev Cancer. 2011;11:671-677. [PubMed] [DOI] |
| 31. | Pavlova NN, Thompson CB. The Emerging Hallmarks of Cancer Metabolism. Cell Metab. 2016;23:27-47. [PubMed] [DOI] |
| 32. | Savic LJ, Schobert IT, Peters D, Walsh JJ, Laage-Gaupp FM, Hamm CA, Tritz N, Doemel LA, Lin M, Sinusas A, Schlachter T, Duncan JS, Hyder F, Coman D, Chapiro J. Molecular Imaging of Extracellular Tumor pH to Reveal Effects of Locoregional Therapy on Liver Cancer Microenvironment. Clin Cancer Res. 2020;26:428-438. [PubMed] [DOI] |
| 33. | Chao M, Wu H, Jin K, Li B, Wu J, Zhang G, Yang G, Hu X. A nonrandomized cohort and a randomized study of local control of large hepatocarcinoma by targeting intratumoral lactic acidosis. Elife. 2016;5:e15691. [PubMed] [DOI] |
| 34. | Mohan V, Das A, Sagi I. Emerging roles of ECM remodeling processes in cancer. Semin Cancer Biol. 2020;62:192-200. [PubMed] [DOI] |
| 35. | Shuai Q, Cao L, Qin Z, Zhang Y, Gu Z, Yang J. VE-cadherin fusion protein substrate enhanced the vasculogenic mimicry capability of hepatocellular carcinoma cells. J Mater Chem B. 2020;8:1699-1712. [PubMed] [DOI] |
| 36. | Ghose S, Biswas S, Datta K, Tyagi RK. Dynamic Hyaluronan drives liver endothelial cells towards angiogenesis. BMC Cancer. 2018;18:648. [PubMed] [DOI] |
| 37. | Liu T, Zhou L, Li D, Andl T, Zhang Y. Cancer-Associated Fibroblasts Build and Secure the Tumor Microenvironment. Front Cell Dev Biol. 2019;7:60. [PubMed] [DOI] |
| 38. | Zhou Y, Ren H, Dai B, Li J, Shang L, Huang J, Shi X. Hepatocellular carcinoma-derived exosomal miRNA-21 contributes to tumor progression by converting hepatocyte stellate cells to cancer-associated fibroblasts. J Exp Clin Cancer Res. 2018;37:324. [PubMed] [DOI] |
| 39. | Huang B, Huang M, Li Q. Cancer-Associated Fibroblasts Promote Angiogenesis of Hepatocellular Carcinoma by VEGF-Mediated EZH2/VASH1 Pathway. Technol Cancer Res Treat. 2019;18:1533033819879905. [PubMed] [DOI] |
| 40. | Jia CC, Wang TT, Liu W, Fu BS, Hua X, Wang GY, Li TJ, Li X, Wu XY, Tai Y, Zhou J, Chen GH, Zhang Q. Cancer-associated fibroblasts from hepatocellular carcinoma promote malignant cell proliferation by HGF secretion. PLoS One. 2013;8:e63243. [PubMed] [DOI] |
| 41. | Pasquier J, Ghiabi P, Chouchane L, Razzouk K, Rafii S, Rafii A. Angiocrine endothelium: from physiology to cancer. J Transl Med. 2020;18:52. [PubMed] [DOI] |
| 42. | Zeng Y, Yao X, Liu X, He X, Li L, Liu X, Yan Z, Wu J, Fu BM. Anti-angiogenesis triggers exosomes release from endothelial cells to promote tumor vasculogenesis. J Extracell Vesicles. 2019;8:1629865. [PubMed] [DOI] |
| 43. | Géraud C, Mogler C, Runge A, Evdokimov K, Lu S, Schledzewski K, Arnold B, Hämmerling G, Koch PS, Breuhahn K, Longerich T, Marx A, Weiss C, Damm F, Schmieder A, Schirmacher P, Augustin HG, Goerdt S. Endothelial transdifferentiation in hepatocellular carcinoma: loss of Stabilin-2 expression in peri-tumourous liver correlates with increased survival. Liver Int. 2013;33:1428-1440. [PubMed] [DOI] |
| 44. | Tsuchida T, Friedman SL. Mechanisms of hepatic stellate cell activation. Nat Rev Gastroenterol Hepatol. 2017;14:397-411. [PubMed] [DOI] |
| 45. | Lin N, Meng L, Lin J, Chen S, Zhang P, Chen Q, Lin Y. Activated hepatic stellate cells promote angiogenesis in hepatocellular carcinoma by secreting angiopoietin-1. J Cell Biochem. 2020;121:1441-1451. [PubMed] [DOI] |
| 46. | Zhao W, Zhang L, Xu Y, Zhang Z, Ren G, Tang K, Kuang P, Zhao B, Yin Z, Wang X. Hepatic stellate cells promote tumor progression by enhancement of immunosuppressive cells in an orthotopic liver tumor mouse model. Lab Invest. 2014;94:182-191. [PubMed] [DOI] |
| 47. | Li W, Miao S, Miao M, Li R, Cao X, Zhang K, Huang G, Fu B. Hedgehog Signaling Activation in Hepatic Stellate Cells Promotes Angiogenesis and Vascular Mimicry in Hepatocellular Carcinoma. Cancer Invest. 2016;34:424-430. [PubMed] [DOI] |
| 48. | Dou L, Shi X, He X, Gao Y. Macrophage Phenotype and Function in Liver Disorder. Front Immunol. 2019;10:3112. [PubMed] [DOI] |
| 49. | Miura K, Ohnishi H, Morimoto N, Minami S, Ishioka M, Watanabe S, Tsukui M, Takaoka Y, Nomoto H, Isoda N, Yamamoto H. Ezetimibe suppresses development of liver tumors by inhibiting angiogenesis in mice fed a high-fat diet. Cancer Sci. 2019;110:771-783. [PubMed] [DOI] |
| 50. | Ye YC, Zhao JL, Lu YT, Gao CC, Yang Y, Liang SQ, Lu YY, Wang L, Yue SQ, Dou KF, Qin HY, Han H. NOTCH Signaling via WNT Regulates the Proliferation of Alternative, CCR2-Independent Tumor-Associated Macrophages in Hepatocellular Carcinoma. Cancer Res. 2019;79:4160-4172. [PubMed] [DOI] |
| 51. | Vetsika EK, Koukos A, Kotsakis A. Myeloid-Derived Suppressor Cells: Major Figures that Shape the Immunosuppressive and Angiogenic Network in Cancer. Cells. 2019;8:1647. [PubMed] [DOI] |
| 52. | Nachmany I, Bogoch Y, Sivan A, Amar O, Bondar E, Zohar N, Yakubovsky O, Fainaru O, Klausner JM, Pencovich N. CD11b+Ly6G+ myeloid-derived suppressor cells promote liver regeneration in a murine model of major hepatectomy. FASEB J. 2019;33:5967-5978. [PubMed] [DOI] |
| 53. | Lin Y, Yang X, Liu W, Li B, Yin W, Shi Y, He R. Chemerin has a protective role in hepatocellular carcinoma by inhibiting the expression of IL-6 and GM-CSF and MDSC accumulation. Oncogene. 2017;36:3599-3608. [PubMed] [DOI] |
| 54. | Chiu DK, Xu IM, Lai RK, Tse AP, Wei LL, Koh HY, Li LL, Lee D, Lo RC, Wong CM, Ng IO, Wong CC. Hypoxia induces myeloid-derived suppressor cell recruitment to hepatocellular carcinoma through chemokine (C-C motif) ligand 26. Hepatology. 2016;64:797-813. [PubMed] [DOI] |
| 55. | Masucci MT, Minopoli M, Carriero MV. Tumor Associated Neutrophils. Their Role in Tumorigenesis, Metastasis, Prognosis and Therapy. Front Oncol. 2019;9:1146. [PubMed] [DOI] |
| 56. | Zhao Y, Huang X, Ding TW, Gong Z. Enhanced angiogenesis, hypoxia and neutrophil recruitment during Myc-induced liver tumorigenesis in zebrafish. Sci Rep. 2016;6:31952. [PubMed] [DOI] |
| 57. | Huo X, Li H, Li Z, Yan C, Agrawal I, Mathavan S, Liu J, Gong Z. Transcriptomic profiles of tumor-associated neutrophils reveal prominent roles in enhancing angiogenesis in liver tumorigenesis in zebrafish. Sci Rep. 2019;9:1509. [PubMed] [DOI] |
| 58. | Gao Q, Zhao YJ, Wang XY, Qiu SJ, Shi YH, Sun J, Yi Y, Shi JY, Shi GM, Ding ZB, Xiao YS, Zhao ZH, Zhou J, He XH, Fan J. CXCR6 upregulation contributes to a proinflammatory tumor microenvironment that drives metastasis and poor patient outcomes in hepatocellular carcinoma. Cancer Res. 2012;72:3546-3556. [PubMed] [DOI] |
| 59. | Sasada T, Suekane S. Variation of tumor-infiltrating lymphocytes in human cancers: controversy on clinical significance. Immunotherapy. 2011;3:1235-1251. [PubMed] [DOI] |
| 60. | Liu L, Sun H, Wu S, Tan H, Sun Y, Liu X, Si S, Xu L, Huang J, Zhou W, Yang Z, Wang Z. IL17A promotes CXCR2dependent angiogenesis in a mouse model of liver cancer. Mol Med Rep. 2019;20:1065-1074. [PubMed] [DOI] |
| 61. | Ouyang W, Kolls JK, Zheng Y. The biological functions of T helper 17 cell effector cytokines in inflammation. Immunity. 2008;28:454-467. [PubMed] [DOI] |
| 62. | Ren L, Yu Y, Wang L, Zhu Z, Lu R, Yao Z. Hypoxia-induced CCL28 promotes recruitment of regulatory T cells and tumor growth in liver cancer. Oncotarget. 2016;7:75763-75773. [PubMed] [DOI] |