修回日期: 2020-05-06
接受日期: 2020-05-28
在线出版日期: 2020-06-28
调节性B细胞(regulatory B cells, Breg)作为B淋巴细胞中一种特殊的亚群, 通过产生白介素(interleukin, IL)-10、IL-35、转化生长因子-β等细胞因子, 参与消化系统自身免疫性疾病的免疫调节的作用, 然而, Breg的表型和表面特异性抗原尚未确定, 其潜在的治疗功能需要进一步研究. 本文将就Breg在消化系统自身免疫性疾病中的作用进行综述.
核心提要: 调节性B细胞(regulatory B cells, Breg)通过产生细胞因子, 与T细胞相互作用, 参与多种消化系统自身免疫性疾病的发生发展, 明确Breg在疾病中的免疫调节作用可为临床治疗提供新的思路.
引文著录: 霍佳慧, 王小云, 龚镭, 顾馨. 调节性B淋巴细胞在消化系统自身免疫性疾病中的作用. 世界华人消化杂志 2020; 28(12): 486-492
Revised: May 6, 2020
Accepted: May 28, 2020
Published online: June 28, 2020
Recently, regulatory B cells (Breg), a subset of functional B cells, have been reported to participate in the negative regulation of immunity in autoimmune diseases by producing interleukin (IL)-10, IL-35, and transforming growth factor-β. However, a specific surface marker for Breg has not been identified and their potential therapeutic role requires further study. This review discusses the function of Breg in autoimmune diseases of the digestive system, with the purpose of highlighting their regulation of immune responses and their potential as a therapeutic target for the treatment of these diseases.
- Citation: Huo JH, Wang XY, Gong L, Gu X. Role of regulatory B cells in autoimmune diseases of the digestive system. Shijie Huaren Xiaohua Zazhi 2020; 28(12): 486-492
- URL: https://www.wjgnet.com/1009-3079/full/v28/i12/486.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i12.486
B淋巴细胞来源于造血干细胞, 在骨髓中成熟, 能够分化成浆细胞, 合成并且分泌抗体, 介导体液免疫[1-3]. B细胞能够产生细胞因子、参与抗原呈递从而参与疾病的调节[4-6]. 调节性B细胞(regulatory B cells, Breg)作为一类较为特别的B细胞亚群在许多免疫炎症反应中起到负性调节作用[7,8]. 大多研究提示, 调节性B细胞的调节作用是依靠分泌白介素(interleukin, IL) -10参与免疫调节, 所以分泌IL-10的调节性B细胞也被称为B10细胞[9]. 调节性B细胞不仅仅分泌IL-10, 它也能够分泌IL-35、腺苷酸、转化生长因子-β (Transforming growth factor-β, TGF-β)等细胞因子[10]. 然而调节性B细胞, 并不像调节性T细胞(regulatory T cells, Treg)为大家所熟知, 调节性T细胞的分型包括了天然生成的, 为抗原非特异性的自然调节性T细胞, 以及需要特定的免疫环境抗原刺激才能分化, 为抗原特异性适应性调节T细胞. Foxp3作为转录因子是调节性T细胞特异性标志性分子, 目前调节性B细胞的表型没有明显的特异性, 于是将这组具有免疫抑制作用的B细胞都归为Breg[11]. Breg在鼠和人类中有多种亚型, 比如在鼠中较为常见的有CD19+CD21hiCD23+CD24hiT2-MZPB细胞、CD19+CD21hiCD23-CD24hiMZB细胞、Tim-1+B细胞、CD5+CD1dhiB细胞、CD138+浆细胞、浆母细胞等. 人类Breg表型有CD19+CD24hiCD28hi未成熟B细胞、CD19+CD24hiCD27+B细胞等[12,13]. 到目前为止, Breg的来源被认为有两种, 一种类似于胸腺来源的Treg, 是B细胞的一个专门谱系, 有特定的基因负责其抑制免疫的性质; 另一种是B细胞在受到一定的刺激后, 表现出调控表型, 从而抑制局部炎症反应. Toll样受体(Toll-like receptor, TLR)和/或CD40的激活是诱导B细胞分化成Breg的最典型的信号[13]. 尽管Breg数量不多, 但在实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)、类风湿性关节炎(rheumatoid arthritis, RA)、系统性红斑狼疮、桥本氏甲状腺炎(Hashimoto's thyroiditis)等自身免疫性疾病中都起到了免疫调节的作用[14-17]. 在EAE中, Wolf等[7]人发现B细胞缺乏的小鼠无法从EAE中恢复. Matsumoto等[18]人发现在引流淋巴结中的CD138+浆母细胞作为Breg在EAE中主要产生IL-10, 抑制自身免疫反应. 研究发现在长期中度活动或活动性的RA患者血液样本中CD19+CD27+B细胞的数量明显低于健康对照组, 与健康对照组相比, RA中Breg抑制CD4+T细胞产生干扰素γ的能力显著降低, 提示Breg的功能缺陷与RA的发病机制有关[19-21]. Breg在以上自身免疫性疾病的发生及发展过程中均有参与, 本文将就Breg在消化系统自身免疫性疾病中的作用进行综述.
克罗恩病(Crohn's disease, CD)是一种慢性胃肠道炎症性疾病, 多见于回肠末端及结肠, 可累及全消化道, 表现为反复发作的非特异性的节段性、非对称性、透壁性炎症, 大多数患者在诊断时表现为肠道炎症, 随着时间推移, 半数的患者出现狭窄、瘘管形成、脓肿等并发症, 了解CD的发病机制对于缓解疾病进展、预防和阻止并发症的发生至关重要[22]. 目前认为遗传易感性、环境因素、肠道微生态等多因素导致的黏膜免疫应答异常和上皮屏障功能受损是CD主要发病机制[22]. 肠道黏膜上皮细胞作为黏膜免疫的第一道防线, 在CD中, 上皮细胞间紧密连接松散, 黏膜通透性增加, 肠黏膜屏障受损, 使肠腔内抗原进入固有层[23]. 潘氏细胞作为高度特化的上皮细胞, 分泌抗微生物肽、α-防御素等保护肠黏膜屏障, 潘氏细胞正常的自噬功能能维持肠道内环境的稳定, CD患者自噬基因位点突变, 导致其自噬功能受损, 诱发进一步炎症反应[24]. 当微生物进入上皮内及固有层后, 由不同的模式识别受体如TLR、NOD样受体识别, 启动信号传导途径, 与抗原接触后的树突状细胞成熟, 将抗原提呈给T细胞及B细胞, 导致一系列免疫应答. 辅助性T细胞1 (T helper 1 cell, Th1)、辅助性T细胞17 (T helper 17 cell, Th17)、Treg在CD适应性免疫中发挥重要的免疫调节功能, Th1、Th17作为效应T细胞, 分泌IL-17、IL-22、干扰素(interferons-γ, IFN-γ), 肿瘤坏死因子α (tumor necrosis factor α, TNF-α)等促炎细胞因子, Treg分泌IL-10、TGF-β、IL-35等调节免疫, 抑制炎症反应[25].
Th1、Th17、Treg的免疫失衡是CD发病机制中的重要环节, 研究表明, Breg能负向调节T细胞免疫反应, 通过产生IL-10抑制Th1和Th17细胞, 减少炎症因子的产生[26]. SAMP1/Yit小鼠作为CD的小鼠模型可自发形成回肠和盲肠肠道炎症, Olson等[27]人提出SAMP1/Yit小鼠中B细胞稳态和功能可能存在异常. Mishima等[28]进一步研究发现SAMP1/Yit小鼠的肠系膜淋巴结B细胞的产生的IL-10和TGF-β明显减少, 并且实验还表明产生IL-10以及TGF-β的B细胞的表面抗原以CD1d为主. IL-10可以通过调节Th1/Th2平衡及Th17, 以及抑制包括IL-1和TNF-α在内的促炎细胞因子的产生来抑制免疫反应, TGF-β则通过诱导效应T细胞的凋亡抑制疾病严重程度[29,30]. SAMP1/Yit小鼠的肠系膜淋巴结B细胞分别与巨噬细胞、T细胞共同培养, 与对照组相比IL-1β、IFN-γ明显增加, 该实验结果是第一次提示Breg功能缺陷参与CD的小鼠模型的发病机制.
Oka等[31]的实验检测了18位CD人、24位溃疡性结肠炎(ulcerative colitis, UC)的病人以及26名健康人外周血中IL-10及Breg的表达, 患者外周血B细胞产生的IL-10、外周血中的CD19hiCD1dhiBreg及CD24hiCD38hiBreg较健康对照组明显减少. 通过分别将SAMP1小鼠肠系膜淋巴结中的整体CD4+T细胞和去除Treg的T细胞转移到严重免疫缺陷(severe combined immunodeficiency, SCID)小鼠中, 构建两种结肠炎模型, 缺少Treg的SCID小鼠肠道炎症更为严重. 然后分别将整体B细胞和去除CD19hiCD1dhiBreg的B细胞再注入两种结肠炎小鼠中, 缺少CD19hiCD1dhiBreg的小鼠炎症指标明显高于对照组及注入整体B细胞的小鼠. 肠道炎症的加重可能依赖于CD19hiCD1dhiBreg的减少, 且无论是否存在Treg, Breg都能够缓解肠道炎症. 因此, Breg的减少和缺乏从而加重肠道炎症可能与CD的发病机制有关.
另一项自发性结肠炎的小鼠模型的研究中发现, 通过过继转移腹膜腔B10细胞, 结肠炎的病理特征减弱, 杯状细胞数量保留, 隐窝扭曲变形减轻, 显著减少外周及淋巴结中CD4+T细胞的数量, 并调节中性粒细胞浸润, 并且发现腹膜腔B10细胞是脾脏、肠道或肠系膜淋巴结中的10倍, 腹膜腔B10细胞能够下调肠道组织内T细胞的活化, 并可能抑制T细胞的募集进入肠道[32]. 将正常人外周血CD19+CD25hiBreg与CD4+T细胞在体外共同培养, 发现Breg通过细胞间接触及分泌细胞因子, 主要通过分泌TGF-β促进Treg增加, 减少Th17细胞的数量[33]. 上述实验表明Breg与CD4+T细胞的相互作用, 能够参与到Th1、Th17、Treg间的平衡, 可能与CD的发病机制有关, 但仍需进一步研究.
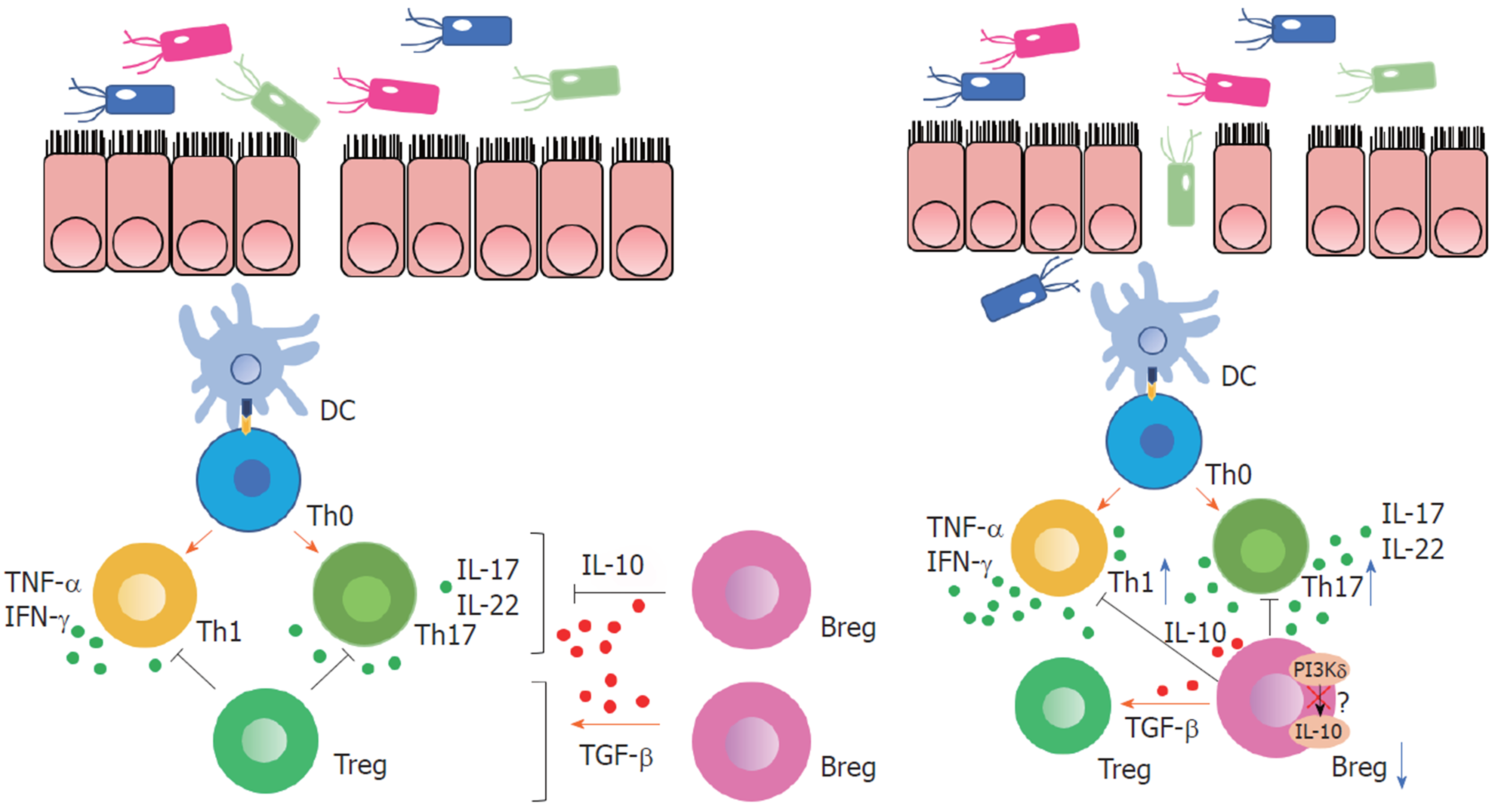
进一步研究Breg在CD功能障碍研究中的作用机制, Oka等[34]人构建磷酸肌醇-3激酶(phosphoinositide 3-kinase, PI3K) δ突变小鼠模型, 探究PI3Kδ信号在Breg参与肠道炎症免疫调节中的作用. PI3Kδ基因定位于人炎症性肠病(inflammatory bowel disease, IBD)易感位点, PI3Kδ信号的基因缺失可导致小鼠自发性结肠炎, PI3K-Akt信号通路是B细胞产生IL-10的重要途径, 来自PI3Kδ突变小鼠的B细胞或用PI3K特异性抑制剂处理的野生型B细胞在细菌刺激下分泌的IL-10明显减少, IL-12p40增加, 这些B细胞与巨噬细胞或CD4+T细胞共培养未能抑制其产生细胞因子从而抑制炎症. 在体内, 过继转移的野生型B细胞改善了T细胞介导的结肠炎, PI3Kδ突变B细胞则没有对黏膜炎症提供保护. 这些结果表明, PI3Kδ信号介导Breg免疫分化, 对产生Breg在肠道稳态和炎症中的诱导和调节功能至关重要(图1).
UC作为IBD的一种, 病变常累及直肠及结肠, 主要局限于黏膜及黏膜下层. 其发病机制与遗传、免疫、感染等因素相关, 固有免疫及适应性免疫同样也是疾病发病环节中的重要环节, CD主要由Th1介导, 而UC主要由辅助性T细胞2 (T helper 2 cell, Th2)介导, Th2主要分泌IL-4、IL-5、IL-6、IL-13等引起免疫应答[35]. 在Breg与CD4+T细胞的共同培养后, IL-4、IL-6和IL-10的显著增加, 但IL-2、IFN-γ和TNF的变化不明显, 提示Th1与Th2中, Th2分泌细胞因子增多[33]. 通过检测UC患者外周血及肠组织中的CD24hiCD38hiBreg以及CD5+ Breg较正常对照组显著下降, Mayo评分、C反应蛋白、血沉等均与Breg及IL-10呈反比, 提示Breg可能参与UC的发病机制[36].
Yanaba等[37]通过葡聚糖硫酸钠溶液(dextran sulfate sodium, DSS)诱发小鼠肠道损伤, 构建UC模型. 使用CD19-/-小鼠和野生型小鼠分别给予3% DSS 7 d, 同时记录体重和疾病活动指数来评估肠道损伤的严重程度. 相比野生型小鼠, 使用DSS诱导的CD19-/-小鼠出现了更明显的体重降低以及更高的疾病活动指数. 将野生型小鼠脾脏中的CD1d+CD5+B细胞传输后, 可以显著的发现DSS诱导肠道损伤的缓解, 然而IL-10-/-小鼠脾脏中CD1d+CD5+B细胞或者是野生型小鼠的非CD1d+CD5+B细胞都不能起到缓解肠道炎症的效果. 实验结果表明Breg产生的IL-10能够调节DSS诱导的肠道损伤. TCR基因敲除小鼠产生由Th2途径介导的肠道炎症反应, 与UC相似, 在该小鼠模型中肠道相关淋巴组织的Breg中CD1d上调, 产生IL-10, 通过下调与IL-1上调和STAT3激活相关的炎症级联反应来抑制肠道炎症的进展[38].
IL-35能够诱导产生Breg, 并且促进Breg分泌IL-35及IL-10, IL-35具有抗炎和对自身免疫性炎症疾病的保护作用[39,40]. 在UC患者中, 通过IL-35预处理的外周单个核细胞提高了Breg分泌IL-10, IL-35抑制了CD4+CD25- T细胞、CD8+ T细胞的增生, 但是不影响B细胞增生. 通过IL-35处理后的B细胞表现出明显的调节功能, 其特征是抑制细胞增殖和CD4+ T细胞及CD8+ T分泌的IFN-γ、IL-17、TNF-α. 在UC患者炎症及非炎症组织中, IL-35均明显减少, 考虑与抑制p35转录有关, 在IL-35分泌较高的组织中IL-10分泌也较多[41]. 也有实验表明Breg分泌的IL-35在UC活动期较非活动及健康对照组均有显著增加, 增加分泌IL-35的Breg的表达能够下调炎症反应[42]. 然而, 要将这些发现应用于UC的治疗策略, 还需要进一步研究.
自身免疫性肝病包括自身免疫性肝炎(autoimmune hepatitis, AIH)、原发性胆汁性胆管炎(primary biliary cholangitis, PBC)及原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)等, AIH中自身免疫损伤影响肝细胞, 导致界面性肝炎, PBC损伤小叶间胆管, 导致非化脓性胆管炎, PSC损伤肝内及肝外胆管, 导致同心圆形纤维化, 进行性闭塞, 导致多灶性胆管狭窄[43,44]. 目前认为发病机制与遗传易感性、环境因素等相关.
AIH免疫反应由抗原提呈细胞提呈自身抗原后启动, 幼稚CD4+ Th细胞被激活, 分化成Th1和Th2, Th1细胞产生IL-2和IFN-γ, 并同时激活细胞毒性CD8+ T细胞, 产生IFN-γ和TNF, 肝细胞暴露于干扰素γ导致MHC类分子上调, MHC Ⅱ类分子异常表达, 从而导致进一步的T细胞活化和肝损伤. 分化为TH2细胞导致分泌IL-4、IL-10和IL-13, 使B细胞成为分泌自身抗体的浆细胞, 通过抗体介导的细胞毒性和补体激活诱导损伤[45]. 研究显示在新发AIH患者中, CD19+ CD5+ Breg、CD19+ CD5+ CD1d+ Breg和CD19+ CD5+ CD1d+ IL-10+Breg较正常对照组均明显减少, IL-10也同样下降, 提示Breg与IL-10的减少可能与早期AIH有关[46]. 通过建立小鼠实验性自身免疫性肝炎(experimental autoimmune hepatitis, EAH)模型模拟人AIH, B细胞缺陷导致CD4+T细胞增殖和IFN-γ的增加, 增加了EAH严重性, 过继转移B细胞后通过影响TCR信号转导和下调TCR表达改善EAH, CD11b在所有B细胞中的表达和CD19+CD1dhiCD5+B细胞数量也显著增加, IL-10可能通过上调CD11b的表达而影响B细胞的调节功能[47].
PBC的胆道损伤是免疫循环失调和肝内免疫反应的结果, 促炎效应T细胞包括CD4+、CD8+T细胞等被上调并促进胆道损伤, 自然杀伤细胞(natural killer, NK)介导自身抗原释放和T细胞自身反应, Treg和滤泡调节细胞的调节作用未能充分抑制损伤反应, 最终导致进行性炎症、胆汁淤积和胆道纤维化[48]. 以dnTGF-βRⅡ鼠为PBC模型,并与缺乏B细胞小鼠杂交生成Ig-/-dnTGF-βRⅡ小鼠, Ig-/-dnTGF-βRⅡ小鼠较dnTGF-βRⅡ鼠发生了更严重的胆管炎, 并且激活CD4+T细胞和CD8+T细胞更多, 降低了肝脏CD4+T细胞中Foxp3+Treg和NK细胞, 促炎细胞因子包括TNF-α和IL-6水平升高, 并导致了比对照组更严重的结肠炎, 提示了B细胞在PBC中的抑制作用[49].
自身免疫性胰腺炎(autoimmune pancreatitis, AIP)包含有两种亚型, 其临床特征是梗阻性黄疸, 组织学特征为淋巴浆细胞浸润和纤维化[50]. 1型AIP又称IgG4相关胰腺炎, 可以同时或先后出现其他器官受累的表现, 2型AIP较为少见, 与小叶内中性粒细胞浸润和粒细胞上皮病变有关[51-53]. 既往研究报道CD24+CD25hiTreg增加与IgG4的产生有关, 而幼稚Treg的减少可能参与了1型AIP的发病机制[54]. Sumimoto等[55]人招募了21例未接受皮质类固醇治疗的1型AIP患者、14例慢性胰腺炎患者、20例胰腺癌患者和25名健康受试者作为对照, 以阐明Breg在1型AIP中的作用. 1型AIP患者外周血中CD19+CD24hiCD38hiBreg较其他组明显升高, 而CD19+CD24hiCD27+Breg有降低的趋势, 但不显著, 通过增加CD19+CD24hiCD38hiBreg可能抑制疾病活动, 从而参与1型AIP的发病机制.
本文综述了Breg在消化系统自身免疫性疾病中的研究进展, 包括IBD、自身免疫性肝病、AIP. Breg在自身免疫疾病中有抑制炎症反应、缓解疾病活动等作用, 然而具体机制尚未明确, 既往的大多数研究是基于小鼠模型或在体外进行的, 因此可能不能代表Breg在人体内的真正作用. 由于Breg数量较少、功能尚不明确, Breg作为免疫网络中的一个角色, 仍需要进一步的研究. 通过识别出Breg的特异性表面标记, 并确定其调控作用的机制, Breg在自身免疫疾病中的作用会更明确.
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Pieper K, Grimbacher B, Eibel H. B-cell biology and development. J Allergy Clin Immunol. 2013;131:959-971. [PubMed] [DOI] |
| 2. | Cooper MD. The early history of B cells. Nat Rev Immunol. 2015;15:191-197. [PubMed] [DOI] |
| 3. | LeBien TW, Tedder TF. B lymphocytes: how they develop and function. Blood. 2008;112:1570-1580. [PubMed] [DOI] |
| 4. | Heesters BA, van der Poel CE, Das A, Carroll MC. Antigen Presentation to B Cells. Trends Immunol. 2016;37:844-854. [PubMed] [DOI] |
| 5. | Bao Y, Cao X. The immune potential and immunopathology of cytokine-producing B cell subsets: a comprehensive review. J Autoimmun. 2014;55:10-23. [PubMed] [DOI] |
| 6. | Bao Y, Cao X. Epigenetic Control of B Cell Development and B-Cell-Related Immune Disorders. Clin Rev Allergy Immunol. 2016;50:301-311. [PubMed] [DOI] |
| 7. | Wolf SD, Dittel BN, Hardardottir F, Janeway CA. Experimental autoimmune encephalomyelitis induction in genetically B cell-deficient mice. J Exp Med. 1996;184:2271-2278. [PubMed] [DOI] |
| 8. | Mizoguchi A, Mizoguchi E, Smith RN, Preffer FI, Bhan AK. Suppressive role of B cells in chronic colitis of T cell receptor alpha mutant mice. J Exp Med. 1997;186:1749-1756. [PubMed] [DOI] |
| 9. | Tedder TF. B10 cells: a functionally defined regulatory B cell subset. J Immunol. 2015;194:1395-1401. [PubMed] [DOI] |
| 10. | Ray A, Wang L, Dittel BN. IL-10-independent regulatory B-cell subsets and mechanisms of action. Int Immunol. 2015;27:531-536. [PubMed] [DOI] |
| 11. | Mauri C, Bosma A. Immune regulatory function of B cells. Annu Rev Immunol. 2012;30:221-241. [PubMed] [DOI] |
| 12. | Menon M, Rosser EC, Mauri C. Identification and Isolation of Regulatory B Cells in Mouse and Human. Methods Mol Biol. 2019;1899:55-66. [PubMed] [DOI] |
| 13. | Rosser EC, Mauri C. Regulatory B cells: origin, phenotype, and function. Immunity. 2015;42:607-612. [PubMed] [DOI] |
| 14. | Matsushita T, Yanaba K, Bouaziz JD, Fujimoto M, Tedder TF. Regulatory B cells inhibit EAE initiation in mice while other B cells promote disease progression. J Clin Invest. 2008;118:3420-3430. [PubMed] [DOI] |
| 15. | Kim J, Lee HJ, Yoo IS, Kang SW, Lee JH. Regulatory B cells are inversely associated with disease activity in rheumatoid arthritis. Yonsei Med J. 2014;55:1354-1358. [PubMed] [DOI] |
| 16. | Matsushita T. Regulatory B cells in mouse models of systemic lupus erythematosus (SLE). Methods Mol Biol. 2014;1190:195-205. [PubMed] [DOI] |
| 17. | Kristensen B, Hegedüs L, Lundy SK, Brimnes MK, Smith TJ, Nielsen CH. Characterization of Regulatory B Cells in Graves' Disease and Hashimoto's Thyroiditis. PLoS One. 2015;10:e0127949. [PubMed] [DOI] |
| 18. | Matsumoto M, Baba A, Yokota T, Nishikawa H, Ohkawa Y, Kayama H, Kallies A, Nutt SL, Sakaguchi S, Takeda K, Kurosaki T, Baba Y. Interleukin-10-producing plasmablasts exert regulatory function in autoimmune inflammation. Immunity. 2014;41:1040-1051. [PubMed] [DOI] |
| 19. | Daien CI, Gailhac S, Mura T, Audo R, Combe B, Hahne M, Morel J. Regulatory B10 cells are decreased in patients with rheumatoid arthritis and are inversely correlated with disease activity. Arthritis Rheumatol. 2014;66:2037-2046. [PubMed] [DOI] |
| 20. | Ummarino D. Rheumatoid arthritis: Defective IL-10-producing Breg cells. Nat Rev Rheumatol. 2017;13:132. [PubMed] [DOI] |
| 21. | Bankó Z, Pozsgay J, Szili D, Tóth M, Gáti T, Nagy G, Rojkovich B, Sármay G. Induction and Differentiation of IL-10-Producing Regulatory B Cells from Healthy Blood Donors and Rheumatoid Arthritis Patients. J Immunol. 2017;198:1512-1520. [PubMed] [DOI] |
| 22. | Torres J, Mehandru S, Colombel JF, Peyrin-Biroulet L. Crohn's disease. Lancet. 2017;389:1741-1755. [PubMed] [DOI] |
| 23. | Söderholm JD, Olaison G, Peterson KH, Franzén LE, Lindmark T, Wirén M, Tagesson C, Sjödahl R. Augmented increase in tight junction permeability by luminal stimuli in the non-inflamed ileum of Crohn's disease. Gut. 2002;50:307-313. [PubMed] [DOI] |
| 24. | Salzman NH, Hung K, Haribhai D, Chu H, Karlsson-Sjöberg J, Amir E, Teggatz P, Barman M, Hayward M, Eastwood D, Stoel M, Zhou Y, Sodergren E, Weinstock GM, Bevins CL, Williams CB, Bos NA. Enteric defensins are essential regulators of intestinal microbial ecology. Nat Immunol. 2010;11:76-83. [PubMed] [DOI] |
| 26. | Sokolov AV, Shmidt AA, Lomakin YA. B Cell Regulation in Autoimmune Diseases. Acta Naturae. 2018;10:11-22. [PubMed] |
| 27. | Olson TS, Bamias G, Naganuma M, Rivera-Nieves J, Burcin TL, Ross W, Morris MA, Pizarro TT, Ernst PB, Cominelli F, Ley K. Expanded B cell population blocks regulatory T cells and exacerbates ileitis in a murine model of Crohn disease. J Clin Invest. 2004;114:389-398. [PubMed] [DOI] |
| 28. | Mishima Y, Ishihara S, Aziz MM, Oka A, Kusunoki R, Otani A, Tada Y, Li YY, Moriyama I, Oshima N, Yuki T, Amano Y, Matsumoto S, Kinoshita Y. Decreased production of interleukin-10 and transforming growth factor-β in Toll-like receptor-activated intestinal B cells in SAMP1/Yit mice. Immunology. 2010;131:473-487. [PubMed] [DOI] |
| 29. | Fillatreau S, Sweenie CH, McGeachy MJ, Gray D, Anderton SM. B cells regulate autoimmunity by provision of IL-10. Nat Immunol. 2002;3:944-950. [PubMed] [DOI] |
| 30. | Tian J, Zekzer D, Hanssen L, Lu Y, Olcott A, Kaufman DL. Lipopolysaccharide-activated B cells down-regulate Th1 immunity and prevent autoimmune diabetes in nonobese diabetic mice. J Immunol. 2001;167:1081-1089. [PubMed] [DOI] |
| 31. | Oka A, Ishihara S, Mishima Y, Tada Y, Kusunoki R, Fukuba N, Yuki T, Kawashima K, Matsumoto S, Kinoshita Y. Role of regulatory B cells in chronic intestinal inflammation: association with pathogenesis of Crohn's disease. Inflamm Bowel Dis. 2014;20:315-328. [PubMed] [DOI] |
| 32. | Maseda D, Candando KM, Smith SH, Kalampokis I, Weaver CT, Plevy SE, Poe JC, Tedder TF. Peritoneal cavity regulatory B cells (B10 cells) modulate IFN-γ+CD4+ T cell numbers during colitis development in mice. J Immunol. 2013;191:2780-2795. [PubMed] [DOI] |
| 33. | Hong M, Liao Y, Liang J, Chen X, Li S, Liu W, Gao C, Zhong Z, Kong D, Deng J, Zhang J, Pan G. Immunomodulation of human CD19+CD25high regulatory B cells via Th17/Foxp3 regulatory T cells and Th1/Th2 cytokines. Hum Immunol. 2019;80:863-870. [PubMed] [DOI] |
| 34. | Oka A, Mishima Y, Liu B, Herzog JW, Steinbach EC, Kobayashi T, Plevy SE, Sartor RB. Phosphoinositide 3-Kinase P110δ-Signaling Is Critical for Microbiota-Activated IL-10 Production by B Cells that Regulate Intestinal Inflammation. Cells. 2019;8:1121. [PubMed] [DOI] |
| 35. | Ungaro R, Mehandru S, Allen PB, Peyrin-Biroulet L, Colombel JF. Ulcerative colitis. Lancet. 2017;389:1756-1770. [PubMed] [DOI] |
| 36. | Wang X, Zhu Y, Zhang M, Wang H, Jiang Y, Gao P. Ulcerative Colitis Is Characterized by a Decrease in Regulatory B Cells. J Crohns Colitis. 2016;10:1212-1223. [PubMed] [DOI] |
| 37. | Yanaba K, Yoshizaki A, Asano Y, Kadono T, Tedder TF, Sato S. IL-10-producing regulatory B10 cells inhibit intestinal injury in a mouse model. Am J Pathol. 2011;178:735-743. [PubMed] [DOI] |
| 38. | Mizoguchi A, Mizoguchi E, Takedatsu H, Blumberg RS, Bhan AK. Chronic intestinal inflammatory condition generates IL-10-producing regulatory B cell subset characterized by CD1d upregulation. Immunity. 2002;16:219-230. [PubMed] [DOI] |
| 39. | Wang RX, Yu CR, Dambuza IM, Mahdi RM, Dolinska MB, Sergeev YV, Wingfield PT, Kim SH, Egwuagu CE. Interleukin-35 induces regulatory B cells that suppress autoimmune disease. Nat Med. 2014;20:633-641. [PubMed] [DOI] |
| 40. | Sakkas LI, Mavropoulos A, Perricone C, Bogdanos DP. IL-35: a new immunomodulator in autoimmune rheumatic diseases. Immunol Res. 2018;66:305-312. [PubMed] [DOI] |
| 41. | Wang S, Qin C. Interleukin 35 Rescues Regulatory B Cell Function, but the Effect Is Dysregulated in Ulcerative Colitis. DNA Cell Biol. 2017;36:413-421. [PubMed] [DOI] |
| 42. | Fonseca-Camarillo G, Furuzawa-Carballeda J, Yamamoto-Furusho JK. Interleukin 35 (IL-35) and IL-37: Intestinal and peripheral expression by T and B regulatory cells in patients with Inflammatory Bowel Disease. Cytokine. 2015;75:389-402. [PubMed] [DOI] |
| 43. | Carbone M, Neuberger JM. Autoimmune liver disease, autoimmunity and liver transplantation. J Hepatol. 2014;60:210-223. [PubMed] [DOI] |
| 44. | Dyson JK, Beuers U, Jones DEJ, Lohse AW, Hudson M. Primary sclerosing cholangitis. Lancet. 2018;391:2547-2559. [PubMed] [DOI] |
| 45. | Mieli-Vergani G, Vergani D, Czaja AJ, Manns MP, Krawitt EL, Vierling JM, Lohse AW, Montano-Loza AJ. Autoimmune hepatitis. Nat Rev Dis Primers. 2018;4:18017. [PubMed] [DOI] |
| 46. | Ma L, Qin J, Ji H, Zhao P, Jiang Y. Tfh and plasma cells are correlated with hypergammaglobulinaemia in patients with autoimmune hepatitis. Liver Int. 2014;34:405-415. [PubMed] [DOI] |
| 47. | Liu X, Jiang X, Liu R, Wang L, Qian T, Zheng Y, Deng Y, Huang E, Xu F, Wang JY, Chu Y. B cells expressing CD11b effectively inhibit CD4+ T-cell responses and ameliorate experimental autoimmune hepatitis in mice. Hepatology. 2015;62:1563-1575. [PubMed] [DOI] |
| 48. | Gulamhusein AF, Hirschfield GM. Primary biliary cholangitis: pathogenesis and therapeutic opportunities. Nat Rev Gastroenterol Hepatol. 2020;17:93-110. [PubMed] [DOI] |
| 49. | Moritoki Y, Zhang W, Tsuneyama K, Yoshida K, Wakabayashi K, Yang GX, Bowlus C, Ridgway WM, Ueno Y, Ansari AA, Coppel RL, Mackay IR, Flavell RA, Gershwin ME, Lian ZX. B cells suppress the inflammatory response in a mouse model of primary biliary cirrhosis. Gastroenterology. 2009;136:1037-1047. [PubMed] [DOI] |
| 50. | Hart PA, Zen Y, Chari ST. Recent Advances in Autoimmune Pancreatitis. Gastroenterology. 2015;149:39-51. [PubMed] [DOI] |
| 51. | Kamisawa T, Chari ST, Lerch MM, Kim MH, Gress TM, Shimosegawa T. Recent advances in autoimmune pancreatitis: type 1 and type 2. Gut. 2013;62:1373-1380. [PubMed] [DOI] |
| 52. | Notohara K, Nishimori I, Mizuno N, Okazaki K, Ito T, Kawa S, Egawa S, Kihara Y, Kanno A, Masamune A, Shimosegawa T. Clinicopathological Features of Type 2 Autoimmune Pancreatitis in Japan: Results of a Multicenter Survey. Pancreas. 2015;44:1072-1077. [PubMed] [DOI] |
| 53. | Okazaki K, Tomiyama T, Mitsuyama T, Sumimoto K, Uchida K. Diagnosis and classification of autoimmune pancreatitis. Autoimmun Rev. 2014;13:451-458. [PubMed] [DOI] |
| 54. | Miyoshi H, Uchida K, Taniguchi T, Yazumi S, Matsushita M, Takaoka M, Okazaki K. Circulating naïve and CD4+CD25high regulatory T cells in patients with autoimmune pancreatitis. Pancreas. 2008;36:133-140. [PubMed] [DOI] |
| 55. | Sumimoto K, Uchida K, Kusuda T, Mitsuyama T, Sakaguchi Y, Fukui T, Matsushita M, Takaoka M, Nishio A, Okazaki K. The role of CD19+ CD24high CD38high and CD19+ CD24high CD27+ regulatory B cells in patients with type 1 autoimmune pancreatitis. Pancreatology. 2014;14:193-200. [PubMed] [DOI] |