修回日期: 2020-05-22
接受日期: 2020-05-28
在线出版日期: 2020-06-28
自噬是一个支持营养循环和代谢适应的多步骤溶酶体降解途径, 被认为是一个调节癌症进展的过程. 本研究使用白花丹醌处理大鼠肝细胞癌(hepatocellular carcinoma, HCC)细胞, 探究其对HCC自噬活性影响, 为HCC治疗提供新的思路.
探讨白花丹醌对黄曲霉毒素B1(aflatoxin B1, AFB1)诱导型大鼠HCC细胞自噬活性的影响, 分析其发生的可能机制.
AFB1制作大鼠HCC模型并用白花丹醌干预, 透射电镜观察肝组织和自噬细胞的超微结构. RT-PCR和免疫组织化学染色技术测AKT1 mRNA和蛋白的表达. Western Blot测肝组织中LC3BⅠ、LC3BⅡ蛋白表达.
AFB1诱癌模型组和白花丹醌处理组大鼠肝组织中多见细胞自噬现象. 与对照组相比, AFB1诱癌模型组大鼠肝组织中AKT1 mRNA和蛋白表达水平明显增加(t值分别为17.013、9.986, 均P<0.001); 2 mg/kg、3 mg/kg白花丹醌处理组大鼠肝组织中AKT1 mRNA 表达明显低于AFB1诱癌模型组(前者t = -2.378、P = 0.030; 后者t = -17.980, P<0.001). 与AFB1诱癌模型组相比, 2 mg/kg白花丹醌、3 mg/kg白花丹醌处理组大鼠肝组织中LC3B-II/I比值均明显升高(前者t = 2.420, P = 0.028; 后者t = 35.136, P<0.001), 大鼠肝组织中LC3B-II/I比值在2 mg/kg白花丹醌和3 mg/kg白花丹醌处理组间的差异有统计学意义(t = 21.316, P<0.001). 3 mg/kg白花丹醌处理组大鼠肝组织中AKT1 mRNA表达与LC3B-II/I比值间存在明显相关性(r = -0.611, P = 0.035).
白花丹醌可能通过抑制ATK1表达, 增强大鼠HCC细胞自噬活性.
核心提要: 白花丹醌具抗菌、抗氧化、抗肝损伤、逆转肝纤维化以及抗肿瘤作用, 我们的研究显示白花丹醌能有效抑制AFB1诱导性大鼠肝细胞癌组织AKT 1表达, 进而推测白花丹醌可能通过抑制AFB1诱导性大鼠肝细胞癌组织AKT1表达, 诱导肝细胞癌细胞自噬活性.
引文著录: 陈懿, 李雪, 陈金霞, 林文雅, 张友才. 白花丹醌对大鼠肝细胞肝癌自噬活性的影响并机制初探. 世界华人消化杂志 2020; 28(12): 467-474
Revised: May 22, 2020
Accepted: May 28, 2020
Published online: June 28, 2020
Autophagy is a multi-step lysosomal degradation pathway supporting nutritional cycle and metabolic adaptation, which is considered to be a process of regulating cancer progression. In this study, rats with hepatocellular carcinoma (HCC) were treated with plumbagin to explore its effect on the autophagy activityin HCC, in order to provide a new idea for the treatment of this malignancy.
To investigate the effect of plumbagin on autophagy activity in aflatoxin B1 (AFB1)-induced rat hepatocellular carcinoma and to explore the possible mechanism involved.
AFB1 was used to develop a rat hepatocellular carcinoma model. The rats were then treated with plumbagin. The ultrastructure of liver tissues and autophagic cells was observed by electron microscopy. The expression of AKT1 mRNA and protein was measured by RT-PCR and immunohistochemical staining, respectively. Western blot was used to detect the expression of LC3B Ⅰ and LC3B Ⅱ protein in liver tissue.
Autophagy was common in liver tissues of the AFB1-induced cancer model group and plumbagin treated group. Compared with the control group, the expression levels of AKT1 mRNA and protein in the liver tissues of the AFB1-induced cancer model group were significantly increased (t = 17.013 and 9.986, respectively, P < 0.001).The expression of AKT1 mRNA in liver tissue of rats treated with 2 mg/kg and 3 mg/kg plumbagin was significantly lower than that of the AFB1-induced cancer model group (t = -2.378, P = 0.030; t = -17.980, P < 0.001). Compsared with the AFB1-induced cancer model group, the LC3B-II/I ratio in the liver tissue of rats treated with 2 mg/kg and 3 mg/kg plumbagin was significantly increased (t = 2.420, P = 0.028; t = 35.136, P < 0.001). The LC3B-II/I ratio in rat liver tissue was significantly different between the 2 mg/kg and 3 mg/kg plumbagin treatment groups (t = 21.316, P < 0.001). There was a significant correlation between the expression of AKT1 mRNA and the LC3B-II/I ratio in the liver tissue of rats treated with 3 mg/kg plumbagin (r = -0.611, P = 0.035).
Plumbagin may enhance the autophagy activity of rat HCC cells by inhibiting the expression of ATK1.
- Citation: Chen Y, Li X, Chen JX, Lin WY, Zhang YC. Effect of plumbagin on autophagy activity in rat hepatocellular carcinoma and underlying mechanism. Shijie Huaren Xiaohua Zazhi 2020; 28(12): 467-474
- URL: https://www.wjgnet.com/1009-3079/full/v28/i12/467.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i12.467
肝细胞癌(hepatocellular carcinoma, HCC)恶性程度高, 发展迅速, 且易于复发. 手术难以切除或失去根治机会, 对化疗药物不敏感, 经导管动脉化疗栓塞术等可能会加重癌肿组织缺血、缺氧, 改变肿瘤细胞内基因转录活性, 启动应激反应, 诱导肿瘤细胞逃逸凋亡, 是严重危害人类生命健康的重大疾病之一.
PI3K/AKT/mTOR信号通路在细胞适应生理条件和环境压力过程中, 发挥极其重要的负向调节作用, 是自噬启动阶段的关键分子之一, 同时参与肿瘤细胞迁移、黏附、细胞基质的降解[1,2]. 白花丹醌是天然的植物化学物质, 具有抗菌、抗氧化、抗肝损伤以及逆转肝纤维化的作用[3-5]. 有报道称白花丹醌可能通过PI3K/AKT信号传导途径, 影响肿瘤细胞自噬活性, 具有抗肿瘤作用[6,7]. 但其对肝细胞癌的发生和进展的影响目前仍未见报道. 本研究拟借助黄曲霉毒素B1 (aflatoxin B1, AFB1)诱导型大鼠HCC模型, 研究中药白花丹醌对大鼠早期HCC细胞自噬活性的影响, 并探讨其抗肝细胞癌机制是否与PI3K/AKT信号通路相关.
4周龄清洁级近交系雄性Wistar大鼠, 体重60-80 g, 由中国科学院上海实验动物中心提供. AFB1为美国Sigma公司产品(批号A6636), 白花丹醌购自美国Sigma公司, 二甲基亚砜(DMSO)和2-乙酰氨基芴(2-AAF)购于广州伟伯化工有限公司(编号226388、304-28-9), 2-AFF饲料为将基本饲料粉碎后, 按150 g/1000 g比例充分混合而成. 总RNA提取(TaKaRa RNAiso Plus)、cDNA合成及RT-PCR扩增试剂盒(TaKaRa RNA PCR Kit 3.0)均为大连宝生物工程有限公司产品. Akt抗体购自上海雷浩信息科技有限公司; 磷酸甘油醛脱氢酶(GAPDH)一抗购自武汉博士德生物工程有限公司; 二抗、二氨基联苯胺(DAB)购自北京中衫金桥生物技术有限公司. 兔抗LC3B抗体(北京华夏远洋科技有限公司, 产品编号: AL221). 二喹啉甲酸(BCA)购自上海润成生物科技有限公司.
1.2.1 动物模型的建立: 55只雄性Wistar大鼠按清洁级动物要求养在温州医科大学实验动物中心, 温度控制在24 ℃±1 ℃, 相对湿度45%-70%. 基本饲料安静饲养1 wk后分成对照组, AFB1诱癌模型组、2 mg/kg白花丹醌处理组和3 mg/kg白花丹醌处理组; 对照组10只, 其他每组15只. 对照组给予0.9%氯化纳溶液 2 mL/Kg腹腔注射, 其他组大鼠腹腔注射AFB1 (400 μg/kg, AFB1用15 mL DMSO溶剂混匀), 每周6次, 持续2 wk; 2-AFF饲料喂养2 wk后, 重复上述制作过程(13 wk后用基本饲料喂养), 于37周时停药[8]. 白花丹醌处理组大鼠在应用AFB1基础上, 于第6周起腹腔注射白花丹醌, 每周2次. 于实验第37周断颈处死所有大鼠. 模型制作过程中任大鼠自由饮水、进食.
1.2.2 透射电镜组织超微病理观察: 将所取新鲜肝组织切成1 mm3大小, 用2.5%戊二醛固定, PBS 漂洗后, 1%锇酸固定, 制成2 μm超薄切片, 用醋酸双氧铀、枸椽酸铅双重染色, HITACHI日本H-7500型透射电镜观察.
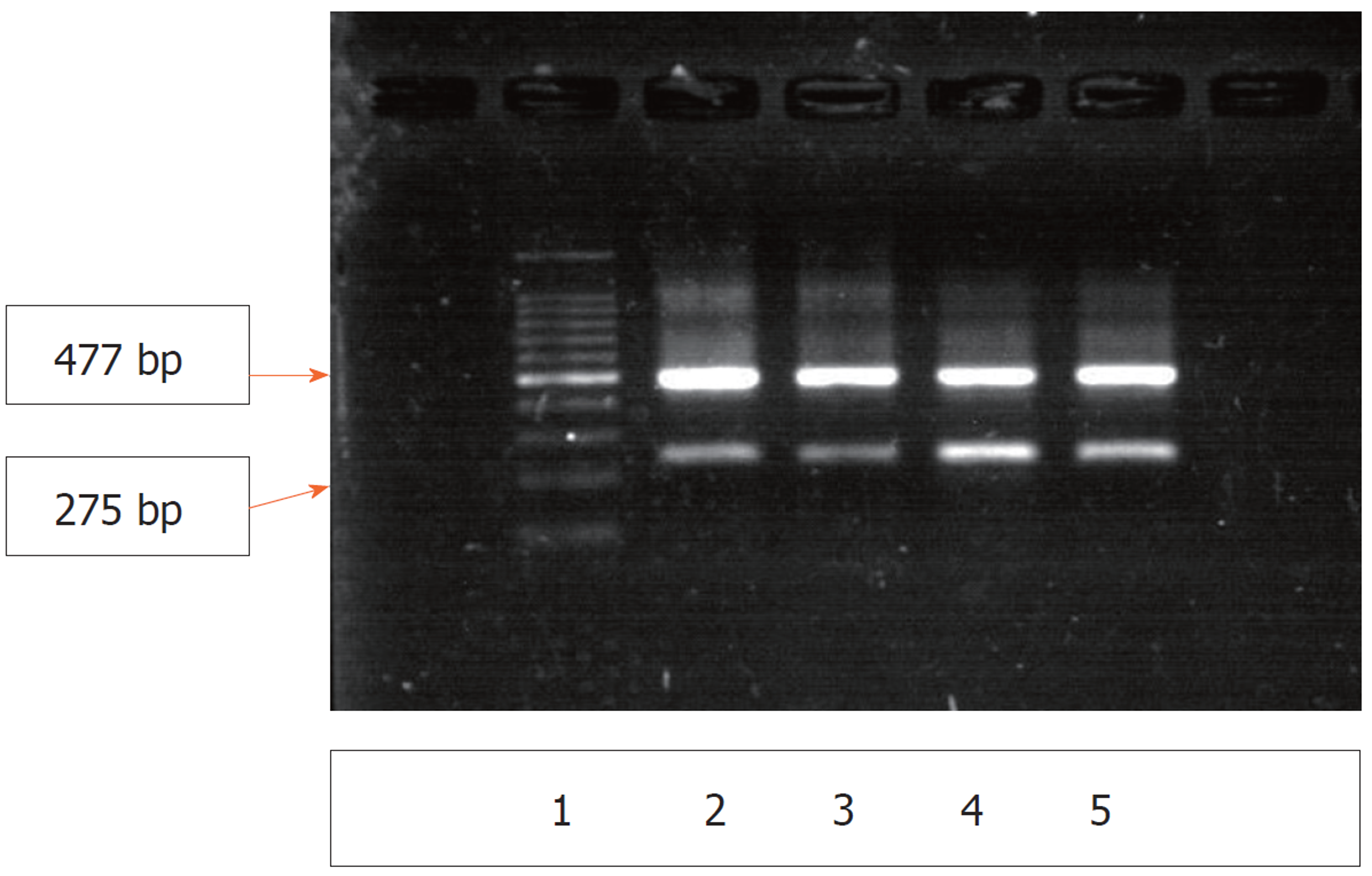
1.2.3 AKT1mRNA表达(RT-PCR): 用RNAiso Plus试剂提取总RNA, 紫外分光光度计测吸光度(A)值, 以A260/A280 = 1.8-2.0为RNA质量判断标准. 按试剂盒说明书要求合成cDNA. AKT1上游引物: 5'- CCACAGGTCGCTACTATGCC-3', 下游引物: 5'- GTCCAGGGCGGACACAATCT-3'; GAPDH上游引物5'-TTCAACGGCACAGTCAAGG-3', 下游引物5'-CACCAGTGGATGCAGGGAT-3'; 产物长度分别为275 bp、477 bp. 反应条件: 94 ℃预变性5 min后, 95 ℃ 30 s, 52 ℃ 30 s, 72 ℃ 45 s, 循环30次后, 72 ℃延伸5 min. 取PCR反应产物5 μL, 用2%琼脂糖凝胶电泳分离后, 在凝胶成像系统(Biosens Sc 810)分析结果.
1.2.4 AKT1免疫组织化学染色: 按过氧化物酶标记链霉亲和素法试剂盒说明书操作. 60 ℃烤片1 h, 二甲苯、乙醇脱蜡至水, 3%过氧化氢溶液 37 ℃温育阻断内源性过氧化物酶, 0.01%枸橼酸缓冲液高压修复, 自然冷却后滴加AKT1一抗(1:50稀释), 4 ℃温育过夜; 滴加二抗及链霉亲和素-过氧化物酶, DAB显色, 苏木精复染, 脱水、封片. 用PBS代替一抗作阴性对照.
1.2.5 Western Blot检测肝组织中LC3BⅠ、LC3BⅡ蛋白: 自噬形成时, 胞浆型LC3(即LC3-I)会酶解掉一小段多肽, 转变为(自噬体)膜型(即LC3-II), 因此, LC3-II/I比值的大小可估计自噬水平的高低. 取-80 ℃保存的肝组织, 各组大鼠肝组织均取0.1 g, 冰浴, 加500 μL组织裂解液和5 μL 磷酸酶抑制剂, 冰浴匀浆, 4 ℃, 以13800Íg离心10 min, 收集上清液置-80 ℃冰箱保存. 使用前用BCA蛋白浓度检测法检测蛋白水平, 蛋白稀释至50 ng/μL 后取15 μL上样, 进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳, 转膜至二氟化树脂膜, 5%脱脂奶粉封闭, 一抗封闭4 ℃过夜, 二抗(羊抗兔)37 ℃温育1 h, 增强化学发光法检测蛋白表达, Gel-Pro 3.1软件测定各条带的灰度值, 经内参照GAPDH校正后得到蛋白相对表达量.
统计学处理 应用SPSS 17.0软件进行统计学处理, 计量数据用mean±SD表示, 各组样本均数比较采用单因素方差分析, Levene法检验方差齐性, 方差齐时采用LSD-t检验, 方差不齐时采用Dunnett T3检验, P<0.05表示差异有统计学意义.
实验大鼠中, 对照组大鼠无死亡, AFB1诱癌模型组7只大鼠死亡, 死亡率为 46.67% (7/15), 2 mg/kg白花丹醌处理组5只大鼠死亡, 死亡率为33.33% (5/15), 3 mg/kg白花丹醌处理组3只大鼠死亡, 死亡率为 20.00% (3/15). 对照组大鼠肝组织质地柔软, 表面光滑, 边缘整齐, 肝小叶结构正常, 肝细胞索排列规则有序, 未见炎性反应、变性和坏死. 模型组和处理组大鼠, 肝表面可见微小颗粒, 或大小不一结节, 或肿块, 肝细胞核异型性明显, 病理检查证实有肝癌发生.
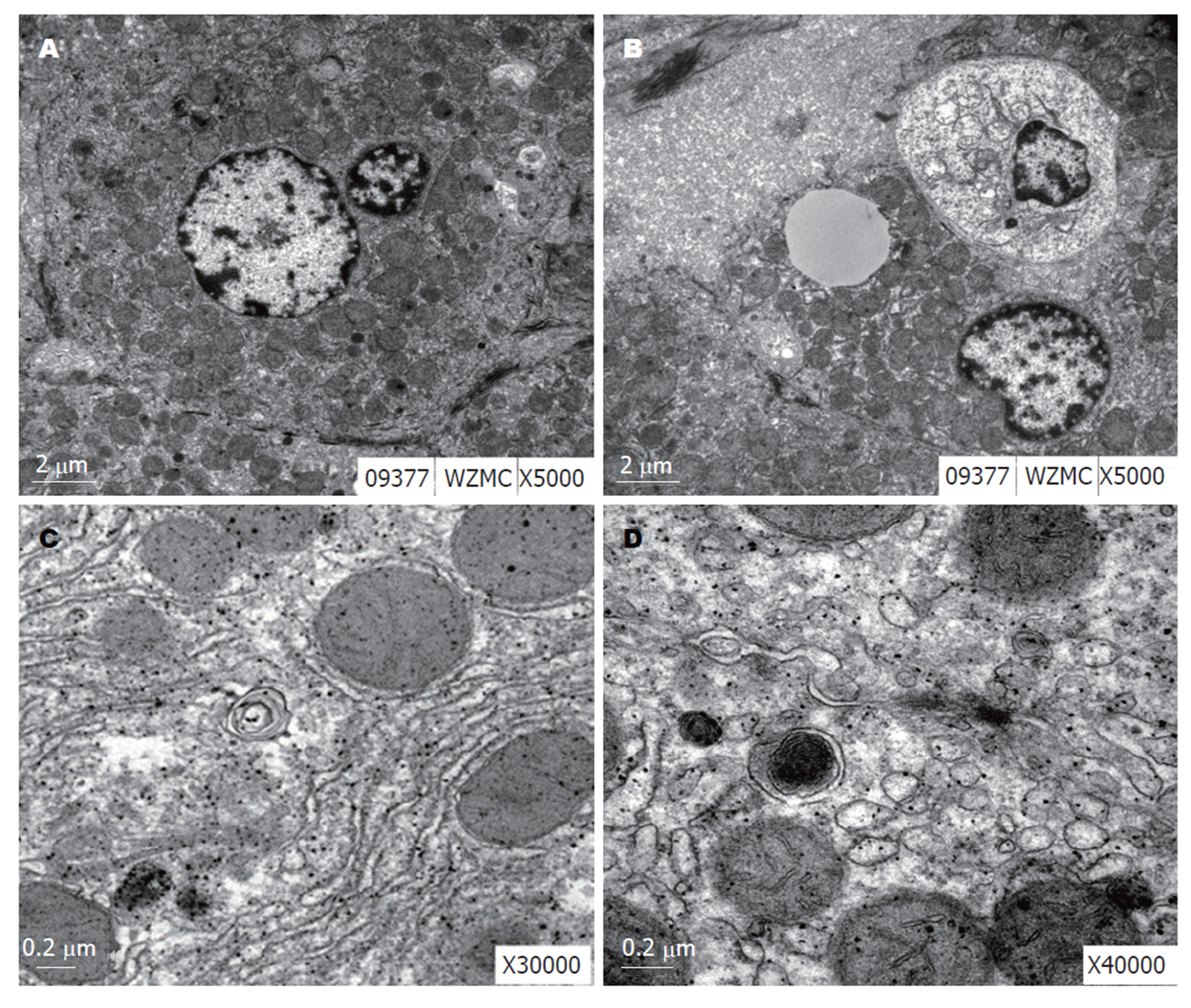
电镜下肝细胞肿胀明显, 核体积增大, 核膜固缩, 异染色质在核膜下聚集, 核仁深染(图1A). 细胞浆内线粒体数目增多、肿胀, 嵴变短、减少, 基质密度增加, 呈粗颗粒状. 粗面内质网增生, 呈囊性扩张或成泡状. 部分肝细胞内可见线管状滑面内质网增生. 糖原颗粒可见. 瘤细胞大小不一致, 胞核深染、大小不均. 核膜曲折内陷或外凸, 异染色质丰富, 呈粗颗粒状弥漫分布或凝集成块堆集在核膜下. 可见巨核、双核, 甚至多核, 胞核形态不规整, 可见怪异核, 核仁体积增大, 数目增多, 形态不规则, 靠边(图1B).
3 mg/kg白花丹醌处理组大鼠肝癌组织中多见细胞自噬现象(8例), AFB1诱癌模型2例, 2 mg/kg白花丹醌处理组4例. 电镜下细胞内大块致密物沉积 , 核固缩、浓集, 细胞器少见(图1B), 新月状或杯状, 双层或多层膜, 有包绕胞浆成分的趋势(图1C). 双层或多层膜的液泡状结构, 内含胞浆成分, 如线粒体(图1D).
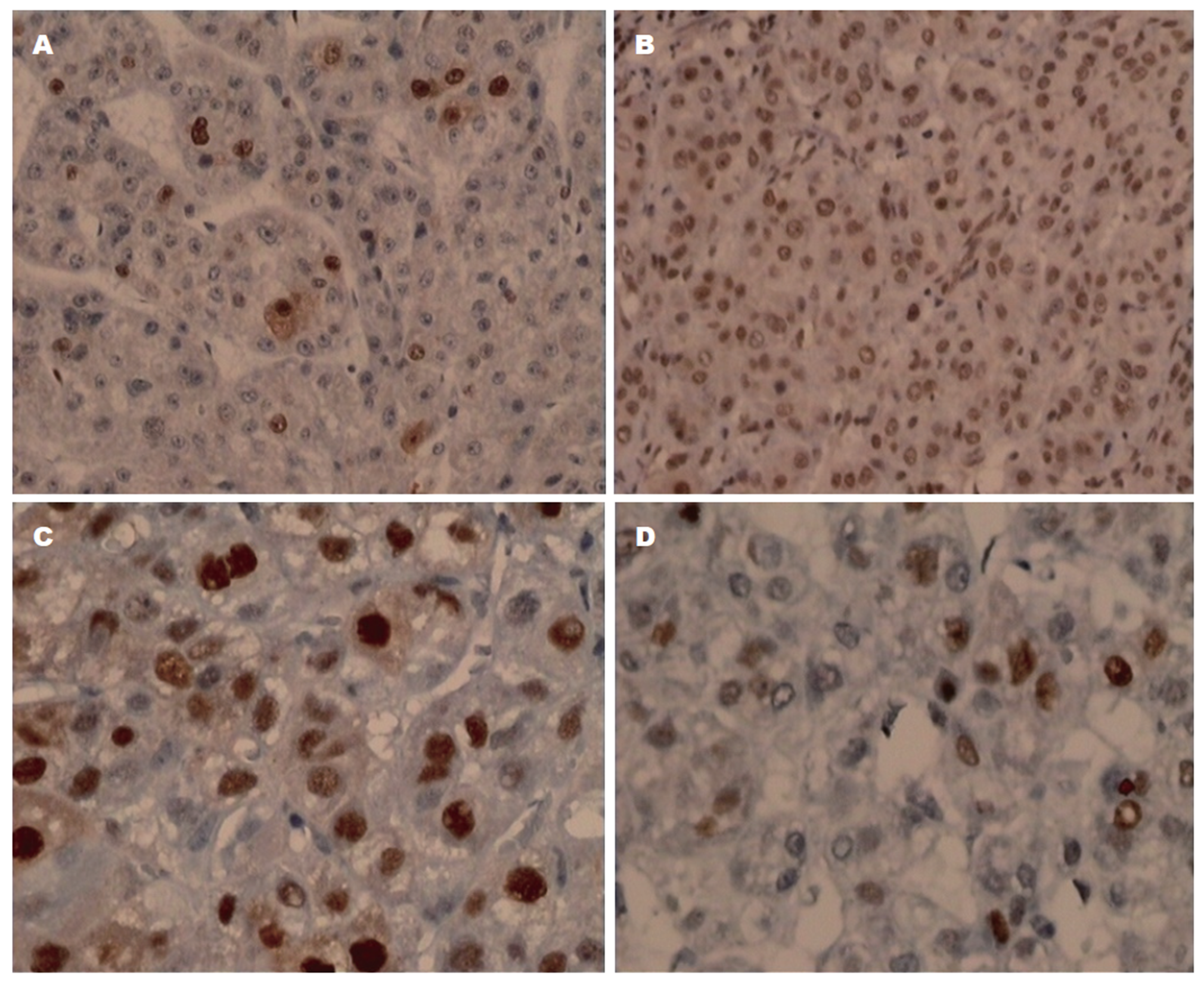
AKT1 mRNA表达(RT-PCR)结果(图2), AFB1诱癌模型组与对照组比较, 大鼠肝组织中AKT1 mRNA 和蛋白表达水平均明显增加, 差异有统计学意义(t值分别为17.013、9.986, 均P<0.001); 2 mg/kg白花丹醌处理组与AFB1诱癌模型组, 大鼠肝组织中AKT1 mRNA表达明显下降, 差异有统计学意义(t = -2.378, P = 0.030), 蛋白表达水平稍有减少, 但差异无统计学意义(t = -1.811, P = 0.089); 3 mg/kg白花丹醌处理组与AFB1诱癌模型组, 大鼠肝组织中AKT1 mRNA和蛋白表达明显下降, 差异有统计学意义(t值分别为-17.980、-4.247, 均P<0.001)(见表1). 免疫组织化学结果显示(图3), AKT1阳性为细胞核染成棕黄色, 阴性为细胞核淡蓝色. 对照组大鼠肝组织AKT1蛋白在汇管周围少量表达, 肝细胞内几乎无表达; AFB1诱癌模型组大鼠肝组织AKT1蛋白在汇管区和部分肝细胞核表达, 表达量较对照组明显增加, 经白花丹醌处理后, 肝组织AKT1蛋白表达量稍有减少, 而3 mg/kg白花丹醌处理组表达显著减少.
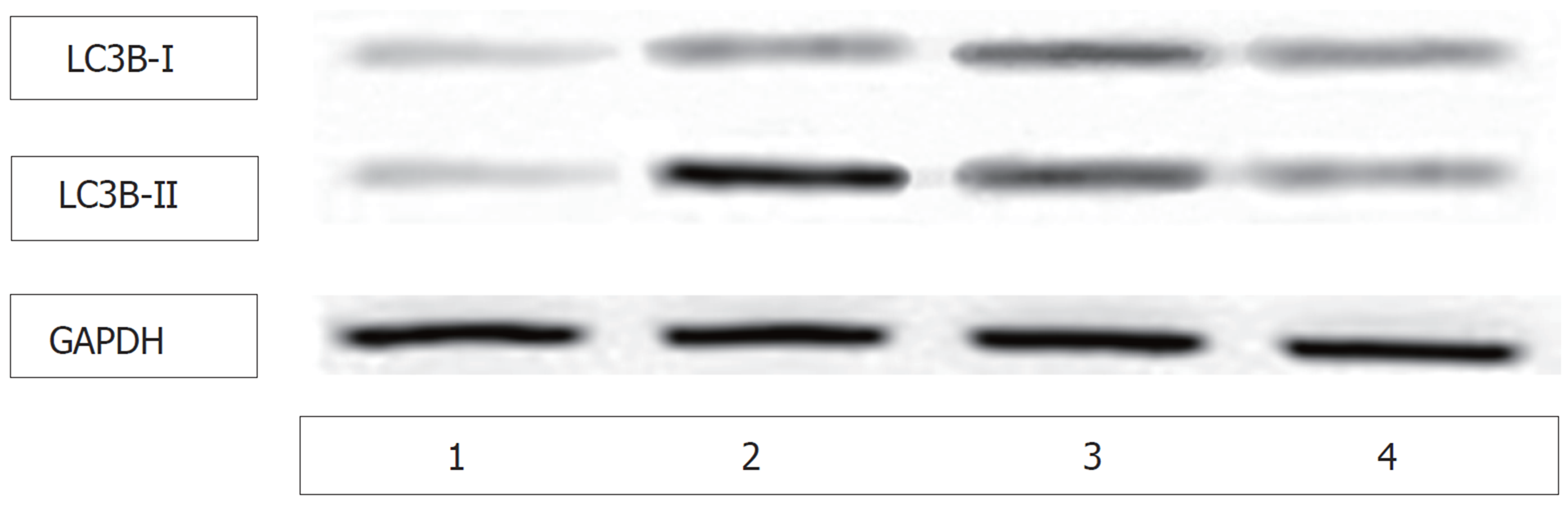
Western印迹检测肝组织中LC3BⅠ、LC3BⅡ蛋白结果(图4), 与对照组比较, AFB1诱癌模型组大鼠肝组织中LC3B-II/I比值稍有上升, 差异无显著性(t = 2.053, P = 0.057). 与AFB1诱癌模型组比较, 2 mg/kg白花丹醌和3 mg/kg白花丹醌处理组大鼠肝组织中LC3B-II/I比值均明显升高, 差异有统计学意义(t = 2.420, P = 0.028; t = 35.136, P<0.001), 大鼠肝组织中LC3B-II/I比值在2 mg/kg白花丹醌和3 mg/kg白花丹醌处理组之间的差异有统计学意义(t = 21.316, P<0.001)(表2).
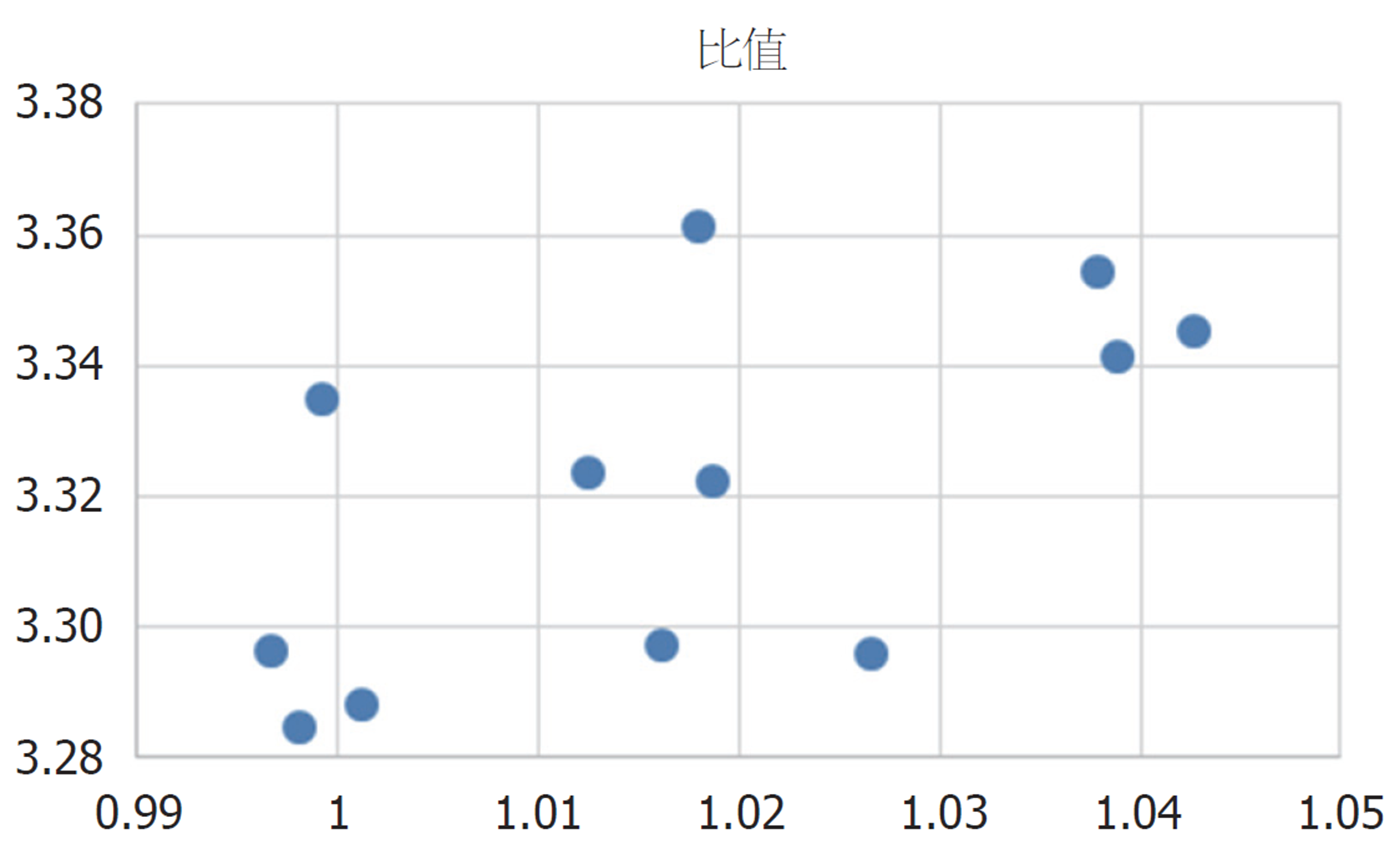
mRNA表达与LC3B-II/I比值的相关性 在3 mg/kg白花丹醌处理组大鼠肝细胞癌组织中, 其AKT1 mRNA表达与LC3B-II/I比值间存显著负相关(r = -0.611, P = 0.035), 见图5.
PI3K/AKT/mTOR信号通路在细胞适应生理条件和环境压力过程中, 发挥极其重要的负向调节作用, 是自噬启动阶段的关键分子, 参与肿瘤细胞迁移、黏附、细胞基质的降解[9]. 活化的AKT可直接磷酸化mTOR的Ser2448位点, 激活下游分子mTOR, 后者引起自噬蛋白Atg13过磷酸化, 使Atg13与Atg1相互作用的亲和力降低, 调控与细胞自噬发生相关的多种效应分子的磷酸化, 调控自噬蛋白的转录和转位过程. mTOR激酶活性受抑制时, Atg13部分脱磷酸化, 诱导自噬的发生[10]. 自噬是细胞质蛋白和细胞器降解的主要途径, 与肿瘤抑制相关, 特别是在肝脏[11].
白花丹醌, 为一种具有潜在的抗癌活性的萘醌化合物. 有研究报道, 白花丹醌的提纯物可能通过ERK和PI3K抑制剂, 快速诱导自噬活性, 显著抑制祼鼠MDA-MB-231乳腺癌细胞的生长, 具有强有力的广谱抗肿瘤活性[6]. Ma等[12]报道, 白花丹醌通过活化细胞自噬途径和线粒体介导的凋亡途径, 显著抑制AGS胃癌细胞增殖、抑制细胞浸润和迁移. Lin等[13]报道, 白花丹醌以剂量和时间依赖方式, 抑制人肝癌SMMC-7721细胞株的细胞增殖, SMMC-7721 细胞内有自噬体形成和LC3 蛋白表达, 有效抑制祼鼠移植瘤的生长, 诱导细胞凋亡、自噬. 我们的实验电镜结果显示, 白花丹醌处理组大鼠肝癌组织中多见细胞自噬现象. 与AFB1诱癌模型组比较, 2 mg/kg白花丹醌和3 mg/kg白花丹醌处理组大鼠肝组织中LC3B-II/I比值均明显升高, 以3 mg/kg白花丹醌处理组更显著. 结合电镜结果, 我们发现, 白花丹醌可显著增加AFB1诱导型大鼠肝癌细胞自噬活性.
白花丹醌具有抗肿瘤作用, 但其抗癌机制尚未阐明. Xue等[14]报道, 白花丹醌可能通过抑制AKT/mTOR 信号通路, 增加细胞内活性氧物质的含量, 提高顺铂对CAL27细胞、顺铂耐受的CAL27/CDDP细胞的细胞毒性、凋亡和自噬作用, 抑制舌鳞状细胞癌发生和进展. 我们的实验结果显示, AFB1诱癌模型组大鼠肝组织中AKT1 mRNA和蛋白表达水平均明显增加, 应用3 mg/kg白花丹醌预处理后, 大鼠肝组织中AKT1 mRNA和蛋白表达明显下降. 这些证据表明, 白花丹醌能有效抑制AFB1诱导性大鼠肝细胞癌组织中AKT1表达, 这证实了白花丹醌可能通过抑制AKT/mTOR信号通路, 发挥抗肝脏肿瘤作用.
有部分研究报道了自噬与肿瘤进展的关系, 但HCC肿瘤组织中AKT表达与自噬活性之间相关性的研究, 目前少有报道. 我们的研究结果显示, AFB1诱导型大鼠肝细胞癌组织中, AKT1 mRNA表达与LC3B-II/I比值存在显著负相关(P = 0.035). 我们推测HCC组织中自噬活性的增加, 可能抑制AKT的表达.
综上所述, 我们发现AFB1诱导HCC模型大鼠肝组织中, AKT1表达明显升高, 应用白花丹醌可显著抑制AKT1表达, 使肝肿瘤组织中自噬活性增加, 且AKT1表达与自噬活性之间存在显著负相关. 因此, 我们推测白花丹醌可能通过抑制PI3K/AKT/mTOR信号通路, 抑制AFB1诱导型大鼠肝细胞癌组织中AKT1的表达, 增加肝癌细胞自噬活性, 从而发挥抗肝脏肿瘤的作用. 然而, 白花丹醌药理活性广泛, 对组织氧环境、细胞内氧压力的改变, 也有可能改变细胞自噬活性, 除PI3K/AKT/mTOR信号通路外, 且存在多种影响细胞自噬活性的信号传导途径. 因此, 白花丹醌抗肿瘤的机制有待进一步研究.
自噬在调节肝细胞癌(hepatocellular carcinoma, HCC)的进展中起重要作用. 白花丹醌具有抗肿瘤作用, 但抗癌机制未明确. 本研究采用白花丹醌干预黄曲霉毒素B1 (aflatoxin B1, AFB1)诱导型大鼠HCC细胞, 探究其对HCC自噬活性影响及潜在机制.
白花丹醌是天然的植物化学物质, 探究其对HCC自噬活性的影响及潜在机制, 对药物的临床应用具有积极意义.
探究白花丹醌对大鼠HCC自噬活性影响, 并初步探究其潜在机制.
制作大鼠HCC模型并用白花丹醌干预, 透射电镜观察肝组织和自噬细胞的超微结构. RT-PCR和免疫组织化学染色技术测AKT1 mRNA和蛋白的表达. Western Blot测肝组织中LC3BⅠ、LC3BⅡ蛋白表达.比较各组间AKT1 mRNA和蛋白表达差异, 及LC3B-II/I比值差异.
白花丹醌可显著增加AFB1诱导型大鼠HCC细胞自噬活性. AFB1诱癌模型组大鼠肝组织中AKT1 mRNA 和蛋白表达水平均明显增加, 应用3 mg/kg白花丹醌预处理后, 大鼠肝组织中AKT1 mRNA和蛋白表达明显下降.
白花丹醌可能通过抑制PI3K/AKT/mTOR信号通路, 抑制AFB1诱导型大鼠HCC组织中AKT1的表达, 增加HCC细胞自噬活性, 从而发挥抗HCC的作用.
白花丹醌可以增加HCC自噬活性, 抑制早期HCC进展, 为药物的临床应用提供一定的理论基础.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Liu H, Gong X, Yang K. Overexpression of the clock gene Per2 suppresses oral squamous cell carcinoma progression by activating autophagy via the PI3K/AKT/mTOR pathway. J Cancer. 2020;11:3655-3666. [PubMed] [DOI] |
| 2. | Helmy MW, Ghoneim AI, Katary MA, Elmahdy RK. The synergistic anti-proliferative effect of the combination of diosmin and BEZ-235 (dactolisib) on the HCT-116 colorectal cancer cell line occurs through inhibition of the PI3K/Akt/mTOR/NF-κB axis. Mol Biol Rep. 2020;47:2217-2230. [PubMed] [DOI] |
| 3. | Zaki AM, El-Tanbouly DM, Abdelsalam RM, Zaki HF. Plumbagin ameliorates hepatic ischemia-reperfusion injury in rats: Role of high mobility group box 1 in inflammation, oxidative stress and apoptosis. Biomed Pharmacother. 2018;106:785-793. [PubMed] [DOI] |
| 4. | Giménez-Garzó C, Urios A, Agustí A, Mangas-Losada A, García-García R, Escudero-García D, Kosenko E, Ordoño JF, Tosca J, Giner-Durán R, Serra MA, Felipo V, Montoliu C. Cirrhotic patients withminimal hepatic encephalopathy have increased capacity to eliminate superoxide and peroxynitrite in lymphocytes, associated with cognitive impairment. Free Radic Res. 2018;52:118-133. [PubMed] [DOI] |
| 5. | 陈 小维, 张 伟伟, 陈 金霞, 张 友才, 陈 永平, 李 骥. 白花丹醌对肝纤维化大鼠磷脂酰肌醇3-激酶/蛋白激酶B信号转导通路的影响. 中华传染病杂志. 2013;31:519-523. [DOI] |
| 6. | Tripathi SK, Rengasamy KRR, Biswal BK. Plumbagin engenders apoptosis in lung cancer cells via caspase-9 activation and targeting mitochondrial-mediated ROS induction. Arch Pharm Res. 2020;43:242-256. [PubMed] [DOI] |
| 7. | Ghosh SK, Ganta A, Spanjaard RA. Discovery and cellular stress pathway analysis of 1,4-naphthoquinone derivatives with novel, highly potent broad-spectrum anticancer activity. J Biomed Sci. 2018;25:12. [PubMed] [DOI] |
| 9. | Zhang M, Liu S, Chua MS, Li H, Luo D, Wang S, Zhang S, Sun C, Han B. Correction: SOCS5 inhibition induces autophagy to impair metastasis in hepatocellular carcinoma cells via the PI3K/Akt/mTOR pathway. Cell Death Dis. 2019;10:799. [PubMed] [DOI] |
| 10. | Li F, Vierstra RD. Arabidopsis ATG11, a scaffold that links the ATG1-ATG13 kinase complex to general autophagy and selective mitophagy. Autophagy. 2014;10:1466-1467. [PubMed] [DOI] |
| 11. | Takamura A, Komatsu M, Hara T, Sakamoto A, Kishi C, Waguri S, Eishi Y, Hino O, Tanaka K, Mizushima N. Autophagy-deficient mice develop multiple liver tumors. Genes Dev. 2011;25:795-800. [PubMed] [DOI] |
| 12. | Ma X, Yin X, Liu H, Chen Q, Feng Y, Ma X, Liu W. Antiproliferative activity of plumbagin (5-hydroxy-2-methyl-1,4-naphthoquinone) in human gastric carcinoma cells is facilitated via activation of autophagic pathway, mitochondrial-mediated programmed cell death and inhibition of cell migration and invasion. J BUON. 2019;24:2000-2005. [PubMed] |
| 13. | Lin Y, Chen Y, Wang S, Ma J, Peng Y, Yuan X, Lv B, Chen W, Wei Y. Plumbagin induces autophagy and apoptosis of SMMC-7721 cells in vitro and in vivo. J Cell Biochem. 2019;120:9820-9830. [PubMed] [DOI] |
| 14. | Xue D, Pan ST, Zhou X, Ye F, Zhou Q, Shi F, He F, Yu H, Qiu J. Plumbagin Enhances the Anticancer Efficacy of Cisplatin by Increasing Intracellular ROS in Human Tongue Squamous Cell Carcinoma. Oxid Med Cell Longev. 2020;2020:5649174. [PubMed] [DOI] |