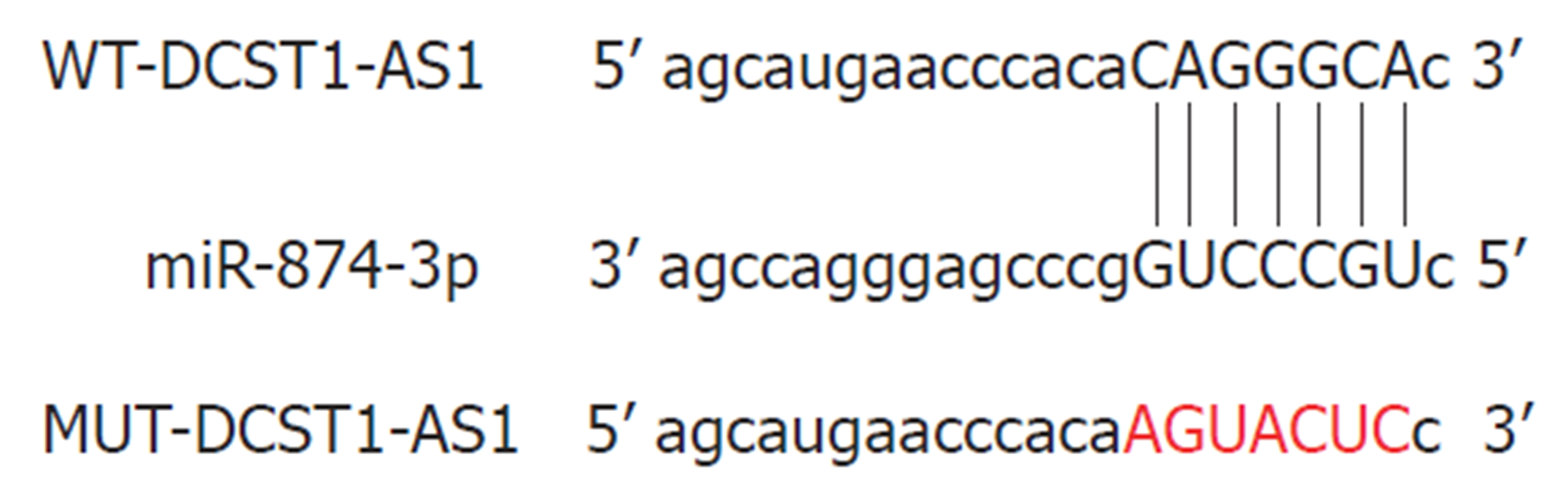修回日期: 2020-05-07
接受日期: 2020-05-14
在线出版日期: 2020-06-08
长链非编码RNA(long non-coding RNA, lncRNA)在直肠癌(rectal cancer, RC)中异常表达并可能参与肿瘤发生及发展过程, lncRNA DCST1-AS1在肿瘤中表达上调, 但其在RC发生及发展过程中的作用机制尚未阐明, 假设lncRNA DCST1-AS1在RC细胞中表达水平升高, 并可能促进肿瘤发生及发展.
研究lncRNA DCST1-AS1对RC细胞增殖、凋亡的影响和潜在的分子机制.
实时荧光定量聚合酶链式反应检测30例RC组织和癌旁组织中lncRNA DCST1-AS1和miR-874-3p RNA的水平, 对RC SW1463细胞进行转染, 分为si-NC组、si-DCST1-AS1组、miR-NC组、miR-874-3p组、pcDNA组、pcDNA-DCST1-AS1组、si-DCST1-AS1+anti-miR-NC组和si-DCST1-AS1+anti-miR-874-3p组, MTT实验和流式细胞术分别检测各组SW1463细胞增殖光密度(optical density, OD)值和凋亡率, Western blot检测细胞中细胞周期蛋白1(CyclinD1)、p21、B淋巴细胞瘤-2 (B-cell lymphoma-2, Bcl-2)和Bcl-2相关蛋白(Bcl-2-associated X protein, Bax)表达, 双荧光素酶报告系统验证lncRNA DCST1-AS1和miR-874-3p的关系.
与癌旁组织组相比, 在RC组织组中lncRNA DCST1-AS1的含量显著升高(P<0.05), miR-874-3p含量显著降低(P<0.05); 与对照si-NC和miR-NC组比较, si-DCST1-AS1组和miR-874-3p组RC SW1463细胞的OD值、CyclinD1和Bcl-2蛋白含量均降低, 细胞凋亡率、p21和Bax蛋白含量均升高; lncRNA DCST1-AS1靶向负调控miR-874-3p的表达; 与si-DCST1-AS1+anti-miR-NC组比较, si-DCST1-AS1+anti-miR-874-3p组SW1463细胞OD值、CyclinD1和Bcl-2蛋白含量升高, 细胞凋亡率、p21和Bax含量降低.
lncRNA DCST1-AS1通过靶向miR-874-3p调控RC SW1463细胞增殖和凋亡, lncRNA DCST1-AS1可能是RC潜在的分子靶点.
核心提要: 长链非编码RNA DCST1-AS1在直肠癌组织及细胞中表达上调, 并可促进细胞增殖及抑制细胞凋亡, 其作用机制可能是通过靶向调控miR-874-3p的表达而发挥作用.
引文著录: 颜王鑫, 戚晓哲, 孙跃胜, 林继徐, 周慧珍, 陈亮. lncRNA DCST1-AS1靶向miR-874-3p对直肠癌细胞增殖和凋亡的影响. 世界华人消化杂志 2020; 28(11): 401-409
Revised: May 7, 2020
Accepted: May 14, 2020
Published online: June 8, 2020
Some long non-coding RNAs (lncRNAs) have been demonstrated to be abnormally expressed in rectal cancer (RC) and may be involved in tumorigenesis and development. The expression of lncRNA DCST1-AS1 is upregulated in tumors, but its mechanism of action in the development and progression of RC has not been elucidated. It was hypothesized that the expression level of DCST1-AS1 is increased in RC cells and it may promote tumorigenesis and development.
To investigate the effects of DCST1-AS1 on the proliferation and apoptosis of RC cells and the potential mechanism.
The levels of DCST1-AS1 and miR-874-3p in 30 RC tissues and adjacent tissues were measured by quantitative real-time polymerase chain reaction. RC SW1463 cells were divided into different groups and transfected with si-NC, si-DCST1-AS1, miR-NC, miR-874-3p, pcDNA, pcDNA-DCST1-AS1, si-DCST1-AS1 + anti-miR-NC, and si-DCST1-AS1 + anti-miR-874-3p, respectively. The proliferation and apoptosis of SW1463 cells in each group were measured by MTT assay and flow cytometry, respectively. Western blot analysis was carried out to measure the expression levels of CyclinD1, p21, B-cell lymphoma-2 (Bcl-2), and Bcl-2-associated X protein (Bax) proteins in SW1463 cells. The targeting relationship between DCST1-AS1 and miR-874-3p was validated using a dual-luciferase reporter assay system.
Compared with tumor adjacent tissues, the level of lncRNA DCST1-AS1 in RC tissues was remarkably increased (P < 0.05), while the level of miR-874-3p was significantly decreased (P < 0.05). Compared with the si-NC and miR-NC groups, cell proliferation and CyclinD1 and Bcl-2 protein levels were reduced in the si-DCST1-AS1 group and miR-874-3p group, while the apoptosis rate and levels of p21 and Bax were increased. LncRNA DCST1-AS1 targeted and negatively regulated the expression of miR-874-3p. Compared with the si-DCST1-AS1 + anti-miR-NC group, cell proliferation and CyclinD1 and Bcl-2 protein levels in the si-DCST1-AS1 + anti-miR-874-3p group were increased, while cell apoptosis rate and p21 and Bax protein levels were decreased.
LncRNA DCST1-AS1 regulates the proliferation and apoptosis of SW1463 cells by targeting miR-874-3p. DCST1-AS1 may be a potential molecular target for RC.
- Citation: Yan WX, Qi XZ, Sun YS, Lin JX, Zhou HZ, Chen L. LncRNA DCST1-AS1 regulates proliferation and apoptosis of rectal cancer cells by targeting miR-874-3p. Shijie Huaren Xiaohua Zazhi 2020; 28(11): 401-409
- URL: https://www.wjgnet.com/1009-3079/full/v28/i11/401.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i11.401
直肠癌(rectal cancer, RC)是世界上常见的消化道恶性肿瘤, 且50岁以下人群发病率呈上升趋势, 且晚期患者居多[1,2]. 随着分子生物学的进步与发展, 分子靶向治疗可能成为治疗RC的重要手段, 因而探究新的诊断和治疗靶点, 有助于提高治疗效果及改善患者预后. 多种长链非编码RNA (long non-coding RNA, lncRNA)和miRNA在RC中表达失调, 并可能作为RC诊断及治疗的潜在靶点[3]. 研究表明, lncRNA DCST1-AS1在肝癌和三阴性乳腺癌组织和细胞中表达上调, 其表达水平与癌细胞的增殖和转移密切相关[4,5]. 经StarBase预测发现, miR-874-3p与lncRNA DCST1-AS1存在结合位点. miR-874-3p在食管鳞状细胞癌、上皮性卵巢癌组织及结RC组织中低表达, 与癌细胞增殖、转移或凋亡有关[6-8]. 但lncRNA DCST1-AS1和miR-874-3p在RC组织和细胞中的表达、作用及两者的关系, 目前还尚未可知. 本课题研究lncRNA DCST1-AS1和miR-874-3p在RC组织中的表达, 及两者对RC SW1463细胞增殖、凋亡的影响和分子机制, 以期为RC的靶向治疗提供新靶点.
选取2017-06/2018-12本院病理检查确诊为RC的患者手术切除的RC组织及癌旁组织(距离RC组织边缘>5 cm)各30例, 将组织标本置于液氮中保存, 术后转移至-80 ℃超低温冰箱内保存. 男19例, 女11例, 年龄19-74岁(49.93岁±18.59岁), 参照AJCC第八版RC pTNM分期系统进行分期: Ⅰ期4例, Ⅱ期12例, Ⅲ期9例, Ⅳ期5例. 所有患者术前未接受放疗和化疗. 人RC细胞株SW1463购自美国ATCC; DMEM培养基和胎牛血清(fetal bovine serum, FBS)购自美国Gibco公司; 四氮唑蓝(thiazolyl blue tetrazolium bromide, MTT)、二甲基亚矾(dimethyl sulfoxide, DMSO)和胰蛋白酶购自美国Sigma-Aldrich公司; 凋亡检测试剂盒购自上海碧云天生物技术有限公司; TRIzol试剂、实时定量聚合酶链式反应(real-time polymerase chain reaction, Real-time PCR)试剂盒、反转录试剂盒购自宝生物工程(大连)有限公司; lncRNA DCST1-AS1抑制物(si-DCST1-AS1)、lncRNA DCST1-AS1过表达载体pcDNA-DCST1-AS1、miR-874-3p mimics (miR-874-3p)、miR-874-3p干扰剂(anti-miR-874-3p)、阴性对照(si-NC、miR-NC、anti-miR-NC、pcDNA)和引物购自上海吉玛制药有限公司; 双荧光素酶报告系统购自美国Promega公司; Lipofectamine 2000转染试剂购自美国Invitrogen公司; 流式细胞仪购自美国BD公司; Real-time PCR仪购自美国Bio-Rad公司.
1.2.1 细胞培养和转染: 将RC SW1463细胞接种于DMEM培养液(含10%FBS+100 U/mL青霉素+100 μg/mL链霉素)中, 置于37 ℃ 5% CO2培养箱中常规培养, 消化传代. 将对数生长期的SW1463细胞以2×l05个细胞/孔接种于6孔板中, 细胞融合度达到80%时根据转染试剂盒说明书进行转染. 根据转染载体分组为si-NC组、si-DCST1-AS1组、miR-NC组、miR-874-3p组、pcDNA组、pcDNA-DCST1-AS1组、si-DCST1-AS1+anti-miR-NC组和si-DCST1-AS1+anti-miR-874-3p组. 转染48 h后收集细胞验证后进行后续实验.
1.2.2 Real-time PCR检测lncRNA DCST1-AS1和miR-874-3p的表达: 用TRIzol试剂提取RC组织、癌旁组织或细胞总RNA, 保存于-80℃. 然后按照反转录PCR试剂盒说明书合成cDNA, 以cDNA为模板进行Real-time PCR检测miR-874-3p和lncRNA DCST1-AS1, 反应程序: 95 ℃ 2 min; 然后95 ℃ 15 s, 55 ℃ 1 min, 共40个循环. 引 物 如 下: miR-874-3p 上 游: 5'-GAACTCCACTGTAGCAGAGATGGT-3', 下游: 5'- CATTTTTTCCACTCCTCTTCTCTC-3'; lncRNA DCST1-AS1上游: 5'-TTCGTCTGGTCCCAATGTGTGG-3', 下游: 5'-AAGCAGGACGAGTAAACCAACC-3'. 用2−△△Ct方法进行数据分析.
1.2.3 MTT实验测定细胞增殖: 将SW1463细胞以1×103个细胞/孔(100 μL细胞/孔)接种于96微孔板中, 分别在培养至24 h、48 h、72 h时进行MTT实验, 每孔分别加入 20 μL MTT溶液, 培养4 h, 弃培养上清, 每孔再加入150 μL DMSO, 室温震荡混匀15 min, 酶标仪测定490 nm吸光度值.
1.2.4 流式细胞术检测细胞凋亡率: 将转染后各组SW1463细胞接种于6孔板中, 培养至对数生长期, 收集细胞后用PBS缓冲液洗涤2次, 胰酶消化, 根据凋亡试剂盒说明书操作, 上流式细胞仪检测分析细胞凋亡率.
1.2.5 Western blot检测细胞中细胞周期蛋白1(CyclinD1)、p21、B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)和Bcl-2相关蛋白(Bcl-2-associated X protein, Bax)蛋白: 收集转染后各组SW1463细胞, 提取细胞总蛋白, 将蛋白样本进行SDS-PAGE, 转PVDF膜, 室温封闭2 h, 加入稀释后的一抗, 37 ℃过夜孵育, 洗膜后加入稀释的酶标二抗, 显影, 拍照, 以GAPDH为内参照, 分析蛋白表达水平.
1.2.6 双荧光素酶报告系统实验: 根据方法1.2.1进行转染, 将构建的lncRNA DCST1-AS1的野生型(WT-DCST1-AS1)和突变型(MUT-DCST1-AS1)双荧光素酶报告载体, 分别与miR-NC或miR-874-3p共转染SW1463细胞, 转染48 h, 收集、裂解细胞并离心收集上清, 根据试剂盒说明书进行操作, 以海肾荧光素酶活性为内参照, 检测并计算相对萤火虫荧光素酶活性.
统计学处理 数据均以mean±SD表示, 数据用SPSS 19.0软件进行分析, P<0.05为差异有统计学意义. 两组间采用独立样本t检验, 多实验组间比较采用单因素方差进行分析.
与癌旁组织组相比, 在RC组织组中lncRNA DCST1-AS1含量显著升高(P<0.05), 而miR-874-3p含量显著降低(P<0.05)(表1).
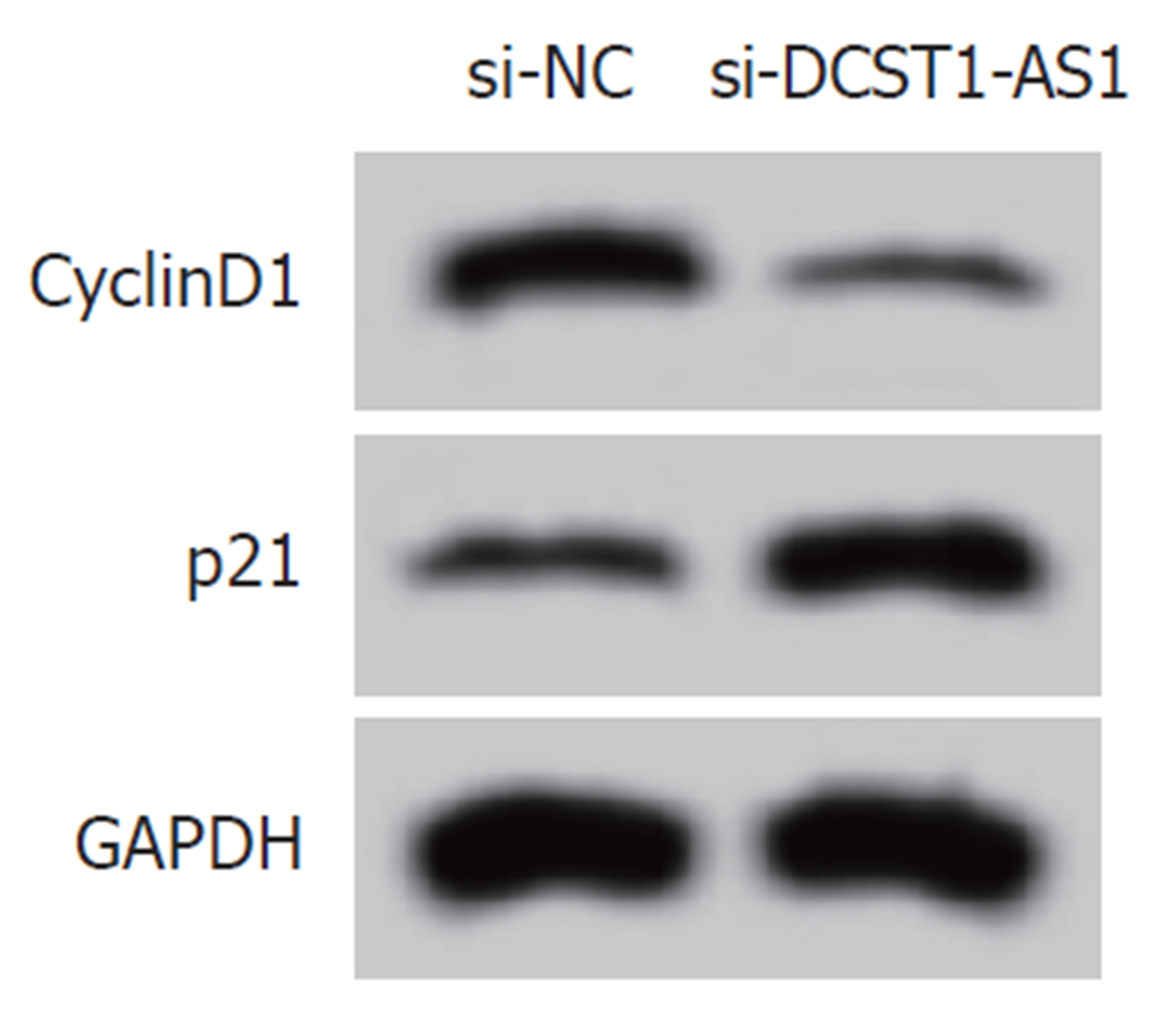
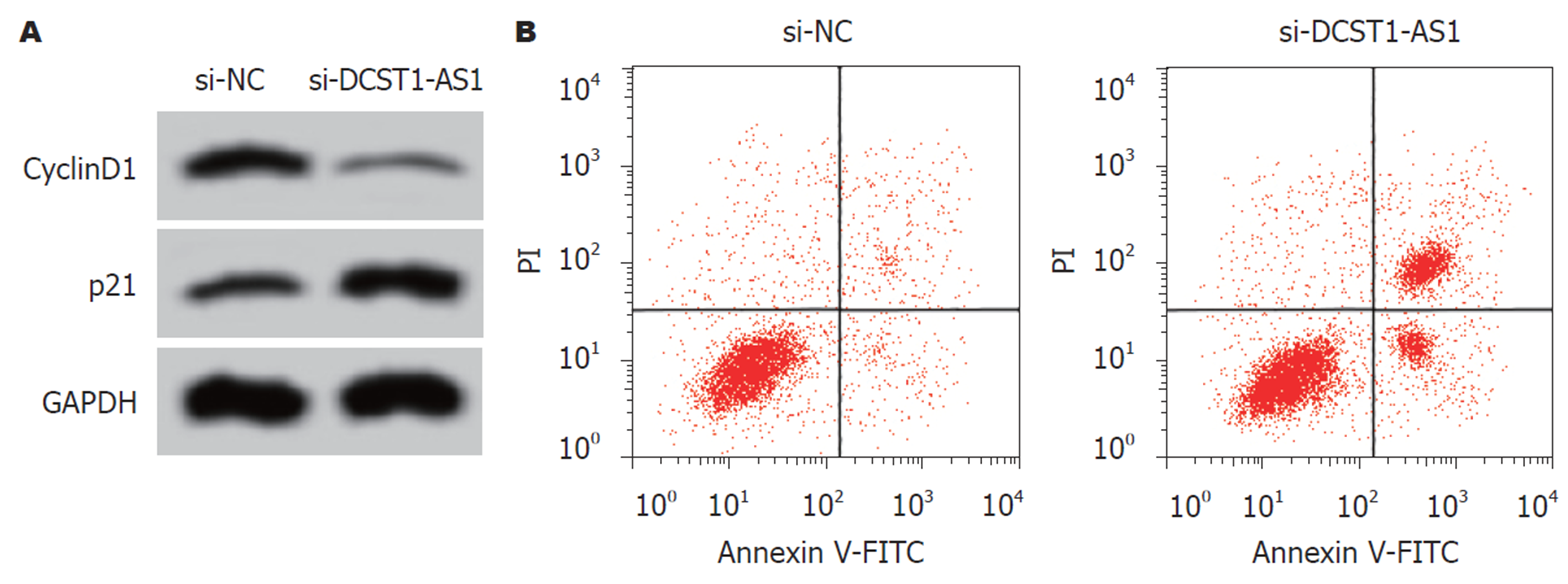
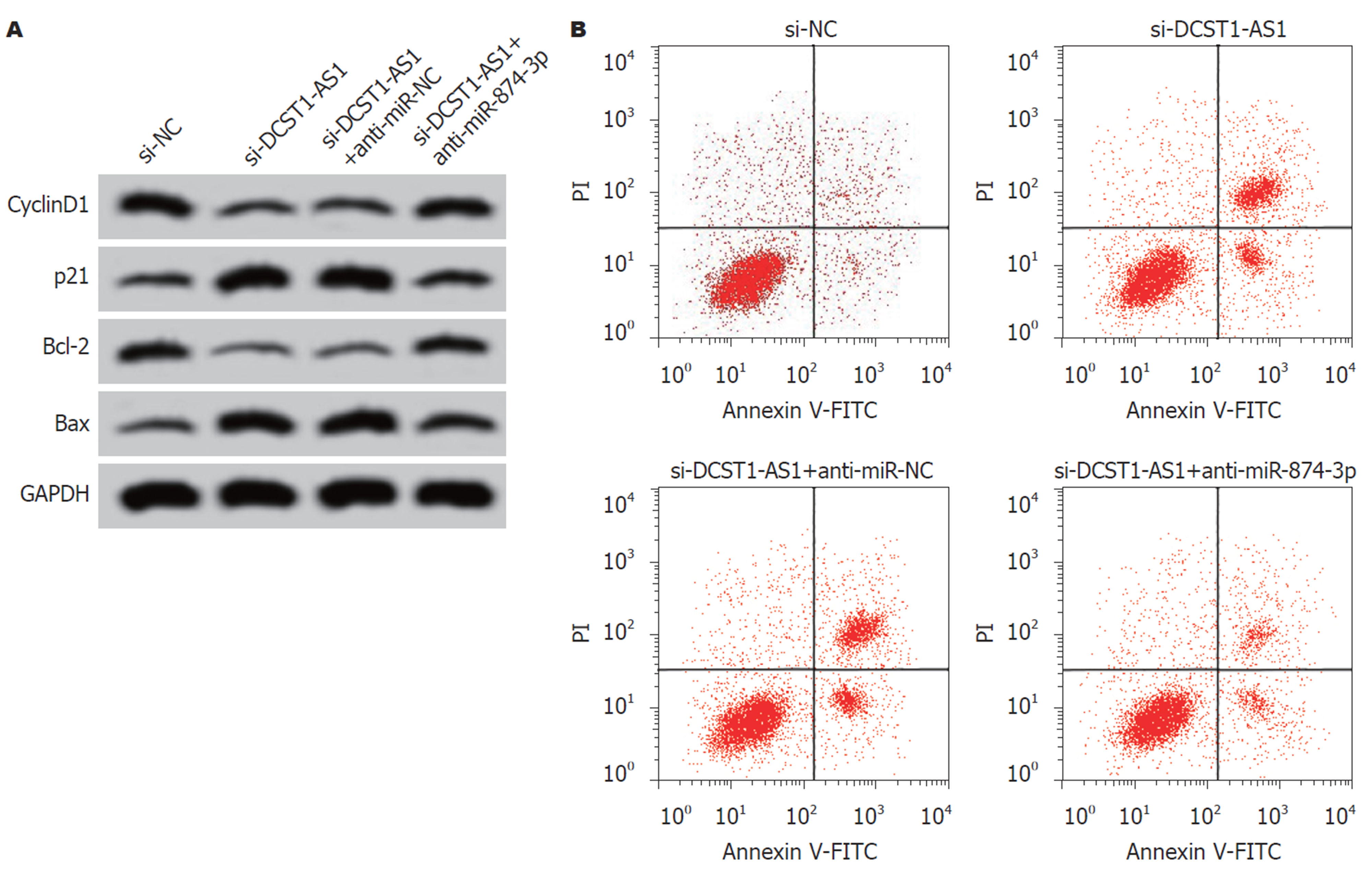
实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qRT-PCR)、Western blot和MTT实验结果表明, 与si-NC组相比, si-DCST1-AS1组SW1463细胞中的lncRNA DCST1-AS1含量降低, 细胞活性[光密度(optical density, OD) = 490 nm]在24 h、48 h、72 h均显著下降, CyclinD1含量降低, p21蛋白含量升高, 均具有统计学意义(P<0.05)(图1和表2). 说明抑制lncRNA DCST1-AS1表达可以抑制RC SW1463细胞增殖.
转染si-DCST1-AS1后, 与对照si-NC组相比, si-DCST1-AS1组的SW1463细胞凋亡率显著增加, Bcl-2含量降低, Bax含量升高, 差异具有统计学意义(P<0.05)(图2和表3).
通过StarBase预测发现, miR-874-3p与lncRNA DCST1-AS1的序列中含互补的位点(图3). 双荧光素酶报告系统结果显示, 与对照miR-NC组相比, miR-874-3p组野生型WT-DCST1-AS1的萤火虫荧光素酶相对活性显著下降(P<0.05), 而突变型MUT-DCST1-AS1的萤火虫荧光素酶相对活性无变化(表4). qRT-PCR结果表明, 上调lncRNA DCST1-AS1可下调miR-874-3p含量, 下调lncRNA DCST1-AS1可显著上调miR-874-3p含量(表5).
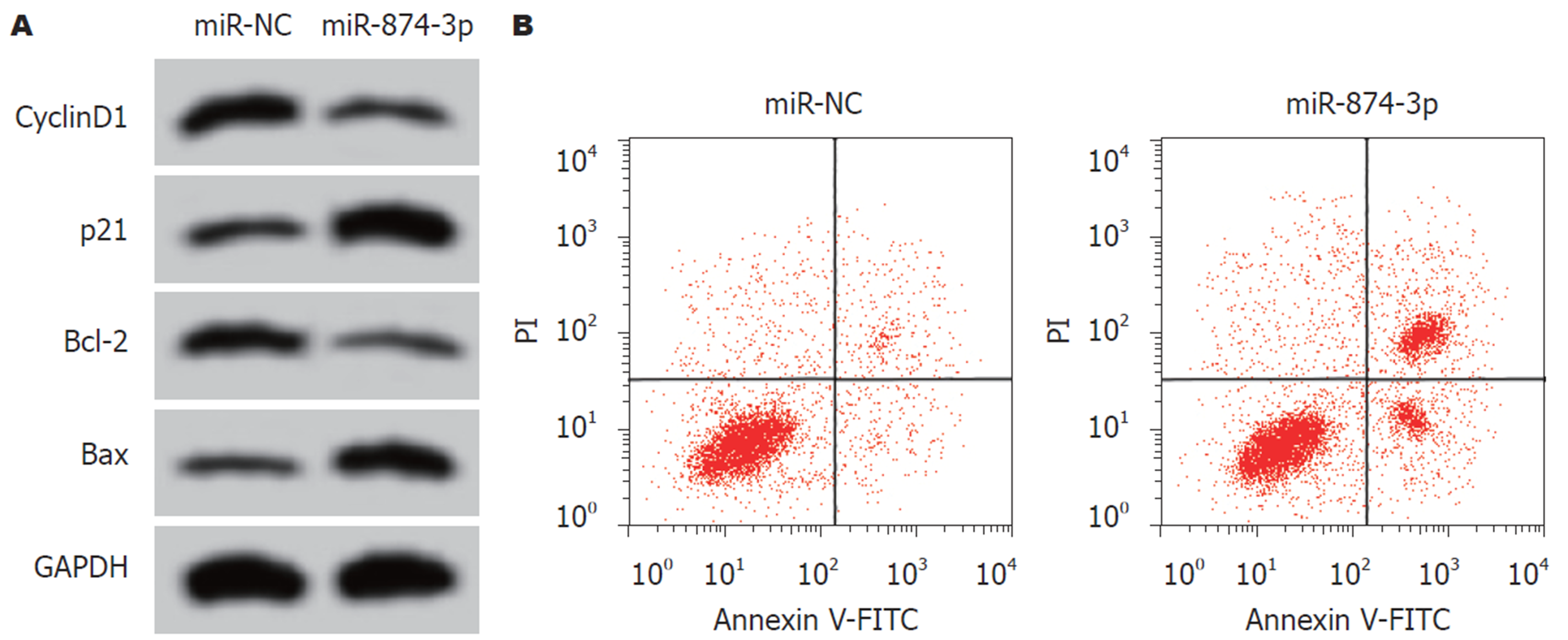
结果表明, 与miR-NC组相比, miR-874-3p组SW1463细胞中的miR-874-3p含量显著升高, 细胞OD值在24 h、48 h和72 h时均显著降低, 细胞凋亡率显著升高, CyclinD1和Bcl-2蛋白含量降低, p21和Bax含量升高, 差异具有统计学意义(P<0.05), 见图4和表6.
| 分组 | miR-874-3p | OD 值(490 nm) | 凋亡率(%) | CyclinD1 | p21蛋白 | Bcl-2蛋白 | Bax蛋白 | ||
| 24 h | 48 h | 72 h | |||||||
| miR-NC | 1.02±0.08 | 0.41±0.03 | 0.79±0.07 | 1.08±0.09 | 6.98±0.67 | 0.60±0.06 | 0.30±0.03 | 0.54±0.05 | 0.25±0.03 |
| miR-874-3p | 2.68±0.26a | 0.39±0.04 | 0.54±0.05a | 0.68±0.06a | 18.25±1.74a | 0.27±0.03a | 0.71±0.06a | 0.23±0.03a | 0.64±0.06a |
| t值 | 18.307 | 1.200 | 8.719 | 11.094 | 18.133 | 14.758 | 18.336 | 15.949 | 17.441 |
| P值 | 0.000 | 0.248 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
为确认lncRNA DCST1-AS1通过调控miR-874-3p对RC SW1463细胞增殖和凋亡发挥调控作用, 在抑制lncRNA DCST1-AS1同时干扰miR-874-3p. 结果表明, 与si-DCST1-AS1+anti-miR-NC组相比, si-lncRNA DCST1-AS1+anti-miR-874-3p组SW1463细胞OD值在24 h、48 h和72 h时显著升高, 细胞凋亡率显著降低, CyclinD1和Bcl-2蛋白含量升高, p21和Bax含量降低, 差异具有统计学意义(P<0.05)(图5和表7).
| 分组 | miR-874-3p | OD 值(490 nm) | 凋亡率(%) | CyclinD1 | p21蛋白 | Bcl-2蛋白 | Bax蛋白 | ||
| 24 h | 48 h | 72 h | |||||||
| si-NC | 1.00±0.06 | 0.43±0.04 | 0.78±0.06 | 1.07±0.09 | 7.22±0.72 | 0.62±0.06 | 0.28±0.03 | 0.53±0.05 | 0.24±0.03 |
| si-DCST1-AS1 | 2.65±0.26a | 0.38±0.03a | 0.51±0.05a | 0.64±0.06a | 20.13±2.01a | 0.23±0.03a | 0.74±0.06a | 0.19±0.02a | 0.67±0.06a |
| si-DCST1-AS1+anti-miR-NC | 2.69±0.27 | 0.37±0.03 | 0.48±0.04 | 0.61±0.05 | 21.45±2.13 | 0.21±0.02 | 0.76±0.07 | 0.18±0.02 | 0.69±0.07 |
| si-DCST1-AS1+anti-miR-874-3p | 1.41±0.14c | 0.41±0.03c | 0.67±0.06c | 0.92±0.08c | 11.54±1.16c | 0.51±0.05c | 0.39±0.03c | 0.42±0.04c | 0.35±0.03c |
| F值 | 163.549 | 6.349 | 63.080 | 86.563 | 161.353 | 203.149 | 207.932 | 220.898 | 179.971 |
| P值 | 0.000 | 0.002 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
多种lncRNA、miRNA和mRNA在RC中上调或下调, 通过lncRNA-miRNA等内源性RNA调控网络, 参与大肠癌发生发展[3,9-13]. 因而本研究积极探寻新型LncRNA并探究其在RC发生及发展过程中的作用机制, 为RC的靶向治疗提供新方向.
DCST1-AS1是一种lncRNA, 在三阴性乳腺癌(triple negative breast cancer, TNBC)组织中表达上调, MYC激活DCST1-AS1, 并与miR-873-5p结合促进TNBC细胞增殖和转移, DCST1-AS1基因敲除抑制TNBC细胞增殖和转移[5]. lncRNA DCST1-AS1在肝细胞癌(hepatocellular carcinoma, HCC)组织中也高表达, 并且其高表达与较大的肿瘤和较短的存活时间显著相关, 敲除DCST1-AS1显著抑制HCC细胞增殖、促进细胞凋亡和周期阻滞, 并抑制体内肿瘤生长, DCST1-AS1竞争性结合miR-1254, 从而上调Fas凋亡抑制剂2促进HCC细胞的增殖[14]. lncRNA DCST1-AS1在RC中的表达和作用尚不清楚. 本研究检测30例RC组织发现, 与癌旁组织相比, 在RC组织中lncRNA DCST1-AS1的含量显著升高, 抑制lncRNA DCST1-AS1可降低细胞中CyclinD1和Bcl-2含量, 提高p21和Bax蛋白含量, 抑制RC SW1463细胞增殖并促进细胞凋亡.
另外, 本研究通过StarBase预测发现, miR-874-3p与lncRNA DCST1-AS1的序列间存在互补结合位点. 通过双荧光素酶报告系统和qRT-PCR进一步发现, lncRNA DCST1-AS1靶向负调控miR-874-3p的表达. miR-874在多种癌症中发挥抑癌基因的作用. miR-874-3p在肝细胞癌组织下调, 过表达miR-874-3p可靶向PIN1抑制肿瘤增殖并促进细胞凋亡[15]. miR-874-3p在胶质瘤细胞中表达降低, 过表达miR-874-3p可抑制胶质瘤细胞增殖、迁移、侵袭和管形成能力[16]. miR-847在胃癌样本中表达下调, 其过表达可靶向水通道蛋白-3抑制胃癌细胞的生长、迁移、侵袭和致瘤性[17]. miR-874在结RC组织中表达明显下调并可抑制结RC细胞增殖及诱导细胞凋亡[18]. 本研究结果发现, miR-874-3p在RC组织中表达下调, 过表达miR-874-3p可抑制RC SW1463细胞增殖, 促进细胞凋亡, 且干扰miR-874-3p表达则会逆转抑制lncRNA DCST1-AS1对SW1463细胞增殖、凋亡的作用, 验证了两者在RC中存在调控关系.
综上, 本研究阐述了在RC组织中, lncRNA DCST1-AS1上调, miR-874-3p下调, 在RC SW1463细胞中lncRNA DCST1-AS1靶向miR-874-3p调控SW1463细胞增殖和凋亡, lncRNA DCST1-AS1可能是RC的潜在分子靶点.
近年来, 直肠癌(rectal cancer, RC)发病率与死亡率逐年上升, 已严重威胁人类生命安全, 目前RC发生及发展的分子机制尚未完全阐明. 目前临床主要采用手术与放化疗结合等方式进行治疗, 患者预后很差. 随着生物技术的发展, 分子靶向治疗逐渐成为RC等肿瘤的新型治疗手段, 但关于RC靶向治疗的潜在作用靶点尚未完全阐明.
长链非编码RNA (long non-coding RNA, lncRNA)在RC等肿瘤中表达异常, 但关于其具体作用机制尚未完全阐明, lncRNA主要通过靶向调控miRNA表达而调控其靶基因表达从而调控肿瘤细胞增殖及凋亡等生物学过程, 已有研究显示lncRNA DCST1-AS1在肿瘤发生及发展过程中发挥癌基因作用, 但其在RC中的表达及其作用机制尚未阐明.
本研究主要探究lncRNA DCST1-AS1在RC中的表达及其对miR-874-3p的靶向调控作用, 为进一步揭示RC发病机制奠定实验基础, 以期为RC的靶向治疗提供潜在的靶点.
采用实时荧光定量聚合酶链式反应方法检测RC组织及细胞中lncRNA DCST1-AS1与miR-874-3p的表达; 采用脂质体转染技术分别将si-NC、si-DCST1-AS1、miR-NC、miR-874-3p mimics、si-DCST1-AS1与anti-miR-NC、si-DCST1-AS1与anti-miR-874-3p转染至RC细胞; 采用MTT法检测细胞增殖; 采用流式细胞术检测细胞凋亡率; 采用Western blot法检测细胞增殖及凋亡相关蛋白表达; 采用双荧光素酶报告实验验证lncRNA DCST1-AS1和miR-874-3p的靶向关系.
lncRNA DCST1-AS1在RC组织及细胞中呈高表达, 而miR-874-3p呈低表达; 干扰lncRNA DCST1-AS1表达或miR-874-3p过表达可显著抑制RC细胞增殖, 促进细胞凋亡, 并可促进p21、B淋巴细胞瘤-2相关蛋白表达及抑制细胞周期蛋白1、B淋巴细胞瘤-2表达; lncRNA DCST1-AS1可靶向结合miR-874-3p, 并可负向调控miR-874-3p的表达; 干扰miR-874-3p表达与干扰lncRNA DCST1-AS1表达共同处理可显著减弱干扰lncRNA DCST1-AS1表达对RC细胞增殖及凋亡的作用.
本研究发现lncRNA DCST1-AS1在RC细胞中表达水平升高, miR-874-3p的表达水平降低; 本研究提出干扰lncRNA DCST1-AS1表达可能通过靶向上调miR-874-3p的表达从而抑制RC细胞增殖及促进细胞凋亡; 本研究结果可为RC的靶向治疗提供新方向, lncRNA DCST1-AS1可能作为RC治疗的潜在靶点.
本研究将继续探究miR-874-3p下游靶基因表达, 并分析lncRNA DCST1-AS1-miR-874-3p-靶mRNA分子轴在RC发生及发展过程中的作用机制; 本研究将进一步采用体内动物实验验证lncRNA DCST1-AS1-miR-874-3p-靶mRNA分子轴在RC发病中的作用机制.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 王禹乔 制作编辑:刘继红
| 1. | Dinaux AM, Leijssen LGJ, Bordeianou LG, Kunitake H, Berger DL. Rectal Cancer in Patients Under 50 Years of Age. J Gastrointest Surg. 2017;21:1898-1905. [PubMed] [DOI] |
| 2. | Deng Y. Rectal Cancer in Asian vs. Western Countries: Why the Variation in Incidence? Curr Treat Options Oncol. 2017;18:64. [PubMed] [DOI] |
| 3. | Li N, Yu J, Luo A, Tang Y, Liu W, Wang S, Liu Y, Song Y, Fang H, Chen B, Qi S, Lu N, Yu Z, Li Y, Liu Z, Jin J. LncRNA and mRNA signatures associated with neoadjuvant chemoradiotherapy downstaging effects in rectal cancer. J Cell Biochem. 2019;120:5207-5217. [PubMed] [DOI] |
| 4. | Li J, Zhai DS, Huang Q, Chen HL, Zhang Z, Tan QF. LncRNA DCST1-AS1 accelerates the proliferation, metastasis and autophagy of hepatocellular carcinoma cell by AKT/mTOR signaling pathways. Eur Rev Med Pharmacol Sci. 2019;23:6091-6104. [PubMed] [DOI] |
| 5. | Tang L, Chen Y, Tang X, Wei D, Xu X, Yan F. Long Noncoding RNA DCST1-AS1 Promotes Cell Proliferation and Metastasis in Triple-negative Breast Cancer by Forming a Positive Regulatory Loop with miR-873-5p and MYC. J Cancer. 2020;11:311-323. [PubMed] [DOI] |
| 6. | Yuan RB, Zhang SH, He Y, Zhang XY, Zhang YB. MiR-874-3p is an independent prognostic factor and functions as an anti-oncomir in esophageal squamous cell carcinoma via targeting STAT3. Eur Rev Med Pharmacol Sci. 2018;22:7265-7273. [PubMed] [DOI] |
| 7. | Xia B, Lin M, Dong W, Chen H, Li B, Zhang X, Hou Y, Lou G. Upregulation of miR-874-3p and miR-874-5p inhibits epithelial ovarian cancer malignancy via SIK2. J Biochem Mol Toxicol. 2018;32:e22168. [PubMed] [DOI] |
| 8. | Que K, Tong Y, Que G, Li L, Lin H, Huang S, Wang R, Tang L. Downregulation of miR-874-3p promotes chemotherapeutic resistance in colorectal cancer via inactivation of the Hippo signaling pathway. Oncol Rep. 2017;38:3376-3386. [PubMed] [DOI] |
| 9. | Wang C, Yuan G, Chen J. Identification of lncRNAs Associated with Prognosis of Rectal Cancer by Comprehensive Bioinformatics Analysis Based on TCGA. Clin Lab. 2019;65. [PubMed] [DOI] |
| 10. | Liu J, Li H, Zheng B, Sun L, Yuan Y, Xing C. Competitive Endogenous RNA (ceRNA) Regulation Network of lncRNA-miRNA-mRNA in Colorectal Carcinogenesis. Dig Dis Sci. 2019;64:1868-1877. [PubMed] [DOI] |
| 11. | Tao F, Xu Y, Yang D, Tian B, Jia Y, Hou J, Dong M. LncRNA NKILA correlates with the malignant status and serves as a tumor-suppressive role in rectal cancer. J Cell Biochem. 2018;119:9809-9816. [PubMed] [DOI] |
| 12. | Zhang Z, Wang S, Ji D, Qian W, Wang Q, Li J, Gu J, Peng W, Hu T, Ji B, Zhang Y, Wang S, Sun Y. Construction of a ceRNA network reveals potential lncRNA biomarkers in rectal adenocarcinoma. Oncol Rep. 2018;39:2101-2113. [PubMed] [DOI] |
| 13. | Qu W, Huang W, Yang F, Ju H, Zhu G. Long noncoding RNA LINC00461 mediates cisplatin resistance of rectal cancer via miR-593-5p/CCND1 axis. Biomed Pharmacother. 2020;124:109740. [PubMed] [DOI] |
| 14. | Chen J, Wu D, Zhang Y, Yang Y, Duan Y, An Y. LncRNA DCST1-AS1 functions as a competing endogenous RNA to regulate FAIM2 expression by sponging miR-1254 in hepatocellular carcinoma. Clin Sci (Lond). 2019;133:367-379. [PubMed] [DOI] |
| 15. | Leong KW, Cheng CW, Wong CM, Ng IO, Kwong YL, Tse E. miR-874-3p is down-regulated in hepatocellular carcinoma and negatively regulates PIN1 expression. Oncotarget. 2017;8:11343-11355. [PubMed] [DOI] |
| 17. | Jiang B, Li Z, Zhang W, Wang H, Zhi X, Feng J, Chen Z, Zhu Y, Yang L, Xu H, Xu Z. miR-874 Inhibits cell proliferation, migration and invasion through targeting aquaporin-3 in gastric cancer. J Gastroenterol. 2014;49:1011-1025. [PubMed] [DOI] |