修回日期: 2020-04-22
接受日期: 2020-04-27
在线出版日期: 2020-05-28
胃癌(gastric cancer, GC)化疗容易产生获得性化疗耐药. miR-10b能参与调节食管癌和鼻咽癌细胞顺铂(cisplatin, DDP)耐药, 而在GC中其与DDP化疗敏感性的关系并不清楚.
探讨miR-10b是否参与GC细胞对DDP耐药, 以及其中的分子机制.
采用DDP反复刺激SGC-7901和MGC-803细胞并浓度递增法构建SGC-7901/DDP和MGC-803/DDP细胞. 检测SGC-7901/DDP和MGC-803/DDP细胞中miR-10b和KLF4的表达. 对SGC-7901和MGC-803细胞转染慢病毒携带的miR-10b过表达载体, MTT法检测miR-10b过表达对DDP敏感性的影响; Annexin V-FITC/PI染色法检测miR-10b过表达对DDP诱导的细胞凋亡的影响; RT-qPCR和Western blot检测miR-10b过表达对KLF4 mRNA和蛋白表达的影响. 进一步构建异体移植瘤模型, 并给予DDP化疗后, 宏观观察瘤体形态并称量瘤体质量. 对SGC-7901和MGC-803细胞共转染miR-10b和KLF4后, MTT法检测细胞对DDP敏感性变化.
与SGC-7901和MGC-803细胞比较, SGC-7901/DDP和MGC-803/DDP细胞中miR-10b表达水平显著增加(P<0.01), KLF4 mRNA和蛋白水平显著降低(P<0.01). 体外实验显示, 过表达miR-10b促进GC细胞对DDP耐药, 抑制KLF4 表达(P<0.01); 在体实验显示, DDP治疗后, miR-10b组瘤体质量显著高于NC组(P<0.01). 过表达KLF4能部分逆转过表达miR-10b诱导的GC细胞对DDP耐药.
miR-10b通过抑制KLF4表达促进GC细胞DDP化疗耐药, 而miR-10b高表达产生的DDP耐药性可以被上调KLF4解除.
核心提要: miR-10b在胃癌(gastric cancer, GC)顺铂(cisplatin, DDP)耐药细胞中高表达. 上调miR-10b能通过抑制KLF4表达来促进GC细胞对DDP耐药, 而上调KLF4能部分逆转miR-10b过表达导致GC细胞DDP耐药.
引文著录: 易弼顺, 马柏强, 李冰震, 田锋. miR-10b通过抑制KLF4表达诱导胃癌细胞对顺铂耐药. 世界华人消化杂志 2020; 28(10): 362-370
Revised: April 22, 2020
Accepted: April 27, 2020
Published online: May 28, 2020
Gastric cancer (GC) chemotherapy is prone to acquired chemotherapy resistance. MiR-10b has been found to be involved in regulating cisplatin (DDP) resistance of esophageal and nasopharyngeal carcinoma cells, but its relationship with DDP chemotherapy sensitivity in GC is unclear.
To investigate whether miR-10b is related to DDP chemoresistance in GC cells and the underlying molecular mechanism.
SGC-7901/DDP and MGC-803/DDP cell lines were established by repeated stimulation of SGC-7901 and MGC-803 cells with increasing concentrations of DDP. The expression levels of miR-10b and KLF4 in SGC-7901/DDP and MGC-803/DDP cells were detected. After SGC-7901 and MGC-803 cells were infected with a lentiviral vector overexpressing miR-10b, cell proliferation was detected by MTT assay, apoptosis was detected by Annexin V-FITC/PI staining, and KLF4 mRNA and protein expression was detected by RT- qPCR and Western blot, respectively. In addition, these cells were further used to construct a xenograft tumor model, and after DDP chemotherapy, tumor morphology was observed macroscopically and tumor weight was measured. After co-transfection of SGC-7901 and MGC-803 cells with miR-10b and KLF4, the sensitivity of cells to DDP was detected by MTT assay.
Compared with SGC-7901 and MGC-803 cells, miR-10b expression levels in SGC-7901/DDP and MGC-803/DDP cells were significantly increased (P < 0.01), and KLF4 mRNA and protein levels were significantly decreased (P < 0.01). In vitro experiments showed that overexpression of miR-10b promoted DDP resistance in GC cells and inhibited KLF4 expression (P < 0.01). In vivo, after DDP treatment, tumor weight in the miR-10b group was significantly higher than that of the control group (P < 0.01). Overexpression of KLF4 could partially reverse DDP resistance of GC cells induced by overexpression of miR-10b.
MiR-10b promotes DDP resistance in GC cells by inhibiting the expression of KLF4, however, the DDP resistance induced by miR-10b overexpression can be reversed by up-regulation of KLF4.
- Citation: Yi BS, Ma BQ, Li BZ, Tian F. MiR-10b induces cisplatin resistance in gastric cancer cells by inhibiting KLF4 expression. Shijie Huaren Xiaohua Zazhi 2020; 28(10): 362-370
- URL: https://www.wjgnet.com/1009-3079/full/v28/i10/362.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i10.362
胃癌(gastric cancer, GC)是常见的消化系统肿瘤. 早期GC症状与一些胃病(如: 胃炎和胃溃疡等)类似, 容易被忽视, 多数患者确诊时已是中晚期GC[1]. 对GC化疗主要是以铂类为主的联合化疗方案, 但是药物化疗常出现耐药, 导致治疗效果不佳[2].
miRNAs可参与调控胚胎发育、肿瘤发生、转移、化疗耐药和代谢等众多生理和病理过程[3-5]. 而, 大多数miRNAs的生物学功能尚未完全阐明, 且多数miRNAs在调节化疗耐药性中的作用以及其中涉及的分子机制未被报道. 顺铂(cisplatin, DDP)是一种临床上常用的化疗药物, 可对多种肿瘤(如: 肺癌和食管癌等)发挥治疗效应[6,7]. 尽管DDP通常在初始的治疗中表现出明显的疗效, 但是由于耐药性的产生, 则不可避免地导致后续化疗效果不理想. 因此克服DDP的化疗抗性仍然是当前面临的重大挑战. 已有研究[8,9]报道, miR-10b能促进食管癌和鼻咽癌细胞DDP耐药. 另外, 多篇文献[9-11]显示, miR-10b能通过下调Krueppel样因子4(Krueppel-like factor 4, KLF4)表达来促进多种肿瘤细胞上皮间质转化、迁移与侵袭. 据报道[12,13], miR-10b在GC组织中高表达, 且其与肿瘤分期和预后不良呈正相关; 而在GC中其与DDP化疗敏感性的关系并不清楚. 因此本研究通过检测细胞活力、细胞凋亡以及细胞内分子水平的改变, 推断出GC可能的DDP耐药产生机制; 并试图探究miR-10b与KLF4的相互作用在GC细胞对DDP耐药性的影响, 为临床治疗提供新思路.
GC细胞SGC-7901和MGC-803(上海雅吉生物科技有限公司). DDP和MTT试剂盒(Sigma, 美国); 青霉素-链霉素混合溶液、RPMI-1640培养基(Thermo Fisher Scientific, 美国); ECL试剂(Millipore, 美国); BCA蛋白测定试剂盒和Annexin V-FITC/PI双染细胞凋亡检测试剂盒(上海碧云天生物科技有限公司, 中国)KLF4抗体和 II 抗(Abcam, 美国); MiRNeasy mini试剂盒、miScript II RT试剂盒和miScript SYBR Green PCR试剂盒(Qiagen, 德国). 酶标仪(Bio-Rad, 美国); 流式细胞仪(Bio-Rad, 美国); ABI StepOne TM实时PCR系统(Applied Biosystems, 美国).
1.2.1 GC的DDP耐药细胞系构建: 以SGC-7901和MGC-803为亲本细胞, 诱导DDP耐药细胞. 首先用MTT法测定DDP对GC亲本细胞的半数抑制浓度为7.5 μmol/L和8.4 μmol/L. 首次加药浓度为2 μmol/L, 每48 h换液一次, 并反复加入同种浓度DDP, 待细胞在含DDP浓度的培养基中稳定生长时, 再按照2、3、5、8、12和16 μmol/L DDP浓度递增方法, 直到细胞可在16 μmol/L的DDP浓度中稳定生长, 至此建立SGC-7901/DDP和MGC-803/DDP细胞. 在后续实验前, SGC-7901/DDP和MGC-803/DDP细胞在无DDP条件下培养2 wk.
1.2.2 细胞培养: SGC-7901、MGC-803、SGC-7901/DDP和MGC-803/DDP细胞培养于RPMI-1640培养基, 置于37 ℃、饱和湿度、5% CO2的恒温箱中培养, 培养基中添加10% FBS及青霉素-链霉素混合溶液(含青霉素、链霉素各100 U/mL). 培养基每周更换2-3次, 用0.25%的胰蛋白酶消化传代, 传代比1:4.
1.2.3 慢病毒感染: miR-10b过表达的慢病毒载体(lentivirus-miR-10b, miR-10b)、阴性对照lentivirus-miR-NC(NC)、lentivirus-KLF4(KLF4)以及慢病毒空载体lentivirus-Vector(Vector)由广州锐博生物科技公司合成, 其中NC为乱码序列, 与人已知的miRNAs序列无同源性, 作为miR-10b的阴性对照; Vector作为KLF4的阴性对照.
分别将SGC-7901和MGC-803细胞以2×104细胞/孔接种在24孔板上, 然后10 MOI miR-10b或NC感染SGC-7901和MGC-803细胞48 h, 构建miR-10b组和NC组.
取miR-10b组或NC组的细胞, 再分别感染10 MOI Vector或KLF4 48 h, 构建NC+Vector组、miR-10b+Vector组和miR-10b+KLF4组.
1.2.4 MTT法检测细胞活力: 分别将SGC-7901、MGC-803、SGC-7901/DDP和MGC-803/DDP细胞和已经病毒感染的细胞以1×104个细胞/孔接种在96孔板上, 然后采用不同浓度(0、10、20、30、40 μmol/L)DDP处理24 h. 吸除培养基后, 然后在37 ℃下与100 μL 5 mg/mL MTT一起孵育3 h, 弃孔内上清液. 随后, 在室温下加入400 μL DMSO并摇动15 min. 通过酶标仪读取590 nm处各孔吸光度.
1.2.5 细胞凋亡分析: 分别取已感染的细胞, 以2×104个细胞/孔接种在24孔板上, 然后采用20 μmol/L DDP处理24 h. 然后收集细胞, 按照Annexin V-FITC/PI双染细胞凋亡检测试剂盒说明书步骤, 用碘化丙锭(propidium iodide, PI)和膜联蛋白V(annexin V)-FITC对细胞共染色. 通过流式细胞仪分选计数凋亡细胞.
1.2.6 RT-qPCR分析: 对于miR-10b分析采用使用MiRNeasy mini试剂盒按照说明书进行分析. 对于KLF4 mRNA检测, 采用TRIzol试剂盒提取总RNA, 测定RNA浓度后, 将(1 μg)的总RNA转化为cDNA. 将稀释的cDNA与含有通用引物和SYBR Green染料的miScript SYBR Green PCR Kit混合, 并加入含有冻干引物于PCR板的孔中.
miR-10b的正向引物为5'-ACATCATACCCTGTAGAACCGAA-3', 反向引物为5'-GATTGGATGTTCTCCACAGTCTC-3'; KLF4的正向引物为5'-CGAACCCACACAGGTGAGAA-3', 反向引物为5'-TACGGTAGTGCCTGGTCAGTTC-3'; U6的正向引物为5'-GCTTCGGCACATATACTAAAAT-3', 反向引物为5'-CGCTTCACGAATTTGCGTGTCAT-3'; GAPDH的正向引物为5'-CGACCACTTTGTCAAGCTCA-3', 反向引物为5'-AGGGGTCTACATGGCAACTG-3'. 用ABI StepOne TM实时PCR系统进行RT-qPCR检测, 并测定的Ct值, miR-10b以U6为内参, KLF4以GAPDH为内参, 采用2-△△Ct法分析基因的相对表达量.
1.2.7 蛋白质免疫印迹: 细胞以4×105个/孔的密度接种在6孔培养皿中, 培养24 h后, 用1 mL PBS/孔洗涤细胞, 并通过胰蛋白酶消化收集细胞. 在冰上, 将细胞在RIPA裂解缓冲液中孵育30 min, 然后在4 ℃下1.2×105 g离心30 min收集总蛋白. 使用BCA试剂盒测定蛋白质浓度. 随后, 取50 μg总蛋白使用8%-15%十二烷基SDS-PAGE凝胶电泳, 并转移到PVDF膜上. 将膜用含5%脱脂奶粉的TBST中封闭2 h, 并孵育Ⅰ抗(KLF4抗体, 1:2000稀释) 4 ℃过夜. 洗涤膜3次, 并与Ⅱ抗一起温育, 洗涤膜3次后用ECL试剂显影. 用凝胶成像设备对膜进行成像, 并用Image J软件进行半定量分析.
1.2.8 异种移植肿瘤模型: 6周龄SPF级雄性裸鼠(18-21 g)购自温州医科大学实验动物中心[SCXK(浙)2015-0001], 饲养于温州医科大学实验动物中心SPF级动物房[SYXK(浙)2018-0017]. 12只小鼠随机分成两组, 每组6只, 分别为阴性对照(NC)组和miR-10b过表达组. 将NC组或miR-10b组的SGC-7901细胞(3×106个细胞)重悬于100 μL培养基中, 并以体积比1:1的比例与基质胶混合, 然后皮下注射到每只小鼠的右腹皮下. 在第2周末, 观察小鼠成瘤情况, 其中miR-10b组有一只小鼠未成瘤, 剔除本研究. 第3周起, 每日腹腔注射5 mg/kg(体重)DDP 1次, 持续4 wk. 在第6周末, 用断颈法处死小鼠, 解剖并取出肿瘤测量称重.
统计学处理 数据表示为mean±SD. 使用Graphpad Prism 7.0软件对数据进行分析. 两组数据的比较行双尾t检验, 多组数据的两两比较行单因素方差分析后Bonfferoni检验. P<0.05认为差异有统计学意义.
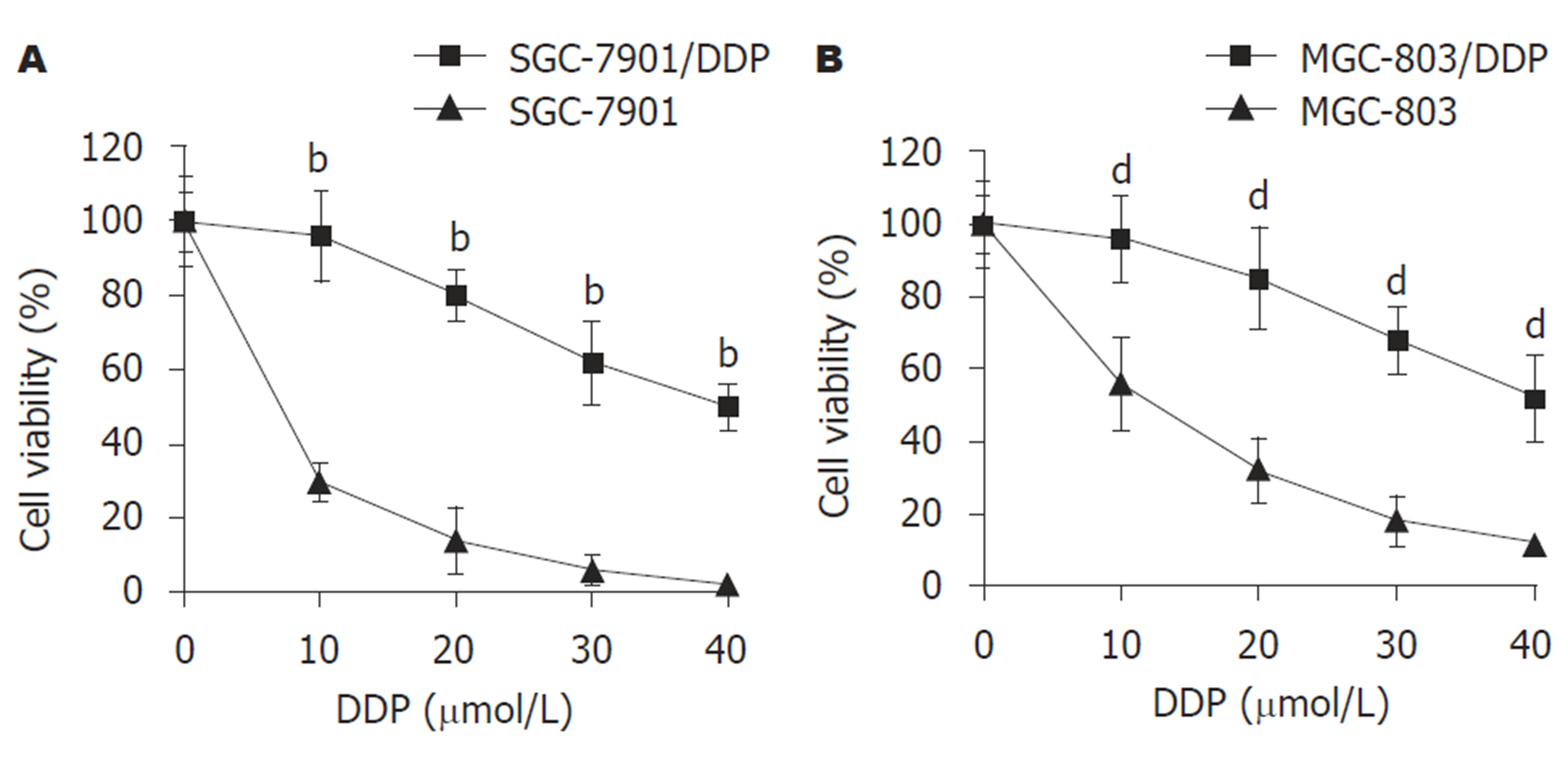
MTT结果显示(图1), 不同浓度DDP处理后, 与SGC-7901或MGC-803细胞比较, SGC-7901/DDP和MGC-803/DDP细胞的细胞活力降低较慢(P<0.01). 以上结果表明构建的SGC-7901/DDP和MGC-803/DDP细胞株具有DDP耐药性.
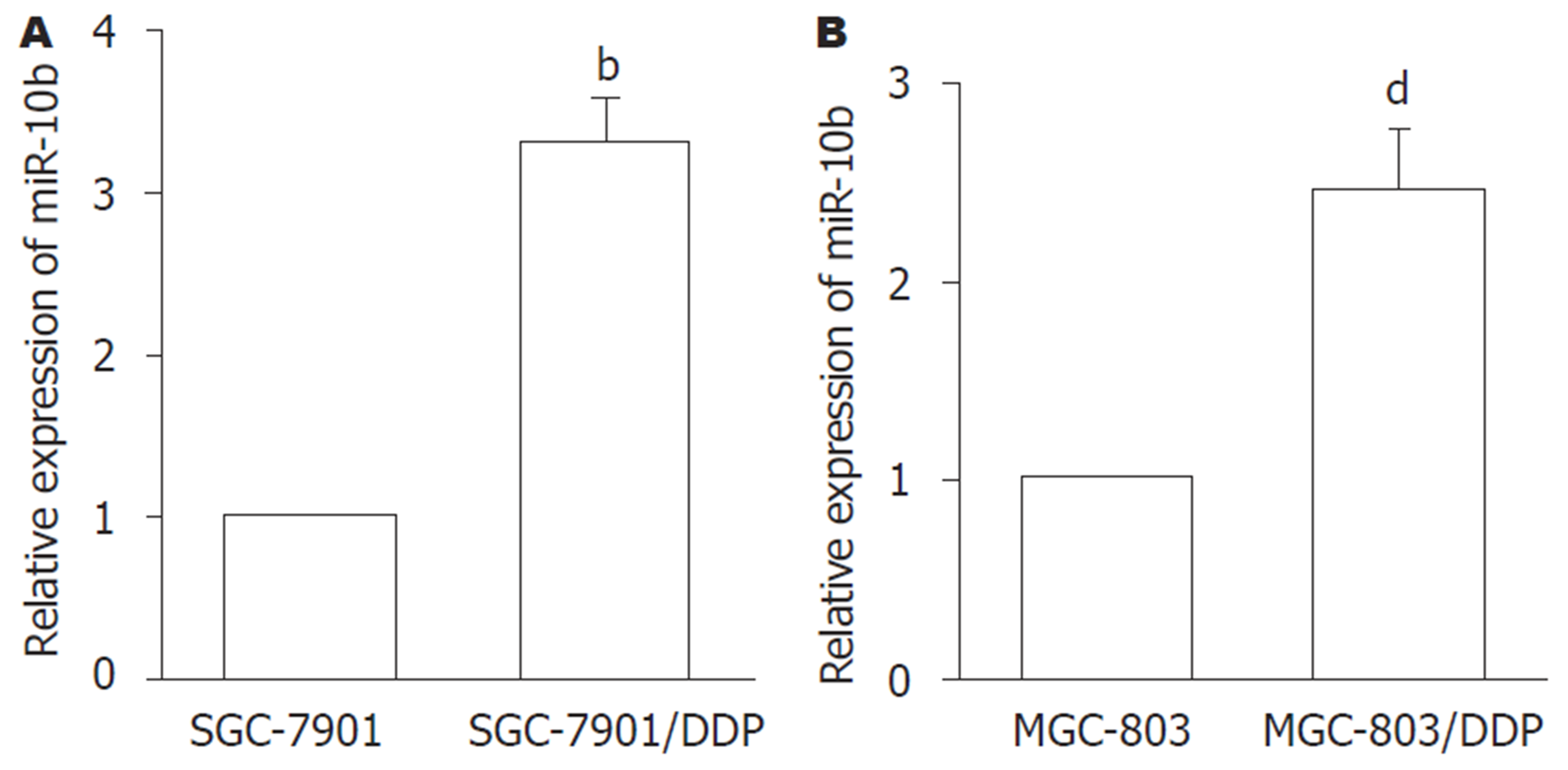
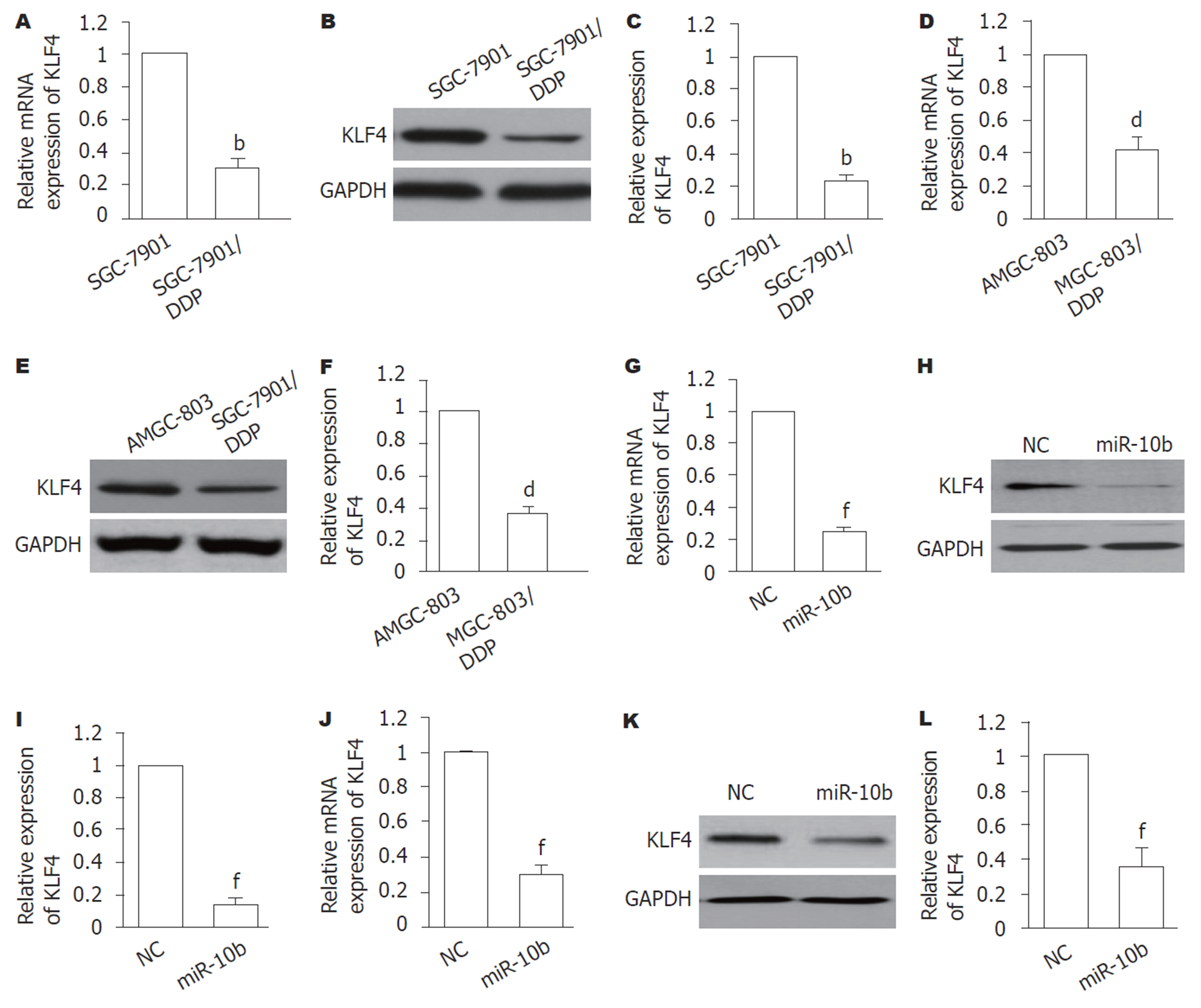
图2结果显示, 与SGC-7901或MGC-803细胞比较, SGC-7901/DDP和MGC-803/DDP细胞中miR-10b的表达显著增加(P<0.01). 提示, miR-10b可能是GC细胞产生耐药性的重要分子.
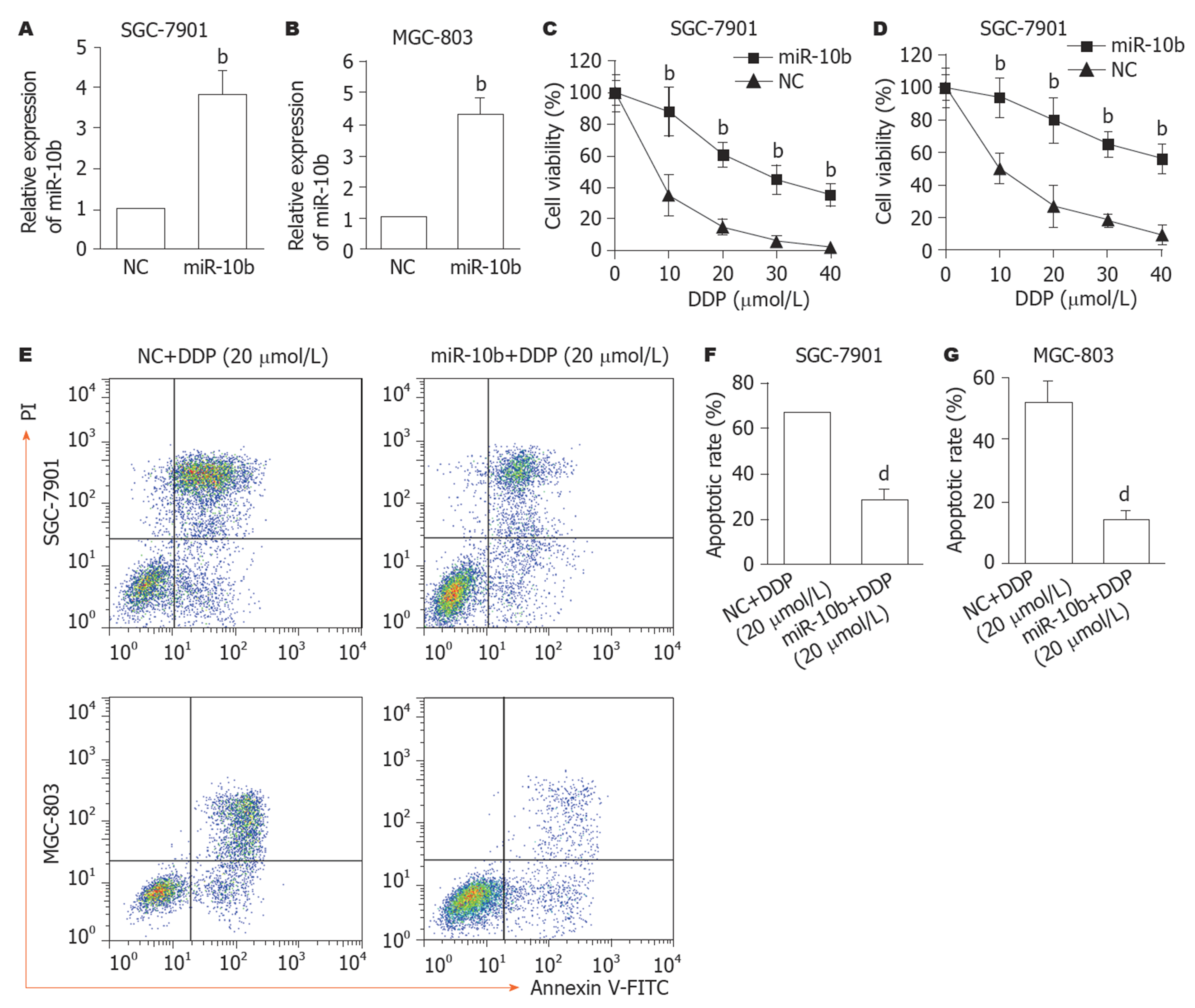
对GC细胞进行慢病毒感染miR-10b或miR-NC, 结果如图3所示, 与NC组相比, miR-10b组的SGC-7901细胞(图3A)和MGC-803(图3B)中miR-10b表达显著增加(P<0.01), 结果表明, 过表达miR-10b的细胞构建成功. 对已过表达miR-10b的GC细胞进行不同浓度的DDP处理, 再进行细胞活力检测, 结果发现, 与NC组比较, miR-10b组的SGC-7901细胞(图3C)和MGC-803(图3D)细胞活力显著增加(P<0.01). 随后, 本研究检测过表达miR-10b对20 μmol/L DDP诱导的凋亡的影响, 结果发现, 与NC+20 μmol/L DDP组比较, miR-10b+20 μmol/L DDP组的SGC-7901细胞(图3E、F)和MGC-803(图3E、G)细胞凋亡比例显著降低(P<0.01).
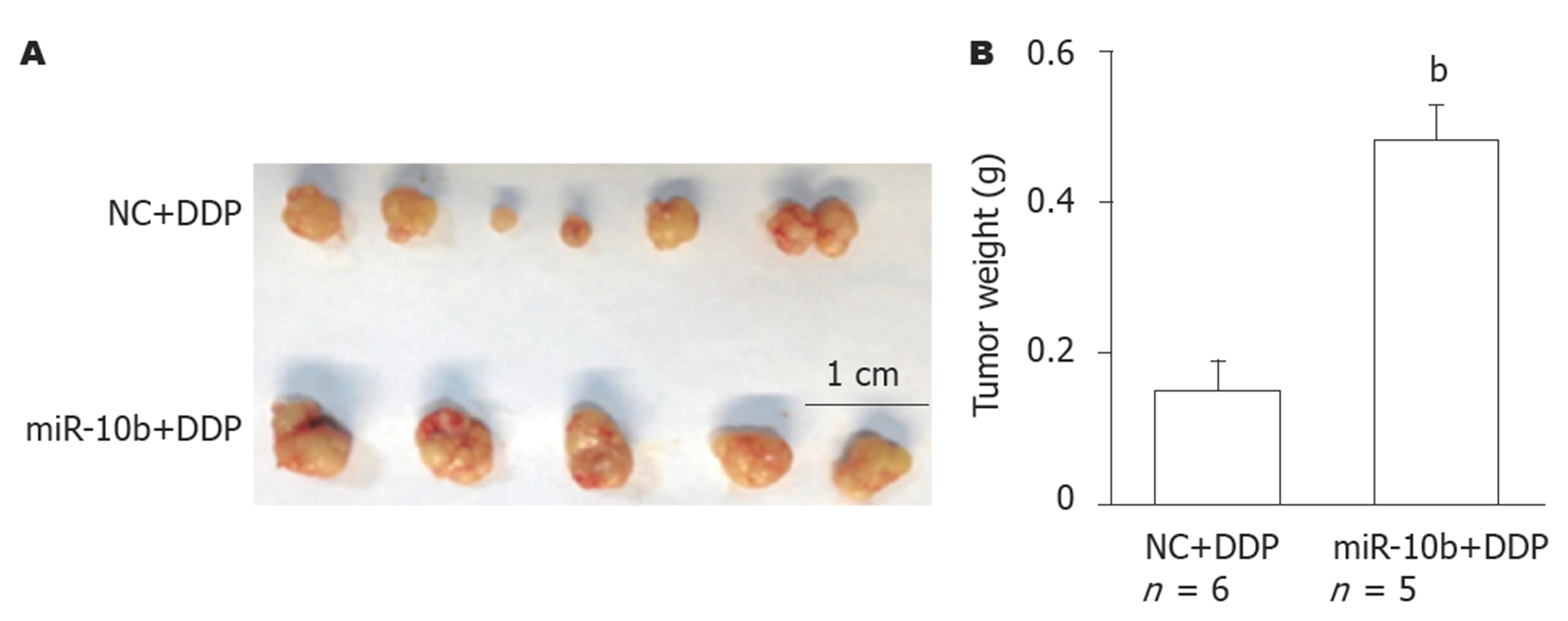
用NC组或miR-10b组的SGC-7901细胞构建异位GC移植瘤模型, 并使用DDP进行化疗. 结果显示, 与NC+DDP组相比, miR-10b+DDP组SGC-7901细胞形成的肿瘤明显变大(图4A), 肿瘤质量显著增加(图4B)(P<0.01). 表明miR-10b高表达促进SGC-7901细胞产生DDP耐药性.
首先分析KLF4在GC的DDP耐药细胞中表达, 结果(图5A-F)显示, 与SGC-7901或MGC-803细胞比较, SGC-7901/DDP和MGC-803/DDP细胞中KLF4的mRNA和蛋白表达均显著降低(P<0.01). 进一步对GC细胞过表达miR-10b, 检测KLF4的表达, 结果显示, 与NC组比较, 在miR-10b组的SGC-7901细胞中KLF4的mRNA(图5G)和蛋白(图5H、I)表达均显著降低(P<0.01); 在MGC-803细胞中也见类似的结果(图5J-L).
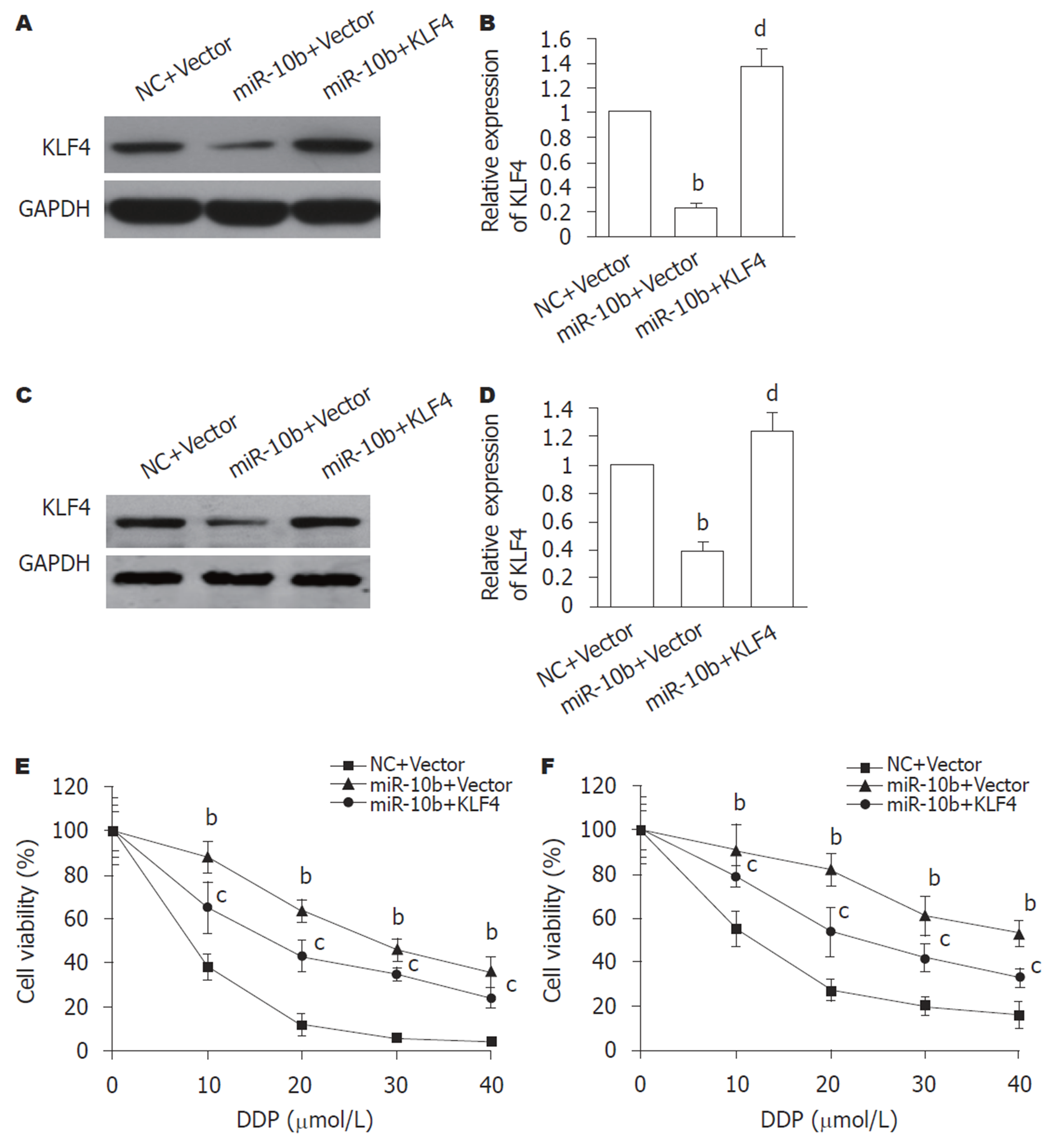
构建miR-10b和KLF4共过表达的GC细胞, Western blot结果(图6A-D)显示, 与miR-10b+Vector组比较, miR-10b+KLF4组的SGC-7901和MGC-803细胞中KLF4蛋白表达均显著增加(P<0.01). 用不同浓度的DDP处理细胞, MTT结果显示, 与miR-10b+Vector组比较, miR-10b+KLF4组SGC-7901细胞(图6E)和MGC-803细胞的细胞活力显著增加(P<0.05). 提示, miR-10b可能通过抑制KLF4的表达导致GC细胞对DDP耐药.
GC常以铂类药物为基础的联合化疗方式进行化疗, 但化疗能产生耐药性[2]. 而探索GC化疗耐药产生的机制, 有助于提高今后对GC的化疗效果.
miRNA是一类内源性非编码的RNA小分子, 可通过碱基互补结合多个靶mRNA的3′UTR区调控靶基因mRNA表达, 从而在转录后调控生物学功能[5]. miR-10b作为miRNA家族中的成员之一, 定位于2号染色体短臂3区l带l亚带的HOXD4与HOXD8基因之间[14]. 除了作用于翻译抑制外, 研究[15]发现miR-10结合含有末端寡嘧啶基序的一组转录物并诱导它们的翻译, 从而为miRNA家族添加新功能. miR-10b在乳腺癌中表达下调[16], 其下调能促进乳腺癌进展; 而在GC[12,13]、食管癌[8]和黑色素瘤[17]等恶性肿瘤中表达上调, 且其上调增强上述肿瘤细胞的增殖、迁移与侵袭[9-11]. 这体现了miR-10b在不同肿瘤中表达和功能的多样性. 另外, miR-10b能促进食管癌和鼻咽癌细胞DDP耐药[8,9], 而其在GC中与DDP化疗敏感性的关系并不清楚. 本研究发现miR-10b过表达可导致体外GC细胞DDP耐药性的产生, 且体内SGC-7901细胞移植瘤实验进一步确认了这一现象. KLF4在机体广泛表达, 主要表达于消化道、口腔、食管上皮、皮肤表皮、血管内皮和胸腺上皮细胞中[18]. 据报道[19], 敲除KLF4可促进GC细胞增殖和转移, 而过表达KLF4则可抑制转移和浸润, 促进细胞凋亡. 在线靶基因预测数据库显示miR-10b在KLF4的mRNA在295-301位点存在结合区域. 且已有文献[10,20]指出KLF4是miR-10b的靶基因之一. 在多种肿瘤细胞中, 敲除KLF4能促进肿瘤细胞的多种化疗药物耐药, 而过表达KLF4能增强化疗药物敏感性[21,22]. 本研究发现, DDP耐药的GC细胞(miR-10b过表达的GC细胞)中KLF4也处于低表达状态, 通过慢病毒过表达KLF4, 发现过表达KLF4能部分逆转miR-10b诱导的DDP耐药.
综上所述, 本研究表明上调miR-10b会使GC细胞对DDP产生耐药性, 并且这一作用可能是通过下调KLF4的表达实现的, 通过上调KLF4的表达能在一定程度上降低GC细胞对DDP的耐药性.
胃癌(gastric cancer, GC)在化疗程序中会产生获得性化疗耐药, 最终导致化疗失败. 已有研究显示miRNAs可参与调节GC的化疗耐药, 而miRNAs数量众多, 多数miRNAs在调节GC化疗耐药中的作用尚未被鉴定.
上调miR-10b能增加食管癌和鼻咽癌细胞对顺铂(cisplatin, DDP)的耐药性. miR-10b在GC中高表达. 而目前尚无关于GC中miR-10b与DDP化疗敏感性的关系的报道.
研究miR-10b与GC细胞DDP化疗敏感性的关系, 并探讨其中的机制.
比较GC细胞与DDP耐药细胞中miR-10b的表达差异. 观察过表达miR-10b对体外和体内DDP化疗敏感性的影响. 分析过表达miR-10b对KLF4表达的影响, 并通过修复实验验证miR-10b、KLF4与DDP敏感性三者之间的内在联系.
miR-10b在GC的DDP耐药细胞中高表达. 上调GC细胞中miR-10b表达能导致细胞对DDP敏感性降低, 并下调KLF4表达. 上调KLF4能废除过表达miR-10b对GC细胞DDP耐药的促进作用.
上调miR-10b表达能通过负调控靶基因KLF4促进GC细胞DDP化疗耐药.
本研究探明了miR-10b促进GC的DDP耐药调控机制, 并为GC的DDP耐药的治疗提供了参考靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 王禹乔 制作编辑:刘继红
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7-30. [PubMed] [DOI] |
| 2. | Song Z, Wu Y, Yang J, Yang D, Fang X. Progress in the treatment of advanced gastric cancer. Tumour Biol. 2017;39:1010428317714626. [PubMed] [DOI] |
| 3. | Vienberg S, Geiger J, Madsen S, Dalgaard LT. MicroRNAs in metabolism. Acta Physiol (Oxf). 2017;219:346-361. [PubMed] [DOI] |
| 4. | Mohr AM, Mott JL. Overview of microRNA biology. Semin Liver Dis. 2015;35:3-11. [PubMed] [DOI] |
| 5. | Bhaskaran M, Mohan M. MicroRNAs: history, biogenesis, and their evolving role in animal development and disease. Vet Pathol. 2014;51:759-774. [PubMed] [DOI] |
| 6. | Zhang L, Li W, Lyu X, Song Y, Mao Y, Wang S, Huang J. Adjuvant chemotherapy with paclitaxel and cisplatin in lymph node-positive thoracic esophageal squamous cell carcinoma. Chin J Cancer Res. 2017;29:149-155. [PubMed] [DOI] |
| 7. | Browning RJ, Reardon PJT, Parhizkar M, Pedley RB, Edirisinghe M, Knowles JC, Stride E. Drug Delivery Strategies for Platinum-Based Chemotherapy. ACS Nano. 2017;11:8560-8578. [PubMed] [DOI] |
| 8. | Wu K, Hu Y, Yan K, Qi Y, Zhang C, Zhu D, Liu D, Zhao S. microRNA-10b confers cisplatin resistance by activating AKT/mTOR/P70S6K signaling via targeting PPARγ in esophageal cancer. J Cell Physiol. 2020;235:1247-1258. [PubMed] [DOI] |
| 9. | Zhang P, Hong H, Sun X, Jiang H, Ma S, Zhao S, Zhang M, Wang Z, Jiang C, Liu H. MicroRNA-10b regulates epithelial-mesenchymal transition by modulating KLF4/Notch1/E-cadherin in cisplatin-resistant nasopharyngeal carcinoma cells. Am J Cancer Res. 2016;6:141-156. [PubMed] |
| 10. | Xiao H, Li H, Yu G, Xiao W, Hu J, Tang K, Zeng J, He W, Zeng G, Ye Z, Xu H. MicroRNA-10b promotes migration and invasion through KLF4 and HOXD10 in human bladder cancer. Oncol Rep. 2014;31:1832-1838. [PubMed] [DOI] |
| 11. | Liu Y, Li M, Zhang G, Pang Z. MicroRNA-10b overexpression promotes non-small cell lung cancer cell proliferation and invasion. Eur J Med Res. 2013;18:41. [PubMed] [DOI] |
| 12. | Obermannova R, Redova-Lojova M, Vychytilova-Faltejskova P, Grell P, Cho WC, Sachlova M, Svoboda M, Vyzula R, Slaby O. Tumor Expression of miR-10b, miR-21, miR-143 and miR-145 Is Related to Clinicopathological Features of Gastric Cancer in a Central European Population. Anticancer Res. 2018;38:3719-3724. [PubMed] [DOI] |
| 13. | Gao Y, Xu Z, Yuan F, Li M. Correlation of Expression Levels of Micro Ribonucleic Ccid-10b (miR-10b) and Micro Ribonucleic Acid-181b (miR-181b) with Gastric Cancer and Its Diagnostic Significance. Med Sci Monit. 2018;24:7988-7995. [PubMed] [DOI] |
| 14. | Kumar MS, Lu J, Mercer KL, Golub TR, Jacks T. Impaired microRNA processing enhances cellular transformation and tumorigenesis. Nat Genet. 2007;39:673-677. [PubMed] [DOI] |
| 15. | Lund AH. miR-10 in development and cancer. Cell Death Differ. 2010;17:209-214. [PubMed] [DOI] |
| 16. | Wang J, Yan Y, Zhang Z, Li Y. Role of miR-10b-5p in the prognosis of breast cancer. PeerJ. 2019;7:e7728. [PubMed] [DOI] |
| 17. | Wang S, Wu Y, Xu Y, Tang X. miR-10b promoted melanoma progression through Wnt/β-catenin pathway by repressing ITCH expression. Gene. 2019;710:39-47. [PubMed] [DOI] |
| 18. | 易 丽娴, 汤 新逸, 王 胜军. KLF4的生物学功能及其研究进展. 江苏大学学报(医学版). 2014;6:545-548. [DOI] |
| 19. | Zheng J, Liu Y, Qiao Y, Zhang L, Lu S. miR-103 Promotes Proliferation and Metastasis by Targeting KLF4 in Gastric Cancer. Int J Mol Sci. 2017;18. [PubMed] [DOI] |
| 20. | Tian Y, Luo A, Cai Y, Su Q, Ding F, Chen H, Liu Z. MicroRNA-10b promotes migration and invasion through KLF4 in human esophageal cancer cell lines. J Biol Chem. 2010;285:7986-7994. [PubMed] [DOI] |