修回日期: 2019-12-25
接受日期: 2019-12-29
在线出版日期: 2020-01-08
术前血小板计数, 肿瘤最大径可辅助判断结直肠癌(colorectal cancer, CRC)患者预后, 结合两者可在一定程度上取长补短, 准确判断患者预后. 但目前在临床上, 对于联合这两个参数, 如血小板计数和肿瘤最大径比(platelet count and maximum tumor diameter ratio, PTR)是否可存在价值的报道较少.
探讨术前PTR对CRC患者3年无进展生存期(progression free survival, PFS)的预测价值.
收集解放军总医院海南医院自2012-12/2019-06经手术后病理确诊的结直肠腺癌患者127例, 计算PTR并分析其在性别、年龄等不同临床临床参数中的差异和对PFS预测的价值.
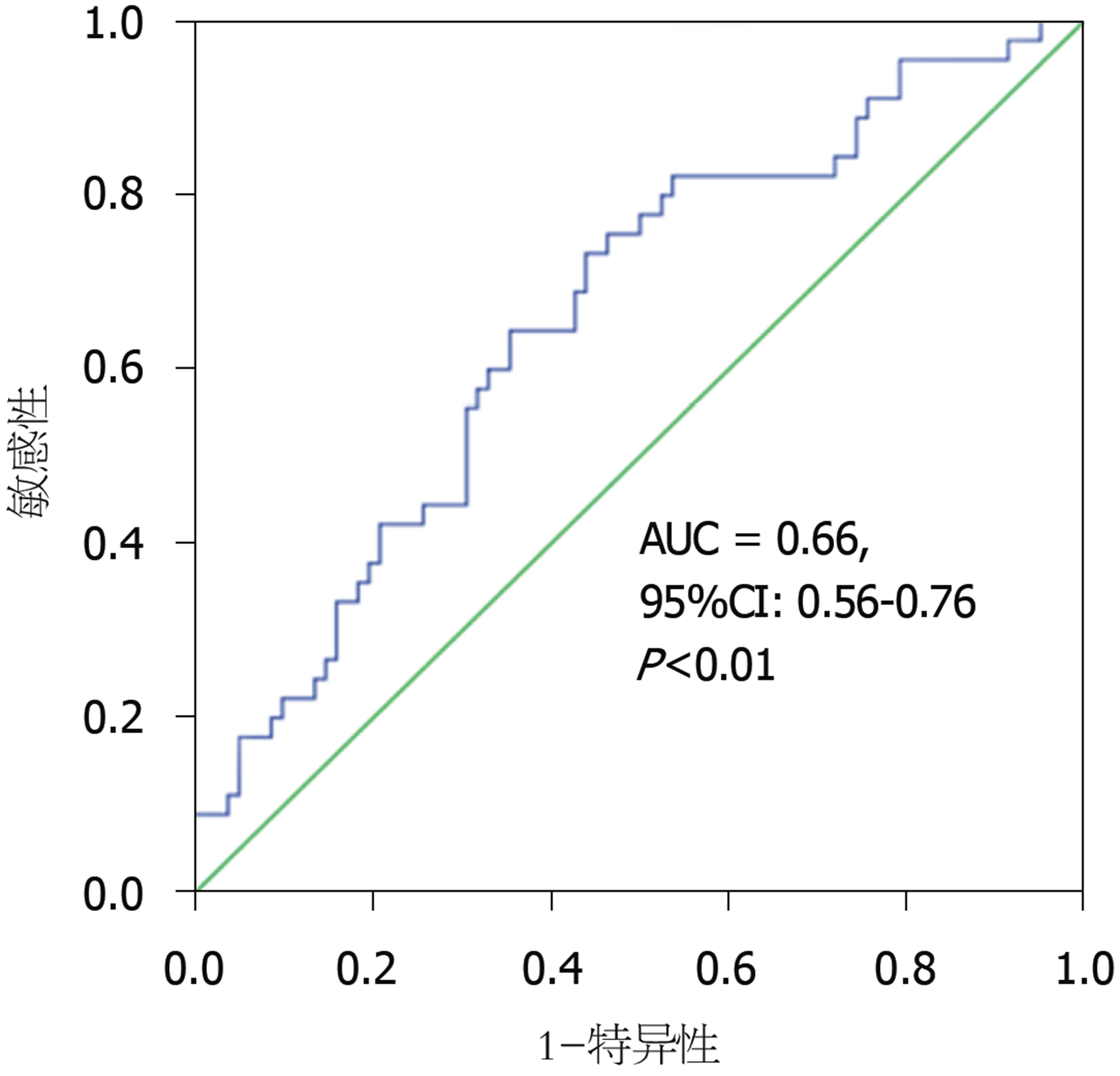
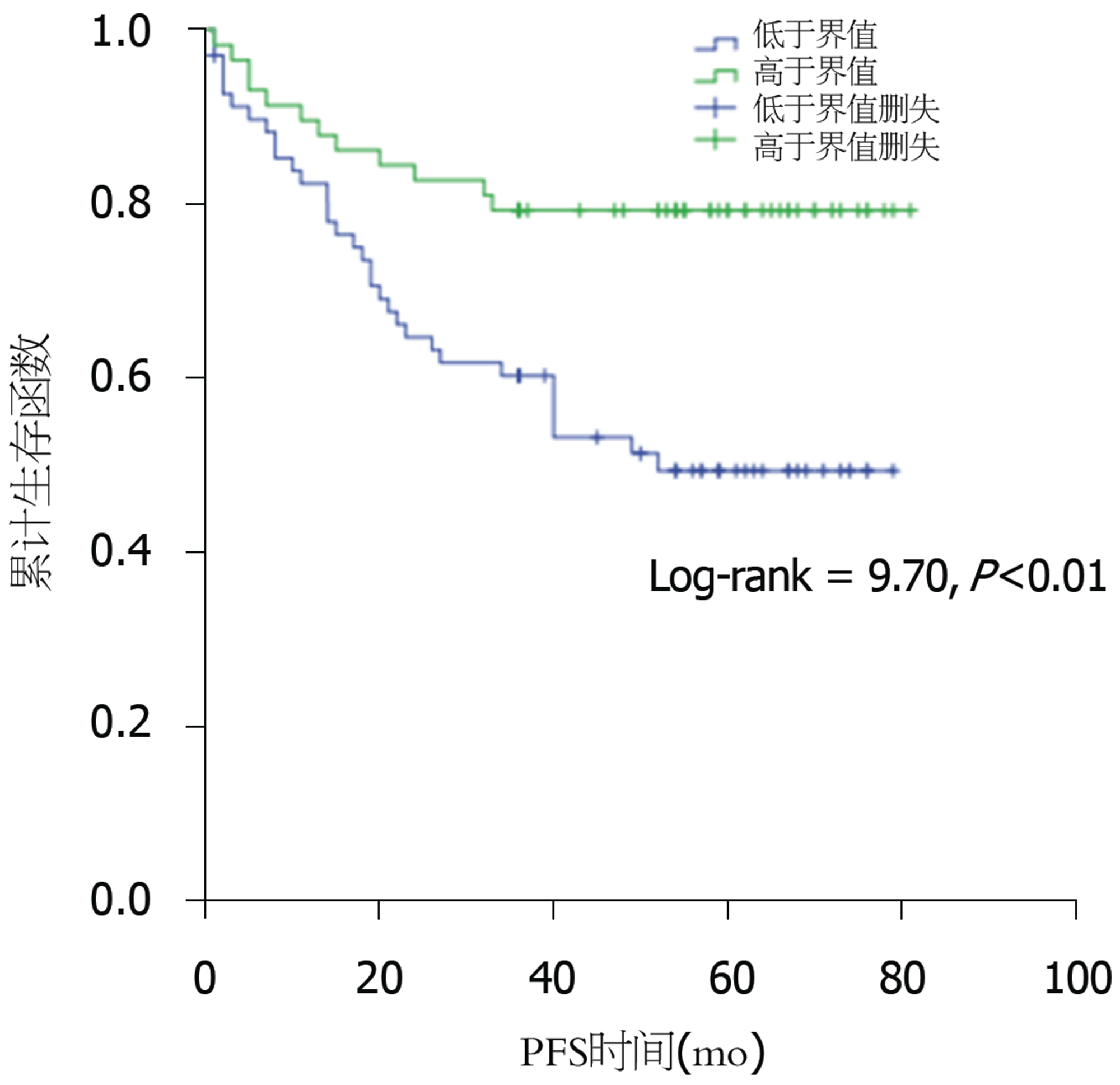
(1)PTR对患者3年PFS存在一定价值(AUC = 0.66, 95%CI: 0.56-0.76, P<0.01), 当其取值为57.27时, 其对3年PFS预测的敏感性73.30%, 特异性为56.10%; (2)以57.27为界, PTR高于界值的患者预后较好(Log-rank = 9.70, P<0.01), 生存时间明显长于低于界值的患者(50.02 mo±22.33 mo vs 38.46 mo±24.39 mo, t = -2.76, P<0.01); (3)单因素分析显示术前癌胚抗原、糖类抗原199及TNM分期, PTR对患者生存存在影响(P<0.01), 但多因素分析仅显示术前癌胚抗原、N及M分期是独立预测因子.
PTR对CRC患者3年PFS预测存在一定价值, 其中PTR较高的患者生存相对较好, 但PTR不是患者预后的独立预测因子.
核心提要: 术前血小板计数和肿瘤最大径比(platelet count and maximum tumor diameter ratio, PTR)对结直肠癌患者无进展生存期预测存在一定价值, PTR较高的患者预后较好. 虽然单因素分析显示PTR对患者生存存在影响, 但多因素分析未提示其为独立预后因子.
引文著录: 孟宪泽, 颜兵. 术前血小板计数和肿瘤最大径比对结直肠癌患者的预后分析. 世界华人消化杂志 2020; 28(1): 26-32
Revised: December 25, 2019
Accepted: December 29, 2019
Published online: January 8, 2020
Pre-operative platelet count and maximum tumor diameter are useful in predicting the prognosis of colorectal cancer patients, however, it is still largely unknown whether the combination of these two parameters, e.g., the pre-operative platelet count to maximum tumor diameter ratio (PTR), could contribute to prognostic prediction for these patients.
To explore the prognostic role of pre-operative PTR in predicting the 3-year progression free survival (PFS) in colorectal cancer patients.
A total of 127 patients who were pathologically confirmed with adenocarcinoma and underwent surgery were collected from December 2012 to June 2019 at Hainan Hospital of PLA General Hospital. The PTR was calculated and its prognostic significance for PFS were analyzed.
PTR displayed appreciated prediction value for the patients (AUC = 0.66, 95%CI: 0.56-0.76, P < 0.01), and when the cut-off value point was set at 57.27, it had a sensitivity and specificity of 73.30% and 56.10%, respectively. Patients with a high PTR had a better prognosis (log rank = 9.70, P < 0.01) and much longer PFS (50.02 mo ± 22.33 mo vs 38.46 mo ± 24.39 mo, t = -2.76, P < 0.01) than those with a low PTR. Univariate analysis showed that pre-operative carcinoembryonic antigen (CEA), carbohydrate antigen 199, TNM stage, and PTR could influence the PFS (P < 0.01), but only pre-operative CEA, N stage, and M stage were identified to be independent prognostic factors by multivariate analysis.
PTR is helpful in predicating the 3-year PFS for colorectal cancer patients. An elevated PTR correlates with a good survival, but it is not an independent prognostic factor.
- Citation: Meng XZ, Yan B. Prognostic implications of pre-operative platelet count to maximum tumor diameter ratio for colorectal cancer. Shijie Huaren Xiaohua Zazhi 2020; 28(1): 26-32
- URL: https://www.wjgnet.com/1009-3079/full/v28/i1/26.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i1.26
结直肠癌(colorectal cancer, CRC)是严重威胁我国人民生命健康的恶性肿瘤之一, 具有很高的发病率和死亡率[1]. 遗憾的是目前对于中晚期患者仍缺乏治愈手段, 如何准确判断这部分患者预后, 进而为其治疗决策提供必要参考是研究的热点之一.
血小板是人体止血和血栓形成等生理病理过程重要参与者之一, 同时在促进肿瘤转移和新生血管形成等方面也具有重要作用[2]. 近年来研究发现血小板计数对肺癌、胃癌、胰腺癌、乳腺癌、卵巢癌等恶性肿瘤预后判断存在一定价值[3-7]. 在CRC研究中, 血小板计数也被证实和患者血清血管内皮生长因子(肿瘤新生血管重要调控因子[8])浓度成正相关[9], 同样也是患者预后的指标之一[10-12], 但也存在敏感性和特异性较低、截点不一等问题[12]; 除此之外, 近年来报道肿瘤最大径也是影响患者预后的重要因素之一[13,14].
截止至目前, 联合术前血小板计数和肿瘤最大径两项参数能否判断CRC患者预后目前尚未见报道. 在前期研究中, 本课题组发现术前血小板计数和肿瘤最大径之比(platelet count to maximum tumor diameter ratio, PTR)对非转移性胃癌患者的预后预测价值[15], 本研究旨在分析PTR对CRC患者3年无疾病进展生存期(progression free survival, PFS)的价值.
收集解放军总医院海南医院自2012-12/2019-06经手术病理证实的结直肠腺癌病例, 排除术前接受任何方式新辅助治疗的患者; 排除术后病理证实为原位癌、复发癌、多处癌或既往合并恶性疾病的患者; 排除术前合并明显影响血小板计数疾患, 包括各类血液系统疾病、心肝肺等脏器病变长期服用药物(如阿司匹林、氯吡格雷等)、活动性感染、自身免疫性疾病长期服用激素等患者. 本研究获得解放军总医院海南医院伦理委员会批准(批准号: 301HNFYLL15).
1.2.1 术前血常规、生化指标和临床病理资料收集: 采用清晨空腹采血的方法收集术前2-4 wk内血常规中血小板计数(参考范围: 100×109/L-300×109/L), 若患者术前存在2个以上血小板计数结果, 则选取最临近手术日数值. 根据住院病历收集患者性别、年龄、术前肿瘤标记物癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原199(carbohydrate antigen 199, CA199)等数据. 根据患者术后病理报告记录TNM分期(根据AJCC第七版)和肿瘤最大径(cm), 并据此计算PTR[15].
1.2.2 患者随访及PFS: 术后对患者常规进行随访, 间期为术后1-2年每3-6 mo随访1次, 术后2年以上每半年随访1次. PFS定义为患者术后至出现任何位置的疾病复发、转移(经影像学资料证实)或死亡, 最终随访时间为2019-11.
统计学处理 所有数据均采用SPSS 19.0进行分析, 所有数据均由两位独立医师录入. PTR对患者预后价值采用受试者工作特征曲线(receiver operating characteristic curve, ROC)分析; 其在临床病理参数中的差异采用χ2检验(或Fisher'确切概率法)和t检验. 不同PTR对PFS影响采用Kaplan-Meier分析, 组间不同采用Log-rank分析. 双侧P<0.05认为具有统计学意义.
经筛选后共收集患者127例, 其中男性例81例, 女性46例, 男女比1.76:1.00. 患者平均年龄58.76岁(范围24-85岁), 其中Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期患者分别为21例、50例、42例和14例.
根据ROC曲线计算, PTR对患者3年PFS预测存在意义(AUC = 0.66, 95%CI: 0.56-0.76, P<0.01)(图1), 当其取值为57.27时, 其对3年PFS预测的敏感性73.30%, 特异性为56.10%.
根据ROC曲线约登指数, 以57.27为界, 将PTR分为低于界值和高于界值两组, 进一步分析其在不同临床病理参数中的差异, 结果显示PTR在不同的CEA、T分期等存在差异(表1).
| 参数 | n | PTR | χ2/t | P值 | |
| 低组 | 高组 | ||||
| 性别 | <0.01 | 1.00 | |||
| 男 | 81 | 44 | 37 | ||
| 女 | 46 | 25 | 21 | ||
| 年龄 | 2.18 | 0.14 | |||
| ≥60岁 | 66 | 40 | 26 | ||
| <60岁 | 61 | 29 | 32 | ||
| 肿瘤位置 | 3.08 | 0.08 | |||
| 右半 | 36 | 24 | 12 | ||
| 左半 | 91 | 45 | 46 | ||
| 病理分化程度 | 1.61 | 0.45 | |||
| 低分化 | 26 | 17 | 9 | ||
| 中分化 | 97 | 50 | 47 | ||
| 高分化 | 4 | 2 | 2 | ||
| CEA状态 | 10.57 | <0.01a | |||
| 正常 | 84 | 37 | 47 | ||
| 升高 | 43 | 32 | 11 | ||
| CA199状态 | 1.82 | 0.18 | |||
| 正常 | 103 | 53 | 50 | ||
| 升高 | 24 | 16 | 8 | ||
| T分期 | 12.87 | <0.01a | |||
| Ⅰ+Ⅱ | 26 | 6 | 20 | ||
| Ⅲ+Ⅳ | 101 | 63 | 38 | ||
| N分期 | 0.58 | 0.45 | |||
| 0 | 72 | 37 | 35 | ||
| 1+2 | 55 | 32 | 23 | ||
| M分期 | 0.81 | 0.37 | |||
| 0 | 115 | 61 | 54 | ||
| 1 | 12 | 8 | 4 | ||
| TNM分期 | 0.32 | 0.57 | |||
| Ⅰ+Ⅱ | 71 | 37 | 34 | ||
| Ⅲ+Ⅳ | 56 | 32 | 24 | ||
| 术后治疗 | 4.30 | 0.04a | |||
| 有 | 76 | 47 | 29 | ||
| 无 | 51 | 22 | 29 | ||
通过Kaplan-Meier生存分析可以看出, PTR较高的患者预后优于较低的患者(Log-rank = 9.70, P<0.01), 较高PTR组患者PFS时间长于较低的患者(50.02 mo±22.33 mo vs 38.46 mo±24.39 mo, t = -2.76, P<0.01)(图2). 单因素分析显示术前CEA、CA199及T、N、M和TNM分期, PTR对患者生存存在影响(P<0.01), 但多因素分析仅显示术前CEA、N及M分期是独立预测因子(表2).
| 单因素 | 多因素 | |||||
| P值 | HR | 95%CI | P值 | HR | 95%CI | |
| 性别 | 0.25 | 1.41 | 0.78-2.55 | |||
| 年龄分层 | 0.23 | 1.44 | 0.79-2.62 | |||
| 肿瘤位置 | 0.40 | 1.36 | 0.67-2.74 | |||
| 肿瘤细胞分化程度 | 0.31 | 0.72 | 0.38-1.36 | |||
| CEA状态 | <0.011 | 3.68 | 2.03-6.68 | <0.011 | 2.79 | 1.51-5.16 |
| CA199状态 | <0.011 | 4.16 | 2.27-7.66 | |||
| T分期合并 | <0.011 | 6.58 | 1.59-27.16 | |||
| N分期合并 | <0.011 | 3.57 | 1.92-6.66 | <0.011 | 2.83 | 1.50-5.34 |
| M分期 | <0.011 | 9.25 | 4.52-18.95 | <0.011 | 5.51 | 2.61-11.61 |
| TNM分期合并 | <0.011 | 3.78 | 2.01-7.13 | |||
| 辅助治疗 | 0.05 | 0.53 | 0.28-1.01 | |||
| PTR | <0.011 | 0.98 | 0.97-1.00 | |||
本研究发现对于CRC患者而言, 较高PTR在CEA升高和较高的T分期患者中比率较低, 总体上PTR较高的患者3年PFS优于较低的患者, 研究结果提示PTR辅助判断CRC患者预后具有一定价值.
血小板在调控止血和血栓形成等生理病理过程具有重要作用, 同时也被发现能促进肿瘤转移和新生血管形成[2]. 在胃肠道恶性肿瘤中, Heras等[4]纳入250例经手术治疗的胃癌患者进行回顾性分析, 发现术前血小板计数随肿瘤分期增加和淋巴结转移正相关, 血小板计数正常的患者1年死亡率为25.2%, 而存在血栓的患者则为52.1%; Oh等[16]通过对4643例行胃癌根治术后患者进行回顾性分析, 发现术前血小板计数升高和术后1年血小板计数较术前升高≥10%的患者总生存较差. 在CRC研究中, Wan等[11]通过收集1513例经手术治疗的不同分期患者, 发现术前血小板计数升高的患者局部复发率高、远期生存时间短, 有意思的是该研究还发现在术后长期生存和没有局部复发的患者中随访血小板计数会下降; 国内学者Lin等[10]通过收集150例经手术治疗的不同分期的CRC患者, 发现血小板计数和淋巴脉管侵犯、远处转移相关, 术前血小板计数升高的患者5年生存率低于正常的患者(13.30% vs 56.30%). 值得注意的是, 单独血小板计数在预测预后方面仍存在敏感性和特异性欠佳等缺陷, 因而目前大部分的临床研究均倾向于联合其他参数, 包括如淋巴细胞计数[17]、C反应蛋白[18]、红细胞分布宽度[19]进一步准确判断患者预后.
除此之外, 肿瘤最大径近年来也被发现和CRC患者预后相关, 例如Li等[20]通过分析68例经手术切除的样本, 发现肿瘤大小(21.5 mm±1.2 mm)和淋巴结转移正相关; 另一项来自国内学者的研究分析了3971例样本, 发现肿瘤最大径小于4 cm是Ⅰ-Ⅲ期患者独立预后因子[21], 然而单独肿瘤最大径判断患者预后同样存在界值不一等问题[13,14]. 联合分析术前血小板计数和肿瘤最大径是否能进一步判断肿瘤患者预后目前仍缺乏关注, 本课题组前期在分析了该指标在胃癌中的价值, 发现其对预测根治术后患者无疾病进展生存期的敏感性(70.20%)和特异性(64.30%)均较佳, 术前PTR较高的患者的患者预后较好[15]. 在本研究中我们同样发现PTR对CRC患者术后3年PFS预测具有较好的敏感性和特异性, 术前PTR较高的患者预后优于较低的患者, 这和本课题组在胃癌中的研究结论基本一致.
对本研究结果的笔者认为可从以下两方面进行理解, 首先对于术前血小板计数基本相同的患者, 术后肿瘤最大径偏大则PTR低, 患者预后较差, 这和既往肿瘤最大径和患者预后研究结论基本一致[21,22]; 另一方面对于术后肿瘤最大径基本一致的患者, 术前血小板计数高则PTR高, 患者预后较好, 这和既往术前血小板计数和患者预后研究结论有所不同. 笔者认为既往此类研究对血小板计数的截值多大于400×109/L[12], 已超过临床参考范围上限, 而本研究中大于该界值的患者数量仅7例, 在样本选择上有所差异.
本研究尚存在以下不足, 第一、研究样本量较小不能尽可能的排除其他混杂因素, 造成研究结果的偏倚; 第二、从Oh等[16]研究可以看出, 血小板计数是一个动态变化的指标, 在术后一定时间内可能产生波动, 综合分析不同时段的PTR是否能更加准确判断患者预后目前仍无相关研究; 第三、应进一步延长随访时间, 从而可分析PTR对患者长期生存的判断价值.
总之, 本研究发现术前PTR对CRC患者预后判断存在一定价值, 术前PTR较高的患者预后优于较低的患者, 但PTR并不是患者预后的独立预测因子.
预后判断对肿瘤患者而言至关重要. 既往研究表明术前血常规中某些成分和恶性肿瘤患者体内系统炎症反应密切相关, 可为患者预后判断提供一定价值; 除此之外, 恶性肿瘤本身的某些特征, 如肿瘤最大径也被证实可辅助判断患者预后. 值得注意的是, 系统性炎症反应和肿瘤本身某些特征存在密切联系, 目前对于联合两者中的某些参数是否可判断患者预后报道较少.
本研究在既往研究基础上, 选取结直肠癌(colorectal cancer, CRC)患者术前血常规中的血小板计数和术后病理中肿瘤最大径两个参数, 旨在分析两者之比(platelet count and maximum tumor diameter ratio, PTR)对判断患者预后是否存在价值, 研究结果可为临床进一步简单、方便判断患者预后提供参考.
本研究通过收集临床数据后计算PTR, 分析了该值在患者不同临床病理参数中的差异, 并进一步分析其对患者预后判断的价值, 对该指标在CRC中的研究尚属首次.
通过纳入排除标准回顾性收集了127例不同分期结直肠患者临床数据, 计算PTR后通过卡方检验、Kaplan-Meier分析和COX比例风险模型等统计方法, 确认了PTR对CRC患者预后的价值.
本研究研究发现PTR对CRC患者3年无进展生存期判断存在一定价值且具有敏感性和特异性均较高等特点. 分析还发现PTR在不同癌胚抗原水平和T分期中分布存在差异, 总体上PTR较高的患者预后优于较低的患者. 然而, 尽管在单因素分析中显示PTR对生存存在影响, 但多因素分析未能进一步确认其为独立预测因子.
本研究发现首次发现PTR在CRC患者中的预后价值, PTR较高的患者预后较好.
本研究尚存在样本量较小、纳入分析参数较少等不足, 未来需进一步扩大样本量并通过长期随访进一步证实PTR对CRC患者长期生存的价值.
学科分类: 胃肠病学和肝病学
手稿来源地: 海南省
同行评议报告分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 2. | Bambace NM, Holmes CE. The platelet contribution to cancer progression. J Thromb Haemost. 2011;9:237-249. [PubMed] [DOI] |
| 3. | Yu D, Liu B, Zhang L, DU K. Platelet count predicts prognosis in operable non-small cell lung cancer. Exp Ther Med. 2013;5:1351-1354. [PubMed] [DOI] |
| 4. | Heras P, Hatzopoulos A, Kritikos N, Kritikos K. Platelet count and tumor progression in gastric cancer patients. Scand J Gastroenterol. 2010;45:1005-1006. [PubMed] [DOI] |
| 5. | Brown KM, Domin C, Aranha GV, Yong S, Shoup M. Increased preoperative platelet count is associated with decreased survival after resection for adenocarcinoma of the pancreas. Am J Surg. 2005;189:278-282. [PubMed] [DOI] |
| 6. | Gu ML, Yuan CJ, Liu XM, Zhou YC, Di SH, Sun FF, Qu QY. Pre-treatment Elevated Platelet Count Associates with HER2 Overexpression and Prognosis in Patients with Breast Cancer. Asian Pac J Cancer Prev. 2015;16:5537-5540. [PubMed] [DOI] |
| 7. | Eggemann H, Ehricke J, Ignatov T, Fettke F, Semczuk A, Costa SD, Ignatov A. Platelet Count After Chemotherapy is a Predictor for Outcome for Ovarian Cancer Patients. Cancer Invest. 2015;33:193-196. [PubMed] [DOI] |
| 8. | Grothey A, Galanis E. Targeting angiogenesis: progress with anti-VEGF treatment with large molecules. Nat Rev Clin Oncol. 2009;6:507-518. [PubMed] [DOI] |
| 9. | George ML, Eccles SA, Tutton MG, Abulafi AM, Swift RI. Correlation of plasma and serum vascular endothelial growth factor levels with platelet count in colorectal cancer: clinical evidence of platelet scavenging? Clin Cancer Res. 2000;6:3147-3152. [PubMed] |
| 10. | Lin MS, Huang JX, Zhu J, Shen HZ. Elevation of platelet count in patients with colorectal cancer predicts tendency to metastases and poor prognosis. Hepatogastroenterology. 2012;59:1687-1690. [PubMed] [DOI] |
| 11. | Wan S, Lai Y, Myers RE, Li B, Hyslop T, London J, Chatterjee D, Palazzo JP, Burkart AL, Zhang K, Xing J, Yang H. Preoperative platelet count associates with survival and distant metastasis in surgically resected colorectal cancer patients. J Gastrointest Cancer. 2013;44:293-304. [PubMed] [DOI] |
| 12. | Long Y, Wang T, Gao Q, Zhou C. Prognostic significance of pretreatment elevated platelet count in patients with colorectal cancer: a meta-analysis. Oncotarget. 2016;7:81849-81861. [PubMed] [DOI] |
| 13. | Yan Q, Zhang K, Guo K, Liu S, Wasan HS, Jin H, Yuan L, Feng G, Shen F, Shen M, Ma S, Ruan S. Value of tumor size as a prognostic factor in metastatic colorectal cancer patients after chemotherapy: a population-based study. Future Oncol. 2019;15:1745-1758. [PubMed] [DOI] |
| 14. | Santullo F, Biondi A, Cananzi FCM, Fico V, Tirelli F, Ricci R, Rizzo G, Coco C, Mattana C, D'Ugo D, Persiani R. Tumor size as a prognostic factor in patients with stage IIa colon cancer. Am J Surg. 2018;215:71-77. [PubMed] [DOI] |
| 15. | 游 俊浩, 崔 美琦, 颜 兵. 术前血小板计数和肿瘤最大径比对非转移性胃癌患者的预后作用. 消化肿瘤杂志(电子版). 2019;11:118-122. [DOI] |
| 16. | Oh SE, Seo JE, An JY, Lee JH, Sohn TS, Bae JM, Kim S, Choi MG. Prognostic Impact of Increased Perioperative Platelet Count in Gastric Cancer Patients. J Surg Res. 2019;242:296-303. [PubMed] [DOI] |
| 17. | Pedrazzani C, Mantovani G, Fernandes E, Bagante F, Luca Salvagno G, Surci N, Campagnaro T, Ruzzenente A, Danese E, Lippi G, Guglielmi A. Assessment of neutrophil-to-lymphocyte ratio, platelet-to-lymphocyte ratio and platelet count as predictors of long-term outcome after R0 resection for colorectal cancer. Sci Rep. 2017;7:1494. [PubMed] [DOI] |
| 18. | Saito H, Kono Y, Murakami Y, Shishido Y, Kuroda H, Matsunaga T, Fukumoto Y, Osaki T, Ashida K, Fujiwara Y. Prognostic Significance of Platelet-Based Inflammatory Indicators in Patients with Gastric Cancer. World J Surg. 2018;42:2542-2550. [PubMed] [DOI] |
| 19. | Bilgin B, Sendur MAN, Hizal M, Dede DS, Akinci MB, Kandil SU, Yaman S, Yalçin A, Kiliç M, Yalçin B. Prognostic effect of red cell distribution width-to-platelet ratio in colorectal cancer according to tumor stage and localization. J Cancer Res Ther. 2019;15:54-60. [PubMed] [DOI] |
| 20. | Li H, Huang D, Jiang L, Yao J, He H, Yao P, Liao X. Tumor budding and size as risk factors of lymph node metastasis in early colorectal cancer. Int J Clin Exp Med. 2016;9:11907-11912. |
| 21. | Li X, An B, Ma J, He B, Qi J, Wang W, Qin C, Zhao Q. Prognostic Value of the Tumor Size in Resectable Colorectal Cancer with Different Primary Locations: A Retrospective Study with the Propensity Score Matching. J Cancer. 2019;10:313-322. [PubMed] [DOI] |
| 22. | Palmieri LJ, Fihri A, Doat S, Dubreuil O, Manceau G, Karoui M, Wagner M, Lucidarme O, Bachet JB. Tumor-size responses to first-line is a predictor of overall survival in metastatic colorectal cancer. Eur Radiol. 2019;29:3871-3880. [PubMed] [DOI] |