修回日期: 2018-12-25
接受日期: 2019-01-10
在线出版日期: 2019-05-08
Peutz-Jeghers综合征(peutz-jeghers syndrome, PJS)是一种常染色体显性遗传疾病, 目前已被证实的致病基因为STK11. 该病的特征性表现为皮肤黏膜色素斑、消化道多发错构瘤性息肉及肿瘤易感性. 基于目前研究报道, STK11胚系突变可能通过干扰正常的细胞凋亡、细胞分裂G1期阻滞、细胞极化及细胞间质水平的细胞增殖抑制等导致了PJS消化道息肉及恶性肿瘤的发生. 治疗消化道息肉及息肉相关并发症是干预该病的主要手段. 近年来, 气囊辅助小肠镜治疗PJS小肠息肉经验不断积累、安全性得到了充分认可, 使得大部分患者避免了外科开腹手术, 这对改善了患者生活质量及远期预后有重要意义. 另外, 针对PJS随年龄增长消化道息肉生长特点及显著增加消化道及非消化道恶性肿瘤风险, 我们按照年龄阶段进行有差别有针对的随访策略.
核心提要: Peutz-Jeghers综合征(peutz-jeghers syndrome, PJS)消化道息肉的生长及肿瘤的发生均与年龄密切相关, 建议分年龄段采取不同随访策略. 气囊辅助小肠镜小肠息肉切除对预防、解除息肉相关并发症及避免外科开腹手术的价值不可替代, 尤其对于少儿PJS患者的小肠息肉的治疗.
引文著录: 李白容, 孙涛, 蒋宇亮, 宁守斌. Peutz-Jeghers综合征发病机制及临床诊治研究进展. 世界华人消化杂志 2019; 27(9): 576-582
Revised: December 25, 2018
Accepted: January 10, 2019
Published online: May 8, 2019
Peutz-Jeghers syndrome (PJS), an autosomal dominant inherited disease, is caused by germinal mutations of the STK11. It is characterized by gastrointestinal hamartomas, mucocutaneous pigmentation and increased cancer risk. Germline mutations in STK11 cause a harmful effect on cell apoptosis, G1 arrest, and cell polarization, which leads to polyp formation and cancer occurrence. Balloon-assisted enteroscopy is widely used in removal of PJS polyps in the small bowel and it is proved to be safe and effective. We suggest to screen polyps and cancer in PJS patients, which seems to benefit these patients in the long run.
- Citation: Li BR, Sun T, Jiang YL, Ning SB. Pathogenesis, diagnosis, and treatment of Peutz-Jeghers syndrome. Shijie Huaren Xiaohua Zazhi 2019; 27(9): 576-582
- URL: https://www.wjgnet.com/1009-3079/full/v27/i9/576.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i9.576
Peutz-Jeghers综合征(peutz-jeghers syndrome, PJS)是一种常染色体显性遗传疾病, 其特征性表现为皮肤黏膜色素斑、消化道多发错构瘤性息肉及肿瘤易感性. 国外统计PJS发病率约为1/50000-1/200000[1]; 该病在我国并非罕见, 粗略估计我国目前患病人数约有6500人左右, 具体发病率及患病率不详, 随着对该病认识的增加以及以小肠镜为代表的临床诊治技术的发展成熟, PJS患者的治疗方式有了实质性的改变.
通常认为PJS的发生与生殖细胞系的STK11突变有关, 研究认为约90%PJS病例存在该基因的突变[2,3]; 联合应用直接DNA测序、多重连接依赖式探针扩增检测大片段基因缺失及其他手段检测mRNA水平等技术, 家族性PJS患者STK11突变阳性率为100%, 而符合临床诊断标准的PJS患者中STK11的阳性率为50%-90%[4-6].
目前在人类基因突变数据库(human gene mutation database, HGMD)中已鉴定出的STK11致病突变共有396种, 绝大多数为微小突变. 不同突变类型对PJS的疾病演变的作用存在差异: Scott等[7]发现STK11外显子5上trp239-to-cys (W239C)的杂合突变者发病年龄较晚; Forcet等发现STK11基因外显子8杂合突变的男性PJS仅表现为大量的黑斑而无胃肠道息肉[8]; STK11的ATP结合及催化部位编码突变者在病程中很少发生恶性肿瘤, 而突变发生在底物识别位点者恶性肿瘤风险明显增加[9]; 另外, STK11发生截短突变者有多发息肉及恶性肿瘤的倾向, 常常需要接受更多外科手术治疗[9]. 近期我们的研究显示c.180C>G与其他突变相关特征比较首次发病年龄和首次手术年龄≤7岁的比例明显高于其他类型突变, 该突变导致编码STK11蛋白激酶第60位氨基酸形成终止密码子(TAC→TAG), 进而产生截断蛋白[10].
部分PJS患者在现有检测技术条件下仍不能检出STK11突变, PJS可能存在其他致病基因. Mehenni等[11]通过对6个家系进行全基因组连锁分析后发现19q13.4上可能存在新的PJS致病基因; 而Buchet-Poyau等[12]通过全外显子及外显子-内含子连接区的突变分析否定了Mehenni等[11]的推论. 目前仍不能完全除外基因启动子、增强子等序列的未知突变与PJS相关[5]. 总之, STK11是目前唯一确认的PJS致病基因, 但不能完全除外存在其他PJS致病基因的存在[13].
STK11在胚胎组织及成体组织中广泛表达, 但表达水平存在一定的差异. 生长发育阶段, 心脏、食管、胰腺、肾脏、结肠、肺部、小肠和胃组织中STK11表达上升. 成体组织中, 上皮细胞、卵巢卵泡及黄体、睾丸细精管、骨骼肌肌细胞及神经胶质细胞中STK11表达水平高. PJS恶性肿瘤易感部位与STK11表达水平高的部位具有较好的一致性.
STK11的表达水平、定位及其效应通路中上下游分子共同决定了其生物效应的发挥. STK11蛋白在人体组中广泛分布, 其在细胞内的分布于细胞质、细胞核, 并且在细胞凋亡时向线粒体转移. 研究证实LIP1可通过调节STK11蛋白的定位而调节其功能的发挥[14]; STRAD也是与STK11定位的相关分子, 它可将非突变STK11蛋白由核内定位至细胞质, 从而将分裂阻滞在G1期, 而突变的STK11不受LIP1对定位的调节[15]. 另外, PTEN也是与STK11蛋白在细胞质中重新定位相关的分子, STK11上与PTEN相互作用的位点的基因突变也可导致PJS的发生[16].
STK11是一种抑癌基因, 它在细胞质内通过p-53依赖的调节途径诱导p21的产生, 从而抑制细胞增殖[17]; 在STK11蛋白缺乏的肿瘤细胞系内恢复STK11活性可使细胞阻滞于G1期[18]; 另外, STK11缺陷的间充质细胞产生的TGF-β减少, 其细胞增殖水平出现同步上调[19]. STK11突变导致细胞极性紊乱也与PJS瘤体形成有关[15,20]. 也有研究从表观遗传水平对STK11突变的PJS机制进行了初步探索: STK11基因缺陷增加了细胞系甲基化的多样性, 可能会增加基因偶发突变累积, 这一效应可能在PJ的发生及癌变过程中发挥了重要作用[21]. 基于目前研究报道, STK11突变从减少细胞凋亡、G1期阻滞效应下调、扰乱细胞极化及破坏基质水平抑癌效应等方面导致了PJS及其相关肿瘤的发生.
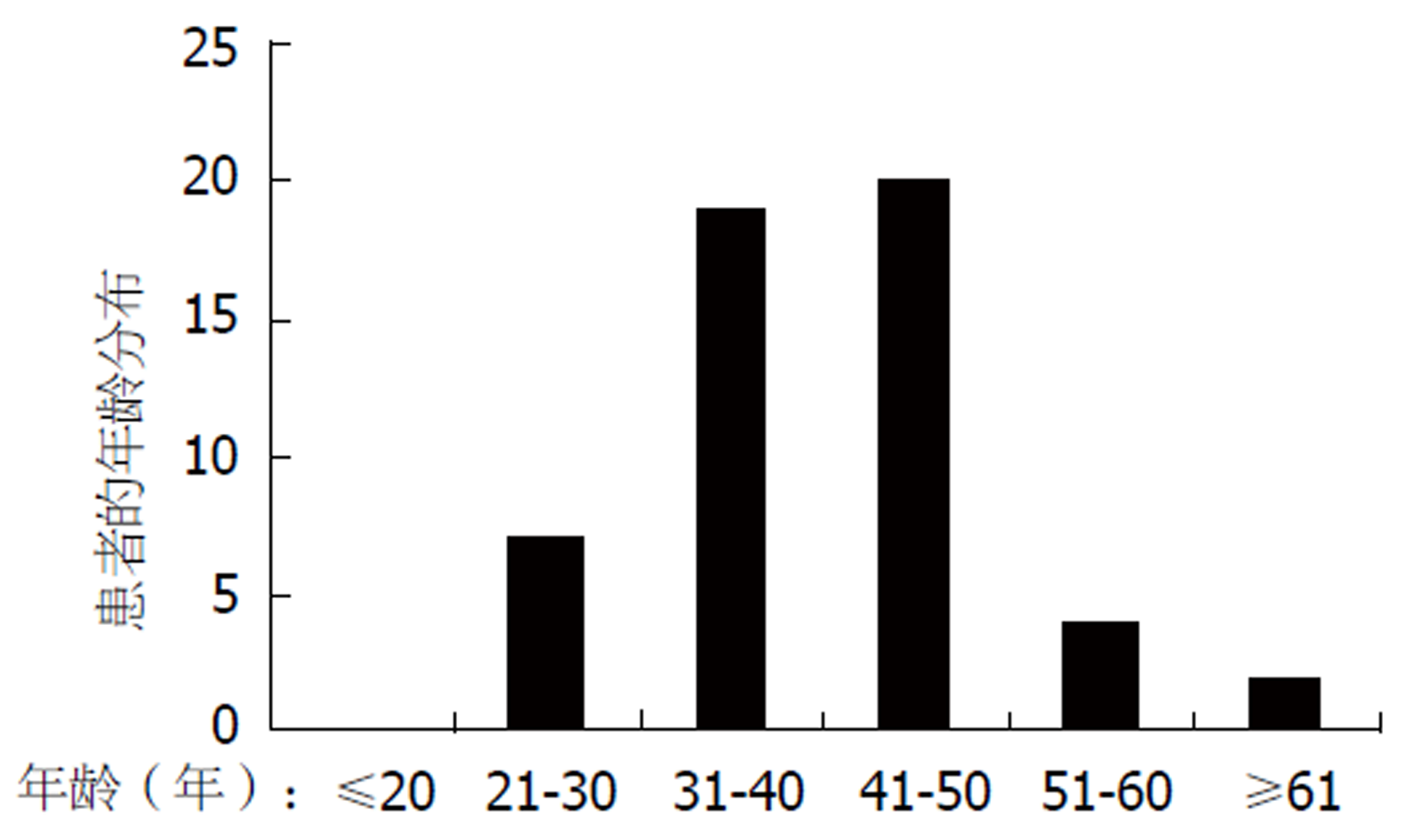
PJS的特征性表现是皮肤黏膜色素斑、消化道错构瘤性息肉及肿瘤易感性. 超过95%的患者出现皮肤黏膜色素斑, 常常在婴儿期开始出现, 分布于口周、颊黏膜、面部、前臂、手掌、脚掌及肛周等. PJS患者约88%-100%消化道发生错构瘤性息肉, 此种息肉多呈分叶状生长、黏膜肌层过度增生伸展入固有肌层而形成树枝样分叉, 息肉表面被覆正常上皮[22]. 我中心数据显示PJS小肠息肉常见部位依次为近段小肠(十二指肠及空肠上段)、中段小肠、结肠及远端小肠[23]. PJS错构瘤息肉从婴幼儿开始生长, 胃肠道息肉相关并发症如息肉溃疡出血、肠扭转、肠套叠及肠梗阻等出现的中位年龄为11-13岁, 而发生肠套叠的中位年龄为15岁, 三分之一左右患者在10岁以前接受外科手术治疗[24-26]. 我中心总结217例PJS患者临床特征显示PJS患者首次出现临床症状的平均年龄为13.7岁±7.9岁, 首次发现息肉的平均年龄为15.7岁±8.5岁, 94.0%患者在18岁前出现临床症状, 首次开腹手术的平均年龄为16.5岁±7.4岁, 其中7岁之前开腹人数较少, 7岁之后呈明显上升趋势, 15-18岁是开腹高峰年龄段, 30岁以后开腹人数极少, 提示息肉生长速度与年龄密切相关, 青春期息肉生长速度快, 更容易并发肠套叠肠梗阻而接受开腹手术[23]. 流行病学及分子遗传学证据表明, PJS患者一生中发生恶性肿瘤的风险约为60%, 50岁以后恶性肿瘤风险急剧增加[27,28], 尤以胃、小肠和结直肠肿瘤最为常见[29-32]. 消化道以外乳腺癌及胰腺癌最常见, 其他包括宫颈癌、卵巢癌、骨肉瘤和胆管癌也属于PJS肿瘤谱[29,33]. 2010年荷兰学者van Lier等[32]对21篇研究的1644厘PJS患者的恶性肿瘤风险进行了系统评价, 结果发表于Am J Gastroenterol杂志: 随访期间349例患者发生恶性肿瘤, 肿瘤发生平均年龄为42岁; PJS者恶性肿瘤的风险随年龄增长显著增加, 累积风险率为37%-93%, 其风险为普通人群的 9.9-18倍. 随后van Lier等[32]对荷兰全国133例PJS患者恶性肿瘤发生情况进行回顾性总结分心: 随访期内42人(32%)发生恶性肿瘤, PJS患者40岁和70岁时恶性肿瘤发生率分别为20%和76%; PJS的恶性肿瘤发生风险是普通人群的8.96倍, 且女性显著高于男性, 风险高达20.4倍[2]. 我中心随访336例PJS发现有52例出现恶性肿瘤, 发病中位年龄为41岁, 恶性肿瘤相对危险度为63.858, PJS人群60岁时恶性肿瘤累积风险为55%; 结直肠癌发病率最高, 到60岁时累计风险为28%[34](图1). 恶性肿瘤是影响PJS患者生存时间的重要因素, STK11基因突可能与PJS的恶性肿瘤发生直接相关[35].
绝大多数PJS患者发生消化道息肉, 及时发现并切除体积较大的息肉, 可有效减少肠套叠、肠梗阻及消化道出血的发生率, 同时可以预防息肉癌变, 是目前改善PJS患者生活质量及预后最重要的手段[36].
消化道钡餐、常规CT/MRI检查发现病变的敏感性欠佳; 小肠胶囊内镜虽然依从性好, 但其对病变的定位准确性不佳且对大息肉的漏检率可高达20%, 尤其是近端小肠的病变, 这些都导致其在PJS中的应用价值颇具争议[24,37,38], 推荐作为无症状PJS患者息肉筛查及随访的方法[1]. 常规胃肠镜联合小肠镜可实现全消化道的全面准确评价, 且能同步进行组织活检及治疗, 但其有创性及较高费用限制了它在PJS诊断中的普及. 近年来CT小肠成像及MR小肠成像可检出并定位>10 mm的肠道息肉, 特别对多发性小肠息肉、息肉供血动脉及肠套叠、肠梗阻的诊断价值高, 国外甚至主张使用MR小肠成像联合胶囊内镜作为诊断及全方位评估PJS的策略[39,40]. 我中心开展小肠充气螺旋CT三维重建及仿真内镜来评价小肠息肉大小、形态及分布, 初步经验表明其与小肠镜的结果吻合度高、能够比较准确地判断胃肠道的息肉数量、大小、位置, 可作为患者治疗方式选择的依据, 尤其对小肠镜检查/治疗优选经口/经肛具有指导价值[41].
PJS患者消化道息肉多发性且不断生长、有癌变倾向, 需要进行长期监测及反复治疗. 指南建议对息肉病变进行早期干预, 避免被动地治疗息肉相关并发症及反复外科手术造成的后续诊治困境[42,43]. 指南推荐对大于15 mm的胃肠道息肉进行治疗[25], 也有学者认为应尽可能切除所有息肉来降低后续手术治疗的风险[44]. 胃及结肠的息肉通过内镜下治疗通常难度不大, 但可疑息肉癌变时不宜勉强行内镜下切除, 应结合组织活检及影像学情况决定治疗方式. 对于小肠息肉摘除目前首选气囊辅助小肠镜(balloon assisted enteroscopy, BAE), 其创伤小、可反复行镜下治疗, 镜下息肉切除术相关并发症发生率为0%-3%[45-48], 使绝大多数患者避免了外科开腹手术[49-51]. 我们的经验: 对于长蒂息肉可直接进行圈套切除, 而短蒂、宽基底息肉需进行黏膜下注射后行圈套切除或分块切除, 以减少小肠穿孔、出血的发生; 一次切除较大广基息肉(直径>3 cm)数息肉的数量不宜超过5枚, 创面需谨慎处理、避免术后出血及穿孔, 具体切除数量仍需根据息肉基底创面处理情况决定; 对于巨大息肉(广基且大于5 cm)常需单独处理, 可以采取分次甚至分期圈套切除; 对于术后残根或创面比较大或易出血的病灶, 可采用APC、钛夹夹闭、尼龙圈缝合等措施以预防出血或穿孔. 此外, 对于息肉过于巨大切除风险过高者、息肉位置过深小肠镜无法抵达或可疑息肉癌变等情况下, 需优先考虑外科手术治疗. 小肠息肉切除术后常规需禁食及抗生素预防感染48-72 h, 根据创面情况及术后症状、体征及炎症指标等延长用药时间.
对于少儿PJS患者, 内镜下预防性切除胃肠道尤其是小肠息肉对避免严重并发症、避免开腹手术有重要临床意义; 但因其肠腔直径较小、肠壁菲薄, 息肉切除需充分权衡并发症风险及获益, 带蒂息肉需尽可能切除[43]. BAE在少儿PJS患者中的应用受到极大限制, 极少数有经验的中心开展了少儿PJS的小肠镜下治疗. 我中心对50余例PJS患儿进行约150例次小肠镜下息肉治疗, 术后出血发生率约为5%、穿孔率<3%(数据尚未发表). 对于少儿巨大小肠息肉的镜下切除: 首先要充分暴露息肉、准确估计息肉大小, 尤其要清楚显示息肉根部情况; 于息肉根基部充分注射水垫后再小心切除, 少儿息肉较成人息肉切割速度快, 在切除过程中圈套器避免勒得过紧、以防因切割过快引起术中出血; 术后创面尽可能金属夹缝合, 以避免术后迟发性穿孔及出血; 另外, 内镜术前术中需有充分的并发症处理预案并确保外科协作组能随时参与, 发生严重并发症时及时外科干预.
雷帕霉素是一种mTOR抑制剂, 被用于抑制肾移植患者的免疫排斥反应, 其安全性受到广泛认可, 副作用包括口腔溃疡、高血脂、皮疹、痤疮等. STK11表达产物通过AMPK-TSC1/2通路抑制mTOR活性, 从而调控细胞能量代谢. STK11缺陷导致mTOR活性升高, 因此mTOR抑制剂雷帕霉素可能可有效抑制PJS息肉生长[52], 其疗效已经在小鼠PJS模型得到验证[53-57]. 犹他大学的研究者曾启动一个使用雷帕霉素衍生物依维莫司治疗PJS的临床试验, 但由于仅招募到3位符合条件的PJS患者而没有得出有统计学意义的结果(ClinicalTrials.gov Identifier: NCT00811590). 2016年荷兰医学中心的研究者报告了一例使用依维莫司缓解PJS继发胰腺癌的病例, 患者服用9 mg/d依维莫司6 mo后癌组织由11 cm缩小至7 cm, 但在服药9 mo后癌症进程失去控制[58]. 我中心正在进行雷帕霉素/预防治疗PJS消化道息肉的临床研究.
PJS的监测随访指南都是基于对该病相关消化道并发症及肿瘤的经验性认识制定的, 病程早期监测的主要目标是发现息肉并避免相关并发症, 随着年龄的增长, 肿瘤筛查成为随访监测的另一重要目的. 消化道肿瘤的筛查可与息肉筛查同步进行, 而针对睾丸、乳腺等肿瘤推荐每1-2年进行检查[59]. 指南推荐对从8-10岁开始进行消化道息肉的筛查, 筛查结果为阳性者需每2-3年进行复查随访, 筛查结果阴性者下一次基线筛查为18岁, 此后仍是每2-3年一次, 有症状者需随时进行评估[1,13,32]. 然而, 研究显示40%儿童PJS患者在8岁前已发生息肉相关并发症, 包括肠套叠、出血、息肉脱垂及小肠肿瘤[43], 荷兰一项研究显示PJS患者10岁前发生肠套叠的累积风险为15%, 至20岁达到50%[25]. 研究推荐4-5岁开始行胃肠镜及胶囊内镜评估全消化道筛查[43]. 总之, 筛查起点及间期仍缺少统一意见.
我中心自2004年诊治第一例PJS患者以来, 已经累积诊治了400余例PJS患者, 依据我中心的临床数据及流行病学资料提示, PJS小肠息肉的生长及肿瘤的发生均与年龄密切相关: 青春期息肉生长最快, 易导致肠套叠及肠梗阻等严重并发症而接受手术; 30岁以后少有PJS患者接受开腹手术, 但消化道及全身其他器官肿瘤的发生率明显增高. 因此, 针对PJS随访我们建议分年龄段采取不同随访策略(表1). 对于部分PJS患者因各种原因未能按照以上程序自幼儿开始按步骤完成监测者, 首次接诊时务必完成全消化道检查及全身肿瘤监测, 切除消化道所有大于1 cm的息肉, 自此之后再参照以上要求进行随访. 按年龄段定期随访及预防性内镜下治疗息肉的目的在于主动预防肠套叠/肠梗阻及息肉癌变等严重并发症的发生, 避免不必要的外科手术, 并及早发现和治疗全身其他器官的恶性肿瘤.
| 年龄 | 监测 | 干预 |
| 0-7岁 | 无症状: 临床观察/腹部B超; 有症状: 腹部B超 | 切除息肉 |
| 8-11岁 | 每年常规进行腹部B超检查, 有症状及时腹部B超 | 切除息肉 |
| 12-18岁 | 每年行全消化道检查 (小肠CT三维重建、胶囊内镜或小肠镜选择1项检查) | 尽可能对1 cm以上的息肉全部切除 |
| 19-30岁 | 每2-4年定期复查全消化道息肉及筛查全身肿瘤 | 切除息肉, 治疗肿瘤 |
| >30岁 | 重点监控消化道及全身其他器官肿瘤发生 | 治疗肿瘤 |
PJS作为一种常染色体显性遗传性疾病, 由于未及时处理消化道息肉可以引起肠套叠/肠梗阻及癌变等严重并发症, 该病患者具有肿瘤易感性, 这两者往往对生命健康造成巨大威胁, 所以进行科学合理的随访及主动性治疗干预对于PJS患者具有重要意义. 目前BAE在PJS患者小肠息肉诊治中的临床应用价值得以肯定, 大大改善了PJS患者的生活质量及远期预后. 但是, 内镜及手术等治疗均不能预防PJS息肉的复发, 期待对PJS息肉及肿瘤发生机制能有更加深入及系统的认识, 应用特异的靶向药物控制息肉生长或对携带致病基因的个体进行基因层面干预, 实现彻底阻断PJS的息肉及肿瘤发生发展的临床过程.
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:刘继红
| 1. | Beggs AD, Latchford AR, Vasen HF, Moslein G, Alonso A, Aretz S, Bertario L, Blanco I, B¨¹low S, Burn J, Capella G, Colas C, Friedl W, Møller P, Hes FJ, Järvinen H, Mecklin JP, Nagengast FM, Parc Y, Phillips RK, Hyer W, Ponz de Leon M, Renkonen-Sinisalo L, Sampson JR, Stormorken A, Tejpar S, Thomas HJ, Wijnen JT, Clark SK, Hodgson SV. Peutz-Jeghers syndrome: a systematic review and recommendations for management. Gut. 2010;59:975-986. [PubMed] [DOI] |
| 2. | van Lier MG, Westerman AM, Wagner A, Looman CW, Wilson JH, de Rooij FW, Lemmens VE, Kuipers EJ, Mathus-Vliegen EM, van Leerdam ME. High cancer risk and increased mortality in patients with Peutz-Jeghers syndrome. Gut. 2011;60:141-147. [PubMed] [DOI] |
| 3. | de Leng WW, Jansen M, Carvalho R, Polak M, Musler AR, Milne AN, Keller JJ, Menko FH, de Rooij FW, Iacobuzio-Donahue CA, Giardiello FM, Weterman MA, Offerhaus GJ. Genetic defects underlying Peutz-Jeghers syndrome (PJS) and exclusion of the polarity-associated MARK/Par1 gene family as potential PJS candidates. Clin Genet. 2007;72:568-573. [PubMed] [DOI] |
| 4. | Aretz S, Stienen D, Uhlhaas S, Loff S, Back W, Pagenstecher C, McLeod DR, Graham GE, Mangold E, Santer R, Propping P, Friedl W. High proportion of large genomic STK11 deletions in Peutz-Jeghers syndrome. Hum Mutat. 2005;26:513-519. [PubMed] [DOI] |
| 5. | Chow E, Meldrum CJ, Crooks R, Macrae F, Spigelman AD, Scott RJ. An updated mutation spectrum in an Australian series of PJS patients provides further evidence for only one gene locus. Clin Genet. 2006;70:409-414. [PubMed] [DOI] |
| 6. | Papp J, Kovacs ME, Solyom S, Kasler M, Børresen-Dale AL, Olah E. High prevalence of germline STK11 mutations in Hungarian Peutz-Jeghers Syndrome patients. BMC Med Genet. 2010;11:169. [PubMed] [DOI] |
| 7. | Scott RJ, Crooks R, Meldrum CJ, Thomas L, Smith CJ, Mowat D, McPhillips M, Spigelman AD. Mutation analysis of the STK11/LKB1 gene and clinical characteristics of an Australian series of Peutz-Jeghers syndrome patients. Clin Genet. 2002;62:282-287. [PubMed] [DOI] |
| 8. | Forcet C, Etienne-Manneville S, Gaude H, Fournier L, Debilly S, Salmi M, Baas A, Olschwang S, Clevers H, Billaud M. Functional analysis of Peutz-Jeghers mutations reveals that the LKB1 C-terminal region exerts a crucial role in regulating both the AMPK pathway and the cell polarity. Hum Mol Genet. 2005;14:1283-1292. [PubMed] [DOI] |
| 9. | Salloch H, Reinacher-Schick A, Schulmann K, Pox C, Willert J, Tannapfel A, Heringlake S, Goecke TO, Aretz S, Stemmler S, Schmiegel W. Truncating mutations in Peutz-Jeghers syndrome are associated with more polyps, surgical interventions and cancers. Int J Colorectal Dis. 2010;25:97-107. [PubMed] [DOI] |
| 10. | 蒋 宇亮, 李 伟聪, 赵 子夜, 李 白容, 毛 旭艳, 宁 守斌. 中国Peutz-Jeghers综合征患者STK11基因突变检测及高频突变分析. 河北医科大学学报. 2017;38:878-881. [DOI] |
| 11. | Mehenni H, Blouin JL, Radhakrishna U, Bhardwaj SS, Bhardwaj K, Dixit VB, Richards KF, Bermejo-Fenoll A, Leal AS, Raval RC, Antonarakis SE. Peutz-Jeghers syndrome: confirmation of linkage to chromosome 19p13.3 and identification of a potential second locus, on 19q13.4. Am J Hum Genet. 1997;61:1327-1334. [PubMed] [DOI] |
| 12. | Buchet-Poyau K, Mehenni H, Radhakrishna U, Antonarakis SE. Search for the second Peutz-Jeghers syndrome locus: exclusion of the STK13, PRKCG, KLK10, and PSCD2 genes on chromosome 19 and the STK11IP gene on chromosome 2. Cytogenet Genome Res. 2002;97:171-178. [PubMed] [DOI] |
| 14. | Smith DP, Rayter SI, Niederlander C, Spicer J, Jones CM, Ashworth A. LIP1, a cytoplasmic protein functionally linked to the Peutz-Jeghers syndrome kinase LKB1. Hum Mol Genet. 2001;10:2869-2877. [PubMed] [DOI] |
| 15. | Baas AF, Boudeau J, Sapkota GP, Smit L, Medema R, Morrice NA, Alessi DR, Clevers HC. Activation of the tumour suppressor kinase LKB1 by the STE20-like pseudokinase STRAD. EMBO J. 2003;22:3062-3072. [PubMed] [DOI] |
| 16. | Mehenni H, Lin-Marq N, Buchet-Poyau K, Reymond A, Collart MA, Picard D, Antonarakis SE. LKB1 interacts with and phosphorylates PTEN: a functional link between two proteins involved in cancer predisposing syndromes. Hum Mol Genet. 2005;14:2209-2219. [PubMed] [DOI] |
| 17. | Karuman P, Gozani O, Odze RD, Zhou XC, Zhu H, Shaw R, Brien TP, Bozzuto CD, Ooi D, Cantley LC, Yuan J. The Peutz-Jegher gene product LKB1 is a mediator of p53-dependent cell death. Mol Cell. 2001;7:1307-1319. [PubMed] [DOI] |
| 18. | Tiainen M, Vaahtomeri K, Ylikorkala A, Mäkelä TP. Growth arrest by the LKB1 tumor suppressor: induction of p21(WAF1/CIP1). Hum Mol Genet. 2002;11:1497-1504. [PubMed] |
| 19. | Katajisto P, Vaahtomeri K, Ekman N, Ventelä E, Ristimäki A, Bardeesy N, Feil R, DePinho RA, Mäkelä TP. LKB1 signaling in mesenchymal cells required for suppression of gastrointestinal polyposis. Nat Genet. 2008;40:455-459. [PubMed] [DOI] |
| 20. | Martin SG, St Johnston D. A role for Drosophila LKB1 in anterior-posterior axis formation and epithelial polarity. Nature. 2003;421:379-384. [PubMed] [DOI] |
| 21. | Zarrouk M, Rolf J, Cantrell DA. LKB1 mediates the development of conventional and innate T cells via AMP-dependent kinase autonomous pathways. PLoS One. 2013;8:e60217. [PubMed] [DOI] |
| 22. | Shaco-Levy R, Jasperson KW, Martin K, Samadder NJ, Burt RW, Ying J, Bronner MP. Morphologic characterization of hamartomatous gastrointestinal polyps in Cowden syndrome, Peutz-Jeghers syndrome, and juvenile polyposis syndrome. Hum Pathol. 2016;49:39-48. [PubMed] [DOI] |
| 23. | 张 卓超, 李 白容, 李 欣, 宁 守斌, 毛 高平, 张 亚飞, 步 晓华, 唐 杰, 朱 鸣. 色素沉着息肉综合征患者多发性息肉的分布、生长和临床转归规律. 中华消化杂志. 2016;36:593-596. |
| 24. | Tomas C, Soyer P, Dohan A, Dray X, Boudiaf M, Hoeffel C. Update on imaging of Peutz-Jeghers syndrome. World J Gastroenterol. 2014;20:10864-10875. [PubMed] [DOI] |
| 25. | van Lier MG, Mathus-Vliegen EM, Wagner A, van Leerdam ME, Kuipers EJ. High cumulative risk of intussusception in patients with Peutz-Jeghers syndrome: time to update surveillance guidelines? Am J Gastroenterol. 2011;106:940-945. [PubMed] [DOI] |
| 26. | Le Meur N, Martin C, Saugier-Veber P, Joly G, Lemoine F, Moirot H, Rossi A, Bachy B, Cabot A, Joly P, Fr¨¦bourg T. Complete germline deletion of the STK11 gene in a family with Peutz-Jeghers syndrome. Eur J Hum Genet. 2004;12:415-418. [PubMed] [DOI] |
| 27. | Mehenni H, Resta N, Park JG, Miyaki M, Guanti G, Costanza MC. Cancer risks in LKB1 germline mutation carriers. Gut. 2006;55:984-990. [PubMed] [DOI] |
| 28. | Giardiello FM, Brensinger JD, Tersmette AC, Goodman SN, Petersen GM, Booker SV, Cruz-Correa M, Offerhaus JA. Very high risk of cancer in familial Peutz-Jeghers syndrome. Gastroenterology. 2000;119:1447-1453. [PubMed] [DOI] |
| 29. | Su GH, Hruban RH, Bansal RK, Bova GS, Tang DJ, Shekher MC, Westerman AM, Entius MM, Goggins M, Yeo CJ, Kern SE. Germline and somatic mutations of the STK11/LKB1 Peutz-Jeghers gene in pancreatic and biliary cancers. Am J Pathol. 1999;154:1835-1840. [PubMed] [DOI] |
| 30. | Hinds R, Philp C, Hyer W, Fell JM. Complications of childhood Peutz-Jeghers syndrome: implications for pediatric screening. J Pediatr Gastroenterol Nutr. 2004;39:219-220. [PubMed] [DOI] |
| 31. | Hearle N, Schumacher V, Menko FH, Olschwang S, Boardman LA, Gille JJ, Keller JJ, Westerman AM, Scott RJ, Lim W, Trimbath JD, Giardiello FM, Gruber SB, Offerhaus GJ, de Rooij FW, Wilson JH, Hansmann A, Möslein G, Royer-Pokora B, Vogel T, Phillips RK, Spigelman AD, Houlston RS. Frequency and spectrum of cancers in the Peutz-Jeghers syndrome. Clin Cancer Res. 2006;12:3209-3215. [PubMed] [DOI] |
| 32. | van Lier MG, Wagner A, Mathus-Vliegen EM, Kuipers EJ, Steyerberg EW, van Leerdam ME. High cancer risk in Peutz-Jeghers syndrome: a systematic review and surveillance recommendations. Am J Gastroenterol. 2010;105:1258-64; author reply 1265. [PubMed] [DOI] |
| 33. | Ossipova O, Bardeesy N, DePinho RA, Green JB. LKB1 (XEEK1) regulates Wnt signalling in vertebrate development. Nat Cell Biol. 2003;5:889-894. [PubMed] [DOI] |
| 34. | Chen HY, Jin XW, Li BR, Zhu M, Li J, Mao GP, Zhang YF, Ning SB. Cancer risk in patients with Peutz-Jeghers syndrome: A retrospective cohort study of 336 cases. Tumour Biol. 2017;39:1010428317705131. [PubMed] [DOI] |
| 35. | Jansen M, Langeveld D, De Leng WW, Milne AN, Giardiello FM, Offerhaus GJ. LKB1 as the ghostwriter of crypt history. Fam Cancer. 2011;10:437-446. [PubMed] [DOI] |
| 37. | Soares J, Lopes L, Vilas Boas G, Pinho C. Wireless capsule endoscopy for evaluation of phenotypic expression of small-bowel polyps in patients with Peutz-Jeghers syndrome and in symptomatic first-degree relatives. Endoscopy. 2004;36:1060-1066. [PubMed] [DOI] |
| 38. | Manes G, Porro GB. Small-bowel lesions detected by double-balloon enteroscopy performed after negative capsule endoscopy. Gastrointest Endosc. 2009;70:819; author reply 819-819; author reply 820. [PubMed] [DOI] |
| 39. | Korman U, Kurugoglu S, Ogut G. Conventional enteroclysis with complementary MR enteroclysis: a combination of small bowel imaging. Abdom Imaging. 2005;30:564-575. [PubMed] [DOI] |
| 40. | Kopacova M, Tacheci I, Rejchrt S, Bures J. Peutz-Jeghers syndrome: diagnostic and therapeutic approach. World J Gastroenterol. 2009;15:5397-5408. [PubMed] |
| 41. | 陈 燚, 宋 云龙, 王 萍, 吴 苏蒙, 冯 瑞. 小肠充气螺旋CT三维重建技术对Peutz-Jeghers综合征诊断价值探讨. 中国CT和MRI杂志. 2018;(2). [DOI] |
| 42. | Syngal S, Brand RE, Church JM, Giardiello FM, Hampel HL, Burt RW; American College of Gastroenterology. ACG clinical guideline: Genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol. 2015;110:223-62; quiz 263. [PubMed] [DOI] |
| 43. | Goldstein SA, Hoffenberg EJ. Peutz-Jegher syndrome in childhood: need for updated recommendations? J Pediatr Gastroenterol Nutr. 2013;56:191-195. [PubMed] [DOI] |
| 44. | Oncel M, Remzi FH, Church JM, Connor JT, Fazio VW. Benefits of ¡®clean sweep¡¯ in Peutz-Jeghers patients. Colorectal Dis. 2004;6:332-335. [PubMed] [DOI] |
| 45. | Gao H, van Lier MG, Poley JW, Kuipers EJ, van Leerdam ME, Mensink PB. Endoscopic therapy of small-bowel polyps by double-balloon enteroscopy in patients with Peutz-Jeghers syndrome. Gastrointest Endosc. 2010;71:768-773. [PubMed] [DOI] |
| 46. | Möschler O, May A, M¨¹ller MK, Ell C; German DBE Study Group. Complications in and performance of double-balloon enteroscopy (DBE): results from a large prospective DBE database in Germany. Endoscopy. 2011;43:484-489. [PubMed] [DOI] |
| 47. | Ohmiya N, Nakamura M, Takenaka H, Morishima K, Yamamura T, Ishihara M, Miyahara R, Kawashima H, Itoh A, Hirooka Y, Watanabe O, Ando T, Goto H. Management of small-bowel polyps in Peutz-Jeghers syndrome by using enteroclysis, double-balloon enteroscopy, and videocapsule endoscopy. Gastrointest Endosc. 2010;72:1209-1216. [PubMed] [DOI] |
| 48. | Riccioni ME, Urgesi R, Cianci R, Spada C, Nista EC, Costamagna G. Single-balloon push-and-pull enteroscopy system: does it work? A single-center, 3-year experience. Surg Endosc. 2011;25:3050-3056. [PubMed] [DOI] |
| 49. | Sakamoto H, Yamamoto H, Hayashi Y, Yano T, Miyata T, Nishimura N, Shinhata H, Sato H, Sunada K, Sugano K. Nonsurgical management of small-bowel polyps in Peutz-Jeghers syndrome with extensive polypectomy by using double-balloon endoscopy. Gastrointest Endosc. 2011;74:328-333. [PubMed] [DOI] |
| 50. | 俎 站飞, 毛 高平, 张 亚飞, 宁 守斌. 气囊辅助小肠镜对Peutz-Jeghers综合征患者小肠息肉治疗的安全性评价. 世界华人消化杂志. 2014;22:5174-5178. [DOI] |
| 51. | Korsse SE, Dewint P, Kuipers EJ, van Leerdam ME. Small bowel endoscopy and Peutz-Jeghers syndrome. Best Pract Res Clin Gastroenterol. 2012;26:263-278. [PubMed] [DOI] |
| 52. | Shaw RJ, Bardeesy N, Manning BD, Lopez L, Kosmatka M, DePinho RA, Cantley LC. The LKB1 tumor suppressor negatively regulates mTOR signaling. Cancer Cell. 2004;6:91-99. [PubMed] [DOI] |
| 53. | Miyoshi H, Nakau M, Ishikawa TO, Seldin MF, Oshima M, Taketo MM. Gastrointestinal hamartomatous polyposis in Lkb1 heterozygous knockout mice. Cancer Res. 2002;62:2261-2266. [PubMed] |
| 54. | Robinson J, Lai C, Martin A, Nye E, Tomlinson I, Silver A. Oral rapamycin reduces tumour burden and vascularization in Lkb1(+/-) mice. J Pathol. 2009;219:35-40. [PubMed] [DOI] |
| 55. | Shackelford DB, Vasquez DS, Corbeil J, Wu S, Leblanc M, Wu CL, Vera DR, Shaw RJ. mTOR and HIF-1alpha-mediated tumor metabolism in an LKB1 mouse model of Peutz-Jeghers syndrome. Proc Natl Acad Sci U S A. 2009;106:11137-11142. [PubMed] [DOI] |
| 56. | Wei C, Amos CI, Zhang N, Wang X, Rashid A, Walker CL, Behringer RR, Frazier ML. Suppression of Peutz-Jeghers polyposis by targeting mammalian target of rapamycin signaling. Clin Cancer Res. 2008;14:1167-1171. [PubMed] [DOI] |
| 57. | Wei C, Amos CI, Zhang N, Zhu J, Wang X, Frazier ML. Chemopreventive efficacy of rapamycin on Peutz-Jeghers syndrome in a mouse model. Cancer Lett. 2009;277:149-154. [PubMed] [DOI] |
| 58. | Klumpen HJ, Queiroz KC, Spek CA, van Noesel CJ, Brink HC, de Leng WW, de Wilde RF, Mathus-Vliegen EM, Offerhaus GJ, Alleman MA, Westermann AM, Richel DJ. mTOR inhibitor treatment of pancreatic cancer in a patient With Peutz-Jeghers syndrome. J Clin Oncol. 2011;29:e150-e153. [PubMed] [DOI] |
| 59. | Higham P, Alawi F, Stoopler ET. Medical management update: Peutz Jeghers syndrome. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010;109:5-11. [PubMed] [DOI] |