修回日期: 2019-03-05
接受日期: 2019-04-28
在线出版日期: 2019-05-08
原发性肝细胞癌(hepatocellular carcinoma, HCC)在我国有着较高发病率和死亡率, 对人们健康构成严重威胁. HCC是一种富血供恶性肝脏肿瘤, 其发生、发展、侵袭以及转移有着明显血管依赖性. 病理检查是评估HCC微血管生成状态的"金标准", 但具有创伤性. 超声造影能实时动态反映肿瘤组织的血流灌注过程, 可反映肿瘤组织的微血管生成状态. 运用超声造影评估HCC的微血管生成状态, 对于临床制定治疗方案意义重大.
运用超声造影分析HCC的血流灌注状态, 并评估其微血管密度.
选取在浙江省肿瘤医院行手术切除并经病理证实的68例HCC患者(共68个病灶)作为研究对象. 所有患者于术前均行超声造影检查, 通过时间-强度曲线测定病灶组织及病灶旁肝组织的峰值强度和曲线下面积, 分析其与术后组织标本微血管密度的相关性.
HCC病灶组织的峰值强度和曲线下面积明显高于病灶旁肝组织, 差异有统计学意义(P<0.05); HCC病灶组织的微血管密度明显高于病灶旁肝组织, 差异有统计学意义(P<0.05); HCC的峰值强度和曲线下面积均与微血管密度呈正相关(r = 0.840, P<0.05; r = 0.781, P<0.05).
超声造影可定量评估HCC的血流灌注量, 其血流灌注量参数与微血管密度相关性良好, 可为临床无创性评估HCC微血管生成状态提供有价值的参考.
核心提要: 超声造影能实时反映肿瘤组织的血流灌注过程, 从而间接反映肿瘤的微血管生成状态, 可为临床无创性客观评估原发性肝细胞癌微血管生成状态提供一种可靠的影像学方法.
引文著录: 潘建强, 盛陈卓娅, 张浩. 原发性肝细胞癌微血管密度与其超声造影血流灌注量参数的相关性. 世界华人消化杂志 2019; 27(9): 565-569
Revised: March 5, 2019
Accepted: April 28, 2019
Published online: May 8, 2019
Primary hepatocellular carcinoma (HCC) has a high incidence and mortality in China, posing a serious threat to people's health. HCC is a blood-rich malignant liver neoplasm, and its development, progression, invasion, and metastasis have obvious vascular dependence. Pathological examination is the golden standard for evaluating the microangiogenesis of HCC, but it is traumatic. Contrast-enhanced ultrasound can dynamically monitor the blood perfusion process of tumor tissue in real time and thus assess the microangiogenesis in tumor tissue. It is of great significance to evaluate the microangiogenesis of HCC by contrast-enhanced ultrasound for evaluation of its clinical treatment.
To analyze the blood perfusion status of HCC by contrast-enhanced ultrasound, and evaluate its correlation with microvessel density.
Sixty-eight patients with HCC (68 lesions) who underwent surgical resection and were confirmed by pathology at Zhejiang Tumor Hospital were selected as subjects. All patients underwent contrast-enhanced ultrasound before operation. The peak intensity and the area under the curve were measured by the time-intensity curve, and the correlations between peak intensity, the area under the curve, and microvessel density were analyzed.
The peak intensity and the area under the curve were significantly higher in HCC than in tumor adjacent tissues (P < 0.05). The microvessel density of HCC was significantly higher than that of adjacent tissues (P < 0.05). The peak intensity and the area under the curve were positively correlated with microvessel density in HCC (r = 0.840, P < 0.05; r = 0.781, P < 0.05).
Contrast-enhanced ultrasound can quantitatively evaluate the blood perfusion of HCC. The correlation between the parameters of blood perfusion and microvessel density is good. Contrast-enhanced ultrasound can provide valuable information for non-invasive assessment of angiogenesis of HCC.
- Citation: Pan JQ, Sheng CZ, Zhang H. Correlation between microvessel density and contrast-enhanced ultrasound perfusion parameters in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2019; 27(9): 565-569
- URL: https://www.wjgnet.com/1009-3079/full/v27/i9/565.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i9.565
原发性肝细胞癌(hepatocellular carcinoma, HCC)是一种恶性程度较高的实体性肝脏肿瘤, 在我国有着较高的发病率及死亡率[1]. HCC属于富血供肝脏肿瘤, 其肿瘤组织内微血管生成状态与其发生、发展、转移及预后密切相关[2]. 目前, 病理学中的微血管密度是评估肿瘤组织微血管生成状态的"金标准"[3]. 本研究运用超声造影评估HCC组织的血流灌注量, 并分析其与微血管密度相关性, 探讨超声造影在无创性评估HCC微血管生成状态中的应用价值.
选取2017-05/2018-11期间, 在浙江省肿瘤医院行手术切除并经病理证实的68例HCC患者作为研究对象, 其中男53例, 女15例, 年龄32-66岁, 平均年龄47.74岁±7.82岁. 病灶最大径线范围1.6-7.4 cm, 平均3.87 cm±1.47 cm. 纳入标准: (1)均符合HCC诊断标准[4]; (2)术前均未曾接受过放疗、化疗等任何形式治疗. 术前3 d内对所有患者行超声造影检查, 术后测定组织标本微血管密度.
1.2.1 超声造影检查: 采用Acuson S2000彩色多普勒成像仪, 配有4C1探头(频率4.0 MHz)、超声造影模式以及时间-强度曲线分析软件. 造影剂采用Sono Vue(声诺维), 使用前向粉末瓶中注入5 mL生理盐水, 震荡摇匀配成混悬液备用.
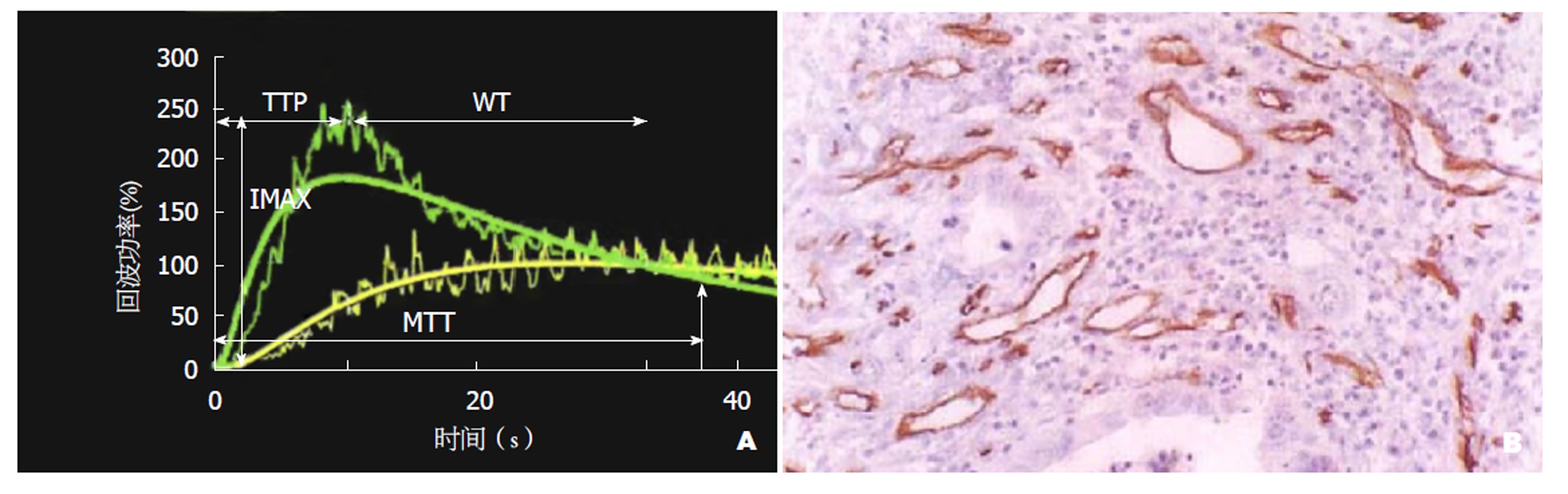
首先对病灶行常规二维超声以及彩色多普勒超声检查, 观察肿瘤大小、形态、边界、内部回声、血供等情况. 确定病灶最佳显示切面, 固定探头, 启动超声造影模式, 经肘部浅静脉以团注法推注造影剂2.4 mL, 尾随5 mL生理盐水冲管, 同步计时, 观察并记录病灶组织及病灶旁肝组织的造影全程, 将数据图像存储作后续分析. 分别选取增强最显著的病灶组织及处于相同深度的病灶旁肝组织作为感兴趣区, 通过时间-强度曲线分析并记录病灶组织及病灶旁肝组织的峰值强度和曲线下面积. 见图1A.
1.2.2 微血管密度测定: 将术后组织标本切片, 行免疫组化染色(抗CD34单克隆抗体SP法). 首先在光学显微镜低倍镜下, 选取最密集血管区域, 然后对5个高倍视野内的微血管进行计数, 以平均数作为最终微血管密度值. 与邻近组织以及微血管分界清楚, 呈"棕色"染色的内皮细胞簇均被视为独立的微血管. 见图1B.
统计学处理 数据处理使用SPSS 20.0统计学软件. 计量资料以mean±SD表示, 组间比较采用独立样本t检验. 两变量间相关性采用Pearson直线相关分析. 以P<0.05为差异有统计学意义.
HCC病灶组织的峰值强度和曲线下面积明显高于病灶旁肝组织, 差异有统计学意义(P<0.05). 见表1.
| 参数 | 峰值强度(dB) | 曲线下面积 |
| 病灶组织 | 64.60 ± 7.06 | 832.49 ± 104.82 |
| 病灶旁肝组织 | 32.78 ± 5.38 | 584.63 ± 88.43 |
| t值 | 29.553 | 14.903 |
| P值 | 0.000 | 0.000 |
HCC病灶组织的微血管密度50.56个/400倍视野±8.12个/400倍视野明显高于病灶旁肝组织(22.99个/400倍视野±6.05个/400倍视野), 差异有统计学意义(t = 22.455, P = 0.000).
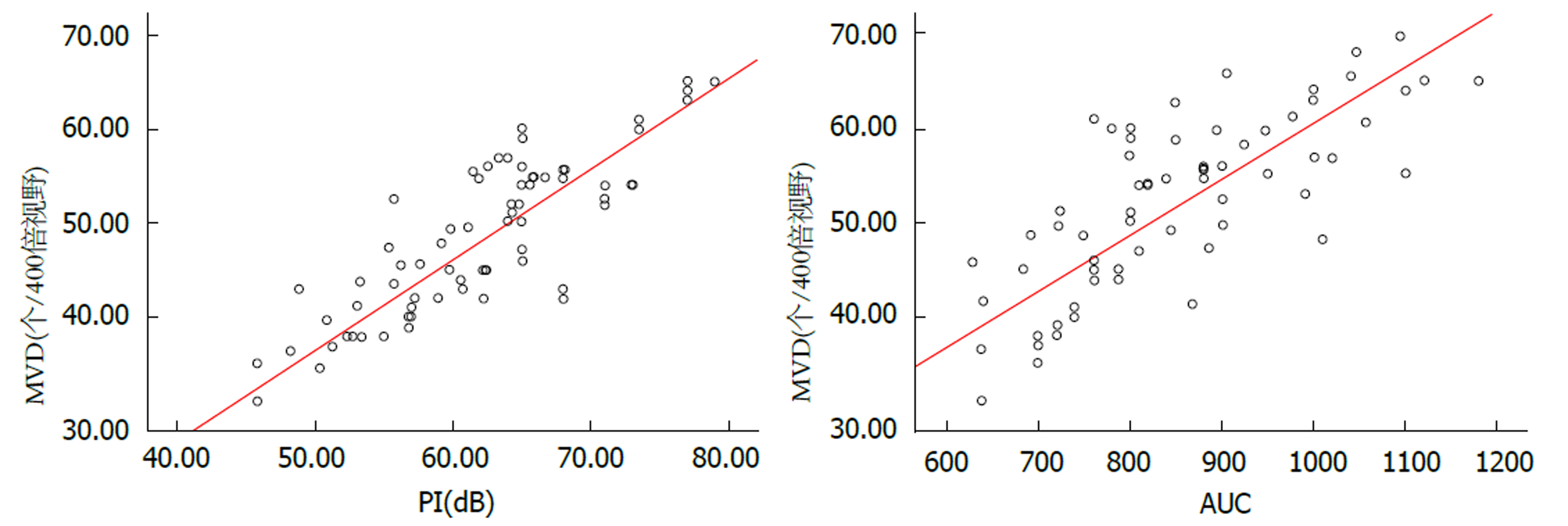
HCC的峰值强度与微血管密度呈正相关(r = 0.840, P<0.05); HCC的曲线下面积与微血管密度呈正相关(r = 0.781, P<0.05). 见图2.
HCC在我国有着较高发病率, 作为一种消化系统恶性肿瘤, 其属于富血供肿瘤, 其发生、发展、侵袭以及转移具有明显血管依赖性[5]. 微血管密度是评估肿瘤微血管生成状态的重要指标之一, 与肿瘤浸润、转移以及预后密切相关[6]. 通过测定HCC的微血管密度能准确反映病灶组织的微血管生成状态, 对于临床制定治疗方案意义重大.
超声造影作为一种先进且敏感的血流检测技术, 能实时动态反映目标组织及其周围组织的血流灌注过程, 分析其增强特征, 为肿瘤血管研究提供了一种全新的影像学定量方法[7]. 超声造影所使用的造影剂可停留在微小血管内, 属于血池显像剂, 是一种真正意义的血管示踪剂[8]. 超声造影图像信号与造影剂浓度呈线性关系, 其造影参数变化反映了组织内血流灌注状态变化, 借助时间-强度曲线可定量分析组织血流灌注量, 其中峰值强度、曲线下面积是反映组织血流灌注量的2个重要指标. 本研究结果中, HCC病灶组织的峰值强度和曲线下面积明显高于病灶旁肝组织(P<0.05), 提示HCC组织内血流灌注量丰富. 肿瘤组织内微血管大量生成, 微血管密度增加, 组织内营养物质丰富, 肿瘤细胞增殖活跃, 同时新生微血管内皮细胞发育不成熟, 基底膜不完整, 血管通透性大, 促使大量肿瘤细胞向周围浸润转移. 在此过程中, 肿瘤细胞释放大量血管生成因子以正反馈方式诱发微血管生成, 势必导致肿瘤内血流灌注量随之改变, 这是超声造影下肿瘤血流灌注量增加的病理学基础[9]. HCC可同时接受肝动脉以及门静脉双重血供, 并以肝动脉为主要供血途径, 组织内新生微血管通透性大, 且存在大量动静脉瘘, 使其血流灌注量大, 灌注速度快, 反映在超声造影中即为峰值强度以及曲线下面积明显增加.
微血管是HCC恶性生物学行为的物质形态基础, 微血管不仅为肿瘤细胞的生长发展提供充足营养物质, 并可及时排泄代谢产物, 为HCC转移扩散提供血液途径[10]. 本研究结果中, HCC病灶组织的微血管密度明显高于病灶旁肝组织(P<0.05), 提示HCC组织内有着丰富的微血管网, 为HCC生长发展提供可靠的物质基础. 病理学的微血管密度测定只适用于术中以及术后, 不适用于术前以及不宜手术者, 故不利于术前评估以指导治疗. 因此, 寻找一种无创、重复性强的方法评估活体中HCC微血管生成意义重大. 本研究结果中, HCC的峰值强度和曲线下面积均与微血管密度呈正相关(r = 0.840, P<0.05; r = 0.781, P<0.05), 提示利用峰值强度和曲线下面积可有效无创性评估HCC的微血管密度, 从而反映HCC的微血管生成状态. HCC的微血管密度值越大, 新生微血管量越多, 血流灌注量越大, 超声造影时进入病灶组织内的造影剂越多, 病灶与周围正常肝组织的对比越强烈, 故峰值强度值和曲线下面积值越大.
总之, 超声造影可定量评估HCC的血流灌注量, 其血流灌注量参数与微血管密度相关性良好, 可为临床无创性评估HCC微血管生成状态提供有价值的参考.
原发性肝细胞癌(hepatocellular carcinoma, HCC)是一种富血供肿瘤, 其恶性生物学行为与其微血管生成状态密切相关. 微血管生成状态的评估方法中, 病理学方法具有创伤性, 而超声造影具有简便重复性好等优点, 可为临床无创性评估HCC微血管生成状态提供一种可靠的影像学方法.
运用超声造影定量分析HCC的微循环血流灌注, 从而评估其微血管密度, 以期为临床无创性评估HCC微血管生成状态提供有价值的参考.
本篇论文研究的主要目标是运用超声造影分析HCC的微循环血流灌注, 评估其微血管生成. 结果显示HCC在超声造影中的血流灌注量参数与其微血管密度相关性良好, 能准确反映HCC的微血管生成状态, 具有一定临床价值.
本篇论文运用超声造影分析HCC的微循环血流灌注量与其微血管密度的相关性. 超声造影是一种可靠的高敏感性血流检测方法, 能定量评估目标组织的微循环血流灌注状态.
本篇论文研究达到了实验目标, 研究结果显示HCC病灶组织的微血管密度、峰值强度和曲线下面积明显高于病灶旁肝组织(P<0.05), 且HCC的峰值强度和曲线下面积均与微血管密度呈正相关. 本研究结果说明超声造影可用于临床无创性定量评估HCC微血管生成状态.
本研究发现HCC的血流灌注量参数与微血管密度相关性良好. 本研究提出超声造影能定量评估HCC的微血管生成状态, 从而指导临床治疗.
超声造影时, 嘱患者呼吸频率及幅度尽可量减少, 并将病灶图像放置屏幕中央, 固定好探头进行观察. 本研究未来研究的方向是超声造影分析HCC的血流灌注参数在不同级别微血管密度中的变化情况. 本研究未来研究的最佳方法是超声造影联合血管内皮生长因子评估HCC的微血管生成状态.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:刘继红
| 2. | Ozakyol A. Global Epidemiology of Hepatocellular Carcinoma (HCC Epidemiology). J Gastrointest Cancer. 2017;. [PubMed] [DOI] |
| 3. | Murakami K, Kasajima A, Kawagishi N, Ohuchi N, Sasano H. Microvessel density in hepatocellular carcinoma: Prognostic significance and review of the previous published work. Hepatol Res. 2015;45:1185-1194. [PubMed] [DOI] |
| 5. | Niska JR, Keane FK, Wolfgang JA, Hahn PF, Wo JY, Zhu AX, Hong TS. Impact of intravenous contrast enhancement phase on target definition for hepatocellular carcinoma (HCC) and intrahepatic cholangiocarcinoma (IHC): Observations from patients enrolled on a prospective phase 2 trial. Pract Radiat Oncol. 2016;6:e9-16. [PubMed] [DOI] |
| 6. | Leon SP, Folkerth RD, Black PM. Microvessel density is a prognostic indicator for patients with astroglial brain tumors. Cancer. 1996;77:362-372. [PubMed] [DOI] |
| 7. | Rubenthaler J, Paprottka KJ, Hameister E, Hoffmann K, Joiko N, Reiser M, Rjosk-Dendorfer D, Clevert DA. Diagnostic accuracy of contrast-enhanced ultrasound (CEUS) in monitoring vascular complications in patients after liver transplantation - diagnostic performance compared with histopathological results. Clin Hemorheol Microcirc. 2017;66:311-316. [PubMed] [DOI] |
| 8. | Gurtler VM, Rjosk-Dendorfer D, Reiser M, Clevert DA. Comparison of contrast-enhanced ultrasound and compression elastography in the follow-up after endovascular aortic aneurysm repair. Clin Hemorheol Microcirc. 2014;57:175-183. [PubMed] [DOI] |
| 9. | Mori N, Mugikura S, Takahashi S, Ito K, Takasawa C, Li L, Miyashita M, Kasajima A, Mori Y, Ishida T, Kodama T, Takase K. Quantitative Analysis of Contrast-Enhanced Ultrasound Imaging in Invasive Breast Cancer: A Novel Technique to Obtain Histopathologic Information of Microvessel Density. Ultrasound Med Biol. 2017;43:607-614. [PubMed] [DOI] |