修回日期: 2019-01-20
接受日期: 2019-03-15
在线出版日期: 2019-04-28
手术切除是目前临床治疗肝癌的首选方法, 对于无法手术切除的患者, 射频消融(radiofrequency ablation, RFA)治疗为其提供了一种重要的治疗手段. 实施RFA需借助于影像学方法的引导, 通常采用超声、电子计算机断层扫描(computed Tomography, CT)或磁共振成像(magnetic resonance imaging, MRI). CT引导具有射线辐射, MRI引导不适用于心脏起搏器植入、血管支架植入、心脏换瓣等患者, 而超声引导具有无辐射、简便、灵活等优点被广泛应用于临床, 成为一种引导肝肿瘤RFA的理想有效影像学手段.
探讨超声造影(contrast-enhanced ultrasound, CEUS)在RFA治疗常规超声不显示原发性肝细胞癌(hepatocellular carcinoma, HCC)中的临床应用价值.
选取常规超声不显示而增强MRI(contrast-enhanced MRI, CEMRI)显示并经穿刺活检病理确诊的52例HCC患者作为研究对象, 共75个肿瘤. 所有患者均行CEUS检查并在CEUS引导下行RFA治疗, 术后行CEMRI以及CEUS评估治疗效果.
术前CEUS对常规超声不显示HCC的检出率与CEMRI比较, 差异无统计学意义(P>0.05); 术前HCC的开始增强时间、达峰时间明显短于邻近正常肝组织, 而峰值强度明显高于邻近正常肝组织, 差异具有统计学意义(P<0.05); 术后CEUS判定HCC完全消融的准确率与CEMRI比较, 差异无统计学意义(P>0.05); 患者术后血清甲胎蛋白水平较术前明显下降, 差异有统计学意义(P<0.05).
CEUS 能有效发现并准确定位常规超声不显示HCC从而引导RFA治疗, 能为临床评估RFA 疗效提供一种可靠的影像学方法, 具有一定临床价值.
核心提要: 部分原发性肝细胞癌(hepatocellular carcinoma, HCC)可在常规超声下呈不显示状态, 对于该类HCC因常规超声无法准确定位而难以对其实施射频消融(radiofrequency ablation, RFA)治疗. 超声造影可清晰显示该类HCC, 并引导RFA顺利实施, 成为一种引导RFA治疗的新手段.
引文著录: 周华玲, 唐潮浪. 超声造影在射频消融治疗常规超声不显示原发性肝细胞癌中的临床应用价值. 世界华人消化杂志 2019; 27(8): 503-508
Revised: January 20, 2019
Accepted: March 15, 2019
Published online: April 28, 2019
Surgical resection is the first choice for the treatment of hepatocellular carcinoma (HCC). For patients who have unresectable HCC, radiofrequency ablation (RFA) is an important choice. RFA is usually guided by imaging methods including ultrasound, computed tomography (CT), and magnetic resonance imaging (MRI). CT has radiation damage, and MRI is not suitable for some patients (such as those who have pacemaker implantation, vascular stent implantation, or heart valve replacement). Ultrasound as a guidance method has the advantages of non-radiation, simplicity, and flexibility, and has been widely used in clinical practice. It has become an ideal and effective imaging method guiding RFA for liver tumors.
To investigate the clinical value of contrast-enhanced ultrasound (CEUS) in RFA for HCC undetectable by conventional ultrasound.
A total of 52 patients with HCC undetectable by conventional ultrasound, but detected by contrast-enhanced MRI (CEMRI) and confirmed by pathology were selected as subjects (with a total of 75 tumors). All patients underwent CEUS and RFA guided by CEUS. CEMRI and CEUS were performed to evaluate the therapeutic effect after operation.
There was no significant difference in the detection rate between CEUS and CEMRI (P > 0.05). Time to starting enhancement and time to enhancement peak were significantly shorter in HCC tissues than in adjacent normal tissues, but peak intensity was significantly higher in HCC tissues than in adjacent normal tissues before operation (P < 0.05). Regardless of whether HCC was completely ablated or not, there was no significant difference in the accuracy rate between CEUS and CEMRI (P > 0.05). Serum alpha fetoprotein after operation was significantly lower than that before operation (P < 0.05).
CEUS can effectively detect and accurately locate HCC undetectable by conventional ultrasound and guide RFA, thus providing a reliable imaging method for evaluating RFA efficacy.
- Citation: Zhou HL, Tang CL. Clinical value of contrast-enhanced ultrasound in radiofrequency ablation for primary hepatocellular carcinoma undetectable by conventional ultrasound. Shijie Huaren Xiaohua Zazhi 2019; 27(8): 503-508
- URL: https://www.wjgnet.com/1009-3079/full/v27/i8/503.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i8.503
射频消融技术(radiofrequency ablation, RFA)作为一种积极有效的原发性肝细胞癌(hepatocellular carcinoma, HCC)非手术治疗手段, 因具有操作简便、安全、微创等优点而广泛应用于临床[1]. 高质有效的引导技术以及评估手段对于提高RFA疗效至关重要. 常规超声是RFA常用引导技术及评估手段之一, 然而当HCC在常规超声下缺乏明显声像图对比而不显示时, 将不利于RFA的顺利实施[2]. 超声造影(contrast-enhanced ultrasound, CEUS)能实时反映肿瘤组织的血流灌注过程, 在各肿瘤诊疗中发挥着重要作用[3]. 本研究采用CEUS引导下对常规超声不显示HCC行RFA治疗, 并于术后评估RFA疗效, 旨在探讨CEUS在RFA治疗常规超声不显示HCC中的应用价值.
2017-02/2018-11期间, 连续选取嘉兴市第二医院常规超声不显示而增强MRI(contrast-enhanced MRI, CEMRI)显示并经穿刺活检病理确诊的52例HCC患者作为研究对象(75个肿瘤). 52例患者中, 肝炎后肝硬化患者32例(45个肿瘤), 酒精性肝硬化患者14例(17个肿瘤), 血吸虫性肝硬化患者6例(13个肿瘤); 75个肿瘤中, 9个位于近膈顶部, 66个位于非近膈顶部; 21个最大径线≤1 cm, 54个最大径线>1 cm. 所有患者均在CEUS引导下行RFA治疗. 纳入标准: (1)所有肿瘤均符合《原发性肝癌诊疗规范(2017年版)》关于HCC诊断标准[4]; (2)均通过穿刺活检获得病理确诊. 排除标准: (1)肝肾功能衰竭; (2)凝血功能障碍; (3)严重感染.
采用GE LOGIQ 9超声诊断仪, 配有3.5-5.0 MHz凸阵探头以及超声造影成像系统. 采用声诺维(Brocca公司)作为超声造影剂, 按照说明书配备成混悬液备用. 采用S-1500肿瘤射频治疗仪(上海迈德公司)进行RFA治疗, 配有17 G多极针. 采用Siemens verio 3.0 T超导MR进行CEMRI, 所用造影剂为普美显.
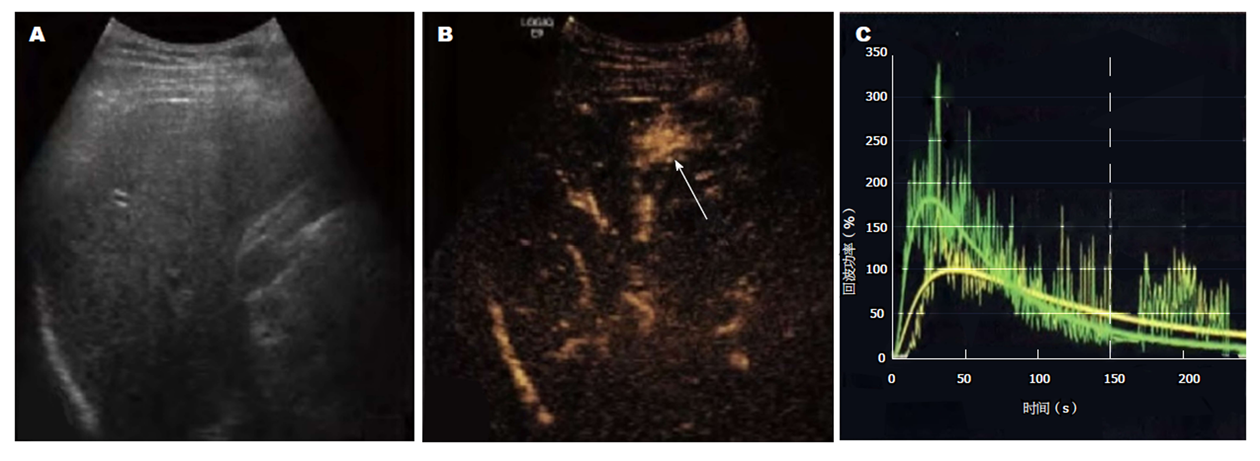
术前: 术前1 d, 测定患者血清甲胎蛋白水平; 术中: 参照CEMRI图像, 在同一肝区行CEUS检查. 启动CEUS模式, 抽取2.4 mL造影剂以快速团注方式注入肘部浅静脉, 尾随5 mL生理盐水快速冲管, 同步计时并存储影像资料作后续分析. 观察肿瘤增强模式, 绘制时间-强度曲线(time-intensity curve, TIC), 测定并记录RFA治疗前肿瘤及其邻近正常肝组织的开始增强时间、达峰时间、峰值强度等参数. 造影时相划分为: 0-30 s为动脉相、 31-120 s为门脉相, 121-360 s为延迟相. 根据CEUS所呈现的肿瘤位置、形态、大小、比邻关系等情况, 选择最佳穿刺路径以及制定最佳布针方案, 在CEUS引导下对肿瘤穿刺活检后行RFA治疗. 术后: 术后1 mo行CEUS、CEMRI以及复查血清甲胎蛋白水平. 见图1.
完全消融: RFA治疗后, 各时相肿瘤内均无血流灌注增强区; 不完全消融: RFA治疗后, 动脉期肿瘤内存在血流灌注增强区, 门脉期或延迟期消退.
统计学处理 采用SPSS 19.0统计学软件进行数据处理. 计量资料表示为mean±SD, CEUS参数比较采用独立样本t检验, AFP治疗前后比较采用配对样本t检验. 计数资料表示为(%), 组间比较采用χ2检验. 以P<0.05为差异有统计学意义.
HCC患者52例, 其中男38例, 女14例, 年龄28-65岁, 平均49.07岁±8.16岁. CEMRI共发现75个肿瘤, 最大径线0.7-3.1 cm, 平均2.24 cm±0.67 cm. 于相同肝区层面CEUS成功发现72个肿瘤, 肿瘤的检出率为96.00%(72/75). 术前CEUS对常规超声不显示HCC的检出率与CEMRI比较, 差异无统计学意义(χ2 = 3.061, P = 0.080). 所发现的HCC在CEUS下均表现为不同程度的动脉相高增强, 门脉相低增强. 术前HCC的开始增强时间、达峰时间明显短于邻近正常肝组织, 而峰值强度明显高于邻近正常肝组织, 差异具有统计学意义(P<0.05). 见表1.
| 部位 | 开始增强时间(s) | 达峰时间(s) | 峰值强度(%) |
| HCC | 12.96 ± 4.31 | 22.53 ± 5.09 | 45.09 ± 5.61 |
| 正常肝组织 | 17.79 ± 4.90 | 36.97 ± 6.75 | 27.41 ± 3.98 |
| t值 | -6.274 | -14.501 | 21.804 |
| P值 | 0.000 | 0.000 | 0.000 |
术后CEMRI提示72个肿瘤内各时相均无血流灌注增强, 判定为完全消融; CEUS提示70个肿瘤内各时相均无血流灌注增强, 判定为完全消融, 而2个肿瘤动脉期存在周边环形高增强区, 判定为不完全消融, 后经穿刺活检病理证实为炎性充血带. CEUS判定HCC完全消融的准确率为97.22%(70/72). 术后CEUS判定HCC完全消融的准确率与CEMRI比较, 差异无统计学意义(χ2 = 2.028, P = 0.154). 见表2.
| CEUS | CEMRI | 总计 | |
| 不完全消融 | 完全消融 | ||
| 不完全消融 | 0 | 2 | 2 |
| 完全消融 | 0 | 70 | 70 |
| 总计 | 0 | 72 | 72 |
患者术后血清甲胎蛋白水平(410.72 ng/mL±98.76 ng/mL较术前50.75 ng/mL±32.74 ng/mL明显下降, 差异有统计学意义(t = 30.723, P = 0.000).
手术切除仍是HCC首选治疗手段, 但对于无法手术患者, RFA可为其提供一种重要的非手术治疗手段[5-8]. RFA治疗的顺利实施依靠于高质量的影像学方法作为引导, 而超声是引导RFA的常用方法之一. 超声引导具有操作方便、灵活、无辐射、实时等优点, 在清晰显示肿瘤位置、形态、大小、边界、毗邻关系等前提下, 可实时监控RFA治疗全程, 目前广泛应用于临床[9]. 但在各种复杂因素(如脂肪肝、HCC呈等回声, 体积较小, 肝硬化背景等)影响下, HCC与其周围肝组织缺乏明显声像图对比, 致使HCC在常规超声下无法显示, 成为"隐形肝癌", 此时常规超声无法准确定位HCC而影响RFA治疗的顺利实施[10].
CEUS所采用的微泡造影剂属于血管池造影剂, 能通过实时显示HCC内微循环血流灌注动态过程[11-15], 清晰显示常规超声不显示的HCC, 从而使CEUS引导下对该类HCC行RFA治疗成为可能. 本研究结果显示, CEUS对常规超声不显示HCC的检出率为96.00%(72/75), 与CEMRI的检出结果高度一致, 证实了CEUS能敏感发现常规超声不显示的HCC, 其检出能力堪与CEMRI相媲美. CEUS使常规超声不显示HCC行RFA治疗得以顺利实施, 其在RFA治疗中无疑是一种理想的全新超声引导手段, 能保证RFA治疗的准确性以及有效性. 本研究中有3个肿瘤CEUS未能发现, 原因可能是肿瘤位置靠近膈顶, 受气体干扰所致. 本研究结果中, 术前HCC的开始增强时间、达峰时间明显短于邻近正常肝组织, 而峰值强度明显高于邻近正常肝组织(P<0.05), 提示CEUS可定量分析HCC的血流灌注特征, 为临床诊疗提供更丰富的血流动力学信息. HCC中90%血供来自于肝动脉, 使其在动脉相得以快速增强, 同时病灶内存在大量高通透性的新生血管以及动静脉短路, 使造影剂能在动脉期对病灶进行快速大量灌注.
准确评估HCC灭活状态是RFA治疗是否成功的关键. HCC经RFA治疗后其边界常常不清晰, 导致常规超声难以辨别HCC坏死的真实范围, 不利于RFA疗效评估[16]. 故临床上常采用增强CT或CEMRI进行RFA疗效评估, 虽然两者在评估RFA疗效方面均具有极高准确度[17-19], 但增强CT具有辐射性, 而CEMRI价格昂贵, 操作费时, 过程复杂, 不适合金属支架或起搏器置入患者检查等原因, 其应用受到一定限制. CEUS能实时动态反映肿瘤内部微循环血流灌注状态, 可直观反映RFA治疗前后肿瘤内部血流动力学变化, 从而判断肿瘤灭活情况[20]. 本研究结果中, CEUS判定HCC完全消融的准确率为97.22%(70/72), 与CEMRI比较差异无统计学意义(P>0.05), 提示CEUS能有效监测RFA对HCC的疗效, 从而指导临床进一步治疗. 本研究结果中, 术后CEUS将2个动脉期存在周边环形高增强区的HCC判定为不完全消融, 从而导致假阳性. 原因可能是HCC经RFA治疗后周围出现明显的炎性充血带所致[21]. 本研究结果中, 患者术后血清甲胎蛋白水平明显低于术前(P<0.05), 进一步证实了CEUS引导下对常规超声不显示HCC行RFA治疗的有效性.
总之, CEUS能有效发现并准确定位常规超声不显示HCC从而引导RFA治疗, 能为临床评估RFA疗效提供一种可靠的影像学方法, 具有一定临床应用价值.
原发性肝细胞癌(hepatocellular carcinoma, HCC)治疗首选手术切除, 而对于无法手术患者, 射频消融(radiofrequency ablation, RFA)是一种有效的非手术治疗方法. 临床常采用超声引导RFA治疗.
运用超声造影(contrast-enhanced ultrasound, CEUS)对常规超声不显示HCC进行显影, 并引导RFA治疗以及判定RFA疗效, 以期为临床提供参考.
本篇论文研究的主要目标是运用CEUS引导RFA治疗常规超声不显示HCC, 并判定RFA疗效. 结果表明CEUS 能有效发现并准确定位常规超声不显示HCC从而引导RFA治疗, 能为临床评估RFA疗效提供一种可靠方法.
本篇论文采用CEUS引导RFA治疗常规超声不显示HCC, 并于术后评估RFA疗效. CEUS是一种能实时反映肿瘤组织血流灌注的超声新技术, 能有效发现常规超声不显示HCC.
本篇论文研究达到了实验目标, 研究结果显示术前CEUS对常规超声不显示HCC的检出率以及术后CEUS判定HCC完全消融的准确率与增强磁共振成像(contrast-enhanced MRI, CEMRI)比较, 差异无统计学意义(P>0.05). 本研究结果说明CEUS能敏感发现常规超声不显示HCC, 并能有效监测RFA疗效, 其能力堪与CEMRI相媲美.
本研究发现CEUS能敏感发现常规超声不显示HCC, 并引导RFA治疗, 术后能有效监测RFA疗效. RFA治疗常规超声不显示HCC时, 可采用CEUS作为引导方法以及术后疗效评估方法.
肿瘤位置靠近膈顶, 容易受气体干扰而导致CEUS发现不了肿瘤. 术后肿瘤周围的炎性充血带可导致误诊. 本研究未来研究的方向是三维超声造影在RFA治疗HCC中的应用. 本研究未来研究的最佳方法三维超声造影评估RFA对HCC的治疗效果.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Patidar Y, Singhal P, Gupta S, Mukund A, Sarin SK. Radiofrequency ablation of surface v/s intraparenchymal hepatocellular carcinoma in cirrhotic patients. Indian J Radiol Imaging. 2017;27:496-502. [PubMed] [DOI] |
| 2. | Wahl DR, Stenmark MH, Tao Y, Pollom EL, Caoili EM, Lawrence TS, Schipper MJ, Feng M. Outcomes After Stereotactic Body Radiotherapy or Radiofrequency Ablation for Hepatocellular Carcinoma. J Clin Oncol. 2016;34:452-459. [PubMed] [DOI] |
| 3. | Sidhu PS, Cantisani V, Deganello A, Dietrich CF, Duran C, Franke D, Harkanyi Z, Kosiak W, Miele V, Ntoulia A, Piskunowicz M, Sellars ME, Gilja OH. Role of Contrast-Enhanced Ultrasound (CEUS) in Paediatric Practice: An EFSUMB Position Statement. Ultraschall Med. 2017;38:33-43. [PubMed] [DOI] |
| 5. | Schmoldt A, Benthe HF, Haberland G. Digitoxin metabolism by rat liver microsomes. Biochem Pharmacol. 1975;24:1639-1641. [PubMed] |
| 6. | de Stefano G, Farella N, Scognamiglio U, Liorre G, Calabria G, Ascione T, Giorgio A, Iodice V. Sorafenib after RFA in HCC patients: a pilot study. Hepatogastroenterology. 2015;62:261-263. [PubMed] [DOI] |
| 7. | Amarapurkar DN, Dharod MV, Chhabra D. Attack of the Clone: HCC Tract Seeding Following RFA. J Clin Exp Hepatol. 2015;5:262-263. [PubMed] [DOI] |
| 8. | Hocquelet A, Aubé C, Rode A, Cartier V, Sutter O, Manichon AF, Boursier J, N'kontchou G, Merle P, Blanc JF, Trillaud H, Seror O. Comparison of no-touch multi-bipolar vs. monopolar radiofrequency ablation for small HCC. J Hepatol. 2017;66:67-74. [PubMed] [DOI] |
| 9. | 徐 娟, 赵 晔, 付 晓丹, 崔 永慧, 顾 丽婕, 赵 静, 葛 华. 超声引导下经皮微波消融与射频消融治疗原发性肝癌的临床疗效对比分析. 中国医学装备. 2016;13:55-59. [DOI] |
| 11. | Rübenthaler J, Paprottka KJ, Hameister E, Hoffmann K, Joiko N, Reiser M, Rjosk-Dendorfer R, Clevert DA. Contrast-enhanced ultrasound (CEUS) prediction of focal liver lesions in patients after liver transplantation in comparison to histopathology results. Clin Hemorheol Microcirc. 2017;66:303-310. [PubMed] [DOI] |
| 12. | Pinto F, Valentino M, Romanini L, Basilico R, Miele V. The role of CEUS in the assessment of haemodynamically stable patients with blunt abdominal trauma. Radiol Med. 2015;120:3-11. [PubMed] [DOI] |
| 13. | Jang HJ, Kim TK, Burns PN, Wilson SR. CEUS: An essential component in a multimodality approach to small nodules in patients at high-risk for hepatocellular carcinoma. Eur J Radiol. 2015;84:1623-1635. [PubMed] [DOI] |
| 14. | Bolondi L, Correas JM, Lencioni R, Weskott HP, Piscaglia F. New perspectives for the use of contrast-enhanced liver ultrasound in clinical practice. Dig Liver Dis. 2007;39:187-195. [PubMed] [DOI] |
| 15. | Sessa B, Trinci M, Ianniello S, Menichini G, Galluzzo M, Miele V. Blunt abdominal trauma: role of contrast-enhanced ultrasound (CEUS) in the detection and staging of abdominal traumatic lesions compared to US and CE-MDCT. Radiol Med. 2015;120:180-189. [PubMed] [DOI] |
| 16. | 周 玲慧, 何 云, 杨 红. 声脉冲辐射力成像技术评估肝细胞癌射频消融术后24h疗效的价值. 中国临床医学影像杂志. 2017;28:488-491. [DOI] |