修回日期: 2019-02-16
接受日期: 2019-03-24
在线出版日期: 2019-04-28
急性胰腺炎(acute pancreatitis, AP)发病迅速, 并发全身感染, 因此早期的高效治疗对控制病情起到关键作用. 微小RNA(microRNA, miRNA)在AP中的作用机制及临床应用的研究成为近几年的热点. 其在AP发生发展及转归中的作用有助于为AP的诊断和治疗提供新思路.
探讨miR-181a-5p对雨蛙素诱导的大鼠胰腺腺泡细胞AR42J凋亡的影响及机制.
运用ELISA法检测雨蛙素诱导的大鼠胰腺腺泡细胞中AMY、肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)、白介素-6(interleukin-6, IL-6)的表达; 将Cerulein+anti-miR-con组(转染anti-miR-con)、Cerulein+anti-miR-181a-5p组(转染anti-miR-181a-5p)、Cerulein+si-con组(转染si-con)、Cerulein+si-白血病抑制因子(leukemia inhibitory factor, LIF)组(转染si-LIF), 均用脂质体法转染至AR42J细胞, 再用15 nmol/L 的雨蛙素处理8 h; 流式细胞术法检测各组细胞的凋亡; qRT-PCR检测各组细胞中miR-181a-5p mRNA和LIF mRNA的表达; Western blot检测各组细胞中LIF、caspase-3的蛋白表达; 双荧光素酶报告基因检测实验检测各组细胞的荧光活性.
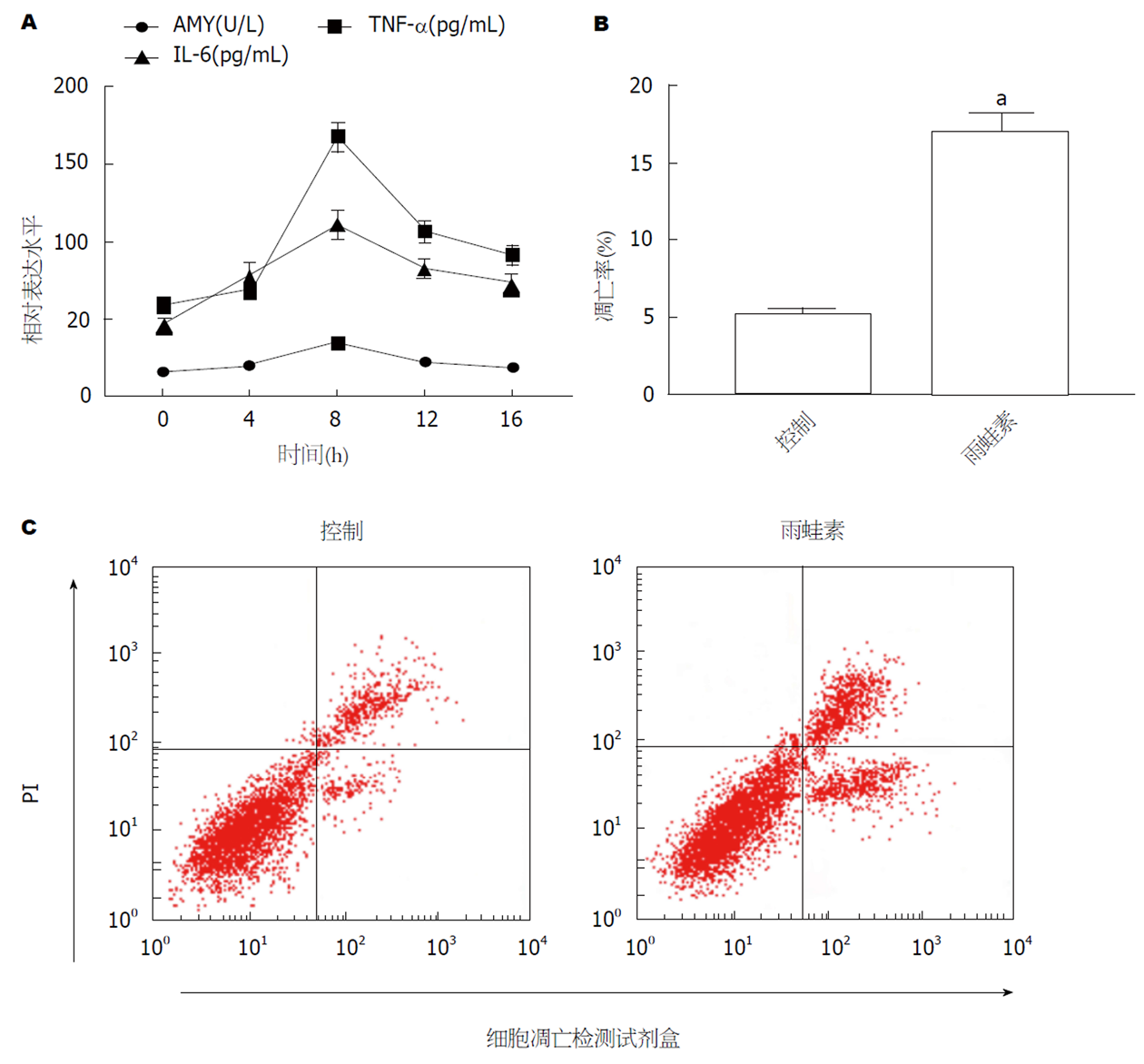
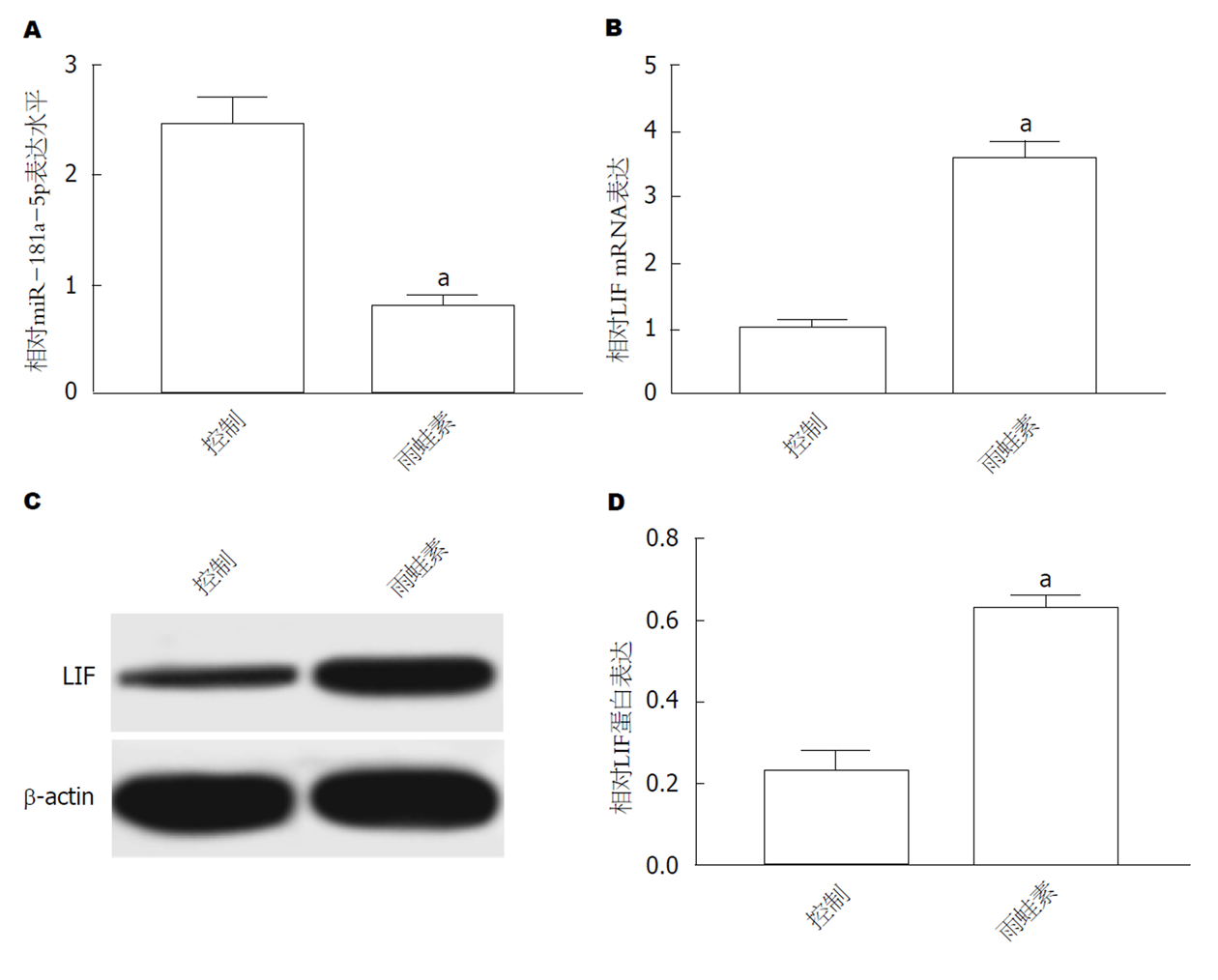
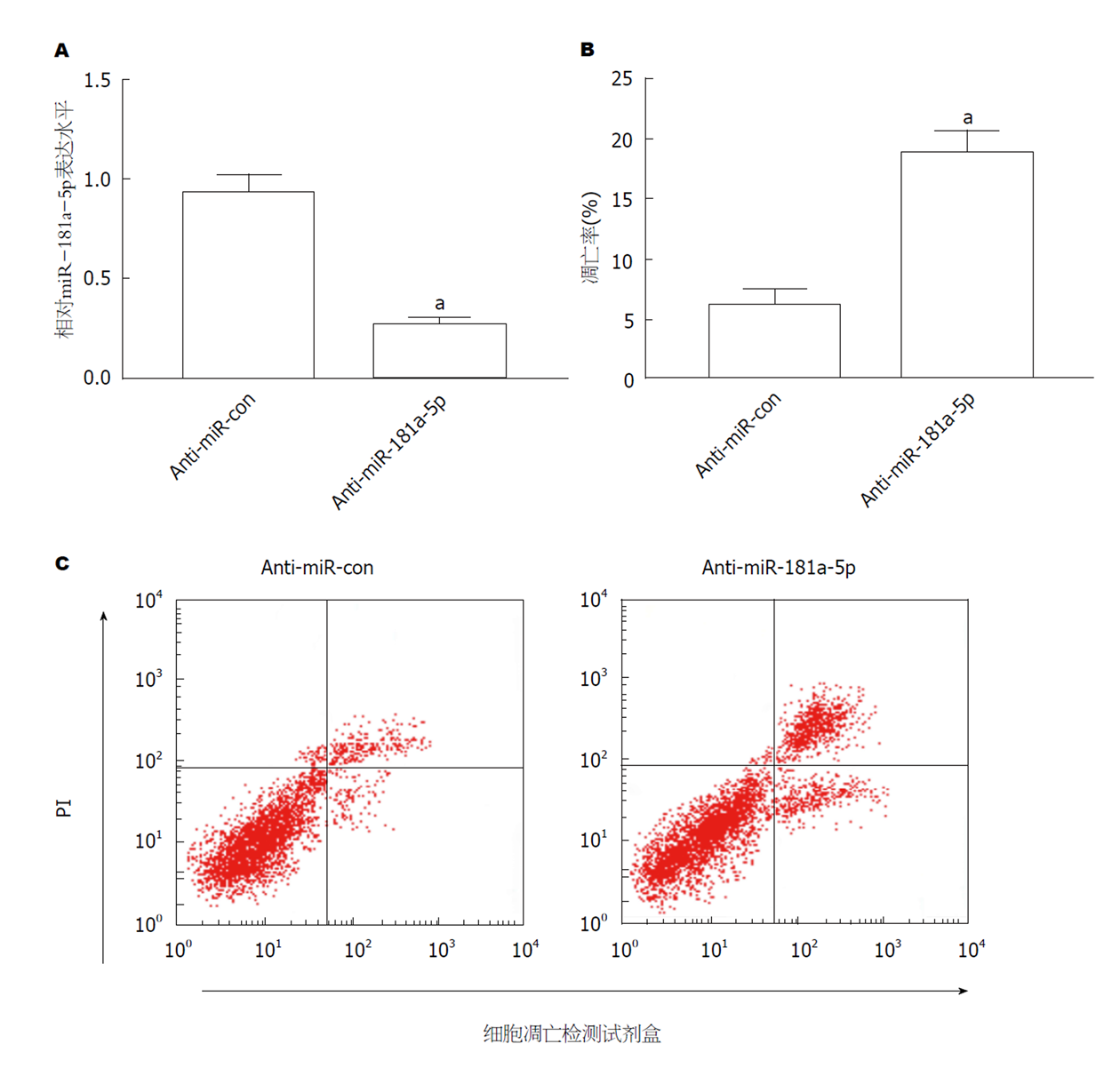
与对照组相比, 雨蛙素处理8 h是AMY、TNF-α和IL-6的含量均升高的时间点, 且细胞凋亡率显著降低(P<0.05); 与Control组相比, Cerulein组AR42J细胞中miR-181a-5p mRNA表达显著下调, LIF mRNA和蛋白表达显著上调(P<0.05); 过表达 miR-181a-5p、敲减LIF均可抑制雨蛙素诱导的AR42J细胞凋亡的促进作用; miR-181a-5p可抑制野生型LIF细胞的荧光活性, 且可负向调控LIF的蛋白表达.
miR-181a-5p可抑制雨蛙素诱导的AR42J细胞的凋亡, 其机制可能与靶向LIF有关, 将可为AP的治疗提供新方向.
核心提要: miR-181a-5p在胰腺炎中发挥保护作用的机制与靶向抑制下游的促炎因子白血病抑制因子的表达密切相关.
引文著录: 龚倩倩, 陈铁江. miR-181a-5p调控LIF的表达调节胰腺腺泡细胞凋亡的分子机制. 世界华人消化杂志 2019; 27(8): 494-502
Revised: February 16, 2019
Accepted: March 24, 2019
Published online: April 28, 2019
Acute pancreatitis (AP) develops rapidly and is often complicated by systemic infections, so early and effective treatment plays a key role in controlling the disease. The mechanism of action and clinical application of microRNAs (miRNAs) in AP have become a hot topic in recent years. Understanding the roles of miRNAs in the development and outcome of AP can help provide new ideas for the diagnosis and treatment of AP.
To investigate the effect and mechanism of miR-181a-5p on cerulean-induced apoptosis of rat pancreatic acinar cells.
The expression of AMY, tumor necrosis factor alpha (TNF-α), and interleukin-6, (IL-6) in rat pancreatic acinar cells induced with cerulein was detected by ELISA. AR42J cells were divided into the following groups: cerulean + anti-miR-con group (transfected with anti-miR-con), cerulean + anti-miR-181a-5p group (transfected with anti-miR-181a-5p), cerulean + si-con group (transfected with si-con), and cerulean + si-leukemia inhibitory factor (LIF) group (transfected with si-LIF). All cells were transfected using liposomes and treated with 15 nmol/L of cerulein for 8 h. Cell apoptosis in each group was detected by flow cytometry. The expression of miR-181a-5p mRNA was detected by qRT-PCR. The protein expression of LIF and caspase-3 was detected by Western blot. The fluorescence activity in each group was detected by double luciferase reporter gene assay.
Compared with the control group, the levels of AMY, TNF-α, and IL-6 increased at 8 h after treatment with cerulein, and the apoptosis rate were significantly decreased (P < 0.05). Compared with the control group, the expression of miR-181a-5p mRNA was down-regulated, and the expression of LIF mRNA and protein was significantly up-regulated in the cerulein group (P < 0.05). Overexpression of miR-181a-5p or knockdown of LIF could inhibit the apoptosis of AR42J cells induced by cerulein. miR-181a-5p can inhibit the fluorescent activity of wild-type LIF cells and negatively regulate the protein expression of LIF.
MiR-181a-5p inhibits cerulein-induced apoptosis of AR42J cells via mechanism possibly related to targeting of LIF, which will provide a new direction for the treatment of AP.
- Citation: Gong QQ, Chen TJ. MiR-181a-5p down-regulates LIF expression to inhibit apoptosis of pancreatic acinar cells. Shijie Huaren Xiaohua Zazhi 2019; 27(8): 494-502
- URL: https://www.wjgnet.com/1009-3079/full/v27/i8/494.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i8.494
急性胰腺炎(acute pancreatitis, AP)是胰腺内胰酶过度激活导致胰腺组织自身消化、出血、坏死的炎性疾病, 易发生全身炎性反应综合征, 死亡率高达约30%[1,2]. 由于现代人生活不规律(暴饮暴食、酗酒), 导致AP的发病率逐年上升[3]. 即使患者脱离生命危险, 长期的药物治疗也会对胰腺造成损伤[4]. miRNA为长度在19-23个核苷酸组成的内源性短链非编码微小的RNA分子, 其参与人类多种疾病的发生发展[5]. 白血病抑制因子(leukemia inhibitory factor, LIF)是白介素-6(interleukin-6, IL-6)家族中的一个多功能细胞因子, 其作为促炎症细胞因子参与了多种炎症反应, 但其胰腺炎症作为抗炎因子发挥作用[6,7]. miR-181a-5p与LIF在胰腺炎中的作用及机制尚未十分清楚. 本研究拟以大鼠胰腺腺泡细胞AR42J为研究对象, 用雨蛙素诱导AR42J损伤建立胰腺炎细胞模型, 检测雨蛙素诱导AR42J细胞中miR-181a-5p、LIF的表达, 观察过表达miR-181a-5p、敲减LIF对雨蛙素诱导AR42J细胞凋亡的影响, 揭示其机制可能与miR-181a-5p靶向LIF有关, 将为AP的靶向治疗提供依据.
大鼠胰腺腺泡细胞AR42J购自美国ATCC; 雨蛙素购自美国sigma公司; DMEM培养基、胎牛血清、MTT、胰蛋白酶均购自美国Sellect公司; LipofectamineTM2000、BCA蛋白定量试剂盒、逆转录试剂盒购自大连Takara公司; 肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)检测试剂盒、IL-6检测试剂盒、淀粉酶(AMY)检测试剂盒均购自江苏江莱生物; PVDF膜购自德国罗氏公司; SDS-PAGE 试剂盒、ECL发光液和RIPA蛋白裂解液均购自碧云天公司; 双荧光素酶报告基因检测试剂盒购自美国Promega公司; Annexin V-FITC/PI凋亡检测试剂盒购自北京索莱宝公司.
1.2.1 细胞培养: 将大鼠胰腺腺泡细胞AR42J用含10%胎牛血清的RPMI1640培养基, 置于37 ℃, 5% CO2的恒温培养箱中常规培养, 待细胞生长至融合度75%左右, 用胰蛋白酶消化约1 min, 按照1:3的比例更换培养基, 每2 d传代一次.
1.2.2 AP细胞模型制造及分组: 雨蛙素诱导的AR42J细胞AP模型: 将AR42J细胞调整至5×104个/mL, 接种于6孔板, 培养24 h后, 然后用15 nmol/L雨蛙素处理0、4、8、12、16 h, 用于后续筛选最佳处理时间, 并将最佳处理时间下的AR42J细胞标记为Cerulein组. 将anti-miR-con、anti-miR-181a-5p、si-con、si-LIF按照LipofectamineTM2000脂质体转染试剂盒说明书要求转染至Cerulein组AR42J细胞, 转染6 h后更换培养液继续培养48 h, 再用15 nmol/L雨蛙素处理8 h, 标记为Cerulein+anti-miR-con组、Cerulein+anti-miR-181a-5p组、Cerulein+si-con组、Cerulein+si-LIF组, 用于后续试验.
1.2.3 ELISA实验检测AMY、TNF-α和IL-6的表达: 按照ELISA检测试剂盒说明书要求操作检测1.2.2各组AR42J细胞中AMY、TNF-α和IL-6的表达.
1.2.4 Annexin V-FITC/PI流式细胞术检测细胞凋亡: 将1.2.2各转染组细胞, 用结合缓冲液 500 μL 悬浮细胞, 分别加入5 μL的 Annexin V-/FITC和PI, 混匀, 室温避光静置15 min. 采用流式细胞仪分析测定结果. 细胞的凋亡率(%) = 早期凋亡率+晚期凋亡率. 每个样品重复3次.
1.2.5 Western blot检测LIF、caspase-3的蛋白表达: 收集1.2.2各转染组细胞, 加入裂解液, 冰上裂解35 min. 12000 rpm离心10 min, 取上清置于EP管, 加入5×SDS上样缓冲液, 沸水煮沸10 min. 电泳后用转膜仪将蛋白转移至PVDF膜; 5%脱脂奶粉将膜封闭2 h, 洗膜, 加入Ⅰ抗, 4 ℃过夜孵育, 洗膜, 加Ⅱ抗, 4 ℃ 2 h. 加发光液, 曝光.
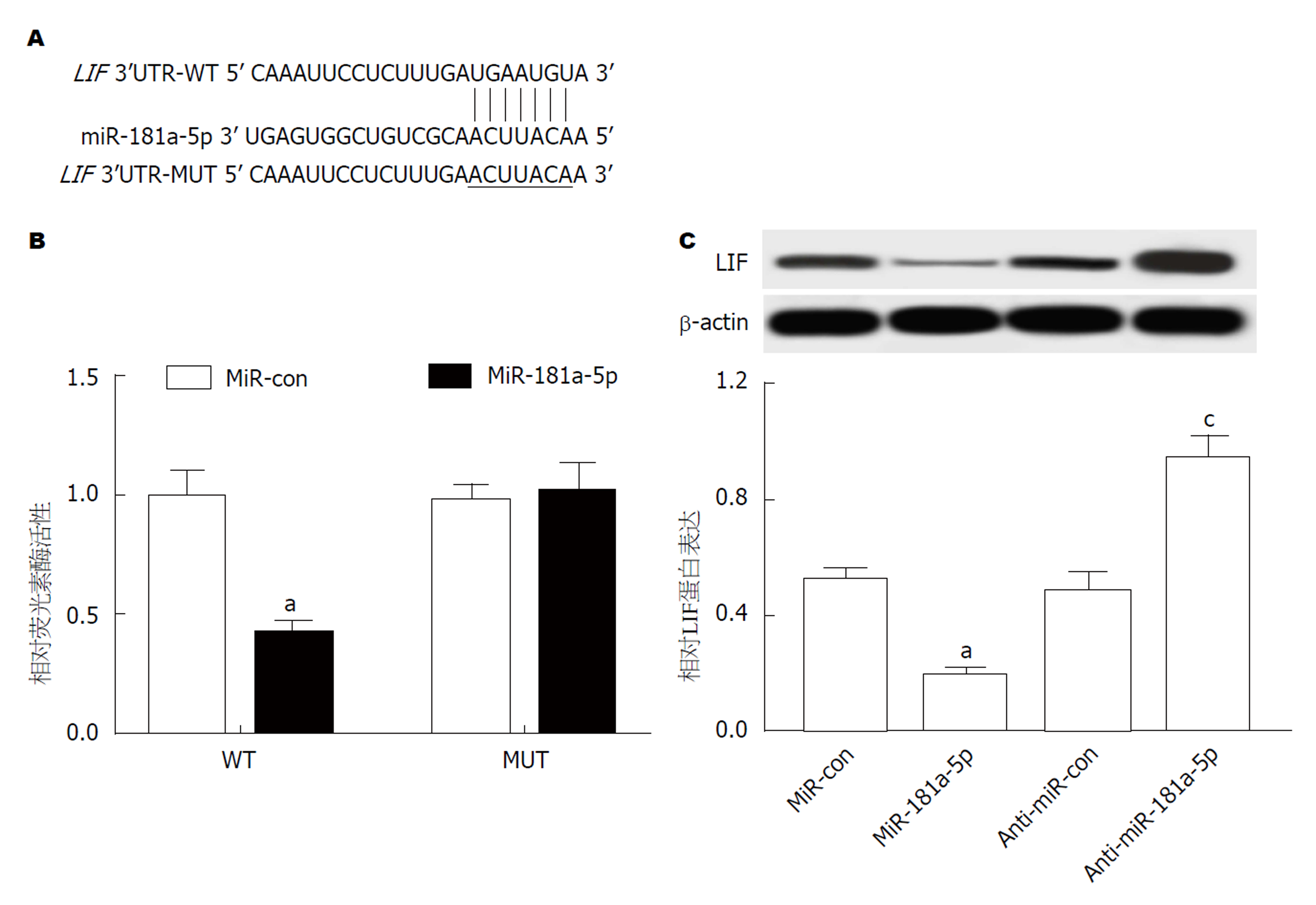
1.2.6 双荧光素酶报告基因实验: 将构建的BDNF 3'UTR-WT(含LIF 3'UTR片段)和LIF 3'UTR-MUT(含LIF 3'UTR片段突变体)的荧光素酶报告载体, 采用LipofectamineTM2000分别将LIF 3'UTR-WT和LIF 3'UTR-MUT与miR-181a-5p mimics、miR-con共转染, 转染后培养24 h, 按双荧光素酶报告基因检测试剂盒技术手册操作, 记录萤火虫荧光素酶和海肾荧光素酶激发值, 以两者的比值评价LIF基因的激活程度.
统计学处理 实验中所有数据均采用SPSS 21.0软件进行分析. 计量资料用mean±SD表示, 多组间数据比较采用单因素方差分析, 两两比较采用t检验, 以P<0.05表示差异有统计学意义.
结果如图1所示, Cerulein组AR42J细胞在处理8 h时AMY、TNF-α和IL-6的表达均升高(图1A); 与Control组相比, Cerulein组AR42J细胞的凋亡率显著升高(图2B和C, P<0.05).
结果如图2所示, 与Control组相比, Cerulein组AR42J细胞miR-181a-5p表达显著下降(图2A), LIF mRNA(图2B)和蛋白表达(图2C和D)均显著升高(P<0.05).
结果如图3所示, 与Cerulein+miR-con组相比, Cerulein+miR-181a-5p组AR42J细胞中miR-181a-5p表达显著升高(图3A), 细胞凋亡率显著降低(图3B, P<0.05).
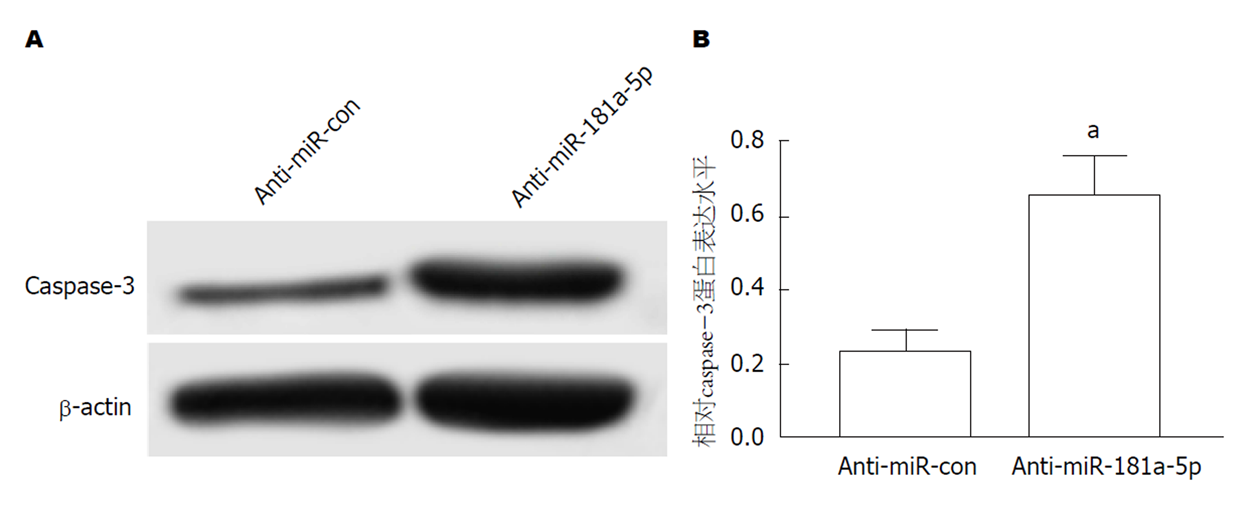
结果如图4所示, 与Cerulein+miR-con组相比, Cerulein+miR-181a-5p组AR42J细胞中caspase-3蛋白表达显著降低(图4A和B, P<0.05).
运用miRcode数据库预测到miR-181a-5p与LIF 3'UTR存在结合位点(图5A); 双荧光素酶活性检测结果显示, 与miR-con组相比, miR-181a-5p组WT-LIF细胞中荧光活性显著降低, MUT-LIF细胞中荧光活性不受影响(图5B); 与miR-con组相比, miR-181a-5p组细胞中LIF表达显著降低, 与anti-miR-con组相比, anti-miR-181a-5p组细胞中LIF表达显著升高(图5C, P<0.05).
miRNA为1993年首次在秀丽线虫中发现的一种22 nt的长链非编码小分子RNA[8]. miRNA参与构成机体约3%的基因组, 30%-90%的人类基因由miRNA调控, 且一个miRNA可调控数千个目标基因[9]. 近年来, miRNA在视网膜疾病、神经退行性疾病、心血管疾病、癌症等多种人类疾病的发生发展过程中的调节作用被广泛研究. 如miR-551b-5p、miR-92b、miR-10a、miR-7在胰腺炎均出现异常表达, 其中miR-551b-5p可通过正向调控组ICC内钙离子浓度发挥调控胰腺炎进展的作用[10]. 林金欢[11]、傅冬阳等[12]在胰腺炎的研究中均报道, miRNA在胰腺炎的发生发展中具有重要作用, 推测其机制可能与miRNA与mRNA之间复杂的调控网络相关. 姚汝铖等[13]研究发现, miR-181a可用来鉴别诊断胰腺癌、慢性胰腺炎、正常胰腺及胰腺的内分泌肿瘤. An等[14]在AP的研究中通过微阵列分析胰腺炎患者血清miRNA的表达谱发现, miR-181a-5p的表达不断下调, 并运用miRNA-mRNA网络揭示了miR-181a-5p的下调与甘油三酯, 总胆固醇和快速血糖具有良好的负相关性, 与Ca2+呈正相关, 提示miR-181a-5p可作为诊断AP的生物标志物. 本研究运用qRT-PCR法检测了雨蛙素诱导的AR42J细胞中miR-181a-5p的表达发现, miR-181a-5p低表达, 这与An的研究结果相一致; 进一步研究发现, 过表达miR-181a-5p可抑制雨蛙素诱导的AR42J细胞的凋亡促进作用; 深入研究运用双荧光素酶报告基因检测实验验证, miR-181a-5p可靶向负调控LIF表达.
TNF-α、IL-1、IL-6是胰腺炎的主要致炎因子[15], 其中TNF发生在炎症起始阶段, 诱导IL-1、IL-6引发的级联反应[16], 但有研究报道, 炎性因子水平的变化与胰腺炎的病理进程并不相一致[17]. LIF属于IL-6家族成员, 为多功能细胞因子, 其在正常组织或血液中低表达, 炎性介质可诱导其表达, 抗炎物质可抑制其表达[18]. 滕晓丽等[19]通过牛磺胆酸钠建立大鼠SAP模型, 运用RT-PCR和免疫组织化学法检测模型大鼠肺组织中LIF的表达显示, LIF的表达在SAP大鼠中显著升高, 提示LIF在SAP肺损伤中发挥促炎作用. 吴鑫等[20]报道, LIF在AP晚期发挥促炎作用. 孙涛[21]在AP的研究中发现, miR-494在损伤胰腺腺泡细胞中高表达, 发挥抑制胰腺腺泡细胞凋亡的作用, 且可通过直接抑制LIF的表达抑制雨蛙素诱导的大鼠胰腺腺泡细胞凋亡, 提示LIF在急性胰腺腺细胞中发挥损伤作用. 本研究运用qRT-PCR、Western blot检测了雨蛙素诱导的大鼠胰腺腺泡细胞AR42J中LIF的表达发现, LIF表达异常升高; 深入研究发现, 敲减LIF可抑制雨蛙素诱导的AR42J细胞凋亡.
总之, miR-181a-5p可抑制雨蛙素诱导的大鼠胰腺腺泡细胞凋亡, 其机制可能与靶向LIF有关, 为AP的治疗研究奠定基础.
miRNA在急性胰腺炎(acute pancreatitis, AP)中的作用已得到认可, 其中miR-181a-5p在AP中的研究甚少, 且miR-181a-5p在AP中的作用机制国内外尚未有人研究.
本研究旨在研究miR-181a-5p在氢化可的松诱导的大鼠胰腺腺泡细胞损伤的凋亡情况, 以期望为及时高效治疗AP提供线索.
探讨miR-181a-5p调控氢化可的松诱导的大鼠胰腺腺泡细胞凋亡的作用, 及这种作用的机制, 以期为AP的治疗提供新方向.
用15 nmol/L雨蛙素处理大鼠胰腺腺泡细胞AR42J 8 h, 运用ELISA法检测AMY、肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)、白介素-6(interleukin-6, IL-6)的表达, 分成Cerulein+anti-miR-con组、Cerulein+anti-miR-181a-5p组、Cerulein+si-con组、Cerulein+si-LIF组, 用流式细胞术、qRT-PCR、Western blot检测细胞的凋亡、miR-181a-5p mRNA和LIF mRNA及LIF、caspase-3蛋白的表达, 双荧光素酶报告基因检测实验验证miR-181a-5p靶向LIF.
本研究成功构建雨蛙素诱导的大鼠胰腺腺泡细胞AR42J损伤, 其中miR-181a-5p表达下调, LIF表达上调, 细胞凋亡率上调, 且过表达miR-181a-5p或敲减LIF均可下调细胞的凋亡率, 另外, miR-181a-5p靶向调控LIF.
miR-181a-5p可抑制氢化可的松诱导的大鼠胰腺腺泡细胞的凋亡, 其可能与靶向LIF有关, 提示miR-181a-5p可作为AP治疗的潜在作用靶点.
本研究仅在体外研究miR-181a-5p对大鼠胰腺细胞损伤的凋亡影响, 后期还需增加miR-181a-5p在胰腺炎大鼠体内是否具有治疗作用, 以更清晰的展示miR-181a-5p对AP的治疗价值, 也为miR-181a-5p的靶向治疗提供更加充分的依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D, D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Ye B, Mao W, Chen Y, Tong Z, Li G, Zhou J, Ke L, Li W. Aggressive Resuscitation Is Associated with the Development of Acute Kidney Injury in Acute Pancreatitis. Dig Dis Sci. 2019;64:544-552. [PubMed] [DOI] |
| 2. | Fei Y, Liu XQ, Gao K, Xue CB, Tang L, Tu JF, Wang W, Li WQ. Analysis of influencing factors of severity in acute pancreatitis using big data mining. Rev Assoc Med Bras (1992). 2018;64:454-461. [PubMed] [DOI] |
| 3. | Fan J, Ding L, Lu Y, Zheng J, Zeng Y, Huang C. Epidemiology and Etiology of Acute Pancreatitis in Urban and Suburban Areas in Shanghai: A Retrospective Study. Gastroenterol Res Pract. 2018;2018:1420590. [PubMed] [DOI] |
| 4. | Song J, Zhong Y, Lu X, Kang X, Wang Y, Guo W, Liu J, Yang Y, Pei L. Enteral nutrition provided within 48 hours after admission in severe acute pancreatitis: A systematic review and meta-analysis. Medicine (Baltimore). 2018;97:e11871. [PubMed] [DOI] |
| 5. | Vishnoi A, Rani S. MiRNA Biogenesis and Regulation of Diseases: An Overview. Methods Mol Biol. 2017;1509:1-10. [PubMed] [DOI] |
| 6. | Chandrasekhar S, Harvey AK. Modulation of PDGF mediated osteoblast chemotaxis by leukemia inhibitory factor (LIF). J Cell Physiol. 1996;169:481-490. [PubMed] [DOI] |
| 7. | Nicola NA, Babon JJ. Leukemia inhibitory factor (LIF). Cytokine Growth Factor Rev. 2015;26:533-544. [PubMed] [DOI] |
| 8. | Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 1993;75:843-854. [PubMed] |
| 9. | Dai R, Ahmed SA. MicroRNA, a new paradigm for understanding immunoregulation, inflammation, and autoimmune diseases. Transl Res. 2011;157:163-179. [PubMed] [DOI] |
| 13. | 姚 汝铖, 郑 军, 邢 荣春. 微小RNA在胰腺癌中的研究进展. 中国普外基础与临床杂志. 2012;19:911-915. |
| 14. | An F, Zhan Q, Xia M, Jiang L, Lu G, Huang M, Guo J, Liu S. From moderately severe to severe hypertriglyceridemia induced acute pancreatitis: circulating miRNAs play role as potential biomarkers. PLoS One. 2014;9:e111058. [PubMed] [DOI] |
| 15. | Norman J. The role of cytokines in the pathogenesis of acute pancreatitis. Am J Surg. 1998;175:76-83. [PubMed] [DOI] |
| 16. | Norman JG, Fink GW, Franz MG. Acute pancreatitis induces intrapancreatic tumor necrosis factor gene expression. Arch Surg. 1995;130:966-970. [PubMed] [DOI] |
| 17. | Brown MA, Metcalf D, Gough NM. Leukaemia inhibitory factor and interleukin 6 are expressed at very low levels in the normal adult mouse and are induced by inflammation. Cytokine. 1994;6:300-309. [PubMed] [DOI] |